INTRODUÇÃO
Os antimicrobianos são substâncias de origem natural ou sintética que agem sobre os microrganismos inibindo seu crescimento ou causando sua destruição, sendo utilizados de modo profilático e/ou terapêutico, constituindo um avanço farmacológico de suma importância e larga utilização 1.
O consumo de antimicrobianos pode ser avaliado por diversos métodos. A Organização Mundial da Saúde preconiza a classificação Anatômica Terapêutica Química (Anatomical Therapeutic Chemical - ATC) que, em conjunto com a Dose Diária Definida (Defined Daily Dose - DDD), formam o sistema ATC/DDD, medida internacional cujo objetivo é determinar o consumo real no ambiente hospitalar, além de estabelecer um perfil de utilização dos fármacos e permitir comparações entre as diversas instituições. A DDD é a dose média de manutenção diária de um medicamento na sua principal indicação, em pacientes adultos, com 70 kg, por via de administração, sendo expressa em quantidade de princípio ativo2,3.
O uso indiscriminado de antimicrobianos contribui para o desenvolvimento de resistência bacteriana. Além disso, o uso abusivo desses fármacos pode originar bactérias multirresistentes, definidas como aquelas não suscetíveis a, pelo menos, um agente em três ou mais categorias de antimicrobianos4,5.
A busca por melhores resultados, para tentar controlar o consumo desses fármacos, faz-se por meio de programas de racionalização do uso de antimicrobianos, como o Antimicrobial Stewardship, definido pelas sociedades americanas Infectious Diseases Society of America, Society for Healthcare Epidemiology of America e Pediatric Infectious Diseases Society como intervenções coordenadas destinadas a melhorar e a quantificar o uso apropriado de antimicrobianos por escolha do melhor esquema antibiótico. Dentre os benefícios, destacam-se a melhor evolução do paciente, a redução de eventos adversos, a melhora das taxas de suscetibilidade aos antimicrobianos escolhidos e a otimização do uso dos recursos6.
Portanto, para otimizar o controle das infecções relacionadas à assistência à saúde (IRAS), objetivou-se determinar o perfil de consumo de antimicrobianos e seu impacto na resistência bacteriana no Hospital Universitário João de Barros Barreto (HUJBB), em Belém, estado do Pará, Brasil, de 2012 a 2016.
MATERIAIS E MÉTODOS
Foram respeitados os preceitos da Declaração de Helsinque e do Código de Nuremberg, assim como as normas de pesquisa envolvendo seres humanos previstas na Resolução n° 466/12 do Conselho Nacional de Saúde, após aprovação do projeto pelo Comitê de Ética em Pesquisa do HUJBB, via Plataforma Brasil, por meio do parecer n° 1.852.513, de 6 de dezembro de 2016.
Foi realizado um estudo observacional e transversal no período de janeiro a abril de 2017. As informações pertinentes (gênero e faixa etária dos pacientes e topografia da infecção) foram compiladas a partir das fichas referentes às IRAS bacterianas, em protocolo próprio. Para a realização da análise estatística de cunho analítico, os dados encontrados foram submetidos aos testes qui-quadrado de aderência, independência e partição e ANOVA, utilizando o software BioEstat® v5.3, adotando-se nível de significância α = 0,05 ou 5% para a tomada de decisão.
Foram incluídas, de forma censitária (na totalidade), na pesquisa, 279 hemoculturas positivas referentes às IRAS bacterianas em pacientes adultos internados em enfermarias (Clínica Médica, Clínica Cirúrgica, Pneumologia e Doenças Infecciosas e Parasitárias) e no Centro de Terapia Intensiva (CTI) do local de estudo entre 2012 e 2016. Foram excluídas as fichas de pacientes pediátricos, pois a definição de DDD não se aplica a eles, de pacientes com infecções comunitárias e/ou de origem não bacteriana e cujos dados estivessem incompletos e/ou incompreensíveis. Foram incluídos os cocos Gram-positivos e os bacilos Gram-negativos (BGN) fermentadores e não fermentadores.
As bactérias foram classificadas, conforme o perfil de sensibilidade aos antimicrobianos, em "sensível" e "resistente", por métodos de disco difusão e gradiente de difusão e automatizado (Vitek®). Em relação à topografia da infecção, foram considerados: infecção primária de corrente sanguínea (IPCS), infecção secundária de corrente sanguínea (ISCS), infecção do trato respiratório (ITR), infecção de pele e partes moles (IPPM), infecção abdominal (IABD) e endocardite - os três últimos foram incluídos na variável "Outras", por sua pequena prevalência.
Foram escolhidos os 20 antimicrobianos mais utilizados para o tratamento das infecções causadas pelos patógenos selecionados, sendo consideradas apenas as apresentações parenterais dos mesmos: amicacina, ampicilina, ampicilina + sulbactam, cefepima, ceftazidima, ceftriaxona, ciprofloxacino, clindamicina, colistina, ertapeném, gentamicina, imipeném, linezolida, meropeném, oxacilina, piperacilina + tazobactam, polimixina B, sulfametoxazol + trimetoprim, tigeciclina, vancomicina. Para mensurar o perfil de consumo, foi realizado o cálculo da DDD/100 leitos/ano, por meio da fórmula disponibilizada pela Agência Nacional de Vigilância Sanitária (ANVISA): DDD/100 leitos/ano = Ax100/BxP, sendo: A = quantidade total do medicamento consumido no período de tempo considerado (em UI ou g); B = DDD estabelecida para o medicamento; e P = número de pacientes-dia no mesmo período de tempo considerado. Foram utilizados, nos cálculos, os valores da DDD estabelecidos para cada medicamento conforme o ATC/DDD Index 20177.
Os valores referentes à quantidade total dos medicamentos consumidos foram obtidos por meio dos relatórios anuais de dispensa de medicamentos, produzidos pela Farmácia do HUJBB. Para a comparação entre o consumo de antimicrobianos e o seu impacto na resistência bacteriana, os dados obtidos foram dispostos em gráficos, sendo as informações analisadas a fim de verificar se estas variáveis sofreram alterações semelhantes.
O número de pacientes/dia nas enfermarias foi fornecido pela Divisão de Arquivo Médico e Estatística. Em relação ao CTI, os valores referentes a 2012 e 2013 foram fornecidos pelo próprio setor; nos anos seguintes, pela Comissão de Controle de Infecção Hospitalar. O número de pacientes/dia é calculado pela fórmula: Nº paciente/dia = O x N x T, em que O = índice de ocupação de leitos (número de leitos ocupados/número total de leitos), N = número de leitos disponíveis e T = período (em dias).
RESULTADOS
No período do estudo, foram realizadas 505 hemoculturas no HUJBB. Após a aplicação dos critérios de inclusão e exclusão, foram avaliados dados de 279 hemoculturas.
Ao analisar a topografia das infecções (Tabela 1), as IPCS foram as mais prevalentes (p < 0,0001), respondendo por 168 casos (60,2%), seguidas por ISCS e ITR, com 17,2% cada.
Tabela 1 - Distribuição dos isolados de hemoculturas realizadas no HUJBB, no período de 2012 a 2016, segundo gênero e faixa etária do paciente e topografia da infecção
| Variáveis | Distribuição de frequência | |
| N | % | |
| Gênero* | ||
| Feminino | 145 | 52,0 |
| Masculino | 134 | 48,0 |
| Faixa etária (anos)† | ||
| < 40 | 75 | 26,9 |
| 40 a 59 | 81 | 29,0 |
| 60 a 79 | 87§ | 31,2 |
| ≥ 80 | 36 | 12,9 |
| Topografia‡ | ||
| Infecção primária de corrente sanguínea | 168§ | 60,2 |
| Infecção secundária de corrente sanguínea | 48 | 17,2 |
| Infecção do trato respiratório | 48 | 17,2 |
| Outras | 15 | 5,4 |
| Total | 279 | 100,0 |
* p > 0,05 (p = 0,5522, teste qui-quadrado de aderência); † p ≤ 0,05 (p < 0,001, teste qui-quadrado de aderência); ‡ p ≤ 0,05 (p < 0,0001, teste qui-quadrado de partição); § Estatisticamente significativo.
Os BGN foram os mais prevalentes (143; 51,3%) (p = 0,7149), com predomínio de cepas fermentadoras (88; 31,6%), sendo as mais frequentes Klebsiella spp. (18,3%) (Klebsiella pneumoniae e Klebsiella oxytoca) e Escherichia coli (6,8%). Quanto aos não fermentadores (55; 19,7%), os mais frequentes foram Pseudomonas aeruginosa (6,8%) e Acinetobacter spp. (6,5%) (Tabela 2).
Tabela 2 - Distribuição dos isolados de hemoculturas realizadas no HUJBB, no período de 2012 a 2016, segundo a espécie isolada
| Espécies | Frequência | |
| N | % | |
| Cocos Gram-positivos | ||
| Staphylococcus aureus | 47 | 16,8 |
| Staphylococcus spp. coagulase-negativa | 56* | 20,1 |
| Staphylococcus epidermidis | 23 | 8,2 |
| Enterococcus spp. | 10 | 3,6 |
| Bacilos Gram-negativos | ||
| Enterobacter spp.† | 10 | 3,6 |
| Escherichia coli † | 19 | 6,8 |
| Klebsiella spp.† | 51 | 18,3 |
| Proteus mirabilis † | 2 | 0,7 |
| Serratia marcescens † | 6 | 2,1 |
| Acinetobacter spp.‡ | 18 | 6,5 |
| Complexo Burkholderia cepacia ‡ | 10 | 3,6 |
| Elizabethkingia meningoseptica ‡ | 1 | 0,4 |
| Pseudomonas aeruginosa ‡ | 19 | 6,8 |
| Stenotrophomonas maltophilia ‡ | 6 | 2,1 |
| Sphingomonas paucimobilis ‡ | 1 | 0,4 |
| Total | 279 | 100,0 |
p ≤ 0,05 (p < 0,0001, teste qui-quadrado de partição); * Estatisticamente significativo; † Fermentadores; ‡ Não fermentadores.
Dentre os cocos Gram-positivos (136; 48,7%) (Tabela 2), predominaram os Staphylococcus spp. coagulase-negativa (20,1%), sendo Staphylococcus hominis e Staphylococcus haemolyticus os mais frequentes.
Na análise do consumo global do HUJBB em DDD/100 leitos/ano (Tabela 3), notou-se uma diminuição do uso dos betalactâmicos entre 2012 e 2016, sendo estatisticamente significativa a redução do consumo de piperacilina + tazobactam (p = 0,0492). Também foi estatisticamente significante a diminuição do consumo do glicopeptídeo vancomicina (p = 0,0398).
Tabela 3 - DDD/100 leitos/ano global dos antimicrobianos pesquisados no HUJBB de 2012 a 2016
| Medicamento | DDD/100 pacientes/ano | p-valor | ||||
| 2012 | 2013 | 2014 | 2015 | 2016 | ||
| Amicacina | 1,07 | 1,76 | 1,63 | 0,64 | 1,83 | 0,3977 |
| Ampicilina | 0,16 | 0,13 | 0,06 | 0,05 | 0,01 | 0,7749 |
| Ampicilina + sulbactam | 0,14 | 0,04 | - | - | 0,13 | 0,6344 |
| Cefepima | 15,29 | 5,32 | 3,11 | 15,30 | 19,02 | 0,3977 |
| Ceftazidima | 2,78 | 3,68 | 2,51 | 2,52 | 2,05 | 0,7802 |
| Ceftriaxona | 12,78 | 10,71 | 13,14 | 12,88 | 13,29 | 0,8922 |
| Ciprofloxacino | 3,82 | 3,33 | 3,04 | 3,98 | 3,96 | 0,6979 |
| Clindamicina | 4,91 | 3,54 | 3,15 | 3,88 | 5,43 | 0,4459 |
| Colistina | 0,01 | - | - | - | 0,46 | 0,9838 |
| Ertapeném | 0,39 | 0,62 | 1,00 | 0,35 | 0,34 | 0,5677 |
| Gentamicina | 0,27 | 0,12 | 0,14 | 0,18 | 0,24 | 0,7828 |
| Imipeném | 4,14 | 5,14 | 6,22 | 4,99 | 3,79 | 0,4998 |
| Linezolida | 0,12 | 0,09 | 0,21 | 0,08 | 0,06 | 0,5678 |
| Meropeném | 0,50 | 1,02 | 0,78 | 0,68 | 0,54 | 0,8188 |
| Oxacilina | 20,68 | 13,87 | 18,40 | 15,66 | 13,83 | 0,6689 |
| Piperacilina + tazobactam | 7,03 | 5,99 | 3,96 | 3,48 | 3,31 | 0,0492* |
| Polimixina B | 0,28 | 0,19 | 0,40 | 0,45 | 0,35 | 0,8566 |
| Sulfametoxazol + trimetoprim | 3,03 | 4,32 | 3,98 | 4,72 | 4,31 | 0,7623 |
| Tigeciclina | 0,02 | - | 0,05 | 0,11 | 0,06 | 0,8988 |
| Vancomicina | 4,47 | 3,38 | 3,30 | 3,41 | 2,50 | 0,0398* |
* Estatisticamente significativo: p ≤ 0,05 (ANOVA - uma escolha). Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
No que diz respeito ao consumo no CTI do HUJBB, em DDD/100 leitos/ano (Tabela 4), também houve redução estatisticamente significativa do consumo de piperacilina + tazobactam (p = 0,0185) e de vancomicina (p = 0,0395), assim como de ceftriaxona (p = 0,0324) e de oxacilina (p = 0,0063). Ademais, no CTI, houve um aumento dos consumos de amicacina (p = 0,0221) e meropeném (p = 0,0348).
Tabela 4 - DDD/100 leitos/ano dos antimicrobianos pesquisados no CTI do HUJBB de 2012 a 2016
| Medicamento | DDD/100 pacientes/ano | p-valor | ||||
| 2012 | 2013 | 2014 | 2015 | 2016 | ||
| Amicacina | 1,64 | 5,30 | 5,42 | 3,86 | 5,44 | 0,0221* |
| Ampicilina | 1,29 | - | - | - | - | 0,9987 |
| Ampicilina + sulbactam | - | 0,89 | - | - | 0,22 | 0,8997 |
| Cefepima | 35,52 | 9,19 | 5,92 | 18,72 | 28,37 | 0,4329 |
| Ceftazidima | 2,35 | 1,46 | 2,55 | 2,55 | 1,14 | 0,7876 |
| Ceftriaxona | 22,31 | 11,74 | 13,48 | 10,25 | 11,28 | 0,0324* |
| Ciprofloxacino | 13,52 | 12,23 | 7,67 | 13,52 | 8,82 | 0,5466 |
| Clindamicina | 6,42 | 2,99 | 4,13 | 1,89 | 6,49 | 0,9234 |
| Colistina | 0,16 | - | - | - | 8,82 | 0,0123* |
| Ertapeném | 2,37 | 1,14 | 1,91 | 1,73 | 0,37 | 0,3566 |
| Gentamicina | 1,74 | 1,35 | 0,43 | 2,49 | 2,76 | 0,7867 |
| Imipeném | 24,63 | 27,67 | 31,99 | 35,48 | 24,50 | 0,8897 |
| Linezolida | 1,04 | 0,84 | 2,49 | 0,09 | 0,28 | 0,8873 |
| Meropeném | 3,52 | 6,32 | 7,45 | 4,38 | 8,15 | 0,0348* |
| Oxacilina | 26,54 | 5,92 | 26,82 | 5,40 | 12,27 | 0,0063* |
| Piperacilina + tazobactam | 27,55 | 18,69 | 16,80 | 11,71 | 12,26 | 0,0185* |
| Polimixina B | 1,26 | 1,91 | 6,37 | 7,01 | 3,46 | 0,6578 |
| Sulfametoxazol + trimetoprim | 19,91 | 15,32 | 15,52 | 25,52 | 23,12 | 0,0784 |
| Tigeciclina | 0,40 | - | 0,72 | 1,51 | 0,41 | 0,8874 |
| Vancomicina | 32,90 | 24,44 | 27,02 | 28,05 | 22,51 | 0,0395* |
* Estatisticamente significativo: p ≤ 0,05 (ANOVA - uma escolha). Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
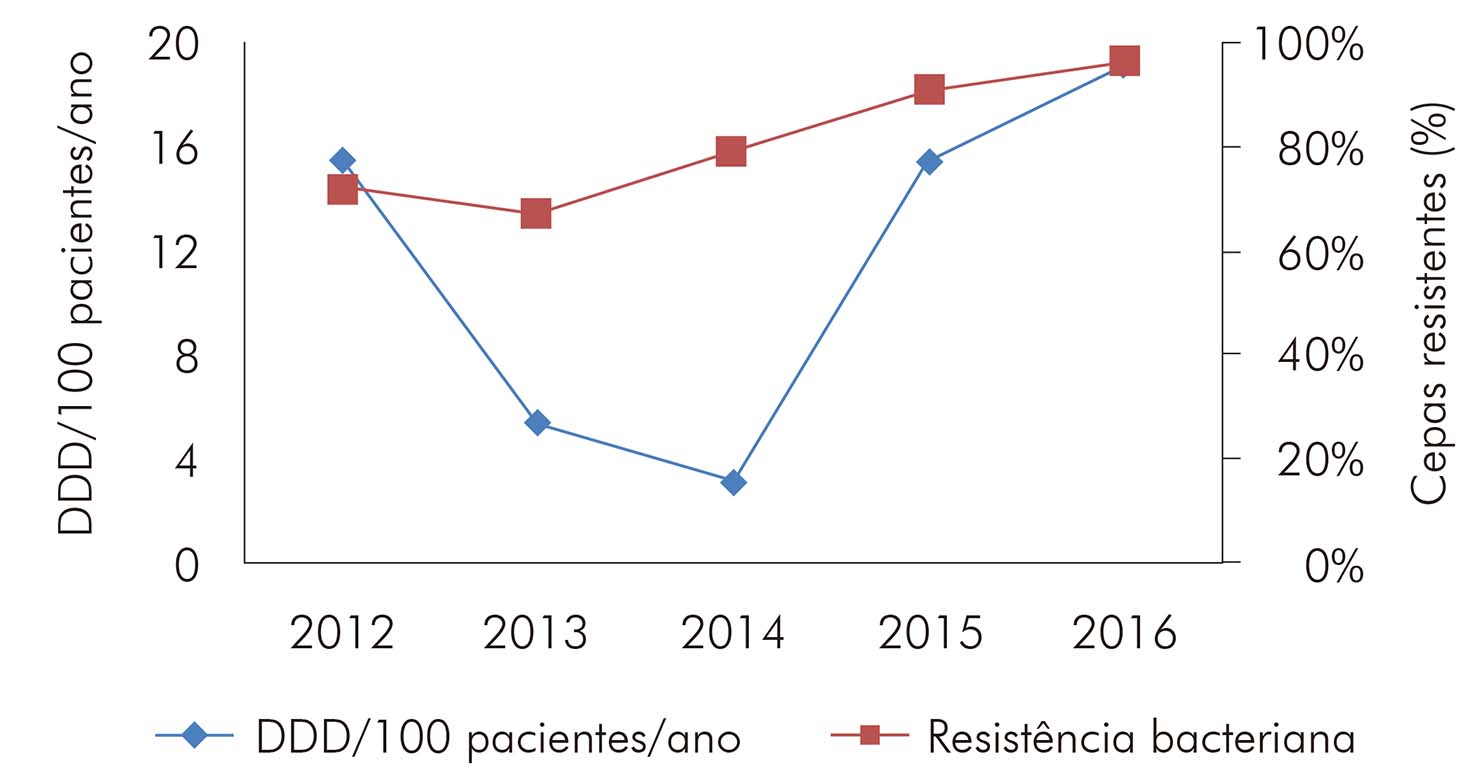
As cepas de Staphylococcus aureus encontradas apresentaram elevados índices de resistência à clindamicina (57,4%) e níveis decrescentes de resistência à oxacilina ao longo do tempo (Tabela 5). Ao correlacionar o consumo de oxacilina ao perfil de resistência desses microrganismos, notou-se, entre 2012 e 2015, um padrão positivo e não linear (as alterações no consumo levando a alterações semelhantes no perfil de resistência) (Figura 1).
Tabela 5 - Perfil de resistência dos isolados de hemoculturas realizadas no HUJBB, de 2012 a 2016, positivas para S. aureus, conforme o ano
| Medicamento | Staphylococcus aureus (N=47) | Total | ||||||||||
| 2012 (N=5) | 2013 (N=7) | 2014 (N=19) | 2015 (N=4) | 2016 (N=12) | ||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | |
| Oxacilina | 3 | 60,0 | 3 | 42,9 | 12 | 63,2 | 1 | 25,0 | 4 | 33,3 | 23 | 48,9 |
| Clindamicina | 4 | 80,0 | 4 | 57,1 | 13 | 68,4 | 3 | 75,0 | 3 | 25,0 | 27 | 57,4 |
| Sulfametoxazol + trimetoprima | 1 | 20,0 | 4 | 57,1 | 3 | 15,8 | 1 | 25,0 | 5 | 41,7 | 14 | 29,8 |
| Vancomicina | - | - | - | - | - | - | - | - | - | - | - | - |
| Linezolida | - | - | - | - | - | - | - | - | - | - | - | - |
Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
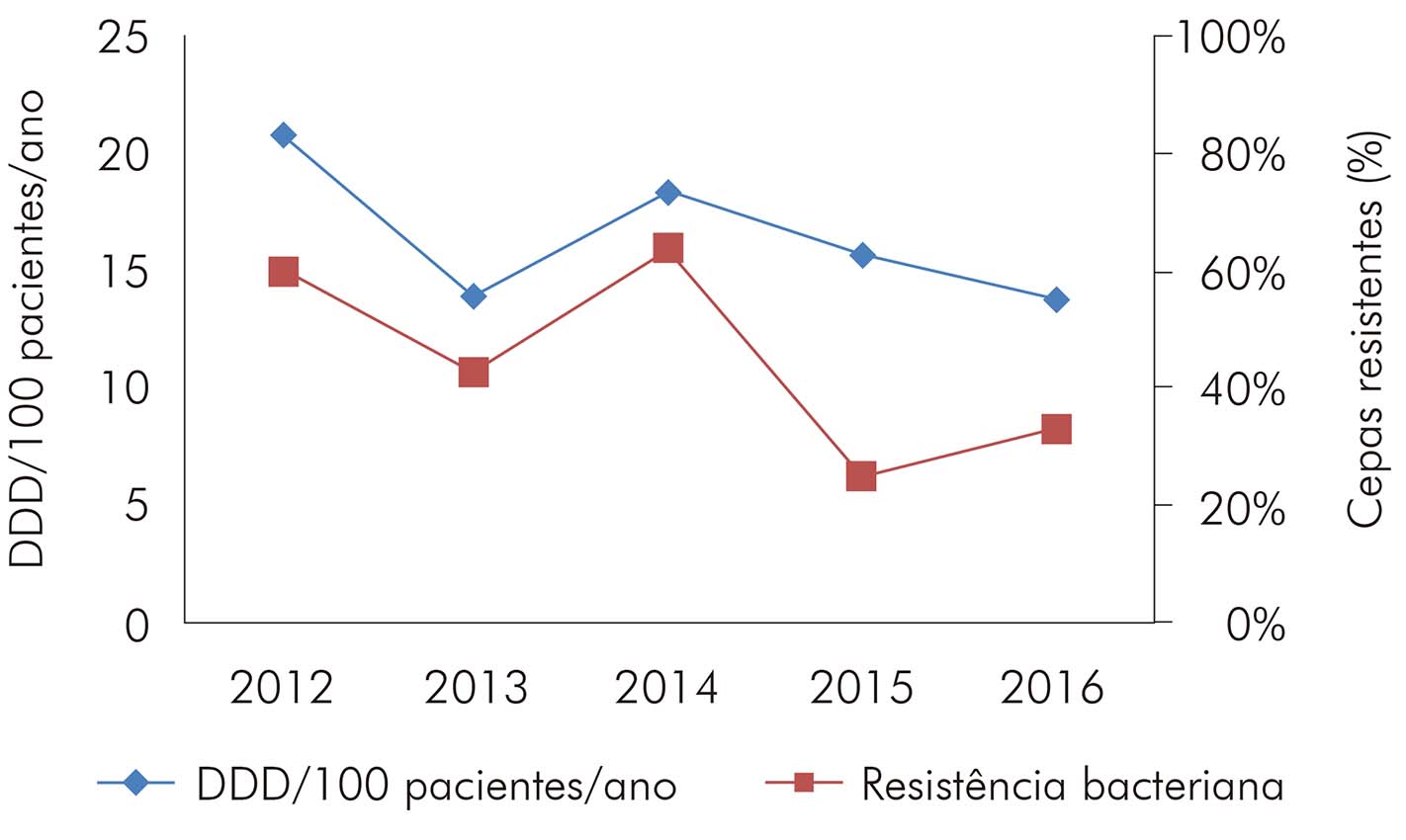
Figura 1 - Relação entre o consumo e a taxa de resistência à oxacilina em cepas de S. aureus isoladas em hemoculturas no HUJBB, de 2012 a 2016
Os BGN fermentadores encontrados no presente estudo apresentaram elevados índices de resistência às cefalosporinas de terceira e quarta geração (83,0% para ceftazidima e 76,1% para cefepima) (Tabela 6), tendo predominado o perfil fenotípico de enterobactérias produtoras de betalactamases de espectro estendido (extended-spectrum beta-lactamases - ESBL). Ao correlacionar o consumo de cefepima e o perfil de resistência (Figura 2), também foi possível observar um padrão positivo e não linear entre 2012 e 2013 e entre 2014 e 2016. No período do estudo, não houve isolados com resistência aos carbapenêmicos.
Tabela 6 - Perfil de resistência dos isolados de hemoculturas realizadas no HUJBB, de 2012 a 2016, positivas para bacilos Gram-negativos fermentadores, conforme o ano
| Medicamento | Bacilos Gram-negativos fermentadores (N=88) | Total | ||||||||||
| 2012 (N=8) | 2013 (N=11) | 2014 (N=27) | 2015 (N=20) | 2016 (N=22) | ||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | |
| Ciprofloxacino | 4 | 66,7* | 6 | 54,5 | 8 | 33,3* | 9 | 45,0 | 14 | 63,6 | 41 | 46,6 |
| Ceftazidima | 6 | 85,7* | 7 | 63,6 | 22 | 81,5 | 18 | 90,0 | 20 | 95,2* | 73 | 83,0 |
| Cefepima | 5 | 71,4* | 6 | 66,7* | 18 | 78,3 | 18 | 90,0 | 20 | 95,2* | 67 | 76,1 |
| Meropeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Imipeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Ertapeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Piperacilina + tazobactam | - | - | 4 | 40,0* | 3 | 15,0* | 5 | 25,0 | 5 | 23,8* | 17 | 19,3 |
| Amicacina | 2 | 28,4* | 1 | 9,1 | 3 | 11,1 | 1 | 5,0 | - | - | 7 | 8,0 |
| Gentamicina | 2 | 50,0* | 5 | 45,5 | 14 | 51,9 | 13 | 65,0 | 9 | 47,4* | 43 | 48,9 |
| Sulfametoxazol + trimetoprima | 6 | 75,0 | 5 | 50,0* | 13 | 72,2* | NT | NT | 3 | 100,0* | 27 | 30,7 |
| Tigeciclina | - | - | - | - | - | - | 1 | 5,0 | 2 | 14,3* | 3 | 3,4 |
| Colistina | NT | NT | - | - | 4 | 22,2 | 3 | 15,0 | - | - | 7 | 8,0 |
* Nos casos assinalados, nem todas as cepas foram testadas para o antimicrobiano em questão. Dessa forma, a porcentagem foi calculada em cima do número de testes de sensibilidade realizados. NT: Não testado. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
DISCUSSÃO
Uma das principais preocupações mundiais quanto ao uso racional de medicamentos está relacionada aos antimicrobianos. O aumento da resistência bacteriana a vários agentes acarreta maiores cuidados no manejo de infecções e contribui para o aumento dos custos do sistema de saúde. Monitorar o consumo de antimicrobianos pode auxiliar avaliações em diversos níveis, como hábitos de prescrição, introdução de novas drogas e variação da flora bacteriana local8.
A utilização de antimicrobianos varia consideravelmente de hospital para hospital, nas diversas enfermarias, especialidades, etc. Assim, devem-se estudar, de maneira ampla, as características de consumo de um órgão, visando estabelecer as prioridades de atuação.
Neste estudo, foram analisadas as variações de consumo de 20 antimicrobianos utilizados nas enfermarias e no CTI de um hospital universitário da Região Norte do Brasil ao longo de cinco anos.
A maior prevalência de IPCS discorda dos resultados encontrados em um hospital de referência do norte do estado de Minas Gerais, em que houve maior frequência de infecções do trato urinário9. As IPCS são definidas como infecções de consequências sistêmicas graves, bacteremia ou sepse, sem foco primário identificável. O maior número de IPCS pode estar relacionado ao uso de dispositivos intravasculares (cateteres venosos centrais e periféricos), muito frequentes em pacientes que mantêm longa permanência no hospital e que são mais suscetíveis às infecções10.
As IPCS representam uma das principais causas de morbimortalidade intra-hospitalar, sendo sua gravidade ainda maior no CTI. De acordo com dados de 2016 publicados pela ANVISA, das 16.949 notificações com a identificação de microrganismos causadores das IPCS em UTI adulto, em 2016, os mais frequentes foram Staphylococcus spp. coagulase-negativa (18,9%), K. pneumoniae (18,2%) e S. aureus (14,1%)11. Embora o pequeno número de IPCS no CTI do HUJBB, nesse mesmo ano, tenha sido causado por variadas bactérias, ao analisar o hospital como um todo, entre 2012 e 2016, os agentes mais frequentes foram os mesmos encontrados pelo estudo publicado pela ANVISA.
O consumo de vancomicina sofreu decréscimo de aproximadamente 44%, o que também ocorreu no CTI, em menor proporção (31,5%). A vancomicina é um dos principais recursos utilizados no tratamento de infecções por S. aureus resistentes à meticilina/oxacilina (MRSA/ORSA); logo, a resistência a esses fármacos gera enorme preocupação. Apesar da ausência de cepas estafilocócicas resistentes à vancomicina, o consumo dessa droga diminuiu. Isso pode ser explicado pela ação do programa de racionalização de antimicrobianos exercendo maior controle sobre o uso desse fármaco, além do uso de drogas menos complexas e efetivas contra essas cepas, como o sulfametoxazol + trimetoprima. A diminuição do consumo de vancomicina também pode ser explicada pela redução de 26,7% da frequência de isolados de MRSA no período analisado.
A elevada resistência de S. aureus à clindamicina foi também observada em um estudo realizado em um hospital terciário, entre 2012 e 2014, que encontrou altos índices de resistência (46,7%)12.
Em relação ao S. aureus e à oxacilina, o presente estudo diverge da literatura. A resistência à oxacilina não apresentou um padrão fixo, discordando da revisão bibliográfica que verificou um crescimento contínuo em instituições hospitalares em nível mundial ao longo do tempo13. Além disso, os níveis de resistência encontrados foram maiores do que os verificados por outros estudos, estando em torno de 35%12,14.
Ao correlacionar o consumo de oxacilina e a resistência apresentada pelo S. aureus, o padrão positivo e não linear observado foi discordante em relação a um estudo realizado em uma instituição hospitalar de São Paulo, cujos resultados não evidenciaram uma correlação estatisticamente significativa entre essas duas variáveis (p = 0,15)15. Como alternativa para o tratamento de cepas estafilocócicas resistentes à oxacilina, pode-se utilizar vancomicina e linezolida, pois não foram encontradas cepas resistentes a esses antimirobianos.
A redução de aproximadamente 53% no consumo de piperacilina + tazobactam difere de um estudo realizado em um hospital de São Paulo, entre 1995 e 2006, que encontrou um aumento estatisticamente significativo do consumo da penicilina de amplo espectro do grupo das ureidopenicilinas em questão15. Isso pode ser explicado principalmente pela maior suscetibilidade de cepas de P. aeruginosa à amicacina, com nível de resistência global de 22,2% entre 2012 e 2016. O consumo de amicacina aumentou cerca de 71% no período analisado. Esse padrão também foi observado no CTI, com redução de cerca de 55,5% no uso de piperacilina + tazobactam, associado aos elevados índices de resistência encontrados.
No CTI, os consumos de ceftriaxona e oxacilina sofreram reduções aproximadas de 49,5% e 53,8%, respectivamente. Isso é decorrente do grande número de Klebsiella spp. e de cepas de estafilococos resistentes, nessa ordem.
Ainda em relação ao CTI, a utilização de amicacina e meropeném aumentou em cerca de 231,7% e 131,5%, respectivamente. O maior consumo de amicacina pode ser explicado pela grande suscetibilidade das cepas encontradas no CTI, em que praticamente todos os BGN fermentadores e P. aeruginosa (além de 40% dos espécimes de Acinetobacter spp.) eram sensíveis. Em relação ao meropeném, o aumento no consumo pode ser explicado pela grande suscetibilidade dos BGN fermentadores encontrados; outro fato que pode explicar tal aumento é a presença de muitos espécimes Gram-negativos fermentadores ESBL positivos, o que inviabilizaria o uso de penicilinas e cefalosporinas, visto que a maioria, com poucas exceções para o cefepima, é ineficaz diante de germes ESBL positivos, tornando os carbapenêmicos uma das principais estratégias de tratamento.
Em relação aos BGN fermentadores, os elevados índices de resistência às cefalosporinas encontrados discordam do observado em outro hospital terciário, de 2012 a 201412, os quais foram inferiores quando comparados com o presente estudo. A elevada utilização de cefepima, a partir de 2014, pode ter contribuído para os altos índices de resistência entre 2014 e 2016, pois houve um aumento de mais de 500% no consumo dessa droga. Além disso, as baixas taxas de suscetibilidade podem ser explicadas pela grande quantidade de cepas ESBL positivas. Nesse sentido, a terapia empírica, na suspeita de infecções por BGN fermentadores, deve ser baseada no uso de carbapenêmicos, pois não foram identificados germes resistentes a essa classe de antimicrobianos.
CONCLUSÃO
As IPCS foram causadas, em sua maioria, por BGN, com destaque para os fermentadores, com padrão fenotípico de produção de ESBL. Os S. aureus foram resistentes à oxacilina em quase metade dos isolados. Houve redução significativa do consumo (global e no CTI) de piperacilina + tazobactam e de vancomicina, assim como consumo menor de ceftriaxona e oxacilina, paralelo às elevações do consumo de amicacina e meropeném. Ao relacionar o consumo e o perfil de resistência bacteriana, houve correlação positiva e não linear entre o consumo de cefalosporinas de quarta geração e o recrudescimento de cepas de BGN fermentadores multirresistentes e entre oxacilina e S. aureus resistentes. Diante do exposto, observa-se que o uso racional de antimicrobianos no ambiente hospitalar e o monitoramento da dinâmica de resistência bacteriana são fundamentais para reduzir a emergência de microrganismos resistentes causadores de IRAS aos pacientes.











 text in
text in