Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Paraense de Medicina
versión impresa ISSN 0101-5907
Rev. Para. Med. v.20 n.1 Belém mar. 2006
Efeitos da exposição perinatal à aguardente sobre o córtex cerebral de ratos1
Ethanol exposition in the perinatal to aguardente into rats cerebral cortex1
Bruno Pires Ferreira e SilvaI; Mario Ribeiro de Melo-JúniorII; Jorge Luiz Silva Araujo-FilhoIII; Vasco José Ramos Malta PatusIV; Carmelita Bezerra de Lima CavalantiV; Nicodemos Teles de Pontes-FilhoVI
IBiomédico e estagiário do LIKA- UFPE
IIProfessor Titular de Patologia – ASCES, Doutorando em Ciências Biológicas – CCB – UFPE
IIIMestre em Anatomia Patológica – CCS – UFPE
IVMestrando em Ciências Biológicas – CCB – UFPE
VMestre em Bioquímica – CCB – UFPE
VIProfessor Adjunto do departamento de Biologia - UFRPE, Doutor em Nutrição
RESUMO
OBJETIVO: avaliar os efeitos da aguardente sobre o peso corporal e encefálico dos filhotes, densidade de vasos, distribuição de fibras elásticas e colágeno, expressão de glicosaminoglicanos e o número médio de micronúcleos no córtex visual de ratos.
MÈTODO: os animais foram separados em dois grupos: grupo controle (GC) e grupo aguardente (GA). A avaliação ponderal dos animais deu-se no 3o (P3), 25o (P25) e no 40o (P40) dia de vida. Os cortes foram submetidos à rotina histológica e técnicas de marcação. No estudo morfométrico foi avaliado o número médio de vasos no córtex.
RESULTADOS: os resultados indicam que os pesos corporais apresentaram diferença ao nascimento 3o no 25o e 40o dias em relação ao GC. O peso encefálico diminuiu no GA em relação ao GC. Observou-se uma maior expressão de glicosaminoglicanos no GA, e distribuição irregular das células PAS+ nas camadas corticais.. O número de micronúcleos no GA também apresentou um significativo aumento em relação ao GC, O GA apresentou significativo aumento na densidade de vasos.
CONCLUSÃO: a aguardente revelou efeitos deletérios sobre a estrutura do córtex visual durante o período perinatal.
Descritores: Córtex cerebral, etanol, micronúcleo.
SUMMARY
OBJECTIVE: This paper evaluated the effects of ethanol in the body and brain weights of litters from matrix were submitted to ethanol exposition. Also were study vessels density, elastic and collagen fibers distribution; glycosaminoglycan expression and micronucleus number in the visual cortex of rats in two groups: control group (CG) and aguardente group (AG). The ponderal study of animals in three periods 3rd (P3), 25th (P25) and 40th (P40) days of life was perffomed. The brain was submitted to histological routine and histochemistry. In the morphometric study was evaluated the average of vessels number into cortex.
RESULTS: The results indicate that the body weight shown differeces in P3, P25 and P40 period between to experimental groups. The AG had lower brain weight when compared to CG. There was higher expression of glycosaminoglycan and irregular distribution on PAS+ cells in cortical layer in AG. Also AG group plays a significant increase of vessels density and micronuceus number.
CONCLUSION: The ethanol aguardente shown the deleterious effects into visual cortex structures during perinatal period.
Key-words: cerebral córtex, ethanol, micronucleous.
INTRODUÇÃO
O consumo de álcool constitui um problema social em todo o mundo, devido a seus efeitos deletérios sobre o organismo humano e principalmente no sistema nervoso. Evidências clínicas e experimentais1 demonstraram diferentes efeitos do álcool sobre a estrutura e a função neural2.
O etanol é uma neurotoxina que altera as propriedades físico-químicas das membranas plasmáticas afetando a embriogênese, a migração celular e a diferenciação celular. A exposição pré-natal ao etanol afeta o desenvolvimento de vários sistemas, incluindo o sistema músculo-esquelético, cardiovascular e o sistema nervoso central (SNC). O sistema nervoso central é, no entanto mais susceptível à toxicidade pelo etanol, que afeta vários componentes celulares e histoquímicos cruciais ao desenvolvimento cerebral, o qual é manifestado depois de um longo tempo na prole, cujos resultados são mostrados como malformações craniofaciais, bem como alterações na morfologia e função do SNC3.
Shibley e colaboradores4 afirmam que tanto em humanos quanto animais a teratogenicidade do etanol resulta de efeitos diretos e indiretos. Para eles, os efeitos diretos são causados pela interação do etanol com a célula fetal; e os indiretos podem ser definidos como qualquer perturbação do desenvolvimento fetal resultante da exposição, excluída a interação etanol-célula.
A formação da rede neuronal funcional no sistema nervoso em desenvolvimento é dependente de três mecanismos, os quais mostraram-se susceptíveis à exposição ao etanol. Estes são: aquisição celular,migração celular e maturação celular. A aquisição celular pode ser diminuída ou por defeito na proliferação ou por um aumento na deleção celular, além disso, a exposição ao etanol durante o desenvolvimento diminui a velocidade com que os axônios em certas partes do SNC adquirem mielina. Essa diminuição parece ser relatada como uma alteração na função dos oligodendrócitos e não como uma aberração no tamanho ou no número dos axônios3.
De acordo com Costa & Guizzeti5, a exposição ao etanol durante o desenvolvimento causa uma severa morte neuronal por apoptose no hipocampo e no córtex cerebral. Análises ultraestruturais em diferentes regiões do cérebro de animais expostos ao etanol durante o desenvolvimento revelam decréscimo no número de sinapses por unidade de área do tecido cerebral, e análises morfométricas dos neurônios hipocampais (in vitro), mostraram que a exposição ao etanol diminui o número de sinapses por dendrito. A exposição pré-natal ao etanol inibe o tamanho da árvore dendrítica e diminui o número e as ramificações dos dendritos em várias áreas cerebrais de roedores.
Além da disfunção do sistema nervoso central, o espectro do efeito teratogênico do álcool inclui desde a deficiência de crescimento e anormalidades craniofaciais até patologias órgão-específicas. O conjunto de todos esses distúrbios é denominado Síndrome do Alcoolismo Fetal (FAS), a qual foi descrita por Jones & Smith6 e que representa a mais severa expressão das malformações fetais relacionadas ao uso abusivo do álcool. As características fenotípicas determinadas pela FAS: micrognatia, assimetria auricular, encurtamento da ponte nasal, lábio superior fino (Figura 1) são mais evidentes dos 4 aos 14 anos, podendo tornar-se menos distintas ou desaparecerem na adolescência e vida adulta7.

OBJETIVO
Avaliar os efeitos da exposição crônica à aguardente sobre a citoarquitetura do córtex visual de ratos durante o desenvolvimento perinatal.
MÉTODO
Animais
Utilizaram-se 20 ratos machos jovens (40 dias) provenientes do acasalamento de fêmeas adultas sem parentesco (matrizes com 120 dias de vida e peso médio de 235 g).
Os animais utilizados foram da linhagem Wistar e oriundos da colônia do Biotério do Departamento de Nutrição do Centro de Ciências da Saúde/UFPE. Durante o trabalho foram mantidos em ambiente com ciclo claro-escuro de 12 horas (luminosidade entre 6:00 e 18:00 horas), com temperatura de 23±1 oC e com oferta de água filtrada ad libitum durante todo o experimento. O protocolo experimental desenvolvido no presente trabalho foi submetido e aprovado pela Comissão de ética em experimentação animal (CCB _ UFPE _ ofício 119/2003).
Para o acasalamento foram colocados em cada gaiola 3 fêmeas e 1 macho. A prenhez era confirmada pela identificação de células descamativas, muco gestacional e espermatozóides ao exame microscópio da secreção vaginal diluída em solução salina morna. No terceiro dia após o parto executou-se a sexagem excluindo-se as fêmeas devido à conhecida influência dos hormônios sexuais femininos no metabolismo do álcool8. Os filhotes machos de cada grupo experimental, gerados por diferentes matrizes foram misturadas entre si e mantidos em ninhadas de 4 a 6 animais. Estes procedimentos foram adotados no intuito de eliminar a formação de grupos contendo apenas filhotes irmãos e de uma única mãe, excluindo-se a possibilidade dos resultados serem influenciados pela susceptibilidade individual. A padronização do tamanho da ninhada teve como objetivo eliminar a desnutrição induzida por grandes ninhadas durante a lactação9.
Grupos experimentais
Quando confirmada a prenhez, as matrizes foram separadas de acordo com o protocolo experimental, no máximo 2 por gaiola, e ali mantidas até o 18o dia de gestação. A partir deste período foram transferidas para gaiolas individuais até o final do aleitamento (25 dias de vida dos filhotes).
Os filhotes das matrizes assim tratadas originaram os 2 grupos desse trabalho: Grupo controle (GC), constituído por ratos alimentados com dieta de manutenção do biotério, LABINA®, desde o acasalamento das mães até a idade experimental (40 dias) e Grupo aguardente (GA), constituído por ratos sob efeito indireto da aguardente (3g.kg-1.dia-1) desde a gestação até a idade experimental (40 dias). Após o desmame foram mantidos com a dieta padrão até o diada perfusão (40 dias). Administração diária de água filtrada ou de aguardente por gavagem (técnica de administração intragástrica através de cânula orogástrica). A gavagem foi executada sempre entre as 7:00 e 9:00 horas da manhã.
Análise do peso corporal
Os animais foram pesados em três períodos distintos: P3 – período referente ao 3o dia após o nascimento, P25, referente ao 25o dia de vida (final da lactação) e P40 – aos 40 dias de vida, utilizando-se balança eletrônica (Marte, modelo S000).
Perfusão e microtomia
Aos 40 dias de vida os filhotes foram pesados e anestesiados, por via intraperitoneal, com solução aquosa contendo uma mistura de Uretana a 10% (1g/ Kg) e Cloralose a 0,4% (40 mg/Kg) de acordo com o peso corporal. Para execução da perfusão procedeu-se ampla abertura do tórax para exposição do coração. Após a injeção 0,1ml de heparina (Liquemine®) no ventrículo esquerdo para evitar a coagulação sanguínea, introduziu-se na mesma região uma cânula de polietileno (por onde foram injetadas as soluções de perfusão) e concomitantemente fez-se a abertura do átrio direito. Desta forma, tanto o sangue quanto as soluções de perfusão eram eliminadas por aquela abertura. Após o bloqueio da artéria aorta abdominal com uma pinça hemostática procedeu-se a perfusão com auxílio de um compressor com pressão regulada em torno de 90/mmHg. Para a remoção do sangue e manutenção da integridade tecidual injetou-se através da cânula um volume em torno de 300ml de formaldeído a 10%, diluído em salina a 0,9%, controlando-se a fixação do tecido pelo volume inoculado e a rigidez da cabeça e dos membros superiores, a microtomia foi realizada sempre entre 12 e 24 horas após a perfusão.
No momento anterior a microtomia, o encéfalo foi dividido em três partes, mediante 2 cortes coronais (Figura 2), utilizando-se navalha para microtomia e uma lupa estereoscópica com ocular milimétrica (Olympus, modelo TGHM), obtendo-se três fragmentos que foram denominados: posterior, médio e anterior.
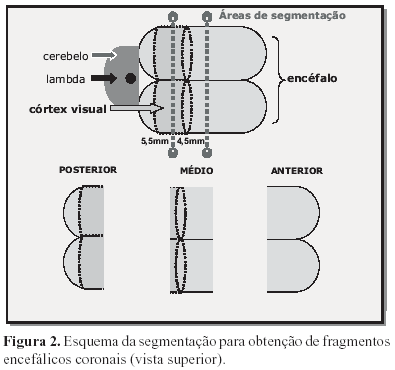
O fragmento posterior correspondia à região encefálica posterior, indo da porção voltada para lambda e para o cerebelo até 5,5mm em direção à região anterior do cérebro.
O fragmento médio iniciava-se no bordo da superfície de corte voltada para o fragmento posterior indo até outra superfície de corte distante 4,5mm, também voltada para a parte anterior do encéfalo. Finalmente, o fragmento anterior era constituído pelo segmento iniciado no bordo da superfície de corte voltada para o fragmento médio e contendo o restante do encéfalo anterior.
Esse procedimento foi adotado para obtenção de cortes histológicos coronais seriados do córtex posterior (fragmento posterior) correspondente à área visual (Figura 3).

Análise do peso encefálico
Após a perfusão realizou-se a abertura da caixa craniana, o encéfalo foi retirado excluindo-se o bulbo olfatório, nervos cranianos e cerebelo, sendo pesado empregando-se a balança analítica (Zeiss, modelo Sartorius).
Procedimento histoquímico e morfometria
Os fragmentos de cérebro selecionados foram incubados num período mínimo de 48 horas em formalina 10% tamponada e em seguida emblocados em parafina. A partir disto, foram obtidos cortes histológicos com 4 µm de espessura através de micrótomo horizontal Yamato Koki (Japan) e montados em lâminas histológicas albuminizadas. Os cortes obtidos foram previamente expostos à rotina histológica e submetidos a diferentes técnicas de marcação: Hematoxilina-Eosina (HE), para observação das características histológicas gerais; e Tricrômico de Masson (TM), Ácido Periódico de Schiff (PAS), Van Gienson (VG) e Feulgen (F) que mapearam, respectivamente, a deposição de colágeno, a expressão de glicosaminoglicanos (RUBIN; FARBER, 1999)10, fibras elásticas e análise de micronúcleos. Todos os protocolos experimentais foram desenvolvidos segundo Spicer11.
Os critérios utilizados na seleção das lâminas para as análises histológicas foram a integridade do corte, a boa marcação com os respectivos corantes, e o reconhecimento dos limites do córtex, que foi realizado através de comparação com um atlas estereotáxico12.
Para a verificação da expressão de glicosaminoglicanos, foi realizada uma comparação quantitativa das células PAS+ nos dois grupos experimentais estudados, analisando-se 10 campos (com magnificação de 400X por campo, distribuídos aleatoriamente por todo o córtex e sem distinção dos hemisférios cerebrais).
Para a avaliação da densidade de micronúcleos, foram analisados, para cada preparação histológica, cinco campos (400X por campo) distribuídos aleatoriamente por todo o córtex e sem distinção dos hemisférios cerebrais. Em cada campo foram analisados 10 neurônios e por fim feito uma média de micronúcleos por campo.
A densidade média dos vasos nos cortes histológicos foi analisada utilizando-se preparações histológicas coradas com HE (Hematoxilina – Eosina). Para cada preparação, foram analisados 10 campos (com aumento de 400X por campo, distribuídos aleatoriamente por todo o córtex e sem distinção dos hemisférios cerebrais) e obtida uma média a partir destes13.
Análise estatística
Para a análise estatística foi utilizado o teste de t Student. Em todos os casos, considerou-se como nível de significância para rejeição de hipótese nula um valor de P<0,05, através do programa Prisma 3.0.
RESULTADOS
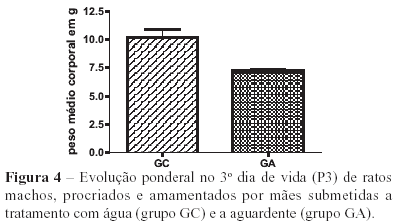
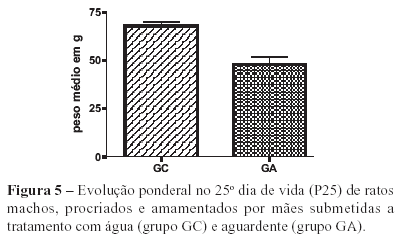
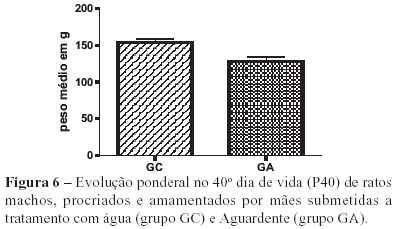
Os resultados obtidos em relação aos efeitos do tratamento com aguardente no período gestacional (P3), no final do período de amamentação (P25) e no dia do sacrifício (P40) revelaram diminuição significativa do peso corporal dos animais tratados em relação aos animais controle (Figuras 4, 5 e 6).
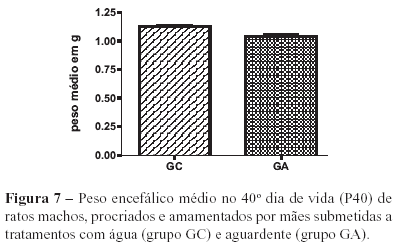
A análise dos pesos médios encefálicos aos 40 dias de vida (P40) demonstrou que houve diferença significativa (p<0,05) entre o grupo experimental e controle (Figura 7).
De acordo com a metodologia, não foram observados depósitos de fibras de colágeno e/ou de fibras elásticas no grupo tratado com aguardente e nem no grupo controle.
Com relação ao número de células PAS+, foram observadas diferenças significativas entre os 2 grupos através de análise quantitativa. O grupo GA apresentou um maior número de células PAS+, distribuídas aleatoriamente por todo o córtex visual, com exceção da camada molecular, apresentando uma maior concentração nas camadas inferiores (Figura 8).

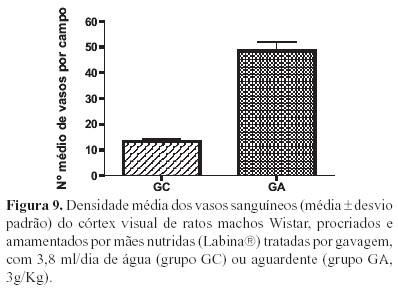
A análise comparativa da densidade dos vasos demonstrou uma diferença significativa quando comparados os grupos GC e GA (Figura 9).
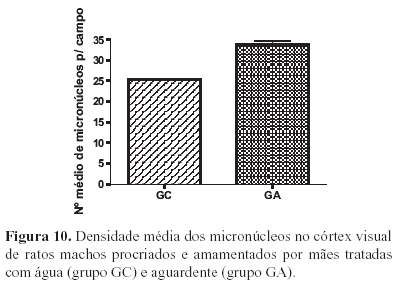
Observou-se diferença estatística entre os grupos GC e GA em relação ao número médio de micronúcleos das células da neurópila. O grupo experimental apresentou uma maior quantidade de micronúcleos (Figuras 10).
DISCUSSÃO
Um dos mecanismos de toxidade indireta do etanol sobre o cérebro é decorrente de sua ação sobreos vasos sanguíneos. A circulação placentária e a circulação cerebral fetal são meios de transporte fundamentais para o fornecimento de substâncias essenciais ao desenvolvimento e maturação do SNC4. Portanto, qualquer condição fisiopatológica que venha a interferir na perfusão sanguínea cerebral comprometerá o amadurecimento deste órgão14.
Alterações do transporte de nutrientes pela placenta têm sido descritas após o uso crônico de etanol, assim como alterações morfológicas da placenta. O peso da placenta pode estar aumentado ou diminuído, e foram relatados trombos intervilosos e vilite não específica. Estes achados podem estar envolvidos na etiologia do retardo do crescimento fetal e podem explicar o agravamento do desenvolvimento fetal na presença de desnutrição materna, onde a mãe já apresenta deficiência sérica de nutrientes2.
Os resultados obtidos, em relação aos efeitos do tratamento com aguardente durante a gestação (P3), indica que houve interferência do tratamento no peso corporal. Observou-se concordância dos nossos resultados com aqueles obtidos por Abel e Hanningan15, onde os animais que receberam aguardente apresentaram peso menor que os tratados com água. Este resultado leva-nos a supor que a diminuição do peso em (P3) foi ocasionado pelos efeitos indiretos do álcool4.
Modificações no transporte placentário de nutrientes, bem como alterações morfológicas da placenta descritas após o uso crônico de álcool, explicado por uma diminuição geral do fluxo sanguíneo placentário e umbilical e hipóxia, podem estar envolvidos na etiologia do retardo do crescimento fetal2.
No contexto da nutrição materna, alguns pesquisadores16,17 enfatizam a anorexia como importante fator de desnutrição. No presente trabalho, foi verificado que durante a gestação algumas matrizes demonstravam irritabilidade no momento da gavagem para administração de aguardente, além de apresentarem sinais de embriaguez e demora na recuperação desta. Tais condições, em intensidade variável entre as gestantes, retardaram a procura pelo alimento.
Quando foram analisados os pesos nos períodos P25 e P40 também se observou diminuição do peso dos animais tratados com aguardente em relação ao controle. Estudos feitos por Abel18 no que se refere a animais tratados com etanol não apresentou diferença ponderal no dia do desmame (P25) em animais expostos à mesma dose.
Segundo Silva2, no período de abstinência mães e filhotes apresentaram maior necessidade calórica,devido à supressão das calorias derivadas do álcool; essa exigência induz um aumento na procura do alimento.
Com relação à diminuição do peso nos animais tratados com aguardente visto em nosso trabalho, supõe-se que devido à aguardente ser formada por diferentes álcoois, e principalmente por ser adoçada artificialmente, daria um suporte calórico maior aos lactantes fazendo com que a procura pelo leite materno fosse menos freqüente, ao contrário do etanol que fornece calorias vazias13.
Quanto à ação do álcool na massa encefálica, estudos experimentais feitos por Woozniak19 utilizando etanol, demonstraram haver grande perda celular em algumas regiões cerebrais. Para Costa e Guizzetti5, quando o etanol é administrado durante o terceiro trimestre de gravidez em humanos e durante as duas primeiras semanas pós-natal em ratos, o efeito mais notável é a microcefalia, observada em 80% dos casos de Síndrome do Alcoolismo Fetal.
Para Miller & Potempa20, em trabalho semelhante ao nosso e referindo-se à presença desta característica em animais com noventa dias de idade , a microcefalia seria decorrente da redução da quantidade e do volume dos neurônios e dos componentes da neurópila.
Estudos recentes feitos por Wozniak19,21 afirmam que essa exposição primária ao etanol ocasiona uma extensa onda de neurodegeneração por apoptose em diferentes regiões do cérebro de ratos em desenvolvimento, sendo esta a causa principal da redução na massa cerebral e conseqüentemente seu peso. Estes estudos corroboram os achados deste trabalho, no qual houve uma diminuição no peso cerebral de ratos expostos a aguardente.
Apesar da diferença significativa na densidade média dos vasos sanguíneos no córtex visual dos ratos tratados em relação aos controles observada no nosso trabalho não encontramos na literatura trabalhos que pudessem comprovar esse fato.
Estudos semelhantes a este, relacionados a outros órgãos22,23 demonstraram aumento no número de vasos após a exposição ao etanol e sugeriram serem decorrentes de angiogênese. Ao nosso ver, no nosso experimento o aumento da densidade vascular pode ser justificado pela miniaturização (empacotamento) do cérebro24. Esse efeito, que é determinado pela redução dos componentes celulares da neurópila faz com que os vasos aglutinem-se dando falsa impressão de maior número.
Alguns estudos22, demonstram que o etanol tem a capacidade de depositar colágeno em diversos tecidos e órgãos. No entanto, de acordo com a nossa metodologia não foi observado depósitos de fibras colágenas ou elásticas em animais tratados com aguardente, inclusive no controle.
O álcool pode ter alterado a distribuição das fibras de colágeno e elásticas, todavia, nossa técnica de marcação para essas fibras restringiu-se a análise por microscopia óptica, como no tecido cerebral a quantidade dessas é normalmente muito pequena, não foi possível detectá-las; sendo possível, talvez, a sua observação utilizando-se a microscopia eletrônica ou outras técnicas mais específicas de imunohistoquímica.
Para Nishimura25 os glicosaminoglicanos têm um papel importante na mediação de interações entre células durante o desenvolvimento do (SNC), entretanto, mucopolissacarídeos e oligossacarídeos foram detectados em depósitos no cérebro de pessoas idosas e em pacientes com Síndrome de Down e Alzheimer, indicando processo degenerativo.
O termo degeneração indica lesões reversíveis decorrentes de alterações bioquímicas que resultam em acúmulo de substâncias no interior das células e essa degeneração é agrupada de acordo com a natureza da substância acumulada. A deposição aumentada de carboidratos nas células se deve a deficiência de enzimas responsáveis por sua metabolização; as glicogenoses e as mucopolissacaridoses são os principais exemplos.
Portanto, além das disfunções morfológicas resultantes da ingestão de aguardente, pode ocorrer uma série de distúrbios bioquímicos que geram acúmulo de substâncias indicadoras de estresse celular dentre elas a presença de glicosaminoglicanos.
Segundo Champe e Harvey26, as glicosaminoglicanas (GAGs) – uma classe de compostos antigamente denominados mucopolissacarídeos – estabilizam e suportam os componentes celulares e fibrosos do tecido – já que geralmente se associam a proteoglicanos formando grandes complexos na matriz extracelular e por vezes a proteínas fibrosas da matriz, como o colágeno. O ácido hialurônico é o principal componente dos glicosaminoglicanos e é encontrado abundantemente nos tecidos embrionários conferindo à substância fundamental maior fluidez, favorecendo a migração celular.
No que diz respeito ao número das células PAS+ no grupo experimental de nosso trabalho, houve concordância com estudos feitos no cérebro de ratos submetidos à aguardente nos períodos pré e pós-natal27. Houve um aumento no número das células, bem como uma desorganização destas células na neurópila. A observação feita quanto ao posicionamento das células PAS+ são sugestivas quanto ao efeito da aguardente em P40. A distribuição aleatória por todo ocórtex, exceto na camada molecular, bem como uma maior concentração nas camadas inferiores indica que no período de migração a ação da aguardente no desenvolvimento da neurópila foi mais acentuada.
Neste trabalho, a presença acentuada de micronúcleos nas células dos animais do grupo experimental demonstra uma possível neurotoxicidade da aguardente sobre as células do córtex cerebral.
As exposições ambientais podem ser ocasionais ou devido a um acúmulo seqüencial de diversos agentes que podem, por sua vez, promover efeitos interativos acentuando ou inibindo a mutagenicidade. Desse modo, a análise de micronúcleos em células esfoliadas da mucosa bucal, bexiga, ureter, cérvice uterina e esôfago permite identificar danos genotóxicos nos tecidos que são alvos específicos de certos carcinógenos, identificando estágios pré-clínicos no desenvolvimento de neoplasias28.
O consumo de bebida alcoólica é conhecido como carcinógeno humano, estando envolvido no aumento do risco de câncer no trato gastrintestinal; a formação do acetaldeído como metabólito do etanol é o principal agente causador de câncer, estando relacionado com o dano genotóxico e conseqüentemente um aumento no número de micronúcleos em linfócitos humanos29.
O álcool é um dos agentes químicos relacionados a danos cromossômicos. O micronúcleo é um núcleo adicional e separado do núcleo principal de uma célula, formado durante a divisão celular por cromossomos ou fragmentos de cromossomos que se atrasam em relação aos demais. Resulta de alterações estruturais cromossômicas espontâneas ou experimentalmente induzidas21.
O micronúcleo contém material genético que foi perdido do genoma durante a mitose e ocorrem antes de qualquer mudança histopatológica pré-neoplásica tornar-se evidente30. A presença de micronúcleos aumentada devido à exposição alcoólica é reportada em linfócitos periféricos de alcoolistas, em eritrócitos de medula óssea, células esfoliadas da língua, sugerindo então, ser um forte agente potencializador no desencadeamento de lesões cromossômicas31.
Reis e colaboradores31, trabalhando com alcoolistas e utilizando-se também da coloração de Feulgen para contagem de micronúcleos, observaram um aumento estatisticamente significativo da freqüência de micronúcleos em células esfoliadas do bordo lateral da língua (local mais prevalente de câncer bucal) no grupo de indivíduos expostos ao etanol em relação ao grupo controle (p<0,01), comprovando assim o efeito genotóxico do etanol.
CONCLUSÕES
Os ratos jovens submetidos indiretamente à ação da aguardente durante o desenvolvimento peri-natal apresentam: redução de peso corporal ao nascer, no desmame e aos 40 dias de vida; redução de peso encefálico; alteração na citoarquitetura com presença de ectopia e heterotopia; diferença em relação à densidade de vascular quando comparado ao grupo controle; maior número de células PAS+ quando comparada com o controle; distribuição irregular das células PAS+ nas várias camadas corticais, aumento no número de micronúcleos quando comparado com o grupo controle.
REFERÊNCIAS
1. GUEDES RCA, FRADE SF. Effect of ethanol on cortical speading depression, Brazilian Med. Biol. Res.26: 1241-1244, 1993.
2. SILVA VA. Ambiente e desenvolvimento: efeitos do álcool etílico e da desnutrição. Mundo e vida. 2(1), 2000.
3. ÖZER E, SARIOGLU S, GÜRE A. Effects of prenatal exposure on neuronal migration, neuronogenesis and brain myelination in the mice brain. Clin. Neuropath..19: 121-25, 2000.
4. SHIBLEY IA, McINTYRE TA, PENNINGTON SN. Experimental models used to measure direct and indirect ethanol teratogenicity. Alcohol and Alcoholism. 34: 125-140, 1999.
5. COSTA LG, GUIZZETTI M. Inhibition of Muscarinic Receptor- Induced Proliferation of Astroglial Cells by Ethanol: Mechanisms and Implications for the Fetal Alcohol Syndrome. Neurotoxicology.102: 1-7, 2002.
6. JONES KL, SMITH DW. Recognition of the fetal alcohol syndrome in early infancy. Lancet. 2: 999-1001, 1973.
7. SPOHR, H. L.; STEINHAUSEN, H. C. Alcohol, Pregnancy, and the developing child. Cambridge, England, 1996.
8. BERMAN RF, HANNIGAN JH, SPERRY MA, ZAJAC CS. Prenatal alcohol exposure and effects of environmental enrichment on hippocampal dendritic spine density. Alcohol. 13: 209-216, 1996
9. DELUCA B, CIOFFI LA, BURES J. Cortical and caudate spreading depression as na indicator of neural changes induced by early malnutrition in rats. Activitas Nervosa Superior. 19:130-131, 1997.
10. RUBIN, E.; FARBER, J. Cell injury. IN: RUBIN, E.; FARBER, J. (Eds.) Pathology. Lippincott, PA, p. 13, 1999.
11. SPICER SS. Histochemistry in pathologic diagnosis. New York: Dekker. 1041p, 1987.
12 PAXINOS G, WATSON C. The rat brain in stereotaxic coordinates. 4. ed. Califórnia: Academic Press, 1998.
13. PONTES-FILHO NT. Morfometria e histoquímica do córtex cerebral de ratos jovens submetidos ao álcool e a desnutrição. 58p., Tese de Doutorado. Programa de Pós-Graduação em Nutrição, Departamento de Nutrição- CCS, Univer. Fed. de Pernambuco, 2003.
14. PHILLIPS DE, KRUEGER SK, WALL KA, SMOYER-DEARING LH, SIKORA AK. The development of the blood-brain barrier in alcohol-exposed rats. Alcohol. 14: 333-343, 1997.
15. ABEL EL, HANNIGAN JN. Risc factors pathogenesis. In:SPOOHR, H. L.; STEINHAUSEN, H. A. Alcohol, Pregnancy and Developing child, Cambridge University Press, Cambridge. p..63-75, 1996.
16. PALENCIA G, TEIXEIRA F, ORTIZ A, PEREZ R, RIOS C, SOTELO J. Detrimental effects of malnutrition on the damage induced by alcoholism: A study of animal models that simulate chronic alcoholism and malnutrition of large human groups. J. Stud. Alcohol. 55: 113-120, 1994.
17. BRODY T. Alcohol, In: Nutritional biochemistry. 9ed., cap. 4. Academic Press (London). 201-220, 1998.
18. ABEL EL. An update on incidence of FAS: FAS is not an equal opportunity birth defect. Neurotoxicol. Teratol. 17: 437-443, 1995.
19. WOZNIAK DF, HARTMAN RE, BOYLE MP, VOGT SK, BROOKS AR, TENKOVA T, YOUNG C, OLNEY JW, MUGLIAB LJ. Apoptotic neurodegeneration induced by ethanol in neonatal mice is associated with profound learning/memory in juveniles.Department of Psychiatry, Washington University School of Medicine, St. Louis, MO 63110, USA, 2004.
20. MILLER MW, POTEMPA G. Number of neurons and glia in mature rat somatosensory cortex: Effects ofis prenatal exposure to alcohol. The Journal of Comparative Neurology. 293: 92-102, 1990.
21. DIKRANIAN K, QIN QY, LABRUYERE J, NEMMERS B, OLNEY JW. Ethanol induced neuroapoptosis in developing rodent cerebellum and related brain stem structures. Developmental Brain Research. 155: 1-13, 2005.
22. ARAÚJO-FILHO J. Análise histomorfométrica do coração de ratos expostos indiretamente ao etanol no período perinatal.Recife: UFPE. (Monografia de conclusão do curso de Bacharelado em Ciências Biológicas - Centro de Ciências Biológicas da Universidade Federal de Pernambuco), 2003.
23. PATU VJRM. Efeitos do etanol e desnutrição crônicos sobre o pâncreas de ratos. Recife: UFPE. (Monografia de conclusão de curso – Departamento de Biologia – Centro de Ciências Biológicas da Universidade Federal de Pernambuco), 2005.
24. ROSENBERG A. Brain damage caused by prenatal alcohol exposure. Science and Medicine. 4: 42-50, 1996.
25. NISHIMURA A, SAWADA S, USHIYAMA I, YAMAMOTO Y, NAKAGAWA T, TANEGASHIMA A, NISHI K. Lectinhistochemical of degenerative glycoconjugate deposits in human brain. Forensic Science International. 113: 265-269, 2000.
26. CHAMPE PC, HARVEY RA. Bioquímica ilustrada. 2.ed. Porto Alegre : Artmed. 446p, 2000.
27. PEDRA-FIXE MG. Estudo morfométrico do córtex cerebral de ratos expostos à aguardente e a desnutrição nos períodos pré e pós-natal. Recife: UFPE, (Monografia de conclusão de curso- Biomedicina – Centro de Ciências Biológicas da Universidade Federal de Pernambuco), 2005.
28. RAMIREZ A. Análise de Células Metanucleadas de Alcoólicos Portadores de Carcinomas Orais, 2000.
29. BROOKS PJ, THERUVATHU JA. DNA adducts from acetaldehyde: implications for alcohol-related carcinogenesis. Alcohol. 35: 187-193, 2005.
30. BLOCHING M, HOFMANN A, LAUTENSCHLAGER C, BERGHAUS A, GRUNMT T. Exfoliative cytology of normal mucosa to predict the relative risk of cancer in the upper aerodigestive tract using the MN-assay. Oral Oncology. 36: 550-5, 2000.
31. REIS SRA, SADIGURSKY M, ANDRADE MGS, SOARES LP, ESPÍRITO-SANTO AR, BOAS SDV. Genotoxic effect of ethanol on oral mucosa cells. Pesquisa Odontol. Bras. 116(3), 2002.
 Endereço para correspondência:
Endereço para correspondência:
Prof. Dr. Nicodemos Teles de Pontes-Filho
Laboratório de Imunopatologia Keizo Asami, LIKA, Setor de Patologia, Universidade Federal de Pernambuco UFPE. Av. Prof. Morais Rêgo s/n, Campus Universitário, CEP 50670-910.
e-mail: ntpf@ig.com.br
Recebido em 03.01.2006
Aprovado em 30.03.2006
1Trabalho realizado no Laboratório de Imunopatologia Keizo Asami – LIKA da Universidade Federal de Pernambuco - UFPE













