Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versión impresa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.3 n.3 Belém dic. 2008
Ecologia reprodutiva dos tralhotos Anableps anableps e Anableps microlepis (Pisces: Osteichthyes: Cyprinodontiformes: Anablepidae) no rio Paracauari, ilha de Marajó, Pará, Brasil
Reproductive ecology of tralhotos Anableps anableps and Anableps microlepis (Pisces: Osteichthyes: Cyprinodontiformes: Anablepidae) in the Paracauari river, island of Marajó, Pará, Brazil
Francylenna Lima do NascimentoI; Maria Ivaneide da Silva AssunçãoII
IUniversidade Federal da Bahia. Salvador, Bahia, Brasil (perolanegray@gmail.com)
IIMuseu Paraense Emílio Goeldi. Belém, Pará, Brasil (assuncao@museu-goeldi.br)
RESUMO
Neste trabalho, são analisados e discutidos a estrutura da população, reprodução e aspectos embrionários de Anableps anableps e A. microlepis coletados no estuário do rio Paracauari, entre 48o 30' 20" W/ 00o 44' 36" S e 48o 31' 12" W/ 00o 43' 34" S, ilha de Marajó, Pará, no período de agosto de 2001 a abril de 2002. As coletas foram realizadas com redes de arrasto, puçá e tarrafa. Foram coletados e analisados 1.203 exemplares de tralhoto, sendo 901 A. anableps e 302 A. microlepis. As duas espécies se agregam em cardumes de dez a 50 indivíduos, sendo que A. microlepis predomina no verão, quando a água está salobra, e A. anableps no inverno, quando a água está doce. Quanto à proporção sexual, A. anableps apresentou paridade de 1:1; já em A. microlepis, as fêmeas predominaram na razão de 2:1. Em relação ao tamanho, A. anableps (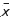 = 240 mm) é, em média, menor que A. microlepis (
= 240 mm) é, em média, menor que A. microlepis (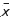 = 270 mm), sendo as fêmeas de cada espécie significativamente maiores que os machos. Ambas as espécies se reproduzem durante o ano todo, com picos reprodutivos em períodos distintos: A. anableps no inverno e A. microlepis no verão. Cada fêmea produz de dez a 31 ovócitos, que, com 1,0 a 1,5 mm de diâmetro, são liberados na cavidade ovariana e, ao chegar até 2,0 mm, aderem-se novamente à parede do ovário, ficando ali até a eclosão. Os embriões são liberados dentro da cavidade ovariana onde completam seu desenvolvimento, vindo nascer aos 45 a 47 mm de comprimento. Apesar de agregadas, cada espécie mantém diferentes estratégias de organização estrutural e temporal, exigindo diferentes condições ambientais, possivelmente mais favoráveis ao desenvolvimento da prole.
= 270 mm), sendo as fêmeas de cada espécie significativamente maiores que os machos. Ambas as espécies se reproduzem durante o ano todo, com picos reprodutivos em períodos distintos: A. anableps no inverno e A. microlepis no verão. Cada fêmea produz de dez a 31 ovócitos, que, com 1,0 a 1,5 mm de diâmetro, são liberados na cavidade ovariana e, ao chegar até 2,0 mm, aderem-se novamente à parede do ovário, ficando ali até a eclosão. Os embriões são liberados dentro da cavidade ovariana onde completam seu desenvolvimento, vindo nascer aos 45 a 47 mm de comprimento. Apesar de agregadas, cada espécie mantém diferentes estratégias de organização estrutural e temporal, exigindo diferentes condições ambientais, possivelmente mais favoráveis ao desenvolvimento da prole.
Palavras-chave: Anableps anableps. Anableps microlepis. Reprodução. Desenvolvimento. Marajó.
ABSTRACT
This paper analyses and discusses population structure, reproduction, and aspects of the embryos of Anableps anableps and A. microlepis collected from the Paracauari River between 48o 30' 20" W/ 00o 44' 36" S and 48o 31' 12" W/ 00o 43' 34" S Marajó Island, state of Pará, Brazil, from August 2001 through April 2002. Sampling was carried out with trawls, shrimp nets, and casting-nets. A total of 1.203 specimens were collected and analyzed, from which 901 were A. anableps and 302 A. microlepis. Both species group themselves into schools of ten to 50 individuals; however, A. microlepis is predominant in the summer when the water is more saline, while A. anableps predominates in the winter when the water is fresh. Regarding sex ratio, it was of 1:1 for A. anableps, while A. microlepis females surpassed males in a ratio of 2:1. In relation to size, A. anableps (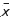 = 240 mm) is on average smaller than A. microlepis (
= 240 mm) is on average smaller than A. microlepis (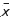 = 270 mm), but females of each species were significantly larger than the males. Both species reproduce throughout the year, yet with reproductive peaks in distinct periods: A. anableps in winter and A. microlepis in summer. Each female produces ten to 31 oocytes that are released into the ovarian cavity when they reach 1.0-1.5 mm in diameter; when reaching 2.0 mm they attach themselves once again to the ovary's wall, where they remain until eclosion. The embryos are released inside the ovarian cavity when development is complete and measure 45-47 mm in length at birth. Despite being mixed, each species maintains distinct strategies regarding structural and temporal organization time, and requiring different environmental conditions - possibly those that are more favorable for offspring development.
= 270 mm), but females of each species were significantly larger than the males. Both species reproduce throughout the year, yet with reproductive peaks in distinct periods: A. anableps in winter and A. microlepis in summer. Each female produces ten to 31 oocytes that are released into the ovarian cavity when they reach 1.0-1.5 mm in diameter; when reaching 2.0 mm they attach themselves once again to the ovary's wall, where they remain until eclosion. The embryos are released inside the ovarian cavity when development is complete and measure 45-47 mm in length at birth. Despite being mixed, each species maintains distinct strategies regarding structural and temporal organization time, and requiring different environmental conditions - possibly those that are more favorable for offspring development.
Keywords: Anableps anableps. Anableps microlepis. Reproduction. Development. Marajó.
INTRODUÇÃO
Os peixes teleósteos apresentam uma enorme diversidade de tipos de reprodução, o que lhes possibilitou ocupar com sucesso os mais variados habitats (Vazzoler, 1996; Nakatani et al., 2001). Entre as mais de 23.400 espécies existentes no mundo, 80% são ovíparas ou ovovivíparas e 20% vivíparas. Neste último grupo, incluem-se 14 famílias, entre as quais Anablepidae, da ordem Cyprinodontiformes (Knight et al., 1985; Wourms, 1981).
A família Anablepidae é formada por três gêneros e dezessete espécies distribuídas na região Neotropical desde o sul do México até o sudeste da América do Sul (Ghedotti, 1998; Novaes & Andreata, 1996). O gênero Anableps inclui três espécies popularmente conhecidas como tralhotos ou peixes-de-quatro-olhos, assim chamados por terem os olhos elevados acima do topo da cabeça e divididos horizontalmente por uma membrana, permitindo-lhes enxergar acima e abaixo d'água (Bone et al., 1995; Miller, 1979; Santos, 1987). As três espécies de Anableps são: A. dowi, da costa do Pacífico, que ocorre do sudeste do México até a Guatemala, e A. anableps e A. microlepis - objetos deste trabalho - ambas da parte leste da América do Sul, da Venezuela à costa do Pará (Baughman, 1947; Burns & Flores, 1981; Ghedotti, 1998; Knight et al., 1985; Parenti, 1981). O mais antigo registro da ocorrência de tralhoto na costa paraense foi feito pelo padre Antônio Vieira, em sua "pregação aos peixes", escrita em 1654, quando de sua estada nesta região (Papavero et al., 2002).
Anableps anableps e Anableps microlepis são peixes pelágicos que transitam nos ambientes salobros e dulcícolas do estuário amazônico (Barthem, 1985; Ghedotti, 1998; Miller, 1979). Apresentam dimorfismo sexual e se reproduzem através de fertilização e desenvolvimento interno. Os machos adultos são facilmente identificados por apresentarem uma modificação nos raios da nadadeira anal, formando um tubo através do qual é liberado o esperma (Burns, 1991; Meisner & Burns, 1997; Miller, 1979; Turner, 1950; Wooton, 1990).
À primeira vista, não têm importância para o consumo humano. Entretanto, segundo informações de terceiros, esses peixes são consumidos como alimento em alguns setores das zonas mais pobres da periferia de Belém. Do ponto de vista da economia formal, sua importância reside no fato de servirem como isca na captura daqueles peixes que geram divisas para o estado do Pará, como o filhote e a dourada. No âmbito do comércio ilegal, delineia-se uma forte pressão de exploração indiscriminada, com ameaças evidentes às populações de tralhoto. Desde 2003, os jornais vêm noticiando a apreensão pelo Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA) de carregamentos de tralhotos que seriam contrabandeados para São Paulo, de onde seriam exportados como peixes ornamentais.
Além da biopirataria, as transformações em curso na Amazônia, em especial nas regiões de estuários, por causa do forte impacto antrópico devido à acelerada ocupação humana, constituem potenciais ameaças aos estoques daquelas espécies. Assim, o conhecimento sobre as interações entre as duas populações, a reprodução e o desenvolvimento embrionário é extremamente importante para subsidiar políticas públicas que visem o manejo adequado das duas espécies e para o entendimento de parte do processo evolutivo do grupo.
Estudos sobre tralhoto no estuário amazônico são escassos, praticamente tudo o que se conhece está resumido nos trabalhos de Ikeda et al., 2005 e Nascimento et al. , 2004, que fizeram um breve relato sobre aspectos biológicos destes peixes.
Quanto ao estudo da biologia reprodutiva e do desenvolvimento embrionário de Anableps, Turner (1938a; 1938b; 1940; 1950) foi pioneiro, publicando imagens de corte histológico do ovário, descrevendo as fases de desenvolvimento embrionário de A. anableps e citando as similaridades que ocorrem entre essa espécie e A. microlepis. Mas antes, Garman (1896) já havia descrito para os gêneros Anableps e Jenynsia o modo de reprodução vivíparo e o órgão copulador dos machos, o gonopódio.
Vários autores (Knight et al., 1985; Turner, 1938a; 1938b; Wourms, 1981) têm demonstrado que a gestação de Anableps é do tipo folicular, ou seja, os ovócitos são fecundados dentro do folículo ovariano ao tamanho de 0,7 mm de diâmetro. Os embriões estabelecem uma relação íntima de matotrofia na transferência de nutrientes da mãe para o embrião.
No intuito de contribuir para o conhecimento da ecologia reprodutiva e do desenvolvimento interno de Anableps anableps e Anableps microlepis no estuário amazônico, este trabalho apresenta a organização estrutural de tralhoto, modos e ambiente requerido para a reprodução e aspectos do desenvolvimento embrionário.
MATERIAL E MÉTODOS
A ilha de Marajó está situada na foz do rio Amazonas, no nordeste do estado do Pará, entre os meridianos 48o W e 51o W e os paralelos 00o S e 2o S. É considerada uma das maiores ilhas flúvio-marinhas do mundo (AMAM, 1998), ocupa uma área de 59.204 km2, o que representa 4,74% da área do estado do Pará. O clima da ilha de Marajó é do tipo tropical super-úmido, com chuvas e ventos regulares. A temperatura média anual é de 26o a 32 oC (Nascimento et al., 1991). Na parte leste da ilha, fica a região de campos, com lagos e igarapés de dimensões variáveis, conforme o regime das águas.
Os rios da parte leste da ilha, entre os quais o Paracauari, sofrem influência de maré através da baía do Marajó, cujos gradientes salinos da água variam conforme a estação do ano. Na época da seca, as águas salinas do oceano penetram na baía e promovem a mistura de águas salgada e doce, tornando a água da baía salobra e a condutividade alta de até 16,2 µmhos. cm-1. Essa água avança para o interior do rio Paracauari, elevando a salinidade desse reservatório a níveis de 10o/∞ (Barthem, 1985). No inverno, devido ao aporte de água doce que chega do continente, a condutividade baixa em toda a baía e nos estuários dos rios que nela deságuam, ficando em torno de 45 µmhos. cm-1
(Barthem, 1985; Barthem & Schwassmann, 1994). A área de estudo compreendeu o estuário do rio Paracauari entre as coordenadas 48o 30' 29" W/ 00o 44' 36" S e 48o 31' 12" W/ 00o 43' 34" S, porção destacada da Figura 1. O rio Paracauari, com aproximadamente 51 km de extensão, localiza-se na parte litorânea da ilha de Marajó, entre 48o 19' 17" W/ 00o 39' 05" S e 48o 30' 17" W/ 00o 44' 56" S.
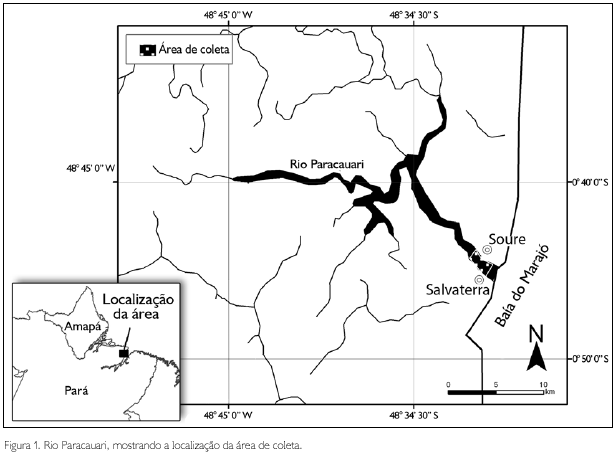
As coletas foram realizadas mensalmente, de agosto de 2001 até abril de 2002, com tarrafas, redes de arrasto e puçás.
O número de i ndi víduos am ostrados foi estabelecido como sendo a captura de 100 exemplares por excursão de coleta.
Após cada coleta, os exemplares eram examinados macroscopicamente, conforme a espécie, o tamanho e o sexo, e acondicionados em sacos plásticos, contendo as informações sobre data, aparelho de pesca, local de amostragem e coletor. Depois de ensacado, o material era congelado e transportado para o Laboratório de Ictiologia do Museu Paraense Emílio Goeldi.
No laboratório, os peixes eram contados, enumerados e medido o seu comprimento-padrão (mm). A orientação do gonopódio (esquerdo ou direito) e as modificações no poro urogenital também eram registradas. Em seguida, as gônadas eram extraídas e etiquetadas com os mesmos números dos exemplares dos quais tinham sido retiradas, para posterior identificação. Cada gônada e cada exemplar foi pesado, separadamente, em balanças digitais com precisão de centésimo de grama e de 1 g, respectivamente.
Esses dados por espécie e sexo foram utilizados para analisar a proporção sexual, identificar a faixa de comprimento em que os exemplares teriam atingido primeira maturidade gonadal e para calcular a relação gonadossomática.
Para obter informações sobre a reprodução e o desenvolvimento intra-ovariano das duas espécies de tralhoto, os ovários foram abertos e examinados sob lupa estereomicroscópica. Os ovos foram contados e medidos os seus diâmetros e os embriões, depois de examinados, foram medidos quanto ao seu comprimento-padrão em mm.
Para facilitar o entendimento sobre o desenvolvimento interno de tralhoto, foram estabelecidas quatro fases de desenvolvimento, como pode ser visto na Tabela 1. Todos os dados coletados foram registrados por espécie e sexo em formulários e inseridos em planilhas do programa Microsoft Excel.

Depois de estudados, os embriões e os exemplares foram fixados em formol a 10% e, posteriormente, conservados em álcool a 70% e depositados na coleção ictiológica do Museu Paraense Emílio Goeldi.
A proporção sexual em número de indivíduos foi estimada por espécie, obtendo-se o percentual de fêmeas e de machos presentes na amostra total de cada espécie. A paridade sexual (1:1) foi testada através do teste do X2, ao nível de significância de 5%, utilizando-se a seguinte fórmula:
X2 = (O - E)2 / E
onde:
O é a freqüência percentual de fêmeas
E a freqüência esperada: 1:1
Para gl= 1, valores de X2 > 3,84 indicam
diferenças significativas.
Quanto aos dados de comprimento, foram calculados os comprimentos mínimo, médio e máximo para cada espécie, por sexo e por maturidade gonadal. Os resultados foram confrontados e demonstrados em gráficos. Quanto aos ovócitos e ovos, foi feita apenas uma descrição das suas características externas.
A duração do período reprodutivo foi identificada pela distribuição temporal da relação gonadossomática média (RGS). A relação foi estabelecida calculando-se, para cada indivíduo, a razão entre os valores do peso da gônada e do peso do corpo, aplicando-se a fórmula:
RGS = Wg/Wc x 100
onde Wg é o peso das gônadas e Wc, o peso total do peixe.
Os dados sobre os embriões foram distribuídos por fase de desenvolvimento e demonstrados em Tabela.
RESULTADOS
No rio Paracauari, Anableps anableps e Anableps microlepis agregam-se e dividem-se em vários cardumes de dez a 50 indivíduos, com o predomínio de uma das espécies, conforme o período do ano. De 1.203 exemplares reunidos em nove meses de coletas, 901 indivíduos pertenciam à espécie A. anableps e 302 à A. microlepis.
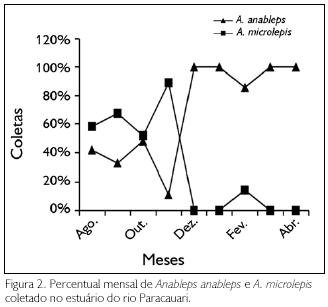
Nas coletas realizadas durante o verão, de agosto a novembro, quando o ambiente estava salobro, A. microlepis foi mais freqüente, representando 68% do total capturado naquele período.
Como pode ser observado na Figura 2, conforme decorresse a estação chuvosa, havia uma inversão nas capturas. De dezembro a abril, quando a água estava doce, A. anableps passou a predominar, com 97% do total coletado no período. De acordo com esses resultados, A. microlepis é mais restrita ao ambiente salobro, enquanto A. anableps, embora ocorra em ambiente salino, explora mais o doce.
Proporção Sexual
Quanto à paridade sexual, a população de A. anableps apresentou uma proporção de 1:1, embora o número de fêmeas (424) tenha sido menor que o de machos (477). As diferenças na proporção de cada sexo na amostra, 48,8% e 51,5%, respectivamente, não foram significativas quando verificados pelo teste do qui-quadrado (X2 = 0,04). Situação inversa foi observada na população de A. microlepis, em que o número de fêmeas (198) predominou sobre o de machos (104), com a proporção sexual de 65,5% e 34,4%, respectivamente. O emprego do teste do qui-quadrado (X2 = 4,80) confirma o predomínio significativo do número de fêmeas em relação ao de machos, na ordem de 2:1.
Comprimento
Comparando-se os comprimentos dos indivíduos das duas espécies, A. microlepis apresentou exemplares maiores, atingindo um comprimento médio de 155 mm e máximo de 270 mm, enquanto A. anableps mostrou um comprimento médio de 141 mm e máximo de 240 mm, abaixo, portanto, da espécie anterior.
Quando os tamanhos foram comparados entre os sexos de cada população, em ambas as espécies, as fêmeas se apresentaram maiores que os machos. O comprimento médio das fêmeas de A. anableps foi de 155 mm, contra 131 mm estimado para os machos, com o máximo e o mínimo se situando entre 240 a 71 mm e 183 a 75 mm, respectivamente. O mesmo foi registrado para A. microlepis, em que o comprimento médio das fêmeas, em torno de 168 mm, foi superior ao dos machos, que alcançou somente 127 mm. Os comprimentos máximos e mínimos variaram de 270 mm a 58 mm para as fêmeas e de 214 mm a 81 mm para os machos.
Maturidade Sexual
Não ficou bem esclarecido o tamanho em que as fêmeas das duas espécies atingem a primeira maturação sexual. Em A. anableps, não foi encontrada fêmea grávida com comprimento abaixo de 82 mm. Entretanto, o comprimento máximo dos indivíduos imaturos (158 mm) ultrapassa o tamanho médio de 154 mm dos exemplares sexualmente adultos, assim como o comprimento médio dos imaturos (98 mm) situou-se acima do comprimento mínimo dos indivíduos adultos, indicando uma indefinição sobre o que era realmente adulto ou sub-adulto.
Nos machos, não foi encontrado nenhum indivíduo sexualmente maduro com comprimento inferior a 90 mm. E o comprimento médio dos exemplares imaturos apresentou valor acima do tamanho mínimo dos indivíduos adultos, que foi de 99 mm.
Nenhuma fêmea de A. microlepis sexualmente madura apresentou comprimento inferior a 98 mm, o que indicaria que a maturidade sexual pode ser atingida a partir deste comprimento. Quanto aos imaturos, não se obtiveram resultados satisfatórios, pois o tamanho médio desses exemplares foi superior ao comprimento mínimo dos adultos, o que poderia caracterizar um erro de análise ou insuficiência de dados.
Os machos de A. microlepis, apesar de atingirem comprimentos menores em relação às fêmeas, aparentaram alcançar a maturidade sexual bem depois destas - somente a partir de 104 mm de comprimento. O comprimento médio de 97 mm dos imaturos situou-os abaixo do mínimo exibido pelos sexualmente maduros, indicando que os dados refletem o tamanho em que os machos teriam atingido a primeira maturação sexual.
Modo de Reprodução
As duas espécies apresentaram o mesmo modo de reprodução, com ocorrência de fecundação interna e viviparidade. O dimorfismo sexual é mais evidente nos machos pela presença do órgão copulador, o gonopódio. Esse órgão é formado pela modificação de seis a oito raios da nadadeira anal e coberto por microescamas provenientes do epitélio da base da nadadeira anal.
Observou-se que o gonopódio apresentava certa mobilidade na sua orientação, podendo estar voltado para a direita ou para a esquerda. Nos exemplares coletados, o comprimento máximo atingido por essa estrutura foi de 28 mm.
Algumas fêmeas continham resquícios de sêmen no ovário e a abertura urogenital ou o gonóporo ainda estava inflamado ao redor, indicando uma cópula recente. Nos primeiros estádios de gravidez, a abertura urogenital apresentava-se fechada, quando o embrião atingia a fase 3 de desenvolvimento, voltava a dilatar-se. Próximo de liberar os embriões, o gonóporo chegava a atingir 1,5 mm de diâmetro. Tais observações levam a sugerir que o gonóporo se fecharia após a cópula, voltando a dilatar-se próximo da liberação dos embriões.
Período Reprodutivo
O período reprodutivo das populações aqui estudadas não ficou definido. Durante a vigência dos trabalhos de campo, de agosto de 2001 a abril de 2002, coletaram-se exemplares em reprodução contínua.
As análises da relação gonadossomática média realizadas para ambos os sexos e por espécie confirmaram o que foi observado no campo. A distribuição mensal dos valores da RGS não delimitou o período reprodutivo de tralhoto, mas mostrou picos reprodutivos que, nos machos de A. anableps, pareceram flutuar ao longo do ano. As fêmeas dessa espécie apresentaram o primeiro pico no começo do inverno, no mês de janeiro, e daí até março - no meio do inverno - houve um declínio na curva da relação gonadossomática, que tendeu a subir novamente a partir de abril. Os machos exibiram ao menos três picos reprodutivos - setembro a outubro, dezembro e março - que não coincidiram com aqueles das fêmeas, apresentando uma tendência de uma nova fecundação ocorrer imediatamente após a gravidez (Figura 3).
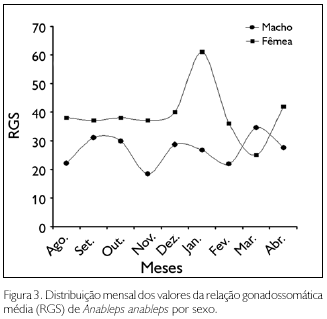
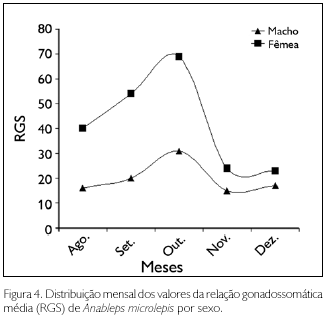
A população de A. microlepis apresentou apenas um pico reproduti vo e, ao contrário do que foi observado em A. anableps (Figura 3), nessa espécie, o período de maior incidência reprodutiva foi o mês de outubro, durante o verão, coincidindo em ambos os sexos (Figura 4). Esse sincronismo nas curvas da relação gonadossomática reforça o que foi observado no ovário de A. microlepis - a presença, no mesmo ovário, de ovos e embriões em diferentes fases de desenvolvimento - indicando que, nessa espécie, uma nova cópula pode ocorrer ainda durante a gravidez.
Gònadas
O tralhoto possui testículos pares, alongados e convolutos, sendo ambos do mesmo tamanho. O ovário é ímpar, sendo que externamente aparenta ser um órgão par, com o ovário esquerdo extremamente reduzido; entretanto, internamente, ocorre apenas uma cavidade onde ovos e embriões ficam alojados.
Nos ovários de cada espécie de Anableps foram encontrados de dez a 31 ovos, que, ao atingirem de 1,0 a 1,5 mm de diâmetro, seriam liberados para a cavidade ovariana, ficando soltos entre si e da parede do ovário. A partir de 2,0 mm, quando já se visualizava o embrião, os ovos se aderiam novamente à parede do ovário, onde permaneciam até a eclosão. Esses resultados levaram a sugerir que, no início do desenvolvimento, o embrião se nutre de suas próprias reservas, passando a depender das reservas da mãe nas fases seguintes. Entretanto, não ficaram esclarecidas as seguintes questões: 1 - se o ovócito seria fecundado dentro do folículo ainda na parede do ovário e, posteriormente, ocorreria a ovulação; 2 - não haveria ovulação; quando o ovócito atingisse a fase matura, o folículo seria liberado com o ovócito no seu interior e a fecundação ocorreria dentro da cavidade ovariana; 3 - a ovulação ocorreria dentro da cavidade ovariana e depois o ovo se aderiria à parede do ovário.
Desenvolvimento Embrionário
A quantidade de embriões dentro do ovário é determinada pelo tamanho da mãe. Nos exemplares coletados, foram encontrados de um a 23 embriões por ovário, sendo que as fêmeas maiores da espécie A. microlepis, com 230 mm de comprimento, continham 19 embriões. Já em A. anableps, as maiores fêmeas, com tamanho de 239 mm, abrigavam 23 filhotes.
Em alguns exemplares de A. microlepis, foram encontrados apenas ovos e embriões mortos que não tinham sido eliminados ou estavam sendo reabsorvidos pelo organismo materno, ficando mumificados dentro do ovário. Esses ovos se apresentavam como uma massa amorfa com pontículos marrons.
Nessa mesma espécie, observaram-se exemplares com embriões em duas fases de desenvolvimento - uma fêmea com embriões nas fases 2 e 4, e duas com filhotes nas fases 1 e 2 (Tabela 1). Esta situação não foi observada em A. anableps.
Durante o desenvolvimento embrionário, os ovos permaneciam aderidos ao ovário até a eclosão. Os ovários com embriões nos estádios iniciais de desenvolvimento 1 e 2 (Tabela 1) não apresentavam sangue no seu interior. Não se observou nenhum aborto de fêmeas capturadas nessas fases.
Na fase 2, os embriões apresentavam saco vitelino grande, róseo translúcido, com restos de material vitelínico no seu interior.
Os ovários com embriões na faixa de 30 a 40 mm de comprimento, no final da fase 2 e na fase 3, tinham grande quantidade de sangue no seu interior. Quando a fêmea era perturbada, o sangue e os filhotes eram liberados juntos. Esses embriões já apresentavam escamas, o saco vitelino vermelho estava bastante regredido e no interior se podia visualizar o intestino. No abdome desses embriões, onde se situava o saco vitelínico, havia uma abertura que ia da região anal até a gular, a qual ainda não havia se fechado.
Na fase final de desenvolvimento (4), o embrião eclodiria ao atingir uns 45 mm de comprimento. Nessa fase, o saco vitelínico se encontrava reduzido, faltando ainda fechar a abertura abdominal. Os recém-eclodidos não nasciam imediatamente, mas ficavam livres na cavidade ovariana até completar seu desenvolvimento. Os embriões eram liberados ao chegarem a 47 mm de comprimento, após a completa cicatrização da abertura abdominal deixada pelo saco vitelino. Depois do nascimento, a membrana que envolvia o embrião e que se prendia ao ovário ainda permanecia presa na parede deste para ser liberada aos poucos.
As fêmeas que acabavam de liberar os embriões, ainda com restos de casca nos ovários, já começariam a ovular, indicando que o tralhoto apresenta reprodução contínua.
DISCUSSÃO
Anableps anableps e A. microlepis são espécies simpátridas, formando cardumes de diferentes tamanhos. No rio Paracauari, embora essas espécies tenham ocorrido nos mesmos cardumes, organizavam-se de maneira diferente, tanto entre elas como dentro de cada população, principalmente em relação às mudanças ambientais, à paridade sexual e à reprodução.
A. microlepis pareceu explorar mais o ambiente salobro, evidenciado pela maior freqüência dessas espécies nas capturas durante o período seco, quando as águas oceânicas invadem a baía de Marajó e conferem maior salinidade ao rio Paracauari (Barthem, 1985; Barthem & Schwassmann, 1994). Semelhantes achados foram obtidos por Camargo & Isaac (2001), que, nas zonas mais salinas do estuário dos rios da região Norte, capturaram somente A. microlepis. Então, A. microlepis deve concentrar-se na zona de água salobra, acompanhando o deslocamento sazonal dessa zona.
A maior incidência de A. anableps nas coletas realizadas no inverno pode indicar que a espécie seria mais adaptada a ambientes com menores teores salinos.
De acordo com Vazzoler (1996), a proporção sexual varia em função de diversos fatores que atuam de modo diferente sobre os indivíduos de cada sexo. Em muitos casos, pode-se observar uma proporção de 1:1; porém, numa análise de comprimentos, pode ocorrer o predomínio de fêmeas nas classes de comprimentos maiores (Assunção & Barthem, 2005). Semelhantemente ao que foi mencionado por esses autores, A. anableps apresentou paridade sexual de 1:1, ao contrário do que foi observado para A. microlepis, que exibiu maior número de fêmeas na proporção de 2:1. Em ambas as espécies, as fêmeas foram significativamente maiores que os machos, semelhantes no que foi observado por Brenner & Krumme (2007), Lowe-McConnell (1987) e Miller (1979). Esses achados levam a sugerir que as tais populações desenvolveram diferentes estratégias de organização estrutural, que possivelmente lhes assegurasse explorar melhor o ambiente.
Não puderam ser definidos os tamanhos em que A. anableps e A. microlepis alcançam a maturidade sexual por falta de uma análise mais apurada, acompanhada de corte histológico das gônadas.
As espécies de Anableps apresentam dimorfismo sexual, com modificação dos raios da nadadeira anal nos machos para formar o órgão copulador (Burns & Flores, 1981; Burns, 1991; Ghedotti, 1998; Meisner & Burns, 1997; Miller, 1979; Nelson, 1994; Parenti, 1981; Santos, 1987; Turner, 1950). Esse órgão pode estar voltado tanto para a esquerda como para a direita, conforme foi observado neste trabalho. Miller (1979), Parenti (1981) e Burns (1991) mencionam que os machos de A. dowi e de outros Cyprinodontiformes (Poeciliidae eJenynsia) com gonopódio voltado para a direita copulam com as fêmeas cuja abertura urogenital esteja voltada para o lado oposto. Nos exemplares estudados neste trabalho, essa lateralidade do gonóporo ou abertura urogenital nas fêmeas não foi confirmada.
Quanto ao período reprodutivo, as duas espécies de tralhoto não apresentaram uma época definida, reproduzindo-se o ano todo, como foi observado por Novaes & Andreata (1996) em Jenynsia lineata. Apesar disso, ambas apresentaram picos reprodutivos em épocas distintas, A. anableps em janeiro, durante o inverno, e A. microlepis em outubro, durante a estiagem. A outra diferença observada foi quanto ao sincronismo reprodutivo entre machos e fêmeas. Na população de A. anableps, os picos reprodutivos dos machos se apresentaram de maneira inversa aos das fêmeas, levando a sugerir que nessa espécie ocorre uma nova cópula imediatamente após a fêmea liberar seus embriões. O contrário, porém, foi observado para A. microlepis: aqui, o pico reprodutivo dos machos coincidiu com o das fêmeas, indicando que uma nova cópula pode ocorrer ainda durante a gravidez, antes da liberação dos embriões. Este fato foi confirmado pela presença de embriões em diferentes fases de desenvolvimento nos ovários dessa espécie.
Diversos autores, como Novaes & Andreata (1996) e Thibault & Schultz (1978), têm demonstrado que o tamanho da fêmea determina a quantidade de embriões a ser produzida, ou seja, fêmeas com cavidade abdominal grande podem acomodar melhor uma grande quantidade de prole. Resultados semelhantes foram encontrados para a população de Anableps, em que as fêmeas maiores tinham maior quantidade de filhotes.
A maioria dos autores - Garman (1896); Grove & Wourms (1994); Turner (1938a; 1938b); Wyman (1854); Wourms (1981) - tem mencionado que A. anableps e A. microlepis apresentam gravidez folicular, com o embrião dependendo totalmente das reservas de nutriente materno. Os dados aqui obtidos conflitam com esses resultados: nas espécies mencionadas, quando os ovos atingiam de 1,0 a 1,5 mm de diâmetro, eram liberados da parede do ovário para a cavidade ovariana, onde ficaram livres; depois, a partir de 2,0 mm de diâmetro, voltaram a se aderir à parede do ovário. A partir destes resultados, sugere-se que, ao menos na fase inicial de desenvolvimento, o embrião do tralhoto se nutre de suas próprias reservas. Porém, é preciso esclarecer se o ovócito seria liberado junto com o folículo, depois de fecundado, ou então se ocorreria a ovulação e, nesse caso, ele seria fecundado dentro da cavidade ovariana. Assim, após esgotarem-se as reservas nutritivas, o ovo se prenderia à parede do ovário para receber os nutrientes maternos. Para esclarecer tal situação, seria necessário realizar cortes histológicos da parede ovariana e do ovo.
A alta variabilidade de alimento determina a quantidade de embriões que chegará à fase final de desenvolvimento (Kamler, 1992; Reznick et al., 1996; Ricklefs, 1996). Nos ovários de Anableps, foram encontrados ovos e embriões mortos, mumificados, semelhantes ao que foi registrado por Burns & Flores (1981) na espécie A. dowie por Thibault & Schultz (1978) em Poecilia vivipara. Isso, em princípio, poderia ser devido a uma eventual pobreza de alimentação, mas outros fatores, como senilidade, doenças etc., também podem estar envolvidos.
A viviparidade é uma estratégia reprodutiva em que os embriões se desenvolvem no interior do organismo materno, onde ficam protegidos (Baughman, 1947; Burns, 1991; Burns & Flores, 1981; Ghedotti, 1998; Knight et al., 1985; Miller, 1979; Nelson, 1994; Santos, 1987; Turner, 1938a; 1938b; Wourms, 1981), não sendo, portanto, afetados pelas condições adversas do ambiente, como temperatura, acidez, turbidez da água, salinidade, doenças e ataque de predadores (Nakatani et al., 2001; Vazzoler, 1996). Os embriões de tralhoto eclodem dentro do ovário, onde completam seu desenvolvimento, e somente nascem quando já completamente formados, aptos para explorar o meio aquático.
CONCLUSÃO
1 - No rio Paracauari, as duas populações de tralhoto ocorrem juntas em pequenos cardumes, predominando uma das espécies conforme a época do ano. A. microlepis predomina no verão, quando a água está salobra, e A. anableps, no inverno, quando a água está doce;
2 - A proporção sexual local foi de 1:1 para A. Anableps e de 2:1 para A. microlepis. A população de A. anableps parece estar em equilíbrio, enquanto a de A. microlepis, provavelmente, é parte de uma outra maior, localizada em águas mais salinas;
3 - Ambas as espécies se reproduzem o ano todo, tendo picos reprodutivos em períodos diferentes: A. microlepis no verão e A. anableps no inverno;
4 - As fêmeas não apresentam direcionamento na abertura urogenital;
5 - Depois da primeira reprodução, uma nova fertilização em Anableps ocorre em fêmeas com ovário recém esvaziado, enquanto que em A. microlepis pode ocorrer em fêmeas ainda grávidas;
6 - Nos primeiros estádios de desenvolvimento, o embrião não depende das reservas nutricionais da mãe, nutrindo-se, ao invés, das próprias reservas;
7 - Embora as duas espécies sejam simpátridas e morfologicamente muito semelhantes, apresentam diferenças significativas na estrutura de suas populações, na exploração de ambientes de diferente salinidade e na estratégia reprodutiva.
REFERÊNCIAS
AMAM, 1998. Um pólo ecoturístico da Amazônia: 1-70. Associação dos municípios do Arquipélago do Marajó, Belém.
ASSUNÇÃO, M. I. S. & R. B. BARTHEM, 2005. Ecologia reprodutiva de carataí (Pseudauchenipterus nodosus) na área de inundação de maré do rio Marapanim, PA: 229. Anais do XVI Encontro Brasileiro de Ictiologia, Ictiofauna Brasileira: estado atual de conhecimento, João Pessoa.
BARTHEM, R. B., 1985. Ocorrência, distribuição e biologia dos peixes da Baía de Marajó, Estuário Amazônico. Boletim do Museu Paraense Emílio Goeldi, série Zoologia 2(1): 49-69.
BARTHEM, R. B. & H. O. SCHWASSMANN, 1994. Amazon river influence on the seasonal displacement of the salt wedge in the Tocantins river estuary, Brazil, 1983-1985. Boletim do Museu Paraense Emílio Goeldi, série Zoologia 10(1): 119-130.
BAUGHMAN, J. L., 1947. An early mention of Anableps. Copeia 1947(3): 200.
BONE, Q., N. B. MARSHALL & J. H. S. BLAXTER, 1995. Biology of fishes: 1-332. Chapman & Hall, London.
BRENNER, M. & U. KRUMME, 2007. Tidal migration and patterns in feeding of the four-eyed fish Anableps anableps L. in a north Breazilian mangrove. Journal of fish biology 70: 406-427.
BURNS, J. R., 1991. Testis and gonopodium development in Anableps dowi (Pisces: Anablepidae) correlated with pituitary gonadotropic zone area. Journal of Morphology 210: 45-53.
BURNS, J. R. & J. FLORES, 1981. Reprodutive biology of the Cuatro Ojos, Anableps dowi (Pisces: Anablepidae), from El Salvador and its seasonal variations. Copeia 1981(1): 25-32.
CAMARGO, M. & V. ISAAC, 2001. Os peixes estuarinos da região Norte do Brasil: lista de espécies e considerações sobre sua distribuição geográfica. Museu Paraense Emílio Goeldi, série Zoologia 17(2): 133-156.
GARMAN, S., 1896. Cross fertilization and sexual rights and lefts among vertebrates. American Naturalist 30: 1-179.
GHEDOTTI, M. J., 1998. Phylogeny and classification of the Anablepidae (Teleostei: Cyprinodontiformes) Part. 6 - Atherinomorpha. In: L. R. MALABARBA, R. E. REIS, R. P. VARI, Z. M. S. LUCENA & C. A. S. LUCENA (Eds.): Phylogeny and classification of Neotropical fishes: 561-582. EDI-PUCRS, Porto Alegre.
GROVE, B. D. & J. P. WOURMS, 1994. Follicular placenta of the Viviparous fish, Heterandria formosa: 11 Ultrastructure and development of the follicular epithelium. Journal of Morphology 220: 167-184.
IKEDA, R. G. P., J. M. SILVA & S. C. S. MIRANDA, 2005. Morfologia do Tralhoto, Anableps anableps (Linnaeus, 1758), do estuário de Caratateua - Curuçá - Pará. Boletim técnico-científico do CEPNOR 5(1): 93-103.
KAMLER, E., 1992. Early life history of fish: an energetics approach: 1-267. Chapman & Hall (Fish and Fiseries, Series 4), London.
KNIGHT, F. M., J. LOMBARDI, J. P. WOURMS & J. R. BURNS, 1985. Follicular placenta and embryonic growth of the viviparous four-eyed fish (Anableps). Journal of Morphology 185: 131-142.
LOWE-MCCONNELL, R. H., 1987. Ecological studies in tropical fish communities: 1-382. Tropical Biology, Cambridge.
MEISNER, A. D. & J. R. BURNS, 1997. Testis andropodial development in a viviparous halfbeak, Dermogenys sp. (Teleostei: Anablepidae). Copeia 1997(1): 44-52.
MILLER, R. R., 1979. Ecology, habitats and relationships ofthe midlle American Cuatro ojos, Anablep dowi (Pisces: Anablepidae). Copeia 1979(1): 82-91.
NAKATANI, K., A. A. AGOSTINHO, G. BAUMGARTNER, A. BIALETZKI, P. V. SANCHES, M. C. MAKRAKIS & C. S. PAVANELLI, 2001. Ovos e larvas de peixes de água doce: desenvolvimento e manual de identificação: 1-378. DUEM, Maringá.
NASCIMENTO, F. L., L. F. A. MONTAG &. R. B. BARTHEM, 2004. Reprodução de tralhoto Anableps anableps (Linnaeus, 1758) e A. microleps Muller & Troschel, 1844 (Teleostei: Cyprinodontiformes) - Soure (PA): 337-337. XXIV Congresso Brasileiro de Zoologia, Itajaí.
NASCIMENTO, P. N., T. C. S. A. PIRES, I. N. F. F. SANTOS & A. C. M. LIMA, 1991. Répteis do Marajó e Mexiana, Pará, Brasil. I. Revisão bibliográfica e novos registros. Boletim do IMuseu Paraense Emílio Goeldi 7(1): 25-41.
NELSON, J. S., 1994. Fishes of the world: (3): 1-600. John Wiley and Sons, New York.
NOVAES, J. L. C. & J. V. ANDREATA, 1996. Aspectos reprodutivos de Jenynsia lineata Jenyns, 1842 (Osteichthyes, Anablepidae) da lagoa Rodrigo de Freitas, Rio de Janeiro. Acta Biológica Leopoldensia 13(2): 129-139.
PAPAVERO, N., D. M. TEIXEIRA, W. L. OVERAL & J. R. PUJOL, 2002. O Novo Éden: a fauna da Amazônia brasileira nos relatos de viajantes e cronistas desde a descoberta do rio Amazonas por Pizón (1500) até o tratado de Santo Idelfonso (1777): 1-429. Museu Paraense Emílio Goeldi, Belém.
PARENTI, L. R., 1981. A phylogenetic and Bioegeographic analysis of Cyprinodontiform fishes (Teleostei, Atherinomorpha). Bulletin of the American Museum of Natural History 168: 335-557.
REZNICK, D., H. CALLAHAN & R. LLAUREDO, 1996. Maternal effects on offspring quality in Poeciliid fishes. American Zoologist 36: 147-156.
RICKLEFS, R. E., 1996. A economia da natureza: 1-470. Guanabara Koogan, São Paulo.
SANTOS, E., 1987. Peixes de água doce: 1-267. Ed. Itatiaia, Belo Horizonte.
THIBAULT, R. E. & J. R. SCHULTZ, 1978. Reprodutive adaptations among viviparous fishes (Cyprinodontiformes: Poeciliidae). Evolution 32(2): 320-333.
TURNER, C. L., 1950. The skeletal structure of the gonopodium and gonopodial suspensorium of Anableps anableps. Journal of Morphology 86: 329-365.
TURNER, C. L., 1940. Follicular pseudoplacenta and gut modifications in a Anablepidae fishes. Journal of Morphology 67: 91-105.
TURNER, C. L., 1938a. Adaptations for viviparity in embryos and ovary of Anableps anableps. Journal of Morphology 62: 323-349.
TURNER, C. L., 1938b. Follicular pseudoplacenta and gut modifications in Anablepid fishes. Journal of Morphology 67: 91-105.
VAZZOLER, A. M., 1996. Biologia da reprodução de peixes teleósteos: teoria e prática: 1-169. EDUEM/CNPq/Nupelia, Maringá.
WOOTON, R. J., 1990. Ecology of Teleost fishes: 1-404. Chapman & Hall, London.
WOURMS, J. P., 1981. Viviparity: the maternal-fetal relationship in fishes. American Zoologist 21: 473-515.
WYMAN, J., 1854. Observation on the development of Anableps gronovii (Cuv. And Val.), a viviparous fish from Surinam. Journal of Natural History 6: 443.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Belém - PA - Brasil
Caixa Postal 399
Telefone: 55-91-3182-3246
Fax: 55-91-3249-6373
E-mail: boletim.naturais@museu-goeldi.br
Recebido: 17/12/2007
Aprovado: 20/12/2008













