Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versión impresa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.4 n.2 Belém ago. 2009
Distribuição temporal do mesozooplâncton no furo Muriá, Pará, Brasil
Temporal distribution of the mesozooplankton in the Muriá creek, Pará, Brazil
Natália da Rocha LeiteI; Luci Cajueiro Carneiro PereiraII; Rauquírio Marinho da CostaIII
IUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil (nr_leite@hotmail.com)
IIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Oceanografia Costeira e Estuarina. Bragança, Pará, Brasil (cajueiro@ufpa.br)
IIIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil (raucosta@ufpa.br)
RESUMO
As variações temporais da comunidade zooplanctônica e das variáveis físico-químicas da água do furo Muriá foram estudadas bimestralmente entre os meses de julho de 2003 (período seco) e janeiro de 2004 (período chuvoso). As coletas foram realizadas durante as marés vazantes de quadratura, no período diurno. As amostras foram obtidas por meio de arrastos horizontais, realizados com o auxílio de uma rede cónica de plancton com 200 µm de abertura de malha. Simultaneamente, foram obtidas medidas in situ de temperatura, salinidade e pH por intermédio de uma sonda multiparâmetros. Adicionalmente, foram coletadas amostras de água para determinação, em laboratório, das concentrações de oxigênio dissolvido e do material particulado em suspensão. Verificou-se uma acentuada variação temporal da salinidade, com valores mais elevados registrados no período seco. Foram identificados 67 grupos taxonómicos, sendo o filo Arthropoda o mais representativo, com destaque para o copépodo Acartia tonsa Dana, 1849, o qual apresentou densidades mais elevadas durante o período chuvoso (valores médios superiores a 1.200 ind.m-3). No período seco, zoea de Brachyura foi o grupo mais abundante, apresentando elevados valores de densidade. A salinidade da água, condicionada pela pluviometria, constituiu o principal fator responsável pelas variações temporais do zooplâncton do furo Muriá.
Palavras-chave: Zooplâncton. Estuário. Região amazônica.
ABSTRACT
The temporal variations of the zooplanktonic community and physical and chemical water parameters were studied bimonthly between July 2003 (dry period) and May 2004 (rainy period) in the Muriá creek. Zooplankton sampling was carried out at neap tides, in daytime, using conical plankton net with 200 µm mesh size. Simultaneously, temperature, salinity and pH were measured in situ through a multiparameter probe and water samples were collected to determine concentrations of dissolved oxygen and suspended particulate matter. It was verified a sharp temporal variation of salinity with higher values reported in the dry season. A total of 67 taxonomic groups was identified, being Arthropoda the most represented group, of which Acartia tonsa Dana, 1849 (Copepoda) had the highest densities (average values higher than 1,200 ind.m-3) recorded during the rainy period. In the dry period, Brachyura zoeae was the most abundant group presenting high density values. Water salinity influenced by rainfall, was the principal responsible for the temporal variations of the zooplankton community in Muriá creek.
Keywords: Zooplankton. Estuary. Amazon region.
INTRODUÇÃO
Os estuários estão entre os ecossistemas mais produtivos do mundo (Day Jr. et al., 1989). Esses ambientes apresentam variações hidrológicas, espaciais e temporais, tais como oscilações de temperatura, salinidade, transparência da água, nutrientes dissolvidos, entre outros, os quais são de fundamental importância na composição e distribuição da biota residente e transitória desses ecossistemas (Ré, 1999).
Nesses ambientes, encontram-se representantes de praticamente todos os filos do reino animal, com destaque para os organismos do zooplâncton, os quais possuem papel central na dinâmica dos ecossistemas aquáticos, especialmente na ciclagem de nutrientes e no fluxo de energia, como elo trófico entre o fitoplâncton e os outros organismos da rede alimentar do ecossistema aquático (Esteves, 1988). A comunidade zooplanctônica apresenta também grande sensibilidade às mudanças ambientais, o que a qualifica como excelente indicadora de distúrbios do ecossistema aquático.
Dentre os organismos zooplanctônicos, os copépodos constituem os principais componentes desta comunidade, embora outros organismos, tais como larvas de Polychaeta, Cladocera, larvas de Cirripedia e larvas de Decapoda, sejam também importantes componentes sazonais do zooplâncton estuarino (Raymont, 1983).
Trabalhos sobre a composição e biomassa do zooplâncton nos estuários da região Norte, principalmente aqueles situados no estado do Pará, são escassos (Krumme & Liang, 2004; Magalhães et al., 2006; Martins et al., 2006; Costa et al., 2008; Costa et al., 2009; Magalhães et al., 2009), o que demonstra a necessidade do desenvolvimento de estudos que venham a ampliar os conhecimentos acerca das comunidades estuarinas da região costeira amazônica.
O presente trabalho foi desenvolvido a fim de verificar a composição e a variação temporal da comunidade zooplanctônica e sua interação com as variáveis físico-químicas do furo Muriá.
MATERIAL E MÉTODOS
DESCRIÇÃO DA ÁREA
O furo Muriá localiza-se no estuário do rio Curuçá, município de Curuçá (nordeste paraense), este último com uma área de, aproximadamente, 673 km2. Limita-se ao norte com o oceano Atlântico, ao sul com o município de Terra Alta, a leste com o município de Marapanim e a oeste com o município de São Caetano de Odivelas. O acesso a Curuçá é feito através da rodovia PA-136, a partir do município de Castanhal, Pará (CCS, 2004).
Essa região, de clima equatorial, caracteriza-se por apresentar temperaturas médias de, aproximadamente, 27 oC, pequena amplitude térmica e precipitações abundantes que ultrapassam os 2.000 mm anuais, sendo os meses de janeiro a junho os mais chuvosos e os meses de julho a dezembro os menos chuvosos (CCS, 2004).
A altura máxima de maré possui um alcance de cerca de 4 m, podendo atingir valores superiores nas marés equinociais de sizígia. As fortes correntes atingem velocidades que variam de 1,9 a 2,1 nós, sendo as principais responsáveis pela presença dos inúmeros bancos de areia, os quais se dispõem perpendicularmente à costa (Mácola & El-Robrini, 2004).
A planície costeira do município de Curuçá apresenta ambientes transicionais altamente dinâmicos, resultantes das condições meteorológicas e oceanográficas da região (Mácola & El-Robrini, 2004).
A salinidade da região varia entre 7, durante o período chuvoso, e 39, no período seco. A vegetação das margens do estuário caracteriza-se pela dominância de florestas de mangue, nas quais se destacam Rhizophora mangle L. e Avicennia germinans (L.) L., sendo parcialmente inundada nas marés altas (Giarrizzo & Krumme, 2007).
METODOLOGIA DE CAMPO
A área de amostragem foi dividida em quatro estações de coleta, denominadas, respectivamente, M1, M2, M3 e M4 (Figura 1).
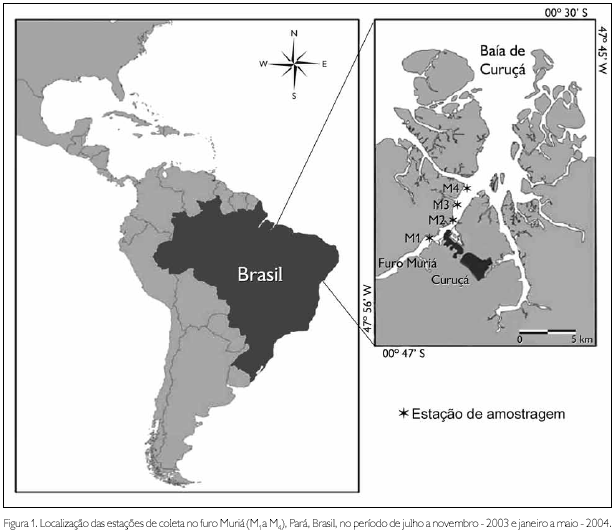
As amostras de zooplâncton foram coletadas bimestralmente entre julho e novembro de 2003 (período seco) e janeiro e maio de 2004 (período chuvoso), durante as marés vazantes de quadratura, no período diurno. Cada amostra foi obtida por meio de arrastos sub-superficiais com duração de três minutos, sendo utilizada uma rede de plâncton cônica com 60 cm de abertura de boca, 200 µm de malha e 2 m de comprimento. O volume filtrado pela rede foi estimado por intermédio de um fluxômetro mecânico, fixado à região central da boca da rede. Após as coletas, o materia foi acondicionado em frascos de 500 ml devidamente etiquetados, contendo formalina 4%, neutralizada com tetraborato de sódio (Bórax).
Medidas de temperatura, salinidade e pH foram tomadas in situ por meio de uma sonda multiparâmetros. Para o cálculo do oxigênio dissolvido (OD) e material particulado em suspensão (MPS), foram coletados 300 ml de água, analisados em laboratório segundo a metodologia de Strickland & Parsons (1972), descrita por Baumgarten et al. (1996). Dados de precipitação pluviométrica foram obtidos da estação meteorológica de Curuçá, Pará (00o 44' 15" S e 47o 51' 12" W), e fornecidos pela Agência Nacional de Águas (ANA, 2006).
METODOLOGIA DE LABORATÓRIO
No laboratório, as amostras foram aliquotadas em um subamostrador e, posteriormente, triadas, identificadas ao menor nível taxonômico possível e contadas, utilizando-se lupa estereoscópica e microscópio óptico.
Os organismos zooplanctônicos foram identificados segundo a literatura básica para o Atlântico Sul (Boltovskoy, 1981, 1999) e outras referências específicas (Rose, 1933; Trégouboff & Rose, 1957).
Os dados quantitativos de cada amostra foram utilizados para calcular a densidade absoluta (ind. m-3) e relativa, bem como os índices ecológicos de diversidade específica, por meio da equação de Shannon-Wiener (Shannon, 1948), e equitabilidade (Pielou, 1969).
Em função dos valores de densidade relativa, foram consideradas espécies abundantes apenas as que apresentaram valores acima de 5% em qualquer uma das amostras analisadas.
Nos cálculos de densidade absoluta, em virtude do grande número de taxa registrado, foram considerados 'outros' todos os organismos identificados, excluindo-se o grupo dos Copepoda. Para determinação da densidade relativa, foram considerados 'outros' todas as espécies/grupos que apresentaram valores abaixo de 5%.
ANÁLISES ESTATÍSTICAS
A partir dos resultados obtidos, foram determinadas a normalidade e homogeneidade dos dados segundo os testes de Lilliefors (Conover, 1971) e Bartlett (Sokal & Rohlf, 1995), respectivamente. Quando necessário, os dados foram transformados (log x+1) para se obter distribuições próximas da normalidade. Sendo observados estes pressupostos, a análise de variância (ANOVA - fator único) foi utilizada para testar as possíveis diferenças nos parâmetros hidrológicos e biológicos entre os diferentes meses de coleta e entre os períodos sazonais, seguida pelo teste post-hoc Least Significant Difference (LSD) de Fisher (p < 0,05). Entretanto, quando as variâncias foram heterogêneas, os testes não paramétricos de Kruskal-Wallis e MannWhitney foram aplicados. As correlações entre os fatores físico-químicos e biológicos foram testadas com o auxílio do coeficiente de correlação de Spearman. Todas as análises foram realizadas adotando-se o pacote estatístico Statistica 6.0.
Para a análise da similaridade entre as amostras, utilizou-se a transformação log (x+1), para a construção da matriz de similaridade de Bray & Curtis (1957), sendo o dendrograma obtido baseado no método Weighted Pairs Group Method Average Arithmethics (WPGMA). Os agrupamentos foram posteriormente confirmados pela análise de Similaridade de Percentagem (SIMPER), o que permitiu indicar os táxons que mais contribuíram para a formação dos grupos. As análises de agrupamento foram realizadas com o auxílio do programa estatístico Plymouth Routines Multivariate Ecological Research (PRIMER), versão 6.1.6, de acordo com Clarke & Warwick (1994).
RESULTADOS
PRECIPITAÇÃO PLUVIOMÉTRICA E CARACTERIZAÇÃO DAS VARIÁVEIS FISICOQUÍMICAS
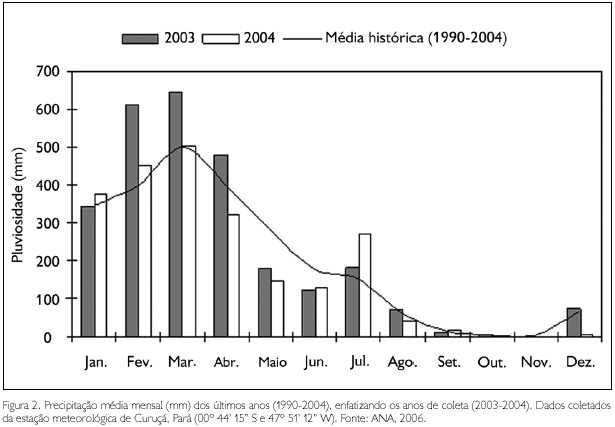
A média dos valores pluviométricos obtidos entre os anos de 1990 e 2004 variou entre 1,95 mm (outubro) e 499,18 mm (março). Durante o período de estudo, foram observados valores acima da média nos meses de janeiro e março - 2004 e julho - 2003, e abaixo da média no mês de setembro - 2003. Em novembro - 2003, não houve registro de chuvas. Os meses de julho, setembro e novembro - 2003 apresentaram baixos valores em comparação aos observados durante o período chuvoso, o que permitiu caracterizá-los como pertencentes à estação seca, enquanto que os meses de janeiro, março e maio - 2004 foram incluídos na estação chuvosa, devido aos elevados valores de pluviosidade (Figura 2).
No presente estudo, os dados bióticos e abióticos não apresentaram diferenças espaciais significativas (F = 0,05; p > 0,05). Dessa forma, os valores obtidos em cada mês foram agrupados (médias) e analisados em escala mensal e sazonal (períodos seco/chuvoso).
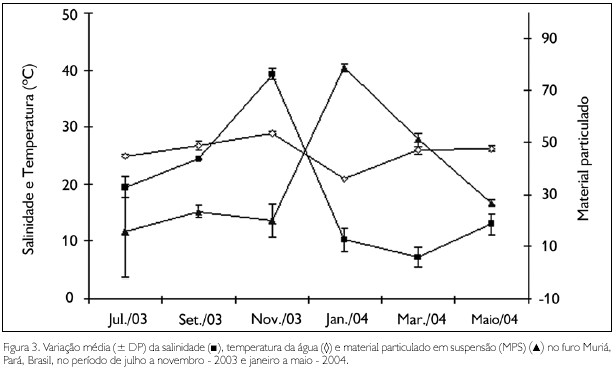
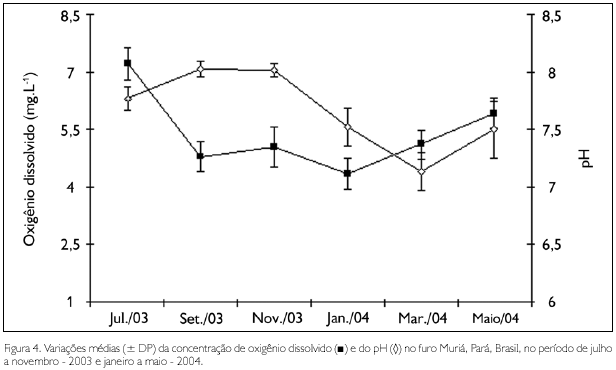
Dentre os fatores ambientais, apenas as concentrações de oxigênio dissolvido não apresentaram diferenças significativas entre os períodos sazonais, enquanto que a temperatura e o pH apresentaram valores significativamente mais elevados (F = 7,58, p < 0,01; F = 42,9, p < 0,01, respectivamente) durante o período seco. Para a salinidade (U = 0,00, p < 0,01) e as concentrações de material particulado em suspensão (MPS) (U = 3,00, p < 0,01), foram observados valores significativamente mais elevados nos períodos seco e chuvoso, respectivamente.
Durante os meses de coleta, os valores médios de temperatura variaram entre 20,9 oC em janeiro - 2004 (período chuvoso) e 29 oC em novembro - 2003 (período seco), com valores significativamente mais baixos (F = 146,97; p < 0,01) no mês de janeiro. A salinidade oscilou entre 7,2 (março - 2004) e 39,2 (novembro - 2003), com valores significativamente mais elevados (H = 22,25; p < 0,01) nos meses de menor precipitação. As concentrações de MPS variaram entre 15,9 mg.L-1 (julho - 2003) e 78,9 mg.L-1 (janeiro - 2004). O pH apresentou valores que oscilaram entre 7,1, no mês de março - 2004, e 8,02, em setembro - 2003 e novembro - 2003. As concentrações de oxigênio dissolvido na água variaram de 4,35 mg.L-1 (janeiro - 2004) a 7,19 mg.L-1 (julho - 2003), apresentando valores significativamente mais elevados (F = 23,36; p < 0,01) nos meses de maio e julho (Figuras 3 e 4).
COMPOSIÇÃO TAXONÔMICA
Devido às elevadas concentrações de material particulado em suspensão, foram observados, em função da colmatação da rede, grupos pertencentes ao microzooplâncton, tais como Tintinnoinea, nauplius de Cirripedia e nauplius de Copepoda.
Foi registrado um total de 67 grupos/táxons para todo o período de estudo, dos quais 64 ocorreram no período seco e 48 no período chuvoso, sendo o zooplâncton representado por 11 filos no total: Sarcomastigophora, Ciliophora, Cnidaria, Ctenophora, Bryozoa, Annelida, Mollusca, Arthropoda, Echinodermata, Chaetognatha e Chordata.
Em ambos os períodos, o filo Arthropoda foi o mais representativo, com 38 grupos/espécies registrados no período seco e 29 no período chuvoso, sendo a classe Copepoda a que apresentou o maior número de taxa, com 28 espécies no período seco e 19 no período chuvoso. As principais famílias registradas durante o período de estudo foram: Acartiidae, Paracalanidae, Pseudodiaptomidae, Pontellidae, Oithonidae, Corycaeidae e Temoriidae (Tabela 1).

DENSIDADE ZOOPLANCTÔNICA
Os valores de densidade total não apresentaram diferenças significativas entre os períodos sazonais, apresentando valor médio mínimo de 1.699,88 ind.m-3, no mês de novembro - 2003 (período seco), e máximo de 2.811,95 ind.m-3, no mês de março - 2004 (período chuvoso). A densidade do grupo Copepoda oscilou entre 629,93 ind.m-3, no mês de novembro - 2003 (período seco), e 1.524,85 ind.m-3, no mês de maio - 2004 (período chuvoso). Os outros grupos zooplanctônicos oscilaram entre 374,11 ind.m-3, em janeiro - 2004, e 1.434,55 ind.m-3, no mês de julho - 2003 (Figura 5).
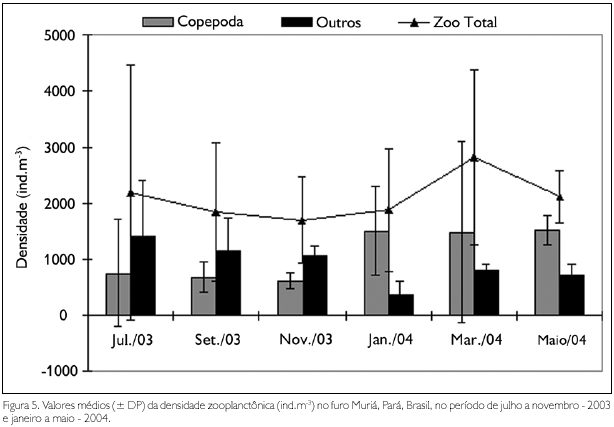
Com base na densidade de Acartia tonsa Dana, 1849, foi possível observar diferenças significativas em ambas as análises (sazonal e mensal), com valores significativamente mais elevados (F = 25,08; p < 0,01) durante o período chuvoso, bem como nos meses de janeiro e maio (F = 6,39; p < 0,01). Com relação à densidade de Acartia lilljeborgii Giesbrecht, 1889, foram observados valores significativamente mais elevados (U = 33; p < 0,05) no período seco.
Os valores médios de densidade de zoea de Brachyura variaram entre 72,23 ind.m-3 e 412,25 ind.m-3, apresentando diferenças significativas em ambas as análises, com valores mais elevados (U = 32; p < 0,05) no período seco, nos meses de julho e setembro (H = 12,22; p < 0,05). A densidade do grupo Cirripedia (nauplius) não apresentou diferenças significativas mensais ou sazonais.
DENSIDADE RELATIVA
Nauplius de Cirripedia (1,16% em novembro e 31,9% em julho), Acartia tonsa (9,08% em novembro e 68,34% no mês de maio), Acartia lilljeborgii (1,95% em março e 7,74% em novembro) e zoea de Brachyura (3,44% em março e 19,76% em setembro) foram os grupos/taxa que apresentaram densidade relativa acima de 5% (Figura 6). Subeucalanus pileatus (Giesbrecht, 1888), Pseudodiaptomus sp., Euterpina acutifrons (Dana, 1847), Euphasiaceae e Oikopleura dioica (Fol, 1872), embora presentes, representaram menos de 5% do zooplâncton total.
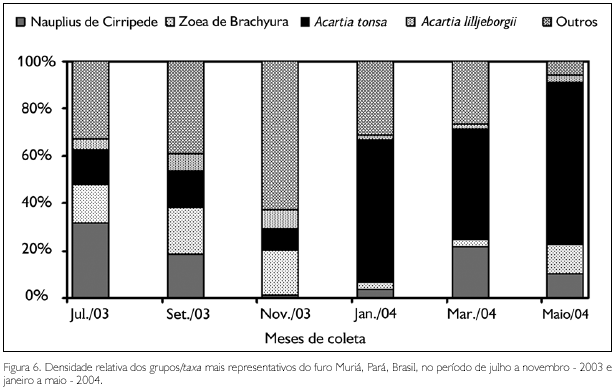
FREQUÊNCIA DE OCORRÊNCIA
A espécie Acartia tonsa ocorreu em 100% das amostras coletadas no período chuvoso, seguida por nauplius de Cirripedia, que foi registrada em 91,67% das amostras neste mesmo período, enquanto que no período seco os grupos/taxa que ocorreram com 100% de frequência foram: Hidromedusae, A. tonsa, A. lilljeborgii, Subeucalanus pileatus, Pseudodiaptomus sp., Euterpina acutifrons, Euphasiaceae, Oikopleura dioica, Bivalvia (larva), Cirripedia (nauplius), Decapoda (larvas) e zoea de Brachyura, seguidos por Paracalanus quasimodo Bowman, 1971, chaetosfera de Polychaeta e larva de Peneidae (91,66%).
DIVERSIDADE ESPECíFICA E EQUITABILIDADE
A diversidade específica (H') variou entre 0,49 bits.ind-1, no mês de maio, e 2,88 bits.ind-1, em novembro, enquanto que a equitabilidade (J) oscilou entre 0,17 e 0,77, também nos meses de maio e novembro, respectivamente (Figura 7), estando os menores valores associados à dominância de Acartia tonsa.
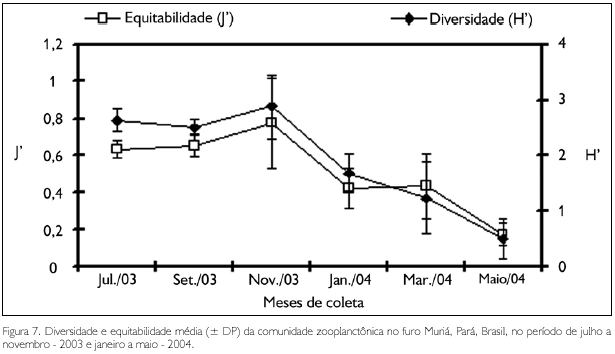
Foram observados valores de diversidade específica e equitabilidade, significativamente mais elevados (U = 3, p < 0,01; F = 28,45, p < 0,01, respectivamente) no período seco, bem como nos meses de maio e novembro (H = 18,62; p < 0,05).
ASSOCIAÇÃO DAS AMOSTRAS
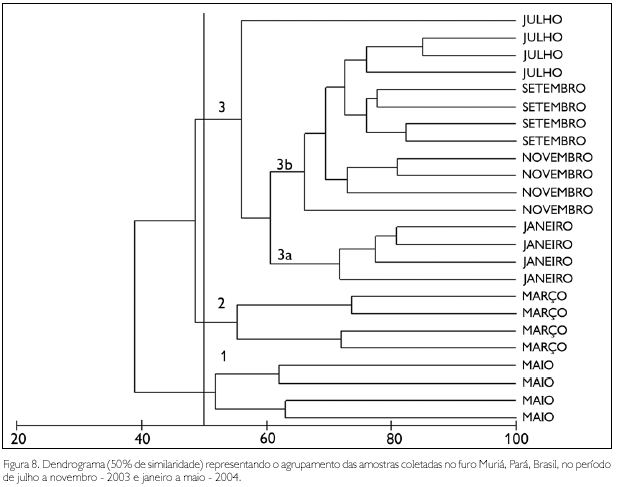
A análise de agrupamento, baseada na densidade das amostras, resultou na formação de três grupos, os quais estiveram relacionados aos diferentes períodos sazonais. O primeiro grupo incluiu amostras do mês de maio (período chuvoso), com as maiores densidades de Acartia tonsa. No segundo grupo, reuniram-se as amostras do mês de março (período chuvoso), com maiores densidades de nauplius de Cirripedia. O terceiro grupo foi dividido em dois subgrupos: 3a, constituído por amostras do período chuvoso (janeiro), quando se observou um elevado número de grupos taxonômicos (28 a 44), com destaque para A. tonsa, que apresentou os maiores valores de densidade; e 3b, compreendendo amostras de todo período seco, quando foram observadas elevadas densidades de zoea de Brachyura.
A formação dos três grupos foi confirmada pela análise de SIMPER, sendo Acartia tonsa e nauplius de Cirripedia os grupos que apresentaram maior contribuição no período chuvoso (68,7% e 15,95%, respectivamente), enquanto que zoea de Brachyura apresentou maior contribuição no período seco (26,03%) (Figura 8).
CORRELAÇÃO ENTRE VARIÁVEIS BIÓTICAS E ABIÓTICAS
As correlações da salinidade, temperatura e pH foram positivas e significativas (p < 0,01) entre si, estando estes parâmetros inversamente correlacionados com MPS (p < 0,01) e com as densidades de Acartia tonsa (p < 0,05).
DISCUSSÃO
A precipitação pluviométrica é um dos mais importantes fatores que influenciam a dinâmica populacional da comunidade zooplanctônica nas regiões tropicais. No estado do Pará, é bastante evidente a caracterização de dois períodos climáticos (uma estação chuvosa que, na maioria das localidades do estado, tem início no mês de dezembro, e uma estação não-chuvosa ou estação seca, com início no mês de junho), apresentando particularidades em algumas regiões, como a zona bragantina, na qual se observa início tardio da estação chuvosa (Moraes et al., 2005). Estes padrões foram observados no município de Curuçá, o qual apresentou o início da estação chuvosa em janeiro e o da estação seca em agosto.
A salinidade é um dos fatores que mais influenciam a sobrevivência e a distribuição dos organismos estuarinos (Nybakken & Bertness, 2005), sendo este parâmetro fortemente relacionado às oscilações da chuva em ecossistemas estuarinos tropicais do Brasil e do mundo (Magalhães et al., 2006; Lam-Hoai et al., 2006). No furo Muriá, as variações de salinidade apresentaram valores médios fortemente influenciados pelos índices pluviométricos.
Embora os valores de temperatura tenham sido significativamente diferentes entre os períodos sazonais e entre os meses de coleta, estas oscilações apresentaram pequena variação durante o período estudado. De acordo com Green (1968), em zonas estuarinas tropicais, as diferenças na temperatura são de pequena magnitude. Os resultados obtidos estiveram associados ao aumento da insolação total e à redução da precipitação pluviométrica durante o período seco, os quais favorecem o aquecimento da coluna d'água (Bastos et al., 2005).
O pH apresentou pequena variação durante o período de estudo, mantendo caráter alcalino ao longo dos meses de amostragem. Esta característica é frequentemente observada nos ambientes costeiros e estuarinos, locais caracterizados por apresentarem alta produtividade biológica primária, o que proporciona o maior consumo de CO2 e, consequentemente, o aumento do pH da água (Branco et al., 2002; Bastos et al., 2005), sendo esta característica comumente observada na costa norte brasileira (Martinelli et al., 2002).
As famílias pertencentes ao grupo Copepoda, tais como Oithonidae, Paracalanidae e Acartiidae, foram frequentes no furo Muriá, fato observado em estuários da região nordeste do Brasil (Neumann Leitão et al., 1992). Por outro lado, as famílias Temoridae, Pontellidae e Pseudodiaptomidae, embora pouco frequentes, também foram registradas, sendo esta última a mais representativa, com maior número de espécies tipicamente estuarinas (Walter, 1986) (Pseudodiaptomus sp., P. marshi Wright, 1936, P. acutus (Dahl F., 1894) P. richardi (Dahl F., 1894), seguido pela família Corycaeidae (Corycaeus speciosus Dana, 1849, C. lautus Brady, 1883, C. latus Dana, 1849 e Corycaeus sp.), a qual esteve representada por espécies oceânicas). De acordo com Froneman (2004), os gêneros Pseudodiaptomus e Acartia, em zonas estuarinas, dominam a comunidade zooplanctônica em termos de densidade e biomassa.
Os efeitos sazonais dos parâmetros ambientais interferiram sobremaneira na composição taxonómica do zooplâncton local. Registrou-se número mais elevado de espécies durante o período seco, embora os valores de densidade tenham sido maiores no período chuvoso, devido, provavelmente, ao aumento da disponibilidade de material particulado em suspensão e nutrientes decorrentes da lavagem das planícies de inundação, como observado por Osore et al. (2004).
Os elevados valores de densidade absoluta de nauplius de Cirripedia nos meses referentes ao período chuvoso podem estar relacionados ao período reprodutivo do grupo, como registrado por outros autores na região nordeste do Brasil (Nascimento-Vieira et al., 1988).
No período seco, registrou-se aumento na densidade de larvas de Brachyura, o mesmo observado por Osore et al. (2004) no canal Mida, no Kênia. Segundo Li et al. (2006), as larvas de Brachyura e Cirripedia são grupos importantes na composição faunística dos estuários. Os crustáceos, de modo geral, possuem a determinação do período reprodutivo ligada a uma interação de fatores, como as flutuações de temperatura, salinidade, disponibilidade alimentar, fotoperíodo, precipitação, ciclo de marés, latitude, zonação intertidal, entre outros (Emmerson, 1994). Em estudos realizados no furo do Meio, no estuário do rio Caeté (Bragança, Pará), as larvas de Ucides cordatus (Linnaeus, 1763) apresentam seu período reprodutivo durante a época chuvosa, entre os meses de janeiro e junho (Diele, 2000). A grande abundância de larvas de Brachyura durante o período seco pode, portanto, estar relacionada ao período reprodutivo de outras espécies de Brachyura, como as pertencentes ao gênero Uca, tais como U. rapax (Smith, 1870), U. lactea Mjoebergi Rathbun, 1924 e U. uruguayensis (Traver) Domínguez, 1991, que se reproduzem nos meses mais quentes do ano (Castiglioni & Negreiros-Fransozo, 2006).
Dentre os Copepoda, grupo mais representativo verificado em todas as estações de coleta, observou-se aumento da densidade durante o período chuvoso, sendo o mesmo observado por Silva et al. (2003) nos estuários dos rios Botafogo, Igarassú e no canal de Santa Cruz; e Vieira et al. (2003), em estudos realizados no estuário Mondego, em Portugal. Essa classe possui representantes em todos os ambientes aquáticos, sendo um dos grupos zooplanctônicos mais ricos e mais conhecidos taxonomicamente (Bradford-Grieve et al., 1999; Berasategui et al., 2006). No furo Muriá, esse grupo esteve representado por 23 espécies, das quais a mais representativa em termos de densidade foi Acartia tonsa.
Acartia tonsa foi registrada em ambos os períodos sazonais, com elevados valores de densidade nos meses que compreendem o período chuvoso, quando a salinidade atingiu valores reduzidos e as águas do estuário adquiriram características mesohalinas, de acordo com o sistema de Veneza (Mouny & Dauvin, 2002). Fato semelhante foi registrado por Osore et al. (2004) em estudos realizados no canal Mida, no Kênia, onde foram registrados picos de densidade de A. tonsa (1.183 ind. m-3) durante a estação chuvosa. Estudos recentes verificaram que esta espécie possui uma ampla tolerância às variações de salinidade e às concentrações de oxigênio dissolvido, estando altamente adaptada a elevadas concentrações de alimento (Hubareva et al., 2008; Chinnery & Williams, 2004).
Segundo Sullivan et al. (2007), A. tonsa é uma espécie típica de águas quentes, embora Bjõrnberg (1981) limite sua ocorrência a águas costeiras frias e temperadas do sul do Brasil, Uruguai e Argentina. Acartia tonsa tem sido também comumente observada em águas estuarinas e costeiras da região Norte do Brasil, sendo sua ocorrência registrada por Costa et al. (2008), em estudo no estuário do Taperaçu, município de Bragança, Pará, bem como por Krumme & Liang (2004), em um canal de maré no nordeste paraense.
Acartia lilljeborgii apresentou densidades mais elevadas nos meses pertencentes à estação seca, ao contrário do observado por Silva et al. (2003), que registraram picos de densidade no período chuvoso. Esta espécie vem sendo registrada para várias regiões do Brasil (Ara, 2004; Silva et al., 2003) e do mundo (Morales-Ramírez & Brugnoli-Oliveira, 2001) como uma espécie tipicamente estuarina de áreas de manguezais.
Os valores de diversidade registrados no furo Muriá foram mais elevados durante o período seco, tal como registrado para outros estuários da região nordeste do Brasil (Silva et al., 2003). Os altos valores de diversidade estiveram relacionados aos maiores valores de salinidade, indicando o forte papel deste parâmetro sobre a distribuição do zooplâncton e sugerindo a ocorrência de espécies eurihalinas.
Por meio da análise de Cluster, foi possível observar que o agrupamento das amostras esteve relacionado aos diferentes períodos sazonais, fato evidenciado pela análise de SIMPER, que confirmou a sazonalidade das espécies de acordo com as condições hidrográficas do local de estudo, principalmente quanto às variações de salinidade.
Nas análises de correlação, foram registradas correlações positivas e significativas em relação à densidade de A. lilljeborgii e salinidade, sendo observada a preferência desta espécie por águas salinas; as correlações entre zoea de Brachyura e salinidade demonstraram a preferência das espécies deste grupo por meses mais quentes. Para A. tonsa, verificaram-se correlações significativas, porém negativas, evidenciando a predominância desta espécie durante o período chuvoso.
CONCLUSÃO
De acordo com os resultados obtidos, foi possível observar que a salinidade, que variou em função das oscilações dos índices pluviométricos, constituiu o principal fator regulador da composição e da distribuição temporal da comunidade zooplanctônica do furo Muriá, sendo Acartia tonsa e zoea de Brachyura os organismos com os maiores percentuais de contribuição nos períodos chuvoso e seco, respectivamente.
AGRADECIMENTOS
Este estudo foi financiado pelos projetos Milênio RECOS (#23116.000272/2002-88), CT-Agro/CNPq (# 552760/05-6), Programa Taxonomia/CNPq (# 563967/05-6) e CT-Hidro Casadinho (# 552126/05-5). A primeira autora agradece ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão da bolsa de Desenvolvimento Tecnológico e Industrial (DTI) utilizada durante o curso de Mestrado. Os autores L. C. C. Pereira e R. M. Costa agradecem ao CNPq pelas bolsas de Produtividade em Pesquisa concedidas aos mesmos (# 304392/2005-7, # 308953/2006-1, respectivamente).
REFERÊNCIAS
ANA, 2006. Agência Nacional de Águas. Climatological data (19902004). Agência Nacional de Águas, Brasília.
ARA, K., 2004. Temporal variability and production ofthe planktonic copepod community in the Cananéia Lagoon estuarine system, São Paulo, Brazil. Zoological Studies 2(43): 179-186.
BASTOS, R. B., F. A. N. FEITOSA & K. MUNIZ, 2005. Variabilidade espaço-temporal da biomassa fitoplanctônica e hidrologia no estuário do Rio Una (Pernambuco - Brasil). Tropical Oceanography 33(1): 1-18.
BAUMGARTEN, M. G. Z., J. M. B. ROCHA & L. F. H. NIENCHESKI, 1996. Manual de análises em oceanografia química: 1-115. Editora da FURG, Rio Grande.
BERASATEGUI, A. D., S. MENU MARQUE, M. GÓMEZ-ERACHE, F. C. RAMÍREZ, H. W. MIANZAN & E. M. ACHA, 2006. Copepod assemblages in a highly complex hydrographic region. Estuarine, Coastal and Shelf Science 66: 483-492.
BJÕRNBERG, T. K. S., 1981. Copepoda. In: D. BOLTOVSKOY (Ed.): Atlas del zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino: 587-679. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata.
BOLTOVSKOY, D., 1981. Atlas del zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino: 1-935. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata.
BOLTOVSKOY, D., 1999. South Atlantic Zooplancton: 2: 1-1705. Backhuys Publishers, The Netherlands, Leiden.
BRADFORD-GRIEVE, J. M., E. L. MARKHASEVA, C. E. F. ROCHA & B. ABIAHY, 1999. Copepoda. In: D. BOLTOVSKOY (Ed.): South Atlantic zooplankton: 869-1098. Backhuys Publishers, The Netherlands, Leiden.
BRANCO, E. S., F. A. N. FEITOSA & M. J. FLORES MONTE, 2002. Variação sazonal e espacial da biomassa fitoplanctônica relacionada com parâmetros hidrológicos no estuário de Barra das Jangadas (Jaboatão dos Guararapes - Pernambuco - Brasil). Tropical Oceanography 30(2): 79-96.
BRAY, J. R. & J. T. CURTIS, 1957. An ordination of the upland forest communities of southern Wisconsin. Ecologie Mangrove 27: 325-349.
CASTIGLIONI, D. S. & M. L. NEGREIROS-FRANSOZO, 2006. Ciclo reprodutivo do caranguejo violinista Uca rapax (Smith) (Crustacea, Brachyura, Ocypodoidea), habitante de um estuário degradado em Paraty, Rio de Janeiro, Brasil. Revista Brasileira de Zoologia 23(2): 331-339.
CCS, 2004. Coordenadoria de Comunicação Social do Governo. Disponível em: <http://www.governodopara.pa.gov.br/conhecaopara/curuca1.asp>. Acesso em: 10 maio 2004.
CHINNERY, F. E. & J. A. WILLIAMS, 2004. The influence oftemperature and salinity on Acartia (Copepoda: Calanoida) nauplii survival. Marine Biology 145(4): 733-738.
CLARKE, K. R. & R. M. WARWICK, 1994. Change in marine communities: an approach to statistical analysis and interpretation: 1-144. Plymouth Marine Laboratory, Plymouth.
CONOVER, W. O. J., 1971. Practical nonparametric statistics: 1-302. John Wiley, New York.
COSTA, K. G., L. C. C. PEREIRA & R. M. COSTA, 2008. Short and long-term temporal variation of the zooplankton in a tropical estuary (Amazon region, Brazil). Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 3(2): 127-141.
COSTA, R. M., N. R. LEITE & L. C. C. PEREIRA, 2009. Mesozooplankton of the Curuçá Estuary (Amazon Coast, Brazil). Journal of Coastal Research 56(1): 400-404.
DAY JR., J. W., C. A. J. HALL, W. M. KEMP & A. YÁÑEZ-ARANCIBIA, 1989. Estuarine Ecology: 1-556. Willey-Interscience, New York.
DIELE, K., 2000. Life history and population structure of the exploited mangrove crab Ucides cordatus cordatus (Linnaeus, 1763) (Decapoda: Brachyura) in the Caeté estuary, North Brazil: 1-104. Zentrum für Marine Tropenökologie (Contribution 9), Bremen.
EMMERSON, W. D., 1994. Seasonal breeding cycles and sex ratios of eight species of crabs from Magazana, a mangrove estuary in Transkei, South Africa. Journal of Crustacean Biology 3(14): 568-578.
ESTEVES, F. A., 1988. Fundamentos de Limnologia: 1-575. Interciência, Rio de Janeiro.
FRONEMAN, P. W., 2004. Zooplankton Community structure and biomass in a southern African Temporarily open/closed estuary. Estuarine, Costal and Shelf Science 60(1): 125-132.
GIARRIZZO, T. & U. KRUMME, 2007. Spatial differences and seasonal cyclicity in the intertidal fish fauna from four mangrove creeks in a salinity zone ofthe Curuçá Estuary, North Brazil. Bulletin of Marine Science 3(80): 739-754.
GREEN, J., 1968. The biology of estuarine animals: 1-452. Sidwick & Jackson, London.
HUBAREVA, E., L. SVETLICHNY, A. KIDEYS & M. ISINIBILIR, 2008. Fate of the Black Sea Acartia clausi and Acartia tonsa (Copepoda) penetrating into the Marmara Sea through the Bosphorus. Estuarine, Coastal and Shelf Science 76(1): 131-140.
KRUMME, U. & T. H. LIANG, 2004. Tidal-induced changes in a copepod-dominated zooplankton community in a macrotidal mangrove channel in Northern Brazil. Zoological Studies 43(2): 404-414.
LAM-HOAI, T., D. GUIRAL & C. ROUGIER, 2006. Seasonal change of community structure and size spectra of zooplankton in the Kaw River estuary (French Guiana). Estuarine, Coastal and Shelf Science 68: 47-61.
LI, K. Z., J. Q. YIN, L. M. HUANG & Y. H. TAN, 2006. Spatial and temporal variations of mesozooplankton in the Pearl River estuary, China. Estuarine, Coastal and Shelf Science 67: 543-552.
MÁCOLA, G. & M. EL-ROBRINI, 2004. Ilha dos Guarás (Mariteua) - Município de Curuçá (NE do Pará): aspectos físicos, meteorológicos e oceanográficos. Companhia Docas do Pará - CDP (Relatório Final - Cartografia, Hidrografia e Digitalização - CHD & Grupo de Estudos Marinhos e Costeiros - GEMC), Belém.
MAGALHÃES, A. L. P., R. M. COSTA, T. H. LIANG, L. C. C. PEREIRA & M. J. S. RIBEIRO, 2006. Spatial and temporal distribution in density and biomass of two Pseudodiaptomus species (Copepoda: Calanoida) in the Caeté river estuary (Amazon region - North of Brazil). Brazilian Journal of Biology 66: 421-430.
MAGALHÃES, A., N. R. LEITE, J. G. S. SILVA, L. C. C. PEREIRA & R. M. COSTA, 2009. Seasonal variation in the copepod community structure from a tropical Amazon estuary, Northern Brazil. Anais da Academia Brasileira de Ciências 81(2): 187-197.
MARTINELLI, J. M., T. GIARRIZZO, J. ESTÁCIO, T. C. B. ALMEIDA, T. DITTMAR & V. J. ISAAC, 2002. Distribuição espacial do macrozooplâncton marinho na região costeira maranhense e paraense. Anais do IV Workshop ECOLAB - Ecossistemas Costeiros Amazônicos do Conhecimento à Gestão. CD ROM.
MARTINS, A. A. V., R. M. COSTA & L. C. C. PEREIRA, 2006. Distribuição espaço-temporal da comunidade zooplanctônica de uma lagoa costeira artificial na região amazônica, Bragança, Pará, Brasil. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 1(3): 103-111.
MORAES, B. C., J. M. N. COSTA, A. C. L. COSTA & M. H. COSTA, 2005. Variação espacial e temporal da precipitação no estado do Pará. Acta Amazonica 35(2): 207-214.
MORALES-RAMÍREZ, A. & E. BRUGNOLI-OLIVEIRA, 2001. El Niño 1997-1998 impact on the plankton dynamics in the Gulf of Nicoya, Pacific coast of Costa Rica. Revista de Biologia Tropical 49(2): 103-114.
MOUNY, P & J. C. DAUVIN, 2002. Environmental control of mesozooplankton community structure in Seine estuary (English Channel). Oceanologica Acta 25(1): 13-22.
NASCIMENTO-VIEIRA, D. A., F. A. FEITOSA & J. Z. O. PASSAVANTE, 1988. Composição do zooplâncton da Bacia do Pina - Recife, PE. Resumos do 3o Encontro Brasileiro de Plancton 19.
NEUMANN LEITÃO, S., L. M. O. GUSMÃO & D. A. NASCIMENTO VIEIRA, 1992. Zooplankton ofthe estuaries ofthe rivers Massangana and Tatuoca, Suape (PE, Brazil). Arquivos de Biologia e Tecnologia 35(2): 341-360.
NYBAKKEN, W. J. & M. BERTNESS, 2005. Estuaries and Salt Marshes. In: C. BRIDGES (Org.): Marine Biology: an ecological approach: 361-407. Benjamin Cummings, San Francisco.
OSORE, M. K. W., J. M. MWALUMA, F. FIERS & M. H. DARO, 2004. Zooplankton composition and abundance in Mida Creek, Kenya. Zoological Studies 43(2): 415-424.
PIELOU, E. C., 1969. An introduction to mathematical ecology: 1-286. Willey-Interscience, New York.
RAYMONT, J. E. G., 1983. Plankton and productivity in the oceans - Zooplankton: (2): 2. Pergamon Press, New York.
RÉ, P., 1999. Biologia Marinha: 1-98. Associação dos Estudantes da Faculdade de Ciências de Lisboa, Lisboa.
ROSE, M., 1933. Faune de France: Copepodes pelagiques: 1-361. Paul LeChevalier, Paris.
SHANNON, C. E., 1948. A mathematical theory of communication. Bell System Technical Journal 27: 379-423.
SILVA, T. A., S. NEUMANN LEITÃO, R. SCHWAMBORN, L. M. O. GUSMÃO & D. A. NASCIMENTO-VIEIRA, 2003. Diel and seasonal changes in the macrozooplankton community of a tropical estuary in Northeastern Brazil. Revista Brasileira de Zoologia 20: 439-446.
SOKAL, R. R. & F. J. ROHLF, 1995. Biometry: principles and practice of statistics in biological research: (3): 1-887. WH Freeman, New York.
STRICKLAND, J. D. H. & T. R. PARSONS, 1972. A practical handbook of seawater analysis. Bulletin Fisheries Research Board of Canada 167(2): 1-311.
SULLIVAN, B. K., J. H. COSTELLO & D. VAN KEUREN, 2007. Seasonality of the copepods Acartia hudsonica and Acartia tonsa in Narragansett Bay, RI, USA during a period of climate change. Estuarine, Coastal and Shelf Science 73: 259-267.
TRÉGOUBOFF, G. & M. ROSE, 1957. Manuel de planctonologie mediterranéenne: 1-583. Centre Nacional de la Rechérche Scientifique, Paris. 2 v.
VIEIRA, L., U. AZEITEIRO, P. RÉ, R. PASTORINHO, J. C. MARQUES & F. MORGADO, 2003. Zooplankton distribution in a temperature estuary (Mondego estuary southern arm: Western Portugal). Acta Oecologica 24: 163-173.
WALTER, T. C., 1986. New and poorly known Indo-Pacific species of Pseudodiaptomus (Copepoda: Calanoida), with a key to the species groups. Journal of Plankton Research 8(1): 129-168.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail:boletim@museu-goeldi.br
Recebido: 20/01/2009
Aprovado: 21/08/2009













