Introdução
A dengue permanece como importante problema de Saúde Pública no Brasil, mesmo após a introdução e disseminação recente dos vírus Zika e chikungunya.1,2 A doença apresenta grande potencial epidêmico, acometendo todas as regiões do Brasil, com destaque para o Nordeste do país.3-5
A repercussão dessas epidemias é percebida diretamente, na assistência aos doentes e na vigilância epidemiológica, muitas vezes expondo suas fragilidades e causando impactos de ordem socioeconômica, política e psicológica.6 Além disso, as epidemias de dengue geram gastos elevados com hospitalização, assistência médica e medidas de prevenção e controle do vetor, implicando uma sobrecarga considerável para os serviços de saúde. Nos anos de 2000 a 2007, o Brasil respondeu por aproximadamente 41% do custo total da dengue no continente americano.7,8
A despeito das ações de controle de vetores desenvolvidas pelos serviços de saúde, o estado do Ceará registrou grandes epidemias a partir da década de 1990.9-11 O município de Fortaleza, capital do estado, concentra grande parte dos casos no Ceará, com registro de casos de dengue desde 1986, epidemias de magnitude e elevada letalidade.10,11
Com a intenção de evitar e minimizar o impacto dessas epidemias, é fundamental conhecer suas características em cada região específica. Dessa forma, para uma melhor compreensão dos mecanismos envolvidos nas epidemias de dengue em grandes centros urbanos, o objetivo deste trabalho foi caracterizar os aspectos entomológicos e epidemiológicos das epidemias de dengue ocorridas em Fortaleza, Ceará, Brasil, no período de 2001 a 2012.
Métodos
Trata-se de um estudo descritivo, para o qual foram selecionados todos os anos nos quais a incidência de dengue foi superior ao percentil 75%, no período de 2001 a 2012.
Em 2012, a cidade de Fortaleza era a quinta capital mais populosa do Brasil, com aproximadamente 2.591.114 milhões de habitantes, residentes em 119 bairros, distribuídos administrativamente em seis Secretarias Executivas Regionais (SER).12
Foram incluídos no estudo todos os casos confirmados da doença entre janeiro de 2001 e dezembro de 2012, referentes a pessoas residentes no município de Fortaleza. Foram considerados os casos confirmados por critério laboratorial e clínico-epidemiológico. Para isso, utilizou-se a definição de caso adotada pelo Ministério da Saúde do Brasil.13 Foi considerado caso de dengue a pessoa que vive em áreas onde são registrados casos de doença ou que, nos últimos 14 dias, tenha viajado para áreas com ocorrência de transmissão de dengue (ou presença de Aedes aegypti), que apresente febre usualmente, no decorrer de dois a sete dias, e duas ou mais das seguintes manifestações: náuseas, vômito, exantema, mialgias, artralgia, cefaleia, dor retro-orbital, petéquias, prova do laço positiva, leucopenia.
Os dados epidemiológicos foram obtidos do Sistema de Informação de Agravos de Notificação (Sinan) em suas três diferentes versões: Sinan-Windows (2000 a 2006), Sinan-Net (2007 e 2010) e Sinan-Online (2011 e 2012).14 Para o cálculo da taxa de incidência de dengue, foi considerado como numerador o número de casos da doença, e como denominador, a população estimada pela Fundação Instituto Brasileiro de Geografia e Estatística (IBGE), disponibilizada pelo Departamento de Informática do Sistema Único de Saúde (Datasus), vezes 100 mil. Também foi calculada a taxa de incidência, por sexo e faixa etária. O número de internações foi obtido do Sistema de Informações Hospitalares do Sistema Único de Saúde (SIH/SUS).
As variáveis estudadas incluíram as seguintes características: sociodemográficas e epidemiológicas; laboratoriais; das internações; e entomológicas.
As variáveis sociodemográficas corresponderam à idade (em anos: <9, 10 a 19, 20 a 49, 50 a 79, ≥80) e ao sexo (masculino; feminino).
As características epidemiológicas consideradas foram:
- classificação final utilizada pelo Ministério da Saúde até 2013 (dengue clássica, dengue com complicações, febre hemorrágica da dengue [FHD], caso descartado, caso em investigação, ignorada);
- critério de confirmação (laboratorial, clínico-epidemiológico, em investigação, descartado);
- evolução (cura, óbito por dengue, óbito por outras causas, ignorada);
- permanência hospitalar (em dias: <1, 1 a 5, 6 a 14, 15 a 21, 22 a 28, ≥29); e
- mês e ano de início dos sintomas
Os dados entomológicos foram obtidos das planilhas de índice de infestação predial (IIP) preenchidas pela Secretaria Municipal de Saúde de Fortaleza, do Sistema de Informação de Febre Amarela e Dengue (SisFAD) até o ano de 2009 e do Sistema do Programa Nacional de Controle da Dengue (SisPNCD) a partir de 2010; além dos levantamentos rápidos do índice de infestação por Aedes aegypti (LIRAa).15 Segundo o Ministério da Saúde, os depósitos infestados pelo mosquito Aedes aegypti devem ser classificados em cinco grandes grupos: A, B, C, D e E.15 No grupo A estão os depósitos utilizados para armazenamento de água. Por sua importância, esse grupo foi subdividido em A1 (caixas d´água) e A2 (depósitos para armazenamento de água ao nível do solo). No grupo B estão os depósitos considerados móveis, como vasos/frascos com água, garrafas, recipientes de degelo em geladeiras, bebedouros em geral, pequenas fontes ornamentais etc. No grupo C estão os depósitos considerados fixos, como tanques em borracharias, calhas, lajes, sanitários em desuso, piscinas não tratadas, vasos em cemitérios etc. No grupo D encontram-se os depósitos passíveis de remoção mecânica; aqui também, pela importância desse tipo de depósito como possível criadouro, esse grupo foi subdividido em D1 (pneus) e D2 (lixo). E no grupo E, foram alocados os recipientes naturais, como axilas de folhas, bromélias, buracos em árvores, rochas etc.15 O percentual dos depósitos infestados pelo mosquito Aedes aegypti foi apresentado segundo cada Secretaria Executiva Regional.
A letalidade por dengue foi calculada como o número de óbitos confirmados por febre hemorrágica da dengue - FHD -, dividido pelo número de casos confirmados de FHD, vezes 100.
Os bancos de dados foram analisados após a eliminação de duplicidades de casos, para cada um dos anos epidêmicos. Em seguida, as informações contidas nas três versões do Sinan foram agrupadas em um único banco para análise. No cálculo das estatísticas descritivas, foram utilizados os softwares EpiInfo® versão 6.0 e Tabwin 32.
Para realização do estudo, foram respeitados os princípios éticos previstos na Resolução do Conselho Nacional de Saúde (CNS) nº 466, de 12 de dezembro de 2012.16 Por se tratar de dados secundários, sem identificação dos casos, o estudo foi autorizado pela Secretaria Municipal de Saúde de Fortaleza, sendo aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Ceará (CEP/UFC) em 1º de novembro de 2013: Protocolo nº 20301313.6.0000.5054.
Resultados
No período de 2001 a 2012, foram notificados 194.446 casos suspeitos de dengue. Os anos com maior incidência de casos confirmados e que foram considerados epidêmicos foram 2001 (587,0/100 mil hab.), 2006 (637,5/100 mil hab.), 2008 (1.396,6/100 mil hab.), 2011 (1.387,3/100 mil hab.) e 2012 (1.561,1/100 hab.) (Figura 1). As epidemias foram marcadas pela circulação de diferentes sorotipos e cocirculação simultânea de até três sorotipos em um único ano, como aconteceu em 2002 e 2003. Em 2001, houve predomínio discreto do sorotipo DENV-2 (53,0%) e cocirculou o DENV-1 (47,0%). Em 2006, predominou o DENV-3 (90,0%), no ano de 2008, o DENV-2 (65,0%), e em 2011, o DENV-1 (97,4%); e no ano de 2012, foi introduzido o DENV-4 (98,0%). Em todos os anos citados, houve cocirculação de pelo menos dois diferentes sorotipos virais (Figura 1).
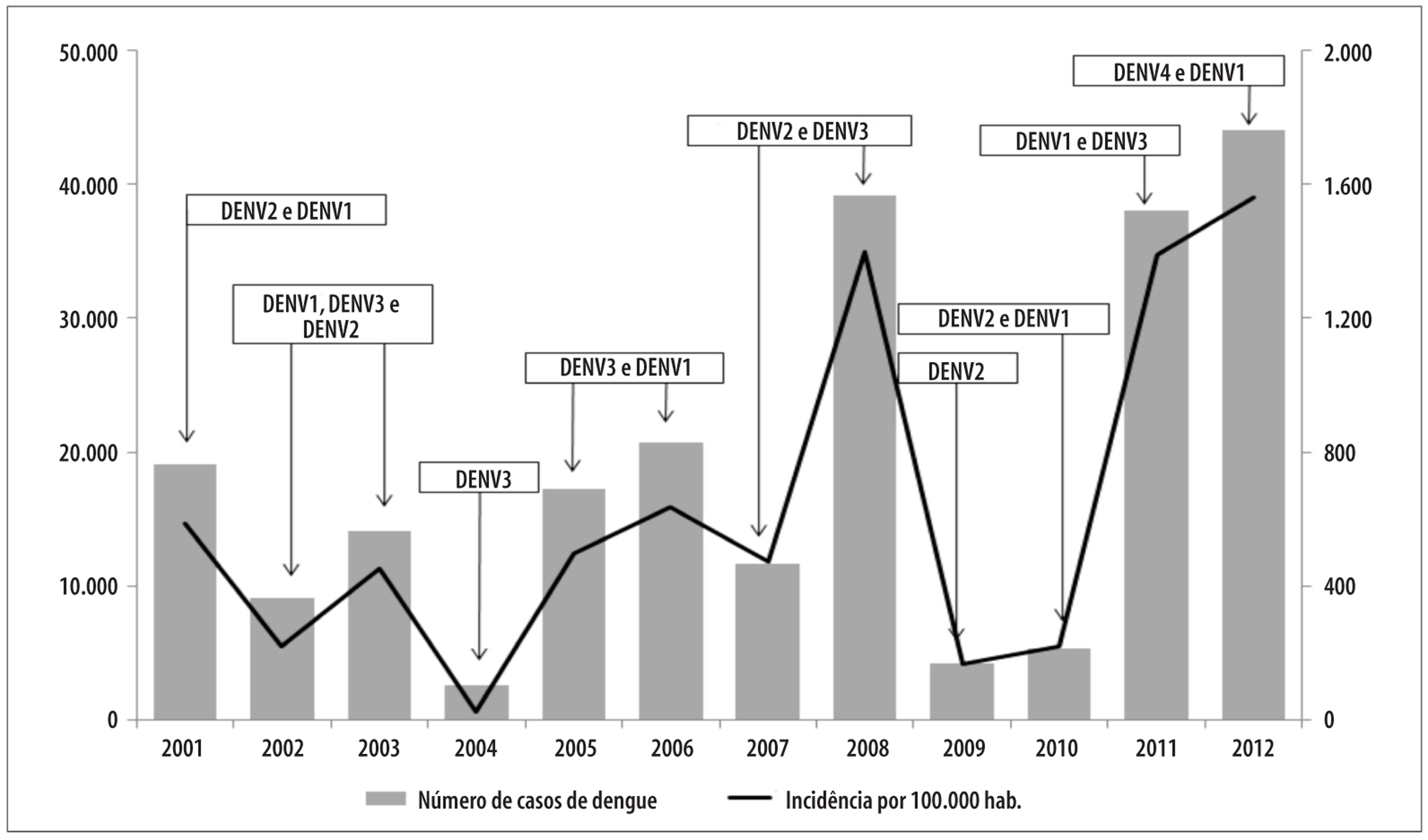
Figura 1 - Número de casos, taxa de incidência e sorotipos circulantes de dengue. Fortaleza, Ceará, 2001, 2006-2012
Os meses de abril, maio e junho concentraram mais de 70% dos casos confirmados, com destaque para maio de 2001 (30,1%) e maio de 2008 (33,8%). Em todos os meses dos anos epidêmicos, foram confirmados casos. O mês de maio de 2012 concentrou mais de 52% dos casos confirmados naquele ano (Tabela 1).
Tabela 1 - Distribuição dos casos notificados de dengue segundo o mês de notificação, classificação e evolução, por ano epidêmico, Fortaleza, Ceará, 2001, 2006, 2008, 2011 e 2012
| Variáveis | 2001 | 2006 | 2008 | 2011 | 2012 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| Mês | ||||||||||
| Janeiro | 184 | 1,4 | 152 | 1,0 | 779 | 2,3 | 1.265 | 3,7 | 573 | 1,5 |
| Fevereiro | 275 | 2,2 | 180 | 1,2 | 1.436 | 4,2 | 2.389 | 7,0 | 965 | 2,5 |
| Março | 948 | 7,4 | 287 | 1,9 | 2.727 | 7,9 | 6.926 | 20,2 | 2.793 | 7,2 |
| Abril | 1.772 | 13,8 | 695 | 4,5 | 11.009 | 31,9 | 11.447 | 33,3 | 6.855 | 17,6 |
| Maio | 3.851 | 30,1 | 3.272 | 21,2 | 11.667 | 33,8 | 6.715 | 19,5 | 20.564 | 52,6 |
| Junho | 2.800 | 21,8 | 4.042 | 26,2 | 4.639 | 13,4 | 2.373 | 6,9 | 5.137 | 13,2 |
| Julho | 1.890 | 14,7 | 2.984 | 19,4 | 832 | 2,4 | 923 | 2,7 | 1.054 | 2,7 |
| Agosto | 610 | 4,8 | 2.004 | 13,0 | 394 | 1,1 | 625 | 1,8 | 434 | 1,1 |
| Setembro | 190 | 1,5 | 797 | 5,2 | 216 | 0,6 | 445 | 1,3 | 203 | 0,5 |
| Outubro | 170 | 1,3 | 434 | 2,8 | 387 | 1,1 | 417 | 1,2 | 203 | 0,5 |
| Novembro | 77 | 0,6 | 374 | 2,4 | 247 | 0,7 | 372 | 1,1 | 126 | 0,3 |
| Dezembro | 51 | 0,4 | 187 | 1,2 | 214 | 0,6 | 455 | 1,3 | 115 | 0,3 |
| Classificação | ||||||||||
| Dengue clássica | 12.760 | 67,4 | 15.169 | 73,7 | 33.956 | 86,8 | 34.016 | 89,5 | 38.876 | 88,4 |
| Dengue com complicações | - | - | 118 | 0,6 | 327 | 0,8 | 234 | 0,6 | 93 | 0,2 |
| Febre hemorrágica da dengue/síndrome do choque da dengue | 58 | 0,3 | 121 | 0,6 | 264 | 0,7 | 102 | 0,3 | 53 | 0,1 |
| Caso descartado | 6.115 | 32,3 | 5.167 | 25,1 | 4.453 | 11,4 | 3.411 | 9,0 | 4.574 | 10,4 |
| Inconclusiva | - | - | - | - | 119 | 0,3 | 222 | 0,6 | 387 | 0,9 |
| Evolução | ||||||||||
| Ignorada/em branco | 120 | - | 246 | - | 5.723 | 0,5 | 3.132 | 0,6 | 2.874 | 2,1 |
| Cura | 18.923 | 99,9 | 20.461 | 99,8 | 33.420 | 99,4 | 34.827 | 99,3 | 41.081 | 97,8 |
| Óbito | 10 | 0,1 | 36 | 0,2 | 20 | 0,1 | 26 | 0,1 | 23 | 0,1 |
| Total | 19.053 | 100,0 | 20.743 | 100,0 | 39.163 | 100,0 | 37.985 | 100,0 | 43.978 | 100,0 |
Após a epidemia de 2008, houve um discreto aumento no percentual de casos inconclusivos. A epidemia com maior registro de óbitos foi a de 2006, com 36 confirmações (Tabela 1).
Houve uma predominância de casos no sexo feminino, variando de 54,4% (2011) a 60,4% (2001). Em todos os anos epidêmicos, proporcionalmente, notificou-se maior número de casos na faixa etária de 20 a 49 anos. Houve importante aumento da infecção entre os menores de nove anos (23,7%) durante a epidemia de 2008 (Tabela 2). A média de idade dos casos foi de 27,7 anos (0 a 95). Houve redução na idade dos indivíduos nas três primeiras epidemias, e um discreto aumento a partir de 2011. Nos anos epidêmicos durante o período 2001-2012, a mediana de idade reduziu-se de forma considerável.
Tabela 2 - Período de permanência hospitalar, número e percentual de casos confirmados de dengue, dengue com complicações, febre hemorrágica da dengue e síndrome do choque da dengue, segundo sexo e faixa etária, e letalidade, Fortaleza, Ceará, 2001, 2006, 2008, 2011 e 2012
| Variáveis | 2001 | 2006 | 2008 | 2011 | 2012 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| Permanência hospitalar (em dias) | ||||||||||
| <1 | 2 | 0,7 | 3 | 0,3 | 22 | 0,7 | 9 | 0,4 | 4 | 0,2 |
| 1-5 | 222 | 81,0 | 690 | 74,6 | 2.561 | 78,0 | 1.781 | 80,2 | 1.174 | 42,0 |
| 6-14 | 49 | 17,9 | 218 | 23,5 | 672 | 20,4 | 419 | 18,9 | 1.604 | 57,4 |
| 15-21 | - | - | 7 | 0,8 | 15 | 0,5 | 7 | 0,3 | 9 | 0,3 |
| 22-28 | - | - | 2 | 0,2 | 7 | 0,2 | 3 | 0,1 | - | - |
| ≥29 | 1 | 0,4 | 6 | 0,6 | 6 | 0,2 | 3 | 0,1 | 2 | 0,1 |
| Casos confirmados de dengue | ||||||||||
| Faixa etária (em anos) | ||||||||||
| ≤9 | 1.623 | 9,2 | 2.808 | 15,0 | 9.281 | 23,7 | 6.387 | 16,8 | 4.536 | 10,3 |
| 10-19 | 2.929 | 16,7 | 4.395 | 23,4 | 8.561 | 21,8 | 8.546 | 22,5 | 9.050 | 20,6 |
| 20-49 | 10.366 | 59,0 | 9.387 | 50,0 | 17.044 | 43,5 | 18.530 | 48,7 | 24.241 | 55,0 |
| 50-79 | 2.572 | 14,6 | 2.047 | 10,9 | 4.024 | 10,3 | 4.241 | 11,2 | 5.918 | 13,5 |
| ≥80 | 93 | 0,5 | 123 | 0,7 | 257 | 0,7 | 303 | 0,8 | 251 | 0,6 |
| Sexo | ||||||||||
| Masculino | 7.546 | 39,6 | 9.329 | 45,0 | 17.219 | 44,0 | 17.321 | 45,6 | 18.896 | 42,9 |
| Feminino | 11.505 | 60,4 | 11.409 | 55,0 | 21.947 | 56,0 | 20.668 | 54,4 | 25.106 | 57,1 |
| Casos confirmados de dengue com complicações, febre hemorragica e síndrome do choque da dengue | ||||||||||
| Faixa etária (em anos) | ||||||||||
| ≤9 | 4 | 6,9 | 22 | 9,4 | 112 | 19,6 | 34 | 10,1 | 9 | 6,2 |
| 10-19 | 9 | 15,5 | 50 | 21,6 | 119 | 20,8 | 61 | 18,2 | 23 | 15,8 |
| 20-49 | 26 | 44,8 | 138 | 59,2 | 256 | 44,8 | 166 | 49,4 | 84 | 57,5 |
| 50-79 | 19 | 32,8 | 22 | 9,4 | 79 | 13,8 | 68 | 20,2 | 25 | 17,1 |
| ≥80 | - | - | 1 | 0,4 | 6 | 1,0 | 7 | 2,1 | 5 | 3,4 |
| Sexo | ||||||||||
| Ignorado/em branco | - | - | - | - | - | - | 1 | 0,3 | - | - |
| Masculino | 22 | 37,9 | 105 | 43,9 | 270 | 45,7 | 172 | 51,2 | 62 | 42,5 |
| Feminino | 36 | 62,1 | 134 | 56,1 | 321 | 54,3 | 163 | 48,5 | 84 | 57,5 |
| Óbitos (letalidade) | 5 | 17,2 | 12 | 15,1 | 19 | 3,4 | 26 | 7,7 | 23 | 15,7 |
Entre os indivíduos hospitalizados, a permanência média de internação foi de 6,4 dias (1 a 30). Nas epidemias de 2001, 2006, 2008 e 2011, a maior parte dos indivíduos permaneceu internada por um período de um a cinco dias. Em 2012, a maior parte das internações (57,4%) referiu permanência de seis a 14 dias, sugerindo maior gravidade dos casos (Tabela 2).
Em geral, o sexo feminino predominou entre os casos graves, com destaque para o ano de 2001 (62,1%); a exceção coube a 2011, com 48,5% dos casos no sexo feminino (Tabela 2). As maiores frequências de casos com formas graves da doença corresponderam às faixas etárias de 20 a 49 (49,8%) e 10 a 19 anos (19,5%). Em 2008, os casos graves em crianças menores de nove anos representaram 19,6% dos casos. A letalidade média por FHD no período foi de 13,7%, variando entre 17,2% em 2001 e 3,4% em 2008 (Tabela 2).
A taxa de incidência da doença foi sempre maior no sexo feminino, variando entre 662,0 casos/100 mil habitantes em 2006 e 1.675,5 casos/100 mil habitantes em 2012. Destacou-se aumento importante na faixa etária <9 anos, chegando a 2.331,3 casos/100 mil habitantes na epidemia de 2008 (Tabela 3).
Tabela 3 - Taxa de incidência de dengue (por 100 mil habitantes) segundo faixa etária e sexo, Fortaleza, Ceará, 2001, 2006, 2008, 2011 e 2012
| Variáveis | 2001 | 2006 | 2008 | 2011 | 2012 |
|---|---|---|---|---|---|
| Faixa etária (em anos) | |||||
| <9 | 406,9 | 660,3 | 2.331,3 | 1.707,4 | 1.114,5 |
| 10-19 | 631,4 | 856,0 | 1.821,3 | 1.793,3 | 1.881,1 |
| 20-49 | 1.047,0 | 856,6 | 1.378,6 | 1.350,7 | 1.743,0 |
| 50-79 | 886,5 | 637,5 | 1.045,5 | 860,2 | 1.156,4 |
| ≥80 | 443,1 | 529,4 | 896,4 | 654,8 | 551,4 |
| Sexo | |||||
| Masculino | 488,2 | 609,4 | 1.313,5 | 1.345,7 | 1.431,1 |
| Feminino | 673,9 | 662,0 | 1.469,6 | 1.422,2 | 1.675,5 |
O número de ciclos de visitas domiciliares e os levantamentos de índices de infestação por Aedes, realizados pelos agentes de endemias e que ocorriam de forma concomitante, variaram de três (2008) a seis ciclos de visitas (2006). Os índices de infestação vetorial oscilaram entre 0,5% durante o terceiro ciclo realizado em 2008 (entre os dias 13 e 18 de outubro) e 9,2% durante o segundo ciclo de 2001 (realizado entre 3 de maio e 24 de agosto). Quatro ciclos apresentaram infestação inferior a 1%. O ano de 2001 apresentou a infestação mais elevada, chegando a 9,2% (Figura 2).

Figura 2 - Índice de infestação predial por Aedes aegypti, por ciclo de controle de visita domiciliar, Fortaleza, Ceará, 2001, 2006, 2008, 2011 e 2012
Quando analisados os dados por Secretaria Executiva Regional - SER - isoladamente, observa-se que os índices de infestação predial oscilaram entre 0,2% e 14,0% nas SER II e IV, respectivamente, durante o segundo ciclo de visitas domiciliares, nos anos epidêmicos avaliados. A SER III foi a que apresentou infestações mais elevadas, seguida das SER V, I, II, IV e VI. Em 17 ciclos durante esses anos epidêmicos, a infestação predial, independentemente da SER avaliada, esteve acima de 1%.
Os depósitos utilizados para armazenar água destinada a consumo humano representaram mais de 40% de todos os depósitos infestados pelo mosquito Aedes aegypti, em todos os anos epidêmicos. Houve aumento na proporção de vasos e pratos de plantas infestados, de 3,4% em 2001 para 21% em 2012 (dados não apresentados em tabela). Os depósitos utilizados para armazenar água (de tipo A2) foram os mais infestados, entre aqueles com a presença de larvas de mosquitos nas SER I, III, V e VI. Nas SER II e IV, destacaram-se os ralos e vasos sanitários (tipo C) (Tabela 4).
Tabela 4 - Percentual dos depósitos infestados pelo mosquito Aedes aegypti durante os anos epidêmicos, por Secretaria Executiva Regional, Fortaleza, Ceará, 2001-2012
| Tipos de depósitos | Secretarias Executivas Regionais - SER | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | Total | ||||||||
| mín. | máx. | mín. | máx. | mín. | máx. | mín. | máx. | mín. | máx. | mín. | máx. | mín. | máx. | |
| Caixas d´água (A1) | 11,6 | 18,1 | 3,5 | 12,5 | 5,8 | 18,4 | 7,7 | 23,1 | 12,1 | 37,8 | 4,8 | 11,8 | 3,5 | 37,8 |
| Outros depósitos para armazenar água (A2) | 56,3 | 67,9 | 20,8 | 29,1 | 48,6 | 68,2 | 24,1 | 26,9 | 46,0 | 54,1 | 47,1 | 54,5 | 20,8 | 68,2 |
| Vasos e pratos de plantas (B) | 8,3 | 14,3 | 12,5 | 30,2 | 7,9 | 21,1 | 3,8 | 22,4 | 2,7 | 25,0 | 15,2 | 23,5 | 2,7 | 30,2 |
| Ralos e vasos sanitários (C) | - | 8,9 | 30,0 | 50,0 | 5,3 | 7,0 | 26,9 | 30,8 | 3,2 | 6,9 | 4,8 | 18,2 | - | 50,0 |
| Pneus (D1) | - | 1,4 | - | 1,2 | - | 1,4 | - | 7,7 | - | 0,9 | - | 0,8 | - | 7,7 |
| Latas, frascos, embalagens, garrafas, outros (D2) | 3,6 | 7,1 | - | 6,7 | 5,3 | 17,4 | 11,5 | 17,9 | - | 4,8 | - | 14,3 | - | 17,9 |
| Depósitos naturais (E) | - | 0,9 | - | 3,5 | - | - | - | - | - | 3,2 | - | 3,2 | - | 3,5 |
Discussão
No período de 12 anos (2001-2012), ocorreram cinco epidemias de dengue em Fortaleza. Observou-se um aumento progressivo da incidência da doença, atingindo, em 2012, o maior pico da série histórica da dengue no município, com a circulação simultânea de mais de um sorotipo, aumento no tempo médio de internação dos casos e elevada letalidade.
Estudo realizado em Manaus, nos anos de 2000 a 2012, apontou 2011 como o da maior epidemia da região.17 Na cidade de Natal, 2008 foi o ano que apresentou maior incidência da doença e - como no presente estudo - circulação do sorotipo DENV-2.18 Os anos epidêmicos, mesmo dentro de uma mesma região geográfica como o Nordeste, oscilam de forma importante. Isso se deve ao tempo de introdução da dengue na região, diversidade de sorotipos circulantes, diferenças de susceptibilidade aos diversos sorotipos, presença simultânea desses sorotipos, além da capacidade instalada das vigilâncias epidemiológicas locais e das ações de controle de vetores desenvolvidas.
A faixa etária dos casos de dengue sofreu uma alteração importante em seu perfil, passando a acometer também a população menor de dez anos de idade em 2008 provavelmente - devido à reintrodução do DENV-2 - quando as crianças estavam mais suscetíveis.19
Embora tenha-se observado um discreto predomínio de casos no sexo feminino, essa diferença não pareceu tão importante, considerando-se os anos epidêmicos estudados, o que corrobora outras epidemias documentadas entre os anos de 2000 e 2012 - nas cidades de Manaus, Natal e São Luís.17,18,20 Entretanto, os inquéritos epidemiológicos sobre dengue realizados no Brasil não apontam maior risco em relação ao sexo.21,22,23 Este achado evidencia um provável viés de registro dos casos notificados, por se tratar, predominantemente, de transmissão domiciliar; e possivelmente, pelo fato de as mulheres costumarem buscar mais os serviços de saúde e o atendimento médico que os homens.
A maior incidência da doença em adultos jovens, encontrada no presente estudo, corrobora as reveladas por pesquisas realizadas nas cidades de Manaus, Natal e São Luís.17,18,20 Em São Luís, assim como em Fortaleza, verificou-se um aumento das formas graves da doença em populações previamente expostas aos sorotipos 1, 2 e 3.20
Uma maior gravidade dos casos foi detectada em 2008, possivelmente devida à maior ocorrências em menores de 9 anos e ao fato de o DENV-2 ter sido o principal sorotipo circulante naquele ano, levando a um grande número de hospitalizações.19 Na epidemia de 2008, provavelmente, o número de óbitos não foi maior pela intensa mobilização da assistência à saúde. Nos anos epidêmicos, pode ser maior a sensibilidade dos profissionais de saúde e da própria rede de serviços diante da infecção, o que, a despeito do aumento da demanda durante as epidemias, geraria atendimento precoce aos casos graves e, consequentemente, redução na letalidade pela doença. Ademais, a percepção do maior número de óbitos está diretamente ligada à existência de um serviço de verificação de óbitos (SVO) implantado e funcionando em articulação com a vigilância epidemiológica e o Laboratório Central de Saúde Pública (Lacen).24 Essa articulação local potencializa a capacidade dos serviços de saúde em detectar óbitos suspeitos, não percebidos pela assistência no curso da evolução clínica.
Em relação aos indicadores entomológicos, o percentual de caixas d’água infestadas por Ae. aegypti apresentou redução de mais de três vezes, e o de pneus, de mais de nove vezes, considerando-se as epidemias de 2001 a 2012. Entretanto, foi observado um aumento importante da infestação proporcional nos pratos e vasos de plantas, conforme estudos realizados em Manaus, de 2000 a 2012, e na região Nordeste, em 2016.17,25 Provavelmente, essa mudança reflete quase três décadas de informações disponibilizadas pelos órgãos da saúde sobre a predominância desses reservatórios para acúmulo de água no Nordeste, bem como as ações de controle desenvolvidas, como vedação definitiva de caixas d´água, vedação temporária com telas de nylon e até mesmo o uso de mecanismos biológicos, como peixes larvófagos.
Cabe destacar que mesmo uma infestação pelo Ae. aegypti relativamente baixa, segundo a maior parte dos levantamentos de índice de infestação realizados, não impediu a ocorrência de epidemias importantes. Embora baixos, os valores desse indicador quase nunca estiveram inferiores a 1%, conforme divulgou a Secretaria Municipal de Saúde de Fortaleza. Observa-se, outrossim, maior incidência da doença e índices de infestação mais elevados no primeiro semestre de cada ano. Outro aspecto a ser compreendido é que possivelmente, há diferenças de competência vetorial em cada região, sugerindo que em algumas áreas, os vetores conseguem se adaptar melhor às condições ambientais, aumentar seu tempo de vida e consequentemente, transmitir dengue por mais tempo.
Diante desse cenário, a dengue continua a ser um grave problema de Saúde Pública na cidade de Fortaleza. Após 30 anos de circulação, com quatro sorotipos circulantes, a presença constante de seu principal vetor disseminado pelos bairros da cidade, somada à recente cocirculação de outros arbovírus como Zika e chikungunya - o que aumenta a dificuldade de diagnóstico e tratamento precoce adequado -, as epidemias de dengue passam a ser potencialmente mais graves.26 O desafio que se apresenta neste momento é compreender o desenvolvimento dessas epidemias simultaneamente à circulação de outras doenças exantemáticas, como sarampo em 2013 e 2015,27 Zika e chikungunya em 2015 e 2016.28
Será cada vez mais complicado falar em casos confirmados de dengue tendo por referência testes como IgM ou mesmo NS1, técnicas cuja sensibilidade e especificidade estará bastante comprometida com a circulação simultânea desses outros arbovírus.29,30 O problema da sensibilidade das técnicas laboratoriais poderia ser minimizado com a disseminação das técnicas moleculares de diagnóstico e/ou implantação de uma vigilância integrada para arboviroses. Entretanto, o custo dessas técnicas moleculares poderia inviabilizar sua disseminação e a possibilidade de vigilância integrada. Sobre essa questão ainda não há consenso, nem mesmo entre os especialistas. Os dados secundários referentes aos registros de casos de dengue no Brasil precisarão ser revisitados a partir dessa circulação simultânea. Provavelmente, teremos casos de dengue, zika e chikungunya confundindo-se clinicamente, com reflexo no número de notificações, sendo necessária, por conseguinte, a investigação dos casos.
Uma limitação deste estudo refere-se ao fato de fundamentar-se em diferentes bases de dados secundários, utilizadas pela vigilância local, além da incompletude de algumas variáveis analisadas. O uso desses dados pode levar à subestimação do número real de casos ocorridos nas epidemias. Não obstante, a compreensão dessas epidemias foi útil à identificação de suas principais características entomológicas e epidemiológicas em Fortaleza.











 texto em
texto em 


