INTRODUÇÃO
As leishmanioses são doenças infecciosas de importância para a saúde pública devido ao seu alto coeficiente de detecção e capacidade de produzir deformidades1. Pertencem ao grupo de doenças tropicais negligenciadas e são causadas por protozoários do gênero Leishmania Ross, 1903 (Kinetoplastida: Trypanosomatidae) transmitidos aos humanos por flebotomíneos hematófagos fêmeas da subfamília Phlebotominae (Diptera: Psychodidae)2,3,4. Compreendem um espectro de doenças classificadas como leishmaniose tegumentar americana (LTA) ou leishmaniose cutânea (mais comum) e leishmaniose visceral (LV), conhecida como calazar, ambas disseminadas em regiões tropicais e subtropicais do mundo1.
No Brasil, a LTA é considerada um grave problema de saúde pública e tem sido registrada em todos os estados brasileiros3,5. Entre 2010 e 2019, o estado de Mato Grosso registrou 23.980 casos da doença, com a detecção de casos autóctones em todos os seus municípios5.
A LV é uma doença grave e potencialmente fatal que ressurgiu em várias localidades do Brasil na década de 1980 e desde então se espalhou para novas áreas, incluindo a Região Centro-Oeste6. Em Mato Grosso, a LV é registrada em áreas urbanas e rurais das regiões norte, centro-sul e sudeste do estado, distribuídas em 34 de seus municípios, prevalecendo as regiões centro-sul e sudeste6. Entre 2010 e 2019, foram registrados 258 casos da doença no estado5.
A transmissão dos agentes etiológicos envolve diferentes flebotomíneos em associações específicas com os parasitas e seus hospedeiros, com ciclos de transmissão que ocorrem em todo o território brasileiro7,8. Existem mais de mil espécies descritas no mundo, das quais mais de 530 advêm da região Neotropical9. Nas Américas existem 40 espécies de flebotomíneos envolvidos na transmissão do parasito Leishmania sp.10. No Brasil, os principais vetores associados à transmissão da LTA são: Bichromomyia flaviscutellata (Mangabeira, 1942), Nyssomyia umbratilis (Ward & Fraiha, 1977), Nyssomyia intermedia (Lutz & Neiva, 1912), Psychodopygus wellcomei Fraiha, Shaw & Lainson, 1971, Migonemyia (Migonemyia) migonei (França, 1920) e Nyssomyia whitmani (Antunes & Coutinho, 1939), sendo esta última a principal espécie associada à transmissão da LTA e amplamente distribuída no Brasil, bem como em Mato Grosso11,12,13,14,15.
Quanto à transmissão da LV no Brasil, a principal espécie associada é Lutzomyia (Lutzomyia) longipalpis (Lutz & Neiva, 1912). Porém, estudos ressaltam a relevância de Lutzomyia (Lutzomyia) cruzi (Mangabeira, 1938) no processo de transmissão da LV3,11,16,17. Na área urbana, os cães são considerados reservatórios domésticos importantes de Leishmania infantum devido à sua estreita relação com humanos18,19.
O estado de Mato Grosso possui três biomas distintos: Cerrado, Pantanal e Floresta Amazônica, sendo que grande parte de seu território encontra-se na Amazônia Legal20. Mais de 50% dos municípios mato-grossenses possuem em seu território Floresta Amazônica, seguido por Cerrado20,21. Apresenta como limites os estados do Amazonas e Pará, ao norte; Tocantins e Goiás, a leste; Mato Grosso do Sul, ao sul; Rondônia e a Bolívia, a oeste20.
A diversidade da fauna de flebotomíneos em Mato Grosso foi relatada primeiramente por Missawa e Maciel22, que listaram 106 espécies relevantes na epidemiologia da LTA e da LV, como Lu. (Lut.) cruzi, Lu. (Lut.) longipalpis, Bi. flaviscutellata, Ny. intermedia, Mg. (Mig.) migonei e Ny. whitmani. Ribeiro et al.23 apresentaram a distribuição desses vetores nos biomas presentes no estado (Floresta Amazônica, Cerrado e Pantanal), reportando Lu. (Lut.) cruzi, Lu. (Lut.) longipalpis e Ny. whitmani nos três biomas; e Bi. flaviscutellata não encontrada apenas no bioma Pantanal.
Transformações ambientais decorrentes da migração da área rural para a periferia das cidades aumentam a construção de moradias irregulares, com carência de saneamento básico, fato que promove as desigualdades sociais24. Assim, as alterações relacionadas ao processo de urbanização e o crescente emprego da técnica de monocultura têm favorecido os flebotomíneos na transmissão de doenças25. A expansão da doença para novas fronteiras provavelmente sobrevêm ao desmatamento de áreas situadas entre as grandes cidades, objetivando a implantação de projetos de desenvolvimento26,27, os quais são cortados por uma extensa rede de rodovias de acesso, promovendo o contato homem-vetor.
O conhecimento da fauna flebotomínica e sua distribuição geográfica conforme o bioma contribuem para uma melhor compreensão da dinâmica de transmissão das leishmanioses. Assim, os objetivos deste trabalho foram: atualizar a lista das espécies de flebotomíneos existentes em Mato Grosso; e demonstrar a distribuição espacial das quatro principais espécies vetoras das leishmanioses no estado, segundo o bioma: Lu. (Lut.) longipalpis e Lu. (Lut.) cruzi, vetores de LV, e Bi. flaviscutellata e Ny. whitmani, vetores de LTA, visando identificar as áreas com risco de transmissão e propensas à vigilância entomoepidemiológica.
MATERIAIS E MÉTODOS
ÁREA DE ESTUDO
O estado de Mato Grosso está situado na Região Centro-Oeste do Brasil, com uma área de 903.358 km², distribuída em 141 municípios, e população estimada em 3.658.813 habitantes28. A geografia é formada e influenciada pela presença de três biomas: Floresta Amazônica, Cerrado e Pantanal20.
O clima é tropical quente, com aproximadamente cinco meses de seca (maio a setembro). O índice de precipitação média anual é de 1.750 mm, com intensidade maior de dezembro a fevereiro. A temperatura máxima durante os meses de verão é de cerca de 40 °C, e a média em torno de 27 °C21.
PESQUISA DE DADOS
Dados sobre a distribuição das espécies vetoras em Mato Grosso foram obtidos utilizando a ferramenta Google Acadêmico e plataforma Scientific Electronic Library Online (SciELO - Brasil) para a busca em conteúdos acadêmicos, e os relatórios entomológicos do banco de dados da Secretaria de Estado de Saúde de Mato Grosso (SES-MT) referentes ao período de 2006 a 2021. A nomenclatura taxonômica dos espécimes seguiu as atualizações recentes de pesquisadores de referência na área.
DESCRIÇÃO DOS PROCEDIMENTOS DE CAPTURA E IDENTIFICAÇÃO TAXONÔMICA DOS ESPÉCIMES
As técnicas de captura utilizadas foram armadilhas luminosa CDC29 e barraca de Shannon30, instaladas no intradomicílio, peridomicílio e extradomicílio. As CDC foram introduzidas ao entardecer e recolhidas ao alvorecer, com duração de aproximadamente 12 h, por três noites consecutivas, já a Shannon foi instalada por uma noite ao entardecer, sendo monitorada por 4 h.
Os espécimes capturados foram separados por município, data e ambiente, sendo devidamente etiquetados, conservados em álcool 70% e encaminhados ao Laboratório de Entomologia da SES-MT para clarificação, montagem, identificação e quantificação, conforme Young e Duncan31, transcorrendo um período de aproximadamente oito dias entre a captura e seu processamento. Para a identificação, foram utilizadas as chaves dicotômicas de Young e Duncan31 e Galati32, seguindo-se a classificação taxonômica proposta por Galati32.
DISTRIBUIÇÃO ESPACIAL DAS LOCALIDADES
Para a distribuição espacial dos flebotomíneos em Mato Grosso, foram utilizados os estudos de Missawa e Maciel22 e de Mestre e Fontes6 como fontes iniciais dos dados, somados aos trabalhos de Missawa e Lima24, Ribeiro et al.23, Missawa et al.33, Zeilhofer et al.34, Missawa et al.35, Queiroz et al.36, Alves et al.37, Brito et al.17, Moraes38, Thies et al.39. Além disso, utilizou-se o banco de dados não publicados das espécies identificadas pelo Laboratório de Entomologia da SES-MT entre 2006 e 2021, contemplando uma série histórica de 16 anos, sendo esse o fiel depositário do acervo dos exemplares.
CLASSIFICAÇÃO DOS MUNICÍPIOS CONFORME O BIOMA
A distribuição dos 141 municípios conforme o bioma foi realizada por meio do programa ArcGIS, considerando a área total do município em (km²) incluso no bioma20,28. Para municípios com mais de um bioma em sua área, foi feito o cálculo da proporção de cobertura de cada local, sendo o município classificado dentro daquele que obtivesse maior cobertura da área: Cerrado, Floresta Amazônica ou Pantanal.
RESULTADOS
De 2006 a 2021, foram realizadas pesquisas entomológicas em 118/141 (83,69%) municípios mato-grossenses: Acorizal, Água Boa, Alta Floresta, Alto Araguaia, Alto Boa Vista, Alto Garças, Alto Paraguai, Apiacás, Araguaiana, Araguainha, Arenápolis, Aripuanã, Barão de Melgaço, Barra do Bugres, Barra do Garças, Brasnorte, Cáceres, Campinápolis, Campo Novo do Parecis, Campo Verde, Campos de Júlio, Canabrava do Norte, Canarana, Carlinda, Chapada dos Guimarães, Cláudia, Colíder, Colniza, Comodoro, Confresa, Cotriguaçu, Cuiabá, Denise, Diamantino, Dom Aquino, Feliz Natal, Gaúcha do Norte, General Carneiro, Guarantã do Norte, Guiratinga, Ipiranga do Norte, Itanhangá, Itiquira, Jaciara, Jangada, Juara, Juína, Juruena, Juscimeira, Lucas do Rio Verde, Luciara, Marcelândia, Matupá, Mirassol D'Oeste, Nobres, Nortelândia, Nossa Senhora do Livramento, Nova Bandeirantes, Nova Brasilândia, Nova Canaã do Norte, Nova Guarita, Nova Lacerda, Nova Marilândia, Nova Maringá, Nova Mutum, Nova Santa Helena, Nova Ubiratã, Nova Xavantina, Novo Horizonte do Norte, Novo Mundo, Novo Santo Antônio, Novo São Joaquim, Paranaíta, Paranatinga, Pedra Preta, Peixoto de Azevedo, Planalto da Serra, Poconé, Pontal da Araguaia, Ponte Branca, Pontes e Lacerda, Porto Alegre do Norte, Porto dos Gaúchos, Porto Esperidião, Porto Estrela, Poxoréo, Primavera do Leste, Querência, Reserva do Cabaçal, Ribeirão Cascalheira, Ribeirãozinho, Rondolândia, Rondonópolis, Rosário Oeste, Salto do Céu, Santa Carmem, Santa Rita do Trivelato, Santo Antônio do Leverger, São Félix do Araguaia, São José do Povo, São José do Rio Claro, São José do Xingu, São José dos Quatro Marcos, São Pedro da Cipa, Sapezal, Serra Nova Dourada, Sinop, Sorriso, Tabaporã, Tangará da Serra, Tapurah, Terra Nova do Norte, Torixoréu, União do Sul, Várzea Grande, Vera, Vila Bela da Santíssima Trindade e Vila Rica (Figura 1).
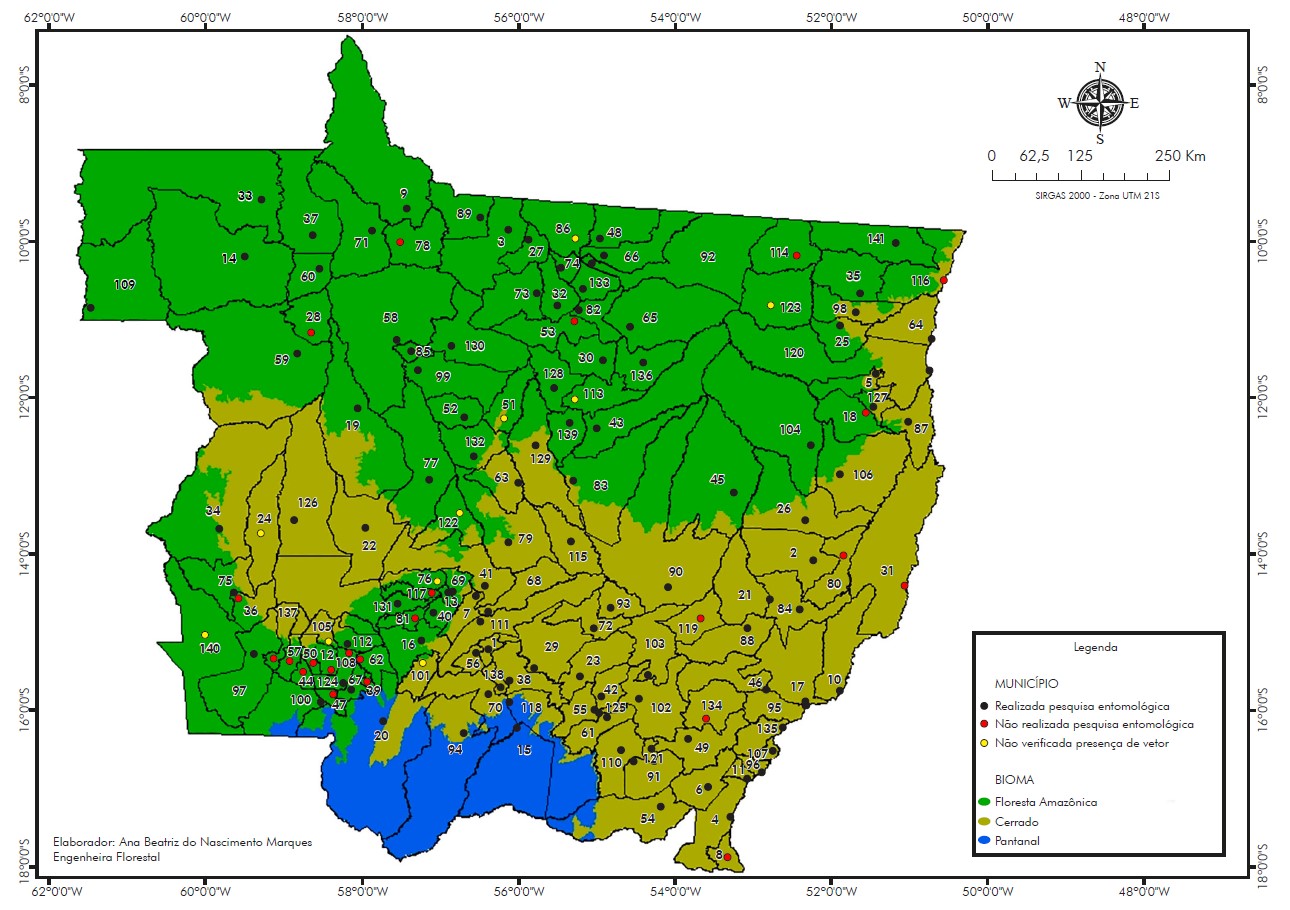
Lista de municípios: 1-Acorizal, 2-Água Boa, 3-Alta Floresta, 4-Alto Araguaia, 5-Alto Boa Vista, 6-Alto Garças, 7-Alto Paraguai, 8-Alto Taquari, 9-Apiacás, 10-Araguaiana, 11-Araguainha, 12-Araputanga, 13-Arenápolis, 14-Aripuanã, 15-Barão de Melgaço, 16-Barra do Bugres, 17-Barra do Garças, 18-Bom Jesus do Araguaia, 19-Brasnorte, 20-Cáceres, 21-Campinápolis, 22-Campo Novo do Parecis, 23-Campo Verde, 24-Campos de Júlio, 25-Canabrava do Norte, 26-Canarana, 27-Carlinda, 28-Castanheira, 29-Chapada dos Guimarães, 30-Cláudia, 31-Cocalinho, 32-Colíder, 33-Colniza, 34-Comodoro, 35-Confresa, 36-Conquista D'Oeste, 37-Cotriguaçu, 38-Cuiabá, 39-Curvelândia, 40-Denise, 41-Diamantino, 42-Dom Aquino, 43-Feliz Natal, 44-Figueirópolis D'Oeste, 45-Gaúcha do Norte, 46-General Carneiro, 47-Glória D'Oeste, 48-Guarantã do Norte, 49-Guiratinga, 50-Indiavaí, 51-Ipiranga do Norte, 52-Itanhangá, 53-Itaúba, 54-Itiquira, 55-Jaciara, 56-Jangada, 57-Jauru, 58-Juara, 59-Juína, 60-Juruena, 61-Juscimeira, 62-Lambari D'Oeste, 63-Lucas do Rio Verde, 64-Luciara, 65-Marcelândia, 66-Matupá, 67-Mirassol D'Oeste, 68-Nobres, 69-Nortelândia, 70-Nossa Senhora do Livramento, 71-Nova Bandeirantes, 72-Nova Brasilândia, 73-Nova Canaã do Norte, 74-Nova Guarita, 75-Nova Lacerda, 76-Nova Marilândia, 77-Nova Maringá, 78-Nova Monte Verde, 79-Nova Mutum, 80-Nova Nazaré, 81-Nova Olímpia, 82-Nova Santa Helena, 83-Nova Ubiratã, 84-Nova Xavantina, 85-Novo Horizonte do Norte, 86-Novo Mundo, 87-Novo Santo Antônio, 88-Novo São Joaquim, 89-Paranaíta, 90-Paranatinga, 91-Pedra Preta, 92-Peixoto de Azevedo, 93-Planalto da Serra, 94-Poconé, 95-Pontal do Araguaia, 96-Ponte Branca, 97-Pontes e Lacerda, 98-Porto Alegre do Norte, 99-Porto dos Gaúchos, 100-Porto Esperidião, 101-Porto Estrela, 102-Poxoréu, 103-Primavera do Leste, 104-Querência, 105-Reserva do Cabaçal, 106-Ribeirão Cascalheira, 107-Ribeirãozinho, 108-Rio Branco, 109-Rondolândia, 110-Rondonópolis, 111-Rosário Oeste, 112-Salto do Céu, 113-Santa Carmem, 114-Santa Cruz do Xingu, 115-Santa Rita do Trivelato, 116-Santa Terezinha, 117-Santo Afonso, 118-Santo Antônio de Leverger, 119-Santo Antônio do Leste, 120-São Félix do Araguaia, 121-São José do Povo, 122-São José do Rio Claro, 123-São José do Xingu, 124-São José dos Quatro Marcos, 125-São Pedro da Cipa, 126-Sapezal, 127-Serra Nova Dourada, 128-Sinop, 129-Sorriso, 130-Tabaporã, 131-Tangará da Serra, 132-Tapurah, 133-Terra Nova do Norte, 134-Tesouro, 135-Torixoréu, 136-União do Sul, 137-Vale de São Domingos, 138-Várzea Grande, 139-Vera, 140-Vila Bela da Santíssima Trindade, 141-Vila Rica.
Figura 1 - Distribuição das pesquisas entomológicas para flebotomíneos realizadas nos municípios do estado de Mato Grosso, Brasil, de 2006 a 2021
Quanto à distribuição dos municípios por bioma, a classificação adotada revelou predomínio do bioma Floresta Amazônica, ocupando 53,19% da área geográfica e presente em 75 municípios; na sequência, o Cerrado com abrangência de 43,97%, contemplando 62 municípios; e o Pantanal, presente em quatro municípios, ocupando 2,84% do território mato-grossense.
As coletas entomológicas ocorreram em 100% (4/4) dos municípios localizados no bioma Pantanal, em 77,33% (58/75) daqueles pertencentes ao bioma Floresta Amazônica e em 90,32% (56/62) dos municípios com bioma Cerrado.
Foram registradas 132 espécies de flebotomíneos (26 ainda não haviam sido descritas para o estado de Mato Grosso), distribuídas em 17 gêneros: Evandromyia (20); Psathyromyia (19); Psychodopygus (19); Lutzomyia (13); Micropygomyia (11); Nyssomyia (10); Pintomyia (7); Brumptomyia (6); Trichophoromyia (6); Bichromomyia (3); Migonemyia (3); Pressatia (3); Sciopemyia (3); Trichopygomyia (3); Viannamyia (3); Martinsmyia (2); e Expapillata (1) (Quadro 1).
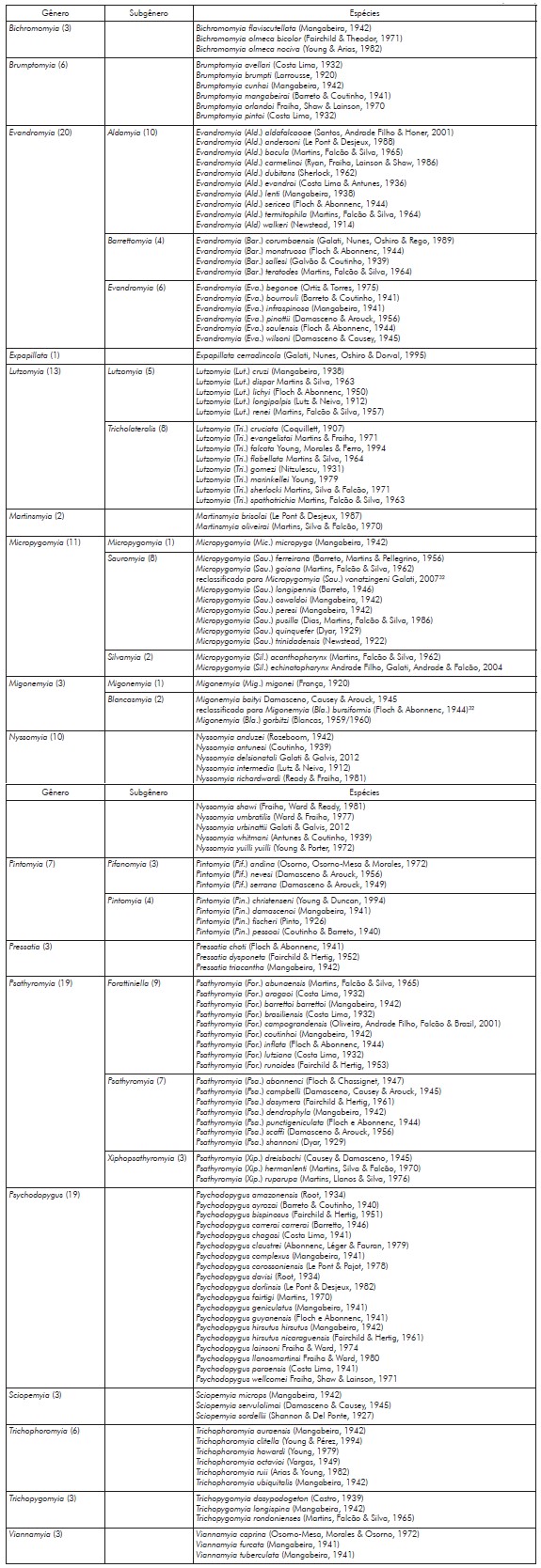
Quadro 1- Lista das espécies de flebotomíneos identificadas no estado de Mato Grosso, no período de 2006 a 2021
Ny. whitmani e Bi. flaviscutellata, espécies consideradas como principais vetores de LTA no Brasil e em Mato Grosso, foram encontradas em 105/118 (88,98%) e em 54/118 municípios (45,76%) mato-grossenses, respectivamente. Em 53/118 (44,91%) deles houve registro da simpatria entre essas espécies (Figura 2).

Lista de municípios: 1-Acorizal, 2-Água Boa, 3-Alta Floresta, 4-Alto Araguaia, 5-Alto Boa Vista, 6-Alto Garças, 7-Alto Paraguai, 8-Alto Taquari, 9-Apiacás, 10-Araguaiana, 11-Araguainha, 12-Araputanga, 13-Arenápolis, 14-Aripuanã, 15-Barão de Melgaço, 16-Barra do Bugres, 17-Barra do Garças, 18-Bom Jesus do Araguaia, 19-Brasnorte, 20-Cáceres, 21-Campinápolis, 22-Campo Novo do Parecis, 23-Campo Verde, 24-Campos de Júlio, 25-Canabrava do Norte, 26-Canarana, 27-Carlinda, 28-Castanheira, 29-Chapada dos Guimarães, 30-Cláudia, 31-Cocalinho, 32-Colíder, 33-Colniza, 34-Comodoro, 35-Confresa, 36-Conquista D'Oeste, 37-Cotriguaçu, 38-Cuiabá, 39-Curvelândia, 40-Denise, 41-Diamantino, 42-Dom Aquino, 43-Feliz Natal, 44-Figueirópolis D'Oeste, 45-Gaúcha do Norte, 46-General Carneiro, 47-Glória D'Oeste, 48-Guarantã do Norte, 49-Guiratinga, 50-Indiavaí, 51-Ipiranga do Norte, 52-Itanhangá, 53-Itaúba, 54-Itiquira, 55-Jaciara, 56-Jangada, 57-Jauru, 58-Juara, 59-Juína, 60-Juruena, 61-Juscimeira, 62-Lambari D'Oeste, 63-Lucas do Rio Verde, 64-Luciara, 65-Marcelândia, 66-Matupá, 67-Mirassol D'Oeste, 68-Nobres, 69-Nortelândia, 70-Nossa Senhora do Livramento, 71-Nova Bandeirantes, 72-Nova Brasilândia, 73-Nova Canaã do Norte, 74-Nova Guarita, 75-Nova Lacerda, 76-Nova Marilândia, 77-Nova Maringá, 78-Nova Monte Verde, 79-Nova Mutum, 80-Nova Nazaré, 81-Nova Olímpia, 82-Nova Santa Helena, 83-Nova Ubiratã, 84-Nova Xavantina, 85-Novo Horizonte do Norte, 86-Novo Mundo, 87-Novo Santo Antônio, 88-Novo São Joaquim, 89-Paranaíta, 90-Paranatinga, 91-Pedra Preta, 92-Peixoto de Azevedo, 93-Planalto da Serra, 94-Poconé, 95-Pontal do Araguaia, 96-Ponte Branca, 97-Pontes e Lacerda, 98-Porto Alegre do Norte, 99-Porto dos Gaúchos, 100-Porto Esperidião, 101-Porto Estrela, 102-Poxoréu, 103-Primavera do Leste, 104-Querência, 105-Reserva do Cabaçal, 106-Ribeirão Cascalheira, 107-Ribeirãozinho, 108-Rio Branco, 109-Rondolândia, 110-Rondonópolis, 111-Rosário Oeste, 112-Salto do Céu, 113-Santa Carmem, 114-Santa Cruz do Xingu, 115-Santa Rita do Trivelato, 116-Santa Terezinha, 117-Santo Afonso, 118-Santo Antônio de Leverger, 119-Santo Antônio do Leste, 120-São Félix do Araguaia, 121-São José do Povo, 122-São José do Rio Claro, 123-São José do Xingu, 124-São José dos Quatro Marcos, 125-São Pedro da Cipa, 126-Sapezal, 127-Serra Nova Dourada, 128-Sinop, 129-Sorriso, 130-Tabaporã, 131-Tangará da Serra, 132-Tapurah, 133-Terra Nova do Norte, 134-Tesouro, 135-Torixoréu, 136-União do Sul, 137-Vale de São Domingos, 138-Várzea Grande, 139-Vera, 140-Vila Bela da Santíssima Trindade, 141-Vila Rica.
Figura 2 - Distribuição espacial de Ny. whitmani e Bi. flaviscutellata no estado de Mato Grosso, Brasil, de 2006 a 2021
Ny. whitmani foi a espécie predominante nos três biomas. Bi. flaviscutellata, apesar de também detectada nos mesmos biomas, foi menos frequente no Pantanal (1/4 municípios), tendo sido encontrada pela primeira vez em Barão do Melgaço, correspondendo ao primeiro registro dessa espécie nesse bioma.
No bioma Floresta Amazônica, Ny. whitmani foi registrada em 86,21% (50/58) dos municípios enquanto Bi. flaviscutellata se fez presente em 44,83% (26/58).
Nos municípios com bioma Cerrado, Ny. whitmani ocorreu em 91,07% (51/56) e Bi. flaviscutellata em 50,00% (28/56).
Das espécies de importância na epidemiologia da LV, Lu. (Lut.) longipalpis foi detectada em 48,31% (57/118) dos municípios e Lu. (Lut.) cruzi, em 34,75% (41/118). Essas espécies foram encontradas em simpatria em 25,42% (30/118) dos municípios analisados (Figura 3).

Lista de municípios: 1-Acorizal, 2-Água Boa, 3-Alta Floresta, 4-Alto Araguaia, 5-Alto Boa Vista, 6-Alto Garças, 7-Alto Paraguai, 8-Alto Taquari, 9-Apiacás, 10-Araguaiana, 11-Araguainha, 12-Araputanga, 13-Arenápolis, 14-Aripuanã, 15-Barão de Melgaço, 16-Barra do Bugres, 17-Barra do Garças, 18-Bom Jesus do Araguaia, 19-Brasnorte, 20-Cáceres, 21-Campinápolis, 22-Campo Novo do Parecis, 23-Campo Verde, 24-Campos de Júlio, 25-Canabrava do Norte, 26-Canarana, 27-Carlinda, 28-Castanheira, 29-Chapada dos Guimarães, 30-Cláudia, 31-Cocalinho, 32-Colíder, 33-Colniza, 34-Comodoro, 35-Confresa, 36-Conquista D'Oeste, 37-Cotriguaçu, 38-Cuiabá, 39-Curvelândia, 40-Denise, 41-Diamantino, 42-Dom Aquino, 43-Feliz Natal, 44-Figueirópolis D'Oeste, 45-Gaúcha do Norte, 46-General Carneiro, 47-Glória D'Oeste, 48-Guarantã do Norte, 49-Guiratinga, 50-Indiavaí, 51-Ipiranga do Norte, 52-Itanhangá, 53-Itaúba, 54-Itiquira, 55-Jaciara, 56-Jangada, 57-Jauru, 58-Juara, 59-Juína, 60-Juruena, 61-Juscimeira, 62-Lambari D'Oeste, 63-Lucas do Rio Verde, 64-Luciara, 65-Marcelândia, 66-Matupá, 67-Mirassol D'Oeste, 68-Nobres, 69-Nortelândia, 70-Nossa Senhora do Livramento, 71-Nova Bandeirantes, 72-Nova Brasilândia, 73-Nova Canaã do Norte, 74-Nova Guarita, 75-Nova Lacerda, 76-Nova Marilândia, 77-Nova Maringá, 78-Nova Monte Verde, 79-Nova Mutum, 80-Nova Nazaré, 81-Nova Olímpia, 82-Nova Santa Helena, 83-Nova Ubiratã, 84-Nova Xavantina, 85-Novo Horizonte do Norte, 86-Novo Mundo, 87-Novo Santo Antônio, 88-Novo São Joaquim, 89-Paranaíta, 90-Paranatinga, 91-Pedra Preta, 92-Peixoto de Azevedo, 93-Planalto da Serra, 94-Poconé, 95-Pontal do Araguaia, 96-Ponte Branca, 97-Pontes e Lacerda, 98-Porto Alegre do Norte, 99-Porto dos Gaúchos, 100-Porto Esperidião, 101-Porto Estrela, 102-Poxoréu, 103-Primavera do Leste, 104-Querência, 105-Reserva do Cabaçal, 106-Ribeirão Cascalheira, 107-Ribeirãozinho, 108-Rio Branco, 109-Rondolândia, 110-Rondonópolis, 111-Rosário Oeste, 112-Salto do Céu, 113-Santa Carmem, 114-Santa Cruz do Xingu, 115-Santa Rita do Trivelato, 116-Santa Terezinha, 117-Santo Afonso, 118-Santo Antônio de Leverger, 119-Santo Antônio do Leste, 120-São Félix do Araguaia, 121-São José do Povo, 122-São José do Rio Claro, 123-São José do Xingu, 124-São José dos Quatro Marcos, 125-São Pedro da Cipa, 126-Sapezal, 127-Serra Nova Dourada, 128-Sinop, 129-Sorriso, 130-Tabaporã, 131-Tangará da Serra, 132-Tapurah, 133-Terra Nova do Norte, 134-Tesouro, 135-Torixoréu, 136-União do Sul, 137-Vale de São Domingos, 138-Várzea Grande, 139-Vera, 140-Vila Bela da Santíssima Trindade, 141-Vila Rica.
Figura 3 - Distribuição espacial de Lu. (Lut.) longipalpis e Lu. (Lut.) cruzi no estado de Mato Grosso, Brasil, de 2006 a 2021
Lu. (Lut.) longipalpis e Lu. (Lut.) cruzi foram localizadas nos três biomas. No bioma Floresta Amazônica, Lu. (Lut.) longipalpis ocorreu em 36,84% (21/57) e Lu. (Lut.) cruzi em 15,79% (9/57) dos municípios com predominância desse bioma. Para o Cerrado, Lu. (Lut.) longipalpis foi detectada em 32/56 (57,14%) e Lu. (Lut.) cruzi em 28/56 (50,00%) dos municípios que integram esse bioma. Ambas as espécies foram registradas em todos (4/4) os municípios do bioma Pantanal.
Entre os 118 municípios analisados neste estudo, apenas 10 (8,47%) não apresentaram as principais espécies de importância epidemiológica para LTA e LV (Figura 1).
DISCUSSÃO
Os achados do presente estudo revelam a ampliação da vigilância entomológica para flebotomíneos no Mato Grosso, partindo dos 68 municípios pesquisados por Missawa e Lima24 (1996-2004) para 118 (2006-2021). Porém, ainda se faz necessária a expansão das ações de vigilância entomológica para os demais municípios não pesquisados/silenciosos (Alto Taquari, Araputanga, Bom Jesus do Araguaia, Castanheira, Cocalinho, Conquista D'Oeste, Curvelândia, Figueirópolis D'Oeste, Glória D'Oeste, Indiavaí, Itaúba, Jauru, Lambari D'Oeste, Nova Monte Verde, Nova Nazaré, Nova Olímpia, Rio Branco, Santa Cruz do Xingu, Santo Afonso, Santo Antônio do Leste, Santa Terezinha, Tesouro e Vale de São Domingos), a fim de se atingir o estado como um todo.
Além do aumento do número de municípios pesquisados, houve incremento no quantitativo de espécies de flebotomíneos registradas, partindo de 106 espécies descritas por Missawa e Maciel22 para 132. Esse aumento pode ser decorrente da ampliação de monitoramentos entomológicos realizados tanto por serviços de saúde como por grupos de pesquisa, revelando a importância dessas atividades para o conhecimento da fauna de flebotomíneos. Essas informações são necessárias para o planejamento de medidas de prevenção e controle visando à redução do risco de transmissão das leishmanioses em Mato Grosso, pois a presença de vetores e a sua densidade espacial estão relacionadas ao menor ou maior risco de ocorrência das leishmanioses em determinada área geográfica. Dessa forma, este estudo contribui para a identificação das localidades com risco de transmissão das doenças no estado.
Missawa e Maciel22, utilizando Young e Duncan31 para classificação taxonômica, identificaram Lutzomyia goiana (Martins, Falcão & Silva, 1962) e Migonemyia baityi Damasceno, Causey & Arouck, 1945 em Mato Grosso. Utilizando a classificação taxonômica proposta por Galati32, as referidas espécies foram reclassificadas como Micropygomyia (Sauromyia) vonatzingeni (Galati, 2007) e Migonemyia (Blancasmyia) bursiformis (Floch & Abonnenc, 1944), respectivamente, fato que alterou qualitativamente a lista das espécies de flebotomíneos encontradas em Mato Grosso (Quadro 1).
Queiroz et al.36 e Moraes38 identificaram, respectivamente, Ps. wellcomei e Micropygomyia (Sauromyia) ferreirana (Barreto, Martins & Pellegrino, 1956) no município de Barra do Garças, sendo esses os primeiros registros dessas espécies no Mato Grosso. Em Cáceres, Alves et al.37 detectaram: Brumptomyia avellari (Costa Lima, 1932); Brumptomyia mangabeirai (Barreto & Coutinho, 1941); Evandromyia (Aldamyia) aldafalcaoae (Santos, Andrade Filho & Honer, 2001); Psathyromyia (Forattiniella) campograndensis (Oliveira, Andrade Filho, Falcão & Brazil, 2001); Expapillata cerradincola (Galati, Nunes, Oshiro & Dorval, 1995); e Micropygomyia (Silvamyia) echinatopharynx Andrade Filho, Galati, Andrade & Falcão, 2004. Thies et al.39 relataram Viannamyia caprina (Osorno-Mesa, Morales & Osorno, 1972) e Psychodopygus dorlinsis (Le Pont & Desjeux, 1982) em Sinop, o primeiro registro dessas espécies no Estado.
Além das principais espécies envolvidas na epidemiologia das leishmanioses1,12, outras também envolvidas no ciclo de disseminação foram registradas em Mato Grosso, como Bichromomyia olmeca bicolor (Fairchild & Theodor, 1971), Bichromomyia olmeca nociva (Young & Arias, 1982), Ny. umbratilis, Nyssomyia yuilli yuilli (Young & Porter, 1972), Trichophoromyia ubiquitalis (Mangabeira, 1942), Mg. (Mig.) migonei, Nyssomyia antunesi (Coutinho, 1939), entre outras.
A diversidade de espécies de flebotomíneos registradas em Mato Grosso (132 espécies) supera quantitativamente seus estados vizinhos do Pará (130)40, Amazonas (131)41, Tocantins (43)42, Goiás (47)43 e Mato Grosso do Sul (54)14; à exceção apenas de Rondônia, que superou esse registro, com 143 espécies44. Na Bolívia, país que faz divisa com Mato Grosso, foram registradas 121 espécies45.
Essa diversidade demonstra a adaptação desses vetores a diferentes ambientes (ecótopos, biomas), com níveis variados de interferência antrópica, seja por formas de uso e ocupação do solo, desmatamento, incêndios ou extrativismo, fatores que podem causar modificação na ecologia dos flebotomíneos26,46. O tamanho da área geográfica de Mato Grosso e a variedade de biomas (Cerrado, Floresta Amazônica e Pantanal), assim como zonas de transição, podem favorecer a diversificação da fauna de flebotomíneos, como já observado para espécies de triatomíneos47. Conhecer a fauna flebotomínica é importante, à medida que se estima que 10% dela é incriminada ou suspeita de transmitir os agentes causadores das leishmanioses48.
O Brasil é um país de grande extensão territorial, apresentando cinco biomas, o que pode explicar a diversidade de flebotomíneos43. Mato Grosso apresenta três biomas ao longo da sua área territorial, o que pode ter contribuído para uma maior riqueza de espécies registradas quando comparada a outros Estados brasileiros20,21.
Quanto ao registro de vetores de importância na epidemiologia da LTA, este estudo destacou a ampla distribuição de Ny. whitmani em Mato Grosso, percebida em 88,98% dos municípios mato-grossenses pesquisados, resultados que corroboram os achados de Zeilhofer et al.34 e Missawa et al.33.
A vasta distribuição de Ny. whitmani se reflete na ocorrência disseminada de casos humanos em 100% dos municípios mato-grossenses, bem como na manutenção e crescimento dos casos de LTA no Estado26. Ny. whitmani está envolvida na transmissão da LTA em áreas de colonização antiga, assim como em área de recente urbanização49. Segundo Souza et al.50, essa espécie está adaptada às áreas urbanas, podendo transmitir LTA tanto no peridomicílio quanto no intradomicílio, sendo frequentemente encontrada em galinheiros, sugerindo processo de adaptação ao ambiente antrópico36,51; apresenta caráter oportunista e ecletismo alimentar, ajustando seus hábitos à disponibilidade de hospedeiros nos ambientes antrópicos52.
Ny. whitmani pode ser encontrada nas cinco regiões do Brasil em associação a uma variedade de tipos de vegetação, como florestas, cerrado e caatinga, amplamente distribuída em Roraima, Acre, Tocantins e Mato Grosso do Sul53. Essa ampla distribuição e a associação com Leishmania braziliensis em diferentes regiões geográficas mostram a importância dessa espécie na epidemiologia da LTA, reforçando seu status de principal vetor em Mato Grosso, corroborando o encontro da mesma em outras áreas54,55,56.
Esses achados vetoriais demonstram a relevância de pesquisas entomológicas e reforçam a necessidade do desenvolvimento de políticas públicas de saúde, visando à prevenção e à promoção a saúde, bem como ao diagnóstico e ao tratamento oportunos dos casos humanos de LTA.
Apesar de ter sido registrada em todos os biomas estudados, Bi. flaviscutellata foi mais predominante em municípios do Cerrado mato-grossense, reforçando a necessidade de atenção quanto a sua dispersão e importância na epidemiologia da LTA no estado. Essa espécie apresenta caráter zoofílico, realiza o repasto sanguíneo em pequenos roedores dos gêneros Oryzomys e Proechimys, sendo considerada vetor da Leishmania amazonensis57. Possui como habitat áreas de floresta, podendo ser encontrada em aberturas de árvores caídas que ofereçam condições tanto para o desenvolvimento das formas imaturas como para a permanência de seus hospedeiros vertebrados58. Ocasionalmente, é encontrada invadindo o habitat peridoméstico59 e abrigos de animais domésticos60,61, explorando também, de forma diferencial, áreas degradadas geralmente ocupadas por populações humanas, propiciando o contato homem-vetor42,59.
Ao avaliar a dispersão das espécies de importância para LV em Mato Grosso, seu principal vetor, Lu. (Lut.) longipalpis, ocorreu em todos os municípios do bioma Pantanal e em 57,14% daqueles de Cerrado. Missawa e Lima24 relataram a associação dessa espécie aos biomas Floresta Amazônica e Cerrado. A manutenção de Lu. (Lut.) longipalpis possivelmente está associada ao seu ecletismo alimentar7,62,63,64,65,66.
Lu. (Lut.) cruzi também foi localizada em 100,00% dos municípios com bioma Pantanal e em 50,00% dos municípios de Cerrado, corroborando os achados de Ribeiro e Missawa67 e de Missawa e Lima24, que relataram maior frequência dessa espécie em municípios de Cerrado e Pantanal, sugerindo ser o Cerrado o ambiente preferencial dessa espécie.
Lu. (Lut.) cruzi tem importância na epidemiologia de LV em Mato Grosso35 e em Mato Grosso do Sul68. Casos de LV e de LTA foram notificados na ausência da principal espécie vetora, Lu. (Lut.) longipalpis, sendo que já há registro de infecção natural de Lu. (Lut.) cruzi por Leishmania chagasi em ambos os estados35,68, demonstrando que essa espécie pode compor a cadeia de transmissão das leishmanioses.
A ocorrência de Lu. (Lut.) longipalpis e Lu. (Lut.) cruzi com ampla distribuição nos diferentes biomas de Mato Grosso, confirma o caráter generalista dessas espécies, adaptadas a habitats diversificados69.
Outra espécie com presença constante em áreas endêmicas para LTA é Ny. umbratilis70, considerada um dos principais vetores de Leishmania (Viannia) guyanensis na maior parte da América Latina, em países como Brasil, Bolívia, Colômbia, Peru, Venezuela, Suriname e Guiana Francesa, bem como na Região Amazônica71. Já, Mg. (Mig.) migonei é um vetor permissivo, sendo capaz de se infectar com várias espécies de Leishmania72, também encontrado no Estado.
Uma espécie de Leishmania pode ser transmitida por diferentes espécies de flebotomíneos (Diptera: Psychodidae: Phlebotominae) em diferentes regiões geográficas e biomas43. A presença das espécies de flebotomíneos de importância médica, nos distintos biomas do estado, revela áreas vulneráveis e/ou receptivas para a transmissão das leishmanioses em todos os municípios mato-grossenses pesquisados.
CONCLUSÃO
Este estudo revelou elevada diversidade de flebotomíneos em Mato Grosso, classificando-o como o segundo estado brasileiro com o maior número de espécies distintas.
Foi possível verificar a ampliação da vigilância entomológica no estado com o transcorrer dos anos, assim como um incremento no número de espécies identificadas, as quais podem estar envolvidas e/ou incriminadas na transmissão de leishmanioses em Mato Grosso.
Assim, estudos de vigilância entomoepidemiológica, especialmente voltados ao conhecimento da fauna flebotomínica e seu comportamento, proverão subsídios para embasar serviços de saúde frente às atividades de prevenção e promoção efetivas da saúde, visando ao controle das leishmanioses.
Reforça-se ainda a importância do trabalho integrado entre as Secretarias Municipais de Saúde e a Secretaria de Estado de Saúde, permitindo otimizar os recursos e efetivar as ações de controle do vetor em tempo oportuno, diminuindo assim o risco de transmissão da doença ao garantir a melhoria da qualidade de vida da população.











 texto em
texto em 


