Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.3 Ananindeua set. 2010
http://dx.doi.org/10.5123/S2176-62232010000300010
Culicoides Latreille (Diptera: Ceratopogonidae) da vila de Alter do Chão, Santarém, Pará, Brasil
Fábio Daniel Florêncio da SilvaI; Yukari OkadaII; Maria Luiza Felippe-BauerIII
ILaboratório
de Polimorfismo de DNA, Instituto de Ciências Biológicas,
Universidade Federal do Pará, Belém, Pará, Brasil
IILaboratório de Zoologia, Faculdade de Ciências Biológicas,
Universidade Federal do Pará, Santarém, Pará, Brasil
IIILaboratório de Diptera, Instituto Oswaldo Cruz, Rio de Janeiro, Rio
de Janeiro, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Culicoides Latreille (Diptera: Ceratopogonidae) da vila de Alter do Chão, Santarém, Pará, Brasil. Traducido por: Lota Moncada
RESUMEN
El objetivo de este estudio es listar la fauna de Culicoides Latreille y registrar su distribución estacional en una zona de playa de la villa de Alter do Chão (Município de Santarém, Estado de Pará, Brasil). Las colectas se hicieron mensualmente, entre mayo del 2006 y abril del 2007, utilizando atracción humana y trampa luminosa modelo CDC. Se recolectaron 58 ejemplares de maruins pertenecientes a cinco especies: C. crucifer Clastrier, C. insinuatus Ortiz & Leon, C. fusipalpis Wirth & Blanton, capturados con atracción humana; C. insignis Lutz con trampa CDC, y C. ruizi Forattini, colectados con las dos técnicas. C. crucifer fue la especie más abundante picando a humanos, mientras que C. insignis fue, predominantemente, recolectada en trampa CDC. La mayor incidencia de Culicoides sucedió en octubre del 2006. Durante el registro, no se evidenció correlación entre los factores climáticos y los meses de colecta por medio del coeficiente de Spearman.
Palabras clave: Culicoides; Insectos Vectores; Ecosistema; Demografía.
INTRODUCCIÓN
La familia Ceratopogonidae comprende pequeños dípteros nematóceros clasificados en 109 géneros distribuidos en cerca de 5.925 especies1. Apenas cuatro géneros (Austroconops Wirth y Lee, endémico de Australia, y los cosmopolitas Leptoconops Skuse, Forcipomyia Meigen del subgénero Lasiohelea Kieffer y Culicoides Latreille) tienen hembras hematófagas2. Los ceratopogónidos hematófagos poseen diversas denominaciones en el continente americano, siendo popularmente conocidos en Brasil como "maruim" (jejenes), "mosquito-pólvora" (polvorines) y "mosquitinho de mangue" (mosquitos de manglar)3.
Culicoides es el género más abundante, tanto en número de especies como de individuos, y también el más bien distribuido, pudiendo ser encontrado en diversos tipos de ambientes4. Las larvas pueden desarrollarse en charcos, corrientes de agua, bañados, lodazales, playas, pantanos, huecos de árboles, irrigaciones, suelos saturados, estiércol de animales y tejidos de frutas u otros vegetales en descomposición. Las hembras emprenden el vuelo para buscar compañeros sexuales, alimentación sanguínea o un sitio para oviposición. La extensión del vuelo de los Culicoides es usualmente corta y la mayoría de las especies se dispersa a pocas centenas de metros de sus sitios de cría, o un poco más que 2 a 3 km5.
Algunas especies de Culicoides buscan el repasto sanguíneo durante el dia aún bajo fuerte irradiación solar, pero la mayoría de las especies prefiere el crepúsculo o la noche como períodos de alimentación6. Pueden atacar tanto a hombres como a animales, sus picadas son irritantes o dolorosas y, donde quiere que existan en gran número, se vuelven verdaderas plagas para humanos, ganado y animales silvestres7. Son reconocidos vectores de protozoarios y nemátodos para aves y mamíferos y de virus para el hombre y para los rumiantes silvestres y domésticos3.
Enfermedades veterinarias, como encefalitis, oncocercosis equina y lengua azul, son transmitidas por diferentes especies de Culicoides. La microfilaria Mansonella ozzardi (Manson) y el virus Oropouche han sido transmitidos a los humanos por Culicoides paraensis (Goeldi). Según Nunes y colaboradores8, la virosis Oropouche es la única que ha sido señalada en Brasil, con acentuada importancia sanitaria, en áreas urbanas y silvestres de diversos Estados de la Región Amazónica brasileña. Pero M. ozzardi, encefalitis, oncocercosis equina, entre otras, también pueden estar ocurriendo en el territorio nacional.
Han sido desarrollados pocos estudios sobre la fauna de jejenes de la Región Amazónica brasileña. El trabajo más amplio fue realizado por Wirth y Blanton9, en el que se describieron15 nuevas especies de una lista de 60 registros de especies para esa región. Posteriormente, Felippe-Bauer y colaboradores10,11 describieron dos nuevas especies para los Estados de Amazonas y de Acre. Castellón y colaboradores,realizaron trabajos de registro de Culicoides en la Reserva Forestal Ducke12, en Cachoeira Porteira13 y Cachoeira dos Espelhos, Estado de Amazonas14; Trindade y Gorayeb15 realizaron el registro de jejenes en dos áreas de la costa paraense. Barros y colaboradores16 registraron las especies de jejenes de la Región Metropolitana de São Luís, Estado de Maranhão, observando la actividad hematofágica de esos insectos en los mamíferos y aves de las áreas estudiadas. Trindade y Gorayeb17 registraron nueve especies de Culicoides en la Reserva de Desarrollo Sustentable Itatupã-Baquiá, Municipio de Gurupa, Estado de Pará.
El objetivo de este trabajo es el de registrar la fauna de Culicoides de una zona de playa en la villa Alter do Chão, en Santarém, Estado de Pará, y registrar su distribución estacional en un período de 12 meses.
MATERIALES Y MÉTODOS
El Municipio de Santarém presenta un área de 22.887 km2 y una población total de 276.074 habitantes18. En la hidrografía del Municipio, el principal río es el Tapajós, que corre en sentido sur-norte, en su curso inferior. Las colectas de jejenes se realizaron en la Reserva Forestal Centro Agroextractivista de la Amazonia (CAAM) - 02o30.640'S 54o56.146'W - que posee un área total de 33 hectáreas de vegetación secundaria (Figura 1). La región presenta dos períodos climáticos distintos: la estación de lluvias (enero a junio) y la seca (julio a diciembre).
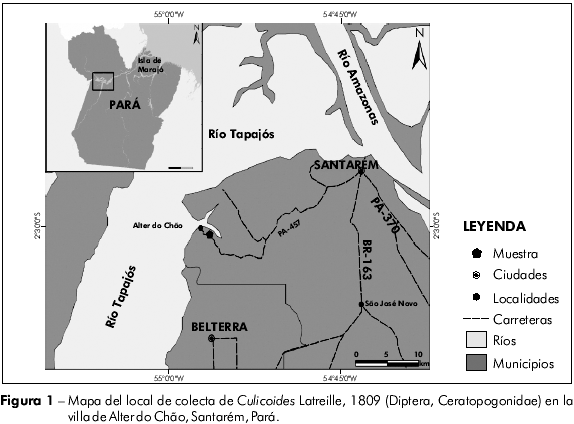
Las capturas se hicieron mensualmente, durante dos días consecutivos, de mayo del 2006 a abril del 2007, utilizándose atracción humana y trampa luminosa modelo CDC (Centers for Disease Control). Las colectas por atracción humana fueron realizadas en dos horarios: de las 6 h a las 12 h y de las 16 h a las 20 h. Las capturas con trampas CDC fueron en el período nocturno, entre 18 h y 6 h. Se instalaron dos trampas CDC en el área abierta de la playa, en frente al cuerpo de agua. No había otras fuentes de luz en el local, a excepción de algunas pocas colectas que coincidieron con períodos de luna nueva. Luego de la colecta, el material se llevó al Laboratorio de Zoología de la Universidade Federal do Pará, en donde se realizó la selección de los insectos con el auxilio de microscopio estereoscópico. Allí fueron conservados en frascos con etanol a 70%, etiquetados y enviados al Laboratorio de Díptera del Instituto Oswaldo Cruz, de Rio de Janeiro, para identificación, en donde están depositados. El pH del agua de la playa fue medido una única vez, al final de las colectas. Los promedios mensuales de temperatura (oC), insolación (W/m2), precipitación (mm de Hg) y humedad relativa del aire (%), se obtuvieron en el proyecto Large Scale Biosphere-Atmosphere Experiment in Amazonia (LBA). La frecuencia mensual de los Culicoides y los datos climáticos fueron analizados por el coeficiente de correlación de Spearman (rs)19 , utilizando el programa BioEstat 4.0.20
RESULTADOS Y DISCUSIÓN
Se capturaron 58 ejemplares de Culicoides distribuidos en cinco especies (Tabla 1). Las especies capturadas por atracción humana fueron C. crucifer Clastrier, C. insinuatus Ortiz & Leon, C. ruizi Forattini y C. fusipalpis Wirth & Blanton, con, respectivamente, 69%, 14%, 14% y 3% del total de ejemplares capturados por esta técnica. C. insignis Lutz y C. ruizi Forattini fueron las únicas especies colectadas por medio de trampa luminosa CDC con, respectivamente, 93% y 7% de los ejemplares capturados por este método. De todos los Culicoides encontrados, 88% eran hembras y 12% machos. Castellón12 colectó, en la reserva forestal Ducke en Manaus, Amazonas, seis especies utilizando atracción humana, y la más abundante fue C. todatangae Wirth & Blanton. También se encontró C. fusipalpis en los Estados de Amazonas y Pará por Castellón y colaboradores13,21 con trampa CDC, y por Castellón y Ferreira14 con atracción humana. Veras22, utilizando diversos tipos de trampas, encontró en la reserva forestal Ducke, C. fusipalpis y C. insignis, comunes en nuestro registro, siendo la primera especie la más abundante. En el estudio hecho en el nordeste de Pará, Trindade y Gorayeb15 utilizando atracción humana y trampa CDC, también encontraron C. crucifer y C. insignis. Barros y colaboradores16 identificaron cuatro especies en el Estado de Maranhão, siendo C. phlebotomus y C. paraensis las más frecuentes, colectadas con trampa CDC. Trindade y Gorayeb17 registraron la especie C. insinuatus y Trindade23 colectó todas las especies identificadas en este estudio. Ambos trabajos se realizaron en el Estado de Pará.

A pesar de C. insignis ser la especie más abundante, no fue capturada por atracción humana (Tabla 1). C. crucifer fue la especie que más forrajeó en la zona de playa. Según Trindade y Gorayeb15, esa especie era citada como ocurriendo apenas en Trinidad y Tobago, en Guayana y Guayana Francesa, pero su distribución se amplió al norte de Brasil.
La figura 2 revela la distribución estacional de Culicoides, capturados por atracción humana y trampa CDC, en el período de mayo del 2006 a abril del 2007. Se observó la presencia constante de Culicoides en este período, a excepción del mes de agosto de 2006, cuando ningún espécimen fue colectado. En octubre del 2006 se registró la mayor abundancia de estos dípteros, capturados principalmente con CDC.
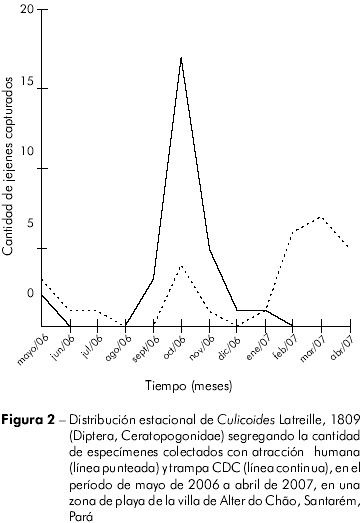
Los promedios de temperatura variaron poco, lo que seguramente es adecuado para un rápido desarrollo larval. En octubre de 2006, debido al estiaje, el río Tapajós estaba bajo, cuando quedaron expuestos extensos sustratos para desarrollo larval adyacentes a la playa. Durante los meses de febrero a abril de 2007, hubo un ligero aumento en el número de Culicoides colectados por atracción humana; esos meses presentaron los más grandes promedios de precipitación, humedad relativa del aire y los menores promedios de insolación y temperatura ambiente (Figura 3). Veras y Castellón24 registraron un mayor pico poblacional de Culicoides en diciembre de 1990 y enero de 1991, meses de elevada precipitación y humedad, mientras que en los meses secos y calurosos los Culicoides fueron poco frecuentes.
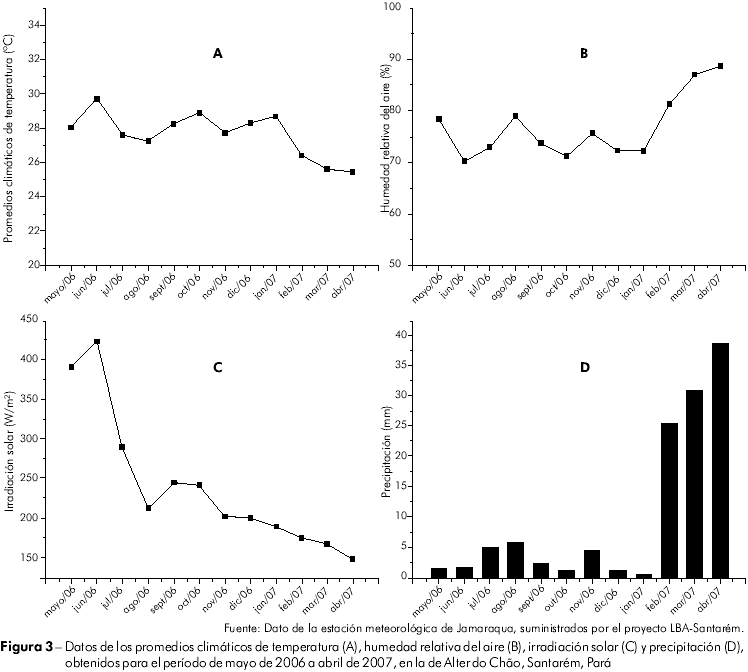
Los resultados de los análisis del coeficiente de correlación de Spearman (rs) indicaron que la estacionalidad de los Culicoídes (datos acumulados de todas las especies) no presentó correlación con los factores climáticos analizados (temperatura, humedad relativa del aire, insolación y pluviosidad). Debe llevarse en consideración que otros factores ambientales influyen en la fluctuación poblacional de esos dípteros, como la velocidad del viento, que no ha sido considerada en este trabajo. Veras y Castellón24 mostraron poca interferencia de los factores climáticos en la estacionalidad de cada especie colectada. Para esos autores, la ausencia de correlación entre la frecuencia de los Culicoides y los factores climáticos no está directamente relacionada a los efectos del clima. Es necesario considerar hipótesis alternativas, principalmente en lo que respecta a los sitios de cría larval. Las primeras lluvias pueden favorecer la oviposición en locales seguros como márgenes de ríos, pero, después de algún tiempo, la acción de predadores, como larvas de odonatos y girinos, pueden interferir en la dinámica poblacional de esos dípteros.
A pesar de no haberse hallado correlación entre los factores climáticos y la fluctuación estacional de Culicoides, y del bajo número de ejemplares capturados, se observó que existen dos grupos de especies (Figura 2): uno que presentó picos de actividad en el mes de octubre de 2006, cuando la precipitación fue la más baja del período analizado, incluyendo las especies C. insignis y C. ruizi; C. insinuatus probablemente está incluida en este grupo, aunque solamente fue capturado un ejemplar; y otro grupo que presentó picos de actividad en los meses de marzo y abril de 2007, cuando la precipitación estaba alta y la humedad relativa del aire fue la más alta del período, y la temperatura y la insolación fueron las más bajas, incluyendo las especies C. crucifery C. insinuatus.
En el curso de los 12 meses, con apenas 58 especímenes colectados, se sospecha que la población de Culicoides sea pequeña en la comunidad de la zona de playas de Alter do Chão. La acidez del río, en esta área, fue medida y estaba alrededor de pH = 5,15, lo que podría estar dificultando el desarrollo de las fases inmaduras. Según Wirth y Blanton6 muchas especies tienen un adecuado desarrollo larval y muchas otras emergen, preferentemente, de aguas con pH superior a 6,5. Las colectas en la zona de playas fueron realizadas en un ambiente preservado, con un mínimo de acción antrópica, no habiendo actividades de pecuaria o agricultura que, comúnmente, favorecen la presencia de ciertas especies de jejenes. La especie C. insignis, capturada en el presente estudio, es considerada como uno de los principales vectores del virus de la lengua azul en América Central y del Sur23. C. paraensis Goeldi, especie vector del virus Oropouche, no fue colectada en este trabajo. De acuerdo con Linley, Hoch y colaboradores2,25,26, C. paraensis está asociada a plantaciones de banana y cacao, que no existen en el área de la investigación. Para análisis más esmerados de la fauna de Culicoides en la Amazonía, sugerimos colectas con diferentes trampas y cebos, realizando muestreo de zonas periurbanas y agropecuarias.
CONCLUSIÓN
Por el método de atracción humana fueron capturadas las especies C. crucifer, C. insinuatus, C. ruizi y C. fusipalpis. Con la trampa CDC se colectaron C. insignis y C. ruizi. C. crucifer fue la especie más abundante por atracción humana, mientras que en la trampa CDC, C. insignis fue la más abundante. C. ruizi fue la única especie capturada por los dos métodos de colecta. Los Culicoides estuvieron presentes en la mayoría de los meses muestreados, a excepción de agosto del 2006. Esos dípteros fueron más frecuentes en octubre del 2006 capturados con trampa CDC, probablemente en consecuencia de la disponibilidad de sitios, adyacentes a la playa adecuados al desarrollo de las larvas. Durante los meses de febrero a abril de 2007, ocurrió un leve aumento en el número de Culicoides colectados por atracción humana. Esos meses presentaron promedios mayores de precipitación, humedad relativa del aire y menores promedios de insolación y temperatura. No se detectó correlación entre la variación mensual de los factores climáticos y la estacionalidad de los Culicoides, analizando los datos acumulados de las especies.
AGRADECIMIENTOS
Los autores agradecen al Prof. Dr. Rodrigo da Silva, de la Universidad Federal del Oeste de Pará, y proyecto LBA-Santarém, por el suministro de los datos meteorológicos. A la Profa. Dra. Lenise da Silva (UFOPA), por los consejos en el manuscrito. Al biólogo Evaldo Costa, de la División de Endemias, y al técnico de entomología, Djalma Costa, de la Secretaría de Estado de Salud Pública (Sespa), por el préstamo de trampas luminosas CDC. Al médico veterinario Jairo Moura del proyecto CAAM, por la liberación del área para investigación. La coautora Felippe-Bauer agradece al CNPq. Por el apoyo financiero para el estudio de la biodiversidad de los ceratopogónidos en la Amazonía brasileña.
REFERENCIAS
1 Borkent A, Spinelli GR. Neotropical Ceratopogonidae (Diptera: Insecta). In: Adis J, Arias JR, Ruenda-Delgado G, Wantzen KM, editors. Aquatic Biodiversity in Latin America. Moscow: Pensoft Publishers; 2007. p. 198.
2 Linley JR, Hoch AL, Pinheiro FP. Biting midges (Diptera: Ceratopogonidae) and human health. J Med Entomol. 1983 Jul;20(4):347-64.
3 Felippe-Bauer ML. A importância do padrão das manchas das asas em Culicoides (Latreille, 1809) (Diptera: Ceratopogonidae): sua limitação. Entomol Vect. 2003;10(4):595-600.
4 Kettle DS. The bionomics and control of Culicoides and Leptoconops (Diptera, Ceratopogonidae = Heleidae). Ann Rev Entomol. 1962;7:401-18. [ Links ]
5 Mellor PS, Boorman J, Baylis M. Culicoides biting midges: their role as arbovirus vectors. Annu Rev Entomol. 2000;45:307-40. [ Links ]
6 Wirth WW, Blanton FS. Arthropods of Florida and Neighboring Land Areas. The Sand Flies (Culicoides) of Florida (Diptera: Ceratopogonidae). Gainesville: Department of Agriculture and Consumer Services; 1979. 204 p.
7 Downes JA, Wirth WW. Ceratopogonidae. In: McAlpine JF, editor. Manual of Neartic Diptera. Quebec: Research Branch Agriculture Canada; 1981. p. 393-421.
8 Nunes MR, Martins LC, Rodrigues SG, Chiang JO, Vasconcelos PF, Rosa AP, et al. Oropouche Virus Isolation, Southeast Brazil. Emerg Infect Dis. 2005 Oct;11(10):1610-3. [ Links ]
9 Wirth WW, Blanton FS. A review of the maruins or biting mi dges of the genus Culicoides (Diptera: Ceratopogonidae) in the Amazon Basin. Amazoniana. 1973;4:405-70.
10 Felippe-Bauer ML, Veras RS, Castellón EG, Moreira NA. A new Culicoides from the Amazonian region, Brazil (Diptera: Ceratopogonidae). Mem Inst Oswaldo Cruz. 2000 Jan-Feb;95(1):35-7. Doi:10.1590/S0074-02762000000100004 [ Links ]
11 Felippe-Bauer ML, Damasceno CP, Py-Daniel V, Spinelli GR. Culicoides baniwa sp.nov. from the Brazilian Amazon Region with a synopsis of the hylas species group (Diptera: Ceratopogonidae). Mem Inst Oswaldo Cruz. 2009 Sep;104(6):851-7. DOI:10.1590/S0074-02762009000600005 [ Links ]
12 Castellón EG. Culicoides (Diptera: Ceratopogonidae) na Amazônia brasileira. II. Espécies coletadas na Reserva Florestal Ducke, aspectos ecológicos e distribuição geográfica. Acta Amaz. 1990;20:83-93.
13 Castellón EG, Ferreira RLM, Silva MNT. Culicoides (Diptera: Ceratopogonidae) na Amazônia brasileira. I. Coletas na usina hidrelétrica (UHE) de Balbina, usina hidrelétrica (UHE) Cachoeira Porteira e Cachoeira dos Espelhos (Rio Xingú). Acta Amaz. 1990;20:77-81.
14 Castellón EG, Ferreira RM. Culicoides Latreille (Diptera: Ceratopogonidea) da Amazônia. III. Resultados de coletas noturnas, na Reserva Florestal Ducke, Estado do Amazonas, Brasil. Bol Mus Para Emilio Goeldi. 1991;7(2):117-23.
15 Trindade RS, Gorayeb IS. Maruins (Ceratopogonidae: Diptera) do estuário do Rio Pará e do litoral do Estado do Pará, Brasil. Entomol Vect. 2005 jan-mar;12(1):61-74. DOI:10.1590/S0328-03812005000100005 [ Links ]
16 Barros VLL, Marinho RM, Rebêlo JMM. Ocorrência de espécies de Culicoides Latreille (Diptera, Ceratopogonidae) na área metropolitana de São Luís, Maranhão, Brasil. Cad Saude Publica. 2007;23(11):2789-90. DOI:10.1590/S0102-311X2007001100026 [ Links ]
17 Trindade RL, Gorayeb IS. Maruins (Diptera: Ceratopogonidae: Culicoides), após a estação chuvosa, na Reserva de Desenvolvimento Sustentável Itatupã-Baquiá, Gurupá, Pará, Brasil. Rev Pan-Amaz Saude. 2010;1(2):121-30. DOI:10.5123/S2176-62232010000200015 [ Links ]
18 Instituto Brasileiro de Geografia e Estatística. 2000 [Internet]. 2007. Disponível em: www.ibge.gov.br.
19 Vieira S. Bioestatística: tópicos avançados. 2. ed. Rio de Janeiro: Ed. Campus Ltda; 2004. 216 p.
20 Ayres M, Ayres MJ, Ayres DL, Santos AS. BioEstat 4.0: aplicações estatísticas nas áreas das ciências biomédicas. Belém: Sociedade Civil Mamirauá, Ministério da Ciência e Tecnologia, Imprensa Oficial do Estado do Pará; 2005. 324 p.
21 Castellón EG, Ferreira RLM, Silva MNT. Culicoides (Diptera: Ceratopogonidae) in the Brazilian Amazon. IV. Species collected with CDC light trap in the Ducke Forest Reserve (RFD), Amazon State, Brazil. Acta Amaz. 1993;23(2-3):309-10.
22 Veras RS. Levantamento da fauna de Culicoides (Diptera: Ceratopogonidae) na reserva florestal Adolpho Ducke (Manaus - AM), usando diferentes tipos de armadilhas e iscas [Dissertação]. Manaus (AM): Instituto Nacional de Pesquisas da Amazônia / Universidade Federal do Amazonas; 1995.
23 Trindade RL. Maruins (Diptera: Ceratopogonidae) do Leste do Pará, com ênfase nas espécies da Serra das Andorinhas, município de São Geraldo do Araguaia, Pará, Brasil [Tese]. Belém (PA): Universidade Federal do Pará/Museu Paraense Emílio Goeldi; 2010.
24 Veras RS, Castellón EG. Culicoides Latreille, 1809 (Diptera: Ceratopogonidae) in brazilian Amazon. V. Efficiency of traps and baits and vertical stratification in the forest reserve Adolpho Ducke. Rev Bras Zool. 1998;15(1):145-52. DOI:10.1590/S0101-81751998000100012 [ Links ]
25 Hoch AL, Roberts DR, Pinheiro FP. Criaderos de Culicoides paraensis y opciones para combatirlos mediante el ordenamiento del medio. Bol Sanit Panam. 1987 jul;103(1):10-20. [ Links ]
26 Hoch AL, Roberts DR, Pinheiro FP. Host-seeking behavior and seasonal abundance of Culicoides paraensis (Diptera: Ceratopogonidae) in Brazil. J Am Mosq Contr Assoc. 1990;6(1):110-4.
 Correspondência / Correspondence /
Correspondencia:
Correspondência / Correspondence /
Correspondencia:
Fábio Daniel Florêncio da Silva
Laboratório de Polimorfismo de DNA,
Instituto de Ciências Biológicas,
Universidade Federal do Pará
Av. Augusto Corrêa, no 01. Bairro: Guamá
CEP:66075-900 Belém-Pará-Brasil
Tels.: (91) 3201-8411 / (91) 8139-7897
E-mail:fabiodaniel@ufpa.br, fabio_daniel2002@yahoo.com.br
Recebido em / Received / Recibido en: 10/6/2010
Aceito
em / Accepted / Aceito en: 30/9/2010











 texto em
texto em 

