Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.3 Ananindeua set. 2010
http://dx.doi.org/10.5123/S2176-62232010000300014
ARTÍCULO ORIGINAL
Seroprevalencia del virus linfotrópico de células T humanas en comunidades ribereñas de la región nordeste del Estado de Pará, Brasil
Louise de Souza Canto FerreiraI; Jaqueline Helen Godinho CostaII; Carlos Araújo da CostaIII; Marly de Fátima Carvalho de MeloIV; Marizete Lopes AndradeV; Luisa Carício MartinsIII; Edna Aoba Yassui IshikawaIII; Maisa Silva de SousaIII
IFaculdade de Farmácia, Centro Universitário do Pará, Belém, Pará, Brasil
IIFaculdade de Ciências Biológicas, Instituto de Ciências da Saúde, Universidade Federal do Pará, Belém, Pará, Brasil
IIINúcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
IVPrograma Luz na Amazônia, Faculdade de Farmácia, Instituto de Ciências da Saúde, Universidade Federal do Pará, Belém, Pará, Brasil
VPrograma Luz na Amazônia, Sociedade Bíblica do Brasil, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Soroprevalência do vírus linfotrópico de células T humanas em comunidades ribeirinhas da região nordeste do Estado do Pará, Brasil. Traducido por: Lota Moncada
RESUMEN
El virus-T linfotrópico humano del tipo 1 (HTLV-1) fue el primer retrovirus humano a ser identificado y está asociado a varias enfermedades debilitantes. El Estado de Pará es el tercero de Brasil con mayor frecuencia de la infección por HTLV entre donantes de sangre. Las comunidades ribereñas carecen de acciones de educación y asistencia a la salud, por la característica de sus viviendas, esparcidas a lo largo de los ríos y cursos de agua, y por la dificultad de acceso a los centros urbanos. Este estudio tuvo como objetivo investigar la infección causada por el HTLV en comunidades ribereñas del nordeste paraense, atendidas por el Programa Luz en la Amazonia, entre febrero de 2009 y junio de 2010. Fue realizada una investigación de anticuerpos anti-HTLV-1/2 en 175 ribereños, siendo 30 (17,14%) de la comunidad de São Pedro (Acará); 62 (35,43%) de la comunidad del Furo do Aurá (Belém) y 83 (47,43%) de Santa Maria (Acará). En los casos reactivos, se utilizaron métodos de biología molecular para confirmar la infección e identificar el tipo viral. La prevalencia total del HTLV-1 fue de 1,14% (2/175), variando entre cero (0/34) en São Pedro, 1,20% (1/83) en Santa Maria y 1,61% (1/62) en el Furo do Aurá. El HTLV-1 fue identificado en dos de las 117 (1,71%) familias analizadas de las tres comunidades. No se observó ningún caso de transmisión familiar en la muestra. El HTLV-2 no fue hallado en la muestra estudiada. Este estudio demostró la ocurrencia de HTLV-1 en las comunidades ribereñas estudiadas, con frecuencias similares a las de las poblaciones urbanas, indicando la necesidad de una mayor investigación y de acciones de prevención de las enfermedades asociadas al virus en esas comunidades.
Palabras clave: Deltaretrovirus; Estudios Transversales; Estudios Seroepidemiológicos; Prueba ELISA.
INTRODUCCIÓN
Los virus linfotrópicos humanos de células T (HTLV) pertenecen a la familia Retroviridae, a la subfamilia Orthoretrovirinae y al género Deltaretrovirus. Evidencias epidemiológicas consistentes señalan al HTLV-1 como agente asociado a enfermedades como: Leucemia/ Linfoma de Células T del Adulto conocida como LLTA o ATL, Paraparesia Espástica Tropical/ Mielopatía Asociada al HTLV-1 conocida como PET/MAH o TSP/HAM, uveítis y dermatitis infectiva1,2,3. Con relación al HTLV-2, raramente se lo ha asociado a esas enfermedades4. Y apenas entre 1 % y 4% de los individuos infectados desarrollará algún tipo de enfermedad debilitante asociada al virus5.
El HTLV ocurre en todo el mundo, pero su distribución varía de acuerdo con la región geográfica. El HTLV-1 es endémico en Japón, el Caribe, África, América del Sur y las islas de la Melanesia6. En Brasil, se estima que 2,5 millones de personas estén infectadas. El vírus está presente en todos los Estados aunque con prevalencia variada. La Ciudad de Salvador presenta la mayor población de seropositivos para HTLV entre los donantes de sangre de Brasil7,8.
La transmisión de ese virus puede suceder de cuatro formas: por contacto sexual; de madre para hijo, por el amamantamiento; por transfusión de sangre; y por medio de jeringas y agujas conteniendo células infectadas con el virus2,7,8. El contacto celular es necesario para que haya transmisión eficiente entre células e individuos9. Estimativas señalan que, aproximadamente, de 10 a 20 millones de personas están infectadas por el HTLV-1 en el mundo. La infección por ese virus tiene un período de latencia prolongado, pudiendo durar algunas décadas o toda la vida del individuo infectado7.
La mayoría de las comunidades ribereñas de la región amazónica tiene dificultad para obtener asistencia de todo y cualquier tipo, principalmente de acciones de salud, por la característica de las familias estar esparcidas en islas o al margen de igarapés (arroyos) y furos (pequeños canales), sin fácil acceso a los centros urbanos. Este estudio identificó la frecuencia y distribución del HTLV-1/2 en comunidades ribereñas, con el objeto de minimizar la propagación de esa infección y la ocurrencia de enfermedades asociadas.
MATERIALES Y MÉTODOS
Entre febrero de 2009 y junio de 2010 el Programa Luz en la Amazonia atendió a tres comunidades ribereñas: São Pedro y Santa Maria, en el Municipio de Acará y la comunidad del Furo do Aurá, del Municipio de Belém. El referido programa es una colaboración entre la Sociedade Bíblica do Brasil (SBB) y la Universidade Federal do Pará (UFPA) y, con la ayuda de voluntarios, desarrolla acciones de promoción de la salud en comunidades ribereñas de la región nordeste del Estado de Pará.
Se realizó una investigación serológica para HTLV en familias registradas en las tres comunidades ribereñas atendidas en el periodo del estudio, siendo 28 familias de la comunidad de São Pedro (con 30 individuos), 46 familias de la comunidad de Santa Maria (con 83 individuos) y 43 familias del Furo do Aurá (con 62 individuos), correspondiendo a un total de 175 individuos. Fueron incluidos en el estudio individuos de ambos sexos, mayores de 18 años de edad, residentes en la comunidad, priorizando los representantes adultos de cada familia.
Los ribereños encuadrados en los criterios de inclusión fueron orientados y convidados a participar del estudio y se firmó el Término de Consentimiento Libre y Esclarecido. El proyecto de investigación fue analizado y aprobado por el Comité de Ética en Investigación en Seres Humanos, según el protocolo de no 071/2006-CEP/NMT.
Se realizaron charlas sobre los objetivos de la investigación en todas las comunidades y las muestras de sangre se colectaron después de obtener el consentimiento de cada individuo. El cuestionario epidemiológico fue completado en el momento de la colecta de la muestra sanguínea, identificando variables como edad, género, histórico de transfusiones sanguíneas o de hemoderivados y el uso de drogas inyectables, entre otros. Todas las muestras de sangre colectadas fueron analizadas por el método de ensayo inmunoenzimático (ELISA), para la detección de anticuerpos anti-HTLV-1/2 (Ortho®, USA), de acuerdo a las instrucciones del fabricante. Las muestras con resultados reactivos y con valores próximos a los del cutoff, fueron probadas por duplicado.
Las muestras consideradas positivas por ELISA se analizaron por la técnica de reacción en cadena de la polimerasa (PCR), seguida de digestión enzimática para confirmar la infección y diferenciación de los tipos 1 y 2 de HTLV. La técnica emplea la detección del ADN proviral por la amplificación de la región Px del virus. Para la reacción PCR se utilizó solución con 5,0 mL de Go Taq® Green Master Mix, 2,0 µL de agua, 1 (10 pmol) de cada primer HTLV_Externo F 5'-TTCCCAGGGTTTGGACGAAG-3' (7219-7238, directo) y HTLV_Externo R 5'-GGGTAAGGACCTTGAGGGTC-3' (7483-7464, reverso) y 1,0 µL de ADN, para un volumen final de 10 µL. El protocolo para amplificación siguió la temperatura de desnaturación de 94o C por 4 min, seguida de 30 ciclos (repeticiones), en los cuales la temperatura de desnaturación fue de 94o C por 40 seg, la temperatura de anelamiento a 51,6o C por 30 seg y finalmente, la temperatura de extensión a 72o C por 40 seg, seguida de la temperatura de extensión final de 72o C, 10 min, y 10o C por 10 min10.
La identificación molecular del genoma viral se realizó por nested-PCR, utilizando las mismas cantidades de reactivos de la primera PCR y 1µL (10 pmol) de cada primer HTLV_interno F 5'CGGATACCCAGT CTACGTGTT3' (7248-7268, directo) y HTLV_interno R 5'GAGCCGATAACGCGTCCATCG3' (7406-7386, reverso). El protocolo de amplificación se continuó en 35 ciclos (repeticiones), con temperatura de desnaturación de 94o C por 30 seg, la temperatura de anelamiento de 51,6o C por 30 seg y la temperatura de extensión por 72o C por 30 seg, seguido de la temperatura de extensión final a 72o C, 10 min, y 10o C por 10 min10.
Todas las muestras de ADN fueron previamente amplificadas para un fragmento del gen de globina humana, utilizando las mismas condiciones de reactivos, con excepción de los oligonucleótidos específicos para VPH, que fueron sustituidos por los oligonucleótidos G73 y G7411. Fueron utilizados controles positivos (muestra sabidamente positiva) e negativos (agua estéril) a cada reacción de PCR.
Después de la identificación de los casos con resultados de PCR positivos, se realizó la digestión enzimática de los mismos, para identificar el tipo de HTLV presente en la muestra. La reacción enzimática utilizó la enzima Taq I (Promega®) siguiendo las recomendaciones del fabricante. A cada reacción enzimática se utilizó un control positivo para HTLV-2. Los productos de PCR y de digestión enzimática fueron visualizados en gel de agarosa a 2% y a 3%, respectivamente, conteniendo bromuro de etidio (1 mg/mL), bajo luz UV.
Los comunicantes y familiares de los individuos confirmados con infección viral fueron investigados con relación a la transmisión familiar del HTLV-1/2, obedeciendo a los criterios de investigación del cónyugue, madre e hijos, cuando la persona infectada era del sexo femenino; y cónyugue y madre, cuando era del sexo masculino.
RESULTADOS
La investigación serológica para HTLV-1/2 se realizó en 117 de las 149 (78,52%) familias registradas en el programa Luz en la Amazonia, en el período de enero de 2009 a junio de 2010, siendo 28 familias de la comunidad de São Pedro (30 individuos), 46 familias de Santa Maria (83 individuos) y 43 del Furo do Aurá (62 individuos), correspondiendo a un total de 175 individuos.
El tabla 1 demuestra la distribución, por franja etaria y por género, de la demanda de 175 ribereños que participaron del estudio: con edades variando de 18 a 85 años y promedio de 41 años; con un 93,14% (1 63/175) de las personas con edad igual o superior a 20 años. Se identificó también, una mayor frecuencia, 58,28% (102/175), de individuos del sexo femenino en la muestra analizada en las tres comunidades.
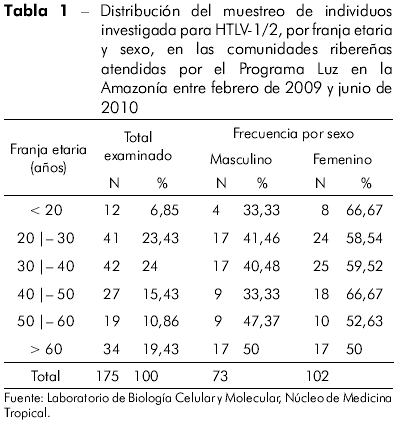
La presencia de anticuerpos anti-HTLV-1/2 fue identificada en dos de las 175 muestras analizadas, caracterizando una prevalencia de 1,14%. La frecuencia de anticuerpos varió de cero (0/30) en la comunidad de São Pedro a 1,20% (1/83) en la comunidad de Santa Maria y 1,61% (1/62) en la comunidad del Furo do Aurá. Las frecuencias de HTLV-1/2 no difirieron estadísticamente entre las tres comunidades estudiadas (p = 0,7525). Los dos individuos seropositivos tenían edades de 20 y 65 años, siendo del sexo femenino y masculino, respectivamente.
Resultados de la PCR confirmaron la amplificación del fragmento del genoma proviral del HTLV-1/2 en las dos muestras ELISA positivas y el tipo HTLV-1 fue identificado por la digestión enzimática en ambas muestras, no habiendo sido encontrado ningún caso de HTLV-2.
La investigación de anticuerpos anti-HTLV-1/2 en los familiares de la mujer ribereña con infección confirmada por HTLV-1 fue negativa. De esta familia, fueron analizados sus dos hijos (con edades de dos y cuatro años), su madre y su cónyugue. El otro caso, también positivo para HTLV-1, relató ser viudo, no teniendo padres vivos ni hijos, y ningún otro familiar residiendo en la misma comunidad, imposibilitando el análisis de sus comunicantes. Ninguno de los individuos infectados por HTLV-1 relató historia de transfusión de sangre o uso de drogas endovenosas.
DISCUSIÓN
La infección por el HTLV-1/2 se caracteriza por el agrupamiento en áreas geográficas definidas en el mundo; por la variación espacial de las tasas de seroprevalencia, dentro de áreas de prevalencia reconocidamente elevadas; por el aumento de la seroprevalencia con la edad (efecto de la edad, efecto de cohorte, seroconversión tardía); y seroprevalencia más elevada en mujeres, volviéndose más acentuada después de los 40 años de edad10.
En Brasil, hasta el momento, no existen estudios epidemiológicos con bases poblacionales y con metodologías adecuadas sobre la infección por el HTLV que permitan conocer su real prevalencia6. La principal manera de comparar la prevalencia de la infección ha sido realizada por el análisis serológica de donantes en bancos de sangre, en los cuales las tasas encontradas en las capitales brasileñas varían de 0,04% en Florianópolis, Santa Catarina, a 1,80% en Salvador, Bahia7,8,12. La seroprevalencia de HTLV-1/2 de este estudio, de 1,14%, está inserta en la variación encontrada entre los donantes de sangre en Brasil y en la variación de 0,91% a 1,61% encontrada en los donantes de sangre del Estado de Pará7,8.
Como los ensayos inmunoenzimáticos están sujetos a frecuentes reacciones falso positivas13,14,15, el inmunodiagnóstico del retrovirus depende de confirmación de la serorreactividad por Western Blot (WB) o de la PCR. En este sentido, otros estudios demostraron prevalencia de infección por el HTLV confirmada por la técnica de WB de 0,3% en el interior de Bahia16, 0,11% en Rio Branco, Acre17, 0,07% en Maringá, Paraná18 y 0,02% en Uberaba, Minas Gerais19. En este estudio, la infección por HTLV-1 se confirmó por métodos moleculares en todas las muestras serológicamente reactivas para HTLV-1/2.
La alta prevalencia de infección por HTLV en la Región Amazónica, especialmente en el Estado de Pará, que se destaca como el tercero en número de casos entre donantes de sangre en Brasil7,8, ha suscitado estudios seroepidemiológicos y moleculares dirigidos a comunidades con poblaciones específicas, habiendo sido ya registrada una prevalencia de 1,8% para HTLV-1, entre inmigrantes japoneses20, y la variación de cero a 2,06% para HTLV-1 y de cero a 1,06% para HTLV-2 en comunidades remanentes de quilombolas, en la Isla de Marajó (Pará, Brasil)21. El HTLV-2 también ha sido identificado en hasta un 30% de comunidades indígenas amazónicas22 y en un 29% de las muestras serorreactivas de donantes paraenses, pero en las comunidades ribereñas, objeto de este estudio, tan sólo fue encontrado el HTLV-1.
La variación en la prevalencia de HTLV de comunidades estudiadas previamente, así como en este estudio, demostró que el virus todavía no ha penetrado en ciertas comunidades, donde probablemente los factores asociados a la exposición son menos frecuentes. Por otro lado, considerando que son poblaciones pequeñas, la presencia de una única persona puede elevar esta prevalencia a índices próximos o superiores a los encontrados en la población en general. Además, a partir del momento en que se encuentra un caso positivo en una comunidad cerrada, existe una oportunidad mayor de que ese virus se propague de forma silenciosa, contribuyendo a un aumento de la infección y de las enfermedades asociadas.
A partir de la noción adquirida en anterior investigación23, sobre la forma silenciosa con la que el HTLV se propaga en el seno de las familias, el presente trabajo tuvo también como objetivo, investigar la transmisión familiar de la infección entre los ribereños, pero ningún caso fue identificado en la familia investigada. Estudios epidemiológicos relatan un aumento de la infección con la edad, que puede ocurrir por seroconversión tardía de infección adquirida al inicio de la vida o por el riesgo acumulativo de nuevas infecciones a lo largo de la vida24. En este sentido, sería importante investigar a posteriori a los hijos del caso portador, visto que todavía son niños y que hubo relato de amamantamiento natural por un largo período.
La muestra de familias analizadas en este estudio es significativa para inferir datos estadísticos sobre las tres comunidades estudiadas e incluso, puede representar la realidad de las comunidades ribereñas localizadas próximas a la Ciudad de Belém, aunque no debe demostrar la prevalencia de la infección por el HTLV-1/2 en la población de ribereños del Estado de Pará, debido a la gran diversidad de esa población lo que puede estar o no, relacionado a los factores asociados a la infección.
CONCLUSIÓN
La prevalencia del HTLV-1 en la muestra de comunidades ribereñas investigadas fue de 1,14%, variando de cero a 1,61%, no habiendo sido encontrado ningún caso de HTLV-2 ni tampoco ningún caso de transmisión familiar. Una visión mejor sobre la prevalencia de la infección por HTLV-1/2 en la población ribereña del Estado de Pará, se obtendría por un estudio epidemiológico de base poblacional. Ese conocimiento es importante en la prevención de nuevas infecciones y de enfermedades asociadas a esos virus.
APOYO FINANCIERO
Este trabajo obtuvo apoyo financiero de la Fundação de Amparo à Pesquisa do Estado do Pará (PPSUS-PA 2006-2007_PROJ_428_9577372), en colaboración con la UFPA y la SBB.
REFERENCIAS
1 Proietti FA, Carneiro-Proietti AB, Catalan-Soares BC, Murphy EL. Global epidemiology of HTLV-I infection and associated diseases. Oncogene. 2005 Sep;24(39):6058-68. DOI:10.1038/SJ.ONC.1208968 [ Links ]
2 Bittencourt AL. Vertical transmission of HTLV-I/II: a review. Rev Inst Med Trop Sao Paulo. 1998 Jul-Aug;40(4):245-51. DOI:10.1590/S0036-46651998000400008 [ Links ]
3 Spalton DJ, Nicholson F. HTLV-I infection in human disease. Br J Ophthalmol. 1991 Mar;75(3):174-5. [ Links ]
4 Posada-Vergara MP, Montanheiro P, Fukumori LM, Bonasser F, Duarte AJ, Penalva de Oliveira AC, et al. Clinical and epidemiological aspects of HTLV-II infection in São Paulo, Brazil: presence of tropical spastic paraparesis/HTLV-associated myelopathy (TSP/HAM) simile diagnosis in HIV-1-co-infected subjects. Rev Inst Med Trop Sao Paulo. 2006 Jul-Aug;48(4):207-10. DOI:10.1590/S0036-46652006000400006 [ Links ]
5 Santos FLN, Lima FWM. Epidemiologia, fisiopatogenia e diagnóstico laboratorial da infecção pelo HTLV-I. J Bras Patol Med Lab. 2005 abr;41(2):105-16. DOI:10.1590/S1676-24442005000200008 [ Links ]
6 Gonçalves DU, Proietti FA, Ribas JG, Araújo MG, Pinheiro SR, Guedes AC, et al. Epidemiology, treatment, and prevention of human T-cell leukemia virus type 1-associated diseases. Clin Microbiol Rev. 2010 Jul;23(3):577-89. [ Links ]
7 Carneiro-Proietti ABF, Ribas JGR, Catalan-Soares BC, Martins ML, Brito-Melo GEA, Mertins-Filho AO, et al. Infecção e doença pelos vírus linfotrópicos humanos de células T (HTLV-I/II) no Brasil. Rev Soc Bras Med Trop. 2002 set-out;35(5):499-508. [ Links ]
8 Catalan-Soares B, Carneiro-Proietti AB, Proietti FA. Interdisciplinary HTLV Research Group. Heterogeneous geographic distribution of human T-cell lymphotropic viruses I and II (HTLV-I/II): serological screening prevalence rates in blood donors from large urban areas in Brazil. Cad Saude Publica. 2005 May-Jun;21(3):926-31. DOI:10.1590/S0102-311X2005000300027 [ Links ]
9 Igakura T, Stinchcombe JC, Goon PKC, Taylor GP, Weber JN, Griffiths GM, et al. Spread of HTLV-I between lymphocytes by virus-induced polarization of the cytoskeleton. Science. 2003 Mar;299(5613):1713-6. [ Links ]
10 Tuke PW, Luton P, Garson JA. Differential diagnosis of HTLV-I and HTLV-II infections by restriction enzyme analysis of nested PCR productes. J Virol Methods. 1992 Nov;40(2):163-74. DOI: 10.1016/0166-0934(92)90065-L [ Links ]
11 Greer CE, Peterson SL, Kiviat NB, Manos MM. PCR amplification from paraffin-embedded tissues: effects of fixative and fixation time. Am J Clin Pathol. 1991 Feb;95(2):117-24. [ Links ]
12 Salles NA, Sabino EC, Barreto CB, Barreto AME, Otani MM, Chamone DF. Descarte de bolsas de sangue e prevalência de doenças infecciosas em doadores de sangue da Fundação Pró-Sangue/Hemocentro de São Paulo. Rev Panam Salud Publica. 2003 Feb-Mar;13(2-3):111-6. DOI:10.1590/S1020-49892003000200011 [ Links ]
13 Zehender G, Maddalena C, Gianotto M, Cavalli B, Santambrogio S, Orso M, et al. High prevalence of false-negative anti-HTLV type I/II enzyme-linked immunosorbent assay results in HIV type 1-positive patients. AIDS Res Hum Retroviruses. 1997 Sep;13(13):1141-6. [ Links ]
14 Caterino-de-Araujo A, Chieco-Bianchi L, Meleiro MC, Suleiman J, Calabro ML, Favero A, et al. Sensitivity of two enzyme-linked immunosorbent assay tests in relation to western blot in detecting human T-cell lymphotropic virus types I and II infection among HIV-1 infected patients from São Paulo, Brazil. Diagn Microbiol Infect Dis. 1998 Mar;30(3):173-82. DOI:10.1016/S0732-8893(97)00236-8 [ Links ]
15 Poiesz BJ, Dube S, Choi D, Esteban E, Ferrer J, LeonPonte M, et al. Comparative performances of an HTLV-I/II EIA and other serologic and PCR assays on samples from persons at risk for HTLV-II infection. Transfusion. 2000 Aug;40(8):924-30. DOI:10.1046/j.1537-2995.2000.40080924.x [ Links ]
16 Britto APCR, Galvão-Castro B, Straatmann A, Santos-Torres S, Tavares-Neto J. Infecção pelo HTLV-I/II no Estado da Bahia. Rev Soc Bras Med Trop. 1998 jan-fev;31(1):35-41. DOI: 10.1590/S0037-86821998000100005 [ Links ]
17 Colin DD, Alcântara Júnior LC, Santos FL, Uchôa R, Tavares-Neto J. Seroprevalence of human T cell lymphotropic virus infection and associated factors of risk in blood donors of Rio Branco city, AC, Brazil (1998-2001). Rev Soc Bras Med Trop. 2003 Nov-Dec;36(6):677-83. [ Links ]
18 Veit APT, Mella EAC, Mella-Junior SE. Soroprevalência do vírus linfotrópico de células T humanas (HTLV-I/II) em indivíduos doadores de sangue do hemocentro da cidade de Maringá-PR. Arq Cienc Saude Unipar Umuarama. 2006 set-dez;10(3):123-6. [ Links ]
19 Lima GM, Eustáquio JMJ, Martins RA, Josahkian JA, Pereira GA, Moraes-Souza H, et al. Decline in the prevalence of HTLV-1/2 among blood donors at the Regional Blood Center of the City of Uberaba, State of Minas Gerais, from 1995 to 2008. Rev Soc Bras Med Trop. 2010 Jul-Aug;43(4):421-4. DOI:10.1590/S0037-86822010000400017 [ Links ]
20 Vallinoto AC, Muto NA, Pontes GS, Machado LF, Azevedo VN, Santos SE, et al. Serological and molecular evidence of HTLV-I infection among Japanese immigrants living in the Amazon region of Brazil. Jpn J Infect Dis. 2004 Aug;57(4):156-9. [ Links ]
21 Vallinoto AC, Pontes GS, Muto NA, Lopes IG, Machado LF, Azevedo VN, et al. Identification of human T-cell lymphotropic virus infection in a semi-isolated Afro-Brazilian quilombo located in the Marajó Island (Pará, Brazil). Mem Inst Oswaldo Cruz. 2006 Feb;101(1):103-5. DOI:10.1590/S0074-02762006000100020 [ Links ]
22 Ishak R, Harrington Jr WJ, Azevedo VN, Eiraku N, Ishak MO, Guerreiro JF, et al. Identification of human T cell lymphotropic virus type IIa infection in the Kayapo, an indigenous population of Brazil. AIDS Res Hum Retroviruses. 1995 Jul;11(7):813-21. [ Links ]
23 Catalan-Soares B, Carneiro-Proietti AB, Proietti FA. Grupo Interdisciplinar de Pesquisas em HTLV. Human T-cell lymphotropic virus in family members of seropositive blood donors: silent dissemination. Rev Panam Salud Publica. 2004 Dec;16(6):387-94. [ Links ]
24 Murphy EL, Wilks R, Morgan OS, Hanchard B, Cranston B, Figueroa JP, et al. Health effects of human T-lymphotropic virus type I (HTLV-I) in a Jamaican cohort. Int J Epidemiol. 1996;25(5):1090-7. [ Links ]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Maísa Silva de Sousa
Núcleo de Medicina Tropical,
Universidade Federal do Pará
Av. Generalíssimo Deodoro, 92.
Bairro: Umarizal
CEP: 66055-240
Belém-Pará-Brasil
Tel./Fax: (91) 3241-4681
E-mail:maisasousa@ufpa.br
Recebido em / Received / Recibido en: 1/9/2010
Aceito em / Accepted / Aceito en: 25/9/2010










 texto em
texto em