Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim de Pneumologia Sanitária
versão impressa ISSN 0103-460X
Bol. Pneumol. Sanit. v.8 n.2 Rio de Janeiro dez. 2000
Manejo da doença micobacteriana não-tuberculosa
Hisbello S. Campos
Médico do Centro de Referência Prof. Hélio Fraga/FUNASA-MS
RESUMO
O papel das micobactérias não-tuberculosas (MBNT) como agente etiológico de diversas doenças foi recentemente reconhecido e o conhecimento sobre as doenças por elas causadas tem evoluído nos últimos anos. Critérios diagnósticos foram estabelecidos e, embora limitados, ajudam a identificar doentes. Entre as doenças causadas por MBNT, aparentemente as provocadas pelo complexo avium-intracellulare são as mais freqüentes. A patogênese das doenças causadas por MBNT ainda não está esclarecida, mas não foi identificada nenhuma predisposição genética ou deficiência imune específica. O tratamento ideal para as doenças pulmonares causadas por MBNT ainda está por ser determinado, mas está claro que esquemas terapêuticos que contenham um macrolídeo (claritromicina ou azitromicina) são mais efetivos. Infelizmente, os efeitos adversos dos fármacos são um problema significativo e limitante. Apesar de associada a complicações freqüentes, a cirurgia é uma boa opção para doentes selecionados. Tanto o tratamento como a profilaxia da doença disseminada causada pelo MAC em pessoas HIV-positivas ou em doentes com aids com esquemas contendo macrolídeos apresentam bons resultados. Embora a resposta bacteriana a esquemas com duas drogas (claritromicina e etambutol) seja boa, a incidência de efeitos adversos da claritromicina é maior nos esquemas duplos.
Palavras chave: Micobactérias não-tuberculosas, Complexo micobactéria avium-intracellulare.
SUMMARY
The role of nontuberculous mycobacterias as etiologic agents of several diseases has been reconized recently and the knowledge about nontuberculous mycobacterial disease has been evoluting during the last years. Diagnostic guidelines have been developed and, although limited, they help identifying patients with indolent disease during long-term follow-up. Among the diseases caused by nontuberculous mycobacterias, it seems that those caused by Mycobacterium avium-intracellularee complex (MAC) are more frequent. The pathogenesis of nontuberculous mycobacterial (NTMB) diseases still is poorly understood, but no genetic predisposition or specific immune deficiency has been identified so far. The optimal treatment for patients with NTMB lung disease remains to be determined, but it is clear that therapeutic regimens that contains a macrolide (clarithromycin or azithromycin) are most effective. Unfortunately,drug-related side effects are still a significant and limiting problem. Although associated with frequent complications, surgery is important for selected patients. Both treatment and prophylaxis of disseminated MAC disease in HIV infected or aids patients are quite effective with macrolide-containing regimens. Patients with MAC disease respond well microbiologically to two-drugs regimens (clarithromycin and ethambutol). On the other hand, the incidence of clarithromycin side effects is higher with this two-drug regimen.
Key words: Nontuberculous mycobacteria, Mycobacterium avium complex.
Introdução
Até o surgimento da aids, não se dava grande importância às infecções por micobactérias não-tuberculosas (MBNT). Relatos de doenças pulmonares causadas por esse grupo eram esporádicos. Apenas a partir dos anos cinqüenta, começaram a surgir relatos de grandes séries de doenças pulmonares causadas por MBNT1,2. Há cerca de 13 espécies de MBNT, de virulência variável, reconhecidamente capazes de provocar doenças no homem, mas, certamente, a susceptibilidade humana a essas micobactérias varia muito entre as diferentes populações e etnias. O complexo Mycobacterium avium-intracellularee (CMA) parece ser o mais freqüente agente causal de doença. Historicamente, os doentes com doença causada pelo CMA eram tratados com os mesmos fármacos antituberculose dos doentes tuberculosos. Ao mesmo tempo, o CMA era interpretado como apenas um colonizador e a detecção dessas micobactérias em bronquiectasias nem sempre era sinônimo de tratamento, o que, por vezes, levava à sintomatologia progressiva e à maior morbidade. Entretanto, com o impacto crescente da aids e com a conscientização de que essas micobactérias podiam ser causa de doenças, o enfoque mudou, o que permitiu, ao final da década de 80, a introdução de drogas efetivas, primariamente a claritromicina (CRT) e a azitromicina (AZT), melhorando o desfecho dos doentes.
O presente artigo visa oferecer uma revisão sucinta das doenças causadas pelas MBNT, focando sua patogenia e seus diagnóstico e tratamento.
Epidemiologia e patogênese
A maior parte das MBNT tem sido isolada do solo ou da água. O grupo melhor estudado é o CMA. A identificação de cepas aerossolizadas desse complexo, associadas à sua virulência, permite supor um mecanismo inalatório de infecção3. Embora o M. avium seja um importante agente patogênico no gado e em suínos, estudos sorológicos indicam que a transmissão entre os animais não é importante na infecção humana4, já que há indícios de que as cepas que infectam os homens são diferentes5,6. É aceito que os reservatórios naturais de água são as fontes ambientais para a maior parte das infecções humanas causadas pelas MBNT (CMA, M. marinum, M. kansasii, M. xenopi, M. malmoense, M. genavense, M. ulcerans e a M. simiae)7,8,9,10,11,12,13.As micobactérias de crescimento rápido, como a M. fortuitum, a M. chelonae e a M. abscessus, são habitualmente recuperadas do solo e da água, e são as MBNT mais comumente associadas à doença nosocomial14,15,16,17,18. Estudos sobre surtos hospitalares causados por essas espécies demonstraram que a água usada nos Serviços, sob as mais diversas formas (na limpeza, para fazer gelo, na diálise ou para o preparo de soluções como violeta genciana) era fonte usual desses microrganismos19,20,21,22. Ainda não se conhece totalmente a patogenia das infecções pelas MBNT, mas estudos recentes sugerem que a infecção homem-a-homem é rara. Acredita-se que a maior parte das pessoas são infectadas por MBNT ambientais. Ao mesmo tempo em que as MBNT aerossolizadas possivelmente têm papel importante no comprometimento pulmonar, a ingestão de material infectado pode ser a fonte de contaminação das crianças com linfoadenite por MBNT e a colonização gastrointestinal, ponto de partida para as doenças por elas causadas nos doentes com aids.
Pela sua freqüência, a doença pulmonar causada pelo CMA merece destaque. O fato de ela ocorrer com freqüência razoável em uma população relativamente distinta e homogênea - mulheres idosas com bronquiectasias/nódulos pulmonares sem doença pulmonar ou imunossupressora preexistente - motivou a busca de um possível defeito no sistema imune desses pacientes23,24,25,26,27. Até o momento, se existe, esse defeito ainda não foi identificado mas, certamente, fatores do hospedeiro são extremamente importantes no processo de adoecimento e de cura.
Diagnóstico da doença causada pelas MBNT
No homem, foram descritas diversas formas de doenças causadas pelas MBNT, acometendo pulmão, gânglios, pele, articulações, tendões e mesmo doença disseminada. No quadro 1, são apresentadas as formas clínicas já identificadas e as respectivas micobactérias causais.

A doença pulmonar é a forma clínica mais freqüente das doenças causadas por MBNT28,29,30. Nos Estados Unidos, o CMA e o M. kansasii são os patógenos mais freqüentes que causam doença pulmonar. Outras MBNT causadores de pneumopatias naquele país incluem o M. abscessus, o M. xenopi, o M. malmoense, o M. simiae, o M. szugulai, o M. fortuitum, o M. celatum, o Maiaticum e o M. shimodii. No Canadá, no Reino Unido e em algumas áreas da Europa, o M. xenopi é o segundo mais freqüente agente causal31.
Habitualmente, os doentes são adultos e há história de uma doença crônica pulmonar associada. Os sinais e os sintomas do comprometimento pulmonar são inespecíficos, incluindo tosse crônica, expectoração e fadiga. Menos comumente, mal-estar, dispnéia, febre, hemoptise e perda de peso podem surgir, usualmente nas formas avançadas da doença. Radiograficamente, as lesões pulmonares por MBNT costumam mostrar diferenças com relação às causadas pelo M. tuberculosis: as cavidades têm paredes finas e menos infiltrado parenquimatoso em sua volta; a disseminação é mais freqüentemente por contigüidade que broncogênica; envolvimento marcante da pleura nas áreas pulmonares envolvidas.
Linfadenite submandibular, submaxilar, cervical ou pré-auricular em crianças de 1 a 5 anos é a apresentação clínica mais comum das formas ganglionares causadas pelas MBNT32,33. É a doença por MBNT mais comum entre as crianças e, na ausência de infecção pelo HIV, raramente afeta adultos34. O diagnóstico diferencial entre as linfadenites causadas pelo M. tuberculosis e as originadas pelas MBNT é fundamental para a decisão terapêutica. O diagnóstico presuntivo da etiologia MBNT é baseado na apresentação histopatológica (granuloma com necrose de caseificação com ou sem BAAR) e na prova tuberculínica negativa. O diagnóstico definitivo é dado pela identificação do organismo causal em material da lesão.
As MBNT podem causar lesões de pele, do subcutâneo, de tendões, de articulações e ósseas. As micobactérias mais freqüentemente isoladas nesses casos têm sido a M. abscessus, o M. fortuitum, o M. marinum, o M. conspicum, o M. chelonae, o M. kansasii e o CMA.
Mesmo em indivíduos imunocompetentes, doenças causadas por MBNT podem se apresentar sob diferentes formas ou mesmo como doença disseminada. Uma grande variedade de lesões dermatológicas, geralmente não diagnosticadas adequadamente, que duram meses e não respondem aos tratamentos habituais, podem ser causadas por MBNT. Num estudo retrospectivo35, com história de trauma no local da lesão, e de hobbies ou de ocupação ligados à pescaria ou à água, em que o tempo médio da lesão foi de 19 meses (1 a 132), o M. marinum foi identificado como o agente etiológico. Foram descritos dois casos de doença pelo M szulgai nos quais a única manifestação foi uma síndrome de túnel do carpo36. O diagnóstico foi feito pelo exame histopatológico da sinóvia e pelo isolamento da micobactéria. Foram descritos 54 casos de tenosinovite, depois de trauma, causados pelo M.terra37. Já foi descrita doença disseminada por MBNT em doentes imunossuprimidos (transplantados, leucêmicos, doentes em uso crônico de corticosteróides orais, p. ex.). Nesses relatos, as micobactérias observadas foram: CMA38,28, M. chelonae39,40, M. kansasii41, M. hemofillum42, M. abscessus28 e M. escrofulaceum28.
Pacientes imunocomprometidos têm maior probabilidade de apresentarem doenças causadas por MBNT. Até o momento, em doentes infectados pelo HIV, apenas a imunossupressão muito avançada é considerada um fator relevante na gênese das doenças por MBNT43,44,45. Ao mesmo tempo, há indícios de que a restauração parcial do sistema imune com a quimioterapia combinada anti-retroviral possa ter um papel na patogenia da doença pelo CMA46,47,48. Em doentes aidéticos, já foi descrita doença disseminada e pulmonar (CMA, M. genavense e M. kansasii)49,43,50, e doença de pele, subcutâneo, ossos e juntas (M. hemofillum)51. Por vezes, a apresentação clínica pode dar pistas para o agente etiológico. Num estudo entre doentes aidéticos com doença disseminada causada pelo CMA (24) e pelo M. genavense (12), observou-se que os infectados pelos últimos tinham dor abdominal mais freqüentemente52.
Ainda não se tem total conhecimento sobre a história natural da doença pulmonar causada pelo CMA. Alguns doentes mantêm quadro clínico-radiográfico estável por anos, enquanto em outros a doença evolui rapidamente. A apresentação fibrocavitária no ápice pulmonar, em homens com 40 a 60 anos, com história de fumo e de alcoolismo, sempre foi considerada típica. Recentemente, a significância da associação de nódulos pulmonares com bronquiectasias para o diagnóstico de doenças pulmonares causadas pelo CMA foi definida. Essa apresentação parece ser mais comum entre mulheres idosas não-fumantes53,54,55. Num estudo prospectivo sobre o papel da biópsia transbrônquica e do lavado broncoalveolar em 26 doentes HIV-negativos, com pequenos nódulos pulmonares periféricos próximos a bronquiectasias (visualizados pela TC), concluiu-se ser essa associação sugestiva de doença pulmonar por CMA, embora possa também ocorrer em outras infecções micobacterianas56.
Em 1997, a American Thoracic Society (ATS) publicou as conclusões de uma oficina de trabalho sobre diagnóstico e tratamento das doenças pulmonares causadas por MBNT. No quadro 2 apresenta-se o sumário dos critérios diagnósticos sugeridos pela ATS. É importante frisar que esses critérios aplicam-se melhor ao complexo avium e às micobactérias abscessus e kansasii. O conhecimento ainda é pequeno para se ter certeza se esses critérios são adequados para o universo das micobacterioses não-tuberculosas. Por exemplo, num estudo realizado entre mineradores de ouro na África do Sul57, os critérios foram atingidos em apenas 32 (27%) de 118 indivíduos classificados como doentes (muitos com formas significativas de doença pulmonar). Nessa população, as incidências de tuberculose e de infecção pelo HIV são altas, o que fez com que a terapêutica anti-tuberculose fosse iniciada empiricamente na maior parte (70%) dos doentes, antes do isolamento e da identificação do agente causal. O Micobacterium kansasii, susceptível às drogas anti-tuberculose, foi a espécie mais freqüentemente isolada58. Segundo os autores desse estudo, os dois principais pontos de choque entre os critérios propostos pela ATS e os adotados nesse grupo foram: 1) uso de meio líquido de cultura (a ATS preconiza o meio sólido) e 2) não utilização de métodos diagnósticos invasivos (broncoscopia com biópsia transbrônquica). Num grupo como esse de mineiros da África do Sul, no qual a população é susceptível ao risco de doença micobacteriana rapidamente progressiva, incluindo tuberculose, a recomendação de seguimento a longo prazo para firmar o diagnóstico é discutível.

Na investigação de formas pulmonares, pelo menos 3 amostras para exame devem ser obtidas de cada doente, e deve-se fazer cuidadosamente o diagnóstico diferencial visando excluir outras possibilidades diagnósticas.
Devido à maior relevância das doenças pulmonares causadas pelo CMA, alguns autores propõem critérios diagnósticos específicos (Quadro 3).

Pode-se notar que os critérios atuais de diagnóstico enfatizam o seguimento por longos prazos e a coleta de múltiplas amostras de material pulmonar quando houver suspeita de doença pulmonar causada por MBNT. A ênfase no acompanhamento a longo prazo visa reduzir a chance de o médico não valorizar o isolamento de uma MBNT em portadores de doenças vagarosamente progressivas60.
A variedade de MBNT potencialmente patogênicas, sua virulência variável, e as diferentes susceptibilidades individuais tornam difícil um critério diagnóstico único ser apropriado a todas as doenças pulmonares causadas por MBNT em diferentes situações e populações. Provavelmente, o futuro trará recomendações diagnósticas que se apóiem nas diferentes características das espécies de MBNT.
Tratamento da doença por MBNT
Como ainda há claros no conhecimento das doenças causadas por MBNT, as recomendações terapêuticas devem ser consideradas temporárias. Certamente, na medida em que avançarmos na compreensão dessas patologias, o perfil de sensibilidade das MBNT for sendo definido nas diferentes regiões do mundo, e novos fármacos forem sendo desenvolvidos, esquemas terapêuticos mais efetivos substituirão as atuais recomendações. No quadro 4 são apresentados os antibióticos sugeridos a serem considerados no tratamento das doenças causadas pelas MBNT, segundo a micobactéria, o valor terapêutico do fármaco e o grau de utilidade da realização de testes de sensibilidade.
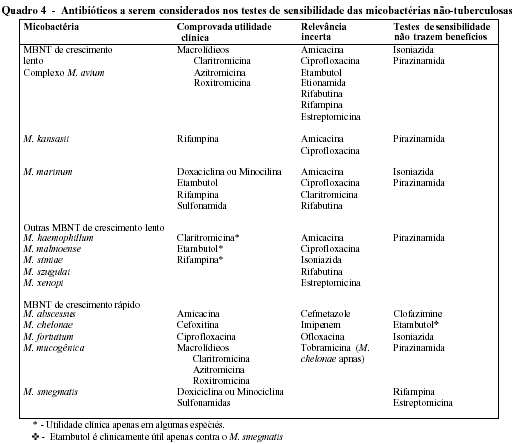
As recomendações da ATS para o tratamento das doenças causadas por MBNT são41:
• Doença pulmonar pelo complexo Avium-intracellulare - (adultos HIV-negativos)
Claritromicina (500 mg duas vezes ao dia) diária, ou Azitromicina (250 mg), ou Rifampina (600 mg) ou Rifabutina (300 mg) + Etambutol (25 mg/K nos 2 primeiros meses, seguido por 15 mg/K). Tratamento por 1 ano ou até cultura ser negativa.
• Doença disseminada pelo complexo Avium-intracellulare -
Claritromicina (500 mg duas vezes ao dia) diária, ou Azitromicina (250 a 500 mg) + Etambutol (15 mg/K). Considerar uma terceira droga (Rifabutina na dose de 300 mg/dia). Tratamento por toda a vida até que mais sobre a doença seja sabido.
• Doença pulmonar pelo M. kansasii
Rifampicina (600 mg) + Isoniazida (300 mg) + etambutol (25 mg/K nos 2 primeiros meses, seguido por 15 mg/K). Tratamento por 18 meses com um mínimo de 12 meses de manutenção da cultura negativa para as formas pulmonares em adultos.
A Claritromicina ou a Rifabutina devem ser substituídas pela Rifampina nos doentes HIV-positivos que estejam usando inibidores de protease.
• Linfadenite cervical por MBNT -
Idealmente, o tratamento é cirúrgico, com retirada do gânglio (95% de cura). Um esquema contendo a Claritromicina pode ser considerado para doentes com doença extensa ou pouca resposta à cirurgia.
• Doença não-pulmonar por MBNT de crescimento rápido -
Incluir drogas como a Amicacina e a Claritromicina com base nos testes de sensibilidade.
Como a doença causada pelo CMA é a mais freqüentemente diagnosticada, sua abordagem terapêutica deve ser vista com maior detalhe. Historicamente, os resultados do tratamento quimioterápico da doença causada pelo CMA eram frustrantes. A maior limitação para resultados favoráveis era a ausência de agentes antimicrobianos que associassem baixa toxicidade e boa atividade in vivo contra esses microrganismos. Ainda hoje, há outros obstáculos ao tratamento dessas doenças, entre os quais destacam-se o longo tempo de terapia necessário, o custo dos remédios e o fato de que parte dos doentes não podem ser adequadamente tratados apenas com medicamentos, necessitando de cirurgia. O impacto mais importante no tratamento das doenças pulmonares por MBNT ocorreu há uma década, com a introdução da claritromicina e da azitromicina no arsenal terapêutico. Desde então, nenhum outro agente tão efetivo foi lançado. Possivelmente, o grande valor dos macrolídeos (claritromicina e azitromicina) sobre o CMA se deve às suas altas atividade fagocítica e concentração tecidual. A rifabutina (um derivado da rifamicina S) apresenta maior atividade in vitro que a rifampina sobre isolados do CMA61. Seu valor no esquema terapêutico ainda é objeto de discussão, mas há indícios de que seja uma boa opção profilática na aids62. Nesse grupo particular, os esquemas terapêuticos contendo os macrolídeos citados são efetivos na doença disseminada por CMA. Do mesmo modo, a monoterapia com um macrolídeo é um efetivo esquema quimioprofilático contra doença disseminada63,64,65.
Diversos esquemas terapêuticos foram testados no tratamento das enfermidades causadas pelo CMA. Num estudo utilizando quatro drogas (claritromicina 10 mg/K - etambutol 15 mg/K - rifampina 10 mg/K e kanamicina IM 3 vezes por semana por 2 a 6 meses, seguido de quinolona diária até completar 24 meses)66, 72% (28/39) dos doentes que completaram 6 meses de tratamento negativaram o escarro. A taxa de negativação foi menor para aqueles que já haviam sido tratados antes, ou para os que estavam infectados por cepas resistentes à claritromicina ou eram positivos à baciloscopia pré-tratamento. Não houve diferenças entre as taxas de negativação quando comparados aqueles com doença cavitária com os que apresentavam nódulos/bronquiectasias. Se excluídos aqueles com cepas resistentes à claritromicina, a taxa de negativação foi de 84%. Num outro estudo avaliando o uso intermitente da claritromicina67, observou-se que a administração da droga 3 vezes na semana era tão efetiva quanto o uso diário. Num estudo retrospectivo que procurou avaliar o papel da adição da ciprofloxacina à claritromicina e ao etambutol no tratamento da doença disseminada causada pelo CMA entre pouco mais de 3.000 doentes HIV-positivos, observou-se que aqueles que usaram a quinolona tiveram maior sobrevida68. Entretanto, enquanto a eficácia da claritromicina está bem estabelecida, não há, ainda, evidências científicas suficientes que não deixem dúvidas sobre o valor da adição de quinolonas ao esquema terapêutico.
Um estudo69 comparou a efetividade de dois esquemas:
• azitromicina (600 mg) 3 vezes por semana + etambutol (25 mg/K) diário + rifabutina (600 mg) diário e estreptomicina 2 vezes por semana na fase inicial ;
• azitromicina (600 mg) + etambutol (25 mg/K) + rifabutina (600 mg) todos 3 vezes por semana e estreptomicina 2 vezes por semana na fase inicial.
No primeiro grupo, 14 (74%) dos 19 pacientes que completaram 6 meses de tratamento, negativaram o escarro na cultura. No segundo grupo, 24 (62%) dos 36 doentes que completaram 6 meses de tratamento negativaram a cultura. Esses resultados são equivalentes aos obtidos com esquemas diários contendo claritromicina ou azitromicina70,.71 Entretanto, num estudo comparativo avaliando o papel da rifabutina quando associada à claritromicina e ao etambutol, não se observou qualquer diferença entre as respostas clínica e bacteriológica entre o grupo que associou a rifabutina às outras duas. Porém, o grupo que recebeu a droga desenvolveu muito menos resistência à claritromicina (2% vs 14%)72.
Um outro estudo, comparando a associação da azitromicina ou da claritromicina ao etambutol73, não revelou diferenças importantes entre as duas no que se referia à resposta clínica (sintomas) ou à tolerância. Entretanto, por mecanismos ainda incompreendidos, a resposta bacteriológica (medida pelo clearance da bacteremia) foi significativamente melhor para a claritromicina (4,4 semanas vs 16 semanas para a azitromicina). Por outro lado, ao mesmo tempo em que há evidências de que a dose de claritromicina deve ser alta (1.000 a 2.000 mg duas vezes ao dia) no tratamento da doença disseminada por CMA74,75, de modo ainda não esclarecido, aparentemente a taxa de mortalidade cresce com o aumento da dose. Interroga-se se a claritromicina interferiria negativamente com a imunidade celular, o que seria maléfico para pacientes já imunologicamente comprometidos. Certamente, a toxicidade dessa droga e os problemas na sua interação com a rifabutina são obstáculos importantes no tratamento das doenças pulmonares ou disseminadas causadas pelo CMA.
Embora haja indícios de que um esquema composto por um macrolídeo (claritromicina ou azitromicina) e o etambutol seja efetivo18, aparentemente há maior risco de desenvolvimento de resistência à claritromicina na ausência da rifabutina. Ao mesmo tempo em que a substituição da rifabutina pela rifampina melhora a tolerância ao esquema, reduz a concentração da claritromicina76, aumentando a chance de desenvolvimento de cepas de CMA resistentes a essa droga.
Dada a freqüência com que infecções pelo CMA podem causar doença em pacientes com aids, alguns esquemas quimioprofiláticos estão sendo estudados. Em um deles, no qual foi comparado o uso de claritromicina e de rifabutina, isoladas e combinadas, ficou demonstrado que a claritromicina e a combinação eram superiores à rifabutina isolada. Entretanto, a associação oferecia maior risco de efeito adversos77. Por outro lado, ao mesmo tempo em o CMA é um importante patógeno que pode causar doença disseminada em doentes com aids, e que a introdução dos novos macrolídeos (claritromicina e azitromicina) e da rifabutina melhorou o desfecho do tratamento, esses mesmos medicamentos estão associados a efeitos adversos e a potenciais interações medicamentosas indesejáveis. As rifamicinas (a rifampina mais do que a rifabutina) induzem as enzimas do citocromo P450 e aceleram o metabolismo da claritromicina e dos inibidores de protease do HIV. Ao mesmo tempo, a claritromicina inibe as enzimas do citocromo, levando à maior toxicidade da rifabutina. Nos esquemas terapêuticos, a claritromicina e a azitromicina têm que ser usadas associadas a outros antibióticos, habitualmente o etambutol, para prevenir a emergência de resistência aos macrolídeos. Infelizmente, nem todos respondem bem a esquemas contendo macrolídeo, rifabutina e etambutol, e muitos apresentam, efeitos adversos importantes (em sua maior parte gastrointestinais)78,79.
Finalmente, dado que a maior parte dos portadores de doenças causadas por MBNT são idosos e tomam grande número de fármacos, monitorar a ocorrência de manifestações de toxicidade dos medicamentos usados é importante. Sintomas visuais, como a acuidade (etambutol e rifabutina80) devem ser pesquisados. Sinais de comprometimento do sistema nervoso central (cicloserina, ciprofloxacina, ofloxacina, etionamida), gastrointestinais (etionamida), do fígado (isoniazida, rifampina, etionamida, claritromicina, rifabutina)81,82, dos rins (estreptomicina, amicacina), da audição e da função vestibular (estreptomicina, amicacina, azitromicina) e marcadores hematológicos (sulfonamidas, cefotoxina, rifabutina)81 devem ser pesquisados durante todo o tempo de uso dos medicamentos. A não ser que novos fármacos, com maior efetividade e menor toxicidade sejam inseridos no limitado arsenal terapêutico das doenças causadas por MBNT, pode ser que, para alguns doentes, o tratamento seja pior que a doença.
Referências bibliográficas
1. Ahren P, Giese SB, Klausen J, Inglis NF. Two markers, IS901-IS902 and p40, identified by PCR and by using monoclonal antibodies in mycobacterium avium strains. J Clin Microbiol 1995; 33: 1049-53.
2. American Thoracic Society. Diasgnosis and treatment of disease caused by nontuberculous mycobacteria. Am J Respir Crit Care Med 1997; 156: S1-S25.
3. Ang P, Rattana-Apiromyakij N, Gob CL. Retrospective study of mycobacterium marinum skin infections. Int J Dermatol 2000; 39 (5): 343-7.
4. Bartley PB, Allworth AM, Eisen DP. Mycobacterium avium complex causing endobronchial disease in AIDS patients after partial immune restoration. Int J Tuberc Lung Dis 1999; 3(12): 132-6.
5. Benson CA, Williams PL, et al. Clarithromycin or rifabutin alone or in combinations for primary prophylaxis of blind, placebo-controlled trial. J Infect Dis 2000; 181(4): 1289-97.
6. Bolan G, Reingold AL, et al. Infections with mycobacterium chelonei in patients receiving dialysis and using processed hemodialysers. J Infect Dis 1985; 152: 1013-9.
7. Bottger EC. Mycobacterium genavense: na emerging pathogen. Eur J Clin Microbiol Infect Dis 1994;13: 932-6.
8. Bottger EC. Mycobacterium genovense: na emerging pathogen. Eur J Clin Microbiol Infect Dis 1994;13: 932-6.
9. Brown BA, Wallace RJ, et al. Clarithromycin-induced hepatoxicity. Clin Infect Dis 1995; 20: 1073-4.
10. Chaisson RE, Benson CA, Dube MP, et al. Clarithromycin therapy for bacteremic mycobacterium avium complex disease. Ann Intern Med 1994; 121: 905-11.
11. Cinti SK, Kaul DR, et al. Recurrence of mycobacterium avium infection in patients receiving highly active antiretroviral therapy and antimycrobacterial agents. Clin Infec Dis 2000; 30(3): 511-4.
12. Cohn DL, Fisher EJ, Peng GT, et al. A prospective randomized trial of four three-drug regimens in the ttreatment of disseminated mycobacterium avium complex disease in AIDS patients: excess mortality associated with high-dose clarithromycin.Clin Infect Dis 1999; 20: 125-33.
13. Collins CH, Grange WC, Noble WC, Yates MD. Mycobacterium marinum infections in man. J Hyg Camb 1985; 94: 135-49.
14. Corbett EL, Churchyard GJ, Hay M, et al. The impact of HIV infection on mycobacterium kansasii disease in South African miners. Am J Respir Crit Care Med 1999; 160: 10-4.
15. Corbett EL,Blumberg L, Churchyard GJ, et al. Nontuberculous mycobacteria, defining disease in a prospective cohort of South African miners. Am J Respir Crit Care Med 1999; 160: 15-21.
16. Crow HE, King CT, Smith E, Corpe RF, Stergus I. A limited clinical, pathologic, and epidemiological study of patients with pulmonary lesions associated with atypical acid-fast bacilli in the sputum. Am Ver Tuberc 1957; 75: 199-222.
17. Diagnosis and treatment of disease caused by nontuberculous mycobacteria. Official statement of the American Thoraic Society. Am J Respir Crit Care Med 1997; 156(2 Pt2): S1-S25.
18. Falkinham JO. Epidemiology of infection by nontuberculous mycobacteria. Clin Microbiol Rev 1996; 9: 177-215.
19. Gordin JF, Sullam P, Shafran S, et al. A randomized placebo-controlled trial of rifabutin added to a regimen of clarithromycin and ethambutol for treatment of disseminated infection with M. avium complex. Clin Infect Dis 1999; 28: 1080-5.
20. Griffith DE, Brown BA, Cegielski P, Murphy DT, Wallace RJ Jr. Early reaults (at 6 months) with intermittent clarithromycin-including regimens for lung disease due to Mycobacterium aviumcomplex. Clin Infect Dis 2000; 30: 288-92.
21. Griffith DE, Brown BA, et al. Adverse events associated with high-dose rifabutin in macrolide-containing regimens for the treatment of mycobacterium avium complex lung disease. Clin Infect Dis 1995; 21: 594-8.
22. Griffith DE, Brown BA, et al. Early results (at 6 months) with clarithromycin-including regimens for lung disease due to mycobacterium avium complex. Clin Infec Dis 2000; 30(2): 288-92.
23. Griffith DE, Brown BA, Girard WN, Murphy DT, Wallace RJ Jr. Azithromycin activity against mycobacterium avium complex lung disease in HIV negative patients. Clin Infect Dis 1996; 153: 1737-8.
24. Griffith DE, Brown BA, Murphy Dt, et al. Initial (six months) results of three times weekly azithrmycin in treatment regimens for Mycobacterium avium complex lung disease in HIV negative patients. J Infect Dis 1998; 178: 121-6.
25. Griffith DE. Risk-benefit assessment of therapies for mycobacterium avium complex infections. Drug Safety 1999; 21(2): 137-52.
26. Guerrero C, Bernasconi C, Burki D, Bodmer T, Telenti. A novel insertion element from mycobacterium avium, IS1245, is a specific target for analysis of strain relatedness. J Clin Microbiol 1995; 33: 304-7.
27. Hartman TE, Swensen SJ, Williams DE. Mycobacterium avium-intracellulares complex: evaluation with CT. Radiology 1993; 187: 23-6.
28. Havlir DV, Dube MP, Sattler FR et al. Prophylaxis agianst disseminated Mycobacterium avium complex with weekly azithromycin, daily rifabutin, or both. N Engl J Med 1996; 335: 392-8.
29. Henriques B, Hoffner SE, et al. Infection with mycobacterium malmoense in Sweden.: report of 221 cases. Clin Infect Dis 1994; 18: 596-600.
30. Hoffman PC, Fraser DW, Robicsek F, O´Bar PR, Mauney CU. Two outbreaks of sternal wound infections due to organisms of the mycobacterium fortuitum complex. J Infect Dis 1981; 143: 533-42.
31. Hoover DR, Saah AJ, et al. Clinical manifestations of AIDS in the era of pneumocystis prophylaxis. N Engl J Med 1991; 324: 1922-6.
32. Horsburgh CJ Jr, Selik RM. The epidemiology of disseminated nontuberculous mycobacterial infection in the Acquired Immunodeficiency Syndrome (AIDS). Am Rev Respir Dis 1989; 139: 4-7.
33. Horsburgh CR Jr, Mason UG, et al. Disseminated infection with mycobacterium avium-intracellulare. Medicine 1985; 64: 36-48.
34. Horsburgh CR. Mycobacterium avium complex infection in the acquired immunodeficiency syndrome. N Engl J Med 1991; 324: 1332-8.
35. Horusitzki A, Puechal X, et al. Carpal syndrome caused by mycobacterium szulgai. J Rheumatol 2000; 27 (5): 1299- 302.
36. Huang JH, Oefner PJ, Adi V, et al. Analysis of the NRMP1 and IFN-?R! genes in women with Mycobacterium aviumintracellulare pulmonary disease. Am J Respir Crit Care Med 1998; 157: 377-81.
37. Ingram CW, Tanner DC et cols. Disseminated infection with rapidly growing mycobacteria. Clin Infect Dis 1993; 16: 463-71.
38. Jouanguy E, Altare F, Lamhamedi S, et al. Interferon-?-receptor deficiency in na infant with fatal bacille Calmette-Guérin infection. N Engl J Med 1996; 335: 1956-91.
39. Keiser P, Nassar N, Skiest D et cols. A retrospective atudy of the addition of ciprofloxacin to chlaritromycin and ethambutol in the treatment of disseminated Mycobacterium avium complex infection. Int J STD & Aids 1999; 10(12): 791-4.
40. Kiehn TE, White M. Mycobacterium haemophilum : na emerging pathogen. Eur Clin Microbiol Infect Dis 1994; 13: 925-31.
41. Kuritski JN, Bullen CV, et al. Sternal wound infections and endocarditis due to organisms of the Mycobacterium fortuitum complex: a potential environmental source. Ann Intern Med 1983; 98: 938-9.
42. Laussucq S, Baltch AL, et al. Nosocomial mycobacterium fortuitum colonization from a contamined ice machine. Am Rev Respir Dis 1988; 138: 891-4.
43. Lerner CW,Safdar A, et al. Mycobacterium haemophillum infection in AIDS. Infect Dis Clin Prac 1995;4:233-6.
44. Lewis AG, Lasche EM, Armstrong AL, Dunbar FP. A clinical study of the chronic lung disease due to nonphotochromogenic acid-fast bacilli. Ann Intern Med 1960; 53: 273-85.
45. Lichtenstein IH, MacGregor RR. Mycobacterial infections in renal transplant recipients: report of five cases and review of the literature. Rev Infect Dis 1983; 5: 216-226.
46. Lincoln EM, Gilbert LA. Disease in children due to mycobacteria other than mycobacterium tuberculosis. Am Rev Respir Dis 1972; 105: 683-714.
47. Livanainen EK, Martikainen PJ, Vaananen PK, Katila ML. Environmental factors affecting the occurrence of mycobacteria in brook waters. Appl Environ Microbiol 1993; 59: 398-404.
48. Lowry PW, Jarvis WR, Oberle AD, et al. Mycobacterium chelonae causing otitis media in an ear-nose-and-thorat practice. N Engl J Med 1988; 319: 978-82.
49. Maloney S, Welbel S, Daves B, et al. Mycobacterium abscessus pseudoinfection traced to na automated endoscope washer: utility of epidemiology and laboratory investigations. J Infect Dis 1994; 169: 1166-9.
50. Margileth AM, Chandra R, et al. Chronic lymphadenopathy due to mycobacterial infection. Am J Dis Child 1984; 138: 917-22.
51. McSwiggan DA, Collins CH. The isolation of M. kansasii and M. xenopi from water systems. Tubercle 1974; 55: 291- 7.
52. Meissner G, Anz W. Sources of mycobacterium avium complex infection resulting in lung disease. Am Rev Respir Dis 1977; 116: 1057-64.
53. Meissner OS, Falkinham JO. Plasmid DNA. Profiles as epidemiologic markers for clinical and environmental isolates of mycobacterium avium, mycobacterium intracellullare, and mycobacterium scrofulaceum. J Infect Dis 1986; 153: 325-31.
54. Moore EH. Atypical mycobacterial infection in the lung: CT appearance. Radiology 1993; 187: 777-82.
55. Nalaboff KM, Rozenshtein A, Kaplan MH. Imaging of mycobacterium avium-intracellullare infection in AIDS patients on highly active antiretrovitral therapy: reversal syndrome. Am J Roentgen 2000; 157(2): 387-90.
56. Newport MJ, Huxley CM, Huston S, et al. A mutation in the interferin-?-receptor gene and susceptibility to mycobacrial infection. N Engl J Med 1996; 335: 1941-9.
57. Nightingale SD, Cameron DW et cols. Two controlled trials of rifabutin prophylaxis against M. bacterium avium complex infection in AIDS. N Engl J Med 1993; 329: 828- 33.
58. Patz EF, Swenson SJ, Erasmus J. Pulmonary manifestations of nontuberculous mycobacteria. Radiol Clin North Am 1995; 33: 719-29.
59. Pierce M, Crampton S, Henry D et al. A randomized trial of clarithromycin as prophylaxis against disseminated Mycobacterium avium complex infection in patients with advanced acquired immunodiciency syndrome. N Engl J Med 1996; 335: 384-91.
60. Portaels F. Epidemiology of mycobacterial diseases. Clin Dermatol 1995; 13: 207-22.
61. Safranek TJ, Jarvis LA, et al. Mycobacterium chelonae wound infections after plastic surgery employing contaminated gentian violet skin-marking solution. N Engl J Med 1987; 317: 197-201.
62. Schaad UB, Votteler GH, et al. Management of atypical mycobacterial lymphadenitis in childhood: a review based on 380 cases. J Pediatr 1979; 95: 356-60.
63. Shafran S, Singer J, Zarowny DP et al. A comparison of two regimens for the treatment of Mycobacterium avium complex bacteremia in AIDS: rifabutin, ethambutol and clarithromycin versus rifampin, ethambutol, clofazimine, and ciprofloxin . N Engl J Med 1996; 335: 377-83.
64. Shafran SD, Deschenes J, et al. Uveitis and pseudojaundice during a regimen of chlarithromycin, rifabutin, and ethambutol. N Engl J Med 1994; 330: 438-9.
65. Sherer R, Sable R, et al. Disseminated infection with mycobacterium kansasii in the Acquired Immunodificiency Syndrome. Ann Intern Med 1986; 105: 710-2.
66. Slutsky AM, Arbeit AM, Barber TW, et al. Polyclonal infections due to mycobacterium avium complex in patients with AIDS detected bypulsed-field gel electrophoresis of sequential clinical isolates. J Clin Microbiol 1994; 32: 1773- 8.
67. Smith DS, Lindholm-Levy P, et al. Mycobacterium terrae: case reports, literature review, and in vitro antibiotic susceptibility testing. Clin Infec Dis 2000; 30 (3): 444-53.
68. Steadman JE. High-catalase strains of mycobacterium kansasii isolated from water in Texas. J Clin Microbiol 1980; 11: 496-8.
69. Szabo I. Mybocatrium chelonei endemy after heart surgery with fatal consequences. Am Rev Respir Dis 1980; 121: 607.
70. Szabo I. Mycobacterium chelonei endemy after heart surgery with fatal consequences. Am Rev Respir Dis 1980; 121: 607.
71. Tanaka E, Anitani R, Niimi A,Ssuzuki K, Murayama T, Kuze F. Yield of computed tomography and bronchoscopy for the diagnosis of mycobacterium avium complez pulmonary disease. Am J Respir Crit Care Med 1997; 155: 2041-6.
72. Tanaka E, Kimoto T, Tsuyuguchi K, et al. Effect of clarithromycin regimen for Mycobacterium avium complex pulmonary disease. Am J Respir Crit Care Med 1999; 160: 866-72.
73. Thomsen VO, Dragsted UB, et al. Disseminated infection with mycobacterium genavense: a challenge to physicians and mycobacteriologists. J Clin Microbiol 1999; 37(12): 3901-5.
74. Wallace RJ jR, Brown BA, Griffith DE, et al. Initial clarithromycin monotherapy for Mycobacterium aviumintracellulare complex lung disease. Am J Respir Crit Care Med 1994; 149: 1355-41.
75. Wallace RJ Jr, Brown BA, Griffith DE, Girard W, Tanaka K. Reduced serum levels of clarithromycin in patients treated with multidrug regimens including rifampin or rifabutin for Mycobacterium avium-M. intracellulare infection. J Infect Dis 1995; 171: 747-50.
76. Wallace RJ Jr, Swenson JM, et al. Spectrum of disease due to rapidly growing mycobacteria. Rev Infect Dis 1983; 5: 657-79.
77. Wallace RJ, Zhang Y, Brown BA, et al. Polyclonal Mycobacterium avium complex infections in patients with nodular bronchiectasis. Am J Respir Crit Care Med 1998; 158: 1235-44.
78. Ward TT, Rimland D, Kauffman C, Huycke M, Evans TG, Heifets L. Randomized, open-label trial of azithromycin plus ethambutol as therapy for mycobacterium avium complex bacteremia in patients with human immunodeficiency virus infection. Clin Infect Dis 1998; 27: 1278-85.
79. Wenger JD, Spika JS, et al. Outbreak of mycobacterium chelonae infection associated with use of jet injectors. JAMA 1991; 264: 373-6.
80. Wolinsky E. Nontuberculous mycobacteria and associated diseases. Am Rev Respir Dis 1979; 119: 107-59.
81. Wollinsky E, Rynearson TK. Mycobacteria in soil and their relation to disease-associated strains. Am Rev Respir Dis 1968; 97: 1032-7.













