Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Informe Epidemiológico do Sus
versão impressa ISSN 0104-1673
Inf. Epidemiol. Sus v.9 n.3 Brasília set. 2000
http://dx.doi.org/10.5123/S0104-16732000000300002
Contribuição ao conhecimento sobre a hantavirose no Brasil
A contribution to the knowledge of hantaviruses in Brazil
Luiz Tadeu Moraes FigueiredoI; Aldaisa Cassanho ForsterII; Charles FulhorstIII; Eugênia Maria Silveira RodriguesII; Frederick KosterIV; Gelse Mazzoni CamposI; Gizelda KatsV; Júlia de Souza FelipeVI; Luiz Eloy PereiraVII; Lygia Busch IverssonVIII; Marcelo SimãoIX; Paula PadulaX; Paulo FelixXI; Pedro VasconcelosXII; Robert BradleyXIII; Robert shopeXIV; Rosely Cerqueira de OliveiraXV; Sylvia Lemos HinrichsenXVI
IDepartamento de Clinica medica - Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo
IIDepartamento de Medicina Social - Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo
IIIDepartamento de Patologia - Escola de Medicina - Universidade do Texas - USA
IVDepartamento de Medicina Interna - Escola de Medicina - Universidade do Novo México - USA
VCentro de Vigilância Epidemiológica Prof. Alexandre Vranjac - Secretaria Estadual de Saúde de São Paulo
VIDivisão de Biologia Médica - Instituto Adolfo Lutz
VIIInstituto Adolfo Lutz
VIIIDepartamento de Epidemiologia - Escola de Saúde Pública - Universidade de São Paulo
IXFaculdade de Medicina - Universidade Federal de Uberlândia
XInstituto Nacional de Enfermidades Infecciosas - ANLIS ( Buenos Aires - Argentina)
XIDepartamento de Patologia - Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo
XIIInstituto Evandro Chagas - Ministério da Saúde
XIIIDepartamento de Ciêncas Biológicas - Universidade do Texas Tech (Lubbock - USA)
XIVDepartamento de Patologia - Escola de Medicina - Universidade do Texas em Galveston (TX - USA)
XVCoordenação de Vigilância Epidemiológica - Centro Nacional de Epidemiologia - Fundação Nacional de Saúde
XVIDepartamento de Clínica Médica - Faculdade de Medicina - Universidade Federal de Pernambuco
RESUMO
Foram revistos diferentes aspectos da síndrome pulmonar e cardiovascular por hantavírus, uma doença emergente transmitida pela inalação das excretas de roedores silvestres e que ocorre principalmente em indivíduos que têm contato com o meio rural e com estes animais. Trata-se de doença grave, com letalidade acima de 50%, que leva à insuficiência respiratória e ao choque. A terapia de suporte ventilatório e cardiovascular deve ser precocemente instituída, preferencialmente em unidades de terapia intensiva. A presença de edema pulmonar exige cuidados de ventilação precoces. Apesar dos pacientes apresentarem-se em choque, deve-se ter cuidados com a infusão de líquidos para que não se agrave o edema pulmonar. É necessário informar os profissionais de saúde sobre a doença, considerando que muitos casos devem passar despercebidos. O diagnóstico laboratorial de hantavirose acessível e rápido precisa ser implementado e para tanto, precisa-se de pesquisas desenvolvendo métodos diagnósticos sensíveis e confiáveis. O controle da doença exige envolvimento de múltiplos profissionais visando conhecer sua história natural, a biologia do reservatório e a do vírus.
Palavras-Chave: Hantaviroses no Brasil; Síndrome Pulmonar por Hantavírus; Doença Viral Emergente.
SUMMARY
Hantavirus pulmonary and cardiovascular syndrome, an emerging disease transmitted by the inhalation of wild rodent excreta and affecting mostly agriculture workers and other professionals in contact with these animals, is reviewed. Hantavirus pulmonary syndrome is a severe disease with case fatality ratio greater than 50%. The syndrome is characterized by respiratory distress and shock. Disease management includes early mechanical ventilation and volume administration, preferable in intensive care units. Caution is advised during liquid infusion for shock treatment since pulmonary edema develops frequently. Information about hantavirus pulmonary and cardiovascular syndrome should be widely disseminated among the Brazilian medical community considering that, many cases can be undiagnosed. Rapid and accessible laboratory diagnosis of hantaviruses must be implemented in Brazil and research focused on the development of sensible and reliable diagnostic methods and reagents is encouraged. The control of hantaviruses depends on a multi-professional approach aiming to know the natural history, the biology of the reservoir and of the virus.
Key Words: Hantaviruses in Brazil; Hantavirus Pulmonary Syndrome; Emerging Viral Disease.
Introdução
Em 1993, três indivíduos moradores da área rural de Juquitiba, SP, apresentaram uma enfermidade aguda caracterizada por febre, cefaléia, prostração, náuseas e vômitos. Dois destes pacientes evoluíram com insuficiência respiratória aguda e foram a óbito. Exames sorológicos destes casos confirmaram o diagnóstico de hantavirose, evidenciando o primeiro surto conhecido de Síndrome Pulmonar e Cardiovascular por hantavírus (SPCVH) no Brasil.1 Desde então, até fevereiro de 2000, 43 casos desta grave doença foram notificados no país, com uma letalidade de 58%. Observou-se SPCVH nos Estados do Rio Grande do Sul, Minas Gerais e Mato Grosso. Porém, a maioria dos casos brasileiros ocorreu no Estado de São Paulo, na Região de Ribeirão Preto. Entre maio de 1998 e junho de 1999, ocorreram oito casos de SPCVH.
Os hantavírus têm sua evolução em estrito relacionamento com a de seus animais-reservatório, os quais, no continente americano, são roedores silvestres pertencentes à ordem Rodentia, família Muridae e subfamília Sigmodontinae. Os roedores mantêm infecção persistente e os vírus podem ser detectados em diversos órgãos do animal, mesmo após meses do contágio.2
São conhecidas como hantaviroses duas doenças humanas distintas, a febre hemorrágica com síndrome renal, que ocorre na Ásia e Europa, e a síndrome pulmonar e cardiovascular (SPCVH), que ocorre nas Américas.
Os hantavírus são vírus RNA esféricos, envelopados, com diâmetro de 80 a 120nm, possuem projeções glicoprotéicas na superfície e compreendem um gênero na família Bunyaviridae. Possuem genoma trissegmentado de fita simples e polaridade negativa. Os vírus denominados Juquitiba, Araraquara, Franca e Castelo dos Sonhos tiveram genoma detectado e são agentes associados a doença humana no Brasil.3,4
O mecanismo habitual de infecção humana nas hantaviroses relaciona-se à inalação de aerossóis contendo excretas de roedores. Entretanto, em surto ocorrido na Região de Bariloche, Argentina, em 1996, causado pelo vírus Andes, as evidências mostram que ocorreu transmissão interpessoal do vírus entre os pacientes com SPCVH.5 Cinco pacientes eram médicos, alguns outros, funcionários de um hospital, e um médico e um familiar de paciente infectaram-se, pelo contato com outros pacientes em Buenos Aires. A transmissão interpessoal do vírus , observada neste surto, teria ocorrido por contato direto, fômites contaminados ou por inalação de aerossóis.
Estudo efetuado no Estado de São Paulo mostrou locais com altíssima densidade populacional de roedores silvestres e a pesquisa de anticorpos nos animais capturados mostrou níveis altos de anticorpos contra hantavírus no "rato do rabo peludo" (Bolomys lasiurus), no "rato da mata" (Akodon sp.) e no "ratinho do arroz" (Oligoryzomys sp.). Acredita-se que estes três roedores silvestres sejam reservatórios de vírus que causam SPCVH no Brasil.
Objetivamos com este documento contribuir para o diagnóstico, tratamento, estudo epidemiológico e controle da SPCVH, uma doença emergente no Brasil, divulgando recomendações feitas por especialistas brasileiros, norte-americanos e argentinos reunidos no Encontro Internacional sobre Hantavirose ocorrido na Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, em fevereiro de 2000. Também, pretendemos colocar este problema na discussão e planejamento das autoridades em saúde pública do país.
Fisiopatologia
O exame anátomo-patológico dos pulmões de casos fatais por SPCVH mostra edema alveolar difuso, membranas hialinas e infiltrado intersticial linfocitário. O estado preservado em que se encontram as células endoteliais nos pulmões, associado à hemoconcentração e à presença, em alguns casos, de derrames pleurais, sugere que a SPCVH manifeste-se com extravasamento de líquidos dos capilares para interstício e alvéolos. Também, encontram-se células semelhantes a linfócitos atípicos, denominadas imunoblastos, no sangue, nos interstícios pulmonares, nos espaços portais hepáticos e em baço.6 Presença de partículas virais e antígenos de hantavírus é descrita nas células endoteliais de seres humanos infectados bem como em roedores, nos pulmões, mas, também, no endotélio renal, cardíaco, hepático, esplênico e em tecido adiposo. Observa-se que altas cargas virais se associam a uma maior intensidade do edema pulmonar. Os hantavírus americanos utilizam ß3 integrinas como receptores para infectar as células.7 Estas proteínas compõem as tight-junctions que unem as células endoteliais e fecham a barreira alvéolo-capilar. A infecção viral, provavelmente, desencadeia agressão imunológica, humoral e celular, ao endotélio vascular, principalmente em nível pulmonar. Em conseqüência da infecção viral do endotélio capilar e desta agressão imune ocorreria extravasamento de líquidos e edema pulmonar levando à insuficiência respiratória. Observa-se que o edema pulmonar coincide com queda rápida da viremia.
As plaquetas, que também possuem ß3 integrinas em membrana, são infectadas pelos hantavírus, ocorrendo trombocitopenia e redução da adesividade plaquetária, o que explica, em parte, fenômenos hemorrágicos que ocorrem nesses pacientes.
O quadro de choque que ocorre na SPCVH tem mecanismo fisopatológico pouco conhecido. Observa-se ausência de fenômeno inflamatório em miocárdio de casos fatais. O quadro de choque associa-se a baixos níveis de anticorpos neutralizantes contra o vírus. Trabalho sobre distribuição de freqüências fenotípicas em pacientes com SPCVH mostrou associação entre alelos HLA-B, haplótipos MHC: B35 e DR14 e mortalidade por choque na SPCVH. Sabendo-se que a região dos genes MHC associa-se ao controle da liberação do Fator de necrose trumoral (TNF)como alelo hipersecretor e que existem altos títulos de TNF no sangue dos pacientes com SPCVH, supõe-se que TNF tenha participação no choque cardiogênico que ocorre na SPCVH, atuando como depressor da função miocárdica.
Diagnóstico Clínico
A SPCVH manifesta-se com dois acometimentos: pneumonia intersticial grave e generalizada que leva à insuficiência respiratória e choque cardiogênico, que é causa comum de óbito.
Os oito casos de SPCVH ocorridos na região de Ribeirão Preto permitiram determinar um padrão na história e quadro clínico que será utilizado na descrição da doença. Os pacientes eram, em sua maioria, do sexo masculino (sete homens e uma mulher), tinham idades entre 13 e 55 anos, predominando os adultos jovens, entre 20 e 30 anos, e 75% tinham contato com o meio rural em sua atividade profissional. Nestes casos, a doença independeu de nível socioeconômico já que dois eram lavradores e outros três, proprietários rurais. Também, todos os casos, com exceção de um, ocorreram nos meses de maio e junho, ou seja, em final do outono e início do inverno, sugerindo uma sazonalidade para a SPCVH na região de Ribeirão Preto - SP.
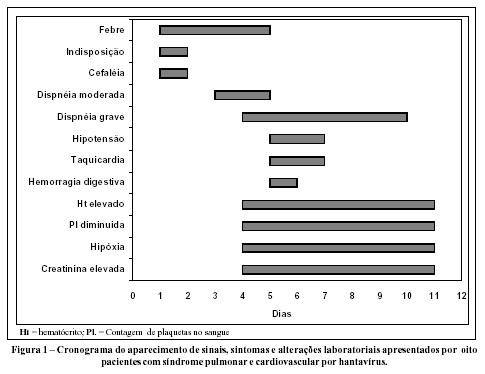
Sabe-se que a SPCVH inicia-se após um período de incubação de 11 a 29 dias. Os principais sinais e sintomas apresentados pelos oito pacientes da região de Ribeirão Preto incluíam, em todos os casos, febre e dispnéia. Taquicardia, astenia, hipotensão e estertoração à ausculta pulmonar ocorreram em 85% dos casos. Cefaléia, cianose, vômitos e tosse seca apresentaram-se em 60% dos pacientes. Mialgias, diarréia e hemorragia digestiva foram menos comuns, sendo observados
em 1/3 dos pacientes. Alterações em exames laboratoriais dos oito casos estudados incluíam plaquetopenia (<130000/mm3) e hipoxemia (PO2 < 70 mmHg), hemoconcentração (hematócrito > 55%), leucocitose (>15000/mm3), neutrofilia (> 7000/mm3) com formas jovens (> 600 bastonetes/mm3). Alterações de função renal (creatinina > 1,5 mg/ 100ml) foram bastante freqüentes, ocorrendo em 87,8 % dos casos. A Figura 1 mostra a cronologia de aparecimento dos principais sinais, sintomas e alterações laboratoriais apresentados pelos pacientes. A SPCVH se inicia com sinais e sintomas inespecíficos, febre, cefaléia e astenia. A dispnéia surge no 3º ou 4º dia de doença manifestando-se, inicialmente, aos moderados esforços, mas progredindo em 24 a 48 horas para dispnéia aos mínimos esforços, concomitante a uma inundação de alvéolos detectável por estertoragem crepitante disseminada ao exame dos pulmões. Também, acompanha a inundação de alvéolos pulmonares, tosse freqüente com eliminação de secreção pulmonar rósea. A dispnéia, desconfortável e incapacitante, leva o paciente a procurar assistência médica, mais comumente no 4° dia de doença. Na admissão hospitalar, que ocorreu no 4º e 5º dia de doença para os pacientes analisados, já estavam presentes a hipotensão, o hematócrito aumentado (> 55%), a plaquetopenia (< 130.000/ mm3), a hipóxia (PO2<70mmHg) e a creatininemia elevada (> 1,5mg/100ml). Nos pacientes que sobreviveram à doença, 50% dos casos, o curso clínico e laboratorial mostrou melhora acentuada das funções respiratória, renal e hemodinâmica em torno do 10° dia após início dos sintomas, ou seja, após cinco ou seis dias de internação.
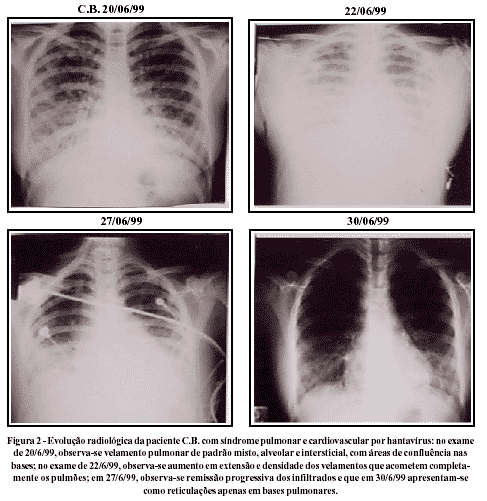
O exame radiográfico de tórax dos pacientes com SPCVH mostra-se típico e, portanto, de grande importância para o diagnóstico. Na Figura 2, a evolução radiológica da paciente C.B. mostra o padrão radiológico da pneumopatia que ocorre na SPCVH. Acompanham o surgimento da febre e da dispnéia, em torno do quarto dia de doença, imagens radiológicas de velamento pulmonar bilateral intersticial e que vão se tornando mistos, com infiltração alveolar. Concomitante com o agravamento da insuficiência respiratória, o velamento pulmonar misto torna-se progressivamente confluente e mais denso, acometendo praticamente todos os campos pulmonares. Nesta fase, medidas terapêuticas de oxigenação, como intubação e ventilação são comumente tomadas. Após aproximadamente três dias, o quadro radiológico começa a mostrar sinais de melhora e esta remissão costuma ser progressiva. No caso de C.B., duas semanas após o aparecimento dos sintomas, a remissão dos velamentos foi quase completa, mantendo-se no último exame, ainda, infiltrado reticular nas bases pulmonares. Dois dos pacientes estudados apresentaram derrames pleurais, com pequeno e médio volume.
Diagnóstico diferencial na fase inicial da SPCVH é feito com uma vasta gama de doenças infecciosas ressaltando-se as viroses respiratórias por influenza A e B e as gastroenterites infecciosas. Na fase em que o paciente já se encontra com insuficiência respiratória e choque, fazem diagnóstico diferencial as septicemias, ressaltando-se as estafilocócicas, a leptospirose, as pneumonias (atípicas) por outros vírus, por micoplasma e, principalmente, a pneumocistose quando ocorre como primeira manifestação da Aids em indivíduo previamente saudável.
Entretanto, deve-se ressaltar que a doença não se inicia com tosse, coriza, ou outros sintomas respiratórios. A tosse costuma surgir no terceiro dia de doença.
Sabendo-se que o quadro de choque e o quadro de insuficiência respiratória na SPCVH podem instalar-se ou tornarse irreversíveis em questão de horas, é importante que, para reduzir a letalidade, os pacientes sejam atendidos em local com recursos de terapia intensiva e que, no máximo, em 12 horas, sejam iniciadas medidas terapêuticas de suporte. Trata-se de decisão crítica para a vida do paciente.
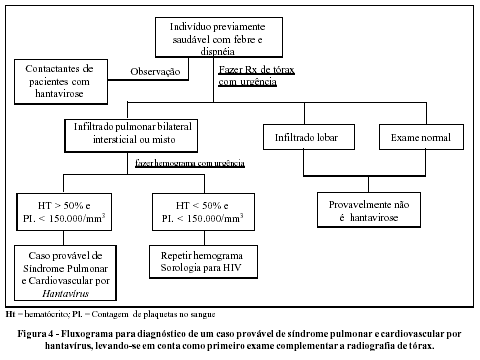
Deve-se suspeitar de SPCVH: diante de indivíduos previamente hígidos, que trabalham em contato com o meio rural (não necessáriamente em todos os casos), apresentando doença com febre e mialgias e que evolui com tosse e insuficiência respiratória (freqüência > 26 ipm). Nestes casos, a contagem de plaquetas deve ser feita imediatamente e se estiver menor do que 130.000/mm3 isto reforça fortemente o diagnóstico clínico, devendo-se, nestes casos, proceder-se à internação hospitalar em local com recursos de terapia intensiva, conforme mostrado na Figura 3. O achado de plaquetas maior do que 130.000/mm3 não afasta a suspeita clínica. Sabendo-se que na SPCVH as plaquetas séricas tendem à queda acelerada, deve-se repetir o exame após seis horas e, em caso de, no segundo exame, o número de plaquetas ser inferior a 130.000/mm3, deve-se proceder à internação hospitalar. Também, a radiografia de tórax deve ser feita em todos os casos e a presença de infiltrado intersticial bilateral, que pode evoluir até velamento total dos campos pleuro-pulmonares, em paciente previamente hígido, poderia ser usada para diagnóstico clínico em locais onde não se dispõe com facilidade do exame de contagem das plaquetas conforme mostrado na Figura 4.

Outros exames complementares que auxiliam o diagnóstico de SPCVH incluem hemograma, que costuma mostrar hemoconcentração, presença de imunoblastos e a dosagem de transaminases séricas que costumam estar elevadas. Podem-se utilizar, no diagnóstico, esfregaços sangüíneos corados pelo Giemsa que propiciam a visualização de grande quantidade de imunoblastos, além de permitir a detecção de outros patógenos circulantes como plasmódios, etc., que fariam diagnóstico diferencial com a hantavirose. Também, hemoculturas são importantes para efetuar o diagnóstico de infecções bacterianas graves que fazem diagnóstico diferencial com a doença por hantavírus.
Diagnóstico Laboratorial
O diagnóstico laboratorial dos casos humanos de hantavirose no Brasil é comumente feito por método sorológico de ELISA que visa à detecção de anticorpos IgM e IgG específicos. O diagnóstico sorológico é possível, mesmo na fase aguda da doença, porque os anticorpos na SPCVH surgem juntamente com o aparecimento dos sinais e sintomas. O diagnóstico sorológico pode, também, ser utilizado em inquéritos populacionais. Para tanto, utilizam-se, nos testes, antígenos dos vírus SinNombre (USA) ou do vírus Andes (Argentina). Estes antígenos são produzidos por purificação direta do material viral após inativação ou por clonagem e expressão de genes virais que passam a produzir sua proteína antigênica em bactéria. Comumente, utilizam-se como antígenos proteínas N do nucleocapsídeo viral ou as glicoproteínas G1 e G2 do envelope viral. O método utilizado é um ELISA indireto. Outros métodos sorológicos menos utilizados incluem a imunofluorescência indireta com células infectadas por hantavírus em spotslides e o Westernblot.8
Deve-se ressaltar que a situação do diagnóstico laboratorial de hantaviroses se limita a dois ou três locais no país e que ele é completamente dependente de antígenos de hantavírus fornecidos principalmente pelo CDC dos USA e laboratórios da Argentina, já que os referidos antígenos não são produzidos no Brasil. Trata-se de importante fator limitante ao conhecimento da doença no país e que deve, seguramente, relacionar-se a uma importante subnotificação de casos. Para melhorar esta situação, recomenda-se: estimular a pesquisa visando à produção de antígenos para diagnóstico laboratorial com amostras brasileiras de hantavírus; incentivar o desenvolvimento de técnicas diagnósticas e uniformizá-las através de uma bateria única de soros-controles; implementar o diagnóstico da infecção em maior número de laboratórios distribuídos no território do país, naturalmente com supervisão e controle de qualidade; regionalizar o acesso diagnóstico, equipando laboratórios para facilitar esse processo; criar um banco de antígenos a ser produzido com amostras brasileiras de hantavírus, bem como de soros-controles (positivo e negativo), para que sejam distribuídos aos laboratórios existentes; promover o treinamento de pessoal de laboratório para consecução do item anterior e para uniformizar procedimentos e técnicas.
O diagnóstico virológico de hantaviroses pode ser feito por tentativas de isolamento viral em culturas de células de rim de macaco verde africano (VERO-E6) com posterior identificação do vírus isolado por imunofluorescência ou teste de reação em cadeia da polimerase precedido por transcrição reversa (RTP-CR). O grande problema no manuseio dos hantavírus é que existe risco de contaminação dos trabalhadores em laboratório e, por isso, recomenda-se que esse trabalho seja feito em laboratórios de segurança do tipo P3 que praticamente não existem no país para este uso. Também, RT-PCR pode ser feita após extração de RNA diretamente no sangue total ou soro de pacientes com a SPCVH, detectando presença do genoma viral. Para tanto, deve-se encaminhar ao laboratório de virologia, no prazo máximo de 12 horas amostras a 4oC. Também as amostras podem ficar armazenadas até o processamento em nitrogênio líquido ou em freezers a -70oC.
Materiais de necrópsia de casos fatais de SPCVH, como pulmões e outros órgãos podem ser testados por método imunohistoquímico e hibridação, detectando a presença viral com o tecido visualizado ao microscópio, ou por RTPCR após extração de RNA do tecido.
A detecção de genes virais completos por RT-PCR em tecidos ou no sangue de pacientes com SPCVH, bem como em tecidos de roedores, permitiria o seqüenciamento dos nucleotídios destes genes seguido de análise filogenética do vírus detectado quando comparado a outros já conhecidos. Esta análise permitiria um melhor conhecimento do vírus bem como de seus roedores-reservatórios. Também, poder-se-ia fazer clonagem do gene viral em plasmídio que, por sua vez, infectaria bactérias, as quais passariam a expressar a proteína antigênica desse vírus. O produto bacteriano expressado, contendo antígenos do hantavírus, é material de manuseio seguro, porque sem risco da presença viral e de uso importante no diagnóstico sorológico, bem como em pesquisas futuras para o desenvolvimento de vacinas.
Sendo os procedimentos de diagnóstico virológico de grande importância para o estudo das hantaviroses, já que não se sabe praticamente nada quantos aos hantavirus existentes no Brasil, pois a maioria dos casos dessas virose tem sido diagnosticada por sorologia, recomenda-se: que sejam criadas unidades laboratoriais com nível de segurança P3 para que vírus possam ser isolados e que se utilizem mais as provas de RT-PCR para seqüenciamento e reconhecimento dos tipos virais; prover recursos e treinamento de pessoal aos laboratórios de saúde pública distribuídos no país; manter um banco de tecidos, de casos fatais humanos e de roedores, sob refrigeração e em blocos de parafina, para facilitar estudos retrospectivos.
Tratamento
Bons resultados no tratamento da SPCVH dependem da precocidade da internação, antes que o paciente entre em franca insuficiência respiratória e choque. Por outro lado, considerando que a SPCVH é doença grave, com alta mortalidade, e que evidências sugerem ter ocorrido transmissão interpessoal de hantavírus, inclusive acometendo pessoal médico, em surtos argentinos e chilenos pelo vírus Andes, recomenda-se que os pacientes sejam isolados em quarto privativo e que a equipe médica adote precauções universais e respiratórias utilizando luvas, avental, óculos protetores e máscara até o desaparecimento do quadro respiratório e da febre.
Os pacientes internados devem receber cuidados precoces de terapia intensiva, monitoração cuidadosa da oxigenação, do balanço de fluidos, da pressão arterial e ventilação precoce. Inicialmente, pode-se oxigenar o paciente com cânula nasal ou máscara de Venturi. Entretanto, se o edema intersticial progride com extravasamento de líquidos e inundação pulmonar, deve-se entubar o paciente e iniciar ventilação mecânica, evitando-se distensão alveolar excessiva. Também, durante a ventilação, devem-se evitar colapsos e re-expansões alveolares repetidas, utilizando-se pressão expiratória final positiva elevada. Quanto ao choque cardiogênico, observa-se que cursa com grande aumento da resistência vascular periférica e má perfusão dos órgãos. Para seu monitoramento, deve-se implantar no paciente cateter em artéria pulmonar ou cateter venoso que deverá, além de propiciar o monitoramento do choque (medida da pressão em artéria pulmonar ou da pressão venosa central), ser utilizado na infusão de líquidos e drogas. Entretanto, o tratamento do choque na SPCVH deve ser muito cuidadoso quanto à infusão de líquidos, porque esta infusão agrava o edema pulmonar e a insuficiência respiratória. Recomenda-se: infundir não mais que dois litros de líquidos cristalóides; utilizar plasma fresco congelado para compensar as perdas plasmáticas no interstício pulmonar e não utilizar diuréticos para reduzir o edema pulmonar porque estes exacerbam o choque. Recomenda-se, também, o uso das drogas inotrópicas dobutamina (3 a 5ug/Kg/min) e/ou dopamina, visando melhorar o débito cardíaco e reduzir a resistência vascular periférica. O uso de corticosteróides não se mostrou útil no tratamento destes pacientes. Observa-se que níveis de lactato maiores do que 4 mM/L associam-se à alta mortalidade na SPCVH.
A droga antiviral ribavirina, tem ação in vitro sobre os hantavirus americanos e tem sido utilizada com redução da mortalidade em sete vezes em casos de febre hemorrágica com síndrome renal, na Ásia. A droga, na dose de 1g 6/6h por quatro dias seguida de 1g 8/8h por três dias pode ser utilizada no tratamento de casos de SPCVH. Entretanto, estudo efetuado não mostrou benefício clínico da droga, provavelmente porque esta leva quatro dias para atuar e na SPCVH a doença grave já se encontra instalada após este tempo.8
Outra terapia possível, mas ainda não utilizada na SPCVH, refere-se à imunização passiva dos pacientes com pools de soros de convalescentes contendo altos níveis de anticorpos específicos. Uma indicação para este tratamento seria a observação de que o quadro de choque associa-se a baixos níveis de anticorpos neutralizantes contra o vírus. Também, sabendo que existem altos títulos de TNF no sangue pacientes com SPCVH, o desenvolvimento de drogas bloqueadoras do Ffkb, um precursor na síntese do TNF, seria uma esperança terapêutica para o futuro.
Um exemplo de que a letalidade pode ser reduzida com o incremento de informações, aquisição de experiência e capacitação progressiva para diagnosticar casos de SPCVH cada vez mais precocemente, ocorreu nos surtos causados pelo vírus Sin Nombre na América do Norte. A letalidade, que era superior a 50%, em 1993, caiu para 40% em 1994 - 1996, e, em 1997, de 20 casos notificados, apenas 20% morreram.3
Recomendações finais
É importante ressaltar que a compreensão do problema das hantaviroses e da SPCVH envolve diferentes áreas do conhecimento, relaciona-se com a meteorologia, a modificação do meio ambiente e o cultivo agrícola que determinam o aumento das populações de roedores silvestres. A expansão desta zoonose passa pela forma como os lavradores e agricultores trabalham e entram em contato com as excretas de roedores para se infectarem, até o modo como esses pacientes são atendidos nos postos de saúde e hospitais (Será que os profissionais de saúde conhecem a doença e a incluem em seu diagnóstico diferencial ?). Envolve, também, o laboratório para diagnóstico e pesquisas nas áreas da Virologia e da Biologia Molecular. Portanto, trata-se de um problema que, para controle, necessita abordagem multiprofissional, incluindo médicos clínicos e sanitaristas, pessoal de enfermagem, biólogos e biomédicos, mamalogistas, veterinários, engenheiros agrônomos, meteorologistas, incluindo, também, os profissionais que lidam no campo com risco de infectarem-se. Para tanto, algumas medidas, além das citadas anteriormente, necessitam ser tomadas, conforme recomenda-se a seguir:
• Divulgar informações sobre hantavirose aos diversos setores da população, especialmente aos profissionais de saúde (médicos clínicos, outros profissionais da área da saúde, técnicos de laboratórios), lideranças políticas e lideranças informais de cada comunidade, lembrando que é uma doença de notificação compulsória.
• Incluir informações à população orientando quanto a aspectos dos roedores e procedimentos de limpeza nos locais de risco.
• Investigar todos os casos suspeitos e alertar a vigilância epidemiológica dos estados e municípios de interesse.
• Criar uma rede de vigilância utilizando a internet para agilizar a comunicação e a divulgação dos dados epidemiológicos.
• Reunir nas instituições existentes no país que trabalham com taxonomia, biologia e ecologia de roedores as informações disponíveis e difundi-las aos que estão investigando a doença.
• Criar programas de treinamento visando à formação de equipes de campo para trabalho com roedores.
• Realizar estudos sobre a distribuição geográfica das espécies e gêneros de roedores potencialmente transmissores de hantavírus. É importante o monitoramento contínuo dos roedores já identificados como transmissores de hantavírus. É desejável que tais estudos sejam realizados em consonância com alterações climáticas e ambientais.
• Considerando que a sistemática de roedores é deveras complicada, seria importante que os estudos contassem com a colaboração de mamalogistas de museus e universidades para que exista confiabilidade quanto às espécies identificadas.
• Buscar envolver os centros de zoonoses nas pesquisas para que neles, sejam formados grupos específicos com vistas a intervenções futuras, na ocorrência de casos.
• Catalogar as atividades de risco para a infecção por hantavírus, bem como as áreas de risco, alertando as pessoas contactantes.
• Integrar estudos da área de meteorologia com a ocorrência de casos de hantaviroses visando detectar épocas favoráveis à proliferação de roedores silvestres e a organizar programas preventivos da transmissão destes vírus para o homem.
• Promover a pesquisa sobre hantaviroses e regionalizar diagnóstico e tratamento dos casos.
• Identificar os hantavírus circulantes, classificando-os perante os previamente conhecidos.
• Incentivar o desenvolvimento de técnicas diagnósticas e uniformizá-las através de uma bateria única de soros controles.
Referências bibliográficas
1. Iverssen LB, Travassos da Rosa APA, Rosa MDB. Infecção humana por hantavírus nas regiões sul e sudeste do Brasil. Revista da Associação Médica Brasileira 1994; 40 : 85-92.
2. Zhao X, Hay J. The evolution of Hantaviruses. Immunological Investigations 1997; 26 : 191- 197.
3. Peters CJ. HPS in the Americas. In: Scheld WM, Craig WA, Hughes JM. Emerging Infections 2. Washington DC: ASM Press; 1998. p. 17-64.
4. Johnson AM, Souza LTM, Ferreira IB, Pereira LE, Ksiazek TG, Rollin PE, Peters CJ, Nichol ST. Genetic investigation of novel hantaviruses causing fatal HPS in Brazil. Journal of Medical Virology 1999; 59 : 527- 535.
5. Wells RM, Estani SS, Yadon ZE. An unusual outbreak in southern Argentina: person to person transmission? Emerging Infectious Diseases 1997; 3 : 171-174.
6. Figueiredo LTM, Moreli ML, Almeida VSO, Félix PR, Bruno JC, Ferreira IB, Mançano FD. Hantavirus pulmonary syndrome in Guariba, SP, Brazil. Report of 2 cases. Revista do Instituto de Medicina Tropical de São Paulo 1999; 41 : 131-137.
7. Gravilovskaya IN, Shepley M, Shaw R, Ginsberg MH, Mackow ER. B3 integrins mediate the cellular entry of hantaviruses that cause respiratory failure. Proceedings of the National Academy of Sciences of USA 1998; 95 : 7074-7079.
8. Simpson SQ. Hantavirus pulmonary syndrome. Heart & Lung 1998; 27 : 51-57.
 Endereço para correspondência:
Endereço para correspondência:
Luiz Tadeu Moraes Figueiredo
Unidade Multidepartamental de Pesquisa em Virologia, Faculdade de Medicina de Ribeirão Preto,
Av. Bandeirantes, 3.900
14049-900
Ribeirão Preto, SP, Brasil
e-mail: ltmfigue@fmrp.usp.br.












 Curriculum ScienTI
Curriculum ScienTI
