Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.24 n.2 Brasília jun. 2015
http://dx.doi.org/10.5123/S1679-49742015000200017
TRADUÇÃO
Principais itens para relatar Revisões sistemáticas e Meta-análises: A recomendação PRISMA*
Tradução para o idioma português do documento: Moher D, Liberati A, Tetzlaff J, Altman DG, The PRISMA Group. Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. Disponível em: www.prisma-statement.org. Traduzido por: Taís Freire Galvão e Thais de Souza Andrade Pansani; retro-traduzido por: David Harrad
Introdução
Revisões sistemáticas e meta-análises se tornaram extremamente importantes na assistência à saúde. Clínicos as leem para se manterem atualizados em suas áreas,1,2 e elas são frequentemente utilizadas como ponto de partida para o desenvolvimento de instruções sobre práticas clínicas. Agências de fomento podem solicitar uma revisão sistemática para se assegurarem de que há necessidade de pesquisas adicionais,3 e alguns periódicos da área clínica estão seguindo nessa mesma direção.4 Como em toda pesquisa, o valor da revisão sistemática depende do que foi feito, do que foi descoberto, e da clareza do relato. Assim como em outras publicações, a qualidade dos relatos das revisões sistemáticas varia, limitando a habilidade dos leitores de avaliar os pontos fortes e fracos dessas revisões.
Vários estudos anteriores avaliaram a qualidade das revisões sistemáticas. Em 1987, Mulrow analisou 50 artigos de revisão publicados em quatro grandes periódicos de medicina em 1985 e 1986 e verificou que nenhum deles atendia a todos os oito critérios científicos, como a avaliação de qualidade dos estudos incluídos.5 Em 1987, Sacks et al6 avaliaram a adequação do relato de 83 meta-análises em 23 características de seis domínios. Os relatos eram fracos em geral; entre uma a 14 características foram adequadamente relatadas (média = 7,7; desvio padrão = 2,7). Uma atualização de 1996 deste estudo mostrou pouca melhora.7
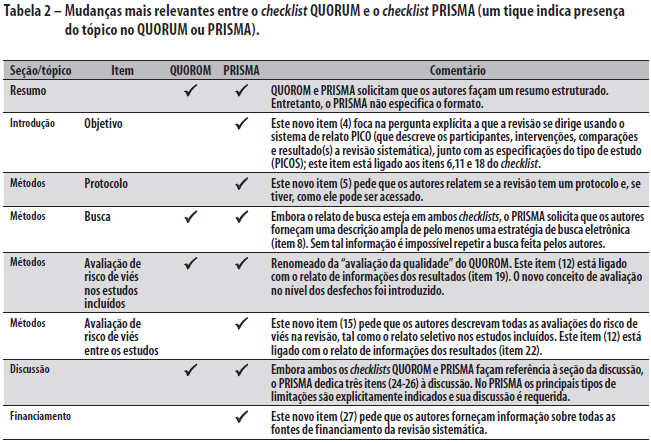
Em 1996, para tratar sobre o subaproveitamento dos relatos de meta-análise, um grupo interacional desenvolveu um guia chamado recomendação QUORUM (Qualidade dos Relatos de Meta-análises), cujo foco era os relatos de meta-análises de ensaios clínicos randomizados.8 Neste artigo, sumarizamos a revisão dessas diretrizes, renomeada como PRISMA (Principais Itens para Relatar Revisões sistemáticas e Meta-análises), que foi atualizada para atender a vários avanços conceituais e práticos na ciência das revisões sistemáticas (Quadro 1).

Terminologia
A terminologia utilizada para descrever uma revisão sistemática ou meta-análise mudou com o tempo. Uma das razões para mudar o nome de QUORUM para PRISMA foi o desejo de abranger tanto as revisões sistemáticas quanto as meta-análises. Foram adotadas as definições usadas pela Colaboração Cochrane.9 Uma revisão sistemática é uma revisão de uma pergunta formulada de forma clara, que utiliza métodos sistemáticos e explícitos para identificar, selecionar e avaliar criticamente pesquisas relevantes, e coletar e analisar dados desses estudos que são incluídos na revisão. Métodos estatísticos (meta-análise) podem ou não ser usados para analisar e resumir os resultados dos estudos incluídos. Meta-análise se refere ao uso de técnicas estatísticas em uma revisão sistemática para integrar os resultados dos estudos incluídos.
Desenvolvimento da Recomendação PRISMA
Uma reunião de três dias foi realizada em Ottawa, Canadá, em junho de 2005 com 29 participantes, incluindo autores de revisões, metodologistas, clínicos, editores e um consumidor. O objetivo da reunião de Ottawa era revisar e expandir o checklist e o fluxograma do QUORUM, conforme necessário.
O comitê executivo realizou as seguintes tarefas antes do encontro: uma revisão sistemática de estudos examinando a qualidade dos relatos de revisão sistemática, e uma busca extensiva na literatura para identificar artigos metodológicos e outros que pudessem dar base à reunião, principalmente em relação à modificação dos itens do checklist. Foi realizado um inquérito internacional com autores de revisões, consumidores, e grupos que utilizam revisões sistemáticas e meta-análises, incluindo a Rede Internacional de Avaliação de Tecnologias em Saúde (INAHTA) e a Rede Internacional de Diretrizes Clínicas (GIN). O objetivo do inquérito foi verificar os pontos de vista sobre o QUORUM, incluindo o mérito dos itens já existentes no checklist. Os resultados dessas atividades foram apresentados durante a reunião e resumidos no site do PRISMA (http://www.prisma-statement.org/).
Apenas os itens julgados essenciais foram mantidos ou adicionados ao checklist. Alguns itens adicionais foram considerados desejáveis e os autores da revisão podem optar por incluí-los se relevantes.10 Por exemplo, é útil indicar se a revisão sistemática é uma atualização11 de outra revisão, e descrever qualquer mudança nos procedimentos indicados no protocolo original.
Logo após a reunião, um esboço do checklist PRISMA circulou pelo grupo, incluindo os membros que foram convidados, mas não puderam comparecer. Um arquivo foi criado, contendo comentários e revisões de cada participante, e o checklist foi revisado 11 vezes. O grupo aprovou o checklist, o fluxograma, e o presente artigo.
Embora nenhuma evidência direta tenha sido encontrada para apoiar a retenção ou a adição de alguns itens, evidências de outros domínios foram consideradas relevantes. Por exemplo, o item 5 pede que os autores forneçam informação sobre o registro da revisão sistemática, incluindo um número de registro, se disponível. Embora o registro de revisão sistemática não esteja amplamente disponível12,13, os periódicos participantes do Comitê Internacional de Editores de Periódicos Médicos (ICMJE)14 agora requerem que todos os experimentos clínicos sejam registrados, num esforço para aumentar a transparência e responsabilidade.15 Tais aspectos também tendem a beneficiar os autores de revisões sistemáticas, possivelmente reduzindo o risco de um número excessivo de revisões relacionadas a uma mesma pergunta16,17 e fornecendo maior transparência ao atualizar revisões sistemáticas.
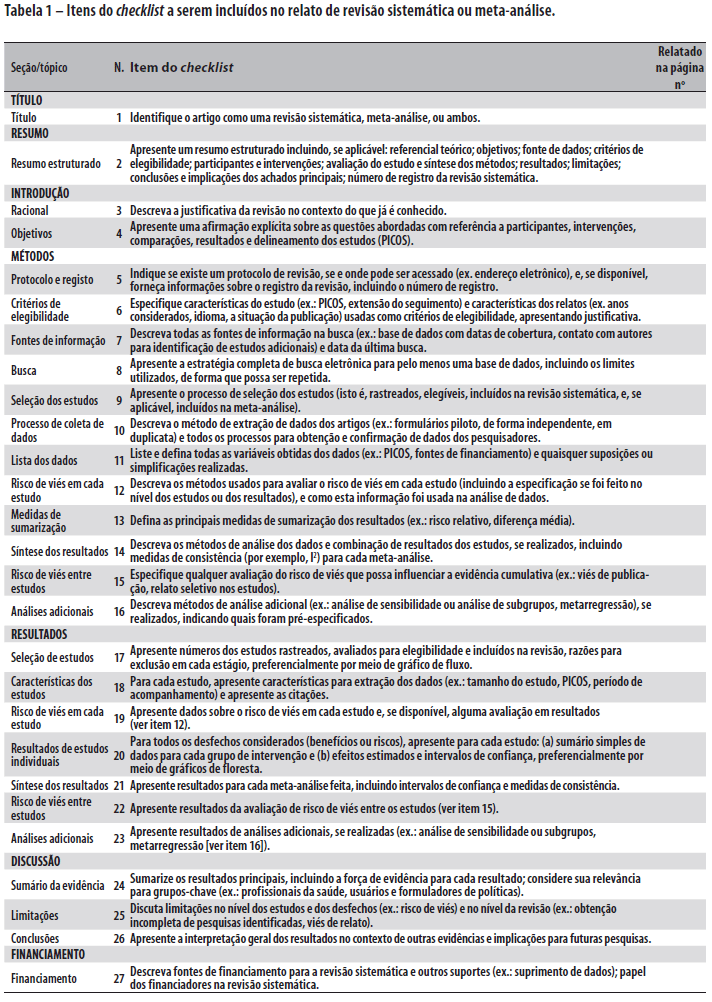
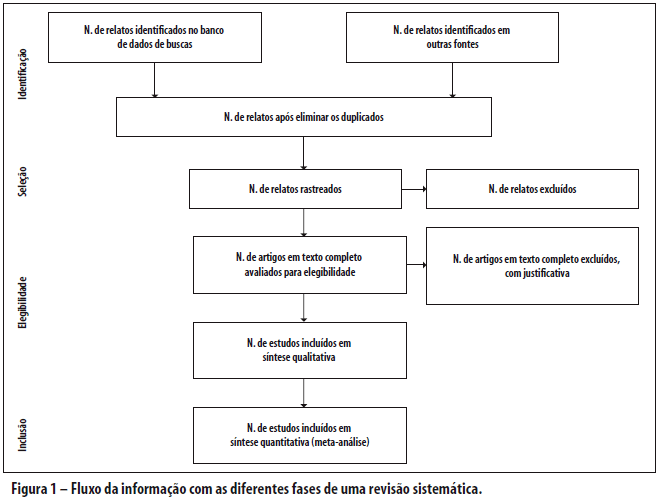
A recomendação PRISMA consiste em um checklist com 27 itens (Tabela 1; veja também o Quadro S1 para um modelo em Word disponível para uso dos pesquisadores) e um fluxograma de quatro etapas (Figura 1; veja também a Figura S1 para um modelo em Word disponível para uso dos pesquisadores). O objetivo do PRISMA é ajudar os autores a melhorarem o relato de revisões sistemáticas e meta-análises. O foco foi em ensaios clínicos randomizados, mas o PRISMA também pode ser usado como uma base para relatos de revisões sistemáticas de outros tipos de pesquisa, particularmente avaliações de intervenções. O PRISMA também pode ser útil para a avaliação crítica de revisões sistemáticas publicadas. Entretanto, o checklist PRISMA não é um instrumento de avaliação de qualidade para ponderar a qualidade de uma revisão sistemática.
Do QUOROM ao PRISMA
O novo checklist PRISMA difere em diversos aspectos do checklist QUOROM, e as mudanças substanciais são destacadas na Tabela 2. Em geral, o checklist PRISMA "separa" diversos itens presentes no checklist QUOROM e, quando possível, diversos itens do checklist são ligados para melhorar a consistência do relato de revisão sistemática.
O fluxograma também foi modificado. Antes de incluir estudos e fornecer razões para excluir outros, a equipe de revisão deve pesquisar a literatura disponível. Esta busca resulta no número de relatos encontrados. Uma vez que estes relatos foram rastreados e os critérios de elegibilidade aplicados, um número menor de artigos remanescerá. O número de artigos incluídos pode ser menor (ou maior) do que o número de estudos, porque os artigos podem relatar múltiplos estudos, e os resultados de um estudo particular podem ser publicados em diversos artigos. Para capturar esta informação, o fluxograma do PRISMA solicita agora a informação sobre essas fases do processo de revisão.
Endosso
A recomendação PRISMA deve substituir o QUOROM naqueles periódicos que haviam endossado o QUOROM. Espera-se que outros periódicos apoiem o PRISMA; isso pode ser feito por meio do registro no website do PRISMA. Para enfatizar aos autores, e a outros, a importância do relato transparente de revisões sistemáticas, incentivam-se os periódicos que apoiam a recomendação PRISMA a referenciá-lo e incluir seu endereço eletrônico em suas instruções aos autores. Organizações editoriais são convidadas a endossar o PRISMA e incentivar autores a aderirem a seus princípios.
O documento de explicação e elaboração PRISMA
Além da recomendação PRISMA, um documento de apoio de explicação e elaboração foi produzido18 seguindo o estilo usado em outras orientações19-21. O processo de finalização deste documento incluiu o desenvolvimento de um grande banco de dados de exemplares para destacar qual a melhor forma de reportar cada item do checklist, e identificar uma boa base de evidências que apoie a inclusão de cada item no checklist. O documento de explicação e elaboração foi finalizado após várias reuniões presenciais e repetidas revisões entre os participantes do evento, que depois foram compartilhadas com o grupo todo para revisões adicionais e aprovação final. Finalmente, o grupo formou um subcomitê de divulgação para ajudar na divulgação e implementação do PRISMA.
Discussão
A qualidade do relato de revisões sistemáticas ainda não é ótima.22-27 Em uma revisão recente de 300 revisões sistemáticas, poucos autores relataram avaliar o possível viés de publicação,22 apesar de haver fortes evidências tanto de sua existência28 quanto de seu impacto nos resultados das revisões sistemáticas.29 Mesmo quando a possibilidade de viés de publicação é avaliada, não há nenhuma garantia de que os revisores o avaliaram ou o interpretaram apropriadamente.30 Embora a ausência de relato de tal avaliação não indique necessariamente que ela não tenha sido feita, relatar uma avaliação de possível viés de publicação é um provável marcador do rigor na conduta da revisão sistemática.
Diversas abordagens foram desenvolvidas para conduzir revisões sistemáticas em uma disposição mais ampla de perguntas. Por exemplo, atualmente revisões sistemáticas são conduzidas para investigar custo-efetividade,31 perguntas de diagnóstico32 e prognóstico,33 associações genéticas,34 e formulação de políticas.35 Os conceitos e tópicos gerais cobertos pelo PRISMA são todos relevantes para qualquer revisão sistemática, não apenas para aquelas cujo objetivo é resumir os benefícios e prejuízos de uma intervenção em assistência médica. Entretanto, algumas modificações dos itens do checklist ou do fluxograma serão necessárias em circunstâncias específicas. Por exemplo, avaliar o risco de viés é um conceito chave, mas os itens usados para tal avaliação em uma revisão diagnóstica provavelmente irão focar em questões como o espectro de pacientes e a verificação do status da doença, que diferem das revisões de intervenções. O fluxograma também necessitará de ajustes ao relatar os dados de um paciente individualmente em uma meta-análise.36
O documento explanatório foi desenvolvido18 para aumentar a utilidade do PRISMA. Para cada item do checklist, este documento mostra um exemplo de bom relato, uma razão para sua inclusão, e a evidência de apoio, incluindo referências, sempre que possível. Acredita-se que este documento servirá também como um recurso útil para aqueles que ensinam a metodologia de revisão sistemática. Periódicos são incentivados a incluir a referência ao documento explanatório em suas instruções aos autores.
Como todo esforço baseado em evidência, o PRISMA é um documento vivo. Sendo assim, os leitores estão convidados a comentar a versão revisada, particularmente o novo checklist e o fluxograma, por meio do website do PRISMA. Essas informações serão usadas para prosseguir no desenvolvimento continuado do PRISMA.
Figura S1. Fluxo da informação nas diferentes fases da revisão sistemática (modelo para download disponível para uso dos pesquisadores).
Disponível em: http://scielo.iec.pa.gov.br/doc/ress/v24n2/a17ms01.doc
http://www.scielo.br/pdf/ress/v24n2/a17ms02.pdf
Quadro S1. Checklist dos itens para incluir quando da redação de uma revisão sistemática ou meta-análise (modelo para download disponível para uso dos pesquisadores).
Disponível em: http://scielo.iec.pa.gov.br/doc/ress/v24n2/a17ms03.doc
http://www.scielo.br/pdf/ress/v24n2/a17ms04.pdf
Reconhecimento
As seguintes pessoas colaboraram para a Recomendação PRISMA: Doug Altman, DSc, Centre for Statistics in Medicine (Oxford, UK); Gerd Antes, PhD, University Hospital Freiburg (Freiburg, Germany); David Atkins, MD, MPH, Health Services Research and Development Service, Veterans Health Administration (Washington, D. C., US); Virginia Barbour, MRCP, DPhil, PLoS Medicine (Cambridge, UK); Nick Barrowman, PhD, Children's Hospital of Eastern Ontario (Ottawa, Canada); Jesse A. Berlin, ScD, Johnson & Johnson Pharmaceutical Research and Development (Titusville, New Jersey, US); Jocalyn Clark, PhD, PLoS Medicine (quando este artigo foi escrito, BMJ, London, UK); Mike Clarke, PhD, UK Cochrane Centre (Oxford, UK) and School of Nursing and Midwifery, Trinity College (Dublin, Ireland); Deborah Cook, MD, Departments of Medicine, Clinical Epidemiology and Biostatistics, McMaster University (Hamilton, Canada); Roberto D'Amico, PhD, Università di Modena e Reggio Emilia (Modena, Italy) and Centro Cochrane Italiano, Istituto Ricerche Farmacologiche Mario Negri (Milan, Italy); Jonathan J. Deeks, PhD, University of Birmingham (Birmingham, UK); P. J. Devereaux, MD, PhD, Departments of Medicine, Clinical Epidemiology and Biostatistics, McMaster University (Hamilton, Canada); Kay Dicker-sin, PhD, Johns Hopkins Bloomberg School of Public Health (Baltimore, Maryland, US); Matthias Egger, MD, Department of Social and Preventive Medicine, University of Bern (Bern, Switzerland); Edzard Ernst, MD, PhD, FRCP, FRCP(Edin), Peninsula Medical School (Exeter, UK); Peter C. G0tzsche, MD, MSc, The Nordic Cochrane Centre (Copenhagen, Denmark); Jeremy Grimshaw, MBChB, PhD, FRCFP, Ottawa Hospital Research Institute (Ottawa, Canada); Gordon Guyatt, MD, Departments of Medicine, Clinical Epidemiology and Biostatistics, McMaster University (Hamilton, Canada); Julian Higgins, PhD, MRC Biostatistics Unit (Cambridge, UK); John P. A. Ioannidis, MD, University of Ioannina Campus (Ioannina, Greece); Jos Kleijnen, MD, PhD, Kleijnen Systematic Reviews Ltd (York, UK) and School for Public Health and Primary Care (CAPHRI), University of Maastricht (Maastricht, Netherlands); Tom Lang, MA, Tom Lang Communications and Training (Davis, California, US); Alessandro Liberati, MD, Università di Modena e Reggio Emilia (Modena, Italy) and Centro Cochrane Italiano, Istituto Ricerche Farmacologiche Mario Negri (Milan, Italy); Nicola Magrini, MD, NHS Centre for the Evaluation of the Effectiveness of Health Care - CeVEAS (Modena, Italy); David McNamee, PhD, The Lancet (London, UK); Lorenzo Moja, MD, MSc, Centro Cochrane Italiano, Instituto Ricerche Farmacologiche Mario Negri (Milan, Italy); David Moher, PhD, Ottawa Methods Centre, Ottawa Hospital Research Institute (Ottawa, Canada); Cynthia Mulrow, MD, MSc, Annals of Internal Medicine (Philadelphia, Pennsylvania, US); Maryann Napoli, Center for Medical Consumers (New York, New York, US); Andy Oxman, MD, Norwegian Health Services Research Centre (Oslo, Norway); Ba' Pham, MMath, Toronto Health Economics and Technology Assessment Collaborative (Toronto, Canada) (quando da primeira reunião, GlaxoSmithKli-ne Canada, Mississauga, Canada); Drummond Rennie, MD, FRCP, FACP, University of California San Francisco (San Francisco, California, US); Margaret Sampson, MLIS, Children's Hospital otf Eastern Ontario (Ottawa, Canada); Kenneth F. Schulz, PhD, MBA, Family Health International (Durham, North Carolina, US); Paul G. Shekelle, MD, PhD, Southern California Evidence Based Practice Center (Santa Monica, California, US); Jennifer Tetzlaff, BSc, Ottawa Methods Centre, Ottawa Hospital Research Institute (Ottawa, Canada); David Tovey, FRCGP, The Cochrane Library, Cochrane Collaboration (Oxford, UK) (quando da primeira reunião, BMJ, London, UK); Peter Tugwell, MD, MSc, FRCPC, Institute of Population Health, University of Ottawa (Ottawa, Canada).
Referências
1. Oxman AD, Cook DJ, Guyatt GH. Users' guides to the medical literature: how to use an overview. JAMA. 1994 Nov;272(17):1367-71.
2. Swingler GH, Volmink J, Ioannidis JP. Number of published systematic reviews and global burden of disease: database analysis. BMJ. 2003 Nov;327(7423):1083-4.
3. Canadian Institutes of Health Research. Randomized controlled trials registration/application checklist (12/2006) [Internet]. 2006 [cited 2009 May 19]. Available from: http://www.cihrirsc.gc.ca/e/documents/rct_reg_e.pdf
4. Young C, Horton R. Putting clinical trials into context. Lancet. 2005 Jul;366(9480):107-8.
5. Mulrow CD. The medical review article: state of the science. Ann Intern Med. 1987 Mar;106(3):485-8.
6. Sacks HS, Berrier J, Reitman D, Ancona-Berk VA, Chalmers TC. Meta-analysis of randomized controlled trials. New Engl J Med. 1987 Feb;316(8):450-5.
7. Sacks HS, Reitman D, Pagano D, Kupelnick B. Meta-analysis: an update. Mt Sinai J Med. 1996 May-Sep;63(3-4):216-24.
8. Moher D, Cook DJ, Eastwood S, Olkin I, Rennie D, Stroup DF. Improving the quality of reporting of meta-analysis of randomised controlled trials: the QUOROM statement. Lancet. 1994 Nov;354(9193):1896-900.
9. The Cochrane Collaboration. Glossary of terms in The Cochrane Collaboration [Internet]. Version 4.2.5. London: The Cochrane Collaboration; 2005 [cited 2009 May 19]. Available from: http://community.cochrane.org/sites/default/files/uploads/glossary.pdf
10. Strech D, Tilburt J. Value judgments in the analysis and synthesis of evidence. J Clin Epidemiol. 2008 Jun;61(6):521-4.
11. Moher D, Tsertsvadze A. Systematic reviews: when is an update an update? Lancet. 2006 Mar;367(9514):881-3.
12. University of York. Centre for Reviews and Dissemination [Internet]. York: University of York; 2009 [cited 2009 May 19]. Available from: https://www.york.ac.uk/crd/
13. The Joanna Briggs Institute. Protocols and work in progress [Internet]. Adelaide: JBI; 2008 [cited 2009 May 19]. Available from: http://www.joannabriggs.edu.au/pubs/systematic_reviews_prot.php
14. De Angelis C, Drazan JM, Frizelle FA, Haug C, Hoey J, Horton R, et al. Clinical trial registration: a statement from the International Committee of Medical Journal Editors. CMAJ. 2004 Sep;171(6):606-7.
15. Whittington CJ, Kendall T, Fonagy P, Cottrell D, Cotgrove A, Boddington E. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet. 2004 Apr;363(9418):1341-5.
16. Bagshaw SM, McAlister FA, Manns BJ, Ghali WA. Acetylcysteine in the prevention of contrast-induced nephropathy: a case study of the pitfalls in the evolution of evidence. Arch Intern Med. 2006 Jan;166(2):161-6.
17. Biondi-Zoccai GG, Lotrionte M, Abbate A, Testa L, Remigi E, Burzotta F, et al. Compliance with QUOROM and quality of reporting of overlapping meta-analyses on the role of acetylcysteine in the prevention of contrast associated nephropathy: case study. BMJ. 2006 Jan;332(7535):202-9.
18. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche P, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009 Jul;6(7):e1000100.
19. Altman DG, Schulz KR, Moher D, Egger M, Davidoff F, Elbourne D, et al. The revised CONSORT statement for reporting randomized trials: explanation and elaboration. Ann Intern Med. 2001 Apr;134(8):663-94.
20. Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig LM, et al. Towards complete and accurate reporting of studies of diagnostic accuracy: the STARD explanation and elaboration. Ann Intern Med. 2003 Jan;138(1):40-4.
21. Vandenbroucke JP, von Elm E, Altman DG, Gøtzsche PC, Mulrow CD, Pocock SJ, et al. Strengthening the Reporting of Observational Studies in Epidemiology (STROBE): explanation and elaboration. Ann Intern Med. 2007 Oct;147(8):573-7.
22. Moher D, Tetzlaff J, Tricco AC, Sampson M, Altman DG. Epidemiology and reporting characteristics of systematic reviews. PLoS Med. 2007 Mar;4(3):e78.
23. Bhandari M, Morrow F, Kulkarni AV, Tornetta P. Meta-analyses in orthopaedic surgery: a systematic review of their methodologies. J Bone Joint Surg Am. 2001 Jan;83(1):15-24.
24. Kelly KD, Travers A, Dorgan M, Slater L, Rowe BH. Evaluating the quality of systematic reviews in the emergency medicine literature. Ann Emerg Med. 2001 Nov;38(5):518-26.
25. Richards D. The quality of systematic reviews in dentistry: what is the quality of the available systematic reviews in dentistry? Evid Based Dent. 2004 Mar;5:17.
26. Choi PT, Halpern SH, Malik N, Jadad AR, Tramèr MR, Walder B. Examining the evidence in anesthesia literature: a critical appraisal of systematic reviews. Anesth Analg. 2001 Mar;92(3):700-9.
27. Delaney A, Bagshaw SM, Ferland A, Manns B, Laupland KB, Doig CJ. A systematic evaluation of the quality of meta-analyses in the critical care literature. Crit Care. 2005 Oct;9(5):R575-82.
28. Dickersin K. Publication bias: recognizing the problem, understanding its origins and scope, and preventing harm. In: Rothstein HR, Sutton AJ, Borenstein M, editors. Publication bias in meta-analysis: prevention, assessment and adjustments. Chichester (UK): John Wiley & Sons; 2005. p. 11-33.
29. Sutton AJ. Evidence concerning the consequences of publication and related biases. In: Rothstein HR, Sutton AJ, Borenstein M, editors. Publication bias in meta-analysis: prevention, assessment and adjustments. Chichester (UK): John Wiley & Sons; 2005. p. 175-92.
30. Lau J, Ioannidis JPA, Terrin N, Schmid CH, Olkin I. The case of the misleading funnel plot. BMJ. 2006 Sep;333:597-600.
31. Ladabaum U, Chopra CL, Huang G, Scheiman JM, Chernew ME, Fendrick AM. Aspirin as an adjunct to screening for prevention of sporadic colorectal cancer: a cost-effectiveness analysis. Ann Intern Med. 2001 Nov;135(9):769-81.
32. Deeks JJ. Systematic reviews in health care: systematic reviews of evaluations of diagnostic and screening tests. BMJ. 2001 Jul;323(7305):157-62.
33. Altman DG. Systematic reviews of evaluations of prognostic variables. BMJ. 2001 Jul;323(7306):224-8.
34. Ioannidis JP, Ntzani EE, Trikalinos TA, Contopoulos-Ioannidis DG. Replication validity of genetic association studies. Nat Genet. 2001 Nov;29(3):306-9.
35. Lavis J, Davies H, Oxman A, Denis JL, Golden-Biddle K, Ferlie E. Towards systematic reviews that inform health care management and policy-making. J Health Serv Res Policy. 2005 Jul;10 Suppl 1:35-48.
36. Stewart LA, Clarke MJ. Practical methodology of metaanalyses (overviews) using updated individual patient data: Cochrane Working Group. Stat Med. 1995 Oct;14(19):2057-79.
37. Moja LP, Telaro E, D'Amico R, Moschetti I, Coe L, Liberati A. Assessment of methodological quality of primary studies by systematic reviews: results of the metaquality cross sectional study. BMJ. 2005 Apr;330:1053-5.
38. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coelho P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008 Apr;336(7650):924-6.
39. Schunemann HJ, Jaeschke R, Cook DJ, Bria WF, El-Solh AA, Ernst A, et al. An official ATS statement: grading the quality of evidence and strength of recommendations in ATS guidelines and recommendations. Am J Respir Crit Care Med. 2006;174(5):605-14.
40. Chan AW, Hróbjartsson A, Haahr MT, Gotzsche PC, Altman DG. Empirical evidence for selective reporting of outcomes in randomized trials: comparison of protocols to published articles. JAMA. 2004 May;291(20):2457-65.
41. Chan AW, Krleza-Jeric K, Schmid I, Altman DG. Outcome reporting bias in randomized trials funded by the Canadian Institutes of Health Research. CMAJ. 2004 Sep;171(7):735-40.
42. Silagy CA, Middleton P, Hopewell S. Publishing protocols of systematic reviews: comparing what was done to what was planned. JAMA. 2002 Jun;287(21):2831-4.
*Esta tradução foi confirmada pelo grupo PRISMA.













