Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.24 n.4 Brasília dez. 2015
http://dx.doi.org/10.5123/S1679-49742015000400022
ARTIGO DE OPINIÃO
Sob a pele do PL-200/2015 do Senado Brasileiro
Under the skin of Brazilian Senate Bill of Law 200/2015
Carlo Henrique Goretti Zanetti1; Gysélle Saddi Tannous2
1Universidade de Brasília, Faculdade de Ciências da Saúde, Brasília-DF, Brasil
2Federação Nacional das Associações Pestalozzi, Diretoria Executiva, Brasília-DF, Brasil
O Brasil é um país megamorbidiverso. Pesquisas científicas direcionadas ao desenvolvimento tecnológico são imprescindíveis. Apoiá-las é estratégico. Entretanto, diferentes apoios representam diferentes ganhos, ou podem significar perdas.
O Senado brasileiro acredita dar sua contribuição ao avanço das pesquisas clínicas no Brasil, ao encampar proposta de empresários representados pela Aliança Pesquisa Clínica Brasil e pela Interfarma - Associação da Indústria Farmacêutica de Pesquisa, expressa no Projeto de Lei (PL) n° 200/2015. Trata-se de uma versão empobrecida das propostas do Food and Drug Administration (FDA, órgão regulador do governo estadunidense), e da indústria global do Norte, não éticas, expressas no Documento das Américas, elaborado em 2005 na IV Conferência Pan-Americana para a harmonização da regulamentação farmacêutica.1,2,3 O PL propõe fixar em lei modelo foráneo e laissez-fairiano de sistema de revisão ética baseado nas ideias econômicas liberais de menos exigências, mais flexibilidade e menor tramitação.
Desde 1988, a juridicidade da revisão ética das pesquisas com seres humanos no Brasil é amparada, no plano constitucional, pelos direitos fundamentais constantes do art. 5o da Carta Magna, e pela institucionalidade da Saúde; no âmbito legal, pela Lei Orgânica no 8.142/1990, que dispõe sobre a participação da comunidade na gestão do Sistema Único de Saúde (SUS); e no infralegal, pelas resoluções do Conselho Nacional de Saúde (CNS) (no 01/1988, primeira resolução da história do CNS; no 196/1996, que institui o Sistema CEP-CONEP; no 466/2012, a qual atualiza a Resolução no 196; e outras resoluções complementares).
Em que pese a existência de um amplo aparato normativo no atual Sistema de proteção ética aos participantes de pesquisas no Brasil, deliberadamente não se lançou mão do recurso de uma lei específica, dada a natureza dinâmica do objeto normatizado: construtos culturais morais. Tal opção cria certa vulnerabilidade política: opositores dos princípios do ordenamento recorrem ocasionalmente ao Parlamento, instância também responsiva às demandas particularistas e fragmentárias, com propostas de leis específicas que, não raro, fazem tábula rasa do Sistema CEP-CONEP e de sua longa história de sucesso.
A raiz de toda oposição é de fundamento eminentemente ético: a negação dos princípios da beneficência e autonomia. Beneficência, quanto às questões do placebo e do fornecimento de medicamento pós-estudo; autonomia, quanto à ampliação da condição abusível da relação paciente-profissional e da remuneração de participantes doentes. Para doentes, placebo é controle de experimento com a negação do benefício de tratamento convencionado. O não fornecimento de medicamento pós-estudo é negação à continuidade do benefício do tratamento experimental encerrado ou quando finalizada a participação individual. Remunerar participantes doentes é fazer a relação paciente-profissional ficar incontornavelmente assimétrica e heterônoma, quando mediada pela forma mercadoria.
No Parlamento, o debate nunca emerge como discussão ética. Tampouco se dá como discussão política, pois assim se externalizaria o conflito entre elites neoconservadoras e neocorporativas (coalizões intransparentes de segmentos da burocracia, empresários e profissionais)4 representadas versus sociedade organizada na base da democracia participativa em torno do sistema ético vigente. Isso tornaria nítido como ações de representação versus participação na democracia brasileira repercutem no setor; evidenciaria a força dos lobbies em oposição à amplitude, legitimidade, tempo, esforço, dedicação e cultura de milhares de pessoas mobilizadas na discussão, revisão e efetivação das normas do CNS sobre pesquisas com seres humanos. Pois, politicamente, constata-se que o Sistema CEP-CONEP é edificação democrática densa, "pedra no sapato" do neoconservadorismo elitista predominante na gestão dos poderes da República. Tanto que, às vezes, parlamentares deixam escapar ressentimentos quanto às atividades normativas infralegais do CNS, as quais, para eles, solapam prerrogativas representativas do Legislativo.
Obstados os planos dos debates filosófico e político, no congresso o debate é decaído no questionamento da administração pública do particular nacional desse negócio econômico global. Esse núcleo é acrescido do apelo emocional com finalidade despolitizante ("coitados dos doentes que necessitam com urgência da generosidade das novas tecnologias terapêutico-medicamentosas!"), explorando a vulnerabilidade do doente, móbile contra o qual se funda todo o sistema ético.
Incapazes de contestar aberta e diretamente o "custo Brasil" inerente à beneficência (que onera patrocinadores internacionais), para os mesmos fins, a crítica neocorporativa foca a administração pública do Sistema CEP-CONEP, alegando que ela atrapalha a captação e atrasa o início de pesquisas clínicas internacionais (multicêntricas), ao tipificar essas pesquisas como tema especial e exigir sua aprovação em dupla instância (CEPs e CONEP).
Diz-se que o atual sistema de revisão ética é um custo que impacta no desempenho econômico do setor. Todavia, não se diz que esse tempo de aprovação vem caindo muito no país como resultado de ações arrojadas - a exemplo do lançamento da Plataforma Brasil ou dos esforços concentrados da CONEP -, e que pode se reduzir ainda mais com a futura acreditação de CEPs.5 Também não se diz nada sobre a entrada no Sistema de projetos cujos responsáveis, mesmo cientes das regras nacionais sobre placebo e fornecimento de medicamento pós-estudo, usam de todas as instâncias recursais e do tempo do Sistema, apelando para o não fornecimento e, só depois da última negação, aceitam e iniciam a pesquisa. Com isso se realiza uma militância processual ativa e consciente, cujo atraso premeditado só inflaciona a contabilidade do tempo processual dos estudos multicêntricos.
Ai, confundindo-se participação social com burocracia, diz-se que ela nos faz perder estudos para outros países. Esse é o arrimo original dos argumentos pró-PL 200. Essa é a linguagem dominante no discurso congressista. A ele, nuanças e aspectos novos são acrescidos com o trabalho das comissões e suas emendas. Mas, será robusta a base desse discurso? Resistirá ela à análise feita em seus próprios termos? Aparentemente, os dados globais das pesquisas clínicas contam outra história. As evidências do sucesso brasileiro derivam da análise comparativa da atividade de pesquisas clínicas de alcance internacional efetivadas no Brasil e no mundo.
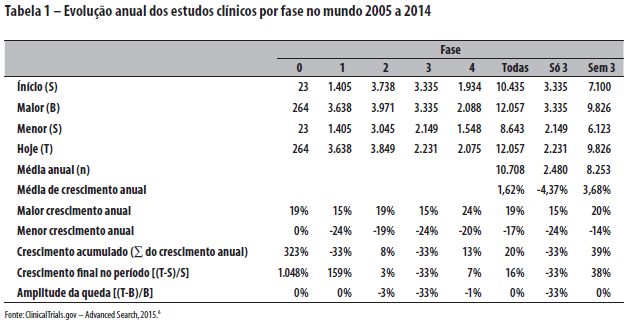
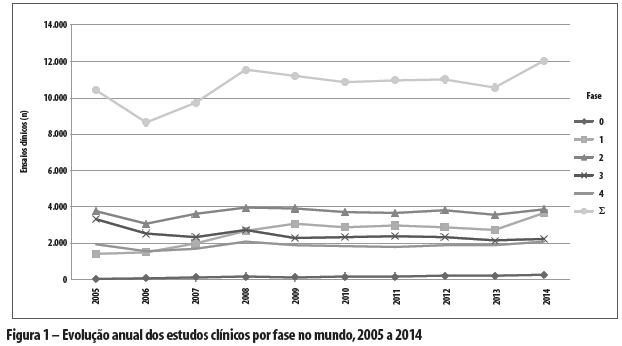
Consideremos os dados globais no decênio, constantes da Tabela 1 e da Figura 1.
Por sua vez, os dados brasileiros são apresentados na Tabela 2 e na Figura 2.
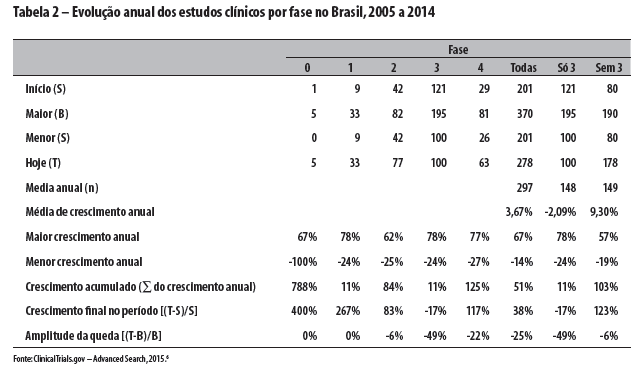
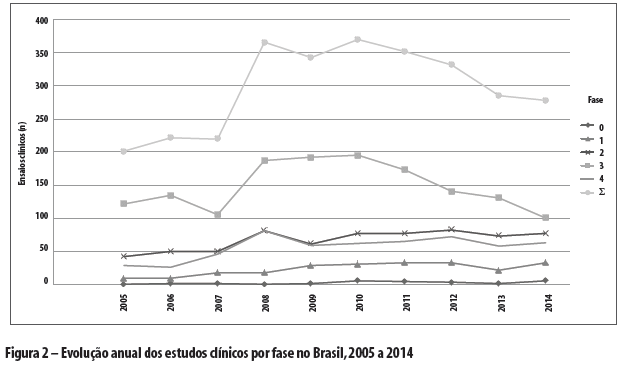
Globalmente, as pesquisas clínicas cresceram a taxas modestas de 1,62% ao ano no decênio, refreadas pelo desempenho das de fase 3 (de base comercial, pré-mercado, que refletem dinâmica econômica da ciência e tecnologia associada como investimento de ampliação da circulação e consumo), com consideráveis taxas negativas anuais de -4,37%. As demais fases - 0, 1 e 2 (de base industrial, que refletem a dinâmica econômica da ciência e tecnologia como investimento de ampliação produtiva) e 4 (de base comercial/industrial, pós-lançamento de mercado, que refletem dinâmica econômica da ciência e tecnologia associada com o reinvestimento e ampliação produtiva) - cresceram a taxas robustas de 3,68% ao ano. O Brasil obteve desempenho incomparavelmente melhor: 3,67%, -2,09% e 9,30%, respectivamente.
Considerando-se o crescimento acumulado, no mundo, todas as fases aumentaram 20% no decênio, sendo que as pesquisas da fase 3 caíram em -33%, e as fases 0, 1, 2 e 4 juntas cresceram 39%. O Brasil, novamente, obteve desempenho incomparavelmente melhor: 51%, 11% e 103%, respectivamente.
Comparando o Brasil e o mundo com países selecionados, das Américas, do grupo BRICS (Brasil, Rússia, Índia, China e África do Sul), do G7 (Estados Unidos, Alemanha, Itália, Japão, França, Reino Unido e Canadá), do Sul da Europa (Portugal, Espanha, Itália, Grécia e Turquia), e de porte produtivo assemelhado (Holanda, Bélgica, Israel, Dinamarca, Austrália, Polônia, Suíça, Taiwan, Suécia, Japão, Áustria, Rússia e República Tcheca), tem-se o ranking de crescimento no decênio, conforme as Tabelas 3 e 4.
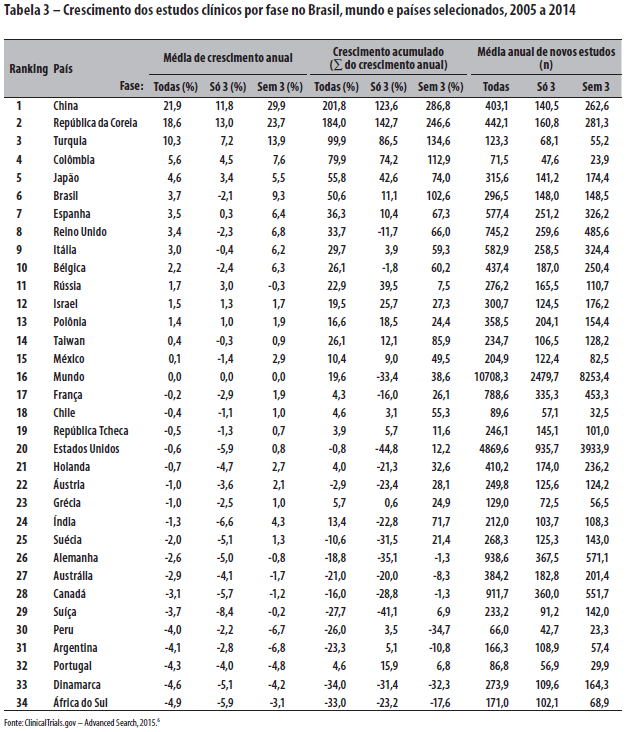
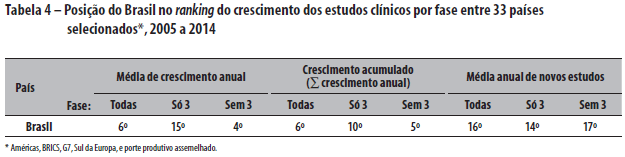
Em resumo, a queda no volume mundial de estudos de fase 3 no Brasil e no mundo, desde a crise econômica do subprime de 2008, e o crescimento vertiginoso dos novos players globais China e Coreia - por razões comerciais e industriais gerais que marcaram a região como grande mercado emergente e o "chão de fábrica" do mundo - acarretaram deslocamentos de investimentos em escala planetária. Contrarrestando, o Brasil resistiu muito bem. Nada indica que a explicação dos fenômenos gerais que têm impacto particular nas pesquisas fase 3 no país possa ser elaborada estribando-se na crítica local do padrão da administração pública do Sistema CEP-CONEP. O Sistema virou bode expiatório para um golpe político contra a prática vitoriosa de democracia participativa do SUS nesse tema, bem como para se derrubar sorrateiramente a vigência dos princípios da beneficência e autonomia nas atividades de pesquisa com seres humanos vulneráveis. Infelizmente, a história recente da Índia é exemplo mundial lamentável do quanto custa, em vidas e em retrocesso econômico, abolir utilitariamente tais princípios éticos nas pesquisas com seres humanos.
O Senado brasileiro contribuiria bem mais com o país se analisasse melhor as razões para o desempenho negativo dos estudos de fase 3. Nosso gargalo não é ético, e sim industrial. Por isso, em vez de seguir proposta da indústria estadunidense e desconstruir algo que funciona como exemplo mundial de sistema de revisão ética, melhor seria almejar o padrão industrial do Norte e formular uma política industrial farmacêutica nacional que estimule ciência e inovação em toda a cadeia produtiva, da pesquisa básica e laboratorial aos estudos clínicos, fase final de desenvolvimento. Isso ampliaria a autonomia, reduzira a vulnerabilidade nacional aos ataques e flutuações especulativas globais no particular dos estudos fase 3, e daria fundamento sólido, estável, autóctone, independente, cultural e moralmente conciliado aos ensaios clínicos no Brasil.
Referências
1. Palácios M, Rego S. A proposta de regulamentação ética da pesquisa clínica apresentada ao Senado Brasileiro não interessa aos participantes de pesquisa. Cad Saude Publica. 2015 ago;31(8):1583-5.
2. Greco DB. Pesquisa clínica: sua relevância para a saúde pública ou ética na pesquisa clínica como alavanca para a ética no acesso aos cuidados de saúde. In: Anais do 11° Congresso Brasileiro de Bioética; 3° Conferência Internacional Sobre Ensino da Ética; 2015 set 16-18; Curitiba. Curitiba: Sociedade Brasileira de Bioética; 2015.
3. Ministério da Saúde (BR). Conselho Nacional de Saúde. Comissão Nacional de Ética em Pesquisa. Carta de Brasília: carta aberta à sociedade brasileira, formulada pelos participantes do Encontro Nacional dos Comitês de Ética em Pesquisa. In: Anais do 4° Encontro Nacional de Comitês de Ética em Pesquisa; 2015 out 15-16; Brasília. Brasília: Conselho Nacional de Saúde; 2015.
4. Habermas J. A nova obscuridade: pequenos escritos políticos. São Paulo: UNESP; 2015.
5. Lima Filho JA. Projeto de Lei 200/2015 joga na latrina os direitos dos participantes de pesquisas no Brasil [Internet]. São Paulo: Agência AIDS; 2015 [citado 2015 set 28]. Disponível em: http://agenciaaids.com.br/home/artigos/artigo_detalhe/483#.VgnqLXpVikp
6. ClinicalTrials.gov: advanced search [Internet]. Bethesda (MD): U.S. National Institutes of Health; 2015 [cited 2015 Aug 30]. Available from: https://clinicaltrials.gov/ct2/search/advanced
 Endereço para correspondência:
Endereço para correspondência:
Carlo Henrique Goretti Zanetti-
Universidade de Brasília,
Faculdade de Ciências da Saúde,
Departamento de Odontologia.
Campus Universitário Darcy Ribeiro-
Asa Norte, Brasília. CEP.: 70910-900
E-mail: zanetti@unb.br