Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2337-9622
Epidemiol. Serv. Saúde v.25 n.1 Brasília jan./mar. 2016
http://dx.doi.org/10.5123/S1679-49742016000100002
ARTIGO ORIGINAL
Características epidemiológicas da febre amarela no Brasil, 2000-2012*
Epidemiological characteristics of yellow fever in Brazil, 2000-2012
Características epidemiológicas de la fiebre amarilla en Brasil en el período 2000-2012
Karina Ribeiro Leite Jardim Cavalcante1; Pedro Luiz Tauil2
1Ministério da Saúde, Secretaria de Vigilância em Saúde, Brasília-DF, Brasil2
2Universidade de Brasília, Faculdade de Medicina, Brasília-DF, Brasil
RESUMO
OBJETIVO: o estudo visa descrever as características epidemiológicas da febre amarela no Brasil no período de 2000 a 2012.
MÉTODOS: estudo epidemiológico, ecológico, descritivo, utilizando informações dos bancos de dados do Ministério da Saúde.
RESULTADOS: foram confirmados 326 casos de febre amarela no país nesse período, com 156 óbitos e taxa de letalidade média de 47,8%; o grupo de adultos jovens do sexo masculino foi o mais acometido; nas epizootias, foi identificado um total de 2.856 primatas não humanos notificados com suspeita de febre amarela, 31,1% deles confirmados laboratorialmente; no período estudado, foi identificada expansão da área de transmissão silvestre da doença para regiões densamente povoadas, como Sul, Sudeste e Centro-Oeste.
CONCLUSÃO: persiste o risco de transmissão urbana da febre amarela, pois a incidência silvestre da doença tem se expandido para regiões onde existe alta infestação do Aedes aegypti, mosquito transmissor do ciclo urbano da doença.
Palavras-chave: Febre Amarela; Epidemiologia Descritiva; Vetores de Doenças; Brasil.
ABSTRACT
OBJECTIVE: this study aims to describe the epidemiological characteristics of yellow fever in Brazil between the years 2000 and 2012.
METHODS: this is a descriptive ecological epidemiological study, using information from Ministry of Health databases.
RESULTS: 326 cases of yellow fever were confirmed in Brazil during this period, with 156 deaths and an average case mortality rate of 47.8%; the young male adult age group was the most affected; in epizootics, 2,856 suspected cases of yellow fever in non-human primates were reported and 31.1% of these were confirmed by laboratory tests; during the study period the area in which sylvatic transmission of the disease occurs was found to have expanded to densely population regions, such as South, Southeast and Midwest Brazil.
CONCLUSION: the risk of urban yellow fever transmission persists, as sylvatic incidence of the disease has expanded to regions with high Aedes aegypti infestation, this being the mosquito responsible for urban transmission of the disease.
Key words: Yellow fever; Epidemiology, Descriptive; Disease Vectors; Brazil.
RESUMEN
OBJETIVO: el estudio tiene como objetivo describir las características epidemiológicas de la fiebre amarilla en Brasil entre 2000 y 2012.
MÉTODOS: estudio epidemiológico descriptivo, ecológico, utilizando información de bases de datos del Ministerio de Salud.
RESULTADOS: se confirmaron 326 casos de fiebre amarilla en el país en este periodo, con un total de 156 muertes y una tasa de letalidad de 47,8%; el grupo de adultos jóvenes del sexo masculino fue el más afectado; se identificó un total de 2.856 primates notificados sospechosos de fiebre amarilla, de los cuales 31,1% fueron confirmados laboratoriálmente; en el período estudiado, identificamos una expansión del área de transmisión silvestre de la enfermedad a zonas densamente pobladas como el Sur, Sudeste y Centro-Oeste.
CONCLUSIÓN: persiste el riesgo de transmisión de fiebre amarilla, ya que la incidencia de la enfermedad se ha extendido a regiones donde hay una alta infestación de Aedes aegypti, el mosquito transmisor del ciclo urbano de la enfermedad.
Palabras-clave: Fiebre Amarilla; Epidemiología Descriptiva; Vectores de Enfermedades; Brasil.
Introdução
A febre amarela (FA) é uma doença infecciosa aguda, febril, não contagiosa, de curta duração (no máximo de 12 dias) e de gravidade variável. As manifestações clínicas podem representar fases evolutivas da doença.1 A forma grave pode levar à morte, caracterizada clinicamente por manifestações de insuficiência hepática e renal. Ainda não existe tratamento etiológico específico. A doença é causada por um arbovírus do gênero Flavivirus, família Flaviviridae, mantém-se endêmica e enzoótica em diversas regiões tropicais das Américas e da África e é responsável por surtos periódicos de magnitude variável.2 Nas Américas, deve-se levar em conta seu risco potencial de disseminação para áreas urbanas.
A FA, transmitida ao homem pela picada de mosquito fêmea infectado, possui caráter sazonal, sendo mais frequente entre os meses de janeiro e abril, quando fatores ambientais propiciam o aumento da densidade vetorial. Atualmente, são reconhecidos dois ciclos básicos de circulação do vírus da FA: um urbano, simples, do tipo homem-mosquito-homem, em que o Aedes aegypti é o principal vetor; e outro silvestre, complexo, envolvendo diferentes espécies de mosquitos, nas Américas e na África, com a participação de primatas não humanos (PNH) na amplificação viral. No continente americano, a FA é uma zoonose transmitida por mosquitos de dois gêneros, Haemagogus (H. janthinomys e H. alboma-culatus) e Sabethes, tendo como principal fonte de infecção, no ciclo silvestre, PNH, particularmente macacos dos gêneros Allouata, Cebus, Atelles e Callithrix. Na África, o ciclo silvestre envolve mosquitos do gênero Aedes (Ae. africanus, Ae. simpsoni, Ae. furcifer, Ae. luteocephalus e Ae. taylori).3
Os vetores da FA apresentam atividade de picar predominantemente diurna. Após um período que, geralmente, varia de nove a 12 dias de sua infecção em um caso virêmico, os mosquitos estão em condições de transmitir a doença. O período de incubação nos seres humanos varia, em média, de três a seis dias após a picada do mosquito infectante, podendo chegar até 10 dias.4
Em 1947, o então Serviço Nacional de Febre Amarela iniciou o emprego do diclorodifenil tricloretano (DDT) no combate ao mosquito. Em 1950, as atividades desse serviço atingiram seu auge, ao empregar 3.349 servidores atuantes em 112.950 localidades. Em 1958, o Departamento Nacional de Endemias Rurais, que já havia absorvido o Serviço Nacional de Febre Amarela, declarou erradicado o Ae. aegypti no país.5
No ano de 1967, entretanto, o Ae. aegypti foi mais uma vez identificado no Brasil, na cidade de Belém, capital do estado do Pará, e dois anos depois, em 1969, no estado do Maranhão. Em 1973, um último foco foi eliminado e o vetor, novamente, considerado erradicado do território brasileiro.6,7 Em 1976, o Ae. aegypti reapareceu pela segunda vez e reinfestou o país a partir da cidade de Salvador, estado da Bahia, em função de falhas na vigilância entomológica. Mudanças sociais e ambientais decorrentes da urbanização acelerada favoreceram a instalação e disseminação desse mosquito no Brasil.8 Foram confirmadas reinfestações nos estados do Rio Grande do Norte e do Rio de Janeiro e, desde então, o Ministério da Saúde tem implementado programas de combate a esse vetor para reduzir o risco de transmissão urbana da FA e, posteriormente, para diminuir a incidência de dengue, uma vez que o Ae. aegypti é também o principal vetor dessa virose.
A reemergência da transmissão silvestre da FA fora da região amazônica, a partir de 2007, expandiu a área de circulação viral no Brasil. As áreas mais recentemente atingidas encontram-se nas regiões Sudeste e Sul do país e são objeto de destaque em virtude da proximidade de grandes centros urbanos, densamente ocupados por uma população não vacinada, consequentemente sem proteção contra a doença, além de apresentarem alta infestação por Ae. aegypti, inclusive com transmissão de dengue em muitos municípios. Essa realidade trouxe à tona a discussão a respeito do risco da retomada da transmissão urbana da FA no Brasil, registrada pela última vez em Sena Madureira, no estado do Acre, em 1942.9,4
Até 1999, a vigilância da FA era pautada, exclusivamente, na ocorrência de casos humanos suspeitos. A partir daquele ano, com a observação de mortes de macacos em vários municípios dos estados do Tocantins e de Goiás e o subsequente aparecimento da doença na população, tais eventos passaram a ser vistos como sinalizadores de eventual risco (evento sentinela) de casos humanos de transmissão silvestre.
As pessoas que correm o risco de adoecer por FA são aquelas não vacinadas e expostas às picadas dos vetores em áreas de floresta, em área endêmica da virose, especialmente onde haja circulação viral. As áreas florestais e rurais mais afetadas correspondem às bacias dos rios Amazonas, Araguaia-Tocantins, Paraná e Orinoco, na América do Sul, e dos rios Nilo e Congo, na África.10
Visando contribuir para o aprimoramento nas ações de vigilância e controle da febre amarela no Brasil, este estudo tem por objetivo descrever as características epidemiológicas da febre amarela no país no período de 2000 a 2012.
Métodos
Trata-se de estudo epidemiológico descritivo, utilizando informações dos bancos de dados do Ministério da Saúde referentes à incidência de casos e óbitos de FA em seres humanos e em primatas não humanos - PNH - no período de 2000 a 2012. Esses dados foram fornecidos pelo Programa de Vigilância, Prevenção e Controle da Febre Amarela da Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS); e pelo Instituto Evandro Chagas de Belém-PA, Instituto Adolfo Lutz de São Paulo-SP e Fundação Osvaldo Cruz (Fiocruz)/Rio de Janeiro-RJ, laboratórios de referência credenciados pela SVS/MS para diagnóstico laboratorial de febre amarela. Sempre que é registrado um caso suspeito em um indivíduo, uma amostra de sangue ou de outro tecido é encaminhada para um desses laboratórios.
A notificação de casos de FA - assim como a investigação epidemiológica decorrente - deve acontecer em até 24 horas após a suspeita. O instrumento de coleta de dados, uma ficha de investigação epidemiológica disponível no Sistema de Informação de Agravo de Notificação (Sinan), contempla os elementos essenciais a serem registrados em uma investigação de rotina.2
Os casos humanos foram distribuídos por ano e Unidade da Federação (UF) de ocorrência, segundo as variáveis 'idade', 'sexo', 'ocupação' e 'evolução' (óbito; não óbito). Foi calculada a amplitude da idade, a média, o desvio-padrão e a mediana. Foram calculadas as taxas anuais de letalidade para o Brasil no período de 2000 a 2012, as taxas de letalidade por UF, e caracterizadas as principais atividades ocupacionais. Houve uma diversidade muito grande nos registros quanto às denominações ocupacionais. Optou-se por agrupar no item 'trabalhador rural' as seguintes denominações: agricultor; pecuarista; lavrador; fazendeiro; vaqueiro; trabalhador rural; pescador; e garimpeiro.
O número de casos humanos foi calculado mensalmente, buscando verificar a existência de sazonalidade da doença no período estudado.
Os dados de óbitos de PNH foram obtidos dos relatórios fornecidos pelos laboratórios de referência e pelo Programa de Vigilância, Prevenção e Controle da Febre Amarela.
Foram consultados os dados referentes às doses de vacinas aplicadas por UF, fornecidos pelo Programa Nacional de Imunizações (PNI/SVS/MS).
Tendo em vista tratar-se de dados secundários, sem identificação dos nomes das pessoas acometidas, o estudo foi dispensado de avaliação por Comitê de Ética em Pesquisa, em conformidade com a Resolução do Conselho Nacional de Saúde (CNS) n° 466, de 12 de dezembro de 2012.
Resultados
Foram registrados 326 casos confirmados de FA, todos pelo ciclo de transmissão silvestre, e 156 óbitos no país, no período de 2000 a 2012, resultando em uma taxa média de letalidade de 47,8%. O ano 2000 foi o que apresentou o maior número de casos e óbitos (Tabela 1).
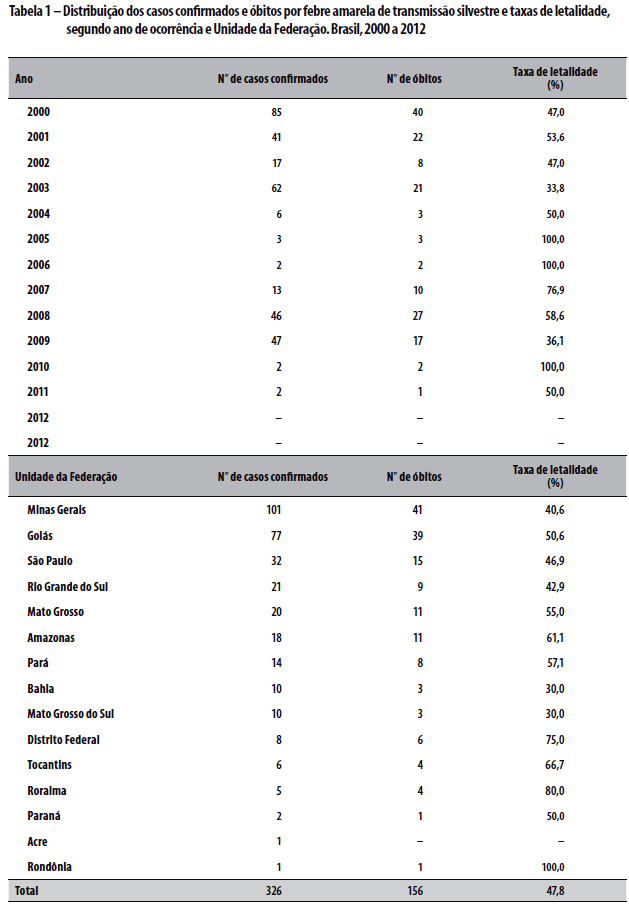
A distribuição de casos de FA por UF mostrou que o estado de Minas Gerais foi o mais afetado no período, com 101 casos confirmados e taxa de letalidade de 40,6%, seguido pelo estado de Goiás, com 77 casos e taxa de letalidade de 50,6% (Tabela 1).
Do total de 326 casos confirmados no país, 268 (86,7%) eram do sexo masculino, com uma taxa de letalidade de 49,6%, maior que a registrada no sexo feminino: 39,7%. Para cada mulher que adoeceu, houve 4,62 homens doentes. Assim também ocorreu com a razão de óbitos, havendo um óbito feminino para 5,78 óbitos masculinos.
Em relação à ocupação, 45% dos acometidos por FA eram trabalhadores rurais. Quanto à idade, observou-se que o grupo de adultos jovens foi o mais atingido. A média de idade foi de 32 anos, com uma variação de zero a 93 anos. O estado que apresentou a média de idade mais elevada foi Mato Grosso do Sul: 43 anos (Tabela 2).
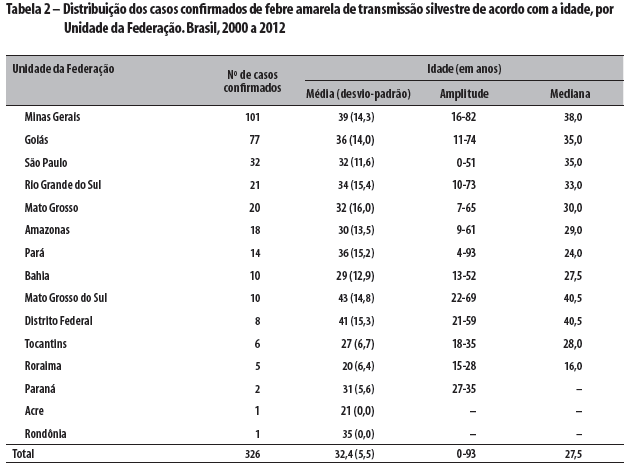
No que se refere à sazonalidade da FA, os meses de janeiro a junho registraram 95% dos casos (Figura 1).
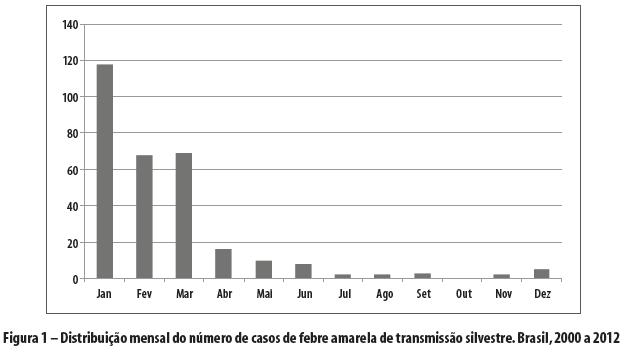
Quanto às epizootias, observou-se um total de 2.856 primatas não humanos notificados com suspeita de FA, dos quais 889 (31,1%) foram confirmados laboratorialmente. Entre as UF, o Rio Grande do Sul registrou o maior número de PNH com exame laboratorial positivo: 77,5% dos PNH notificados no país e com resultado confirmatório de febre amarela (Tabela 3).
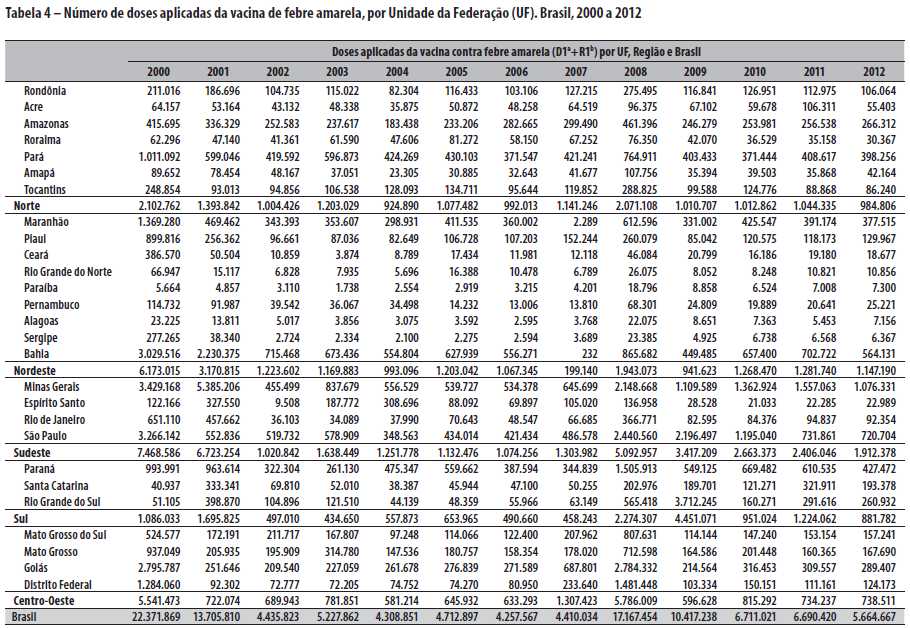
Conforme dados do Ministério da Saúde, 110.081.513 doses de vacinas contra FA foram aplicadas no Brasil, no período de 2000 a 2012, imunizando parte da população em todas as UF (Tabela 4). A observação de epizootias serviu como elemento preditor do risco de ocorrência de FA em humanos (Portaria SVS/MS n° 5, de 21 de fevereiro de 2006) e desencadeou uma série de ações, incluindo a revisão dinâmica das áreas de transmissão, com adequação das estratégias de vacinação cada vez que se desejasse ampliar a cobertura vacinal local.
Discussão
Noventa e cinco por cento dos casos de FA apresentados neste estudo foram confirmados laboratorialmente. O grupo mais acometido foi o de adultos jovens do sexo masculino, trabalhadores de áreas rurais, consideradas de risco para a propagação do vírus.
O ano 2000 foi o que apresentou o maior número de casos confirmados no país, no período estudado. Foi identificado um grande número de casos em regiões densamente povoadas, como Sul, Sudeste e Centro-Oeste, áreas com alta densidade de infestação do vetor urbano, o Aedes aegypti. Este perfil é preocupante, por indicar a possibilidade de aumento do risco de reurbanização da transmissão da doença, uma vez que a transmissão silvestre parece estar migrando para áreas densamente povoadas, onde o mosquito vetor do ciclo urbano, o Ae. aegypti, é abundante. As razões para essa expansão geográfica, por enquanto, não são totalmente conhecidas.
A incidência de FA silvestre mostrou-se sazonal, coincidindo com a estação chuvosa na área endêmica, quando há aumento da densidade dos transmissores. No Brasil, esse período vai de janeiro a junho. Ao longo dos anos, a incidência de FA tem apresentado uma tendência cíclica, com aumento a cada cinco a sete anos. Esse fato é explicado pela maior circulação viral, em virtude do acúmulo de macacos suscetíveis.1
A letalidade da FA no Brasil apresenta-se bastante elevada, fato por demais relevante. Além da virulência do agente infeccioso, a demora na suspeição da doença e a ausência de tratamento etiológico eficaz contribuem para a alta taxa de letalidade.1
A ocorrência de casos e óbitos foi sempre maior no sexo masculino, provavelmente relacionada ao trabalho em áreas rurais e consequentemente, maior exposição à infecção. Segundo os resultados do presente estudo, conforme já foi observado anteriormente,11 o grupo mais acometido pela FA mostrou um perfil típico, majoritariamente representado por adultos jovens masculinos, com média de idade de 32 anos e ocupação na área rural. Trata-se de um contingente sob maior exposição a ecótopos onde circulam os vírus.
O Sistema de Vigilância de Epizootias em primatas não humanos tem como marco inicial o ano de 1999, após período de intensa transmissão na região Centro-Oeste do país, onde a ocorrência de epizootias em PNH precedeu e acompanhou a ocorrência de casos humanos de transmissão silvestre. A partir de então, o Ministério da Saúde passou a incentivar iniciativas regionais para detectar a circulação do vírus ainda em seu ciclo enzoótico.12
A principal medida de prevenção da FA em humanos é a vacinação. Desde 1998, o Ministério da Saúde vem intensificando a aplicação da vacina contra FA, incluída nos calendários de vacinação. A vacina é produzida no Brasil e elaborada com o vírus vivo atenuado; geralmente, ela produz poucos efeitos colaterais, respeitadas suas contraindicações, e é utilizada há mais de 60 anos, sendo o método mais eficaz para se evitar a febre amarela. Até o momento de conclusão deste relato, não havia registro no banco de dados sobre a situação vacinal da grande maioria dos casos ocorridos no período estudado. A aplicação da vacina tem por objetivo proteger a população com a formação de anticorpos protetores e estabelecer uma barreira epidemiológica à propagação do vírus selvático até às zonas urbanas, nas quais o Ae. aegypti está presente.13
No país, as áreas consideradas de maior risco para FA incluem as regiões Norte e Centro-Oeste, os estados de Minas Gerais e Maranhão e parte da Bahia, Piauí, São Paulo, Rio Grande do Sul, Santa Catarina e Paraná.2 O Brasil encontra-se dividido em duas áreas, no que se refere ao risco de circulação do vírus amarílico. A primeira, alvo de recomendação de vacinação, concentra o maior risco para a doença. A segunda, uma área sem recomendação de vacina, representa um risco para a enfermidade mais remoto.2
Após a ocorrência de eventos recentes muito graves - e até letais - atribuídos à vacina contra FA, não há concordância quanto à vacinação da população residente em áreas infestadas pelo Ae. aegypti e (ou) pelo Ae. albopictus. Os que se manifestam contrários à expansão geográfica da cobertura vacinal levam em conta fatos relevantes, como a ocorrência de óbitos associados à vacina nos estados de São Paulo, Minas Gerais, Rio Grande do Sul e Goiás. Na literatura, foram relatados óbitos associados à vacina nos Estados Unidos da América e na Austrália, maior país da Oceania. Os fatores que levam algumas pessoas a apresentarem eventos adversos graves associados à vacina ainda não são totalmente conhecidos.3
Também se encontram opiniões favoráveis à expansão da área atual de cobertura vacinal, em função da detecção de transmissão de FA silvestre em regiões da Bahia e de São Paulo (2000), bem como de Minas Gerais (2001). Trata-se de áreas infestadas por Ae. aegypti que não apresentavam casos autóctones da forma silvestre há anos. Em 2001, no oeste do Rio Grande do Sul, observou-se circulação viral com óbitos de macacos confirmados laboratorialmente, em local onde tampouco havia registro de epizootias por FA há mais de 20 anos.3
Uma limitação do presente estudo reside no uso de dados secundários, possível sub-registro das ocorrências.
O baixo número de casos de febre amarela silvestre reduz o risco de reintrodução da forma urbana da doença. Porém, há que se considerar que cidades com alta infestação pelo Ae. Aegypti, ao receberem pessoas provenientes de áreas endêmicas, na fase inicial da doença e durante o período de transmissibilidade, trazem risco para uma transmissão urbana da febre amarela no Brasil.
Contribuição dos autores
Cavalcante KRLJ participou da concepção, análise e interpretação dos dados e da redação do manuscrito.
Tauil PL participou da concepção e delineamento do estudo, interpretação dos resultados e da revisão crítica relevante do conteúdo intelectual do manuscrito.
Ambos os autores aprovaram a versão final do manuscrito e declaram serem responsáveis por todos os aspectos do trabalho, garantindo sua precisão e integridade.
Referências
1. Lopes AC. Tratado de clínica médica. 2.ed. 3841-3849. São Paulo: Roca; 2009. v. 3.
2. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância em Saúde. Manual de vigilância de epizootias de primatas não humanos. Brasília: Ministério da Saúde; 2005. p.25-26. (Serie A. Normas e Manuais Técnicos).
3. Tauil PL. Aspectos críticos do controle da febre amarela no Brasil. Rev Saude Publica. 2010;44(3):555-8.
4. Coura JR. Dinâmica das doenças infecciosas e parasitárias. 2. ed. Rio de Janeiro: Guanabara Koogan; 2013. v. 2 p. 1788- 1798
5. Franco O. História da febre amarela no Brasil. Rio de Janeiro: Superintendência de Campanhas de Saúde Pública, Ministério da Saúde; 1969.
6. Ministério da Saúde (BR). Fundação Nacional de Saúde. Plano de intensificação das ações de controle da dengue (PNCD): instituído em 24 de julho de 2002. Brasília: Ministério da Saúde; 2002.
7. Nobre A, Antezana D, Tauil PL. Febre amarela e dengue no Brasil: epidemiologia e controle. Rev Soc Bras Med Trop. 1994; 27 supl 3:59-66.
8. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Análise de Situação de Saúde. Dados e indicadores selecionados. Brasília: Ministério da Saúde; 2003.
9. Romano APM, Ramos DG, Araujo FAA, Siqueira GAM, Ribeiro MPD, Leal SG, et al. Febre amarela no Brasil: recomendações para a vigilância, prevenção e controle. Epidemiol Serv Saude. 2011 jan-mar;20(1):101-6.
10. Vasconcelos PFC. Febre Amarela. Rev Soc Bras Med Trop. 2003 mar-abr;36(2):275-93
11. Vasconcelos PFC. Febre amarela: reflexões sobre a doença, as perspectivas para o século XXI e o risco de reurbanização. Rev Bras Epidemiol. 2002;5(3):244-58
12. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Guia de vigilância de epizootias em primatas não humanos e entomologia aplicada à vigilância da febre amarela. 2. ed. Brasília: Ministério da Saúde; 2014.
13. Ministério da Saúde (BR). Superintendência de Campanhas de Saúde Publica. Manual de vacinação anti-amarílica: instruções para vacinadores. Brasília: Ministério da Saúde; 1987.
 Endereço para correspondência:
Endereço para correspondência:
Karina Ribeiro Leite Jardim Cavalcante -
Ministério da Saúde, Secretaria de Vigilância em Saúde,
Coordenação-Geral de Laboratórios,
SCS, Quadra 4 Bloco A, Edifício Principal,
3° andar, Brasília-DF, Brasil.
CEP: 70304-000
E-mail: karina.cavalcante@saude.gov.br
Recebido em 20/01/2015
Aprovado em 18/09/2015
*Parte integrante da dissertação de Mestrado de Karina Ribeiro Leite Jardim Cavalcante, defendida junto ao Programa de Mestrado Profissional em Saúde Coletiva da Universidade de Brasília/Ministério da Saúde em junho de 2014.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI
