Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.1 n.2 Belém ago. 2006
Considerações ecológicas sobre o fitoplâncton da baía do Guajará e foz do rio Guamá, Pará, Brasil
Ecological considerations on phytoplankton from the Guajará bay and from the Guamá river estuary in Pará, Brazil
Rosildo Santos PaivaI; Enide Eskinazi-LeçaII; José Zanon de Oliveira PassavanteIII; Maria da Glória Gonçalves da Silva-CunhaIII; Nuno Filipe Alves Correia de MeloIV
IUniversidade Federal do Pará. Departamento de Biologia. Professor Doutor. Belém, Pará, Brasil (rpaiva@ufpa.br)
IIUniversidade Federal Rural de Pernambuco. Departamento de Botânica. Professora Doutora. Belém, Pará, Brasil (enideleca@terra.com.br)
IIIUniversidade Federal Rural de Pernambuco. Departamento de Oceanografia. Professor Doutor. Belém, Pará, Brasil (zanon@ufpe.br) (gloria10@bol.com.br)
IVUniversidade Federal do Pará. Centro de Geociências. Professor Doutor. Belém, Pará, Brasil (nuno.melo@ufra.edu.br)
RESUMO
Estudos sobre a composição, biomassa e ecologia do fitoplâncton foram realizados bimestralmente, no período de dezembro de 1989 a outubro de 1990, na baía do Guajará, Pará, Brasil. A composição fitoplanctônica foi determinada a partir da análise de amostras de plâncton coletadas com rede de 65 µm de abertura de malha, arrastada horizontalmente à superfície. A biomassa foi calculada a partir da determinação da densidade fitoplanctônica (cel/l), segundo o método de Utermohl, e da determinação dos valores de clorofila 'a'. Paralelamente foram realizadas medidas de salinidade, temperatura, transparência e pH da água. Qualitativamente o fitoplâncton da Baía do Guajará apresentou-se composto por 116 táxons específicos e infraespecíficos, sendo 1 cianofícea, 45 clorofíceas e 70 diatomáceas. Entre esta, destaca-se Polymyxus coronalis por ser considerada indicadora de águas salobras da região Amazônica. Quantitativamente, o fitoplâncton apresentou valores oscilando entre 790.000 cel/l e 4.790.000 cel/l, destacando-se os fitoflagelados por serem os organismos mais abundantes, seguidos das diatomáceas, cianofíceas e clorofíceas. Os teores de clorofila 'a' apresentaram variações entre 1,49 mg/m3 e 23,33 mg/m3. As águas da Baía do Guajará caracterizam-se pela estreita faixa de variação de salinidade, temperaturas elevadas, pequena transparência e pH geralmente ácido. A variação anual destes parâmetros está relacionada ao regime pluviométrico, que determina também os valores quantitativos do fitoplâncton.
Palavras-chave: Fitoplâncton. Biomassa. Estuário Amazônico.
ABSTRACT
Phytoplankton composition, biomass and ecology were studied from samples bimonthly collected from December/1989 to October/1990 at Guajará Bay-Pará (Brazil). Analysis was based on plankton samples collected with a 65 µm mesh net, horizontal-surface hauled. Biomass was calculated by Utermohl method (cell/liter) and chlorophyll 'a' concentration. Water salinity, temperature, transparence and pH were measured for composition. Phytoplankton was composed of 116 specific and infraspecific taxa: 1 Cyanophyceae, 45 Chlorophyceae and 70 Bacillariophyceae. Most significatives were Polymyxus coronalis, amazonic brackishwater indicator. Quantitatively phytoplankton varied from 790000 cel/l to 4790000 cel/l, being phytoflagellate the most abundant followed by diatoms, blue green and green algae. Chlorophyll 'a' varied from 1.49 mg/m3 to 23.33 mg/m3. Guajará Bay water is characterized by small salinity variation, high temperature, law transparence and pH generally acid. These parameters annual variation is related to pluviometer regime that influences the phytoplankton quantitative values.
Keywords: Phytoplankton. Biomass. Amazon estuary.
INTRODUÇÃO
A desembocadura do rio Amazonas abrange uma área de cerca de 60.000 km2, onde a parte sul forma um esturário com mais de 200 km de extensão, que inclui a baía do Marajó e a parte sul do estuário do rio Pará, no qual está inserida a baía do Guajará, com aproximadamente 35 km de extensão (PINHEIRO, 1987).
Provavelmente a mais antiga entre todas as informações sobre a baía do Guajará data de 1616, oportunidade da chegada da expedição portuguesa comandada por Francisco Castelo Branco, que resultou na construção do Forte do Presépio, ponto que deu início ao nascimento da cidade de Belém (CRUZ, 1973). Alguns trabalhos, datados do início do século, fazem referências a aspectos geológicos da baía do Guajará, dentre os quais se destacam os de Hartt (1885), von Kraatz-Koschlau e Huber (1900) e Katzer (1933).
Pinheiro (op. cit.) apresenta as características hidrodinâmicas e sedimentológicas do estuário nas adjacências da cidade de Belém, abordando aspectos geomorfológicos, comportamento das ondas, ventos, marés, correntes de marés e parâmetros físico-químicos da água. Cordeiro (1987), por sua vez, apresenta um levantamento hidrogeoquímico sistemático das águas da baía do Guajará, além de determinações físico-químicas e análise quantitativa e qualitativa dos sedimentos em suspensão. Já Moreira-Filho, Valente-Moreira e Trippia-Cecy (1974), realizaram o primeiro levantamento sobre a composição do microfitoplâncton da foz do rio Guamá, onde listaram, a partir da análise de amostras colhidas no sedimento e plâncton na foz do rio, 24 gêneros, 46 espécies e 1 variedade de diatomáceas.
Este trabalho objetiva caracterizar qualitativamente e quantificar o fitoplâncton da baía do Guajará, além de determinar a sua variação temporal e espacial, assim como somar informações sobre características físico-químicas da água deste ecossistema. Em um segundo momento e considerando que os dados que serão apresentados foram coletados nos anos de 1989 e 1990, espera-se que as informações aqui contidas venham a ser consideradas básicas para acompanhar as crescentes alterações ambientais que a região vem sofrendo em conseqüência de sua rápida industrialização e crescimento urbano desordenado.
LOCALIZAÇÃO DA ÁREA
A baía do Guajará enquadra-se dentro dos paralelos 1o10' Latitude S e 1o30' Latitude S e dos meridianos 48o25' Longitude W e 48o35' Longitude W distante aproximadamente 95 km do Oceano Atlântico (Figura 1).
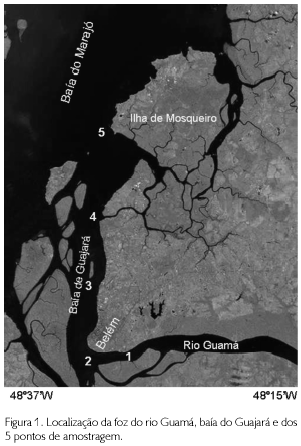
MATERIAL E MÉTODOS
Estudos sobre a composição, biomassa e ecologia do fitoplâncton foram realizados bimestralmente em cinco pontos fixos de amostragem na baía do Guajará, durante o período de dezembro de 1989 a outubro de 1990. A composição fitoplanctônica foi determinada a partir da análise de amostras de plancton coletado com rede de náilon de 65 µm de abertura de malha em arrasto horizontal à subsuperfície. A biomassa foi calculada a partir da determinação do número de células por litro, segundo o método de Utermol, descrito por Vollenweider, Talling e Westlaka (1969) e Hasle (1978), e da determinação da clorofila 'a' total segundo o método de Richards e Thompson (1952), modificado por Creitz e Richards (1955). No que se refere aos aspectos físico-químicos da água na superfície, foram tomadas in situ medidas de pH e temperatura, utilizando-se um aparelho de marca WTW (Wissenschaftliche Technische Werkstatten) modelo pH 91; salinidade segundo o método de Mohr-Knudsen, descrito por Strickland e Parsons (1965); e transparência, com o auxílio de um disco de Secchi de 30 cm de diâmetro, a partir da qual foram calculados os coeficientes de extinção da luz segundo a fórmula de Poole e Atkins (1929).
RESULTADOS E DISCUSSÃO
As águas da baía do Guajará mostraram uma homogeneidade térmica, com temperaturas variando entre 27,1oC e 33,7oC, normalmente ácidas, com médias variando entre 5,5 e 7, baixos teores de salinidade, com mínima de 0 e máximo de 4,5, não fugindo, assim, do padrão dos estuários amazônicos. Estes resultados confirmam as observações realizadas por Pinheiro (op. cit.) e Cordeiro (1987) no que concerne ao alto grau de mistura das águas, cuja salinidade na boca do estuário não atinge valores superiores a 5. Este fato, entretanto, não impede que se instale no estuário uma população fitoplanctônica semelhante àquela já observada em outros estuários brasileiros, ou seja, uma presença considerável de diatomáceas marinhas eurialinas, as quais dominam durante todo o ano sobre os demais grupos. De acordo com Ryley (1967) e Smayda (1983), as diatomáceas destacam-se como os principais organismos do microfitoplâncton estuarino e, na maioria dos casos, elas constituem a maior percentagem das microalgas presentes. Populações assim constituídas foram observadas em Cananéia, São Paulo (KUTNER, 1972), área estuarina de Itamaracá, Pernambuco (ESKINAZI-LEÇA, 1974; BARROS-FRANCA, 1980), estuário do Rio Potengí, Rio Grande do Norte (OLIVEIRA, 1985) e Bacia do Pina-PE (FEITOSA, 1988). Patrick (1967) admite que, nos estuários, as diatomáceas estariam representadas principalmente por espécies marinhas neríticas, além de algumas oceânicas verdadeiramente planctônicas. Completando este pensamento, Lackei (1967) acrescenta que os ecossistemas estuarinos não possuem uma flora diatomológica com características próprias, estando constituída principalmente por espécies marinhas, destacando-se aquelas litorais.
A composição específica do microfitoplâncton da baía do Guajará revelou as diatomáceas como o grupo de maior representação, as quais apresentaram uma participação de 56,2% na composição florística, distribuídos em 1 classe, 2 subclasses, 6 ordens, 13 famílias, 30 gêneros, 68 espécies, 2 variedades e 1 forma:

As diatomáceas formam o grupo mais abundante, compondo 56,2% do microfitoplâncton da baía do Guajará. Entre os gêneros, os que apresentaram maior representatividade, em termos de diversidade, foram Coscinodiscus (14 spp e 1 variedade), Surrela , (10 spp), Actinoptychus (4 spp), Biddulphia, (4 spp), Actinocyclus, (3 spp), Triceratium, (3 spp e 1 forma), Bacteriastrum, (2 spp), Cyclotella, (2 spp), Eunotia, (2 spp), Melosira, (2 spp), Pinnularia, (2 spp) e Rhaphoneis, (2 spp). Os demais gêneros, como Actinella, Amphiprora, Bacillaria, Cerataulus, Ditylium, Eupodiscus, Hyalodiscus, Hydrosera, Navicula, Nitzschia, Pleurosigma, Polymyxus, Rhizosolenia, Skeletonema, Terpsinoe, Thalassionema, Thalassiosrra e Thalassiothryx, ocorreram com uma única espécie.
O segundo grupo melhor representado qualitativamente foi o das clorofíceas, com 2 classes, 3 ordens, 10 famílias, 23 gêneros, 45 espécies e 2 variedades, compondo 38,8% da flora. Em termos de diversidade, os gêneros mais representativos foram: Staurastrum (12 spp e 1 variedade), Pediastrum, (4 spp), Staurodesmus (4 spp), Hyalotheca (3 spp), Micrasterias (3 spp), Desmidium (3 spp), Dictyosphaerium (2 spp) e Xantithidium (2 spp). Os demais gêneros, como Closterium, Dimorphococcus, Oocystis, Pleurotaenium, Radiococcus, Scenedesmus, Sphaerocystis, Sphaerozosma, Spirotaenia, Treubaria, Triploceras, Mougeotia e Eudorina, estiveram representados por apenas uma espécie.
As cianofíceas foram as algas de menor representatividade, com a identificação de 1 classe, 3 ordens, 4 famílias e 6 gêneros (Microcystis, Oscillatoria, Spirulina, Phormidium, Anabaena e Hapalosiphon), figurando com apenas 5% da flora.
A análise da composição da diatomoflórula revelou que a grande maioria era marinha eurialina, seguida pelas de água doce e algumas reconhecidamente salobras. Na composição florística da área estudada, deve ser levado em consideração, também, a presença significativa das clorofíceas, principalmente desmidiáceas, que estiveram presentes em todos os pontos e em todos os meses de amostragem. Quanto às cianofíceas, foram pouco significativas qualitativa e quantitativamente. Além destes grupos de algas, nenhum outro fez-se representar, com exceção dos chamados fitoflagelados, que não foram identificados a níveis específicos.
Surpreende, no fitoplâncton local, a ausência dos dinoflagelados, organismos caracteristicamente marinhos oceânicos, mas que têm sido evidenciados em várias regiões estuarinas do Brasil (SASSI; WATANABE, 1980; OLIVEIRA, 1983; FEITOSA, 1988; SANTANA, 2004), os quais são transportados pelas correntes de marés. Na área estudada, esta ausência pode ser justificada pelos baixos valores de salinidade e da baixa transparência da água, máxima de 1 e mínima de 0,2 m, condições que não favorecem o desenvolvimento destes organismos, os quais, segundo Balech (1977), preferem ambientes com baixa turbidez.
Quanto à presença das diatomáceas no estuário guajarino, observa-se que a composição destas microalgas muito se assemelha a levantamentos em ambientes costeiros adjacentes realizados por Wood (1966), Muller-Melchers (1957) e Reyssac (1980), o que demonstra a penetração destas algas no estuário, as quais podem atingir locais bastante afastados da desembocadura, já considerados limnéticos. A este respeito, Mc Luscky (1971) sugere que organismos marinhos são capazes de penetrar mais facilmente nos ambientes de água doce tropical do que em locais de clima mais frio.
No baixo Amazonas, Gesnner e Simonsen (1967) fizeram referência à presença de várias carapaças de diatomáceas, a uma distância de 300 km da desembocadura, em locais considerados pelos autores como limnéticos. Eles acreditam que estas carapaças podem ter sido transportadas passivamente, não só pelas correntes de marés, mas principalmente pelos sedimentos. Estes autores chamam a atenção para o fato da alta resistência das frústulas das diatomáceas, que podem ser transportadas para locais distantes da desembocadura estuarina, mascarando, assim, a real composição florística local, visto que as carapaças vazias chegam às áreas distantes devido à alta turbulência das águas. Estes autores concluem que das 114 espécies de diatomáceas citadas por Wood (1966), para águas marinhas e salobras do Amazonas, 15 delas consideradas polihalóbias foram transportadas pelas correntes até a parte mais baixa do Amazonas e foram significativamente mais importantes que as diatomáceas verdadeiramente oligohalóbias. Por isto, em virtude da alta resistência de suas carapaças as diatomáceas não podem ser seguramente consideradas como indicadoras ambientais, principalmente em estuários amazônicos que são caracterizados por alta turbulência.
Moreira-Filho, Valente-Moreira e Trippi-Cecy (1974) confirmaram as observações dos autores acima citados, ao identificarem na foz do rio Guamá um elevado número de diatomáceas que apresentavam valvas e frústulas vazias e sugerindo estudos mais acurados nas particularidades de cada indivíduo encontrado no estuário, para que os resultados das pesquisas não indiquem condições contrárias às verdadeiras existentes. Por este motivo, no levantamento da florula diatomológica do estuário guajarino, especial atenção foi dada ao estado estrutural dos cromatóforos das espécies encontradas, para que fosse relacionado apenas àquelas que apresentassem conteúdo citoplasmático.
Levando-se em consideração as características ecológicas da comunidade diatomológica, constatou-se que 84,4% das espécies são marinhas, 11,3% são dulciaqüícolas e 4,3 % são verdadeiramente estuarinas, o que demonstra a enorme penetração das espécies marinhas ao longo do trecho estudado. Considerando-se, ainda, que o ponto de amostragem mais interno dista cerca de 130 km da desembocadura do estuário, conclui-se que as diatomáceas marinhas estão bem adaptadas ao ambiente oligoalino desta área.
Por outro lado, a distribuição quantitativa espacial e temporal das diatomáceas, segundo grupo de maior importância na biomassa, com uma densidade mínima de 280.000 cel/l e uma máxima de 1.310.000 cel/l, também confirma a resistência destas microalgas às condições ambientais reinantes, notadamente ao regime de salinidade cujos valores encontram-se sempre abaixo de 5. Os valores quantitativos apresentaram uma notável estabilidade durante os meses e estações de coleta, comprovando a afirmação de Patrick (1967) quanto ao caráter de eurialinidade das diatomáceas, que são capazes de suportar grandes variações de salinidade.
Ao lado das diatomáceas, as desmidiáceas também se destacaram no fitoplâncton da área estudada. Estas clorofíceas dulciaquícolas têm sido consideradas como as mais importantes dos ambientes limnéticos do Amazonas e chegam mesmo a caracterizar determinados locais da região. Por isto há bastante tempo tem merecido a atenção de vários pesquisadores, já sendo sua flora bastante conhecida na região amazônica (FORSTER, 1969, 1974; UHERKOVICH; SCMIDT, 1974; UHERKOVICH, 1976; UHERKOVICH; RAI, 1979).
Apesar das condições oligoalinas que foram encontradas no trecho estudado, as clorofíceas não apresentaram a importância quantitativa que era esperada, com seus valores variando entre 10.000 cel/l e 310.000 cel/l. A época de maior florescimento coincidiu, como esperado, com o final do período menos chuvoso, principalmente no mês de junho de 1990, acreditando-se que a grande quantidade de material em suspensão durante a época chuvosa seja o elemento inibidor do florescimento destas algas, as quais, segundo Joly (1963), são caracterizadas por preferirem água mais limpa.
Ainda no que se refere aos aspectos quantitativos do fitoplâncton do estuário guajarino, os fitoflagelados apresentaram uma densidade que variou entre 80.000 cel/l e 3.190.000 cel/l. Este componente do fitoplâncton apresentou uma variação anual marcada, cujo período de floração coincidiu com os meses de menor precipitação pluviométrica. Certamente este fato também está relacionado com a maior quantidade de material em suspensão durante a época chuvosa, que determina uma baixa transparência, a qual nunca é superior a 1 m ao longo de todo o ano.
As cianofíceas constituíram o grupo de menor representação quantitativa no fitoplâncton da baía do Guajará, com densidade variando entre 10.000 cel/l e 610.000 cel/l, e, de uma maneira geral, não apresentaram uma variação anual marcada, sendo observada constantes oscilações entre os pontos e os meses amostrados.
Os 116 taxa específicos e infraespecíficos, identificados entre diatomáceas, clorofíceas e cianofíceas, demonstraram uma flora planctónica bastante diversificada. Porém, entre estes, apenas uma espécie de diatomácea pode ser considerada dominante, Polymyxus coronalis, pois, na maioria das vezes, representou mais de 50% do microfitoplâncton total. A dominância de determinadas espécies no fitoplâncton estuarino já havia sido evidenciado por Riley (1967), o qual considerou o microfitoplâncton estuarino rico, porém, com pequeno número de espécies dominantes. Segundo este autor, Skeletonema costatum pode ser considerada como uma das espécies mais comuns em ambientes estuarinos, sendo a mesma uma espécie característica de diversos estuários brasileiros (KUTNER, 1972; SASSI; WATANABE, 1980).
No caso do estuário guajarino, P. coronalis foi a espécie de maior representação, a qual tem sido considerada como característica da águas salobras e indicadoras deste tipo de ambiente na região amazónica (MOREIRA-FILHO; VALENTE-MOREIRA; TRIPPIA-CECY, 1974). Os resultados obtidos corroboram esta afirmação, visto que consiste no único trabalho realizado de maneira periódica, durante um período anual e com vários pontos de amostragem. A espécie esteve presente de maneira abundante desde a primeira até a última estação estudada e em todos os meses amostrados, demonstrando estar bem adaptada às condições salobras reinantes na baía do Guajará. Na região amazônica, esta espécie também já foi encontrada em Gurupá e Breves, Pará, por Gessner e Simonsen (1967) e na foz do rio Guamá, Pará por Moreira-Filho et al., (1974), sempre de maneira abundante. Estudos recentes mostram que P. Coronalis tem ampla distribuição no estado do Pará, já tendo sua ocorrência registrada nos estuários dos rios Marapanim (SANTANA, 2004), Muriá (SILVA, 2005) e Guajará-Mirim (COSTA, 2005; CARDOSO, 2005). Em outros estuários do Brasil, P. coronalis foi encontrada esporadicamente e, até o presente, apenas assinalada em águas estuarinas de Pernambuco (FEITOSA, 1988), o que demonstra ser uma espécie de distribuição restrita no Brasil.
A avaliação quantitativa do fitoplâncton do estuário guajarino foi estimada através da contagem direta dos organismos e da medição do teor de clorofila 'a' total. A conjunção destes métodos deveu-se à necessidade de avaliar a quantidade de matéria orgânica disponível aos demais níveis tróficos e desta forma, traçar um perfil das condições e do potencial ecológico do estuário. Estudos desta natureza são importantes não só pelo significado biológico que apresentam, mas também por que são métodos consagrados na avaliação da produção orgânica de ecossistemas aquáticos.
O fitoplâncton da baía do Guajará e foz do rio Guamá revelaram uma relação proporcional entre o número de células/litro nas diversas estações, com valores variando entre 590.000 e 4.790.000 cel/l, demonstrando que a contribuição fluvial representa um estímulo ao crescimento algal, já que o volume de água doce aportado nos rios locais proporciona uma homogeneidade a toda a área estudada.
Os estudos físico-químicos realizados por Pinheiro (op. cit.) atestam que, no estuário guajarino, as altas descargas fluviais impedem quase que completamente a penetração das águas salobras provenientes do Atlântico, imprimindo um caráter oligoalino ao longo de toda a baía do Guajará. Segundo Ryther, Menzel e Corwin (1967) e Diegues (1972), a água doce é transportada até distâncias consideravelmente grandes da desembocadura dos rios da região e a participação do rio Amazonas na mistura pode ser detectada pelas reduzidas salinidades existentes à superfície.
Nos períodos de menores descargas fluviais, no final da vazante e início da enchente, as águas provenientes dos rios Guamá e Guajará-Açú apresentam valores de condutividade-salinidade relativamente baixos (100-300 µmhos - 0,04-0,12) e ocupam todo o canal de vazante pela margem esquerda do estuário. Por outro lado, no canal dito de enchente, adjacente à margem onde está a cidade de Belém, registram-se valores de condutividade-salinidade entre 350 a 1000 µmhos / 0,15 a 0,42, indicando nitidamente a entrada de águas mais condutivas, salobras e não fluviais, portanto, nesta região da baía do Guajará. Deve-se destacar que os valores mais elevados de condutividade-salinidade ocorrem próximos do fundo, indicando a penetração da maré salina sob a forma de cunha (PINHEIRO, op. cit.). Desta forma, as variações quantitativas ocorridas no número de células/litro estão mais relacionadas aos períodos anuais, principalmente em se tratando de uma área de interação rio-mar. Pode-se, ainda, atribuir grande importância à influência direta ou indireta da precipitação pluviométrica sobre a biomassa fitoplanctônica.
Como reportado anteriormente, Pinheiro (op. cit.) observou que a precipitação pluviométrica provoca uma elevação considerável na concentração de material em suspensão, na água da baía do Guajará, diminuindo consideravelmente a zona fótica. Medidas realizadas no período de dezembro de 1989 a outubro de 1990 revelaram valores de transparência variando entre 0,2 e 1 m e coeficiente de extinção de luz variando entre 1,7 e 8,5 m. Assim, o binômio chuvas-material em suspensão é extremamente importante para a região, estando a biomassa primária condicionada a esta conjunção de parâmetros. O maior aporte fluvial gerado pela elevada precipitação pluviométrica, durante os meses de dezembro/abril, contribui intensamente para a diminuição nos índices quantitativos do fitoplâncton.
Desta forma, a reduzida penetração da luz solar no ambiente pode inibir o desenvolvimento fitoplanctônico, constituindo-se em fator limitante nesta época do ano. Este tipo de relação foi detectada também em águas costeiras de Pernambuco, fortemente impactadas por despejos fluviais (FEITOSA, 1988; RESSUREIÇÃO, 1990).
Apesar da radiação fotossinteticamente ativa ter pouca influência como fator limitante nas regiões tropicais, Tundisi (1986) acredita que nestas áreas a luz pode ser um fator limitante quando os ambientes costeiros estão sujeitos ao aporte de material em suspensão. Isto fica comprovado na área estudada, que se localiza em região reconhecidamente tropical e cujos valores de transparência da água não ultrapassam 1 m.
Ressalte-se, ainda, que durante o período menos chuvoso, época em que as condições climatológicas são mais amenas e a disponibilidade de iluminação no ambiente é maior, aumentando a transparência da água, há maior florescimento fitoplanctônico. O crescimento da biomassa autotrófica no período de junho-agosto-outubro é bastante significativo e coincide com o período em que a precipitação pluviométrica é menor, há um aumento da transparência da água e os valores de salinidade são relativamente maiores, ocasião em que foram registrados 4,51 de salinidade. Desta maneira, o impacto do aporte terrígeno parece influir significativamente no comportamento fitoplanctônico da área estudada, inibindo o crescimento da flora planctônica no período chuvoso, culminando em um comportamento inverso durante o período menos chuvoso.
De acordo com Eskinazi-Leça (1990), nas águas costeiras tropicais podem ocorrer dois tipos de variação anual: um ciclo com aumento considerável de biomassa durante o período chuvoso, característico de ambientes onde a influência terrígena é amena e a maior disponibilidade de nutrientes favorece o crescimento algal; e um ciclo com aumento considerável da biomassa durante o período seco, característico de ambientes onde a influência terrígena é forte durante o período chuvoso, a ponto de provocar a diminuição da transparência da água. Na baía do Guajará os dados obtidos demonstram que o ciclo anual fitoplanctônico enquadra-se no segundo tipo.
Em relação aos teores de clorofila 'a', estes não acompanharam as variações observadas no número de células/litro, apresentando um comportamento inverso, principalmente com respeito aos dois períodos anuais, ocasião em que foram registrados valores médios de 11,28 mg/m3, para o período chuvoso, e de 9,46 mg/m3, para o período menos chuvoso.
De acordo com Sassi (1987) e Gomes (1989), a presença de clorofila a detrital (feopigmentos) nas amostras de água pode superestimar as concentrações reais de clorofila 'a' ativa. Segundo o primeiro autor, os feopigmentos podem ser originados da vegetação lêntica, a qual, em decorrência de variações nas condições hidrodinâmicas locais, pode ser arrancada de seus habitats naturais e entrar em decomposição. Os detritos então formados e em suspensão na massa d'água poderiam ser retidos pelos filtros usados nas análises de pigmentos, resultando na superestimação da clorofila ativa.
É importante ressaltar que no, estuário guajarino, encontram-se agindo vários fatores hidrodinâmicos, como as fortes influências tidais e principalmente as altas descargas fluviais, as quais, durante o período das chuvas, provocam enchentes e inundações das margens, alagando a densa vegetação marginal, sem contar, ainda, com as zonas permanentemente inundáveis (PINHEIRO, op. cit.). Desta forma, pode-se inferir que os elevados teores de clorofila 'a' observados durante o período chuvoso devem estar associados à clorofila detrital proveniente da decomposição não só da vegetação marginal inundada, mas também dos detritos trazidos pela correnteza.
Ressalte-se, no entanto, que de acordo com Lorenzen (1967), a concentração de clorofila 'a' fotossinteticamente ativa pode ser superestimada através dos métodos de avaliação do teor de pigmentos clorofilianos, que não distinguem a fração de produtos de degradação presente na amostra, como o método de Parsons e Strickland (1963) empregado nesta pesquisa e, neste caso, é possível que os dados de clorofila 'a' estejam mascarados pelos feopigmentos, uma vez que os teores mais elevados foram encontrados no período em que ocorre maior mistura das águas. Não obstante, Lorenzen (1971) recomenda a medição da concentração de clorofila 'a' durante as investigações biológicas nos ambientes aquáticos, como uma estimativa rápida e prática do Standing crop do fitoplâncton.
Considerando-se as condições geodinámicas da baía do Guajará, seria importante a continuação dos estudos sobre a biomassa primária, por métodos que possam estimar tanto a clorofila ativa como os feopigmentos, mesmo porque os teores de clorofila 'a' que foram obtidos podem ser considerados elevados quando comparados com o número de células/litro, reforçando, assim, a idéia de que teria havido uma superestimação dos teores de clorofila 'a', decorrente da metodologia empregada.
CONCLUSÃO
O estuário guajarino apresenta-se como um corpo de águas ligeiramente ácidas, raramente chegando a alcalinas, com temperaturas elevadas, de pouca transparência e estreita faixa de variação nos teores de sais dissolvidos. Estas condições sofrem variações anuais pouco acentuadas, ligadas principalmente aos padrões sazonais de precipitação pluviométrica e à forte drenagem fluvial. Qualitativamente, sua flora planctónica apresenta-se composta predominantemente por diatomáceas, entre as quais se destaca Polymyxus coronalis, por ser a espécie que caracteriza o fitoplâncton guajarino, sendo considerada indicadora de águas salobras da região amazónica. Quantitativamente os fitoflagelados são os organismos mais abundantes e responsáveis pelos períodos de florescimento do fitoplâncton. A biomassa fitoplanctónica é considerada elevada e apresenta uma distribuição regular ao longo de todo o estuário, com variações marcadas durante os dois períodos anuais e com expressivo aumento do número de células/litro durante o período menos chuvoso.
REFERÊNCIAS
BALECH, E. 1977. Introducction al Fitoplancton Marino. Buenos Aires: EUDEBA. 211 p.
BARROS-FRANCA, L. M. de. 1980. Composição e aspectos ecológicos do fitoplâncton do Rio Botafogo (PE). Dissertação (Mestrado) - Universidade Federal Rural de Pernambuco.
CARDOSO, F. F. et al. 2005. Composição e Variação Nictemeral do Microfitoplâncton no Estuário do Rio Guajará-Miri, Vigia de Nazaré-Pa. In: CONGRESSO BRASILEIRO DE OCEANOGRAFIA, 2., Vitória. Anais... Vitória: [s.n.]. p. 657.
CORDEIRO, C. A. 1987. Estudo da salinização do estuário do Rio Pará no trecho Belém-Mosqueiro. Dissertação (Mestrado em Geociências) - Universidade Federal do Pará.
COSTA, B. O. da et al. 2005. Análise Preliminar da Composição Florística e Abundância Relativa das Espécies Fitoplanctónicas no Rio Guajará-Mirí, Município de Vigia-PA. In: CONGRESSO BRASILEIRO DE OCEANOGRAFIA, 2., Vitória. Anais... Vitória: [s.n.]. p. 601.
CREITZ, G. I.; RICHARDS, F. A. 1955. The estimation and caracterization of the plankton populations by pigments analyses. A note of the use of millipore embrane filters in the estimation of plankton pigments. Journal of Marine Research, New Haven, v. 14, n. 3, p. 211-216.
CRUZ, E. 1973. História de Belém. Belém: Ufpa. 342 p. (Série José Veríssimo, 1.). Coleção Amazónica. Edição Comemorativa do Sesquicentenário da Adesão do Pará à Independência política do Brasil.
DIEGUES, F. M. F. 1972. Introdução à oceanografia do estuário Amazónico. In: CONGRESSO DE GEOLOGIA, 26., Belém. Anais... Belém: Universidade federal do Pará. p. 301-317.
ESKINAZI-LEÇA, E. 1974. Composição e distribuição do microfitoplâncton na região do Canal de Santa Cruz, Pernambuco-Brasil. Tese (Doutorado de Livre Docência) -. Instituto de Biociências da Universidade Federal de Pernambuco, Pernambuco.
ESKINAZI-LEÇA, E. 1990. Estudos ecológicos do fitoplâncton na plataforma continental de Pernambuco. In: ENCONTRO BRASILEIRO DE PLÂNCTON, 4., Recife. Anais... p. 1-54. Recife: Universidade Federal de Pernambuco.
FEITOSA, F. A. N. 1988. Produção primária do fitoplâncton correlacionada com parâmetros bióticos e abióticos na bacia do Pina, Recife-Pernambuco, Brasil. Dissertação (Mestrado) - Departamento de Oceanografia da Universidade Federal de Pernambuco, Pernambuco.
FORSTER, K. 1969. Amazonische desmidieen. 1. Teil: Areal Santarém. Amazoniana, Manaus, v. 2, n. 1/2, p. 5-232.
FORSTER, K. 1974. Amazonische desmidieen. 2. Teil: Areal Maues Abacaxi. Amazoniana. Manaus, v. 5, n. 2, p. 135-242.
GESSNER, F.; SIMONSEN, R. 1967. Marine Diatoms in the Amazon. Limnology and Oceano. v. 12, n. 4, p. 709-711.
GOMES, N. A. 1989. Composição e variação anual do fitoplâncton na plataforma continental de Pernambuco. Dissertação (Mestrado) - Universidade Federal de Pernambuco, Pernambuco.
HARTT, C. F. 1885. Contribuição para a efermologia do vale do Amazonas. Arch. Mus. Nac., Rio de Janeiro, v. 6, p. 1-175.
HASLE, G. R. S. 1978. The inverted-microscope Method. In: SOURNIA, A. (Ed.). Phytoplankton Manual. Paris: UNESCO. p. 88-96.
JOLY, A. B. 1963. Gêneros de algas de água doce da cidade de São Paulo e arredores. Richia, São Paulo, v. 1, p. 1-1186.
KATZER, F. 1933. Geologia do Estado do Pará- Brasil. Bol. Mus. Para. Hist. Nat. Ethnog., Belém, v. 9, p. 1-269.
KUTNER, M. B. B. 1972. Variação estacional e distribuição do fitoplâncton na região de Cananeia. Tese (Doutorado) - Universidade de São Paulo.
LACKEY, J. B. 1967. The microbiota of estuaries and their roles. In: LAUFF, G. H. (Ed.). Estuaries. Washington: am. ass. adv. Sci. p. 291-302.
LORENZEN, L. J. 1967. Vertical distribution of chlorophyll and phaeo-pigments: baja California. Deep-Sea Research, London, v. 14, p. 735-745.
LORENZEN, L. J. 1971. Continuity in the distribution of surface chlorophyll. j. Cons. Inst. Explor Mer., v. 34, n. 1, p. 18-23.
MC LUSCKY, D. C. 1971. Ecology of estuary. London: Heinemann Educational Books Ltd. 144 p.
MOREIRA-FILHO, H.; VALENTE-MOREIRA, I. M.; TRIPPIA-CECY, I. I. 1974. Diatomáceas do Rio Guamá, Foz do rio - Belém - Estado do Pará. Leandra, Rio de Janeiro, v. 3/4, n. 4/5, p. 123-135.
MULLER-MELCHERS, F. C. 1957. Plankton diatoms of the "Toko Maru" voyage (Brazil coast). Bol. Inst. Oceanogr., São Paulo, v. 8, n. 1/2, p. 111-138.
OLIVEIRA, D. B. F. 1985. Produção primária do fitoplâncton do estuário do Rio Potengi-Natal (RN). Dissertação (Mestrado) - Universidade Federal de Pernambuco, Pernambuco.
OLIVEIRA, R. J. M. 1983. Um levantamento quantitativo relativo do gênero, Actinoptychus, Ehr. (Chrysophyta, Bacillariophyceae) no estuário do Rio Iteberé, Paranaguá, Paraná, Brasil. Est. Biol., Curitiba, v. 8, p. 1-27.
PARSONS, T. R.; STRICKLAND, J. D. H. 1963. Discussion of spectrophotometry determination of marine plankton pigments, with revised equations of as certanimig clorophyll a anol carotenoids. Journal of Marine Research, New Haven, v. 21, n. 3, p. 155-163.
PATRICK, R. 1967. Diatoms communities in estuaries. In: LAUFF, G. H. (Ed.). Estuaries. Washington: Am. Ass. Adv. Sci. p. 311-315.
PINHEIRO, R. V. L. 1987. Estudo hidrodinâmico e sedimentológico do estuário Guajará (PA). Dissertação (Mestrado) - Universidade Federal do Pará, Belém.
POOLE, H. H.; ATKINS, W. R. G. 1929. Photo-eletric measurements of submarine illumination througouth the year. Journal of the Marine Biological Association of the United., Kingdon, London, v. 16, p. 297-324.
RESSUREIÇÃO, M. G. 1990. Variação anual da biomassa fitoplanctônica na plataforma continental de Pernambuco: perfil, em frente ao porto do Recife, (08o03'38" Lat. S.; 34o42'28" a 34o52'00" Long. W). Dissertação (Mestrado) - Universidade Federal de Pernambuco, Pernambuco.
REYSSAC, I. S. 1980. Recherches sun le phytoplankton de la côte brasiliene. Caspect qualitatif et quantitatif, biogeographie. Essai de comparasion avec les populations de s' Ouest - Africain. Bull. Mus. Mist. Hat. Paris, ser. 4a 2B, v. 4, p. 295-339.
RICHARDS, F. A.; THOMPSON, T. G. 1952. The estimation and caracterization of plankton populations by pigment analysis: a spectrophotometric metod for the estimation of plankton pigments. Journal of Marine Research., New Haven, v. 11, n. 2, p. 156-172.
RILEY, G. A. 1967. The plankton of estuaries. In: LAUFF, G. H. (Ed.). Estuaries. Washington: Am. Ass. Adv. Asc. p. 316-326.
RYTHER, J. H.; MENZEL, D. W.; CORWIN, N. 1967. Influence of the Amazon river outflow on the ecology of the western Tropical Atlantic: hydrography and nutrient chemistry. Journal of Marine Research., London, v. 25, n. 1, p. 68-83.
SANTANA, D. S. 2004. Composição florística e variação espaço-temporal dos parâmetros ambientais e da biomassa fitoplanctônica do estuário do rio Marapanim (Pará-Brasil). Dissertação (Mestrado) - Universidade Federal do Pará, Belém.
SASSI, R. 1987. Fitoplâncton da formação recifal da ponta do Seixas (Lat. 7o09'16" S, Long. 34o47'35" W) Estado da Paraiba-Brasil: composição, ciclo anual e alguns aspectos físio-ecológicos. Tese (Doutorado) - Universidade São Paulo, São Paulo.
SASSI, R.; WATANABE, T. 1980. Estudos ecológicos básicos no estuário do Rio Paraíba do Norte, Paraíba, Brasil. Fitoplâncton e fatores hidrológicos. In: SIMPÓSIO NACIONAL DE ECOLOGIA, 2. Resumos... [S.l.:s.n.]. p. 305-313.
SILVA, E. S. 1960. Microplâncton de superfície nos meses de setembro e outubro da estação de Inhaca (Moçambique). Memórias da Junta de Investigações do Ultramar, Lisboa, v. 18, p. 9-56.
SILVA, P. D. A. da et al. 2005. Dados Preliminares sobre a Composição e Variação Espacial da Comunidade Fitoplanctônica do Rio Muriá (Curuçá-Pará-Brasil). In: CONGRESSO BRASILEIRO DE OCEANOGRAFIA, 2., Vitória. Anais... Vitória: [s.n.]. p. 1-794.
SMAYDA, T. J. 1983. The phytoplankton of estuaries. In: KETCHUM, B. H. (Ed.). Estuaries and Enclosed Seas. Amsterdam: Elsevier Scientific Publ. p. 65-101.
SOURNIA, A. 1968. Diatomées planctoniques du Canal de Mozambique et de L'ile Maurice. Memoire O. R. S. T. O., Paris, v. 31, p.: 1-135.
STRICKLAND, J. D. H.; PARSONS, T. R. 1965. A manual of sea water analysis. Bulletin Fisheries Research Board of Canada, Ottawa, v. 125, p. 1-205.
TUNDISI, J. G. 1986. Estudos ecológicos do fitoplâncton marinho e lacustre no Brasil: situação atual e perspectivas. In: BICUDO, C. E.; TUNDISI, J. G. (Ed.). Algas a Energia do Amanhã. [S.l.:s.n.]. p. 27-48.
UHERKOVICH, G. 1976. Algen aus flussen Rio Negro und Rio Tapajós. Amazoniana, Manaus, v. 5, n. 4, p. 465-515.
UHERKOVICH, G.; RAI, H. 1979. Algen aus dem Rio Negro und seinen nebenfhissen. Amazoniana, Manaus, v. 6, n. 4, p. 611-638.
UHERKOVICH, G.; SCHMIDT, G. W. 1974. Phitoplanktontaxa in dem zentralamazonischen schwemmlaudsee Lago Castanho. Amazoniana, Manaus, v. 5, n. 2, p. 243-283.
VOLLENWEIDER, R. A.; TALLING, J. T.; WESTLAKA, D. F. 1969. A manual an method for measuring primary production in aquatic environments. 2. ed. London: International Biological Programe Handbook. 213 p.
VON KRAATZ-KOSCHLAU, K. A.; HUBER, J. 1900. Zwiischen Ocean und Guamá: Beitraz zur Kenntniss dês Staates Pará. Mem. Mus. Para. Hist. Nat. Ethnogr., Belém, v. 2, p. 1-34.
WOOD, E. J. F. 1966. A phytoplankton study of the Amazon region. Bull. Marine Sc., New Haven, v. 16, n. 1, p. 102-123.
 Endereço para correspondência:
Endereço para correspondência:
Editora do Museu Paraense Emílio Goeldi
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91-3219-3317
E-mail:boletim@museu-goeldi.br
Recebido: 07/12/2001
Aprovado: 19/05/2006













