Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.4 Ananindeua dez. 2010
http://dx.doi.org/10.5123/S2176-62232010000400003
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Comparação de dois testes automatizados por quimioluminescência para a detecção de anticorpos contra o vírus da hepatite C
Comparison of two automated chemiluminescence tests for the detection of antibodies against the hepatitis C virus
Comparación de dos pruebas automatizadas por quimioluminiscencia para la detección de anticuerpos contra el virus de la hepatitis C
Felicidade Mota Pereira; Leonardo Assis Bertollo; Maria Alice Sant'Anna Zarife
Laboratório Central de Saúde Pública do Estado da Bahia, Salvador, Bahia, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
INTRODUÇÃO: O diagnóstico correto da infecção pelo vírus da hepatite C (VHC) é de grande importância, já que o tratamento é altamente dispendioso e tem sérios efeitos colaterais. Os testes para a detecção dos anticorpos contra o VHC (anti-VHC) sofreram várias modificações e, atualmente, os testes de terceira geração são amplamente utilizados por terem sensibilidade e especificidade maiores.
OBJETIVO: O objetivo deste estudo foi comparar dois testes automatizados para a detecção do anti-VHC por quimioliminescência, de terceira geração, disponíveis comercialmente.
MÉTODOS: Foram utilizadas 67 amostras da soroteca do Laboratório Central de Saúde Pública do Estado da Bahia. Os reagentes utilizados foram os testes automatizados ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Alemanha), Elecsys® anti-HCV assay (Roche Diagnostics, Basileia, Suíça) e o teste confirmatório Recombinant ImmunoblotAssay (RIBA) (Chiron RIBA VHC 3.0 SIA, Chiron Corporation, Emeryville, CA, EUA).
RESULTADOS: Com o teste Architect anti-HCV assay foram obtidas 18 amostras positivas, 39 negativas e dez indeterminadas, enquanto que com o Elecsys anti-HCV assay, 47 amostras foram negativas e 20 positivas. Não houve amostras indeterminadas com este teste. Das dez amostras indeterminadas no Architect anti-HCV assay, cinco foram negativas pelo teste RIBA e cinco foram indeterminadas. Todas as amostras indeterminadas pelo RIBA apresentaram reatividade para a proteína c33.
CONCLUSÃO: Os dois testes, quando comparados (62 amostras) entre si, tiveram uma concordância de 91,9%. O Elecsys anti-HCV assay parece ser menos sensível que o Architect anti-HCV assay, em particular para a detecção da proteína c33, revelada pelo RIBA. Por outro lado, o Architect anti-HCV assay apresentou um maior número de resultados indeterminados em amostras negativas confirmadas pelo RIBA, o que sugere uma menor especificidade, quando comparado com o outro teste avaliado.
Palavras-chave: Hepatite C; Anticorpos Anti-Hepatite C; Testes Laboratoriais.
ABSTRACT
INTRODUCTION: A correct diagnosis of hepatitis C virus (HCV) infection is important because treatment is highly expensive and has severe side effects. The assays for the detection of antibodies against HCV (anti-HCV) have undergone several changes, and third-generation tests have been widely used due to their increased sensitivity and specificity.
OBJECTIVE: In this study, we aimed to compare two commercially available, automated third-generation chemiluminescence tests for the detection of anti-HCV antibodies.
METHODS: We analyzed 67 samples from the serum databank from the Laboratório Central de Saúde Pública do Estado da Bahia (LACEN-BA). The reagents examined were the automated ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Germany) and Elecsys® anti-HCV assay (Roche Diagnostics, Basel, Switzerland) tests and the confirmatory Recombinant Immunoblot Assay (RIBA) test (Chiron RIBA VHC 3.0 SIA, Chiron Corporation, Emeryville, CA, USA).
RESULTS: The Architect anti-HCV assay indicated 18 positive samples, whereas 39 were negative and ten were indeterminate. The Elecsys anti-HCV assay indicated 47 negative and 20 positive samples and no indeterminate samples. Of the ten indeterminate samples indicated by the Architect anti-HCV assay, five were negative by the RIBA test and five were indeterminate. All indeterminate samples indicated by the RIBA test were reactive against the c33 protein.
CONCLUSION: The agreement between the two tests (62 samples) was 91.9%. The Elecsys anti-HCV assay appears to be less sensitive than the Architect anti-HCV, particularly for the detection of the c33 protein shown by the RIBA test. In addition, the Architect anti-HCV assay indicated more indeterminate results out of the negative samples confirmed by the RIBA test, which suggests a lower specificity than the Elecsys anti-HCV assay.
Keywords: Hepatitis C; Hepatitis C Antibodies; Laboratory Test.
RESUMEN
INTRODUCIÓN: El diagnóstico correcto de la infección por el virus de la hepatitis C (VHC) es de gran importancia, una vez que su tratamiento es muy costoso y tiene serios efectos colaterales. Las pruebas para la detección de anticuerpos contra el VHC (anti-VHC) han pasado por varias modificaciones y, actualmente, las pruebas de tercera generación son ampliamente utilizadas, por tener mayor sensibilidad y especificidad.
OBJETIVO: El objetivo de este estudio fue el de comparar dos pruebas automatizadas para la detección del anti-VHC por quimioluminiscencia, de tercera generación, disponibles comercialmente.
MÉTODOS: Se utilizaron 67 muestras de la seroteca del Laboratório Central de Saúde Pública do Estado da Bahia (LACEN-BA). Los reactivos utilizados fueron las pruebas automatizadas ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Alemania), Elecsys® anti-HCV assay (Roche Diagnostics, Basilea, Suiza) y la prueba de confirmación Recombinant Immunoblot Assay (RIBA) (Chiron RIBA VHC 3.0 SIA, Chiron Corporation, Emeryville, CA, EUA).
RESULTADOS: Con la prueba Architect anti-HCV assay se obtuvieron 18 muestras positivas, 39 negativas y diez indeterminadas, mientras que con Elecsys anti-HCV assay, 47 muestras fueron negativas y 20 positivas. No hubo muestras indeterminadas con esta prueba. De las diez muestras indeterminadas por Architect anti-HCV assay, cinco fueron negativas por la prueba RIBA y cinco fueron indeterminadas. Todas las muestras indeterminadas por RIBA presentaron reactividad para la proteína c33.
CONCLUSIÓN: Cuando comparadas entre sí, las dos pruebas (62 muestras) tuvieron un 91,9% de concordancia. La prueba Elecsys anti-HCV assay parece ser menos sensible que Architect anti-VHC, en particular para la detección de la proteína c33, revelada por RIBA. Por otro lado, Architect anti-HCV assay presentó un mayor número de resultados indeterminados en muestras negativas confirmadas por RIBA, lo que sugiere una menor especificidad, cuando comparada con la otra prueba evaluada.
Palabras clave: Hepatitis C; Hepatitis C Antibodies; Laboratory Test.
INTRODUÇÃO
O diagnóstico virológico e o monitoramento da infecção pelo vírus da hepatite C (VHC) baseiam-se em dois tipos de testes: a detecção sorológica do anticorpo específico contra o VHC (anti-VHC) e a detecção do RNA viral ou a detecção do antígeno core do VHC, que confirma a infecção1. Os anticorpos anti-VHC não possibilitam a distinção entre uma infecção ativa (viremia) e uma infecção resolvida. Além disso, resultados falsonegativos são esperados por causa da janela imunológica (soroconversão do anti-VHC), que dura entre 45 e 68 dias2.
A reação falsopositiva para os anticorpos anti-VHC é um problema bem conhecido. Isto pode ocorrer devido a alguns interferentes como gamaglobulinas elevadas, síndrome nefrótica, doenças do fígado, doenças autoimunes, infecções virais ou parasitárias e amostras de mulheres grávidas3. O Centers for Disease Control and Prevention (CDC) estima que, em média, 35% dos resultados de anti-VHC na população imunocompetente sejam falsopositivos por metodologias como ELISA imunnoassay (EIA)4.
Atualmente, a detecção dos anticorpos anti-VHC é realizada rotineiramente por duas metodologias principais, que são: EIA e quimioluminescência (CLIA)5. O teste de EIA para detecção dos anticorpos anti-VHC passou por vários estágios de desenvolvimento e os testes de terceira geração (EIA III) são os mais utilizados, por sua maior sensibilidade e especificidade, decorrentes de maior reatividade à região NS3 do vírus e da incorporação dos epitopos de c100 e antígenos da porção NS5 do genoma viral6. Entretanto, os testes automatizados por quimioluminescência vêm substituindo os EIA por sua praticidade, precisão, especificidade superior a 98% e sensibilidade similar ao EIA6.
A presença de anticorpos anti-VHC nem sempre significa a existência de infecção atual, pois pode representar resultado falsopositivo ou indicar contato prévio com resolução (cura) da hepatite aguda, correspondendo a uma cicatriz imunológica6. Desta forma, apesar da alta especificidade dos testes de terceira geração, permanece a necessidade de serem realizados testes confirmatórios em amostras com baixos valores da relação sample/cut-off (S/CO), a fim de se evitar resultados falsopositivos7.
Atualmente, os testes CLIA são utilizados em laboratórios de grandes rotinas e, embora os testes por quimioluminescência estejam gradualmente substituindo o EIA, há poucos estudos publicados sobre comparação e avaliação destes testes CLIA automatizados8.
O objetivo deste trabalho foi comparar dois testes por quimioluminescência, totalmente automatizados, de terceiro geração, disponíveis comercialmente, para detecção do anti-VHC, e que são utilizados na rotina do Laboratório Central de Saúde Pública do Estado da Bahia (LACEN-BA).
MATERIAIS E MÉTODOS
Foram utilizadas 67 amostras selecionadas da soroteca do LACEN-BA. Estas amostras foram avaliadas previamente e 18 tiveram resultado positivo para o anti-VHC, 39 foram negativas e dez, indeterminadas. O LACEN-BA utiliza na sua rotina o kit ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Alemanha), sendo este considerado, neste estudo, como referência para a determinação do anti-VHC em comparação com o kit Elecsys® anti-HCV assay (Roche Diagnostics, Basileia, Suíça). Foi realizado o teste confirmatório Recombinant Immunoblot Assay (RIBA) (Chiron RIBA HCV 3.0 SIA, Chiron Corporation, Emeryville, CA, EUA) apenas nas amostras com resultado indeterminado.
As instruções do fabricante foram seguidas em todos os testes. O Architect anti-HCV assay utiliza a metodologia quimioluminescência (CLIA) e foi realizado no equipamento totalmente automatizado ARCHITECT i4000 Abbott, enquanto que o Elecsys anti-HCV assay utiliza a eletroquimioluminescência (ECLIA) e o equipamento utilizado foi o Modular E 170 Roche, também totalmente automatizado.
O RIBA é um ensaio immunoblot com tiras impregnadas com peptídeos sintéticos e recombinantes (c100, c33, c22 e NS5), aplicados em linhas separadas na fase sólida1.
As características dos dois testes automatizados podem ser observadas na tabela 1. Em ambas as metodologias há liberação de sinais de luz que são expressos pela proporção direta da quantidade de anticorpos presentes.

Os dois testes emitem os resultados com base em cut-off (CO) de 1,0. O teste do Architect anti-HCV assay expressa o resultado pela relação S/CO e o teste do Elecsys anti-HCV assay por valor de índex. No LACEN-BA, são considerados como anti-VHC positivos resultados quatro vezes maiores que o cut-off (> 4,0), negativos < 0,9 e indeterminados aqueles entre 0,9 e 4,0, nos dois testes avaliados. Este valor de cut-off foi escolhido por ter maior concordância (95%) com os resultados positivos obtidos com o teste de immunoblot RIBA.
RESULTADOS
Com a utilização do Architect anti-HCV assay foram obtidas 18 amostras positivas, 39 negativas e dez indeterminadas, enquanto que com o Elecsys anti-HCV assay, 47 amostras foram negativas e 20 positivas. Não houve amostras indeterminadas com este teste. Os dados podem ser observados na tabela 2.
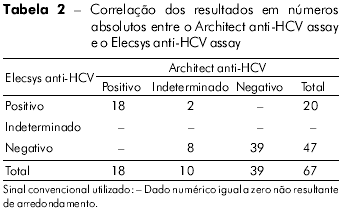
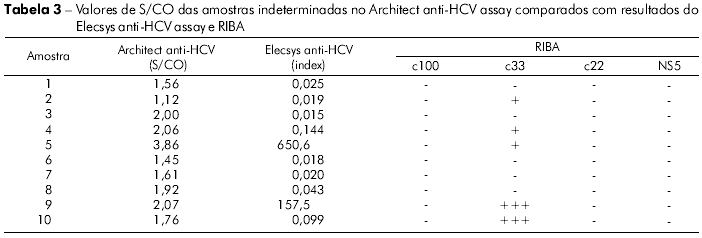
As dez amostras, com resultados indeterminados com o Architect anti-HCV assay, tiveram relação S/CO entre 1,12 a 3,86. Destas, cinco foram negativas e cinco indeterminadas pelo RIBA. Quando submetidas ao teste Elecsys anti-HCV assay, oito foram negativas e duas foram positivas. Assim, das 67 amostras analisadas, 44 foram negativas, 18 positivas e cinco indeterminadas, com base nos resultados do teste RIBA. Todas as amostras com resultado do teste RIBA indeterminado apresentaram reatividade à proteína c33. Os resultados laboratoriais das amostras indeterminadas pelo Architect anti-HCV assay, bem como os resultados do teste RIBA, estão sumarizados na tabela 3. As dez amostras, com resultados indeterminados com o Architect anti-HCV assay, tiveram relação S/CO entre 1,12 a 3,86. Destas, cinco foram negativas e cinco indeterminadas pelo RIBA. Quando submetidas ao teste Elecsys anti-HCV assay, oito foram negativas e duas foram positivas. Assim, das 67 amostras analisadas, 44 foram negativas, 18 positivas e cinco indeterminadas, com base nos resultados do teste RIBA. Todas as amostras com resultado do teste RIBA indeterminado apresentaram reatividade à proteína c33. Os resultados laboratoriais das amostras indeterminadas pelo Architect anti-HCV assay, bem como os resultados do teste RIBA, estão sumarizados na tabela 3.
DISCUSSÃO
O número de amostras avaliadas neste estudo foi relativamente pequeno, quando comparado a outros estudos que avaliaram o desempenho de testes disponíveis comercialmente para a detecção do anti-VHC1,5,8.
Entre as 67 amostras analisadas, dez (14,9%) tiveram resultados discordantes nos dois ensaios utilizados. Com o Architect anti-HCV assay, estas amostras tiveram relação S/CO inferior a 4,0 e foram consideradas indeterminadas, enquanto que, quando analisadas com o Elecsys anti-HCV assay, duas foram positivas e oito negativas. O uso do teste RIBA resolveu o problema em 50% destas amostras (5/10) com o resultado negativo do teste immunoblot. As amostras que tiveram resultado indeterminado pelo teste RIBA apresentaram positividade apenas para a proteína c33.
De acordo com as recomendações do CDC, a determinação do anti-VHC requer o uso de um teste de triagem de alta sensibilidade e as reações com baixa positividade devem ser confirmadas com testes do tipo immunoblot recombinante ou reação em cadeia de polimerase, o Polimerase Chain Reaction (PCR), para pesquisa do RNA do vírus8.
O RIBA pode ser utilizado como teste confirmatório complementar para o anti-VHC, mas apresenta algumas desvantagens, sendo uma delas o alto índice de resultados indeterminados5.
Berger et al1 avaliaram também dois testes sorológicos e obtiveram um resultado diferente, com 1,9% de discordância entre eles e resolutividade pelo teste immunoblot de 63,2% das amostras, com reatividade de até duas proteínas.
As amostras indeterminadas pelo teste RIBA não foram confirmadas pelo RNA viral, pois não havia quantidade suficiente de amostras. Além disso, a presença de anti-VHC não significa necessariamente a presença do vírus. Baixos títulos de anticorpos na amostra podem ocorrer na fase de soroconversão e também quando os pacientes perdem seus anticorpos após a resolução da infecção.
Normalmente, amostras de pacientes com baixo risco para hepatite C, com resultado de RIBA indeterminado e baixa relação S/CO apresentam vírus indetectável quando submetidas ao PCR7.
Os dois testes, quando comparados em amostras positivas e negativas (62 amostras), tiveram uma concordância de 91,9%, resultado este inferior ao encontrado por Kim et al8. Eles verificaram uma faixa de concordância de 94,5% a 98,1% na avaliação de quatro testes anti-VHC incluindo o Architect anti-HCV assay e Elecsys anti-HCV assay.
Desde que o Architect anti-HCV assay foi lançado comercialmente, foram observados alguns resultados falsonegativos e falsopositivos e, por esta razão, o diluente do teste foi modificado e novos estudos revelaram uma melhora na sensibilidade e especificidade1.
Echevarria et al9 demonstraram que o novo Architect anti-HCV assay é eficiente para detectar baixos níveis do anticorpo anti-VHC, tornando-o bastante efetivo para ser utilizado como teste de triagem em banco de sangue.
Com relação ao custo/benefício, o Elecsys anti-HCV assay apresenta algumas desvantagens quando comparado com o Architect anti-HCV assay. A apresentação do kit Elecsys anti-HCV assay é de 100 testes e o reagente não é pronto para uso, sendo uma fonte potencial para contaminação e erro pré-analítico. A calibração é feita por kit e não por lote e para cada calibração são gastos quatro testes além de dois controles, diminuindo a quantidade de testes disponíveis para as amostras, sendo no mínimo 94 testes por kit. Além disso, a estabilidade do kit no equipamento é de três dias e o volume de amostra requerido é maior que o outro teste avaliado.
CONCLUSÃO
De acordo com os resultados obtidos neste estudo, o Elecsys anti-HCV assay parece ser menos sensível que o Architect anti-HCV assay, no que diz respeito à detecção da proteína c33. Por outro lado, o Architect anti-HCV assay apresentou um maior número de resultados indeterminados em amostras negativas confirmadas pelo teste RIBA, o que sugere uma menor especificidade em relação ao outro teste avaliado.
Todas as amostras com baixa relação S/CO devem ser confirmadas com testes suplementares e/ou confirmatórios, tais como immunoblot e PCR, a fim de evitar a liberação de resultados falsopositivos.
Novos estudos são necessários para uma melhor avaliação dos testes que utilizam a quimioluminescência como metodologia, inclusive com um número maior de amostras.
REFERÊNCIAS
1 Berger A, Rabenau H, Allwinn R, Doerr HW. Evaluation of the new Architect anti-VHC screening test under routine laboratory conditions. J Clin Virol. 2008 Oct;43(2):158-61. DOI:10.1016/J.JCV.2008.05.009 [ Links ]
2 Morota K, Fujinami R, Kinukawa H, Machida T, Ohno K, Saegusa H, et al. A new sensitive and automated chemiluminescent microparticle immunoassay for quantitative determination of hepatitis C virus core antigen. J Virol Methods. 2009 Apr;157(1):8-14. DOI:10.1016/J.JVIROMET.2008.12.009 [ Links ]
3 Zachary P, Ullmann M, Djeddi S, Meyer N, Wendling MJ, Schvoerer E, et al. Evaluation of three comercially available hepatitis C virus antibody detection assays under the conditions of a clinical virology laboratory. J Clin Virol. 2005 Nov;34(3):207-10. DOI:10.1016/J.JCV.2005.06.005 [ Links ]
4 Watterson JM, Stallcup P, Escamilla D, Chernay P, Reyes A, Trevino SC. Evaluation of the ortho-clinical diagnostics vitros ECi anti-HCVT test: comparison with three other methods. J Clin Lab Anal. 2007;21(3):162-6. [ Links ]
5 Kesli R, Ozdemir M, Kurtoglu MG, Baykan M, Baysal B. Evaluation and comparison of three different anti-hepatitis C virus antibody tests based on chemiluminescence and enzyme-linked immunosorbent assay methods used in the diagnosis of hepatitis C infections in Turkey. J Int Med Res. 2009 Sep-Oct;37(5):1420-9. [ Links ]
6 Parise E. Diagnóstico sorológico das hepatites crônicas virais. Roche Rev. 2009;8:2-6.
7 Vermeersch P, Van Ranst M, Lagrou K. Validation of a strategy for HCV antibody testing with two enzyme immunoassays in a routine clinical laboratory. J Clin Virol. 2008 Aug;42(4):394-8. DOI:10.1016/J.JCV.2008.02.015 [ Links ]
8 Kim S, Kim JH, Yoon S, Park YH, Kim HS. Clinical performance evaluation of four automated chemiluminescence immunoassays for hepatitis C virus antibody detection. J Clin Microbiol. 2008 Dec;46(12):3919-23. DOI:10.1128/JCM.01603-08 [ Links ]
9 Echevarria JM, Avellón A, Jonas G, Hausmann M, Vockel A, Kapprell HP. Sensitivity of a modified version of the ARCHITECT® anti-HCV test in detecting samples with immunoblot-confirmed, low-level antibody to hepatitis C virus. J Clin Virol. 2006 Apr;35(4):368-72. DOI:10.1016/J.JCV.2005.11.006 [ Links ]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Felicidade Mota Pereira
Rua Waldemar Falcão, 123. Bairro: Candeal.
CEP: 40296-710 Salvador-Bahia-Brasil
Tel: +55 (71) 3276-1721
E-mail: felizmp@yahoo.com.br
Recebido em / Received / Recibido en: 9/8/2010
Aceito em / Accepted / Aceito en: 20/12/2010











 texto em
texto em 

