Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.4 n.2 Ananindeua jun. 2013
http://dx.doi.org/10.5123/S2176-62232013000200006
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Imunoexpressão de TNF-α e TGF-β em lesões de pacientes nas diversas formas clínicas da hanseníase por meio da técnica de imunoistoquímica
Immunolabeling of TNF-α and TGF-β in lesions of patients in several clinical forms of leprosy by immunohistochemistry
Inmunoexpresión de TNF-α y TGF-β en lesiones de pacientes en las diversas formas clínicas de la hanseniasis a través de técnica de inmunohistoquímica
Jorge Rodrigues de SousaI; Paulo Ygor Agrassar da SilvaII; Luis Paulo Miranda Araújo SoaresII; Tinara Leila de Souza AarãoI; Denise da Silva PintoI; Hellen Thais FuziiI; Juarez Antônio Simões QuaresmaI
ILaboratório de Imunopatologia, Núcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
IILaboratório de Imunopatologia, Núcleo de Medicina Tropical, Universidade do Estado do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Visando compreender melhor a dinâmica da hanseníase envolvendo a participação da resposta imunológica em pacientes, foi analisada, pela técnica de imunoistoquímica, a imunomarcação do fator de necrose tumoral alfa (TNF-α) e do fator de crescimento e transformação beta (TGF-β) nas diversas formas clínicas da doença. Para a realização do estudo, foram selecionadas 50 biópsias de pacientes distribuídos de acordo com o diagnóstico definido a partir da análise histopatológica, conforme a classificação de Madri. Dentre as quatro formas clínicas estudadas, a análise atribuída aos polos de resistência tuberculoide e de suscetibilidade lepromatoso a partir da citocina TNF-α denotou um aumento nos níveis de expressão da proteína na forma tuberculoide da doença. Referente à imunoexpressão do TGF-β, a distribuição analítica entre as quatro formas clínicas apresentou significância estatística dentre os grupos estudados. Sobre as formas polares da doença, a diferença entre os grupos demonstrou que a participação do TGF-β foi maior na forma lepromatosa da doença. No estudo paramétrico envolvendo a análise das variáveis estudadas, todas as formas clínicas apresentaram correlação negativa envolvendo o crescimento linear de ambas as citocinas. A partir dos achados, o presente estudo conclui que, durante a evolução espectral da doença, a atuação de ambas as citocinas é fundamental para o controle da resposta imunológica perante o bacilo, reforçando a necessidade de elaboração de estudos que complementem a participação dessas moléculas diante da fisiopatogenia da doença.
Palavras-chave: Hanseníase; Imunoistoquímica; Fator de Necrose Tumoral alfa; Fator de Crescimento Transformador beta.
ABSTRACT
Aiming at better understanding leprosy dynamics, involving immune response in patients, the immunolabeling of tumor necrosis factor alpha (TNF-α) and transforming growth factor beta (TGF-β) was analyzed by immunohistochemistry in several clinical forms of the disease. In the investigation, 50 biopsies were selected from patients distributed according to the diagnosis determined by histopathological analysis, as Madrid classification. Among the four clinical forms studied, the analysis of the poles of tuberculoid resistance and lepromatous susceptibility by cytokine TNF-α showed an increase in the levels of protein expression in tuberculoid form. Regarding the immunolabeling of TGF-β, the analytical distribution between the four clinical forms presented statistical significance among the groups studied. In the polar forms of disease, the difference between the two groups showed higher TGF-β level in lepromatous form. In the parametric study, involving the analysis of variables studied, all clinical forms showed negative correlation in the linear growth of both cytokines. This study concludes that, during the spectral evolution of the disease, both cytokines action is essential to control the immune response before the bacillus, and the necessity of doing studies that complement how these molecules participate in the physiopathogeny of the disease.
Keywords: Leprosy; Immunohistochemistry; Tumor Necrosis Factor-alpha; Transforming Growth Factor beta.
RESUMEN
Con el objetivo de comprender mejor la dinámica de la hanseniasis, abarcando la participación de la respuesta inmunológica en pacientes, fue analizada, por la técnica de inmunohistoquímica, la inmunomarcación del factor de necrosis tumoral alfa (TNF-α) y del factor de crecimiento y transformación beta (TGF-β) en las diversas formas clínicas de la enfermedad. Para realizar el estudio, se seleccionaron 50 biopsias de pacientes distribuidos de acuerdo al diagnóstico definido a partir del análisis histopatológico, según la clasificación de Madrid. Entre las cuatro formas clínicas estudiadas, el análisis atribuido a los polos de resistencia tuberculoide y de susceptibilidad lepromatosa a partir de la citocina TNF-α indicó un aumento en los niveles de expresión de la proteína de forma tuberculoide de la enfermedad. Referente a la inmunoexpresión del TGF-β, la distribución analítica entre las cuatro formas clínicas presentó significado estadístico entre los grupos estudiados. Sobre las formas polares de la enfermedad, la diferencia entre los grupos demostró que la participación del TGF-β fue superior en la forma lepromatosa de la enfermedad. En el estudio paramétrico abarcando el análisis de las variables estudiadas, todas las formas clínicas presentaron correlación negativa comprendiendo el crecimiento linear de ambas citocinas. A partir de esos hallazgos, el presente estudio concluye que, durante la evolución espectral de la enfermedad, la actuación de ambas citocinas es fundamental para el control de la respuesta inmunitaria delante del bacilo, reforzando la necesidad de elaborar estudios que complementen la participación de esas moléculas frente a la fisiopatogenia de la enfermedad.
Palabras clave: Lepra; Inmunohistoquímica; Factor de Necrosis Tumoral alfa; Factor de Crecimiento Transformador beta.
INTRODUÇÃO
A hanseníase é uma doença crônica granulomatosa causada pelo Mycobacterium leprae, bacilo intracelular que afeta preferencialmente os nervos periféricos e a pele, sendo as vias aéreas superiores a principal porta de entrada e via de eliminação do bacilo1,2,3.
Clinicamente, a doença é caracterizada por apresentar um amplo espectro de formas clínicas associadas a alterações imunológicas do hospedeiro. De acordo com o critério histopatológico, estudos sugerem que as formas podem oscilar no espectro da doença. Segundo a classificação de Ridley e Jopling, a hanseníase apresenta cinco formas clínicas: hanseníase tuberculoide (TT), dimorfo tuberculoide (DT), dimorfo dimorfo, (DD), dimorfo lepromatosa (DL) e lepromatosa (LL)4,5.
Por se tratar de uma doença espectral, a resposta imunológica do hospedeiro transita entre os extremos da doença. Na forma tuberculoide, o indivíduo apresenta uma intensa resposta celular mediada por linfócitos Th 1 responsáveis pela produção de citocinas pró-inflamatórias como o fator de necrose tumoral alfa (TNF-α), que estimula o recrutamento de neutrófilos e monócitos para o local da infecção, ativando-os no intuito de combater o crescimento e multiplicação bacteriana no sítio da infecção6,7.
No polo lepromatoso, a resposta imunológica é mediada pelos linfócitos Th2, com a participação de citocinas imunosupressoras como o fator de crescimento transformador beta (TGF-β), responsável pelo controle, diferenciação, proliferação celular, desenvolvimento e reparo tecidual. Estudos demonstram que a sua atuação favoreceria o desenvolvimento da infecção6,8,9.
Sobre as lesões específicas da hanseníase, estudos indicam que a participação da molécula de TNF-α e de seus receptores seria determinante para o aumento da resposta inflamatória no local da lesão, sendo que os efeitos de toxicidade direta do TNF-α incluiriam a liberação de estímulos para a produção de outros mediadores que iriam potencializar o dano tecidual, como a IL-1, IL-6 beta, NO e as MMPs. Foi demonstrado que um aumento nas concentrações de TNF-α em sítios lesionados seria capaz de aumentar a infiltração macrofágica e a dor10,11,12.
No que tange à participação do TGF-β, a atuação de outras citocinas pode vir a modular a resposta celular, causando um efeito diferente, dependendo do estado de ativação da célula envolvida. Além disso, TGF-β é capaz de promover no tecido inflamado o processo de cicatrização13 por meio da estimulação, regulação de matriz extracelular pelos fibroblastos, indução e proliferação de células endoteliais necessárias para o processo de angiogênese13,14,15.
Diversos estudos demonstram que o desenvolvimento da resposta imunológica é um ponto crucial para a mediação de mecanismos efetores que interferem na resposta fisiopatológica frente a determinados patógenos intracelulares16.
Dessa forma, diante da dinâmica espectral da doença, o presente estudo teve como objetivo: avaliar a imunoexpressão do TNF-α e TGF-β em lesões de pacientes em diversas formas clínicas da hanseníase por meio da técnica de imunoistoquímica e o seu papel no desenvolvimento da resposta imunológica na presença do M. leprae.
MATERIAIS E MÉTODOS
CARACTERIZAÇÃO DA AMOSTRA
Para a realização do estudo, foram selecionados 50 pacientes com hanseníase, não tratados, atendidos no Ambulatório de Dermatologia do Núcleo de Medicina Tropical da Universidade Federal do Pará (UFPA), com idade entre 19 e 55 anos, sendo 19 do sexo masculino e 31 do sexo feminino. Sobre as formas clínicas da doença: os pacientes tiveram o diagnóstico confirmado de hanseníase segundo os critérios preconizados pela classificação de Madri. Dentre as formas clínicas, dez casos eram de hanseníase indeterminada (I); 16, de tuberculoide (T); 17, de dimorfo (D); e sete, de lepromatoso (L).
Referente às amostras de pele dos pacientes: as biópsias cutâneas foram colhidas após antissepsia do local selecionado com PVPI tópico e anestesia local com lidocaína a 2% sem vasoconstritor, aplicada por seringa descartável de 5 mL e com agulhas 26 G 1/2" 0,45x13 mm. As amostras foram coletadas a partir da secção realizada com punch descartável de 4 mm de diâmetro.
Para a análise histopatológica das biópsias emblocadas em material parafinado, foram realizados pelo micrótomo cortes histológicos com 5 µ.m de espessura. Para a visualização no microscópio das alterações celulares e teciduais dos pacientes, as lâminas foram submetidas à coloração pela hematoxilina-eosina (HE) e à imunomarcação pela técnica de imunoistoquímica.
TÉCNICA DE IMUNOISTOQUÍMICA
Para a realização, desenvolvimento e descrição dos procedimentos adotados na técnica, o presente trabalho teve embasamento no protocolo adaptado por Quaresma e colaboradores16 e o descrito por Hsu e colaboradores17.
A respeito da avaliação da imunomarcação do tecido, foi utilizado o método imunoistoquímico baseado na formação do complexo antígeno anticorpo a partir da reação envolvendo a ligação entre a estreptavidina-biotina-peroxidase.
Inicialmente, os cortes histológicos foram desparafinizados em xilol e desidratados em álcool etílico. Envolvendo a atividade enzimática, o bloqueio da peroxidase endógena foi feito em câmara escura, com o peróxido de hidrogênio a 3%, por 45 min. Para a exposição e a recuperação antigênica do tecido, foi utilizado o tampão citrato pH 6,0 a 90o C em câmara de Pascal (DakoCytomation) por 20 min.
Referente ao bloqueio das proteínas inespecíficas, a fim de se evitar a formação de ligação cruzada, as lâminas preparadas foram imersas em solução contendo leite desnatado concentrado a 10% por 30 min. Após esta etapa, os cortes histológicos foram preenchidos com os anticorpos primários: Anti-TNF-α (abcam ab6671; diluição: 1:100) e anti-TGF-β (abcam ab66043; diluição: 1:100), diluídos em solução a 1% composta por PBS e soro albumina bovina (BSA). Finalizada a aplicação, as lâminas foram mantidas em câmara úmida a 4o C por 14 h.
Terminada esta etapa, os cortes preenchidos com o anticorpo primário foram imersos em uma solução contendo PBS e, posteriormente, incubados com o anticorpo secundário biotinilado LSAB+System HRP (DakoCytomation), por 30 min, na estufa térmica a 37o C. Após a fixação, os cortes foram novamente imersos em solução de PBS e em seguida incubados com a Streptavidina-Peroxidase LSAB+System HRP (DakoCytomation) por 30 min a 37o C. Após este intervalo, os cortes foram revelados com a aplicação da solução cromógena composta por diaminobenzidina a 0,03% e peróxido de hidrogênio a 3%.
Finalizada esta etapa, os cortes histológicos foram submetidos à coloração pela hematoxilina de Mayer's, por 3 min, em seguida hidratados em álcool etílico e diafanizados em xileno.
ANÁLISE QUANTITATIVA DAS CÉLULAS IMUNOMARCADAS
Para a contagem dos campos com o tecido imunomarcado, as lâminas foram observadas no microscópio óptico Axio Imager Z1- Zeiss, utilizando oculares A-Plan com leitura realizada em objetiva de 400x.
A análise quantitativa foi processada de acordo com a intensidade da imunomarcação no tecido. Para a confirmação de positividade, foram consideradas as células presente na derme que obtiveram coloração acastanhada inequívoca em um fundo característico devido à coloração pela hematoxilina. A análise quantitativa dos eventos foi realizada utilizando o gartículo graduado com 10x10 subdivisões (compreendendo uma área total de 0,0625 mm2 da lâmina). Para a análise, cinco campos foram selecionados aleatoriamente ao longo de cada área da lesão17,18.
ANÁLISE DOS DADOS
Na análise estatística dos dados obtidos, o programa Excel 2007 foi utilizado para organizar as planilhas eletrônicas no intuito de otimizar a elaboração de tabelas e gráficos. Visando o desenvolvimento e aplicação dos testes estatísticos, foram utilizados os programas BioEstat 5.0 e GraphPad Prism 5.0. Envolvendo a análise univariada, foram obtidas frequências, medidas de tendência central e de dispersão, sendo que, para investigação mais detalhada da relação entre as citocinas estudadas e as formas clínicas da doença apresentadas pelos pacientes, foram aplicados testes de Mann-Whitney, Kruskal-Wallis e a correlação de Pearson. Todos os testes foram realizados considerando um nível de significância de 5% (p < 0,05).
ASPECTOS ÉTICOS
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do Núcleo de Medicina Tropical da UFPA (parecer: 047/2008 CEP/NMT).
RESULTADOS
Em relação ao padrão de resposta imunológica, de acordo com o perfil e as formas clínicas apresentadas, verificou-se que, dentre os grupos analisados, não houve significância estatística, quando comparados de forma geral, envolvendo a imunomarcação do anticorpo anti-TNF-α. Segundo os dados, a média das células contadas nos cinco campos para a forma indeterminada foi de 27,40 e o desvio padrão de ± 27,29. Envolvendo a forma tuberculoide, a média obtida foi de 43 células marcadas e o desvio de ± 34,79. Na forma dimorfo, a imunomarcação para o TNF-α esteve na média de 23,88 das células marcadas com desvio de ± 26,08. Já na forma lepromatosa, houve uma média de 7,33, juntamente com desvio apresentado em ± 7,394 e p = 0,0803 conforme a figura 1A.
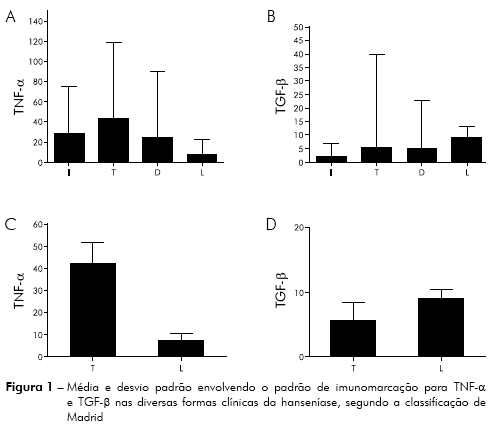
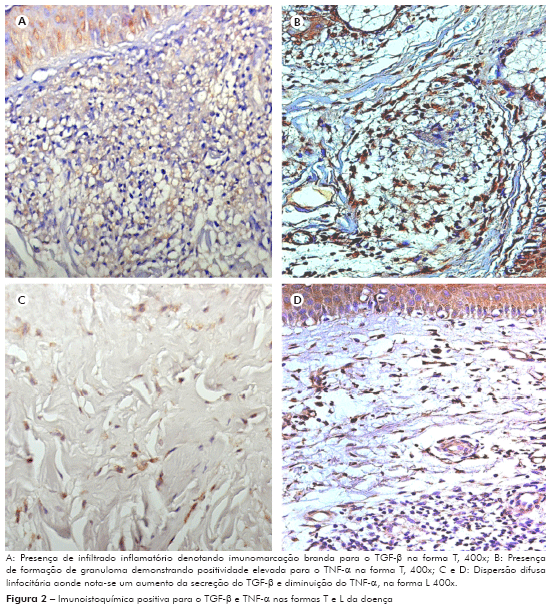
Quanto aos polos de resistência, no caso o tuberculoide e o de suscetibilidade o lepromatoso, quando analisados junto ao marcador anti-TNF-α, nas duas formas clínicas observou-se significância estatística entre os grupos analisados. De acordo com os dados, a média das células marcadas na forma tuberculoide foi de 41,85 e desvio padrão de ± 35,93. Já no polo lepromatoso, a média foi de 7,33 e o desvio de ± 7,394 com p = 0,0201 mostrando significância estatística, conforme as figuras 1C, 2B.
Quanto à imunomarcação do peptídio TGF-β a partir do anticorpo anti-TGF-β, as formas clínicas, quando analisadas de forma geral, apresentaram diferença estatística entre si. Na forma indeterminada, o valor mediano foi de 2 e o desvio padrão de ± 2,21 de células marcadas. No polo tuberculoide, a média foi de 5,53 e o desvio padrão de ± 10,67. Na forma dimorfo, a média encontrada foi de 4,93 e o desvio de ± 6,30. Na hanseníase lepromatosa, pôde-se observar uma maior concentração do peptídio, sendo que a média das células imunomarcadas foi de 9,00 e o desvio de ± 3,08 com p = 0,0285, como demonstra a figura 1B.
As formas polares apresentaram significância estatística quando comparadas, sendo que na forma tuberculoide o valor mediano foi de 5,53 e o desvio padrão de ± 10,67. Na forma lepromatosa, a média das células marcadas foi de 9 e o desvio padrão de ± 3,08, p = 0,0196, como mostrado nas figuras 1D, 2C.
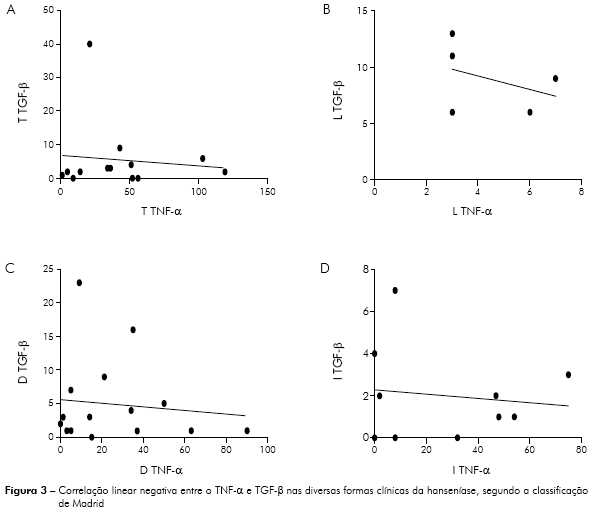
Sobre a análise paramétrica envolvendo a correlação linear, não houve diferença estatística entre os grupos estudados. De acordo com os dados, pôde-se observar na forma tuberculoide da doença uma correlação negativa fraca entre o TNF-α e o TGF-β (r = -0,1037) (p = 0,7360), conforme a figura 3A. No polo lepromatoso, o valor do coeficiente de Pearson demonstrou uma correlação negativa moderada entre as duas citocinas estudadas (r = -0,3745), contudo sem significância estatística (p = 0,5346), como mostra a figura 3B. Na forma dimorfa e indeterminada, em ambas a correlação negativa encontrada foi fraca (r = -0,1078 e r = -0,1234), (p = 0,6910 e p = 0,7342), respectivamente, de acordo com a figura 3C e 3D.
DISCUSSÃO
A interação existente entre o bacilo e o hospedeiro define um ponto crucial no curso evolutivo da doença. De acordo com o grau de aceitação ou restrição ao crescimento do M. leprae, a presença do bacilo retrata a passionalidade e adequação da bactéria em se estabelecer a partir dos mecanismos de evasão imunológica que o patógeno consegue desenvolver nos polos de transição da doença19,20.
Os recentes avanços que foram obtidos em relação ao mecanismo de adesão do M. leprae demonstram que os componentes lipídicos micobacterianos interagem com moléculas específicas da lâmina basal e das células de Schwann21,22,23.
Durante o curso progressivo da infecção, a micobacteria consegue estimular receptores de sinalização específicos que interferem na indução seletiva de genes do hospedeiro que facilitam a invasão, colonização e crescimento bacteriano24.
Dependendo da forma clínica apresentada, o bacilo consegue modular o padrão de resposta imunológica de acordo com o sítio de expressão de determinados receptores22,25.
No intuito de se compreender melhor de que maneira a resposta imunológica evolui perante a dinâmica espectral da doença a partir das alterações fisiopatológicas provocadas pelo M. leprae, este trabalho avaliou a imunoexpressão do TNF-α, TGF-β e o comprometimento das lesões de pele de pacientes nas diversas formas clínicas da doença pela técnica de imunoistoquímica16.
No presente estudo, os resultados demonstram que a imunoexpressão do TNF-α foi maior na forma tuberculoide do que na lepromatosa da doença (41,85 ± 35,93 versus 7,333 ± 7,394 células/campo; p = 0,0201). Estes achados podem ser explicados a partir do perfil de resposta imunológica que é desenvolvida no polo tuberculoide da doença. Estudos retratam que a imunoexpressão do TNF-α estimula a resposta relacionada ao perfil Th1 pró-inflamatório, estimulando o recrutamento de macrófagos, aumentando a produção de NO no local da infecção25,26.
Pesquisas têm demonstrado que esta citocina é fundamental para o combate da proliferação bacilar. De acordo com Santos e colaboradores27, em estudo envolvendo lesões de pacientes multi e paucibacilares, foi observado que a imunoexpressão do TNF-α sob a alteração da região promotora (-308G/A) da proteína era mais frequente em pacientes multibacilares. Nos estudos desenvolvidos por Sarno e colaboradores28, verificou-se que, em pacientes multibacilares, a alteração na produção do gene TNF nos macrófagos proporcionaria um ambiente privilegiado para a manutenção do bacilo, favorecendo a persistência da infecção.
Nas alterações teciduais que são provocadas perante o dano neural, vale ressaltar que a participação da molécula de TNF-α, quando produzida de forma inapropriada, acarreta complicações severas, envolvendo o desenvolvimento das células de Schwann. Segundo os avanços obtidos a partir da compreensão molecular a respeito da expressão celular, estudos demonstram que as lesões provocadas pelo bacilo apresentam uma elevação na produção de linfócitos CD4+, de HLA-DR, do receptor IL-2, em células do infiltrado, assim como nos ceratinócitos6,29,30,31,32.
Quanto à análise sobre as circunstâncias eventuais a partir das alterações histopatológicas, foi demonstrado que o TNF-α atua de forma sinérgica e autócrina com outras citocinas, estimulando a formação do granuloma no local da lesão33,34.
Estudos desenvolvidos sobre o remodelamento tecidual demonstram que a participação do TNF-α contribui de forma direta para o aumento da expressão das MMPs nesta forma clínica da doença, aumentando o efeito citolítico das células, bem como a degradação da matriz tecidual da derme papilar11,35,36.
Sobre os eventos referentes à morte celular programada, já se demonstrou que, em culturas de monócitos dose-dependentes, a participação do TNF-α estimularia o aumento nas concentrações do BAX na forma lepromatosa da doença, o que reforça a atuação desta citocina como uma importante protagonista da resposta fisiopatológica envolvendo a hanseníase16,37.
Referente à participação do TGF-β, nos estudos desenvolvidos sobre sua função, procurou-se entender a diferença existente entre as formas tuberculoide e lepromatosa ao correlacionarem-se à expressão de outros fatores de ação antimicrobicida. Segundo os nossos achados, análise demonstrou que na forma lepromatosa da doença, a concentração de células por campo foi maior do que na tuberculoide (9,00 ± 3,08 versus 5,53 ± 10,67 células/campo; p = 0,0196).
Os estudos desenvolvidos por Goulart e colaboradores30 demonstram que o TGF-β impediria a expressão do óxido nítrico e sua ação antimicrobiana ao contrapor-se a citocinas mediadoras da resposta Th1. Neste sentido, o TGF-β favorece o padrão de resposta Th2 nas formas lepromatosa e dimorfo lepromatosa, enquanto que nas formas tuberculoide e dimorfo tuberculoide encontra-se com a expressão diminuída ou suprimida38,39,40. Sobre as dosagens do peptídio, os estudos demonstram elevadas concentrações nas culturas de células aderentes de monócitos no sangue periférico de pacientes com hanseníase dimorfo lepromatosa e lepromatosa que entraram em reação hansênica do tipo 2 ou do eritema nodoso, adquirindo não só papel supressor, como também inflamatório30,40,41,42.
Os resultados alcançados com este estudo encontraram concordância com trabalhos presentes na literatura, bem como nos primeiros postulados sobre a imunopatogenia do TGF-β. Nestes estudos, a função do peptídio ganha reforço como um forte indutor do padrão de resposta Th2 e antagonista à liberação de espécies reativas intermediárias de oxigênio e nitrogênio, ao ser correlacionado às presenças da enzima óxido nítrico sintetase (iNOS) e das citocinas IFN-γ e TNF-α43,44,45,46.
Estudos demonstram que a participação do TGF-β pode ser um importante indutor para a produção de estímulos que desencadeiem a alteração na produção do colágeno dos tipos 1 e 3 no espaço mesenquimal do epitélio, estimulando o aumento da produção de RNA mensageiro das MMPs, bem como na produção do fator de crescimento do nervo nas células de Schwann. Estudos retratam que esta citocina pode orquestrar eventos que incluem reprogramação do fenótipo das células, levando à transdiferenciação de fenômenos que interfiram na expansão de células de tecido conjuntivo, na fibrogênese, na evolução das lesões dos nervos e na morte celular programada durante o curso progressivo da doença47,48,49.
Referente aos eventos apoptóticos, atualmente alguns autores tentam explicar a atuação do TGF-β no desenvolvimento de mecanismos de morte celular, durante evolução espectral da hanseníase. Estudos demonstram que o TGF-β pode ser um importante indutor de apoptose na forma lepromatosa da doença sendo que, nesta forma clínica, o TGF-β aumentaria a ativação de quinases e o clivamento da caspase 3, aumentando a ativação dos domínios de morte nos processos crônicos e infecciosos da doença50,51,52.
CONCLUSÃO
Dessa forma, o presente estudo conclui que a participação de ambas as citocinas via condicionamento, adaptação, adequação e sinalização pode interferir diretamente no perfil de resposta imunológica desenvolvida na imunopatogenia da hanseníase, reforçando ainda mais o processo de complexidade sobre a análise dos marcadores imunológicos durante o curso evolutivo da doença.
REFERÊNCIAS
1 Ministério da Saúde (BR). Secretaria de Políticas de Saúde. Departamento de Atenção Básica. Guia para o controle da hanseníase. 3. ed. Brasília: Ministério da Saúde; 2002. 89 p. [Link]
2 Organização Mundial da Saúde. A estratégia global para aliviar a carga da hanseníase e manter as atividades de controle da hanseníase; 2005. 27 p. [Link]
3 Araújo MG. Hanseníase no Brasil. Rev Soc Bras Med Trop. 2003 mai-jun;36(3):373-82. [Link]
4 Ishii N. Recent advances in the treatment of leprosy. Dermatol Online J. 2003;9(2):5. [Link]
5 Ridley DS, Jopling WH. Classification of leprosy according to immunity: a five-group system. Int J Lepr Other Mycobact Dis. 1966 Jul-Sep;34(3):255-73. [Link]
6 Mendonca VA, Costa RD, Melo GEBA, Antunes CM, Teixeira AT. Imunologia da hanseníase. An Bras Dermatol. 2008 jul-ago;83(4):343-50. [Link]
7 Andersson AK, Chaduvula M, Atkinson SE, Khanolkar-Young S, Jain S, Suneetha L, et al. Effects of prednisolone treatment on cytokine expression in patients with leprosy type 1 reactions. Infect Immun. 2005 Jun;73(6):3725-33. [Link]
8 Kingsley DM. The TGF-β superfamily: new members, new receptors and new genetic tests of function in different organisms. Genes Dev. 1994 Jan;8(2):133-46. [Link]
9 Letterio JJ, Roberts AB. Regulation of immune responses by TGF-β. Annu Rev Immunol. 1998;16:137-61. [Link]
10 Harris JE, Fernandez-Vilaseca M, Elkington PTG, Horncastle DE, Graeber MB, Friedland JS. IFN-γ synergizes with IL-1 β to up-regulate MMP-9 secretion in a cellular model of central nervous system tuberculosis. FASEB J. 2007 Feb;21(2):356-65. [Link]
11 Teles RMB, Teles RB, Amadeu TP, Moura DF, Mendonça-Lima L, Ferreira H, et al. High matrix metalloproteinase production correlates with immune activation and leukocyte migration in leprosy reactional lesions. Infect Imunn. 2010 Mar;78(3):1012-21. Doi:10.1128/IAI.00896-09 [Link]
12 Fayyazi A, Schweyer S, Eichmeyer B, Herms J, Hemmerlein B, Radzun HJ. Expression of IFN-γ, coexpression of TNF-α and matrix metalloproteinases and apoptosis of T lymphocytes and macrophages in granuloma annulare. Arch Dermatol Res. 2000 Aug;292(8):384-90. [Link]
13 Parks WC, Wilson CL, López-Boado YS. Matrix metalloproteinases as modulators of inflammation and innate immunity. Nat Rev Immunol. 2004 Aug;4(8):617-29. [Link]
14 Nabeshima K, Inoue T, Shimao Y, Sameshima T. Matrix metalloproteinases in tumor invasion: role for cell migration. Pathol Int. 2002 Apr;52(4):255-64. [Link]
15 Unemori EN, Hibbs MS, Amento EP. Constitutive expression of a 92-kD gelatinase (type V collagenase) by rheumatoid synovial fibroblasts and its induction in normal human fibroblasts by inflammatory cytokines. J Clin Invest. 1991 Nov;88(5):1656-62. [Link]
16 Quaresma JA, Lima LW, Fuzii HT, Libonati RM, Pagliari C, Duarte MI. Immunohistochemical evaluation of macrophage activity and its relationship with apoptotic cell death in the polar forms of leprosy. Microb Pathog. 2010 Oct;49(4):135-40. Doi:10.1016/j.micpath.2010.05.003. [Link]
17 Hsu SM, Raine L, Fanger H. Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques: a comparison between ABC and unlabeled antibody (PAP) procedures. J Histochem Cytochem. 1981 Apr;29(4):577-80. [Link]
18 Bobrow MN, Harris TD, Shaughnessy KJ, Litt GJ. Catalyzed reporter deposition, a novel method of signal amplification: application to immunoassays. J Immunol Methods. 1989 Dec;125(1-2):279-85. [Link]
19 Cabello PH. Fatores genéticos nas doenças infecciosas e parasitárias. In: Coura JR . Dinâmica das doenças infecciosas e parasitárias. Rio de Janeiro: Guanabara Koogan; 2005.
20 Rambukkana A, Zanazzi G, Tapinos N, Salzer JL. Contact-dependent demyelination by Mycobacterium leprae in the absence of immune cells. Science. 2002 May 3;296(5569):927-31. [Link]
21 Adams LB, Fukutomi Y, Krahenbuhl JL. Regulation of murine macrophage effector functions by lipoarabinomannan from mycobacterial strains with different degrees of virulence. Infect Immun. 1993 Oct;61(10):4173-81. [Link]
22 Brennan PJ, Vissa VD. Genomic evidence for the retention of the essential mycobacterial cell wall in the otherwise defective Mycobacterium leprae. Lepr Rev. 2001 Dec;72(4):415-28. [Link]
23 Krutzik SR, Tan B, Li H, Ochoa MT, Liu PT, Sharfstein SE, et al. TLR activation triggers the rapid differentiation of monocytes into macrophages and dendritic cells. Nat Med. 2005 Jun;11(6):653-60. [Link]
24 Alter A, Leseleuc L, Van Thuc N, Thai VH, Huong NT, Ba NN, et al. Genetic and functional analysis of common MRC1 exon 7 polymorphisms in leprosy susceptibility. Hum Genet. 2010 Mar;127(3):337-48. Doi:10.1007/s00439-009-0775-x. [Link]
25 Van Lint P, Libert C. Chemokine and cytokine processing by matrix metalloproteinases and its effect on leukocyte migration and inflammation. J Leukoc Biol. 2007 Dec;82(6):1375-81. [Link]
26 Takeichi O, Saito I, Okamoto Y, Tsurumachi T, Saito T. Cytokine regulation on the synthesis of nitric oxide in vivo by chronically infected human polymorphonuclear leucocytes. Immunology. 1998 Feb;93(2):275-80. [Link]
27 Santos AR, Suffys PN, Vanderborght PR, Moraes MO, Vieira LMM, Cabello PH, et al. Role of tumor necrosis factor-α and interleukin-10 promoter gene polymorphisms in leprosy. J Infect Dis. 2002 Dec;186(11):1687-91. [Link]
28 Sarno EN, Santos AR, Jardim MR, Suffys PN, Almeida AS, Nery JAC, et al. Pathogenesis of nerve damage in leprosy: genetic polymorphism regulates the production of TNF alpha. Lepr Rev. 2000 Dec;71 Suppl:154-8. [Link]
29 Litle D, Khanolkar-Young S, Coulthart A, Suneetha S, Lockwood DN. Immunohistochemical analysis of cellular infiltrate and gamma interferon, interleukin-12 and inducible nitric oxide synthase expression in leprosy type 1 (reversal) reactions before and during prednisolone treatment. Infect Immun. 2001 May;69(5):3413-7. [Link]
30 Goulart IM, Penna GO, Cunha G. Imunopatologia da hanseniase: a complexidade da resposta imune do hospedeiro ao Mycobacterium leprae. Rev Soc Bras Med Trop. 2002 jul-ago;35(4):365-75. [Link]
31 Kahawita IP, Walker SL, Lockwood DNJ. Leprosy type 1 reactions and erythema nodosum leprosum. An Bras Dermatol. 2008 Jan-Fev;83(1):75-82. Doi:10.1590/S0365-05962008000100010. [Link]
32 Modlin RL, Melancon-Kaplan J, Young SMM, Pirmez C, Kino H, Convit J, et al. Learning from lesions: patterns of tissue inflammation in leprosy. Proc Natl Acad Sci U S A. 1988 Feb;85(4):1213-7. [Link]
33 Pena M, Geluk A, Van Der Ploeg-Van Schip JJ, Franken KL, Sharma R, Truman R. Cytokine responses to Mycobacterium leprae unique proteins differentiate between Mycobacterium leprae infected and naive armadillos. Lepr Rev. 2011 Dec;82(4):422-31. [Link]
34 Freitas DS, Machado N, Andrigueti FV, Reis Neto ET, Pinheiro MM. Lepromatous leprosy associated with the use of anti-TNF a therapy: case report. Rev Bras Reumatol. 2010 May-Jun;50(3):333-9. [Link]
35 Oliveira AL, Antunes SL, Teles RM, Silva AC, Silva TP, Brandão Teles R. Schwann cells producing matrix metalloproteinases under Mycobacterium leprae stimulation may play a role in the outcome of leprous neuropathy. J Neuropathol Exp Neurol. 2010 Jan;69(1):27-39. Doi:10.1097/NEN.0b013e3181c6515c. [Link]
36 Steenport M, Khan KMF, Du B, Barnhard SE, Dannenberg AJ, Falcone DJ. Matrix metalloproteinase (MMP)-1 and MMP-3 induce macrophage MMP-9: evidence for the role of TNF-α and cyclooxygenase-2. J Immunol. 2009 Dec;183(12):8119-27. Doi:10.4049/jimmunol.0901925. [Link]
37 Hernandez MO, Neves I, Sales JS, Carvalho DS, Sarno EN, Sampaio EP. Induction of apoptosis in monocytes by Mycobacterium leprae in vitro: a possible role for tumor necrosis factor-α. Immunology. 2003 May;109(1):156-64. [Link]
38 Green SJ, Scheller LF, Marletta MA, Seguin MC, Klotz FW, Slayter M, et al. Nitric oxide: cytokine-regulation of nitric oxide in host resistance to intracellular pathogens. Immunol Lett. 1994 Dec;43(1-2):87-94. [Link]
39 Williams AO, Chanock S, Flanders KC. Transforming growth factor beta isoforms in tuberculoid and leprometous leprosy: immunohistochemical studies. Cell Vision. 1995;2:363.
40 Kiszewski CA, Becerril E, Baquera L, Aguilar LD, Hernández-Pando R. Expression of transforming growth fator-β isoforms and their receptors in lepromatous and tuberculoid leprosy. Scand J Immunol. 2003 Mar;57(3):279-85. [Link]
41 Goulart IMB, Figueiredo F, Coimbra T, Foss NT. Detection of transforming growth factor-β1 in dermal lesions of different clinical forms of leprosy. Am J Pathol. 1996 Mar;148(3):911-7. [Link]
42 Goulart IMB, Mineo JR, Foss NT. Production of transforming growth factor-beta 1 (TGF-β1) by blood monocytes from patients with different clinical forms of leprosy. Clinical and Experimental Immunology. 2000 Dec;122(2):330-4. [Link]
43 McCartney-Francis N, Mizel D, Wong H, Wahl L, Wahl S. TGF-β regulates production of growth factors and TGF-β by human peripheral blood monocytes. Growth Factors. 1990;4(1):27-35. [Link]
44 Khanolkar-Young S, Snowdon D, Lockwood DN. Immunocytochemical localization of inducible nitric oxide synthase and transforming growth factor-beta (TGF-β) in leprosy lesions. Clin Exp Immunol. 1998 Sep;113(3):438-42. [Link]
45 Venturini J. Boderline leprosy: in situ and cytokine profile in supernatant of mononuclear cell culture. J Venom Anim Toxins Incl Trop Dis. 2009;15(2):366. Doi:10.1590/S1678-91992009000200018. [Link]
46 Adams LB, Job CK, Krahenbuhl JL. Role of inducible nitric oxide synthase inresistance to Mycobacterium leprae in mice. Infect Immun. 2000 Sep;68(9):5462-5. [Link]
47 Petito RB, Amadeu TP, Pascarelli B, Jardim MR, Vital RT, Antunes SL, et al. Transforming growth factor-β1 may be a key mediator of the fibrogenic properties of neural cells in leprosy. J Neuropathol Exp Neurol. 2013 Apr;72(4):351-66. Doi:10.1097/NEN.0b013e31828bfc60. [Link]
48 Moura DF, Mattos KA, Amadeu TP, Andrade PR, Sales JS, Schmitz V, et al. CD163 favors Mycobacterium leprae survival and persistence by promoting anti-inflammatory pathways in lepromatous macrophages. Eur J Immunol. 2012 Nov;42(11):2925-36. Doi:10.1002/eji.201142198. [Link]
49 Kim M, Shin DW, Shin H, Noh M, Shin JH. Tensile stimuli increase nerve growth factor in human dermal fibroblasts independent of tension-induced TGFβ production. Exp Dermatol. 2013;22(1):72-4. Doi:10.1111/exd.12064. [Link]
50 Quaresma JAS, Almeida FAC, Aarao TLS, Soares LPMA, Magno IMN, Fuzii HT, et al. Transforming growth factor β and apoptosis in leprosy skin lesions: possible relationship with the control of the tissue immune response in the Mycobacterium leprae infection. Microbes Infect. 2012 Aug;14(9):696-701. Doi:10.1016/j.micinf.2012.02.010. [Link]
51 Brown TL, Patil S, Cianci CD, Morrow JS, Howe PH. Transforming growth factor β induces caspase 3-independent cleavage of αll-spectrin (α-fodrin) coincident with apoptosis. J Biol Chem. 1999 Aug 13;274(33):23256-62. [Link]
52 Oliveira RB, Sampaio EP, Aarestrup F, Teles RMB, Silva TP, Oliveira AL, et al. Cytokines and Mycobacterium leprae induce apoptosis in human Schwann. J Neuropathol Exp Neurol. 2005 Oct;64(10):882-90. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Juarez Antônio Simões Quaresma
Universidade Federal do Pará
Núcleo de Medicina Tropical,
Laboratório de Imunopatologia
Av. Generalíssimo Deodoro, 92.
Bairro: Umarizal CEP: 66055-240
Belém-Pará-Brasil
Tel.: +55 (91) 3241-4681
E-mail: ¡uarez@ufpa.br / juarez@pesquisador.cnpq.br
Recebido em / Received / Recibido en: 2/5/2013
Aceito em / Accepted / Aceito en: 12/6/2013













