INTRODUÇÃO
Arbovírus são vírus transmitidos por artrópodes (Arthropod-borne virus) e são assim designados não somente pela sua veiculação através de artrópodes, mas, principalmente, pelo fato de parte de seu ciclo replicativo ocorrer nos insetos. São transmitidos aos seres humanos e outros animais pela picada de artrópodes hematófagos. Os arbovírus que causam doenças em humanos e outros animais de sangue quente são membros de cinco famílias virais: Bunyaviridae, Togaviridae, Flaviviridae, Reoviridae e Rhabdoviridae1.
Estima-se que haja mais de 545 espécies de arbovírus, dentre as quais, mais de 150 relacionadas com doenças em seres humanos, sendo a maioria zoonótica. São mantidos em ciclo de transmissão entre artrópodes (vetores) e reservatórios vertebrados como principais hospedeiros amplificadores2),(3.
As arboviroses têm se tornado importantes e constantes ameaças em regiões tropicais devido às rápidas mudanças climáticas, desmatamentos, migração populacional, ocupação desordenada de áreas urbanas, precariedade das condições sanitárias que favorecem a amplificação e transmissão viral1. São transmitidas pelo sangue de pacientes virêmicos, por insetos hematófagos, o que não deixa de ser uma preocupação na doação de sangue em áreas endêmicas2. Casos de transmissão do vírus Oeste do Nilo (WNV) entre seres humanos, por meio de transfusões de sangue e transplante de órgãos, têm sido relatados, entretanto todos os arbovírus que produzem viremia são potencialmente passíveis de desencadearem infecções iatrogênicas4),(5.
O único continente onde os arbovírus não são endêmicos é o Antártico. Estes vírus tendem a ter uma distribuição geográfica e climática restrita, como parte de um subsistema ecológico especial representado pelos vírus, vetores, hospedeiros amplificadores e reservatórios1.
O Brasil é constituído por uma grande extensão terrestre (pouco mais de 8.500.000 km2), situado em uma área predominantemente tropical, com extensas florestas na Região Amazônica, além de florestas no leste, sudeste e litoral sul. Apresenta também uma grande região de pântano (Pantanal) no centro-oeste, uma região de savana (Cerrado), na área do planalto central, e uma região seca (Caatinga) no interior nordestino. A maior parte do País tem um clima tropical, sendo um local adequado para a existência do vetor e, portanto, para a ocorrência de arboviroses6.
As manifestações clínicas das arboviroses em seres humanos podem variar desde doença febril (DF) indiferenciada, moderada ou grave, erupções cutâneas e artralgia (AR), a síndrome neurológica (SN) e síndrome hemorrágica (SH). A DF geralmente se apresenta com sintomas de gripe, como febre, cefaleia, dor retro-orbital e mialgia. A SN pode manifestar-se como mielite, meningite e/ou encefalite, com mudanças de comportamento, paralisia, paresia, convulsões e problemas de coordenação. A AR manifesta-se como exantema ou rash maculopapular, poliartralgia e poliartrite, enquanto que a SH é evidenciada pelas petéquias, hemorragia e choque combinado com uma redução intensa de plaquetas2.
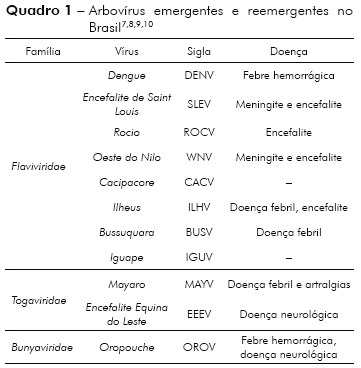
Neste trabalho de revisão são exploradas as características gerais dos vírus, a patogenia e a epidemiologia das arboviroses mais estudadas no Brasil nas últimas décadas (Quadro 1).
FAMÍLIA FLAVIVIRIDAE
A família Fíaviviridae é composta por três gêneros: Flavivirus, Pestivirus e Hepacivirus. No gênero Flavivirus estão incluídas cerca de 39 espécies que são consideradas arbovírus, sendo algumas causadoras de encefalites e outras de febres hemorrágicas em humanos e animais. Destacam-se neste grupo os vírus Dengue, Encefalite de Saint Louis, Rocio, Oeste do Nilo, Cacipacore, Ilheus, Bussuquara e Iguape7.
A partícula dos flavivírus mede de 40 a 60 nm de diâmetro, possui um capsídeo proteico (C) com simetria icosaédrica, envolvido por um envelope lipídico onde estão inseridas as proteínas de membrana (M) e espículas de natureza glicoproteica (E). O genoma dos flavivírus é formado por RNA de fita simples de polaridade positiva, contendo aproximadamente 11 kb. Este genoma possui uma única sequência aberta de leitura (open reading frame - ORF) com 10.233 nucleotídeos que codificam inúmeras proteínas, flanqueada por duas regiões não codificantes (untranslated region - UTR), as quais são importantes para a regulação e expressão do vírus. O genoma codifica para três proteínas estruturais: proteína C do capsídeo, proteína do envelope pré-M, precursora de M e a proteína E. Além destas, o genoma codifica sete proteínas não estruturais (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5) que desempenham funções reguladoras e de expressão do vírus, como a replicação, virulência e patogenicidade11.
O ciclo replicativo destes vírus inicia-se com a ligação com o receptor na superfície celular. Não se conhece ainda qual a estrutura que serve como receptor, porém diversas moléculas presentes na superfície celular têm se mostrado capazes de interagir com partículas de flavivírus. Após a adsorção, a partícula é endocitada em vesículas recobertas por clatrinas. O baixo pH do endossoma induz a fusão do envelope do vírus com membranas celulares, provocando mudanças conformacionais da proteína E, para, então, liberar o nucleocapsídeo no citoplasma. Após a decapsidação, o genoma de RNA é liberado para o citoplasma7.
As proteínas virais são produzidas como parte de uma única poliproteína de mais de 3.000 aminoácidos que é clivada por uma combinação de proteases do hospedeiro e virais. As proteínas estruturais são codificadas na porção N-terminal da poliproteína e as proteínas não estruturais (NS) na parte restante7.
Os flavivírus replicam-se no citoplasma, associados às membranas, por meio de interações que envolvem as pequenas proteínas hidrofóbicas NS, o RNA viral, e, presumivelmente, alguns fatores do hospedeiro. A síntese de uma fita de RNA de polaridade negativa é a primeira etapa da replicação do RNA genômico, que por sua vez servirá de molde para novas fitas de RNA de polaridade positiva. Cópias de RNA viral são detectadas cerca de 3 h após a infecção. A finalização do ciclo replicativo ocorre com a montagem das novas partículas virais, próximo ao retículo endoplasmático, onde o nucleocapsídeo é envelopado. A transição até a membrana plasmática é realizada pelas vesículas que se fundem com a membrana celular e a liberação de novas partículas virais ocorre principalmente por exocitose7),(11.
VÍRUS DENGUE (DENV)
O vírus Dengue (DENV) é representado por quatro sorotipos, a saber, DENV-1 a DENV-4 e sua transmissão é feita pelo mosquito Aedes aegypti. A existência de mais de um sorotipo, DENV-1 e DENV-2, ocorreu por volta de 1940, e o DENV-3 e o DENV-4 foram primeiramente isolados durante epidemias nas Filipinas em 19567),(12.
Este vírus pode afetar pessoas de todas as idades, incluindo recém-nascidos, crianças, adultos e idosos, causando um espectro de doenças que vai desde a febre da dengue até as formas mais graves de dengue hemorrágica e síndrome do choque da dengue. Os sinais e sintomas incluem febre, dor retro-orbital, dor de cabeça intensa, mialgia, artralgia e manifestações hemorrágicas menores, como petéquias, epistaxe e sangramento gengival12),(13.
As primeiras células infectadas após a inoculação viral pela picada do mosquito são, provavelmente, as células dendríticas da pele. Após a replicação inicial e migração para os linfonodos, os vírus aparecem na corrente sanguínea (viremia) durante a fase febril aguda, geralmente por três a cinco dias. A gênese dos sintomas da dengue ainda não é bem esclarecida, porém considera-se que a liberação de citocinas, como resultado da infecção das células dendríticas, macrófagos e a ativação de linfócitos TCD4+ e TCD8+, desempenha um papel importante. Além disso, a liberação de interferon pelos linfócitos T pode estar intimamente relacionada à queda na contagem de plaquetas, pela supressão da atividade da medula óssea, o que gera sintomas como as petéquias espalhadas pelo corpo. Da corrente sanguínea, os vírus são disseminados a órgãos como fígado, baço, nódulos linfáticos, medula óssea, podendo atingir o pulmão, coração e trato gastrointestinal11.
A patogenia dos casos mais graves de dengue (dengue hemorrágica e síndrome do choque da dengue) ainda não é bem conhecida. Existem algumas hipóteses, tais como: reinfecção por um sorotipo diferente; aumento da permeabilidade vascular com extravasamento de plasma e coagulação intravascular, resultante da liberação de mediadores químicos pelos macrófagos/monócitos destruídos pela infecção; surgimentos de cepas mais virulentas após sucessivas passagens em mosquitos e seres humanos. Na reinfecção por um segundo sorotipo, a presença de vírus opsonizados pelos anticorpos pré-formados, porém não neutralizados, formam imunocomplexos que ativam o sistema complemento, levando a liberação dos mediadores químicos7),(11.
A lesão hepática provocada pela replicação viral nos hepatócitos leva a um comprometimento dos fatores de coagulação, que associado à diminuição de plaquetas, pode ocasionar um quadro hemorrágico grave7),(11.
Os vírus são mantidos em ciclos florestais envolvendo pequenos primatas e mosquitos Aedes arborícolas. Os DENV, no entanto, são os únicos arbovírus que se adaptaram aos seres humanos e ao ambiente doméstico, a tal ponto que o ciclo da floresta não é mais necessário para a sua manutenção. Atualmente, o principal ciclo de transmissão do DENV envolve somente os seres humanos e mosquitos nos grandes centros urbanos tropicais. O principal vetor é o A. aegypti, mas A. albopictus e A. polynesiensis são incluídos como vetores secundários. A dengue atinge, predominantemente, regiões tropicais da Ásia, Oceania, Austrália, África e as Américas. Áreas subtropicais e temperadas são suscetíveis à introdução e propagação do vírus na época do verão7.
As primeiras evidências do DENV ocorreram no final do século XVIII, com epidemias quase simultâneas, em 1779, em Jacarta, Indonésia, Cairo e Egito, e em 1780, na Filadélfia e Pensilvânia7. A expansão geográfica global e o aumento da incidência de epidemia de dengue coincidiram exatamente com o crescimento urbano e a globalização. Atualmente, cerca de 3,6 bilhões de pessoas vivem em áreas de risco para esta doença, principalmente a população urbana14. O vírus é endêmico em mais de 110 países, estima-se em 100 milhões de casos da dengue clássica e meio milhão de casos de doença hemorrágica, resultando em 25 mil mortes anualmente15.
Os DENV são os flavivírus mais importantes no Brasil, provavelmente existindo no País desde muitos anos. Há referência de um possível surto da doença causando febre, mialgia e artralgia em 1846, no Estado do Rio de Janeiro. Provavelmente, outros surtos ocorreram no nordeste, sudeste e sul do Brasil no século XIX. Também ocorreram surtos em Curitiba, Estado do Paraná e em localidades do Estado do Rio Grande do Sul, em 1917. Outro grande surto ocorreu no Rio de Janeiro e nas cidades vizinhas, em 1922 e 19236. O DENV foi reintroduzido no Brasil no início da década de 1980 e, desde então, importantes surtos de DENV-1, DENV-2 e DENV-3 têm ocorrido16.
Estudos realizados entre 2010 e 2012 em Manaus, Estado do Amazonas, demonstraram a presença do genoma de DENV-1 e DENV-2, além do genoma do vírus Oropouche (também arbovírus) em liquor de pacientes com suspeita de infecção viral do sistema nervoso central, associando-os à meningoencefalite, meningite e encefalite17.
O DENV-2 é o sorotipo mais relevante no mundo, seguido pelo DENV-3, DENV-1 e DENV-414),(18. Os sorotipos 1 e 3 foram importados no Brasil, respectivamente, em 1986, 1990 e 2000. O DENV-3 foi predominante na maioria dos estados brasileiros de 2002 a 2006, e, de 2007 a 2009, esta posição foi assumida pelo DENV-2. Depois de uma circulação discreta em 2009, o DENV-1 reemergiu na Região Sudeste, sendo detectado em 50,4% dos pacientes, seguido de 30,5% de DENV-2 e 19,1% de DENV-319),(20. O DENV-4 teve uma circulação breve no Brasil em 1982, na região noroeste da Amazônia, em uma epidemia focal, e, em 2010, este sorotipo ressurgiu no Estado de Roraima, sendo, posteriormente, disseminado a diversas regiões do País21. Até o mês de maio de 2014, foram confirmados 483.516 casos da doença, sendo 226 de intensidade grave e 3.026 casos com sinais de alarme, resultando em 119 óbitos, com a prevalência do DENV-1, seguidos pelo DENV-4 e DENV-222.
VÍRUS ENCEFALITE DE SAINT LOUIS (SLEV)
O vírus Encefalite de Saint Loius (SLEV) é amplamente distribuído nas Américas, do Canadá à Argentina. E um vírus neurotrópico, membro do complexo antigênico da encefalite japonesa (JEV), juntamente com o WNV e o vírus Cacipacore (CACV). Os reservatórios deste vírus incluem, principalmente, aves silvestres, primatas, marsupiais e outros animais silvestres. O vírus foi isolado do morcego insetívoro do gênero Tadarida brasiliensis mexicana, no Texas, EUA. A transmissão do SLEV ocorre por mosquitos do gênero Culex. As aves migratórias, em suas distintas rotas, são as responsáveis pela dispersão do vírus pelas Américas, assim como ocorre com outras encefalites. Porém, há diferenças biológicas e genéticas entre os isolados da América do Norte e América do Sul23.
A doença causada pelo SLEV pode variar de sintomas leves, incluindo febre e dor de cabeça, até doença severa, como a meningite e encefalite. Os relatos de casos fatais podem variar de 5% a 20%, entretanto, os números são ainda maiores entre a população idosa24.
Em 1932, em um surto ocorrido em Illinois, EUA, o SLEV foi reconhecido como um vírus causador de encefalite humana. No ano seguinte, ocorreram casos também em Saint Louis e Kansas, em Missouri, EUA. O primeiro isolamento brasileiro do vírus ocorreu em 1960, a partir de mosquitos Sabethes belisarioi capturados na rodovia Belém-Brasília. Ao contrário dos EUA, onde o vírus foi descrito pela primeira vez, no Brasil, não foram notificados surtos e tampouco, encefalite. O vírus foi isolado de dois pacientes que apresentaram uma doença febril com icterícia, sem envolvimento neurológico. Em 2004, o SLEV foi, novamente, isolado no sudeste do Brasil em um paciente com doença febril aguda que apresentou fortes dores de cabeça e, inicialmente, tinha sido diagnosticado como dengue. A análise deste isolado mostrou que era filogeneticamente distinta dos SLEV anteriormente caracterizados no Brasil, e que poderia ser agrupado como uma cepa argentina6),(25. A análise filogenética de 30 cepas brasileiras demonstrou uma grande variabilidade, e apesar do vírus ter sido primeiramente identificado nos EUA, o estudo sugeriu que o SLEV teve origem na América do Sul e posteriormente espalhou-se para a América do Norte26.
Um surto de SLEV ocorreu simultaneamente ao de DENV-3, em São José do Rio Preto, Estado de São Paulo. Durante o surto, alguns pacientes acometidos por SLEV apresentaram manifestações hemorrágicas, como teste do torniquete positivo, petéquias e sangramento. Após o surto, foi desenvolvida uma análise retrospectiva com cerca de 200 amostras clínicas de pacientes com suspeita de dengue ou febre hemorrágica da dengue em fase aguda, tendo sido demonstrado um caso raro de coinfecção DENV-3 e SLEV16.
Apesar dos raros isolamentos de SLEV em humanos no Brasil, anticorpos para esse vírus foram encontrados em aproximadamente 5% das populações das Regiões Norte e Sudeste. Entretanto, devido à possibilidade de reatividade cruzada entre diferentes flavivírus, a interpretação destes resultados deve considerar a vacinação à febre amarela e a exposição ao DENV27.
Não existe vacina contra o SLEV, porém nos EUA, em áreas endêmicas, programas de vigilância realizam a captura de aves para monitorar a presença de anticorpos23.
VÍRUS ROCIO (ROCV)
O vírus Rocio (ROCV) é um vírus neurotrópico, incluído no grupo do vírus Ntaya, que é distinto do grupo JEV. Pode causar desde infecção assintomática até encefalite aguda, atingindo principalmente homens jovens, após um período de incubação de sete a 14 dias. Os sintomas são febre aguda, dor de cabeça, anorexia, náusea, vômito, mialgia e mal-estar. Sinais de encefalite são tardios e incluem confusão mental, distúrbios do reflexo, incapacidade motora, irritação meníngea e síndrome cerebelar. Alguns pacientes apresentaram convulsões. Outros sintomas também observados foram distensão abdominal e retenção urinária. A doença também pode produzir sequelas graves como distúrbios visuais, olfativos e auditivos, falta de coordenação motora, dificuldades de equilíbrio e de deglutição, e distúrbios de memória6.
Este vírus foi primeiramente isolado em 1975, a partir de um caso fatal que ocorreu durante um surto de encefalite em uma área limitada da Mata Atlântica, no Vale do Ribeira, Estado de São Paulo. O surto teve a duração de 1973 a 1980, com relato de cerca de 1.000 casos de encefalite e uma taxa de mortalidade de 10%, e, entre os sobreviventes, 200 sofreram sequelas de equilíbrio ou mobilidade25.
Com base no isolamento do vírus e dados de sorologia, acredita-se que ROCV é mantido em um ciclo, em que as aves selvagens, incluindo algumas espécies migratórias, são os reservatórios e os mosquitos Aedes e Psorophora, os vetores. Ainda não se sabe como este novo flavivírus apareceu em 1973 e desapareceu sete anos depois na mesma região. No entanto, a presença de anticorpos neutralizantes foi detectada em pessoas que vivem em áreas rurais das regiões Sudeste e Nordeste do Brasil25. Segundo investigações sorológicas contínuas, a transmissão esporádica foi relatada em 1989, em crianças IgM-positivas, no foco original do surto (São Paulo). Outro inquérito sorológico realizado em 1995, no Estado da Bahia, também evidenciou a circulação do vírus8. Em 2004, foram detectados anticorpos em pássaros, na Região Sul brasileira. E possível que este vírus circule em regiões distintas do Brasil e o seu ressurgimento na forma de surtos de encefalite grave, representando uma ameaça permanente25.
VÍRUS OESTE DO NILO (WNV)
O vírus Oeste do Nilo (WNV) foi primeiramente isolado na província de West Nile, Uganda, em 1937. Em 1999, um surto em Nova York, nos EUA, causou a morte de um grande número de aves, e em humanos foi relacionado a um grande número de casos de encefalite11.
O neurotropismo deste vírus tem sido mais frequentemente relatado em idosos. É transmitido também por mosquitos e foi associado, nos casos de Nova York, ao mosquito urbano Culex pipiens. O ciclo de transmissão do WNV envolve mosquitos e pássaros e o homem é um hospedeiro acidental. Cerca de 80% das pessoas infectadas são assintomáticas. E dos que apresentam sintomas, apenas 20% desenvolvem a doença febril característica, com um período de incubação de dois a 14 dias, ocasionando febre, dor de cabeça, fadiga, exantema, nódulos linfáticos palpáveis e dor ocular. As manifestações mais graves são meningite e encefalite11.
Com base em uma relação genética estreita, a cepa isolada no Estado americano, em 1999, provavelmente foi trazida do Oriente Médio para as Américas. Na América do Norte, causou grandes epidemias de encefalite e epizootias em cavalos. E notável como o WNV, um vírus do Velho Mundo, tornou-se adaptado a um ciclo americano sem precedentes. Os reservatórios do WNV são aves selvagens e muitas delas são espécies migratórias, de longa distância. Esta é provavelmente a forma como o vírus espalhou-se tão rapidamente em todo o território continental dos EUA, Canadá e México. Seis anos depois, o vírus pode ser encontrado praticamente em toda a América do Norte. Assim, o vírus disseminou-se em direção ao sul das Américas. Foi detectado nas Ilhas Cayman em 2001, na ilha de Guadalupe e no México em 2002, e, em El Salvador e Cuba em 2003 e 2004. Em 2005, o WNV chegou à América do Sul e foi detectado em cavalos na Colômbia, pela constatação de anticorpos neutralizantes, e em 2006 foi isolado de cérebro de cavalos com encefalite na Argentina25.
O surgimento do WNV no Brasil foi relacionado às aves migratórias, do hemisfério norte para o País. No Brasil há também uma variedade de espécies de aves, incluindo algumas que foram anteriormente consideradas como reservatórios do WNV, como Passer domesticus, abundante em áreas urbanas, além da presença endêmica do Culex. Apesar destas circunstâncias, um levantamento sorológico realizado em 2004 com pássaros silvestres de diferentes regiões do Brasil não demonstrou exposição destas aves ao WNV25. Entretanto, em 2010, foi documentada a soropositividade em cavalos e aves na Região do Pantanal, Estado do Mato Grosso e Estado do Mato Grosso do Sul28),(29. Posteriormente, outro estudo realizado na mesma região detectou a presença de anticorpos neutralizantes não somente contra o WNV, mas também, a outros flavivírus (ILHV, SLEV, CACV e ROCV), em equinos, ovinos e jacarés, evidenciando ampla circulação destes vírus na região30. Contudo, no Brasil31, ainda não houve associação do WNV à doença em humanos, apesar da abundância de potenciais vetores e hospedeiros vertebrados, nesta vasta reserva ecológica, o Pantanal. Sugere-se que o WNV já esteja estabelecido no Brasil, tornando, portanto, de grande interesse para a saúde pública, a avaliação da presença do vírus no País, bem como o conhecimento da transmissão, a epidemiologia da doença, assim como, a identificação de vetores e reservatórios vertebrados29.
Diante do risco iminente de emergência do WNV no Brasil, é extremamente importante o desenvolvimento de ferramentas de diagnóstico laboratorial para a vigilância de eventuais surtos. Uma proteína do envelope do WNV (domínio III - rDIII) foi preconizada como potencial candidata a ser utilizada em testes imunoenzimáticos para detecção do vírus32.
VÍRUS CACIPACORE (CACV), ILHEUS (ILHV), BUSSUQUARA (BUSV) E IGUAPE (IGUV)
O vírus Cacipacore (CACV) foi primeiramente isolado de aves (Formicarius analis) em 1977, em uma área amazônica no Estado do Pará5),(25. Recentemente, foi demonstrada a presença de anticorpos contra arbovírus, em macacos de vida livre, capturados no Estado do Mato Grosso do Sul, sendo que dois animais exibiram anticorpos contra o gênero Flavivirus e um apresentou reação monotípica contra o CACV33. Porém, até o momento, não foi associado à doença em humanos e ainda não foi identificado nenhum vetor responsável por sua transmissão25.
O vírus Ilheus (ILHV) foi isolado pela primeira vez em 1944, a partir de um pool de mosquitos Aedes e Psorophora, durante uma investigação epidemiológica de febre amarela, na Cidade de Ilhéus, Estado da Bahia. O vírus tem sido frequentemente isolado de mosquitos Aedes ou Psorophora, do que de Culex, entretanto, os gêneros Coquillettidia, Haemagogus, Sabethes, Trichoprosopon e Wyeomyia, também podem estar envolvidos na transmissão natural do vírus. As aves são os principais hospedeiros vertebrados. A infecção em humanos pelo ILHV provoca fortes dores de cabeça, calafrios, mialgia, fraqueza com ou sem síndrome encefalítica suave7. Recentemente, o ILHV foi detectado em um pool de mosquitos Aedes coletados na Região do Pantanal34, além de ter sido demonstrado anticorpos contra o vírus em equinos, ovinos e jacarés30.
O vírus Iguape (IGUV) foi primeiramente isolado no Brasil, em 1979, na floresta tropical do sudeste brasileiro. Porém, não há relatos de doença humana pelo vírus6),(7.
O vírus Bussuquara (BUSV), originalmente isolado no Brasil, é amplamente distribuído na América Central, no Caribe e na América do Sul até o sul da Argentina. Juntamente com o IGUV, o BUSV está incluído no grupo do vírus Aroa. O vírus é transmitido principalmente por mosquitos Culex para roedores, embora tenha sido isolado de macacos. Inquéritos sorológicos sugerem ser uma infecção de ocorrência rara, com um caso de infecção febril humano relatado7.
Em estudo recente, foi demonstrado a presença de anticorpos contra seis flavivírus, SLEV, ILHV, ROCV e BUSV, em búfalos no Estado do Pará, Brasil, evidenciando a circulação de tais vírus na região35.
FAMÍLIA TOGAVIRIDAE
Os togavírus são vírus de RNA de cadeia simples envelopados, de aparência esférica. Apesar de terem sido originalmente classificados junto aos vários grupos de vírus, predominantemente, transmitidos por insetos, análises mais recentes redefiniram como uma família distinta, com dois gêneros: Alphavirus e Rubivirus. O primeiro é o maior, incluindo cerca de 40 membros, enquanto o gênero Rubivirus é composto de um único membro, o vírus da rubéola9.
Os alfavírus possuem cerca de 70 nm de diâmetro, com um capsídeo icosaédrico e um genoma consistindo de RNA fita simples linear de polaridade positiva, de aproximadamente 11 kb, que codifica oito genes, estruturais e não estruturais9.
Os representantes do gênero Alphavirus são agentes causadores de uma ampla gama de doenças em seres humanos e animais, com distribuição cosmopolita. As infecções humanas evoluem com sintomas clínicos não específicos, que são semelhantes àquelas causadas por outros arbovírus. Assim, um diagnóstico precoce e específico da infecção pelos alfavírus é importante para a determinação da conduta médica e adoção de medidas preventivas eficientes36),(37. São destacados o vírus Mayaro (MAYV) e o vírus Encefalite Equina do Leste(EEEV).
VÍRUS MAYARO (MAYV)
O vírus Mayaro (MAYV) foi isolado pela primeira vez em 1954 de trabalhadores florestais febris em Trinidad e, posteriormente, de vários indivíduos com febre e dor de cabeça frontal, na área do Rio Guamá, Estado do Pará, Brasil. Posteriormente, foi relatada a presença do vírus no norte da América do Sul e na bacia do rio Amazonas9. O MAYV tem sido responsável por surtos de doença febril aguda e síndrome de artralgia na Região Amazônica e no Planalto Central do Brasil, bem como em outros países da América do Sul (Peru, Bolívia e Venezuela)25. Em 1999, foram identificados pela primeira vez no Estado do Amazonas casos de doença febril causada pelo vírus38. E entre os anos de 2007 a 2008, foram identificados 33 casos semelhantes na Cidade de Manaus39. Recentemente, foi demonstrada a presença de anticorpos neutralizantes contra o MAYV e contra o vírus Oropouche (OROV) em soro de primata de vida livre, capturados no Estado do Mato Grosso do Sul, sugerindo a circulação destes vírus na região33.
Casos humanos são esporádicos e ocorrem principalmente em pessoas egressas de florestas tropicais úmidas. Os principais vetores são os mosquitos do gênero Haemagogus, que habitam florestas, e os hospedeiros vertebrados são mamíferos. Também existem algumas evidências da infecção de aves no sul do Brasil. O curso de três a cinco dias de doença é caracterizado por febre, cefaleia, mialgia, erupção cutânea, dor principalmente nas grandes articulações e, menos frequentemente, a artrite. A convalescença de febre pelo MAYV normalmente leva duas semanas. Apesar de o MAYV ser transmitido por mosquitos Aedes, este vírus também pode ser disseminado para as cidades pelas aves infectadas ou humanos (recentemente, três casos de pescadores infectados pelo vírus foram demonstrados no Estado de São Paulo) e adaptar-se a um novo ciclo, que pode envolver o homem como reservatório. A transmissão pelas vias aéreas, como meio de disseminação viral, pode ter sido a fonte de uma infecção acidental, em laboratório. Portanto, pode ser potencialmente uma via de transmissão natural, facilitando assim a disseminação do vírus ocasionando surtos9),(25.
A doença febril por MAYV ocorre durante todo o ano, com maior frequência no período chuvoso, como ocorre com a dengue. A doença afeta pessoas de ambos os sexos de todas as idades, que são, provavelmente, picadas pelos mosquitos Hemagogus silvestres. A estimativa de transmissão do vírus em Manaus, Estado do Amazonas, em cerca de 2 milhões de pessoas, tem se tornado um problema de saúde pública relevante, pois não há vacina e o controle de vetores não é viável. Além disso, considerando relatos de transmissão do vírus por Aedes e a ocorrência de A. aegypti naquela cidade, poderia originar ciclos urbanos da doença, envolvendo o homem como reservatório39.
VÍRUS ENCEFALITE EQUINA DO LESTE (EEEV)
A encefalite equina do leste (EEE) é uma doença zoonótica causada por um vírus de mesmo nome. Foi reconhecida pela primeira vez como uma doença de cavalos, no nordeste dos EUA. No verão de 1831, mais de 75 cavalos morreram em três municípios de Massachusetts. Entre 1845 e 1912, foram registradas epizootias em Long Island, na Carolina do Norte, Nova Jersey, Flórida, Maryland e Virgínia. O vírus responsável pela encefalite foi isolado pela primeira vez em 1933, de cérebros de equinos em Nova Jersey e Virgínia, durante um surto que envolveu também as áreas costeiras de Delaware e Maryland. Apesar da suspeita de casos em humanos, estes não foram demonstrados até 1938, quando um surto no nordeste dos EUA resultou em 30 casos de encefalite fatal em crianças, que viviam nas mesmas áreas dos equinos. Nestes casos, o vírus Encefalite Equina do Leste (EEEV) foi isolado a partir do sistema nervoso central dos seres humanos, bem como de aves9.
O ciclo de transmissão do EEEV primário ocorre entre aves e mosquitos (Culiseta melanura). No entanto, os principais vetores artrópodes para a transmissão de EEEV para os seres humanos ou para os cavalos são os gêneros Aedes, Coquillettidia e Culex os quais, ao contrário do Culiseta melanura, tendem a se alimentar tanto em aves quanto em mamíferos40. A variação sazonal da EEE, bem como de outras arboviroses, está associada a uma determinada faixa de temperatura, a quantidade de chuvas, e outros fatores ambientais que determinam a presença de vetores41.
Em média, seis casos humanos são relatados pelo Centro de Controle e Prevenção de Doenças (CDC) anualmente nos EUA, embora tenham sido relatados 28, em 2006, e 220 confirmados, entre 1964 e 2004. O EEEV é o togavírus mais invasivo e neurovirulento, com altas taxas de encefalite, mortalidade e morbidade, tanto para os seres humanos quanto para os cavalos. A invasão do EEEV no sistema nervoso é estimada em um em cada 23 indivíduos que desenvolvem viremia1),(40.
A mortalidade está em torno de 75% para crianças e 50% para aqueles com mais de 60 anos de idade. A maioria dos sobreviventes manifesta lesão neurológica significativa com deficiência intelectual, alterações de personalidade e paralisia espástica. Anormalidades neurológicas permanentes após EEE são encontradas em 70% a 90% dos sobreviventes lactentes. O risco global de epilepsia é de 14% a 37%. No entanto, alguns pacientes atingem completa recuperação. Já foi relatada a transmissão do EEEV na forma de aerossol, sendo considerado como um dos seis agentes infecciosos que constituem a lista de mais alto nível de ameaça para utilização como agente de bioterrorismo1.
Entre os anos de 2008 e 2009, foi observado um surto de EEEV nos estados brasileiros de Pernambuco, Ceará e Paraíba. A doença ocorreu em 93 fazendas e afetou 229 equinos, com uma taxa de letalidade de 72,92%. Os principais sinais clínicos foram depressão ou hiperexcitabilidade, ataxia e paralisia progressiva, com um período de manifestação clínica de três a 15 dias. Na América do Sul, houve apenas dois casos de EEE fatal relatados em seres humanos, uma no Brasil e outra em Trinidad, enquanto na América do Norte, foram relatados mais de 100 casos fatais. Esta diferença pode ser atribuída às características patogênicas distintas dos agentes e os hábitos dos vetores envolvidos. Sugere-se que as variantes dos EUA são mais virulentas para os seres humanos e cavalos do que as cepas da América do Sul41.
Não há tratamento específico para a EEE. O tratamento de suporte deve incluir o diagnóstico e tratamento do aumento da pressão intracraniana. Uma vacina administrada em cavalos é produzida com o vírus inativado com formalina, e está disponível em combinação com o vírus Encefalite Equina do Oeste (WEEV). Devido à fraca imunogenicidade da vacina inativada, duas vacinações por ano são necessárias para manter a proteção. O desenvolvimento de anticorpos neutralizantes correlaciona-se com a proteção e pode ser utilizado para monitorar o sucesso da imunização1),(40.
FAMÍLIA BUNYAVIRIDAE
A família Bunyaviridae foi oficialmente estabelecida em 1975, e, atualmente é constituída por quatro gêneros de vírus que infectam animais (Orthobunyavirus, Phlebovirus, Nairovirus e Hantavirus) e um gênero de vírus que infectam plantas (Tospovirus). A maioria dos vírus desta família é transmitida por artrópodes, principalmente mosquitos e carrapatos, com exceção dos hantavírus que são transmitidos em aerossóis de excrementos de roedores10.
VÍRUS OROPOUCHE (OROV)
O vírus Oropouche, membro do gênero Orthobunyavirus, é transmitido entre preguiças, marsupiais, primatas e aves pelo mosquito Aedes serratus e Culex quinquefasciatus. Notavelmente, esse vírus adaptou-se a um ciclo urbano, envolvendo o homem, com mosquitos Culicoides paraenses, como o principal vetor. São descritos três sorotipos, designados como I, II e III. Estudos filogenéticos indicam que os diferentes sorotipos do OROV estão presentes em diferentes áreas geográficas. O sorotipo I inclui a cepa protótipo de Trinidad e a maioria das cepas brasileiras. O sorotipo II contém seis cepas isoladas no Peru entre 1992 e 1998, e duas cepas isoladas no oeste do Brasil, em 1991. E o sorotipo III inclui o vírus isolado no Panamá em 1989. O OROV provocou grandes surtos de doença febril aguda em cidades e aldeias da Região Amazônica e Central do Brasil. Estima-se que 500 mil casos de infecção pelo OROV têm ocorrido no Brasil nos últimos 48 anos. Além de surtos, o OROV também pode causar infecções humanas esporádicas10),(42),(43.
Desde o isolamento original do OROV de um paciente febril em Trinidad, na década de 1950, a importância médica do vírus, particularmente nas regiões da bacia amazônica do norte do Brasil e Peru, tornou-se cada vez mais evidente10.
Sabe-se que os sítios epidêmicos do OROV são restritos às áreas tropicais da América Central e do Sul, especialmente na bacia amazônica. De 1961 a 1980, o vírus foi relatado no norte do Estado do Pará e as epidemias mais importantes ocorreram em Belém, sendo que em outras regiões do Estado, centenas de milhares de pessoas foram afetadas. De 1980 a 2004, o vírus espalhou-se para outros cinco Estados do norte brasileiro (Amazonas, Amapá, Acre, Rondônia e Tocantins) e em um Estado da Região Nordeste (Maranhão), indicando, em um curto período de tempo, um perigoso potencial de epidemia. Em 2000, uma cepa foi isolada a partir de um novo hospedeiro, o macaco (Callithrix sp.) na região de Arinos, Estado de Minas Gerais, sudeste do Brasil42.
Em um estudo feito em 2004, no Estado do Acre, foram diagnosticados seis casos de OROV de 357 amostras analisadas. Uma vez que nenhuma destas pessoas tinha sido exposta a surtos de OROV ocorridos no Estado ou em outro local, os resultados sugerem a circulação esporádica do vírus nesta área44.
Em 2006, aproximadamente 110 casos do OROV foram relatados em sete municípios na região Bragantina no Pará45. Entre 2008 e 2009, foram identificados mais de 100 casos em Manaus, Estado do Amazonas, sendo que, provavelmente, estes representam apenas uma pequena parte dos casos. Nestes, a doença febril manifestou-se com fenômenos hemorrágicos, como petéquias, epistaxe e sangramento gengival, porém não foi observado envolvimento do sistema nervoso central43. Em outro estudo realizado em Manaus, foram identificadas três amostras positivas em 110 amostras de líquido cefalorraquidiano analisadas, sendo imputado ao vírus a causa da doença do sistema nervoso central46.
O OROV é o segundo arbovírus mais frequente dos causadores de doença febril no Brasil. Apesar disso, pouco se sabe sobre a patogênese da infecção. Infecções experimentais foram estabelecidas em hamster dourado demonstrando que, aproximadamente a metade dos animais estudados desenvolveu doença caracterizada por letargia, calafrios, tremores, paralisia, e cerca de um terço foram a óbito, com presença de altos títulos virais no sangue, fígado e cérebro47.
Apesar do conhecimento da significante ocorrência de diversos arbovírus na Região Amazônica, muitos casos, presumivelmente arboviroses, permanecem sem diagnóstico, provavelmente por causa de suas manifestações clínicas, geralmente leves e autolimitadas. Os pacientes geralmente se recuperam completamente
após poucos dias. No entanto, casos mais graves podem permanecer sem diagnóstico, especialmente por causa de longas distâncias para instalações de serviços de cuidados à saúde, as dificuldades de transporte da amostra e a falta de laboratórios capazes de conduzir os ensaios de diagnóstico. No que diz respeito às infecções por OROV, o diagnóstico pode ser facilmente confundido com outras doenças febris agudas, incluindo a malária e a dengue, sendo que ambas são endêmicas na região43.
CONCLUSÃO
As arboviroses são de grande relevância na saúde pública, devido a uma série de fatores, que vão desde a diversidade de agentes infecciosos envolvidos e a pluralidade de manifestações clinicas, até a inexistência de apoio laboratorial eficiente, a inexistência de medidas imunoprofiláticas para a maioria das infecções correntes e a dificuldade na implementação e manutenção de medidas educativas e sanitárias. Na mesma proporção de importância estão os fatores impactantes socioeconômicos, pelo enorme ônus na manutenção da cadeia produtiva, pela debilitação dos pacientes e o elevado grau de absenteísmo às atividades essenciais, ocasionando um grande prejuízo às regiões afetadas. Aliado a estas dificuldades e inerentes às infecções virais, está a falta de terapia especifica, relegando o tratamento das arboviroses ao controle sintomático das manifestações clinicas.
Além disso, a extrema complexidade da interação entre o hospedeiro, reservatórios e vetores, na maioria dos casos pouco conhecida, por si só já é um grande desafio. Portanto, estes são motivos suficientes para que novas abordagens de diagnóstico, controle e prevenção destas infecções sejam postas em práticas.
Campanhas de educação sanitária precisam ser constantes e a vigilância deve ser reforçada como parte de programas eficazes de controle das doenças em humanos e animais domésticos, além da essencial minimização da participação de vetores. A infecção pelo DENV, por exemplo, endêmica em várias regiões do país, é subestimada em vários aspectos. Dentre os motivos da negligência à infecção estão a dificuldade no diagnóstico diferencial e o atraso na confirmação da doença, com o agravante do tratamento sintomático que mascara a evolução do quadro clínico.
É necessário o melhor entendimento da biologia dos arbovírus, suas interações e consequências no ecossistema. Estas reflexões envolvem ações no desenvolvimento de métodos de diagnóstico laboratorial rápidos e efetivos, treinamento de recursos humanos em todos os níveis de comprometimento, meios efetivos de educação sanitária e melhoria das condições gerais das populações de risco. Entretanto, para que estas ações sejam implementadas são essenciais investimentos e apoio incondicional às iniciativas que podem levar a minimização dos efeitos das arboviroses.












 Curriculum ScienTI
Curriculum ScienTI