INTRODUÇÃO
A infeção pelo vírus da hepatite C (VHC) constitui, a nível mundial, um grave problema de saúde pública. Globalmente, a Organização Mundial da Saúde (OMS) estima que 71 milhões de pessoas vivam com a forma crônica da infecção pelo VHC (prevalência global de 1%), e que surjam 1,75 milhões de novos casos anualmente1.
No Brasil, 359.673 casos foram notificados entre 1999 e 2018. Na análise da distribuição dos casos por regiões, 63,1% ocorreram no Sudeste, 25,2% no Sul, 6,1% no Nordeste, 3,2% no Centro-Oeste e 2,5% no Norte. O estado do Pará ficou em terceiro lugar entre os estados da Região Norte, com 2.659 casos confirmados no período citado2.
A taxa de cronificação da doença, considerada como a permanência da infecção por um período igual ou superior a seis meses, é alta, em torno de 50-80%. A forma crônica pode ocasionar graves problemas hepáticos, como a evolução para estágios avançados de fibrose e cirrose, em aproximadamente 20% dos casos, e câncer hepático, complicações que aumentam a possibilidade de óbito3. Por esse motivo, o tratamento deve ser recomendado para todo paciente diagnosticado.
O tratamento da hepatite C passou por diversos estágios até alcançar os moldes atuais. Anteriormente, preconizava-se o uso do interferon-α, da ribavirina e do interferon peguilado em diversos esquemas, a depender do genótipo do vírus4. Tais esquemas terapêuticos tinham longa duração, ocasionavam diversos eventos adversos de difícil tolerância, como fadiga, depressão e exacerbação de doenças autoimunes, e apresentavam baixa eficácia, com taxas de resposta virológica sustentada (RVS) em torno de 50%5. A partir de 2011, ensaios clínicos demonstraram que a associação com agentes antivirais de ação direta eram uma estratégia eficaz para o tratamento, aumentando ligeiramente a taxa de RVS. Dessa forma, o boceprevir e o telaprevir foram opções incorporadas ao tratamento da hepatite C, em associação com a ribavirina e o interferon peguilado, formando um esquema tríplice que, no entanto, continuava apresentando efeitos indesejáveis6. A partir de 2014, uma segunda geração de antivirais de ação direta passou a ser utilizada, tendo como representantes o sofosbuvir, o daclatasvir e o simeprevir, o que representou um marco importante no tratamento da hepatite C, pois esses novos fármacos apresentavam taxas de RVS em torno de 90% e possibilitavam uma terapia sem a necessidade de utilização do interferon, dessa forma, reduzindo drasticamente os eventos adversos antes encontrados, simplificando o tratamento e encurtando sua duração5,7.
No Brasil, desde 2015, o Ministério da Saúde, por meio do Protocolo Clínico e Diretrizes Terapêuticas (PCDT) para Hepatite C e Coinfecções, preconiza o uso dos novos agentes antivirais de ação direta. Os fármacos incorporados foram o sofosbuvir, o simeprevir e o daclatasvir8. Posteriormente, novos PCDT incluíram novos fármacos ao arsenal terapêutico e removeram outros. Atualmente, os fármacos propostos pelo PCDT 20199 são: daclatasvir, sofosbuvir, ledipasvir, elbasvir, glecaprevir e velpatasvir.
A eficácia dos novos fármacos foi comprovada por ensaios clínicos realizados em populações e locais variados em todo o mundo. No entanto, mesmo com experiências de sucesso em diversas localidades, há uma grande necessidade de estudos brasileiros, e particularmente regionais, após a implementação do novo tratamento para a hepatite C pelo Sistema Único de Saúde (SUS), com o objetivo de pesquisar o impacto e benefício também na população brasileira e, especificamente, amazônica. Dessa forma, o presente estudo buscou avaliar o impacto do tratamento para a hepatite C, proposto pelo PCDT para hepatite C e coinfecções 201710, quanto à taxa de RVS de pacientes com hepatite C crônica, atendidos no Ambulatório de Hepatologia da Fundação Santa Casa de Misericórdia do Pará (FSCMPA), referência do tratamento no estado.
MATERIAIS E MÉTODOS
Neste estudo transversal, foram coletados dados a partir de 305 prontuários de pacientes com hepatite C crônica, atendidos no Ambulatório de Hepatologia da FSCMPA, em Belém, entre maio de 2017 e março de 2019. A coleta dos dados observou os preceitos da resolução 466/2012 do Conselho Nacional de Saúde e foi autorizada pelo Comitê de Ética e Pesquisa da FSCMPA, sob o parecer nº 2.085.121, em 26 de maio de 2017.
Foram incluídos, na amostra, pacientes maiores de 18 anos de idade que tiveram tratamento completo, entre maio de 2017 e março de 2019, com os agentes sofosbuvir, daclatasvir ou simeprevir, associados ou não a ribavirina, com qualquer genótipo viral, estágio de fibrose ou experiência pregressa com esquemas alternativos. Pacientes com ausência de dados relativos ao seguimento foram excluídos da pesquisa. O regime de tratamento proposto era de responsabilidade do médico assistente vinculado à FSCMPA, de acordo com as drogas disponíveis pelo SUS, segundo o PCDT 2017, não havendo participação dos pesquisadores nessa decisão. Foram avaliados dados demográficos e clínicos, como sexo, idade, procedência por município, grau de fibrose, experiência de tratamento anterior, genótipo e carga viral, esquema de tratamento proposto, presença de eventos adversos e a efetividade do esquema de acordo com a RVS, por meio de protocolo de pesquisa próprio. Em concordância com o PCDT 2017, a RVS foi considerada como ausência de VHC-RNA em exame de reação em cadeia da polimerase (PCR) na 12ª ou 24ª semana após o término do tratamento medicamentoso. Os exames moleculares PCR via transcriptase reversa (RT-PCR) (VHC-RNA) em tempo real (Abbott®) e genotipagem do VHC por técnicas de sequenciamento ou INNO-LiPA® foram realizados no Laboratório Central do Pará. O grau de fibrose foi mensurado por meio de biópsia hepática, registrada em prontuário, ou de métodos não invasivos como o escore AST to Platelet Ratio Index (APRI), o escore Fibrosis-4 (FIB-4) e o exame de elastografia hepática FibroScan®, correlacionados com o escore histológico METAVIR.
As informações obtidas foram organizadas e submetidas à análise estatística por protocolo pelo teste do qui-quadrado com correção de Yates. Os softwares Microsoft Office Excel 2010 e BioEstat v5.3 foram utilizados para a análise dos dados.
RESULTADOS
Dentre os 305 prontuários, 55 foram excluídos devido à ausência de informações relativas ao seguimento, resultando em uma amostra final de 250 pacientes.
Informações clínicas e demográficas da população estudada, de acordo com o esquema de tratamento proposto, são mostradas na tabela 1. Dentre os 250 pacientes analisados, 126 (50,40%) eram do sexo masculino. A média de idade encontrada foi de 61,21 anos; 155 (62%) tinham idade igual ou superior a 60 anos, 92 (36,80%) possuíam entre 40 e 59 anos e três (1,20%) tinham menos de 40 anos. A maioria, 173 (69,20%), era residente em Belém. Quanto aos dados clínicos, 93 (37,20%) tinham carga viral anterior ao tratamento maior que 800.000 UI/mL; 175 (70,00%) receberam tratamento com sofosbuvir e daclatasvir, 69 (27,60%) com sofosbuvir e simeprevir e seis (2,40%) com outros esquemas. O genótipo 1 foi o mais frequente (73,60%), seguido do genótipo 3 (23,20%) e do genótipo 2 (3,20%). Do total de pacientes analisados, 102 (40,80%) tiveram alguma experiência anterior de tratamento e 135 (54,00%) eram portadores de cirrose hepática. A ribavirina foi adicionada em 121 (48,40%) casos; e 212 (84,80%) pacientes tiveram duração do tratamento de 12 semanas. A taxa de RVS geral encontrada foi de 97,20%, havendo falha terapêutica em apenas sete (2,80%) casos. Eventos adversos foram relatados por 54 (21,60%) indivíduos.
Tabela 1 - Características clínicas e demográficas, por esquema de tratamento, de pacientes com hepatite C crônica tratados com agentes antivirais de ação direta na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019
| Variáveis | SOF+DAC±RBV | SOF+SMV±RBV | Outros | Total | p-valor* | ||||
|---|---|---|---|---|---|---|---|---|---|
| Média | Mín.-máx. | Média | Mín.-máx. | Média | Mín.-máx. | Média | Mín.-máx. | ||
| Idade | 61,55 | 38-81 | 60,21 | 30-76 | 62,66 | 48-73 | 61,21 | 30-81 | 0,559000 |
| N = 175 | % | N = 69 | % | N = 6 | % | N = 250 | % | ||
| Sexo | |||||||||
| Masculino | 91 | 52,00 | 35 | 50,72 | 3 | 50,00 | 126 | 50,40 | 0,857519 |
| Feminino | 84 | 48,00 | 34 | 49,28 | 3 | 50,00 | 124 | 49,60 | |
| Genótipo | |||||||||
| 1 total | 116 | 66,29 | 68 | 98,55 | - | - | 184 | 73,60 | < 0,00001 |
| 1 não especificado | 30 | 25,86 | 12 | 17,65 | - | - | 42 | 22,83 | 0,963072 |
| 1a | 27 | 23,28 | 17 | 25,00 | - | - | 44 | 23,91 | 0,091977 |
| 1b | 59 | 50,86 | 39 | 57,35 | - | - | 98 | 53,26 | 0,001065 |
| 2 | 3 | 1,71 | - | - | 5 | 83,33 | 8 | 3,20 | NA |
| 3 | 56 | 32,00 | 1 | 1,45 | 1 | 16,67 | 58 | 23,20 | 0,000001 |
| Carga viral (UI/mL) | |||||||||
| < 800.000 | 105 | 60,00 | 49 | 71,01 | 3 | 50,00 | 157 | 62,80 | 0,108294 |
| ≥ 800.000 | 70 | 40,00 | 20 | 28,99 | 3 | 50,00 | 93 | 37,20 | |
| Tratamento anterior | |||||||||
| Sim | 74 | 42,29 | 27 | 39,13 | 1 | 16,67 | 102 | 40,80 | 0,652236 |
| Não | 101 | 57,71 | 42 | 60,87 | 5 | 83,33 | 148 | 59,20 | |
| Fibrose | |||||||||
| F0-F3 | 73 | 41,71 | 39 | 56,52 | 3 | 50,00 | 115 | 46,00 | 0,036585 |
| F4 | 102 | 58,29 | 30 | 43,48 | 3 | 50,00 | 135 | 54,00 | |
| Duração do tratamento | |||||||||
| 12 semanas | 137 | 78,29 | 69 | 100,00 | 6 | 100,00 | 212 | 84,80 | NA |
| 24 semanas | 38 | 21,71 | - | - | - | - | 38 | 15,20 | |
| Adição de RBV | |||||||||
| Sim | 98 | 56,00 | 17 | 24,64 | 6 | 100,00 | 121 | 48,40 | 0,000010 |
| Não | 77 | 44,00 | 52 | 75,36 | - | - | 129 | 51,60 | |
| RVS | |||||||||
| Sim | 169 | 96,57 | 68 | 98,55 | 6 | 100,00 | 243 | 97,20 | 0,683030 |
| Não | 6 | 3,43 | 1 | 1,45 | - | - | 7 | 2,80 | |
| Eventos adversos | |||||||||
| Sim | 38 | 21,71 | 15 | 21,74 | 1 | 16,67 | 54 | 21,60 | 0,996618 |
| Não | 137 | 78,29 | 54 | 78,26 | 5 | 83,33 | 196 | 78,40 | |
| Cidade | |||||||||
| Belém | 173 | 69,20 | |||||||
| Outros | 77 | 30,80 | |||||||
SOF: sofosbuvir; DAC: daclatasvir; RBV: ribavirina; SMV: simeprevir; NA: não se aplica; RVS: resposta virológica sustentada. *Comparação entre SOF + DAC ± RBV e SOF + SMV ± RBV. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Os pacientes que receberam tratamento com sofosbuvir e daclatasvir, em sua maioria, apresentavam infecção pelo genótipo 1 (66,29%) e pelo genótipo 3 (32,00%); 102 (58,29%) eram portadores de cirrose hepática; e 74 (42,29%) experimentaram outros tratamentos anteriormente. Informações sobre a taxa de RVS total e categorizada por algumas características clínicas desse grupo de pacientes podem ser encontradas na (Figura 1). A taxa de RVS total encontrada nesse subgrupo foi de 96,57%. Esse esquema demonstrou uma ligeira superioridade na taxa de RVS para pacientes com genótipo 1 (98,27%), em comparação aos pacientes com genótipo 3 (92,85%); porém, tal diferença não demonstrou relevância estatística (p > 0,05). Todos os pacientes com o genótipo 2 apresentaram RVS. A frequência de efeitos adversos foi de 21,71%, sendo os principais mostrados na (Figura 2).
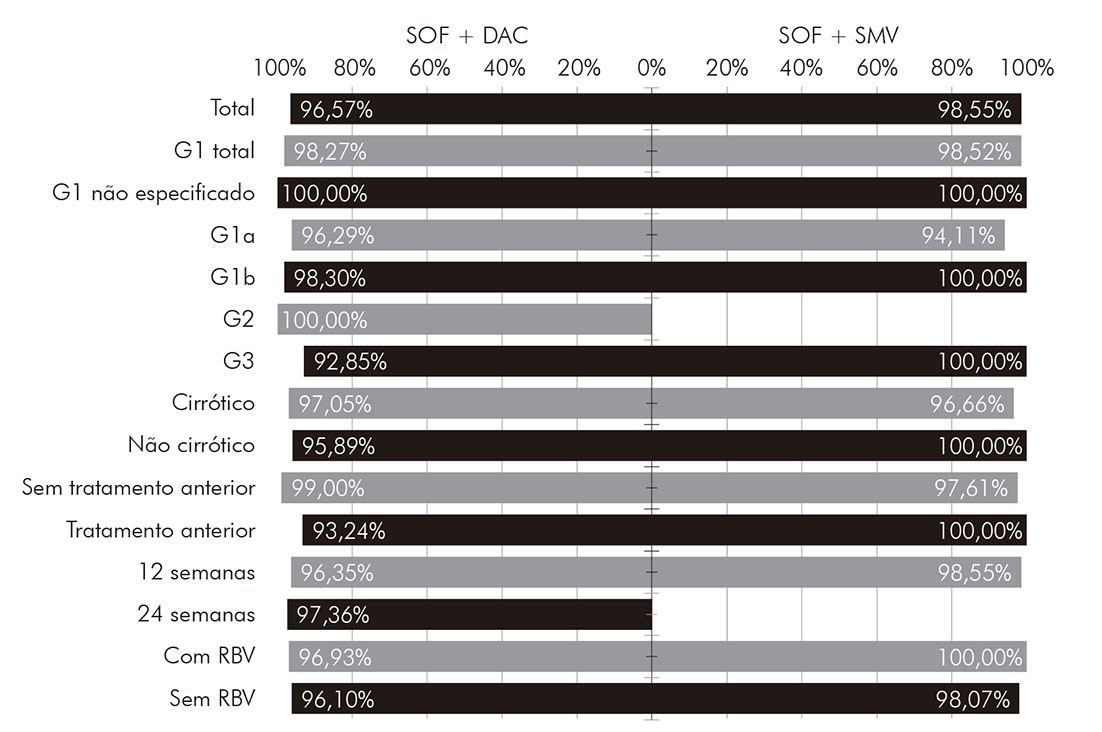
* Total e de acordo com as características clínicas dos pacientes. SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; G1: genótipo 1; G2: genótipo 2; G3: genótipo 3; RBV: ribavirina.
Figura 1 - Taxas de RVS, por esquema de tratamento, de pacientes com hepatite C crônica tratados com agentes antivirais de ação direta na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019*
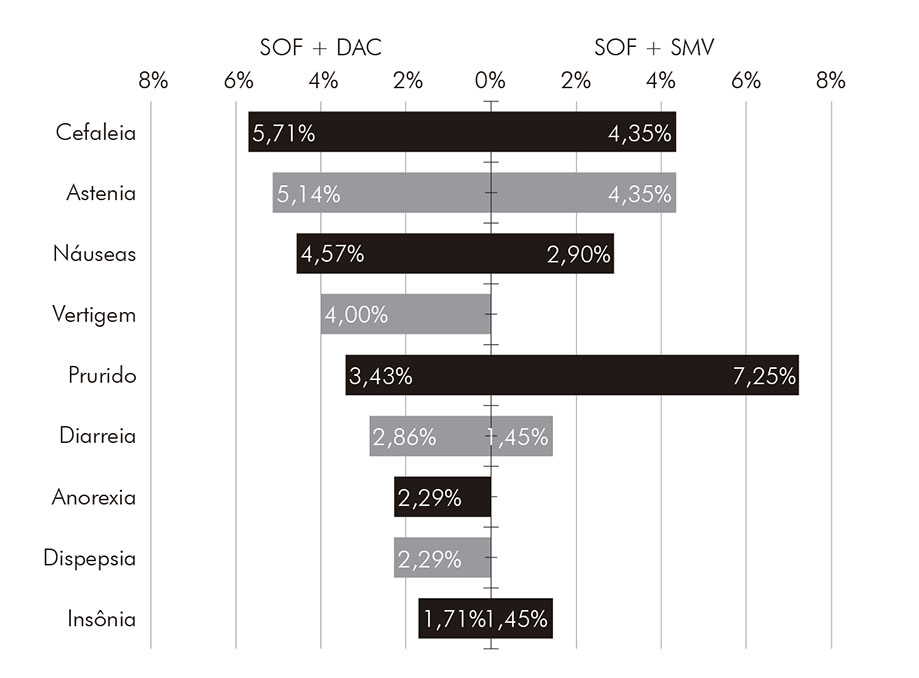
SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir.
Figura 2 - Frequência de eventos adversos, por esquema de tratamento, de pacientes com hepatite C crônica tratados com agentes antivirais de ação direta na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019
Os pacientes que receberam tratamento com sofosbuvir e simeprevir estavam infectados em quase sua totalidade pelo genótipo 1 (98,55%), havendo apenas um paciente infectado pelo genótipo 3 e nenhum com o genótipo 2; 30 (43,48%) eram portadores de cirrose hepática; e 27 (39,13%) experimentaram algum tratamento anteriormente. Informações sobre a taxa de RVS total e categorizada por características clínicas desse grupo de pacientes podem ser encontradas na (Figura 1). A taxa de RVS total encontrada nesse subgrupo foi de 98,55%, ligeiramente maior que a taxa para os que receberam sofosbuvir e daclatasvir; no entanto, sem significância estatística (p > 0,05). A frequência de efeitos adversos nesse esquema foi de 21,74%, muito semelhante à encontrada no grupo que recebeu sofosbuvir e daclatasvir. Os mais frequentes foram cefaleia, astenia e prurido, como mostra a (Figura 2).
Um total de seis pacientes recebeu esquemas alternativos, sendo cinco deles com sofosbuvir e ribavirina, todos infectados pelo genótipo 2, e um com sofosbuvir, interferon peguilado e ribavirina, infectado pelo genótipo 3. Todos apresentaram RVS. Informações clínicas sobre esse subgrupo podem ser encontradas na (Tabela 2).
Tabela 2 - Taxas de resposta virológica sustentada e características clínicas de pacientes que receberam esquemas alternativos para hepatite C crônica na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019
| Esquema proposto | SOF+INF+RBV | SOF+RBV |
|---|---|---|
| Número de pacientes | 1 | 5 |
| Duração em semanas | 12 (100,00%) | 12 (100,00%) |
| Genótipo | 3 (100,00%) | 2 (100,00%) |
| Cirrose (%) | 100,00% | 80,00% |
| Tratamento anterior (%) | 100,00% | - |
| RVS (%) | 100,00% | 100,00% |
SOF: sofosbuvir; INF: interferon alfa; RBV: ribavirina; RVS: resposta virológica sustentada. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Neste estudo, foram encontrados sete pacientes não respondedores, sendo, em sua maioria, mulheres (71,43%), com idade média de 62 anos, infectados pelo genótipo 3 (57,14%), pacientes portadores de cirrose (57,14%), com tratamento com duração de 12 semanas (85,71%). A taxa de RVS no genótipo 3 foi a menor entre todos (93,10%). Outras características clínicas e demográficas acerca desses pacientes são mostradas no (Quadro 1) e na (Tabela 3).

F: feminino; M: masculino; PEG: interferon peguilado; RBV: ribavirina; SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; IFN: interferon alfa.
Quadro 1- Características clínicas e demográficas dos pacientes não respondedores aos agentes antivirais de ação direta na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019
Tabela 3 - Características clínicas e demográficas de pacientes não respondedores aos agentes antivirais de ação direta na Fundação Santa Casa de Misericórdia em Belém, Pará, entre maio de 2017 e março de 2019, por esquema de tratamento
| Variáveis | SOF + DAC ± RBV | SOF + SMV ± RBV | Total | |||
|---|---|---|---|---|---|---|
| Idade | Média | Mín.-máx. | Média | Mín.-máx. | Média | Mín.-máx. |
| 63,33 | 56-75 | 59 | 59 | 62,71 | 56-75 | |
| N = 6 | % | N = 1 | % | N = 7 | % | |
| Sexo | ||||||
| Masculino | 2 | 33,33 | - | - | 2 | 28,57 |
| Feminino | 4 | 66,67 | 1 | 100,00 | 5 | 71,43 |
| Genótipo | ||||||
| 1 total | 2 | 33,33 | 1 | 100,00 | 3 | 42,86 |
| 1a | 1 | 50,00 | 1 | 100,00 | 2 | 66,67 |
| 1b | 1 | 50,00 | - | - | 1 | 33,33 |
| 2 | - | - | - | - | - | - |
| 3 | 4 | 66,67 | - | - | 4 | 57,14 |
| Carga viral (UI/mL) | ||||||
| < 800.000 | 3 | 50,00 | - | - | 3 | 42,86 |
| ≥ 800.000 | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
| Tratamento anterior | ||||||
| Sim | 5 | 83,33 | - | - | 5 | 71,43 |
| Não | 1 | 16,67 | 1 | 100,00 | 2 | 28,57 |
| Fibrose | ||||||
| F0-F3 | 3 | 50,00 | - | - | 3 | 42,86 |
| F4 | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
| Duração do tratamento | ||||||
| 12 semanas | 5 | 83,33 | 1 | 100,00 | 6 | 85,71 |
| 24 semanas | 1 | 16,66 | - | - | 1 | 14,29 |
| Adição de RBV | ||||||
| Sim | 3 | 50,00 | - | - | 3 | 42,86 |
| Não | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
SOF: sofosbuvir; DAC: daclatasvir; RBV: ribavirina; SMV: simeprevir. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Análises estatísticas foram realizadas para buscar possíveis associações entre características clínicas e a existência de RVS. As variáveis analisadas foram sexo, idade maior ou menor que 60 anos, genótipo, existência de tratamento anterior, cirrose, tempo de tratamento entre 12 e 24 semanas, esquema de tratamento com sofosbuvir e daclatasvir ou sofosbuvir e simeprevir, carga viral maior ou menor que 800.000 UI/mL e adição de ribavirina. Nenhuma associação demonstrou significância estatística (p > 0,05). Detalhes acerca dessas análises podem ser vistos na (Figura 3).
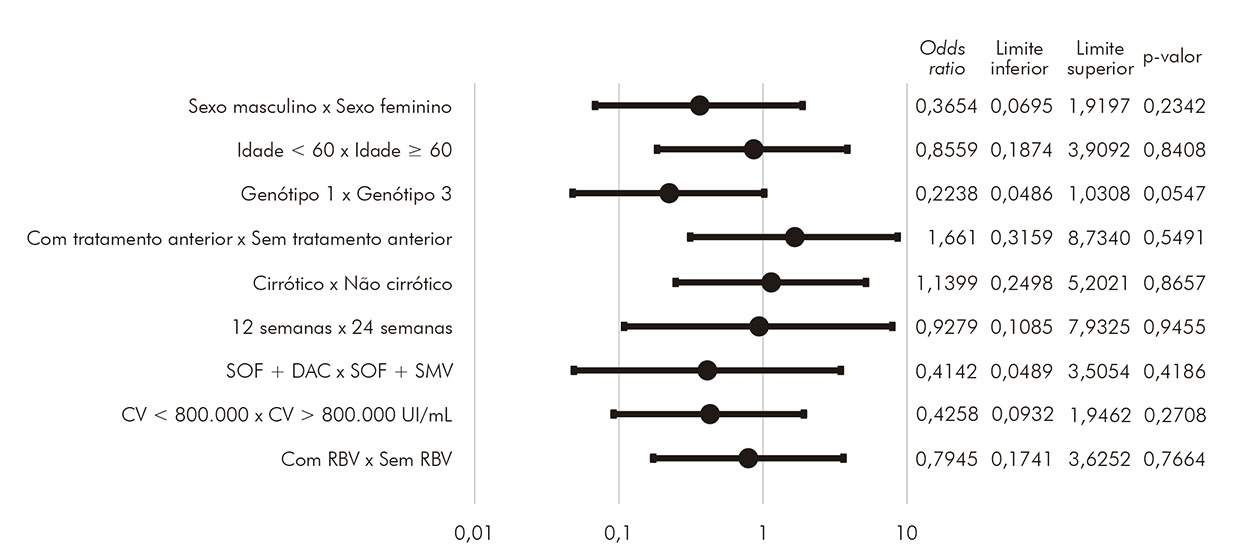
SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; CV: carga viral; RBV: ribavirina.
Figura 3 - Análise estatística de possíveis preditores de RVS de pacientes com hepatite C crônica tratados com agentes antivirais de ação direta na FSCMPA em Belém, estado do Pará, Brasil, entre maio de 2017 e março de 2019
DISCUSSÃO
Os antivirais de ação direta de segunda geração demonstraram alta efetividade na população em tratamento na FSCMPA, com uma taxa geral de RVS de 97,20%. Esse resultado está em concordância com estudos internacionais, como o COSMOS11 e o OPTIMIST-112, e também aqueles realizados a nível nacional e em diversas regiões do Brasil. Na Região Sul, estudos realizados por Ferreira et al.13, Holzmann et al.14 e Molinar et al.15 encontraram taxas de RVS de 91,60%, 93,40% e 94,20% nos estados do Paraná, Rio Grande do Sul e Santa Catarina, respectivamente. Na Região Nordeste, Rolim et al.16 encontraram um percentual de 95% na cidade de Fortaleza, estado do Ceará. Na Região Sudeste, Azevedo17 constatou um percentual de 96,30% na cidade do Rio de Janeiro. Um estudo de abrangência nacional realizado por Cheinquer et al.18, no qual foram avaliados pacientes de várias cidades, mostrou a mesma tendência, com taxas de RVS variando entre 88% e 97%, a depender do genótipo do vírus. Todos esses dados ratificam a efetividade dessas drogas.
A população estudada também mostrou características clínicas e demográficas semelhantes às das populações analisadas em outros estudos, como os estudos nacionais citados anteriormente13,14,15,16,17,18, mostrando uma população predominantemente masculina, idosa, urbana, com elevado percentual de cirróticos e pacientes experimentados com tratamentos anteriores.
No que diz respeito ao genótipo, a maior prevalência correspondeu ao genótipo 1 (73,60%), seguido pelo genótipo 3 (23,20%), em acordo com a prevalência desses genótipos a nível nacional19. A infecção pelo genótipo 3 tem sido considerada de difícil tratamento, principalmente quando associada a cirrose, com menores taxas de RVS, demonstradas em estudos internacionais, como FISSION20, POSITRON21 e ALLY-322. Na presente análise, quatro dos sete pacientes não respondedores estavam infectados pelo genótipo 3, e apenas dois desses pacientes eram cirróticos. A taxa de RVS no genótipo 3 foi a menor entre todos (93,10%). No entanto, o número reduzido de pacientes neste estudo dificulta a análise.
É importante ressaltar que a maioria dos pacientes (54,00%) eram portadores de cirrose hepática. Possivelmente, esses achados estão associados à dificuldade em diagnosticar a hepatite C nos estágios iniciais devido ao seu caráter majoritariamente assintomático, e também pela baixa eficácia e tolerabilidade dos tratamentos com interferon utilizados anteriormente. Na presente amostra, 40,80% dos pacientes já haviam experimentado, sem sucesso, alguma dessas modalidades de tratamento.
Os principais eventos adversos encontrados em pacientes que receberam sofosbuvir e daclatasvir foram cefaleia (5,71%), astenia (5,14%) e náuseas (4,57%). Resultado semelhante foi encontrado nos estudos realizados por Sulkowski et al.23 e Medeiros et al.24 com pacientes que receberam o mesmo esquema de tratamento, havendo demonstrado, com maior frequência, os mesmos eventos adversos citados. Nos pacientes que receberam sofosbuvir e simeprevir, o efeito adverso mais frequente foi o prurido (7,25%), seguido dos demais já referidos. Tais resultados confirmam a boa tolerabilidade dos antivirais de ação direta e reduzida frequência de eventos adversos.
No que tange à adição de ribavirina ao esquema terapêutico, essa não pareceu ser um fator importante no alcance de RVS, havendo pouca diferença proporcional nas taxas de RVS tanto no grupo que recebeu sofosbuvir e daclatasvir (96,93% vs. 96,10%) quanto no que recebeu sofosbuvir e simeprevir (100,00% vs. 98,07%).
É importante notar que, dentre os pacientes que receberam sofosbuvir e simeprevir, um deles era infectado pelo genótipo 3, e, para esse genótipo, nos termos do PCDT 2017 (vigente à época do início da pesquisa) o simeprevir não era recomendado, demonstrando possível falha na assistência. Ainda assim, o paciente em questão apresentou RVS, não resultando em prejuízo. Além disso, desde fevereiro de 2019, o simeprevir deixou de ser recomendado pelo PCDT do Ministério da Saúde9 e foi excluído do arsenal farmacológico do SUS devido à introdução de novas alternativas terapêuticas de maior efetividade, como o glecaprevir/pibrentasvir e o velpatasvir/sofosbuvir, por exemplo, que são considerados esquemas pangenotípicos por tratarem todos os genótipos do VHC, enquanto o simeprevir era indicado apenas para pacientes monoinfectados com genótipo 1 do VHC, sem cirrose ou com cirrose Child-A25.
A hepatite C crônica persiste ainda como uma das principais causas de cirrose e de transplante hepático em adultos na maioria dos países26,27. Frente a esse cenário, a OMS adotou como alvo eliminar o VHC até 203028. Dessa forma, é importante que sejam voltadas atenções à prevenção da doença bem como ao diagnóstico e tratamento precoces, evitando-se complicações decorrentes da infecção crônica pelo VHC. A adoção de antivirais de ação direta de última geração no Brasil poderia corroborar com a meta de eliminação do vírus, bem como aumentar o número de pacientes tratados por não especialistas, ampliando assim o acesso ao tratamento29.
As limitações do presente estudo podem ser algum viés de seleção devido à impossibilidade de avaliar todos os pacientes tratados com antivirais de ação direta no período da coleta de dados, em decorrência da falta de informações de seguimento (desfecho) de muitos pacientes, os quais tiveram de ser excluídos da amostra final, impossibilitando identificar, com precisão, o número de pacientes respondedores e não respondedores ao novo tratamento.
CONCLUSÃO
Os resultados deste estudo observacional, em uma amostra de pacientes cronicamente infectados pelo VHC no estado do Pará, mostrou que os antivirais de ação direta de segunda geração (daclatasvir, sofosbuvir e simeprevir) apresentaram elevada taxa de RVS, refletindo excelente efetividade e tolerabilidade em plena concordância com estudos prévios realizados em outros países e outras regiões do Brasil.











 texto em
texto em 


