Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Paraense de Medicina
versão impressa ISSN 0101-5907
Rev. Para. Med. v.20 n.4 Belém dez. 2006
Avaliação histoquímica da mucosa gastrointestinal de ratos expostos ao álcool1
Histochemical avaliation of the gastrointestinal mucosa of rats exposed to alcohol
Mario Ribeiro Melo-JúniorI; Marcos Cezar Feitosa de Paula MachadoII; Jorge Luiz Silva Araújo-FilhoIII; Vasco José Ramos Malta PatuIV; Eduardo Isidoro Carneiro BeltrãoV; Nicodemos Teles de Pontes–FilhoVI.
IProfessor titular de Patologia – ASCES, Doutorando em Ciências Biológicas – CCB/UFPE
IIMestrando em Patologia – CCS/UFPE
IIIMestre em Patologia – CCS/UFPE
IVMestrando em Ciências Biológicas – CCB/UFPE
VProfessor adjunto do Departamento de Bioquímica – CCB/UFPE, Doutor em Ciências Biológicas
VIProfessor adjunto do Departamento de Biologia – UFRPE, Doutor em Nutrição
RESUMO
OBJETIVO: avaliar através da histoquímica com lectinas a expressão de glicosaminoglicanos (mucinas) nas células do trato gastrointestinal de ratos expostos ao etanol.
MÉTODO: ratos foram expostos ao etanol (3g/kg do peso) durante 15, 30 e 45 dias. Após a perfusão, o estômago e o intestino fixados em formalina tamponada a 10% e fragmentos desses órgãos emblocados em parafina. Os cortes histológicos (4µm) foram incubados com lectinas (PNA, WGA e Con A) conjugadas à peroxidase. A marcação das lectinas se revelou com o DAB–H2O2, seguida pela contra–coloração com hematoxilina. Os métodos Periodic acid–shiff (PAS) e Alcian blue foram usados para avaliar a expressão de glicosaminoglicanos (mucinas).
RESULTADOS: verificou–se que na mucosa gástrica a expressão das mucinas aumentou progressivamente durante a exposição ao etanol, conforme o aumento do número de células PAS e Alcian blue positivas. Por outro lado, na mucosa intestinal nenhuma diferença considerável se observou no número dessas células. Todas as lectinas testadas apresentaram um aumento no padrão de marcação relacionado ao maior período de exposição ao etanol. A PNA foi a mais seletiva das lectinas, reconhecendo, exclusivamente, células do cólon e das glândulas gástricas. A Con A apresentou uma intensa marcação nas regiões apicais das glândulas do cólon e do estômago, enquanto que a WGA reagiu, intensamente, nas células caliciformes e células de Paneth nas glândulas do epitélio intestinal.
CONCLUSÃO: esses achados demonstram que a exposição ao etanol, leva a uma alteração dos padrões de reconhecimento das lectinas nas células do tecido gastrointestinal, bem como, um aumento a expressão gástrica das mucinas.
Descritores: Histoquímica, lectinas, etanol, glicosaminoglicanos
SUMMARY
OBJECTIVES: in this work, lectin histochemistry was used to evaluate the expression of glycosaminoglycan (mucin) in gastrointestinal cells of rats exposed to ethanol.
METHOD: Rats were exposed to ethanol (3g/kg of weight) during 15, 30 and 45 days. After perfusion, the stomach and intestine were formalin 10% fixed and the tissues were paraffin embedded. Slices (4mm) were incubated with peroxidase–conjugated lectins (PNA, WGA and Con A). Lectin staining was revealed with DAB–H2O2 followed by haematoxylin counterstaining. Periodic acid–Shiff (PAS) and Alcian Blue staining methods were used to evaluate glycosaminoglycan expression.
RESULTS: indicated that, in gastric mucosae, acid and neutral mucin expression rose progressively during ethanol exposition while in intestinal mucosae no considerable difference was observed in the number of PAS– and Alcian Blue–positive staining cells. All lectins presented an increasing binding pattern related to the period of ethanol exposure. PNA was the most selective lectin, recognizing exclusively colon cells and gastric glands. Con A presented an intense binding to the bottom region of the colon stomach glands while WGA intensely bound to the caliceform and Paneth cells in the intestinal glands.
CONCLUSION: These findings demonstrate that ethanol exposure led to a different pattern of lectin recognition of the cells of the gastrointestinal tissue.
Keywords: Histochemistry, lectins, ethanol, glycosaminoglycans
INTRODUÇÃO
Um dos principais locais de ação tóxica do etanol nas células é a membrana plasmática. Vários estudos têm demonstrado a existência de correlações entre o nível de intoxicação e a extensão de desordens na membrana celular resultante da ação do etanol1. A ingestão de álcool afeta as membranas plasmáticas e organelas celulares devido no metabolismo de lipídios, carboidratos e proteínas, predispondo os tecidos às injúrias.
Alterações morfológicas e funcionais do trato gastrointestinal após a exposição ao etanol têm sido descritas em humanos2 e animais experimentais3, caracterizando–se, essencialmente, pela interferência nas células epiteliais e na manutenção da flora microbiana residente prejudicando, ao mesmo tempo, a absorção e proteção imune do sistema4.
Os glicosaminoglicanos (carboidratos) das membranas são em sua maioria glicoproteínas ou glicolipídios de elevada complexidade e variabilidade estrutural, funcionando como sinalizadores das alterações sofridas pelas células5. Somando–se a isso, lectinas apresentam alta especificidade por carboidratos e são utilizadas para detectar alterações celulares estruturais e bioquímicas em diferentes situações de injúrias6.
Diferentes modelos experimentais de interações entre lectinas e células do trato gastrointestinal têm sido empregados, tais como: a modulação e controle de infecções do ambiente gastrointestinal de ratos infectados por Salmonella7, aderência e reconhecimento da Giárdia lamblia pelas células intestinais em humanos8, estudos das alterações nos receptores de superfície das células epiteliais durante a infecção por bactérias intestinais em ratos9. Devido à sua versatilidade, as lectinas são também utilizadas como vetores biológicos (bioadesinas) carreando vacinas para as mucosas intestinal e respiratória10.
Uma das mais freqüentes aplicações das lectinas é como marcador histoquímico de tecidos que sofreram transformações neoplásicas6, na identificação de tipos celulares específicos como macrófagos/histiócitos11 , células M intestinais12 e outras células das mucosas gástrica e intestinal em diversos modelos experimentais13.
OBJETIVO
Avaliar através da histoquímica com lectinas a expressão de glicosaminoglicanos (mucinas) nas células do trato gastrointestinal de ratos expostos ao etanol.
MÉTODO
Animais em dieta
Vinte e oito (28) ratos machos Wistar recém–desmamados (25dias) foram expostos, diariamente, ao etanol (3g/kg de peso através da cânula orogástrica, por períodos de 15 (G15, n=7), 30 (G30, n=7) e 45 (G45, n=7), e comparados a um grupo controle (35 dias). Todos os grupos receberam dieta comercial (LABINA– Purinaâ). O protocolo experimental desenvolvido foi submetido e aprovado pela Comissão de Ética em experimentação animal (CCB–UFPE – ofício 119/2003).
Amostra de tecidos
Os animais foram anestesiados, intraperitonialmente, com uma solução contendo 0,5% de cloralose e 12% de uretana, em dose de 1,0ml/kg de peso. Após abertura do tórax e introdução de uma cânula de polietileno no ventrículo esquerdo, foram injetados 200ml de formalina 10% tamponada. Em seguida, procederam-se a retirada do intestino delgado e estômago, que foram preservados em solução de formalina até o momento da microtomia. Para os cortes histológicos, selecionaram–se fragmentos de regiões distintas do intestino (jejuno e íleo) e estômago (corpo e antro), submetidos a rotina histológica e incluídos em parafina. Os cortes histológicos (4mm) foram obtidos em micrótomo horizontal Yamato (Japan).
Histoquímica com Lectinas
Os fragmentos teciduais montados em lâminas histológicas albuminizadas foram tratados com solução de tripsina (0,1%) a 37oC por 2 minutos, expostos ao H2O2 por 20 minutos e incubados a 4o C por 2 horas com lectinas (PNA–25 mg/ml, WGA–25 mg/ml e Con A–50 mg/ml) conjugadas à peroxidase (Sigma). Posteriormente as lâminas foram mergulhadas por 10 minutos em 10 mM de tampão fosfato (PBS) pH 7.2. A reação da peroxidase foi visualizada após incubação por 5 a 8 min em PBS contendo diaminobenzidina (DAB) e peróxido de hidrogênio. As lâminas foram contracoradas com hematoxilina e analisadas em microscópio óptico (Olympus BH–2, Japão). Para controle, as lectinas foram inibidas utilizando–se methyl–a–D–manose para Con A, Dgalactose para PNA e N–acetilglicosamina para WGA (Sigma).
Para o estudo do padrão de marcação das lectinas aplicou–se uma escala semiquantitativa (DxI) calculada levando–se em consideração a intensidade da coloração (I), variando de 1 a 4, e a distribuição (D) variando entre fraca (+), moderada (++) e intensa (+++), conforme metodologia utilizada. 16.
Histoquímica das mucinas
Para diferenciação da composição do muco das células do estômago e do intestino delgado foram utilizados fragmentos teciduais corados com Alcian blue a 1% em pH 2,5 para revelar mucopolissacarídeos ácidos e PAS (Periodic acid–scshiff) a 0,5% para mucopolissacarídeos neutros, segundo o protocolo proposto por Felipe15.
As imagens das lâminas histológicas foram capturadas utilizando um sistema de análise de imagens OptimasTM 6.1 (Optimas Corporation, USA), conectado a um microscópio óptico padrão. Os padrões de marcação dos glicosaminoglicanos foram calculados pelo número médio de células marcadas (área total 12234 µm2), em 5 campos aleatórios por lâmina de cada animal. Os resultados obtidos foram submetidos ao estudo estatístico utilizando–se os Testes t de student e de Tukey, com p<0,05, através do software PRISMA 3.0â.
RESULTADOS
Histomorfologia
A histologia da mucosa gastrointestinal nos grupos estudados não mostrou alterações importantes entre os períodos de exposição ao álcool. A mucosa do estômago, na região do corpo apresentou discreta atrofia das glândulas no grupo G45, principalmente na região glandular apical, enquanto as células e a organização das criptas não diferiu, morfologicamente, entre os indivíduos. A membrana da mucosa do estômago, mais precisamente da camada epitelial, exibiu células descamadas, além de uma camada regular de muco recobrindo o epitélio, que aumentou progressivamente nos grupos G30 e G45.
A mucosa do intestino delgado mostrou–se formadas por diversos tipos celulares, com destaque para células absortivas e caliciformes. Apesar da exposição ao etanol, a mucosa não apresentou alterações morfológicas importantes, apenas uma ligeira diminuição do numero e altura das vilosidades e glândulas de Lieberkühn.
Histoquímica das mucinas
Quanto às reservas de glicosaminoglicanos pelas células da mucosa intestinal reveladas pela reação com PAS e Alcian blue, observou–se um gradativo aumento da expressão dos mesmos pelas células produtoras de muco à medida que o período de exposição ao etanol aumentou (Tabela 1).
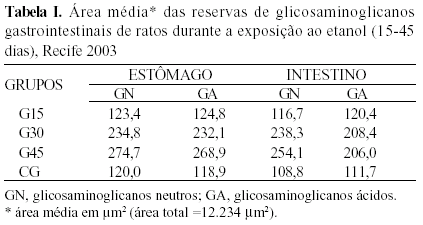
Foi confirmado o aumento na produção de mucopolissacarídeos neutros, evidenciado pela intensa marcação de PAS nas regiões foveolar e apical das células de reserva no corpo gástrico, à medida que a exposição ao etanol foi intensificada, principalmente aos 45 dias.
Na região antral não houve marcação para presença de mucinas ácidas ou neutras para nenhum dos períodos de exposição. No intestino delgado a analise qualitativa não evidenciou diferença na expressão de mucina neutra nem no número de células PAS–positivas nos diferentes períodos de exposição ao etanol.
Histoquímica com Lectinas
As lectinas utilizadas mostram padrões de ligação crescentes com o aumento dos períodos de expçosição ao etanol (Tabela 2).

A PNA foi a mais seletiva das lectinas testadas, marcando, exclusivamente, células do colo e ístmo das glândulas gástricas e com reação negativa para o muco, apresentando um padrão granular de marcação para os eritrócitos. A Con A revelou u'a marcação mais intensa nas regiões do ístmo e criptas das glândulas fúndicas estomacais e falha na marcação do muco, mostrando o mesmo padrão de marcação obtido pela PNA em relação aos eritrócitos. Quanto à WGA, esta marcou, especificamente, as células caliciformes, bem como o muco e os grânulos das células de Paneth, contidas nas glândulas de Liberkühn no intestino. Na mucosa do estômago, revelou um padrão de marcação bastante difuso e inespecífico.
DISCUSSÃO
O etanol sendo uma molécula polar, pode interagir com uma região hidrofóbica de macromoléculas, ligando–se a uma variedade de proteínas e carboidratos de membranas17. Um dos efeitos tóxicos do etanol se reflete na função básica do epitélio intestinal e quando ocorre lesão, os processos de absorção são prejudicados, desencadeando "síndrome de má absorção"4. Atualmente se sabe que tanto o etanol, quanto o seu principal metabólito, o acetaldeído, são indicados como responsáveis por diversos distúrbios da mucosa intestinal, além de serem fatores carcinogênicos tanto para os ratos,18 como para seres humanos19.
O aumento da síntese e distribuição de mucina ácida e neutra pelas células mucosas do estômago e intestino, observado neste estudo, pode ser explicada pela ação tóxica do etanol que, ao ser ingerido oralmente, é transportado ao intestino, onde uma parte é oxidada pelas bactérias residentes na mucosa, que produzem boa parte do acetaldeído tóxico aos eritrócitos, alterando a produção e secreção de muco20.
No epitélio gastrintestinal a mucosa é coberta por um mucoprotetor, composto principalmente de glicoproteínas–mucinas, sintetizado pelas células superficiais (goblet cells), células estas sensíveis às agressões sofridas pela mucosa21.
A observação de achados idênticos quanto às regiões positivas para Alcian blue/PAS e a marcação da lectina WGA para o muco, reafirma a possibilidade da utilização de lectinas como biomarcadores, se tornando uma das ferramentas para o estudo da mucosa gastrintestinal, devido a sua afinidade por substâncias do muco22.
Os glicoconjugados do muco são, possivelmente, relacionados a muitas doenças, apresentando diferenças na sua composição entre a mucosa gástrica normal e durante as situações de estresse como, por exemplo, a ingestão de álcool23.
As lectinas utilizadas mostram variados padrões de marcação para a mucina produzida pelas células secretoras, evidenciando a presença de tipos específicos de carboidratos, mais especificamente, nacetilglicosamina, como um componente importante da proteção da mucosa gastrintestinal.
Os padrões de marcação das glândulas estomacais pelas lectinas PNA e Con A utilizadas neste trabalho, marcando exclusivamente, células do colo e células parietais (oxínticas) nas glândulas do corpo do estômago, mostram–se semelhantes à marcação obtida em epitélio colunar maior e neoplásico de cão24, confirmando observações anteriores que os oligossacarídeos das glicoproteínas nas células epiteliais absortivas, evidenciados por lectinas podem servir como marcadores auxiliares no estudo das modificações funcionais nas células da mucosa, desde lesões pré–neoplásicas até tumores malignos no estômago e intestino25.
As afinidades das lectinas Con A, PNA e WGA pelas células da mucosa gástrica observadas, demonstradas pela marcação intensa e específica a determinados grupos celulares, são corroborada por outros autores, que em estudos recentes26,27 observaram marcação pela PNA na superfície foveolar e células epiteliais, enquanto com WGA essas regiões mostraram–se negativas27. Outros trabalhos afirmam, ainda, que várias lectinas ligam–se, especificamente, a mucinas estomacais e células gástricas, como as lectinas Meã I–II28, BPA e VVA29.
Em relação às variações de intensidade observadas nos padrões de ligação das lectinas, esses resultados são semelhantes a estudos anteriores que atribuíram esse fato aos efeitos tóxicos da exposição ao etanol sobre a extensão da ligação e distribuição de lectinas nos tecidos30.
A ausência de alterações estruturais mais evidentes no epitélio gastrointestinal dos ratos nesse estudo, deve–se à alta capacidade de regeneração desse epitélio que é corroborado por estudo ultraestrutural da mucosa gástrica durante a exposição ao etanol31. A ingestão crônica do álcool favorece uma resposta adaptativa das membranas, apesar desta interação álcool–membrana ocasionar mudanças significativas no funcionamento das mesmas32.
Desta, os resultados obtidos sugerem um importante papel das glicoproteínas durante alterações e reorganização do ambiente celular gastrointestinal quando exposto às situações de estresse. Podendo–se, assim, em concordância com especulações anteriores33, confirmar os efeitos do álcool no glicocálice e instituir a histoquímica com lectinas como uma possível ferramenta para detectar os graus de toxicidade alcoólica nas células.
CONCLUSÕES
Os resultados comprovaram a existência de uma intima relação entre a ingestão crônica de etanol, subseqüente síntese/expressão de mucinas pelas células mucosas e os padrões diferenciados de marcação de lectinas, indicando também alterações na expressão de carboidratos pelas células do trato grastrointestinal, quando expostas a toxinas como o etanol.
REFERENCIAS
1. JUAREZ J, DE TOMASI EB & VASQUEZ C Alcohol treatment during lactation produces an advance in the onset of puberty in female rats. Alcohol. 21(2): 181–185, 2000.
2. PERES WAF, CARMO MGT, ZUCOLOTO S, IGLESIAS AC, BRAULIO VB. Ethanol intake inhibits growth of the epithelium in the intestine of pregnant rats. Alcohol. 33:83–89, 2004.
3. GARIGE M, AZUINE, LAKSHMAN MR.Chronic ethanol consumption upregulates the cytosolic and plasma membrane sialidase genes, but downregulates lysosomal membrane sialidase gene in rat liver. Metabolism Clinical and Experimental. 55: 803– 810, 2006.
4. WATZL B, WATSON RR. Symposium: Nutrition, immunomodulation and AIDS. Role of alcohol abuse in nutritional immunosupression. Am Inst. Nut.33: 773–737, 1992.
5. SHARON N & LIS H. Carboidrates in cell recognition. Scientific Amer. 268: 74–81, 1993.
6. MELO–JÚNIOR M R, TELLES AMS, ALBUQUERQUE F E B, PONTES–FILHO N T, CARVALHO JR.L B, BELTRÃO E I C. Altered lectin–binding sites in normal colon and ulcerative colitis. J. Bras. Patol. Med. Lab. vol.40, no.2, p.123–125. ISSN 1676–2444, Apr 2004.
7. NAUGHTON PJ et al. Modulation of Salmonella infection by the lectin of Canavalia ensiformis (Con A) and Galanthus nivalis (GNA) in a rat model in vivo. J. Appl. Microb. 88(4): 720–727, 2000.
8. SOUSA MC, GONÇALVES CA, BAIROS VB, POIARES–DA–SILVA J. Adherence of Giárdia lamblia trophosoites to Int–407 human intestinal cells. Clin. Diag. Lab. Immunol. 8(2): 258–265, 2001.
9. PUSZTAI A et al. Lectins and also bacteria modify the glycosilation of gut surface–receptors in the rat. Glycoconj. J. 12(1): 22–35, 1995.
10. GUPTA P N, MAHOR S, RAWAT A, KHATRI K, GOYAL A, VYAS SP. Lectin anchored stabilized biodegradable nanoparticles for oral immunization Development and in vitro evaluation. International Journal of Pharmaceutics. 318: 163–173, 2006.
11. URDIALESVIEDMA M, DEHAROMUNOZ T, MARTOSPADILLA S, ABADORTEGA JM, VARELADURAN J, GRANDAPAEZ R JACALIN. Another marker for histocytes in paraffin–embeddee tissues. Histol. Histopathol. 10(3):597–602, 1995.
12. KITAGAWA H et al. Ultrastructural characteristics and lectin–binding properties of M–cells in the follicle associated epithelium of chicken caecal tonsils. J. Anat. 197(4): 607–616, 2000.
13. GEBHARD A & GEBERT A. Brush cells of the mouse intestine possess a specialized glycocalyx as revealed by quantitative lectin histochemistry: Further evidence for a sensory function. J. Histochem. Cytochem. 47(6): 799–808, 1999.
14. SOFFIENTINO B, GOMEZ–CHIARRI M, SPECKER J. Developmental changes in stomach, intestine, and skin glycoconjugates in summer flounder (Paralichthys dentatus) A lectin histochemical study. Aquaculture. 253: 680–687, 2006.
15. FILIPE MI. Gastrointestinal tract. In: Histochemistry in pathologic diagnosis. 10a Edition, Samuel S. Spicer (Ed.). New York (USA). 1041p, 1986.
16. ÖZER E, SARIOGLU S & GÜRE A. Effects of prenatal ethanol exposure on neuronal migration, neurogenesis and brain myelination in the mice brain. Clin. Neuropathol. 19(1): 21–25, 2000.
17. BARRY J, GWRISH K DIRECT NMR. Evidence for ethanol binding to the lipidwater interface of phospholipid bilayers. Biochemistry.33: 882–888, 1994.
18. HOMANN N, TILLONEN J & SALASPURO M. Microbially produced acetaldehyde from ethanol may increase the risk of colon cancer via folate deficiency. Int. J. Cancer. 86(2): 169–173, 2000.
19. SEITZ HK, MATSUZAKI S, YOKOYAMA A, HOMANN N, VOKEVAINEN S, WANG XD. Alcohol and cancer. Alcohol Clin. Exp. Res. 25(5): 137–143, 2001.
20. SALASPURO M. Microbial metabolism of ethanol and acetaldehyde and clinical consequences Add. Biol. 2(1): 35–46, 1997.
21. DEPLANCKE B, GASKINS HR. Microbial modulation of innate defense: goblet cells and the intestinal mucus layer. Am J Clin Nut.73(6): 1131–1141, 2001.
22. ZEPELETA I. Preparation of Ulex europeus lectin–gliadin nanoparticle conjugates and their interation with gastrointestinal mucus. Int. J. Pharm. 19(1): 25–32, 1999.
23. TAYLOR C, ALLEN A, DETTMAR PW, PEARSON J P. Two rheologically different gastric mucus secretions with different putative functions. Biochimica et Biophysica Acta. 1674: 131– 138, 2004.
24. HAINES DM. Peanut agglutinin lectin immunohistochemical staining of normal and neoplastic canine tissues. Vet. Pathol. 30(4): 333–342, 1993.
25. MADRID JF et al. Lectin–gold localization of fucose residuos in human gastric mucosa. J. Histochem. Cytochem. 46(11): 1311– 1320, 1998.
26. KHIN MM et al. Agglutinin of Helicobacter pylori coccoids by lectins. World j Gastroenterol. 6(2): 202–209, 2000.
27. RIOSMARTIN JJ, DIAZCANO SJ & RIVERAHUETO F Ultrastructural distribution of lectin–binding sites on gastric superficial mucus–secreting epithelial–cells. The role of golgi–apparatus in the initial glycosylation. Histochem. 99(2): 181–189, 1993.
28. ZETENO E et al. Specificity of the isolectins from the plant cactus Machaerocereus eruca for aligosaccharides from porcine stomach mucin. Gkycoconj. J. 12(5): 699–706, 1995.
29. SHUE GL et al. Expression of glycoconjugates in pancreatic, gastric and colonic tissue by Bauhnia purpurea, Vicia villosa and Peanut lectins. Scand J gastroenterol. 28(7): 599–604, 1993.
30. CASEY CA. The effects of chronic ethanol administration on the rates of internalization of various ligands during hepatic endocytosis. Biochim. Biophys. Acta. 1134: 96–104, 1992.
31. ARABSKI M et al. Interaction of amoxicillin with DNA in human lymphocytes and H. pylori–infected and non–infected gastric mucosa cells. Chemico–Biological Interactions. 152: 13–24, 2005.
32. DIAMOND I, GORDON A. Celular and Molecular neurosciense of alcholism. Physiol. Rev. 77: 1–20, 1997.
33. SINGH RS, TIWARY AK , KENNEDY JF. Lectins: sources, activities and applications. Crit. Rev. Biotech. 19(2): 145–178, 1999.
 Endereço para correspondência
Endereço para correspondência
Prof. Mario Ribeiro de Melo–Junior
Laboratório de Imunopatologia Keizo Asami, LIKA,
Universidade Federal de Pernambuco, UFPE.
Av. Morais Rêgo s/n, Campus Universitário – CEP 50670–910.
E–mail: mariormj@gmail.com
Recebido em 18.08.2006
Aprovado em 05.10.2006
1Trabalho desenvolvido no Laboratório de Imunopatologia Keizo Asami – LIKA/UFPE













