Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Paraense de Medicina
versão impressa ISSN 0101-5907
Rev. Para. Med. v.22 n.1 Belém mar. 2008
ARTIGO ORIGINAL
Diagnóstico molecular da infecção pelo Helicobacter Pylori em mucosa gástrica1
Molecular diagnosis of Helicobacter Pylori infection in the gastric mucosal
Renato Santana LuscentiI; Luciano Lobo GattiII
IGraduando do Curso de Ciências Biológicas das Faculdades Integradas de Ourinhos e Estagiário do Laboratório de Biologia Molecular das FIOs
IIPhD. Geneticista, Professor Doutor e Pesquisador das Faculdades Integradas de Ourinhos e Coordenador do Projeto de Detecção e Polimorfismos do Helicobacter Pylori no Laboratório de Biologia Molecular das Faculdades Integradas de Ourinhos - FIO
RESUMO
INTRODUÇÃO: Helicobacter Pylori uma bactéria que coloniza mucosa gástrica, associada fortemente com doenças gástricas e adenocarcinoma gástrico. Interações que envolvem fatores ambientais, do hospedeiro e da bactéria têm sido associadas com a progressão da doença gástrica e fatores de virulência, como a citotoxina vacualizante (vacA), e citotoxina associada (cagA), têm sido associados como fatores de virulência da bactéria.
OBJETIVO: padronização do Diagnóstico Molecular da Infecção pelo Helicobacter Pylori no Laboratório de Biologia Molecular das Faculdades Integradas de Ourinhos.
MÉTODO: extração de DNA de biópsia gástrica, através do Kit Wizarg SV Genomic DNA Purification e Reação em Cadeia da Polimerase utilizando primers que amplificam genes específicos do Helicobacter Pylori.
RESULTADOS: todas as amplificações foram padronizadas de acordo com as condições utilizadas com os primers específicos para amplificação gênica do H. pylori.
CONSIDERAÇÕES FINAIS: o estudo proposto alcançou seus objetivos que foi a padronização molecular da infecção pela bactéria H. pylori em mucosa gástrica de indivíduos infectados, fornecendo desta forma uma nova ferramenta e técnica extremamente sensível para detecção da infecção pelo bactéria de maneira rápida e precisa.
DESCRITORES: Helicobacter Pylori, Diagnóstico Molecular da Infecção, doenças gástricas
SUMMARY
INTRODUCTION: Helicobacter Pylori a bacterium to colonize human gastric mucosa, hás been strongly associated with gastric diseases and gastric cancer. Interactions involving environmental, host and bacterial factors seem to associated with gastric diseases progression and virulences factors like vacuolating cytotoxin (vacA), and Associated Cytotoxin (cagA), has been associated like virulence factors from bacterium.
OBJECTIVE: standardization of Molecular Diagnostics of infection by Helicobacter Pylori in the Laboratory of Molecular Biology of the Faculty of Integrated Ourinhos.
METHODS: DNA extraction from gastric biopses through the kit Wizarg SV Genomic DNA Purification and Polymerase Chain Reaction using primers that ampliefied especif genes from Helicobacter Pylori.
RESULTS: all amplifications were standardized in accordance with the terms used with specific primers for amplification of the gene H. pylori.
FINAL CONSIDERATIONS: the proposed study has achieved its objectives which was the standardization of molecular infection by the bacteria H. pylori in gastric mucosa of infected individuals, thus providing a new tool and extremely sensitive technique to detect infection by the bacteria quickly and accurately
KEY WORD: Helicobacter Pylori, Molecular Diagnóstic Infection, Gastric Diseases
INTRODUÇÃO
A infecção pela bactéria Helicobacter Pylori (H. pylori) é considerada a principal causa de gastrite crônica ativa1. Estudos sugerem que esse agente desempenha importante papel na gênese da úlcera péptica2.
Vários estudos indicam um dano progressivo à mucosa gástrica induzido pela infecção do H. pylori, sendo os sintomas clínicos freqüentemente diagnosticados na fase adulta do indivíduo, porém a aquisição da infecção geralmente ocorre na infância3,4. Esses dados são de grande importância, pois é demonstrado que a duração da infecção está diretamente associada ao desenvolvimento de patologias gástricas, particularmente a doença ulcerativa péptica e o carcinoma gástrico5.
Em 1994, a bactéria foi classificada com um carcinógeno do Tipo I para câncer de estômago pelo International Agency for Research on Câncer (órgão este subordinado à Organização Mundial da Saúde)6.
Outras afecções além das gastrites, úlceras e carcinoma gástrico também estão associadas a infecção pelo H. pylori, são: linfoma de tecido linfóide associado à mucosa gástrica, dispepsia não-ulcerativa7, doenças coronarianas e cardiovasculares8,9, urticária idiopática crônica10,11.
O mecanismo exato de transmissão da bactéria ainda é desconhecido. O único fator, universalmente, aceito é de que a mesma só consegue alcançar a mucosa gástrica através da boca, pois trata-se de um microorganismo não-invasivo12. Estudos detectaram a presença do H. pylori na cavidade oral, através de técnicas de cultura microbiológica ou PCR (Reação em Cadeia da Polimerase) de materiais como saliva e placa dentária13,14, sendo que a cavidade oral tem sido proposta como um reservatório da infecção e reinfecção do H. pylori, pois a regurgitação do suco gástrico pode contaminar a boca15.
Vários estudos sugerem uma importante participação na transmissão da bactéria por via oraloral16,17,18,19.
A busca por fatores de virulência da bactéria os quais poderiam estar envolvidos na patogenicidade do H. pylori levou ao isolamento de uma proteína denominada citotoxina vacualizante (vacA) a partir do sobrenadante de cultura20 e de uma proteína de alto peso molecular denominada de Proteína Citotoxina Associada, que encontra-se envolvida no processo de inflamação da mucosa gástrica através do estímulo da liberação de interleucina-8 pelas células gástricas infectadas pela bactéria21.
Estudos realizados por Gatti et al., anteriormente demonstraram a associação dos genes cagA e vacA na gênese de doenças gástricas como gastrite crônica e doença ulcerativa, relevando a importância da detecção e genotipagem das cepas de H. pylori em mucosa gástrica22,23,24.
OBJETIVO
Visto a importância do envolvimento da bactéria na gênese de doenças gástricas, esta pesquisa objetivou em padronizar o diagnóstico molecular através da Técnica de PCR no Laboratório de Biologia Molecular das Faculdades Integradas de Ourinhos, proporcionando aos médicos gastroenterologistas um meio de diagnóstico e genotipagem molecular da bactéria, possibilitando, desta forma, um diagnóstico preciso e sensível, além da determinação genotípica da bactéria ajudando no prognóstico da infecção, uma vez que é sabido das conseqüências e envolvimento dos genes de virulência do H. pylori com o decorrer dos anos de infecção crônica.
MÉTODO
Amostras
Foram utilizados biópsias gástricas de pacientes adultos do sexo masculino e feminino os quais submeteram-se a esofagogastroduenoscopia por indicação médica prévia, onde foram coletadas amostras para o teste da Uréase para o diagnóstico bioquímico da bactéria e uma biópsia do antro gástrico para realização da extração do DNA genômico e detecção do DNA da bactéria, utilizando-se de Iniciadores (primers) específicos para amplificação de genes do H. pylori.
Extração do DNA
A extração do DNA da biópsia gástrica foi realizado de acordo com o protocolo estabelecido pelo Kit Wizard SV Genomic DNA Purification-Promega, no qual consiste na lise das células; em seguida, este lisado é colocado em contato com uma coluna para sua adsorção e, posteriormente, são realizadas lavagens da resina contendo o DNA com soluções descontaminantes, sendo, posteriormente, este eluído e ressuspendido em tampão apropriado, para que seja realizado as técnicas de amplificação gênica dos fragmentos específicos para diagnóstico da bactéria.
primers utilizados para diagnóstico da Infecção pelo H. pylori e condições da PCR
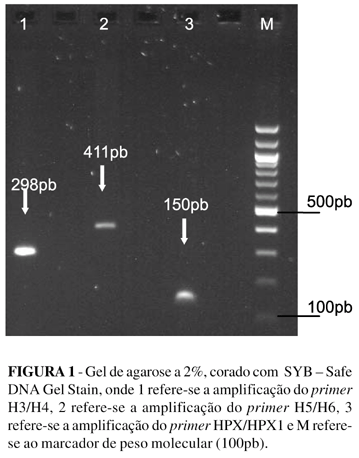
Para a detecção molecular do H. pylori através da técnica da PCR, foram utilizados dois pares de primers denominados de H3/H4, H5/H6 e HPX/HPX1 (Tabela 1), os quais amplificam um fragmento de 296pb do gene que codifica uma proteína antigênica de 26 kDa espécie especifica, 411pb do gene da UreaseA e 150pb referente um fragmento do rRNA 16S do H. pylori respectivamente.
Condições da Reação em Cadeia da Polimerase (PCR)
As condições para realização da Técnica da PCR para o diagnóstico molecular da infecção pelo H. pylori com a utilização de primers específicos encontram-se esquematizadas na tabela 2.

Visualização dos fragmentos de DNA amplificados pela Técnica da PCR
Os fragmentos de DNA amplificados foram fracionados por eletroforese em gel de agarose 2%, corados com com SYB – Safe DNA Gel Stain, documentados e analisados por Sistema de Captura de Imagem.
RESULTADOS
Todas as amplificações foram padronizadas de acordo com as condições utilizadas na tabela 1, utilizando em cada reação 2µl de DNA genomico (50ng), 2µl de cada primer (10mM), 0,2µl de Taq DNA polimerase (1 unidade), 5µl de PCR Buffer (10x), 2µl MgC12 (50mM) e 5µl de Dntps, completando o volume para 50µl de reação com água destilada pura.
Em todas as reações foram incluídos controles positivos (amostras sabidamente positivas para presença do H. pylori) e controle negativo (água ultra pura estéril). Os resultados das amplificações encontram-se na figura 1.
DISCUSSÃO
A técnica da Reação em Cadeia da Polimerase (PCR) é um método muito sensível para o diagnóstico de H. pylori e para alguns autores a técnica é o mais sensível método para tal diagnóstico28. Segundo estudo realizado por Junior FA e colaboradores em 200428, os mesmos constataram uma sensibilidade semelhante dos testes da uréase, histológico e PCR na detecção do H. pylori no estômago de crianças infectadas. Já estudos realizados por Dzierzanowska et al29, utilizando os primers com as mesmas seqüências do H3/H4 e H5/H6 constataram que o método de PCR identificou um maior número de casos de indivíduos infectados com H. pylori em relação à cultura de tecido. Segundo ainda estudos realizados por Junior FA e colaborados, em 2004, não existem diferenças entre a coleta de biópsia do antro e corpo do estômago para detecção molecular da bactéria, resultado este já obtido em estudos anteriores realizados por Carvalho e colaboradores30.
CONSIDERAÇÕES FINAIS
O estudo proposto alcançou seus objetivos que foi a padronização molecular da infecção pela bactéria H. pylori em mucosa gástrica de indivíduos infectados, fornecendo, desta forma, uma nova ferramenta e técnica extremamente sensível para detecção da infecção pelo bactéria de maneira rápida e precisa.
REFERÊNCIAS
1. KAWAGUCHI H; HARUMA K; KOMOTO K; YOSHIHARA M; SUMII K; KAJIYAMA G. Helicobacter pylori infection is the major risk factor for atrophic gastritis. Am. J. Gastroenterol. v.51, p.959-962, 1996.
2. RAUWS EAJ; TYTGAT GNJ. Cure of duodenal ulcer associated with eradication of Helicobacter pylori. Lancet. V.335, p.1233-1235, 1990.
3. BONAMICO M; MARIANI P; MAGLIOCCA FM; PETROZZA V; MONTUORI M; PEZZELA C; LUZZI I; CARPINO F. Helicobacter pylori duodenal colonization in children. Acta Pediatric. V86, p.356-360, 1997.
4. ERNEST PB; GOLD BD. Helicobacter pylori in childhood: new insighths for managing infection in children. J. Pediatr Gastroenterol Nutr. V.28, p. 462-473, 1999.
5. BOURK B; JONES N; SHERMAN PM. Helicobacter pylori infection and peptic ulcer disease in children. Pediatric Infect Dis. v 15, p. 1-13, 1996
6. IARC. Shistosomes, Liver Flukes and Helicobacter pylori. Lyon France: IARC 1994.7. BARDHAN PK; ISLAM M; MAHALANABIS D. A study of Helicobacter pylori in Bangladesh subjects with non-ulcer dyspepsia. Am J Gastroenterol. V.89, p.1301
8. PATEL P; MENDALL MA; CARRINGTON D; STRACHAN DP; LEATHAN E; MOLINEAUX N et al. Association of Helicobacter pylori and Chlamydia pneumoniae infections with coronary heart disease and cardiovascular risk factors. BMJ vol.311, P. 711-714, 1995.
9. OZDOGRU I; KALAY N; DOGAN A; INANC MT; KAYA MG; TOPSAKAL R; GUL I; KUTUKOGLU I; KILIC H; ERYOL NK. The relationship between Helicobacter pylori IgG titre and coronary atherosclerosis. Acta Cardiol. vol.62, pg. 501-5, 2008.
10. TEBBE B; GEILEN CC; SCHULZKE JD. Helicobacter pylori infection and chronic urticaria. J Am Acad Dermatol. Vol.34, p. 685-686, 1996
11. YADAV MK, RISHI JP, NIJAWAN S. Chronic urticaria and Helicobacter pylori. Indian J Med Sci. vol.62, pg.157-62, 2008.
12. KODAIRA MS; ESCOBAR AMU; GRISI S. Aspectos epidemiológicos do Helicobacter pylori na infância e adolescência. Rev saúde Publica, vol.36, pg. 356-359, 2002.
13. SALMANIAN AH; SIAVOSHI F; AKBARI F; AFSHARI A; MALEKZADEH R. Yeast of the oral cavity is the reservoir of Heliobacter pylori. J Oral Pathol Med. Feb 5, 2008.
14. LOSTER BW; MAJEWSKI SW; CZECENIKIEWICZ-GUZIK M; BIELANSKI W; PIERZCHALSKI P; KONTUREK SJ. The relationship between the presence of Helicobacter pylori in the oral cavity and gastric in the stomach. J Physiol Pharmacol. vol.57 Suppl 3, pg. 91-100, 2006.
15. DESAI HG; GILL HH; SHANKARAM K; MEHTA PR; PRABHU SR. Dental plaque: a permanent reservoir of Helicobacter pylori ? Scand J gastroenterol, vol.26, pg. 1205-1208, 1991.
16. GOODMAN JK; CORREA P; AUX HJT; RAMÍREZ H; DELANY JP; PEPINOSA OG; ET AL. Helicobacter pylori infection in the Colombian Andes : a population-based study of transmission pathaways. Am J. Epidemiol. Vol. 144, pg. 290-299, 1996.
17. ALBENQUE M; TALL F; DABIS F; MÉGRAUD F. Epidemiological study of Helicobacter pylori transmission from mother to child in África. Rev Esp Enferm Dig, vol. 78, pg. 48, 1990
18. CLEMENS J; ALPERT MJ; RAO M; HUDA S; QADR F; VAN LOON FPL; ET AL. Sociodemographic, higienic and nutritional correlates of Helicobacter pylori infection of young Bangladeshi children. Pediatr Infect Dis J. Vol.15, pg. 1113-1118, 1996.
19. SHAHAMAT M; VIVES-REGO J; PASKO-KOLVA C; PEARSON AD; COLWELL RR. Survival of Campylobacter pylori in river water. Klin Wochenschr vol. 67, pg. 63, 1989.
20. ATHERTON JC; PEEK RM; THAM KT; COVER TL; BLASER MJ. Clinical and pathological importaqnce of heterogeneity in vacA, the vacuolating cytotoxin gene of Helicobacter pylori. Gastroenterology, vol. 112, pg. 92-99, 1997.
21. KIM SY; LEE YC; KIM HK, BLASER MJ. Helicobacter pylori cagA transfection of gastric epithelial cells induces interleukin-8. Cell Microbiol. Vol.8, pg. 97-106, 2006.
22. GATTI LL; LABIO RW; SILVA LC; SMITH MAC; PAYÃO SLM. cagA positive Helicobacter pylori in Brazilian children related to chronic gastritis. Braz J Infect Dis. Vol. 10, pg. 253-257, 2006.
23. GATTI LL; SOUZA EKF; LEITE KR; BASTOS ELS; VICENTINI LR; SILVA LC; SMITH MAC; PAYÃO SLM. cagA vacA alleles and babA2 genotypes of Helicobacter pylori associated with gastric disease in Brazilian adult patients. Diag. Microbiol Infec Dis. vol 51, pg. 231-235, 2005.
24. GATTI LL; JUNIOR FA; LABIO RW; PIASON FB; SILVA LC; QUEIROZ VF; BARBIERE DP; SMITH MAC; PAYÃO SLM. Helicobacter pylori and cagA and vacA gene status in children from Brazil with chronic gastritis. Clin Exp Med. Vol. 3, pg. 166-172, 2003.
25. HAMMAR M; TYSZKIEWICZ T; WADSTROM T; O'TOOLE PW. Rapid detection of Helicobacter pylori in gastric biopsy material by polymerase chain reaction. J Clin Microbiol. Vol. 30, pg. 54-58, 1992
26. CLAYTON C; KLANTHOUS K; TABAGCHALI S. Detection and identification of Helicobacter pylori by polymerase chain reaction. J Clin Pathol. Vol. 44, pg. 515-516, 1992.
27. SCHOLTE GH; VAN DOORN LJ; QUINT WG; LINDEMAN J. Polymerase chain Reaction for detection of Helicobacter pylori in formaldehyde-sublimate fixed, paraffin-embedded gastric biopsias. Diag Mol. Pathol. Vol. 6, pg. 238-243, 1997.
28. JUNIOR FA; PAYÃO SLM; QUEIROZ VF; ELLINGER F; SILVA LC; THEREZO ALS; GATTI LL; BARBIERE D; PERES CA. Detecção gástrica de Helicobacter pylori em pacientes pediátricos sintomaticos através da reação em cadeia da polimerase (PCR), teste de uréase e exame histológico. Pediatria (São Paulo), vol. 26, pg. 34-42, 2004.
29. DZIERZANOWSKA D; GZYL A; ROZYNEK E. PCR for identification and typing of Helicobacter pylori isolated from children. J Physiol. Pharmacol vol. 47, pg. 101-114, 1996.
30. CARVALHO AS; QUEIROZ DM; MENDES EN; ROCHA GA; PENNA FJ. Diagnosis and distribuition of Helicobacter pylori in the gastric mucosa of symptomatic children. Braz J Med Biol Res. vol.24, pg. 163-166, 1991.
 Endereço para Correspondência:
Endereço para Correspondência:
Prof. Dr. Luciano Lobo Gatti
Laboratório de Biologia Molecular
Faculdades Integradas de Ourinhos – FIO
Rodovia BR 153 Km 339 + 400m
Bairro Água do Cateto - Ourinhos/SP
e-mail:lobogatti@yahoo.com.br
Fone: 14 – 3302 6400 (Ramal 459)
1Trabalho realizado no Laboratório de Biologia Molceular das Faculdades Integradas de Ourinhos – FIO














