Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim de Pneumologia Sanitária
versão impressa ISSN 0103-460X
Bol. Pneumol. Sanit. v.8 n.2 Rio de Janeiro dez. 2000
Um caso fácil: um diagnóstico rápido
Rogério de M. BártholoI; Ryssia A. FloriãoII; Lilian Pinto de A. OliveiraIII; Maria da Glória P. de MoraesIV
IServiço de Pneumologia do Hospital Municipal Cardoso Fontes-RJ e Setor de Pneumologia do HCFF-UFRJ
IIServiço de Dermatologia do Hospital Municipal Cardoso Fontes -RJ
IIIServiço de Pneumologia do Hospital Municipal Cardoso Fontes-RJ
IVServiço de Anatomia Patológica do Hospital Municipal Cardoso Fontes,RJ
RESUMO
Os autores relatam um caso de paracoccidioidomicose (PCM) com comprometimento pulmonar, ganglionar e de mucosas. O diagnóstico foi feito rapidamente pela detecção do parasita na secreção aspirada, por agulha, de um gânglio submandibular.
Palavras chave: paracoccidioidomicose, pulmões, gânglios linfáticos
SUMMARY
The authors relate a case of paracoccidioidomycosis (PCM) involving the lungs,mucosal surfaces and lymphatic nodes. The fungus was detected in secretions which were aspirated by needle from submandibular adenopathy.
Key words: paracoccidioidomycosis, lungs, lymphatic nodes.
Apresentação do caso
MPS, 39 anos, natural do Espírito Santo, solteiro, lavrador até há 1 ano, quando passou a trabalhar como pedreiro. Reside em Vargem Grande, Rio de Janeiro.
Queixa principal: "caroço no pescoço".
História da doença atual: Refere início do quadro há 2 meses, com aparecimento de adenomegalias cervicais, concomitante a ulceração da mucosa oral. Logo após, surgiu astenia intensa e observou aumento do volume dos gânglios com comprometimento das cadeias submandibulares e submentonianas. Procurou atendimento médico, que resultou na prescrição de ampicilina, que usou sem melhora. Refere perda ponderal de 5 kg em 2 meses. Há 10 dias notou tosse com expectoração clara. Voltou a procurar o médico, que solicitou Raios X do tórax. Alterações reveladas neste exame, determinaram o encaminhamento do caso ao Serviço de Pneumologia do Hospital Cardoso Fontes. Tabagista desde os 17 anos. Carga tabágica 22 maços ano. Etilista moderado. O paciente trazia resultados negativos para BAAR, em três amostras de escarro pesquisadas.
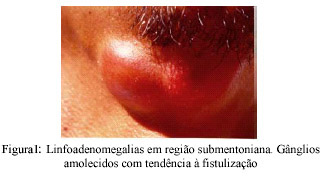
Exame físico: Lúcido, mucosas levemente hipocoradas, hidratado. Adenomegalias nas cadeias cervicais anteriores, submandibulares e submentonianas. Nesta última, gânglios volumosos de consistência amolecida, com tendência à fistulização. (Fig.1) Presença de lesão ulcerosa comprometendo as mucosas labial e gengival, evidenciando em sua superfície fino pontilhado hemorrágico. (Fig.2) Eupneico, pulmões limpos. Ritmo cardíaco regular em dois tempos, bulhas normofonéticas. Sem cianose ou sudorese. Abdome flácido, peristalse presente. Sem hepato ou esplenomegalia. Não apresentava edemas nem anormalidades neurológicas.

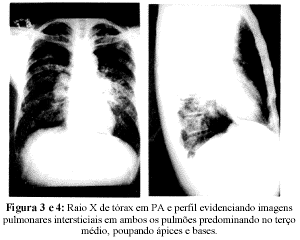
Raios X do tórax: Infiltrado intersticial bilateral predominando no terço médio e poupando ápices e bases (Figs. 3 e 4).
Exames laboratoriais: Hemograma completo: Leucócitos 11,6 mil/mm3; Hemácias 3,7 milhões/mm3; Hemoglobina 11,0 g/mm3; Hematócrito 33%; VHS 90 mm/1ahora; Basófilos 0%; Eosinófilos 12%; Mielócitos 0%; Metamielócitos 0%; Bastões 3%; Neutrófilos 72%; Linfócitos 7%; Monócitos 6%; Uréia 26mg/dl; Creatinina 0.7mg/dl; Glicose 75 mg/dl; Potássio 4.2 mEq/l; Sódio 139 mEq/l.
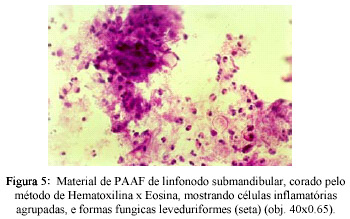
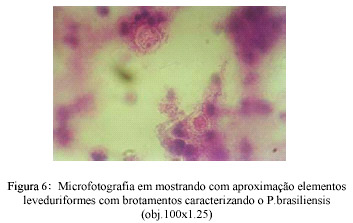
Secreção aspirada por agulha do gânglio submandibular: material corado por HE, mostrando células inflamatórias agrupadas e formas fúngicas leveduriformes, evidenciando brotamento característico de Paracoccidioides brasiliensis (Figs.5 e 6).
Discussão
A paracoccidioidomicose (PCM) é uma doença granulomatosa sistêmica causada pelo P. brasiliensis. A contaminação se dá por via inalatória, com a penetração do fungo nos pulmões, podendo seguir-se disseminação linfo-hematogênica. Com a propagação da doença, os órgãos mais freqüentemente acometidos são as membranas mucosas, os gânglios linfáticos, a pele e as adrenais. Não há contaminação de pessoa para pessoa.
O P. brasiliensis é um fungo termo-dimórfico, isto é, toma forma de levedura a 37o C e, de micélio, à temperatura ambiente(1) . As alterações morfológicas que ocorrem durante esta conversão foram bem estudadas por Carbonell(2). O traço mais característico da forma em levedura é a sua aparência em "roda de leme", isto é, a presença de múltiplas células-mãe em brotamento, circundadas por várias células-filha periféricas, de grande importância para o diagnóstico da doença(3) .
A idéia prevalente é de que o habitat deste fungo não são nem o homem nem os animais que o circundam, com raras evidências apontando para o solo de áreas endêmicas(4). Albornoz, na Venezuela, isolou o P. brasiliensis do solo, o que pareceu reforçar a teoria de que seres humanos são infectados por inalação e que a localização primária da doença é o pulmão. O solo da área onde houve o isolamento tinha pH tendendo para ácido, portanto, indicando ser rico em componentes orgânicos(5). Negroni, em 1966, isolou este fungo do solo da Argentina(6).
Naiff et al, no Pará, isolaram P.brasiliensis de baços, fígados e pulmões de uma série de tatus saudáveis. Este animal pode trazer uma pista para a presença do fungo em lugares naturais(7, 8).
Vergara et al, em 1998, publicaram um estudo em Ibiá, Minas Gerais, Brasil, região onde o P.brasiliensis, recentemente, tinha sido isolado do solo. Capturaram 21 tatus da região e, em um destes, detectaram um granuloma pulmonar contendo P.brasiliensis. Este achado estabelece uma ligação entre as duas espécies e sugere que infecções fúngicas em seres humanos e tatus ocorrem no mesmo microambiente de agricultura e florestas que eles compartilham(9). No mesmo ano e no mesmo local, o isolamento do P.brasiliensis do solo de uma plantação de café, sugere que este é um de seus habitats e reforça a hipótese de aquisição de paracoccidioidomicose a partir de atividades agrícolas nessas áreas(10).
Bagagli et al confirmaram que o tatu é um reservatório natural do P.brasiliensis e um hospedeiro silvestre do fungo(11).
A paracoccidioidomicose é a micose sistêmica mais freqüentemente diagnosticada na América Latina. Uma característica marcante da paracoccidioidomicose é a sua distribuição geográfica, sendo restrita à América Latina, do México [23o N] à Argentina [34o S]; porém a doença não ocorre, em todos os países, dentro destes limites. O Brasil é o país onde a maioria dos casos foi relatada, seguido por Colombia, Venezuela, Argentina, Peru e Equador(4). Jankey et al, em 1986, publicaram um caso em Trinidad que foi diagnosticado e tratado como Sarcoidose e só à necropsia se revelou tratar-se de paracoccidioidomicose(12). Além deste caso, esta micose só tem sido relatada, raramente, nas ilhas do Caribe. Não há referência da doença na Guiana, Guiana Francesa, Suriname, Chile e Nicarágua.
Em países onde a doença é endêmica, os casos não são distribuídos homogeneamente em todo o território, mas tendem a se concentrar em torno de florestas úmidas, subtropicais ou tropicais. As condições predominantes em locais com alta endemicidade são temperaturas discretas (17 a 24o), chuvas adequadas (900 a 1810 mm/ano), florestas abundantes, riqueza de cursos d'agua e de árvores nativas, invernos curtos e verões ensolarados(4).
No Brasil, a doença é mais prevalente nas regiões sudeste, sul e centro-oeste. Alguns casos têm sido relatados fora de áreas endêmicas. Contudo, em tais casos, o paciente visitou ou viveu previamente em um dos países reconhecidamente endêmicos. O longo período decorrido entre a saída da região endêmica e as manifestações da doença foi prolongado, em média, 15,.3 anos(3). Angelov relatou um caso ocorrido na Europa que apresentou a doença 30 anos após seu retorno do Brasil(13).
Os casos descritos em europeus e norteamericanos que desenvolveram a doença algumas décadas após abandonar áreas endêmicas na América Latina, mostram que há infecções por este fungo que podem permanecer dormentes por longos períodos(30).
A PCM só excepcionalmente é observada em crianças (3%) e adultos jovens (10%), sendo diagnosticada com mais frequência entre 30 e 60 anos(14). Teste cutâneo com paracoccioidina em indivíduos saudáveis em áreas endêmicas indica que, se bem que a reatividade seja baixa em crianças e adultos jovens, o contato com P. brasiliensis é importante durante as primeiras décadas da vida. Pereira(15), em Goiânia, realizou um inquérito epidemiológico usando intradermorreação com antígeno polissacarídio de Fava Netto e encontrou positividade de 11,26% no grupo etário de 0 a 10 anos, 16,5% da 2o à 5o década, 36,8% na 6o década e 56,2% em maiores de 60 anos.
A incidência desta micose é maior em homens que em mulheres (relação 13:1), podendo aumentar significativamente esta taxa em países como a Colômbia (até 48:1), Equador e Argentina(16). Contudo, Greer et al, avaliando testes cutâneos para paracoccidioidomicose em indivíduos saudáveis, em uma mesma área, não encontraram diferenças entre homens e mulheres. Os mesmos autores mostraram ainda que também não havia uma incidência maior, com relação ao sexo, entre crianças com doença manifesta (17). A evidência de que a micose ocorre pós-puberdade, predominantemente em homens, levou a conjecturas que consideravam que fatores hormonais, crìticamente, poderiam afetar a sua patogênese (18).
Em 1984, Restrepo et al mostraram que estrogênios inibiam a transformação da forma micelial até a forma de levedura do P. brasiliensis in vitro. É importante notar que a transformação de micélio em levedura ocorre como primeira etapa "in vivo" no estabelecimento da infecção. O sobrenadante após ultracentrifugação de isolados de culturas de espécimes clínicas estudadas, evidenciou uma proteína que se ligava ao esteróide que tem alta afinidade para o 17 Beta estradiol. Os autores sugeriram que esta proteína de ligação poderia representar um receptor de hormônio do fungo que pode também reconhecer estrogênios dos mamíferos. A hipótese seria que a capacidade do estrogênio de diminuir ou retardar a transformação de micélio até levedura no local inicial da infecção poderia contribuir para a marcada resistência das mulheres à doença, e que esta proteína descrita poderia ser o local molecular da ação(18).
Salazar et al, em 1988, mostraram que os conídios produzidos pelo P. brasiliensis são inibidos pelos estrogênios dos mamíferos em sua conversão para a forma de leveduras. No estudo prévio de Restrepo et al tinha sido mostrado que estrogênios igualmente inibem a transição micélio-levedura. Conídios e não fragmentos miceliais são hoje considerados os propágulos infecciosos naturais. Esses achados com conídios suportam a hipótese de que estrogênios afetando as interações iniciais hospedeiro/parasita, por suprimir a conversão da forma parasítica do organismo, são, no mínimo em parte, responsáveis pela maior resistência das mulheres à paracoccidiodomicose(19).
A maioria dos pacientes acometidos são agricultores. Contudo, alguns casos ocorrem em indivíduos que têm contato pouco freqüente com o solo ou com produtos vegetais(20).
A influência racial é difícil de ser avaliada por causa da miscigenação da população. A raça branca parece predominar(20).Valle et al publicaram um caso ocorrido em um indígena da tribo Suruí em Rondônia, enfatizando a raridade da doença na raça indígena(21) .
Estudos de antígenos de histocompatibilidade em pacientes portadores de paracoccidiodomicose têm mostrado correlações diferentes. Restrepo et al demonstraram associação de HLA-A9 e HLA-B13 em pacientes colombianos com a doença(22). Gonzalez et al encontraram a ocorrência de paracoccidioidomicose positivamente correlacionada à presença de HLA-B13 em pacientes venezuelanos(23). No Brasil, Lacerda et al descreveram a associação de HLA-B 40 com esta micose(24). As discrepâncias poderiam ser explicadas por diferenças étnicas entre as populações. Goldani et al estudaram em 1991, 80 pacientes com PCM e demonstraram ser altamente significativo o aumento na incidência de HLA-B40 e HLA-CW1 na população de pacientes comparada aos controles. O risco relativo de ocorrência de paracoccidioidomicose foi 29,2 e 8,8 respectivamente, entre pacientes com HLA-B40 e HLA-CW1(25).
O exato mecanismo de infecção suscitou muito debate principalmente pela falta de conhecimento no que concerne ao habitat natural do fungo. Hoje há concordância de que a infecção é adquirida por inalação e não por trauma como se acreditara outrora. Assim sendo, a forma micélio ou o conídio produzido por este, devem atuar como propágulos infectantes, a exemplo do que ocorre com outros patógenos fúngicos dimórficos, como o Histoplasma capsulatum, o Coccidioidis immitis, e o Blastomyces dermatitidis (26) .
Num elegante experimento com camundongos BALB infectados por via intranasal com conídios de P.brasiliensis, os animais foram sacrificados em intervalos de até 6 meses e estudados por histopatologia e cultura de órgãos. Logo após a inalação, secções de pulmão mostraram que conídios tinham chegado aos alvéolos. Em 12 horas, conídios estavam se transformando em leveduras, com múltiplos brotamentos, aparecendo por 18 horas. Inicialmente, o infiltrado celular era composto por leucócitos polimorfonucleares. Seis dias mais tarde, linfócitos, plamócitos e macrófagos predominaram. Células gigantes multinucleadas apareceram só após 6 semanas. A taxa de infecção pulmonar determinada pela cultura de órgãos foi alta (82 de 83 camundongos estudados). A infecção experimental foi progressiva como indicado, com o tempo, pelo aumentado número de fungos viáveis. Os resultados do estudo demonstraram que conídios produzidos pela forma de micélio do P.brasiliensis são infectantes, produzindo doença ativa em animais saudáveis. As leveduras crescem no parênquima, produzindo uma doença progressiva que se dissemina para outros órgãos. É provável que esta seja a forma de aquisição da doença pelos seres humanos(26) . Se o hospedeiro é imunocompetente o crescimento fúngico é detido e não ocorre nenhum dano aparente para o paciente. Esta é a forma clínica da Paracocidiodomicose-infecção que se apresenta de maneira subclínica. Nesses pacientes, o foco primário desaparece e o fungo é geralmente destruído, porém as células do hospedeiro retêm uma memória imunológica da infecção. Se, por acaso, ocorre uma alteração no equilíbrio hospedeiro/parasita, por imunossupressão ou outras causas, aí então a infecção progride dando origem à doença(27-28).
Do ponto de vista clínico, a doença se apresenta sob duas formas: a forma juvenil aguda (sub-aguda) e a forma crônica do adulto. A primeira tem uma evolução mais grave que a última. Em ambas, porém, as funções imunes mediadas por células são anormais e, se não for feito tratamento específico, a mortalidade é alta(3). Quando o paciente é submetido à terapia adequada, o prognóstico é bom mas, geralmente, lesões residuais permanecem como seqüelas. É a forma residual. Se tais lesões albergam fungos viáveis, podem ocorrer recidivas(28-29). A remissão da doença é, em geral, acompanhada de significativa fibrose pulmonar(30).
A doença mais freqüentemente se origina por reinfecção endógena. Também pode ocorrer reinfecção exógena(27-28). Ortega et al estudaram 4 casos de lesões calcificadas em que formas características de P.brasiliensis foram encontradas. É sugerido que esses achados podem representar, patologicamente, o substrato de infecções não aparentes e de formas benignas da doença. Em três desses casos o P.brasiliensis foi encontrado, por acaso, em necrópsia de rotina. O quarto era um caso de Paracoccidioidomicose sob observação por 22 anos, em que as lesões tinham se tornado calcificadas, mas nenhum tratamento específico para a doença foi feito(31).
A PCM é adquirida pela inalação de conídios infectantes da fase saprofitária do P.brasiliensis(32). Nos alvéolos, estes são fagocitados pelos macrófagos alveolares, iniciando-se um processo inflamatório no parênquima pulmonar. Nessa fase, ocorre disseminação hematogênica para outros locais. Se o hospedeiro é normal, todos esses focos começam a regredir com o estabelecimento da imunidade celular, ocorrendo necrose envolvida por fibrose. Estas lesões regridem espontaneamente, tornam-se residuais, podendo albergar fungos viáveis latentes. Eventualmente evoluem para calcificação.
A evolução para PCM-doença se dá em indivíduos com algum grau de deficiência imunológica. Em geral, a PCM se apresenta nas formas infanto-juvenil disseminada (aguda ou subaguda) e crônica, que pode ter localização pulmonar ou se apresentar de forma disseminada crônica.
Paracoccidioidomicose-doença:
Forma juvenil aguda ou subaguda: representa 3 a 5% dos casos. Caracteriza-se por um curso mais rápido (semanas ou meses) e por marcante envolvimento do sistema retículo-endotelial (baço, fígado, gânglios e medula óssea). A função imune mediada por célula é gravemente deprimida nesses pacientes, a maioria dos quais é constituída por crianças ou adultos jovens(33-34). A forma disseminada é multiforme, comumente acomete vários órgãos, sendo raro o comprometimento pulmonar(34). Apesar de não haver manifestações clínicas ou radiológicas de comprometimento pulmonar, pode-se isolar o fungo do lavado brônquico, evidenciando a participação do pulmão como porta de entrada, mesmo na ausência de alteração radiológica(35) .
Forma Crônica: representa mais que 90% dos casos, a maioria constituída por homens adultos(3). Em aproximadamente 25% dos casos, o pulmão é o único órgão afetado. Em alguns casos, entretanto, o envolvimento pulmonar pode ser silencioso e, quando o paciente procura assistência médica, a doença já se apresenta disseminada (3).
A paracoccidiodomicose é uma doença que tem tendência à disseminação, sendo pouco freqüentes os quadros pulmonares isolados(36).
A forma disseminada crônica corresponde à maior parte dos pacientes. Nesses casos se constata, mais freqüentemente, o envolvimento de outros órgãos - pele, mucosas das vias aéreas superiores, tubo digestivo e linfonodos - como ocorreu em nosso paciente.
Sintomatologia inespecífica como tosse, expectoração, perda ponderal e anorexia tem sido relatada(3). A febre ocorre raramente e pode ser um sinal de gravidade. Existe, com frequência, uma dissociação clínico-radiológica, com quadro radiológico exuberante e manifestações clínicas muitas vezes discretas(3).
Na forma crônica disseminada, os sintomas são variáveis, correspondendo aos orgãos e aos sistemas envolvidos., Com freqüência, ocorrem lesões nas mucosas orais e nasais, pele, gânglios linfáticos e adrenais. Menos freqüentemente, podem ocorrer envolvimento ocular, destruição óssea, e comprometimento dos sistemas nervoso e vascular(3).
As lesões tegumentares ou cutâneo-mucosas são de grande importância no quadro clínico de PCM. Devem ser ressaltadas as lesões da mucosa orofaríngea, que assumem um aspecto altamente sugestivo da doença. As mais importantes características do comprometimento orofaríngeo são: lesão ulcerosa superficial; aspecto lardáceo, lembrando toucinho; superfície finamente granulosa; pontos sanguíneos mais ou menos numerosos, constituindo um pontilhado hemorrágico peculiar; e infiltração endurecida à palpação(37).
A lesão bucal situa-se mais freqüentemente nas gengivas, podendo causar amolecimento e expulsão dos dentes(37). Pode, porém, ocorrer em qualquer ponto da mucosa buco-faríngea, do lábio à parte posterior da faringe (nas bochechas, no assoalho da boca, no palato, na língua ou na laringe)(38).
Clinicamente as lesões mucosas apresentam erosão com pontilhado hemorrágico característico, denominado estomatite moriforme. Evolutivamente as lesões progridem, tornando-se úlcero-vegetantes, atingindo, por vezes, grande extensão da cavidade bucal, faringe, laringe e fossas nasais(38). É alta a incidência de queilite angular simples inespecífica ou macroqueilite específica com acentuado linfedema. Um sinal quase sempre presente é a sialorréia (37). O comprometimento laríngeo pode determinar disfonia ou afonia por lesão das cordas vocais(37).
Quando a infecção atinge os lábios e a região perioral, pode ocorrer tumefação e aparecimento de lesões úlcero-vegetantes e crostosas. Os linfonodos aumentam de volume e, eventualmente, fistulizam. Isto ocorre mais comumente na região cervical, por vezes lembrando o escrofuloderma(37).
Em relação às lesões cutâneas, estas podem ser variadas e polimorfas. Podem também ser únicas, pouco numerosas ou, em casos mais graves, múltiplas. São encontradas em torno da boca e das narinas. Comumente são lesões eritemato-papulosas, pápulo-pustulosas, pápulo-vegetantes e úlcerocrostosas( 38). Raramente podem se apresentar como lesões cutâneas palmares ou plantares(37).
Manns et al relataram um caso de um homem que apresentou com paracoccidioidomicose mais de 15 anos após deixar a América do Sul, onde viveu, por alguns anos, no Brasil e na Argentina. Morava desde então no Canadá, evidenciando-se o quadro com perda ponderal, lesões pulmonares, mucosas e cutâneas. Não respondeu à terapêutica convencional, chegando ao êxito letal por embolias arteriais recorrentes, possìvelmente devido à aortite por paracoccidioidomicose(39).
Achados radiológicos
Manifestações ao exame radiológico simples de tórax variam com o estágio evolutivo da doença. A maioria dos casos é detectada nas formas avançadas. As imagens em geral são bilaterais, simétricas, apresentam preferência pelos terços médios e bases, poupando os ápices e as partes mais periféricas das bases. As lesões cavitárias são pouco freqüentes, e relativamente pequenas. Não se observam adenomegalias. Ápices e seios costofrênicos são livres com zonas de enfisema nos ápices e bases(40). As cavitações e adenomegalias são mais evidenciadas à TC.
Mendes et al(36) referem que a radiologia simples de tórax revela lesões do tipo intersticial em 40% dos pacientes e mistas, com predomínio de comprometimento intersticial, em 42% dos casos. Segundo os mesmos autores, todos os tipos de lesão intersticial podem ser encontrados em pacientes com paracoccidioidomicose, sendo porém mais freqüentes as lesões reticulares espessas (22% dos pacientes), as reticulonodulares com predomínio de retículos espessos (20%), e as retículonodulares com predomínio de nódulos com diâmetro superior a 2 mm (31%). As lesões alveolares ou mistas, com predomínio de comprometimento alveolar, bilaterais, simétricas, e poupando ápices e bases, que lembram asas de borboleta são, em geral, pouco freqüentes, embora quando presentes sejam altamente sugestivas da etiologia paracoccidioidomicótica(36). Podem ocorrer também imagens radiológicas do tipo tumoral, pneumônico ou massas cavitadas. Calcificações pleurais ou pulmonares são, em geral, ausentes. Reis et al relataram, em 1986, um caso de paracoccidiodomicose disseminada aguda com extenso derrame pleural, sendo o fungo visualizado à biopsia pleural(41). Entretanto, derrame e espessamento pleurais, são raros e discretos(36).
O diagnóstico diferencial radiológico deve ser feito com tuberculose, neoplasia, fibrose intersticial, granulomatose de Wegener, abscessos piêmicos e outras doenças(3).
A tomografia computadorizada de alta resolução tem permitido uma melhor avaliação do tipo predominante da lesão, a extensão da doença e a resposta terapêutica. O padrão tomograficamente predominante é um infiltrado intersticial retículonodular, envolvendo principalmente o feixe linfático broncovascular. Ocorrem também bronquiectasias de tração e enfisema cicatricial em quase todos os pacientes. A tomografia computadorizada de alta resolução permite ainda a melhor avaliação do mediastino, onde se destaca a linfadenopatia, freqüentemente de localização nas regiões carinal e retrocava(42).
Funari et al avaliaram 41 pacientes consecutivos com diagnóstico de paracoccidioidomicose crônica, utilizando tomografia computadorizada de alta resolução(43). Destes, 93% tinham TC anormais. Foram evidenciados espessamento septal interlobular em 36 pacientes (88%), nódulos de diâmetro entre 1 a 25 mm em 34 (83%), espessamento intersticial peribroncovascular em 32 (78%), opacidades centrilobulares em 26 (63%), linhas intralobulares em 24 (59%), opacidades em vidro fosco em 14 (34%), cavitação em 7 (17%), consolidação de espaço aéreo em 5 (12%), bronquiectasias de tração em 34 (83%), e enfisema paracicatricial em 26 (68%). Em aproximadamente 90% dos pacientes as anormalidades eram bilaterais, simétricas e envolviam todas as zonas pulmonares.
Diagnóstico laboratorial:
A confirmação diagnóstica dessa micose deve ser feita por métodos laboratoriais. O isolamento do fungo a partir de qualquer material deve ser tentado.
O melhor e mais rápido meio de estabelecer o diagnóstico desta doença fúngica se faz pelo exame direto de espécimes clínicas, o que permitirá a visualização dos elementos fúngicos(3). O exame direto a fresco, entre lâmina e lamínula, em meio a uma gota de hidróxido de potássio, tem um excelente rendimento(44).
Ao exame de microscopia ótica se pode observar a morfologia e o modo de reprodução em exogemulação múltipla, características da forma parasitária do Paracoccidioides brasiliensis (36).
A pesquisa do parasita no escarro é mais difícil que em raspados de lesões tegumentares e em secreções ganglionares, onde é grande a quantidade de fungos(36). Essa pesquisa foi inicialmente feita por simples exame direto e a fresco, entre lâmina e lamínula. Após foi sugerido clarificar o escarro com soda ou potassa e, por fim, sua homogeneização. A taxa de positividade no escarro homogeneizado é muito maior que a verificada no exame micológico comum(36). Lavado brônquico, líquor, urina e homogeneizado de escarro devem ser previamente centrifugados(32).
A cultura de P.brasiliensis pode ser feita usando-se os meios de Mycosel (BBL) ou Mycobiotic agar (Difco), SABHI (Difco), agar-Sabouraud e agar-extrato de levedura(36).
A transformação da forma filamentosa para a leveduriforme, que caracteriza a espécie, deve ser feita semeando-se o fungo em meio de Kelley, mantendo-se o cultivo a 35-36o (36).
Algumas vezes, é necessário o exame histopatológico, sendo que a coloração dos cortes teciduais pela prata (Gomori-Grocot) é melhor que a hematoxilina/eosina para visualização da estrutura parasitária(32).
Entre os testes sorológicos empregados na detecção de anticorpos anti-P. brasiliensis temos a reação de fixação de complemento, a reação de precipitação em tubos, a reação de imunodifusão dupla, a contra imunoeletroforese, a reação de imunofluorescência indireta e os métodos enzimáticos(36). A técnica de imunodifusão dupla é muito sensível e específica. A reação de fixação de complemento é de menor sensibilidade e especificidade(32).
Pesquisas recentes apontaram uma glicoproteína de peso molecular 43000 (gp43) como um componente antigênico específico nos filtrados de cultura de P.brasiliensis (45).
Assim é que uma comissão de especialistas padronizou um teste sorológico e um antígeno para serem usados. A reação padronizada foi a de imunodifusão dupla, com o uso de um exo-antígeno rico em gp 43, obtido de amostra de P.brasiliensis com 7 dias de cultivo, que apresenta grande sensibilidade e especificidade(36).
Outros exames complementares importantes nesta doença fúngica são o hemograma e a eletroforese de proteínas séricas. No primeiro, a presença de anemia e eosinofilia são características(46). A VHS está elevada em quase todos os casos. A eosinofilia que independe de parasitoses intestinais, por vezes é tão marcante que necessita apurado diagnóstico diferencial com síndromes hipereosinofílicas(46).
Na eletroforese de proteínas costuma ocorrer hipoalbuminemia e hipergamaglobulinemia. Parece que frações da parede celular do P.brasiliensis poderiam desempenhar um papel importante na hipergamaglobulinemia associada a esta micose(47).
Santos et al relataram 6 casos de paracoccidioidomicose pulmonar com variadas apresentações clínicas e radiológicas que foram diagnosticados por punção aspirativa com agulha fina. Sugerem que o uso mais freqüente desta técnica poderia permitir um diagnóstico mais precoce desta doença(48).
Paracoccidiodomicose e aids:
Apesar do crescente número de casos de aids, poucos casos de paracocidioidomicose têm sido relatados em pacientes acometidos por esta virose. Goldani et al(49), em uma revisão da literatura, avaliaram detalhadamente 27 casos. A doença ocorreu em pacientes que não estavam recebendo tratamento profilático para P.carinii com trimetoprim e sulfametoxazol, droga também eficaz contra P.brasiliensis. O quadro clínico se evidenciou com febre prolongada, perda ponderal, linfadenopatia generalizada, esplenomegalia, hepatomegalia e erupção cutânea. A despeito da terapia empregada, a taxa de mortalidade de paracocidioidomicose é alta entre pacientes com aids (30%). Os autores enfatizam ainda a importância de manter em mente a possibilidade desta micose em pacientes com aids que residam ou tenham vivido em áreas endêmicas. Bethlem et al(42) referem que uma das razões para justificar o pequeno número de casos de associação entre as duas doenças seria a não superposição das áreas endêmicas de ambas. A aids seria uma doença urbana, enquanto a paracoccidioidomicose seria uma doença rural.
Referências bibliográficas:
1. Albornoz MB. Isolation of paracoccidiodes brasiliensis from rural soil in Venezuela Paracoccidioidomycosis . Proc First Pan Am Symp. Colombia: Pan American Health Organization, 1972. p. 71-75 (Sci. Publ. No. 254)
2. Angelov N. Blastomycose sud-américaine chez un laboureur bulgare revenu depuis 30 ans du Brésil. Mycopathologia 1964; 24: 265-70.
3. Angulo-Ortega A. Calcification in paracoccidioidomycosis: are they the morphological manifestations of subclinical infections? Paracoccidioidomycosis. Proc. First Pan Am. Symp. Colombia: Pan American Health Organization; 1972. p. 129-33 (Sci. Publ. No. 254)
4. Bagagli E, Sano A, Coelho KL, Alquati S, Miyagi M, De Camargo ZP, Gomes GM , Franco M, Montenegro MR. Isolation of paracoccidioides brasiliensis from armadillos(dasypus novemcinctus) captured in an endemic area of paracoccidioidomycosis. Am J Trop Med Hyg 1998 Apr; 58 (4):505-12.
5. Bethlem EP, Capone D, Maranhão B, Carvalho CRR, Wanke B. Paracoccidioidomycosis. Curr Opin Pulm Med 1999;5: 319-25.
6. Borelli D. Prevalence of systemic mycosis in Latin America.Proc Int Symp Mycoses.Colombia: Pan American Health Organization; 1970. P.28-38 (Sci.Publ. No. 205).
7. Brummer E, Castaneda E, Restrepo A. Paracoccodioidomycosis: an update. Clin Microbiol Rev 1993 Apr; 6 : 89-117.
8. Camargo Z P, Taborda C P, Rodrigues EG, Travassos LR. The use of cell-free igens of paracoccidiodes brasiliensis in serological tests. J Med Vet Mycol 1991;29:31-38.
9. Carbonell LM. Ultrastructure of dimorphic transformation in paracoccidioides brasiliensis. J Bacteriol 1969; 100: 1076- 82.
10. Franco MF, Montenegro MRG, Mendes RP, Marcos AS, Dillon NL, Mota NGS. Paracoccidioidomycosis:a recently proposed classification of its clinical forms. Rev Soc Bras Med Trop 1987; 20-129-32.
11. Funari M, Kavakama J, Shikanai Yasuda MA, Castro LG, Bernard G, Rocha MS, Cerri GG, Müller NL. Chronic pulmonary paracoccidioidomycosis (South American blastomycosis): high-resolution CT findings in 41 patients. Am J Roent 1999 Jul; 173(1):59-64.
12. Giraldo R, Restrepo A, Gutierrez F, Robledo M, Londono F, Hernandez H, Sierra F, Calle G. Pathogenesis of paracoccidioidomycosis: a model based on the study of 46 patients. Mycopathologia 1976; 58:63-70.
13. Goldani LZ, Monteiro CMC, Donadi EA, Martinez R, Voltarelli JC. HLA antigens in Brazilian patients with paracoccidioidomycosis. Mycopathologia 1991; 114: 89-91.
14. Goldani LZ, Sugar AM. Paracoccidioidomycosis and AIDS: na overview. Clin Infect Dis 1995; 21(5):1275-81.
15. Gonçalves AP. Paracoccidiodomicose. In: Machado-Pinto J. Doenças infecciosas com manifestações dermatológicas. Rio de Janeiro: Medsi ; 1999. p.411-37.
16. Gonzales NM, Albornoz M, Rios R, Prado L. Paracoccidiodomycosis y su relacion com el sistema HLA. Anais do II Encontro sobre Paracoccidioidomicose; 1983 ; Botucatu , Brazil: 1983.
17. Greer DL, Restrepo A. La epidemiología de la paracoccidioidomicosis. Bol. Of. Sanit. Panam 1977; 83:428-45.
18. Janky N, Raju GC, Borrow S. Paracoccidioidomycosis in Trinidad. Trop GeogrMed 1987; 39 : 83-85.
19. Kanetsuna F. Biochemical characteristics of paracoccidioides brasiliensis. Paracoccidioidomycosis . Proc First Pan Am. Symp. Colombia: Pan American Health Organization; 1972. p. 31-37 (Sci. Publ. No. 254).
20. Lacaz CS, Porto E, Martins JEC. Paracoccidiodomicose. In: Micologia Médica. 8ª ed. Sarvier; 1991. p.248-61.
21. Lacerda GB, Arce-Gomez B, Queiroz-Telles F. Increased frequency of HLA-B 40 in patients with paracoccidioidomycosis. J Med Vet Mycol 1998; 26: 253- 256.
22. Londero AT, Melo IS. Paracoccidioidomycosis in chilhood : a critical review. Mycopathologia 1983; 82:49-55.
23. Manns BJ, Baylis BW, Urbanski SJ, Gibb AP, Rabin HR. Paracoccidioidomycosis: case report and review. Clin. Inf. Diseases 1996;23:1026-32.
24. Marques S A, Franco M, Mendes RP, Silva NCA, Baccili C, Curcelli ED, Ferracin ACM, Oliveira CS, Tagliarini JV, Dillon NL. Aspectos epidemiológicos da paracoccidioidomicose na área endêmica de Botucatu ( São Paulo-Brasil). Rev Inst Med Trop 1983; 25:87-92.
25. McEwen JG, Restrepo BI, Salazar ME., Restrepo A. Experimmental murine paracoccidioidomycosis induced by the inhalation of conidia. J Med Vet Mycol 1987;25:165-75.
26. Mendes R P, Franco MF. Paracoccidioidomicose pulmonar. In: Pneumologia - atualização e reciclagem V. II. São Paulo: Atheneu/ Sociedade Paulista de Pneumologia e Tisiologia; 1998. p.271-284.
27. Montenegro MRG. Formas clínicas de paracoccidioidomicose. Rev Inst Med Trop 1996; 28:203- 04.
28. Naiff RD, Barret TV. Novos registros de paracoccidioides brasiliensis em tatus (dasypus novemcinctus) Resumo do XI Congresso Brasileiro de Parasitologia 1989. São Paulo: 1989.
29. Naiff RD, Ferreira LC, Barret TV, Naiff MF, Arias JR. Enzootic paracoccidioidomycosis in armadillos ( dasypus novemcinctus) in the state of Para. Rev Inst Med Trop 1986; 28:19-27.
30. Naranjo MS, Trujillo M, Munera MI, Restrepo P, Gomez I. Treatment of paracoccidioidomycosis with itraconazole. J Med Vet Mycol 1990; 28:67-76.
31. Negroni P. El paracoccidioides brasiliensis vive saprofiticamente en el suelo argentino. Prensa Med Argent; 53:2381-82.
32. Oliveira SL, Silva MF, Soares AM, Silva CL. Cell wall fractions from paracoccidioides brasiliensis induce hypergamaglobulinemia. Mycopathologia 1993 Jan; 121(1):1-5.
33. Pereira AJCS, Barbosa W. Inquérito intradérmico para paracoccidioidomicose em Goiânia. Rev Pat Trop 1988; 17:157-86.
34. Reis VLL, Rolla VC, Rangel CA, Sampaio MBNO, Tavares W, Praxedes H, Rocha WB. Paracoccidiodomicose disseminada aguda com extenso derrame pleural. Arq Bras Med 1986; 60 (4):275-80.
35. Restrepo FM, Restrepo M, Restrepo A. blood groups and HLA antigens in paracoccidioidomycosis. Sabouraudia 1983; 21: 35-9.
36. Restrepo A, Robledo M, Giraldo R, Hernandez H, Sierra F. The gamut of paracoccidioiodomycosis. Am J Med 1976; 61:33-41.
37. Restrepo A, Salazar ME, Cano LE, Stover EP, Feldeman D, Steves DA, Estrogens inhibit mycelium to yeast transformation in the fungus paracoccidioides brasiliensis : implications for resistence of females to paracoccioidomycosis. Infect Immun 1984; 46:346-53.
38. Restrepo A. The ecology of paracoccidioides brasiliensis: a puzzle still unsolved. J Med Vet Mycol 1985; 23: 323-334.
39. Rios-Gonçalves AJ, Terra GMF, Rozenbaum R, Barbosa LSG, Figueiredo PC, Aguilar J, Almeida SL. Uma revisitação à paracoccidiodomicose. Apresentação e discussão de algumas formas clínicas incomuns. Arq Bras Med 1995; 69(9): 445-58.
40. Salazar ME, Restrepo A, Stevens DA. Inhibition by estrogens of conidium-to-yeast conversion in the fungus paracoccidioides brasiliensis. Infect Immun 1988; 56:711- 13.
41. Sampaio AS, Rivitt EA. Dermatologia. São Paulo: Arte Médica ;1998. p.535-544.
42. Santos JWA, Severo LC, Porto NS. Fine needle aspiration in the diagnosis of pulmonary paracoccidioidomycosis. Mycopathologia 1998;143: 63-69.
43. Tarantino AB. Doenças pulmonares. 4 ª ed. Rio de Janeiro: Guanabara Koogan ;1997. p.458-66.
44. Terra GMF, Rios-Gonçalves A J, Londero AT, Braga M P, Ourivuri AL, Mesquita CC, Marinho JC, A Ervilha LM, Vieira ARM, Deker-Mader S, Duarte DMA. Paracoccidioidomicose em crianças. ABP. Arq Bras Med 1991; 65:8-15.
45. Valle ACF, Coimbra Jr CEA, Bornay Llinares FI, Monteiro PCF, Guimarães MRC. Paracoccidioidomicose entre o grupo indígena Suruí de Rondônia ,Amazonas,Brasil.Registro de caso. Rev Inst Med Trop 1991 set/out; 33 : 407-11.
46. Vergara M L, Martinez R. Role of the armadillo dasypus novemcimctus in the epidemiology of paracoccidioidomycosis. Mycopathologia 1998;144 (3):131- 3.
47. Vergara ML, Martinez R, Chadu A, Madeira M, Freitas Silva G, Leite Maffei C. Isolation of a paracoccidioidomycosis strain from the soil of a coffee plantation in Ibiá, State of Minas Gerais, Brazil. Med Myc 1998 Feb; 36(1):37-42.
48. Wanke B. Micoses profundas. In:Schechter M, Marangoni DV. Conduta diagnóstica e terapêutica. Rio de Janeiro: Guanabara Koogan; 1994.













