Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletim de Pneumologia Sanitária
versión impresa ISSN 0103-460X
Bol. Pneumol. Sanit. v.10 n.2 Rio de Janeiro dic. 2002
REVISÃO DE TEMAS
Emergência da resistência às drogas
Sonia Natal
Doutora em Saúde Coletiva, médica CRPHF - FUNASA, Pesquisador visitante Dpto Endemias - ENSP - FIOCRUZ, sonianatal@uol.com.br
RESUMO
A resistência aos tuberculostáticos é um dos temas mais importantes na atualidade, pois a disponibilidade de drogas eficazes para o tratamento da tuberculose é reduzida. Além das repercussões epidemiológicas, o prognóstico o doente é reservado. A prevalência da resistência global apresentou uma variação de 5,0% na Nova Zelândia a 42,4% na Republica Dominicana, no Brasil de 10,6%. A revisão aborda os mecanismos de resistência, os fundamentos da quimioterapia de curta duração, o tratamento e a resistência no Brasil, os fatores de risco para a resistência e repercussão no PCT. Os principais fatores de risco para a resistência são o uso inadequado /ou suprimento inadequado das drogas, diagnóstico tardio, acessos inadequados para o tratamento, a co-infecção T-HIV.
Palavra-chave: Tuberculose - Resistência a Drogas - Fatores de Risco
SUMMARY
Due to the reduced acess to treatment and to efficient drugs, the drug resistance is one of the most important themes nowadays. Beyond the epidemological repercussion, the patient prognostic is private. Global resistance prevalence showed a variation of 5,0% in New Zealand and 42,4% in the Dominican Republic. The revision approaches the mechanism of resistance, the fundamentals in short term chemotherapy, the treatment and the resistance in Brazil, the risk factors for resistance and control program repercussion. The main risk factors for resistance are the unsuitable use, or supply of drugs, late diagnostic, unsuitable acess to treatment, co-infection by T-HIV.
Key-words: Tuberculosis - Drug Resistance - Risk factors
Descrição preliminar
A resistência em microorganismos previamente susceptíveis ocorre quando se utilizam antibióticos em infecções humanas ou em animais. A seleção natural de cepas resistentes criou uma competição entre a tecnologia e a evolução microbiana. Com o uso desregrado dos agentes antimicrobianos, há várias décadas, a resistência aparece em vírus, bactérias, fungos e protozoários, levando a novos desafios tanto para o tratamento individual como para os programas de controle (NEU, 1992).
A resistência aos tuberculostáticos foi reconhecida desde a implantação da quimioterapia (ISEMAN, 1989). Entretanto pode ter surgido anteriormente à quimioterapia, decorrente de mutação natural dos bacilos, pois é um evento que ocorre ao acaso, não necessita ser induzida. Uma grande população bacilar quando exposta aos tuberculostáticos terá organismos resistentes a uma ou outra droga, por mutação natural. A freqüência estimada da mutação dos bacilos para-resistentes é estimada para a rifampicina (R) de 1/10(8), para a isoniazida (H) e a estreptomicina (S) de 1/10(6) e para o etambutol (E) de 1/10(4) (CENTERS FOR DISEASE CONTROL (CDC), 1993). Em uma lesão causada pela tuberculose não cavitária o número de bacilos existentes é relativamente baixo, aproximadamente de 10(4) a 10(5) por grama de tecido, portanto a chance de detectar-se bacilos resistentes é reduzida. Já, em uma lesão cavitária o número de bacilos encontrados por grama de tecidos é de aproximadamente de 10(9) a 10(11) e a chance de existir bacilos resistentes é grande. Nestas lesões cavitárias, em presença da monoterapia, a mutação de bacilos com resistência para este antibiótico passa a ter uma vantagem de seleção sobre os bacilos sensíveis e compromete toda a população bacilar. Em microbiologia a resistência é definida de acordo com a proporção de organismos resistentes a uma concentração crítica específica para cada antibiótico. Geralmente quando um porcento ou mais organismos em uma amostra é detectado como resistentes o sucesso terapêutico fica reduzido e a amostra deste espécime é considerada resistente. (CANETTI, 1965; GOBLE, 1993; FRIEDEN, 1993; CDC, 1993; PLIKAYTIS, 1994).
A mutação para a resistência aos antibióticos não é ligada cromossomicamente e o desenvolvimento espontâneo da resistência a mais de uma droga é raro. Por exemplo, a mutação espontânea à H e à R é de 10(-6) a 10 (-8) respectivamente, portanto a resistência às duas drogas seria de 10(-14). O desenvolvimento de resistência a mais de uma droga está relacionado diretamente com a subdose das drogas. Quanto maior a população bacilar maior a chance da droga-resistência. Em uma população de bacilos resistentes à H, mesmo com a vantagem da adição de outras drogas, a chance de surgir resistência às drogas adicionadas aumenta. (CANETTI, 1965; GOBLE, 1993; FRIEDEN, 1993; CDC, 1993; PLIKAYTIS, 1994).
Na tuberculose humana, as maiores populações estão nas lesões cavitárias. Em estudos de necropsia em doentes não submetidos à quimioterapia, foi estimada a população bacilar inicialmente presente em diferentes tipos de lesões. As populações encontradas em cavidades eram na ordem de 10(7) a 10(8) bacilos, enquanto em lesões caseosas endurecidas eram de 10(2) a 10(4) bacilos. (HOWARD, 1949; HOWLETS, 1949)
Dados de pesquisas experimentais com animais mostraram que o bacilo resistente seria menos virulento que o sensível, como observou-se em estudo em animais que evidenciou que os bacilos resistentes à H eram menos virulentos que os sensíveis (MITCHISON, 1954). Foi verificado que a transmissão dos bacilos resistentes é semelhante à dos sensíveis. SNIDER (1985), comparou o risco de infecção entre contatos de doentes sem tratamento anterior com os de doentes com tratamento anterior, controlando se eram resistentes ou sensíveis, não encontrou evidências de que os bacilos resistentes eram menos infecciosos que os sensíveis. Os autores, entretanto, verificaram um aumento do risco de infecção entre os contatos dos doentes resistentes e com tratamento anterior, que ocorreria por uma exposição prolongada e não por aumento da infecciosidade do bacilo resistente.
Outros estudos também demonstraram que pacientes com MDR-Tb transmitem e causam a doença em pessoas susceptíveis, da mesma forma que o fazem os doentes sensíveis às drogas (SNIDER, 1985; CDC, 1991; VALWAY, 1991; BE CK-SAGUE, 1992). Por ser facilmente contagiosa, com a conseqüente disseminação de bacilos resistentes na população, a falta de disponibilidade para o tratamento dos doentes resistentes, poderá aumentar exponencialmente estes bacilos, agravando o problema de controle da tuberculose.
O reconhecimento da resistência aos tuberculostáticos, imediatamente após o estabelecimento do tratamento quimioterápico, na tuberculose multidroga resistente (MDR-Tb) em doentes com infecção por HIV, nos EUA e na Europa, foi um fator estratégico para priorizar o controle da tuberculose, principalmente para obtenção de recursos financeiros (NATAL, 1993). Os surtos de resistência identificados nos EUA preocuparam não só pelo número de doentes identificados como resistentes, mas também pela transmissão aos trabalhadores da área da saúde. A evidência epidemiológica da transmissão hospitalar foi confirmada pelo DNA fingerprinter, que ao identificar padrões semelhantes, sugeria a existência de uma conexão entre os surtos ocorridos (CDC, 1991).
A resistência aos tuberculostáticos assume grande importância no programa de controle da tuberculose, pois a disponibilidade de drogas eficazes para o tratamento da tuberculose é reduzida (RIEDER, 1995). Além das repercussões epidemiológicas, o prognóstico para o doente resistente é reservado, principalmente quando a resistência inclui a H e a R. As opções terapêuticas, para a MDR-Tb, são de baixa eficácia e eficiência, de maior toxicidade e de maior custo, comparadas com as disponíveis para os doentes sensíveis. As taxas de cura, dos doentes portadores da MDR-Tb, são inferiores a 60% e, em alguns estudos, estes resultados são semelhantes aos da era pré-quimioterápica (MITCHISON, 1986).
A resistência aos tuberculostáticos é a amplificação pelo homem do fenômeno natural. Diferentemente de outras bactérias, no M. tuberculosis não há indicação da transferência horizontal de genes (resistance plasmids or transposons). Em cepas de M. tuberculosis não expostas às drogas, nunca foi demonstrada uma resistência, com exceção do M. bovis, e referente a resistência à H. Para o programa de controle da tuberculose o interesse se dá no processo de mutação genética, decorrente da exposição às drogas, responsável pela emergência da resistência clínica aos tuberculostáticos (HOWARD, 1949; HOWLETS, 1949).
Durante a multiplicação bacteriana, a resistência espontânea aos tuberculostáticos ocorre em uma freqüência definida, e os genes envolvidos na resistência são diferentes para cada droga (Tabela 1) (MITCHSON, 1979; FOX, 1975). A mutação genética que resulta na resistência do M. tuberculosis à R, ocorre em uma taxa de 10(-10) por divisão celular que conduz a uma prevalência estimada de 1 bacilo resistente em 10(8) dos bacilos sem drogas no meio ambiente. A mutação genética à H conduz a uma prevalência de 1 em 10(6) bacilos sem drogas (GRANGE, 1990). Populações bacilares superiores a 10(7) são comuns em lesões cavitárias (CANETTI, 1965).
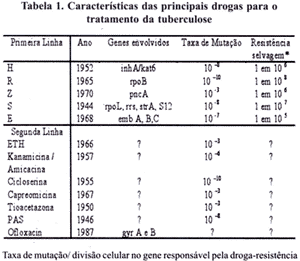
Em 1980, a reutilização da pirazinamida, (Z) junto com a R e a H, permitiu a redução do tempo de uso das drogas, já que esta associação mostrou-se altamente eficaz, com rápida redução da população bacilar. Este fato permitiu o tratamento ambulatorial - isolamento "químico" - decorrente da rápida atuação como redutor da tosse e da negativação do escarro, além da vantagem de ser totalmente oral e de baixa toxicidade. (MITCHISON, 1979; FOX 1975; FOX, 1978).
A monoterapia, que decorre do erro de prescrição, da não adesão ao tratamento, do tempo insuficiente, das subdoses e da falta de drogas, suprime o crescimento dos bacilos sensíveis a essas drogas, mas permite o crescimento dos resistentes. Este fenômeno é chamado de resistência secundária ou adquirida. A transmissão desses bacilos a outras pessoas causa a resistência primária. Toda droga ativa para o tratamento da tuberculose induz a resistência e, quanto mais ativa a droga, maior o risco de indução da resistência clínica (CANETTI, 1965).
A MDR-Tb devido a ocorrência de mutação espontânea, é basicamente impossível. A probabilidade de mutação espontânea, induzindo resistência à H e à R, é o produto das probabilidades de cada droga (1 em 10(14) (10 (-6) X 10(-8) )). Porém, é possível ocorrer, em uma cepa com resistência à H em que apareça resistência espontânea à R, em alguns bacilos, pelo tratamento com H e R que selecionará bacilos resistentes a essas duas drogas. Uma seqüência similar de eventos conduz a resistência a outras combinações de drogas. A aquisição de resistência à R e à H parece não ocorrer em bloco, mas por mecanismos cumulativos, culminando com a mutação de bacilos para-resistentes (GOBLE, 1993; PLIKAYTIS, 1994; FRIEDEN, 1993).
Os mecanismos microbiológicos da resistência são: (NIKAIDO, 1994; KWON, 1995)
- Variação da permeabilidade da parede celular, para diferentes drogas;
- Produção de enzimas que degradam ou modificam as drogas;
- Modificação espontânea ou provocada de cromossomas de genes alvos das drogas.
Esses mecanismos vão levar, como conseqüência, à inativação das drogas, à impossibilidade da droga penetrar através da parede celular, à redução da droga por degradação por enzimas bacilares e, à alteração por mutação genética.
A má absorção das drogas, resultando em uma concentração sérica inadequada (CHOUDRI, 1997), em pacientes com aids e que apresentavam má absorção e quadro consumptivo, não foi aceito como um mecanismo para o fracasso do tratamento e potencialmente para o surgimento da resistência. Apesar da baixa concentração sérica, em todos os pacientes, verificaram-se picos maiores que as concentrações inibitórias mínimas, para cada droga, semelhante ao estudo do SHAI, 1997. Estes autores concluíram que mesmo em doentes com aids, em estado grave, apresentavam uma boa resposta clínica ao uso dos tuberculostáticos. Outros autores detectaram a má absorção, em pacientes com aids, como causa da R monoresistente, e o mecanismo que acarretaria a R resistente, não estaria claro. Foi descrito interação entre as rifamicinas e os antiretrovirais, esta interação selecionaria R resistentes em alguns pacientes, não se sabendo também qual o mecanismo. (RIDZON, 1998).
A R atinge o pico de concentração sérica duas horas após a sua ingestão, se de estômago vazio; já em sua ingestão com alimentos, verifica-se um retardo e uma incompleta absorção. (ELLARD, 1999).
Segundo SBARBARO, 1996, o problema é assegurar que o doente tome o número adequado de drogas, para atingir um nível sangüíneo satisfatório. A H necessita de um nível sangüíneo baixo para sua ação bactericida, e atinge este nível logo após o início do tratamento. Já a R teoricamente levaria 14 dias de tratamento da tuberculose mento para atingir o nível sangüíneo bactericida. Se o doente utilizar dose inferior à recomendada, e/ou se ingerir as drogas após alimentação, o nível sangüíneo bactericida da R será prejudicado, o que poderá acarretar resistência.
Apesar de todos estes mecanismos microbiológicos, a emergência da resistência na população está principalmente associada com a operacionalização do programa e fatores relacionados ao doente (BARNES, 1987).
O principal elemento da emergência da resistência, não está no doente ou nos técnicos de saúde, mas sim na organização do programa que deve manter um sistema com diagnóstico rápido, eficiência do tratamento e garantia dos insumos necessários. Por essa razão a resistência aos tuberculostáticos é um indicador da qualidade do programa de controle da tuberculose (REICHMAN, 1997). Os fatores, relacionados ao doente, estariam ligados ao uso irregular das drogas.
Populações bacilares: fundamento da quimioterapia com isoniazida, rifampicina e pirazinamida
O crescimento bacilar constitui-se de várias fases que vão desde populações sem crescimento, até as populações que estariam em franca multiplicação, com alto metabolismo (MITCHISON, 1998).
As populações bacilares, segundo o crescimento e a atividade metabólica, seriam:
1- Crescimento contínuo, alto metabolismo: nesta população a ação preferencial seria a da H. Com menos eficácia, também agiriam a R, o E e a estraptomicina (S).
2- População intracelular, no interior dos macrófagos, meio ácido: esta população predominaria na fase inicial da doença, com a migração dos macrófagos. A droga de ação neste meio ácido, intracelular, seria a Z.
3- População com baixo metabolismo, de multiplicação esporádica: A R seria a droga de ação.
4- População de metabolismo inativo, dormente: seria uma população bacilar adaptada à baixa concentração de oxigênio, responsável pela reinfecção endógena. A ação, nesta população, estaria ligada à imunidade do hospedeiro.
O termo, "bacilo persistente", foi utilizado, pela primeira vez, por McCune, em 1966 (MITCHISON, 1998), referindo-se à capacidade do bacilo em sobreviver nos tecidos, na presença de altas concentrações de agentes bactericidas.
A natureza desses bacilos persistentes é desconhecida, mas assume-se que existe um estado de dormência, com estes bacilos apresentando curtos intervalos de metabolismo ativo.
GRANGE (1992), não concorda que as populações de dormentes e persistentes sejam iguais. Existiria uma população que apesar de ser inativa, sofreria a ação das drogas, pois foi demonstrada a ação da H em bacilos dormentes, em indivíduos com tuberculose-infecção. Existiria um segundo tipo de bacilo persistente, responsável pela reativação endógena da tuberculose, após anos ou décadas da infecção, e uma terceira população que dependeria da resposta imunológica, esta última, seria a responsável pelo adoecimento rápido em indivíduos com comprometimento imunológico.
A redução da resposta imunológica, por diversos fatores, fala a favor de que a resposta imunológica seria importante para a manutenção de um tipo de bacilo "persistente", como verificado em adoecimento após a infecção pelo HIV.
O retratamento, com o mesmo esquema, tem como pressuposto que a recidiva decorre da população "persistente", teoricamente sensível.
Tratamento da tuberculose no Brasil
O Brasil foi o primeiro país a implementar o esquema de curta duração, auto-administrado, em um programa de saúde pública. A auto-administração foi sempre questionada internacionalmente, principalmente, por não haver nenhum sistema de monitoramento das tomadas das drogas e o controle ser apenas as visitas mensais aos centros de saúde. Outro grande problema que surgiu na implementação desse esquema foi o desaparecimento da visitadora domiciliar, agravando o abandono do tratamento, e o não seguimento de todos os doentes após a alta.
A medida adotada no Brasil e recomendada pela a OMS, foi o uso das drogas em uma só apresentação, com doses fixas, sendo que a OMS recomenda a combinação de três drogas - R, H e Z - enquanto que no Brasil utiliza-se a combinação fixa de R e H. Com esta medida seria evitada a monoterapia e, por conseguinte, a resistência por uso inadequado, superando a resistência mutacional, principalmente se considerarmos a probabilidade da resistência a duas drogas seria de 10(-14), o que poderia ser considerada rara. (PARSONS, 1997).
Com a implementação do esquema de curta duração, no início da década de 80, também houve a universalização do programa de controle da tuberculose, garantindo um melhor sistema de informação. Porém, não houve a descentralização dos centros de diagnóstico e tratamento.
Para a detecção da resistência utiliza-se o teste de sensibilidade. Na prática, a detecção precoce e simples da possibilidade da resistência, pode ser realizada através do acompanhamento da evolução dos resultados da baciloscopia. No início do tratamento a destruição dos bacilos sensíveis se faz de maneira rápida, reduzindo a população bacilar. Posteriormente, o número de bacilos poderá voltar a crescer, devido à multiplicação de mutantes resistentes. A repositivação do escarro, após a negativação, é um fenômeno há muito conhecido e de grande importância prática, pois permite a detecção da resistência, através de um método simples e barato, além de ser um bom indicador da tomada correta dos medicamentos pelo doente. O grau de positividade dos exames diretos do escarro - baciloscopia - seria mais importante que os testes de sensibilidade para a detecção da resistência durante o tratamento. A cultura do escarro, já não seria um bom marcador durante o tratamento, devido à chamada resistência transacional, que aparece antes da negativação da cultura do escarro (FOX, 1977). A realização de cultura do escarro, após a negativação da baciloscopia, pode mostrar positividade, inclusive com detecção de bacilos resistentes o que apenas significa que houve a eliminação dos bacilos sensíveis; os resistentes decorrentes de mutação genética tardam mais para serem eliminados. Devido a este fato, a cultura não é um bom exame para o acompanhamento da evolução dos doentes, na ausência da piora clinica e/ou a persistência de bacilos ao exame direto do escarro.
A resistência no Brasil
Após a descoberta da S, em 1944, outras drogas foram sendo descobertas progressivamente e deu-se o início da era da quimioterapia. A descoberta de outras drogas possibilitou associações que culminaram com o esquema tríplice, S + ácido para-amino salicílico (PAS) + H. Este esquema poderia evitar a emergência de bacilos resistentes, garantindo maior taxa de cura. Em 1950, já se afirmava: "Só não cura de tuberculose ou quem não quer ou quem não pode" (NATAL, 1993).
Porém após o entusiasmo inicial, um grande problema é detectado no final da década de 50 - a resistência aos tuberculostáticos - e se afirmava: "o maior desastre para o doente tuberculoso é que seu bacilo se torne resistente às drogas padronizadas. Isto pode virtualmente ser evitado por métodos adequados de quimioterapia, porém os menores erros de ação ou omissão podem ser desastrosos."
No estudo realizado em 1959, pelo Laboratório Central, Rio de Janeiro, a resistência adquirida a pelo menos duas drogas era de 68 %. Além da resistência, a taxa de mortalidade nos hospitais especializados chegava a 75%, nos dois primeiros meses de internação. Isto demonstrava o baixo rendimento dos hospitais e dispensários.
Como o aparecimento da resistência foi considerado uma conseqüência do emprego inadequado das drogas, propôs-se, então, o primeiro esquema padronizado1, com duração de 18 a 24 meses de tratamento, difásico, isto é, os primeiros três meses internados, para rápida redução da carga bacilar e para educação sanitária.
Nos meados da década de 60, a Campanha Nacional Contra à Tuberculose (CNCT), seguiu a orientação expressa no Oitavo Informe da OMS, 1964. Estas orientações definiam o que era um caso de tuberculose, e recomendava a baciloscopia como o método preferencial de diagnóstico para tuberculose, no lugar da radiografia, devido ao menor custo e maior especificidade para o bacilo álcool-ácido-resistente. O esquema de tratamento foi reduzido para 12 meses, após os estudos da UICT2, 1965, o que possibilitaria a redução do custo e a maior oferta de tratamentos.
Com essas medidas, foi possível a avaliação dos resultados de tratamentos em 19 dispensários, inscritos no Serviço Nacional de Tuberculose (SNT), 1966-1968, devido à padronização do esquema. A taxa de cura foi 68.7%, a de abandono 14.2%, a de crônicos 5.9% e a de óbitos 3.0%. Em um segundo momento a taxa da resistência secundária reduziu de 68% para 22.1%. Podemos considerar estes resultados, em face do esquema que era utilizado, como um grande sucesso.
Na década de 70, no Instituto Clemente Ferreira, de 1077 casos diagnosticados no período de 1972 a 1976, eram resistentes 8,5% (LIMA FILHO, 1980). A resistência verificada, por drogas, foi de 5,0% à H e S, de 0,8% ao PAS e de 0,4% às três drogas. Verificou-se a ausência de resistência primária à R e ao E. Recomendou- se, então, a utilização destas drogas para o tratamento da tuberculose.
A outra medida seria garantir o tratamento a todos os doentes, com melhoria do diagnóstico e tratamento, o que só foi conseguido em 1979, com o esquema de curta duração, graças a recursos remanejados principalmente das internações, pois o tratamento era prioritariamente ambulatorial.
A partir de 1979, iniciou-se a utilização do esquema com R, H e Z, progressivamente, até atingir todos os doentes em 1982.
Após a introdução deste esquema foi realizado, entre 1986 e 1988, um estudo da resistência primária, em vários estados. A resistência detectada, em um total de 928 amostras, foi: 3,0% à H, 8,0% à S, 0,1% ao E, 3,5% à H e S associadas, 0,3% à H e R associadas, e 0,1% à H, S e R associadas. A resistência global foi de 15,0%, bastante alta, semelhante aos países em desenvolvimento. Entretanto a associada à H e R foi bastante baixa, semelhante aos países desenvolvidos, e não foi verificada a resistência à R isolada. (BARRETO, 1988).
Em inquérito realizado na América Latina, no período de 1986 a 1990, em 339 amostras do Brasil, foi verificada resistência em 40 amostras (11,8%), onde 9,1% eram monoresistentes, 0,1% associação H e R e 11, 6% S. (LASLO, 1995). Com a introdução da quimioterapia de curta duração, nesse período, houve uma redução da resistência às drogas no Brasil.
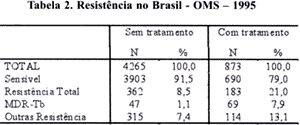
No inquérito, mais recente, realizado no Brasil, 1995 e 1996, em vários estados, com uma amostra de 5138 casos de tuberculose, a resistência (Tabela 2) a pelo menos uma droga foi de 10,6% (545 casos), a resistência primária de 8,5% (362/ 4265) e a secundária de 21,0% (183/873). A associação com a R e H foi de 2,2% ( 116) (BRAGA,1999). Neste inquérito, nos resultados preliminares, a resistência mais freqüente foi com a H, de 6,3% e a menor com o E, de 0,2%. A resistência à S foi de 3,8% e à R de 1,5% (WHO, 1997).
Fatores de risco para a resistência aos tuberculostáticos
Os fatores de risco de maior importância para o desenvolvimento da resistência são o uso inadequado dos tuberculostáticos (COSTELLO, 1980, FRIEDEN, 1993), e indivíduos que moram em países ou comunidades de alta prevalência de bacilos resistentes (PITCHENIK, 1982; RILEY, 1989).
As lesões cavitárias e/ou história de tratamento para tuberculose, também, aumentam o risco da resistência adquirida. BEM-DOV, 1987, verificou que pacientes com cavidades tinham quatro vezes mais chances de adquirir resistência, quando comparados com aqueles sem lesão cavitária, com um intervalo de confiança a 95%, de 2,1 a 7,6. Em doentes com história de tratamento para tuberculose, a resistência foi 4,7 vezes maior, quando comparados com doentes sem história de tratamento (IC 95% = 2,6-8,8). A combinação da lesão cavitária e de história de tratamento confere um risco adicional. Em doentes com os dois riscos, 71,0% foram resistentes.
SUMARTOJO, 1993, relaciona o fracasso do tratamento, com o conseqüente aumento da resistência, à não adesão ao tratamento, sendo que os fatores relacionados com a não adesão seriam as circunstâncias sociais adversas. Fatores demográficos como sexo, idade, raça, educação estariam ligados também ao fracasso do tratamento. Entretanto, estes fatores não seriam inerentes à causa do fracasso do tratamento. Poderiam apresentar- se como um fator de risco devido à falta de informação e a aspectos culturais, mas seriam fatores de confusão. A idade, maior de 40 anos, foi associada à não adesão, na maioria dos estudos, como também o sexo masculino. O autor acha que a interpretação destas variáveis é difícil e inconsistente.
HUMA (1996), relaciona a resistência aos tuberculostáticos com o aumento dos sem tetos e da pobreza, limitação do acesso aos serviços de saúde, doses subótimas dos tuberculostáticos e não adesão ao tratamento. A redução de recursos financeiros para o controle da tuberculose e da aids é importante para a resistência adquirida. Para a resistência primária, o fator de risco seria a migração de pessoas oriundas de países de alta prevalência, com freqüência de resistência primária à H superior a 4%. A autora recomenda, para países com freqüência de resistência primária à H inferior a 4,0%, tratamento com três drogas - H, R e Z. Em países com taxas altas de resistência à H e a mais uma outra droga, a quimioterapia deveria ser iniciada com 4 ou 5 drogas, com monitoramento da adesão ao tratamento, pois em grupos sob regime auto-administrado a resistência secundária ocorreu em 14% contra 2,1% entre os que foram supervisionados.
FENG-ZENG (1997), recomenda o acompanhamento dos doentes através da baciloscopia, pois a conversão do escarro, no terceiro mês de tratamento, seria um importante preditor para o sucesso da quimioterapia, enquanto, a não conversão, seria um preditor para a falência, devido ao aparecimento da resistência. Estudos mostraram uma correlação entre o escarro positivo no segundo mês e a falência do tratamento, e fortemente associada, quando positivo no terceiro mês do tratamento.
Outros fatores de riscos reconhecidos seriam a mobilização populacional, o aumento de sem-tetos, o uso de drogas injetáveis e a aids. Verificou-se também que a resistência era mais prevalente em doentes jovens, indicando infecções recentes (BEM-DOV, 1987).
Também, como causa da resistência, é citada a falha dos programas de controle da tuberculose no suprimento dos medicamentos, além das associações inadequadas em doentes não responsivos ao tratamento e a não identificação da resistência em tempo oportuno (MAHMOUDI, 1993).
A associação da tuberculose e das formas de resistência primária e secundária com as más condições sociais, é um achado unânime. Estudos, nos EUA, verificaram que a resistência primária era mais freqüente nos imigrantes dos países da América Latina, Ásia, Haiti e Filipinas (AITKEN, 1980; PITCHENIK, 1982; RILEY, 1989).
O uso do esquema tríplice objetiva evitar a emergência de bacilos resistentes. A resistência primária é geralmente baixa nos países desenvolvidos e alta, naqueles em desenvolvimento. No Quadro 1, podemos ver que a resistência secundária às drogas é maior nos indivíduos originários de países subdesenvolvidos, nos quais é maior a incidência da tuberculose. Também é mais comum a resistência bacteriana às drogas nos doentes que já fizeram tratamento para tuberculose (HERSHFIELD, 1987).

AITKEN, 1980, testou a sensibilidade aos tuberculostáticos em 766 culturas, achando uma resistência de 13,0%. Entre os resistentes 61 doentes eram imigrantes asiáticos, 5 hispânicos e 35 nem asiáticos, nem hispânicos. Constatou que a maior freqüência estava entre as populações originárias dos países com alta prevalência de resistência.
A sorologia reativa para o HIV, tanto em caso de infecção como de imunodeficiência, foi um achado associado à resistência. Além dos fatores citados, o mecanismo de maior desenvolvimento da resistência, neste grupo, ainda não está estabelecido.
Em levantamento retrospectivo, realizado em São Paulo, em um centro de tratamento para aids, com o objetivo de identificar a freqüência da resistência e o padrão das drogas utilizadas nos doentes com tuberculose e aids, a resistência global encontrada foi de 19,0% (82), a primária de 12,95% e a secundária de 41,1%. A distribuição dos casos foi homogênea quanto ao sexo, idade e alcoolismo. Em análise multivariada houve correlação entre resistência e tratamento prévio, e tempo de evolução da aids. (PINTO, 1998)
No Quadro 2 estão apresentados estudos de predição para a resistência aos tuberculostáticos e as associações encontradas.
A resistência aos tubeculostáticos como manutenção dos casos infectantes e situação mundial.
A infecciosidade se dá, essencialmente, a partir da tuberculose pulmonar ou da laringe. O mecanismo principal de transmissão é a tosse presente nos doentes pulmonares bacilíferos, sobretudo os com lesões cavitárias. Antes do diagnóstico, os tuberculosos representam grande risco epidemiológico, mas, aqueles submetidos a tratamento inadequado exibem risco maior, pois, além da manutenção dos sintomas respiratórios, estão sujeitos a desenvolver resistência adquirida e se converterem em fontes de transmissão de bacilos resistentes.
O tratamento inadequado é, em geral, conseqüência da não adesão ao tratamento que, segundo CHAULET, 1987, apresenta vários níveis, a saber: total recusa ao tratamento - abandono, o não cumprimento da duração do tratamento, o uso irregular das drogas e o uso incorreto das doses, este, por erro de prescrição como no caso de não ser levada em consideração a interação medicamentosa, ou por decisão espontânea do doente. Os fatores da não aderência são responsáveis pela permanência da fonte de infecção, emergência da resistência bacteriana e aumento do custo do tratamento.
Também, leva a persistência de bacilos resistentes, o acompanhamento inadequado - tratamento sem acompanhamento baciloscópico e a alta por cura sem a verificação da negativação em três diferentes amostras de escarro - por não identificação da falência do tratamento, acarretando a piora do doente e agravamento epidemiológico com a disseminação destes bacilos.
A resistência secundária, gerada pelo tratamento inadequado, é responsável pela disseminação de bacilos resistentes que, por sua vez, levam à resistência primária (WHO, 1997). A resistência natural, como citado anteriormente, independente de exposição prévia aos tuberculostáticos e, até o momento, não foi detectada como determinante de resistência clinica(3). Esta resistência estaria ligada às grandes populações bacilares, como encontradas em extensas cavidades, e poderia ser considerada rara (HOWARD, 1949; HOWLETT, 1949).
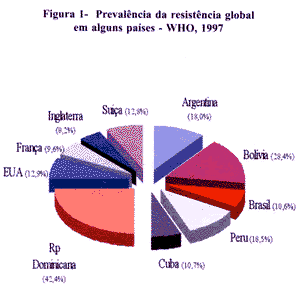
A OMS, em 1994, realizou um levantamento da resistência à isoniazida, à rifampicina, ao etambutol e à estreptomicina, com participação de cerca de 20% dos países, (OMS, 1977). Verificou-se uma grande variação entre os países participantes, porém a verdadeira magnitude do problema ainda permanece desconhecida (Fig 1).A resistência global verificada variou de menos de 5% na Nova Zelândia a valores superiores a 40%, como na Rep. Dominicana. No Brasil, esta resistência foi de 10%, inferior à da Argentina, da Bolívia e do Peru. Verificamos que países como os EUA, e/ou aqueles do Mercado Comum Europeu, também apresentaram freqüência importante. É claro que os dados do Brasil são uma média de várias cidades participantes e dilui a realidade, pois sabemos que este problema é maior em alguns centros.
Neste estudo, a resistência primária a qualquer uma das drogas variou de 2% na República Checa a 41% na República Dominicana, com uma média de 10.4%. A multidrogaresistência (4) (MDR-Tb) primária variou de 0% no Quênia a 14.4% na Lituânia, com uma média de 1.4%. No Brasil a resistência primária a pelo menos 1 droga foi de 8.6% (Fig. 2).
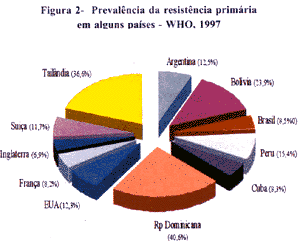
A resistência secundária mostrou uma variação de 5.3% a qualquer droga, na Nova Zelândia, a 100% na Rússia, com uma média de 36%. Porém este percentual da Rússia é decorrente de um número pequeno - apenas 33, e taxa de 14,0% - de doentes de retratamento. O mesmo se verificou em Cuba, que tem um excelente programa de controle da tuberculose, que apresentou 91.3% de resistência secundária, com apenas 23 casos de doentes de retratamento, uma taxa de cura de 91.0% e taxa de retratamento de 7.0%.(Fig 3).
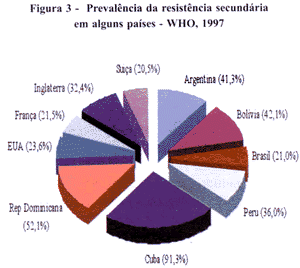
No Brasil, a resistência secundária foi de 21,0%, e a taxa média de retratamento de 17,0% (OMS, 1997). A média dilui os problemas dos grandes centros onde concentra-se o maior número de casos, conforme verificado acima. A taxa de reingresso no município do Rio de Janeiro foi de 20%. Este "problema da média" repete-se em outros indicadores operacionais.
O problema da resistência é preocupante e, para o êxito do controle da tuberculose, é um importante aspecto a ser considerado, pelas sérias repercussões epidemiológicas que acarreta. A situação é agravada em presença de esquemas de tratamento ineficazes.
A falta de estudos de novas drogas é mais um problema com que se depara hoje o controle da tuberculose. A rifampicina foi a última droga aprovada especificamente para a tuberculose, em 1966, sendo que nos Estados Unidos somente em 1972. Várias quinolonas, que se mostraram eficazes pare o tratamento da tuberculose, mas não foram aprovadas pare o uso exclusivo nesta endemia, indicam um desinteresse da indústria farmacêutica neste campo, já que estas drogas são utilizadas em bronquites, pneumonias ou outras doenças de maior prevalência. Por outro lado, a industria farmacêutica resiste em desenvolver novas drogas, por temer pressões para distribui-las a baixo custo, pois a tuberculose, apesar de sua alta prevalência, ocorre sobretudo, em pessoas pobres com baixo poder aquisitivo (REICHMAN, 1996).
O principal mecanismo para o controle da resistência ainda é a garantia de um primeiro tratamento bem feito, uma vez que as opções terapêuticas alternativas são de baixa eficácia, alto custo e toxicidade maior que a do tratamento de curta duração. O que se verificou, também, é que quanto maior for o tempo de tratamento, maior o risco de emergência de bacilos resistentes (MITCHISON, 1986).
Para o controle da infecciosidade são necessárias medidas como: detecção precoce da doença, tratamento adequado, controle dos comunicantes, quimioprofilaxia e vacinação com BCG intradérmico, além das medidas gerais.
O diagnóstico é outro ponto de estrangulamento decorrente da falta, seja do exame baciloscópico, ou de equipamentos, de insumos e de pessoal treinado, o que leva a muitos diagnósticos sem realização da baciloscopia, falsos negativos, falta de acompanhamento pela baciloscopia e alta por cura em doentes sem a confirmação da negativação.
No Brasil, a cultura de escarro, com tipagem e teste de sensibilidade é de uso bastante limitado, mesmo nos grandes centros.
É necessário, para melhorar o diagnóstico, não só incrementar os laboratórios, mas também, intensificar a busca de casos novos incluindo grupos de risco como comunicantes, presidiários, albergados e outros. O controle da prevalência da infecção, também, é importante entre os trabalhadores de saúde, prática pouco usual no nosso meio. Uma preocupação mais atual é com viagens aéreas, pois já foi demonstrado o risco de infecção por este meio de transporte (DRIVER, 1994).
Há mais de 20 anos da recomendação para a combinação das drogas em doses fixas, atualmente questiona- se a biodisponibilidade da R nestas combinações. A provável redução da biodisponibilidade da R em combinações fixas já foi documentada e a sua implicação no controle da tuberculose é desastrosa (PILLAI, 1999), pois acarretaria um aumento das taxas de falência do tratamento com o esquema de curta duração e aumentaria a probabilidade de surgimento de mutantes resistentes, tanto à R como à H, com um impacto epidemiológico negativo decorrente do aumento de bacilos resistentes circulantes. Em termos individuais seria um desastre para o doente, por reduzir ou mesmo impossibilitar a cura (ELLARD, 1999).
Segundo SBARBARO, 1999, os testes in vitro não garantiriam realmente uma biodisponibilidade da R quando utilizada no homem.
Tanto SBARBARO, 1999 e MITCHISON, 1998, questionam se o uso de doses fixas combinadas das drogas preveniriam o surgimento da resistência, se interrompido o tratamento, parcial ou totalmente. Estes autores, reconhecem a necessidade de protocolos para determinar a biodisponibilidade da R em apresentações combinadas.
MITCHISON, 1998, apresenta vários mecanismos pelos quais a resistência às drogas não seria reduzida com o uso combinado em uma única apresentação. O autor descreve que o mecanismo de morte dos bacilos não é do tipo contínuo. Haveria fases em que os bacilos seriam reduzidos por ação das drogas e, em outro momento, quando as drogas deixassem de ser tomadas, os bacilos voltariam a ter uma taxa de crescimento. Em cada um destes ciclos ocorreria seleção, favorecendo os mutantes resistentes em detrimento dos sensíveis. O recrudescimento da população bacteriana ao tamanho da população inicial, anterior à quimioterapia, poderia ocorrer com a presença de proporções crescentes de bacilos resistentes no início de cada ciclo. Diferentes mecanismos, incluindo o efeito bactericida precoce das drogas usadas, favoreceriam a seleção de mutantes resistentes. O efeito bactericida precoce seria a velocidade com que a droga iniciaria seu efeito bactericida. Esquemas contendo isoniazida iniciariam a ação bactericida mais rapidamente que esquemas sem esta droga, nas fases iniciais. No início do uso de esquemas com H e R os mutantes H resistentes seriam selecionados porque só poderiam ser mortos pela R; os bacilos sensíveis à H seriam cada vez mais eliminados pela H. Esta seleção se daria porque na atividade bactericida precoce teria uma diferença de dois dias de tratamento para serem similares. Após este período as drogas teriam a atividade bactericida similar. Como na fase inicial a população bacilar é grande e a probabilidade de seleção de bacilos resistentes é maior, haveria a seleção de mutantes resistentes à H, e haveria também mutantes resistentes à R; como a R demoraria para o início de sua ação teria uma situação semelhante à monoterapia, e estas populações resistentes aumentariam rapidamente. Este mecanismo explicaria a produção da resistência em doentes com baixa adesão ao tratamento, ou que não tomassem a terceira droga. O doente que deixasse de tomar, por dois a três dias, já daria a defasagem de ação das drogas, e seria como se estivesse fazendo monoterapia. Por este comportamento o uso de drogas combinadas não garantiria uma redução da resistência aos tuberculostáticos. O bacilo da tuberculose sofre um hiato metabólico de duração variável para cada droga após o início de sua utilização. Se o intervalo entre as tomadas da medicação for superior a este hiato poderá haver um aumento dos mutantes resistentes.
O mecanismo de ciclos e o de efeito bactericida precoce, ocorrem preferencialmente, na fase inicial do tratamento, quando a atividade bacilar está em multiplicação rápida; o hiato metabólico dos bacilos seria na fase de continuidade, quando a população bacilar estaria reduzida e os períodos de multiplicação seriam ocasionais e com uma atividade metabólica mínima (semidormentes)
A atual estratégia da OMS, com relação ao tratamento, é o "Directly Observed Treatment", DOTS, tratamento supervisionado com o objetivo de reduzir a incidência da tuberculose, o risco de infecção, a falência, a recidiva e reduzir e controlar a resistência bacteriana (SUDRE, 1992; WHO, 1994).
Outra recomendação da OMS, é a inclusão de uma quarta droga nos esquemas de retratamento para a tuberculose. A droga recomendada é o etambutol, adicionado ao esquema com R, H e Z, nos dois primeiros meses. Mitchison, 1998, questiona esta estratégia como pouco eficaz. Tal medida reduziria a chance do crescimento da resistência à H ou à R isolada ou à H e Z. Entretanto, não traria vantagens para reduzir outros padrões de resistência como a H associada à R. O autor acha que as desvantagens são maiores que o possível benefício, como o custo e o aumento do risco de toxicidade, além de que esta associação aumentaria a probabilidade de uma pobre absorção da R.
A União Internacional Contra a Tuberculose, apresentou uma revisão dos esquemas de tratamento para tuberculose, onde se verificou, em vários estudos, que a adição da S nas fases iniciais do tratamento, dois primeiros meses, reduziria as taxas de falência em doentes sensíveis, mas, o acréscimo do E, neste esquema, não traria nenhuma vantagem nesse sentido. O esquema de R e H, com E em vez da Z, em doentes inicialmente sensíveis, demonstrou que o E teria uma baixa capacidade de esterilização, com uma taxa de doentes positivos a baciloscopia no segundo mês superior ao esquema que utilizou o Z, as taxas de falência e recidivas também foram superiores com uso do E quando comparado com o Z, com diferença estatisticamente significativa. (FOX,1999)
Deve-se destacar a necessidade de tratamento diferenciado para grupos específicos como os dependentes de álcool, e/ou outras drogas, os indigentes, os albergados, os prisioneiros, os internados em asilos e orfanatos. No Brasil o primeiro passo para uma terapia supervisionada seria a descentralização do diagnóstico e do tratamento. No Rio de Janeiro, por exemplo, estes procedimentos estão concentrados nos Centros de Saúde, o que dificulta o acesso dos doentes e o conhecimento, pelo serviço de saúde, de características próprias da comunidade (NATAL, 1993).
Repercussão da resistência no programa de controle da tuberculose.
Um programa de controle da tuberculose com boas estratégias, ou seja, com taxas eficientes de detecção de casos novos e de cura, tem pouca probabilidade de emergência de resistência.
Com o esquema de curta duração - R, H e Z - a eficácia verificada é de 95,0%, mas, outros fatores têm que ser cumpridos para evitar a emergência da resistência. Os principais seriam: um diagnóstico precoce que significa população bacilar pequena e, portanto, baixa probabilidade de emergência de bacilos resistentes; redução da taxa de abandono do tratamento e garantia de uso adequado das drogas (ROUILLON,1977; STYBLO, 1991)
Quando a taxa de abandono aumenta, surgem, consequentemente, bacilos resistentes. Em um primeiro momento será a resistência devido ao uso das drogas - resistência secundária. Como as taxas de sucesso de tratamento destes doentes é baixa - inferior a 60% nos melhores resultados - eles permanecem infectantes. Em um segundo momento detecta-se a resistência primária, decorrente da disseminação dos bacilos resistentes por estes doentes crônicos. Em caso de que a resistência primária ultrapasse a secundária, a situação epidemiológica é grave.
Considerando que a resistência secundária é decorrente das falhas operacionais do programa de controle da tuberculose, com a emergência da resistência primária onde já se tem a limitação de drogas para o tratamento, presume-se que a situação epidemiológica poderá deteriorar-se rapidamente
Referências bibliográficas
1. Aitken ML, Sparks R, Anderson K, et al. Predictors of drugresistant Mycobacterium tuberculosis. Am Rev Respir Dis 1984; 130:831-33.
2. Barnes PF. Compliance of patients and physicians: experience and lessons from tuberculosis. BMJ 1983; 287: 101-05.
3. Barreto AMW, Martins FM. Estudo da resistência primária no Brasil de 1986 a 1988. Bol CNCT 1988; 2: 21-5.
4. Beck-Sague C, Dooley SW, Hutton MD, et al. Hospital outbreak of multidrug-resistant Mycobacterium tuberculosis infections: factors in transmission to staff and HIV infected patients. JAMA 1992; 268:1280-86.
5. Bem-Dov I, Mason GR. Drug-resistant tuberculosis in a Southern California hospital : trends from 1969 to 1984. Am Rev Respir Dis 1987; 135: 1307-10.
6. Braga JU, Barreto AMW, Hijjar MA. Inquérito epidemiológico da resistêmcia as drogas usadas no tratamento da tuberculose. BR: Relatório final. Rio de Janeiro: CRPHF/FUNASA; 1999.
7. Canetti G. Present aspects of bacterial resistance in tuberculosis. Am Rev Respir Dis 1965; 92: 687-703.
8. Centers for Disease Control. Nosocomial transmission of multidrug-resistant tuberculosis among HIV-infected persons - Florida and New York, 1988-91. MMWR 1991; 40(34): 585-9.
9. Centers for Disease Control. Initial therapy for tuberculosis in the era of multidrug resistance: recommendations of the Advisory Council for the Elimination of Tuberculosis. MMWR 1993; 42(7):1-13.
10. Chaulet P. Compliance with anti-tuberculosis chemotherapy in developing countries. Tubercle 1987; 68: 19-24.
11. Choudri SH, Hawken M, Gathua S, et al. Pharmacokinetics of antimycobacterial drugs in patients with tuberculosis, AIDS and diarrhea. Clin Infect Dis 1997; 25: 104-11.
12. Costelo HD, Caras GJ, Snider Jr DE. Drug resistance among previously treated tuberculosis patients: a brief report. Am Rev Respir Dis 1980; 121: 313-16.
13. Driver CR, Valway SE, Morgan WM, et al. Transmission of Mycobacterium tuberculosis associated with air travel. JAMA 1994; 272: 1031-35.
14. Ellard GA, Fourie PB. Rifampicin bioavailability: a reviw of its pharmacology and the chemotherapeutic necessity for ensuring optimal absorption. Int J Tuberc Lung Dis1999; 3(11 Suppl 3): S301-S308.
15. Feng-Zeeng Z, Levy MH, Sumin W. Sputum microscopy results at two and three months predicted outcome of tuberculosis treatment. Int J Tuberc Lung Dis 1997; 1( 6): 570-72.
16. Fox W, Mitchison DA. Short-course chemoterapy for pulmonary tuberculosis. Am Rev Resp Disease 1975; 2: 325-47.
17. Fox W. Manejo y tratamiento modernos de la tuberculosis pulmonar. Bol UICT 1977; 52: 27-32.
18. Fox W. Estado actual de la quimioterapia acortada de la tuberculosis. Bol UICT 1978 53 (4): 27-32.
19. Fox W. Ellard GA, Mitchison DA. Studies on the treatment of tuberculosis undertaken by British Medical Research Council Tuberculosis Units, 1946-1986, with relevants subsequent publications. Int J Tuberc Lung Dis 1999; 3(10):231-79.
20. Frieden T, Sterling T, Pablos-Mendez A, et al. The emergence of drug-resistant tuberculosis in New-York. N Engl J Med 1993; 328: 521-26.
21. Goble M, Iseman MD, Madsen LA, et al. Treatment of 171 patients with pulmonary tuberculosis resistant to isoniazid and rifampin. N Engl J Med 1993; 328: 572-32.
22. Grange J M. Tubercle 1978 1990. Tubercle 1990: 71: 157-59.
23. Grange JM. The mistery of the mycobacterial "persistor". Tuber Lung Disease 1992; 73: 249-51.
24. Hershfield E S. Drug resistance- response to Dr. Shimao. Tubercle 1987; 68 Suppl: 17-18.
25. Howard WL, Maresh F, Mueller EE, et al. The role of pulmonary cavitation in the development of bacterial resistance to streptomycin. Am Rev Tuberc 1994; 59: 391.
26. Howlet HS, O’Connor JB, Sadusk Júnior JF, et al. Sensitivity of tubercle bacilli to streptomycin: the influence of various factors upon the emergence of resistant strains. Am Rev Tuberc 1949; 59: 402.
27. Huma LM. Prevention and treatment of drug-resistant tuberculosis. Am J Health Syst Pharm 1996; 53(1): 2291-98.
28. Iseman M, Madsen LA. Drug-resistant tuberculosis. Clin Chest Med 198; 10: 341.
29. Kwon HH, Tomioka H, Saito H. Distribution and characterrization of lactamases of b- mycobacteria and related organisms. Tuber Lung Dis 1995; 76(2):141-48.
30. Laszlo A, Kantor IN. Encuesta por muestreo aleatorio de farmacoresistencia inicial en casos de tuberculosis en América Latina. Bol Oficina Sanit Panam 1995; 119(3) 226-35.
31. Lima Filho M T, Oliveira AG, Nishi I, et al. Resistência primária do Mycobacterium tuberculosis no Brasil. Rev Med Brasil 1980; 26(6):182-84.
32. Mahmoudi A, Iseman MD. Pitfalls in the care of patients with tuberculosis: common errors their association with the acquisition of drug resistance. JAMA 1993; 270(1): 65-8.
33. Mitchison DA. Basic mechanism of chemoterapy. Chest 1979; 76(6Suppl):771-81.
34. Mitchison DA, Nunn AJ. Influence of initial drug resistance on the response to short course chemotherapy of pulmonary tuberculosis. Am Rev Respir Dis 1986; 133: 423-30.
35. Mitchison DA. How drug resistance emerges as a result of poor compliance during short course chemotherapy for tuberculosis. Int J Tuberc Lung Dis 1998; 2( 1): 10-5.
36. Natal S. Abandono do tratamento da tuberculose: aspectos do tratamento mal conduzido. [dissertação de Mestrado em Saúde Coletiva]. Rio de Janeiro: Instituto de Medicina Social, Universidade do Estado do Rio de Janeiro; 1993. 140p.
37. Natal S. Fatores de predição para a resistência aos tuberculostáticos: discussão do padrão e dos possíveis fatores como causa da resistência ao tratamento específico da tuberculose.[tese de Doutorado em Saúde Coletiva; Epidemiologia] Rio de Janeiro: Instituto de Medicina Social, Universidade do Estado do Rio de Janeiro; 2000. 116p.
38. Neu HC. The crisis of antibiotic resistance. Science 1992; 257: 1064-73.
39. Nikaido H. Prevention of drug acsses to bacterial targets: permeability barriers and active eflux. Science 1994; 264:328-88.
40. Pablos Mendez A, Knirsch CA, Barr G, et al. Nonadherence in tuberculosis treatment: predictors and consequences in New York City. Am J Med 1997; 102: 164-70.
41. Parsons LM, Driscoll JR, Taber HW, et al. Drug resistance in tuberculosis. Infect Dis Clin N Am 1997; 11(4): 945-50.
42. Pinto WP. Tuberculose e resistência a drogas em pacientes atendidos em um centro de referência para síndrome da imunodeficiência adquirida em São Paulo. 1998. [tese de Doutorado] São Paulo: Universidade de São Paulo; 1998. 141p.
43. Pitchenik AE, Russel BW, Cleary T, et al. The prevalence of tuberculosis and drug resistance among Haitians. N Engl J Med 1982; 307: 162-65.
44. Plikaytis BB, Marden JL, Crawford J T, et al. Multiplex PCR assay specific for the multidrug-resistant stain W of Mycobacterium tuberculosis. J Clin Microbiol 1994; 32: 1542-46.
45. Reichman LB. How to ensure the continued resurgence of tuberculosis. Lancet 1996; 347: 175-77.
46. Reichman LB. Tuberculosis elimination: what’s to stop us? Int J Tuberc Lung Dis1997; 1: 3-11.
47. Research Committee of South-East Metropolitan Regional Thoracic Society. Relapse in tuberculosis. Brit J Dis Chest 1973: 67: 3342.
48. Ridzon R, Whitney CG, Mackenna MT, et al. Risk factors for rifampin mono-resistant tuberculosis. Am J Respir Crit Care Med 1998; 157: 1881-84.
49. Rieder H L. Epidemiology of tuberculosis in Europe. Eur Respir J 1995; 8 (Suppl 20): 620-32.
50. Riley LW, Arathoon E, Loverde VD. The epidemiologic patterns of drug resistant Mycobacterium tuberculosis: a community-based study. Am Rev Respir Dis 1989; 19: 1282-85.
51. Rouillon A, Perdrizet S, Parrot R. et al. Metodos de controle de la tuberculosis. Washington: Organization Panamericana de la Salud; 1977. 81 p.
52. Sbarbaro J, Blomberg B, Chaulet P. Fixed-dose combinations for tuberculosis treatment. Int J Tuberc Lung Dis 1999; 3( 11Suppl): S286-S287.
53. Sahai J, Gallicano K, Swick L, Tailor S, et al. Reduced plasma concentrations of antituberculosis drugs in patients with HIV infection. Ann Int Med 1997; 127( 4): 289-93.
54. Salomon N, Perlman D C, Friedman P, et al. Predictors and outcome of multidrug-resistant tuberculosis. Clin Infect Dis 1993; 21: 1245-52.
55. Salomon N, Perlman DC, Depalo VA, et al. Drug-resistant tuberculosis: factors associated with rise in resistance in na HIV-infected urban population. Mt Sinai J Med 1994;61(4): 341-48.
56. Sbarbaro JA. A chanllenge: to our practices and to our principles. Tuber Lung Dis 1996; 77: 2-3.
57. Snider DE, Kelly GD, Cauthen GM, et al. Infection and disease among contacts of tuberculosis cases with drug-resistant and drug-susceptible bacilli. Am Rev Respir Dis 1985; 132: 125-32.
58. Styblo K. Epidemiology of tuberculosis. Royal Nrtherlands Tuberculosis Association. Selected Papers 1991; 24: 10-115.
59. Sudre P, Tem Dam G, Kochi A. Tuberculosis: a global overview of the situation today. Bull WHO 1992; 70: 149-59.
60. Sumartojo E. When tuberculosis treatment fails: a social behavioral account of patient adherence. Am Rev Respir Dis 1993; 147: 1311-20.
61. Valway SE, Richard SB, Kovacovich J, et al. Outbreak of multidrug-resistant tuberculosis in a New York State prison, 1991. Am J Epidemiol 1994; 140: 113-22.
62. Weltman AC, Rose DN. Tuberculosis susceptibility patterns, predictors of multidrug resistance, and implications for initial therapeutic regimens at a New York City Hospital. Arch Intern Med 1994;154:2161-67
63. World Health Organization. Tuberculosis notifications update. Bull WHO 1994; 72( 2): 213-20.
64. World Health Organization. Anti tuberculosis drug resistance in the world. Geneva: WHO; 1997. 227 p.
1 3 a 6 meses S + H + PAS/ 12 meses H + PAS/ 6 meses H
2 3 meses S + H + PAS/ 3 meses H + PAS/ 6 meses H
3 Segundo a OMS: Resistência adquirida ou secundária: é aquela encontrada em pacientes que receberam no mínimo 1 mês de tratamento prévio com tuberculostáticos. Resistência primária: é a presença de cepas resistentes de M. tuberculosis, em doentes sem história de tratamento. Resistência Combinada: é a prevalência de resistência às drogas específicas, entre todos os casos de tuberculose, independente de tratamento anterior, em um dado ano, em um pais.
4 Multi-droga resistente : é definida como a resistência, no mínimo, à H e à R, as duas mais potentes drogas da principal etapa do tratamento da tuberculose.













