Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Informe Epidemiológico do Sus
versión impresa ISSN 0104-1673
Inf. Epidemiol. Sus v.8 n.3 Brasília sep. 1999
http://dx.doi.org/10.5123/S0104-16731999000300002
Trajetória das doenças infecciosas: da eliminação da poliomielite à reintrodução da cólera*
Infectious diseases trends: from polio elimination to the reintroduction of cholera
Eliseu Alves WaldmanI; Luiz Jacinto da SilvaII; Carlos Augusto MonteiroI
IFaculdade de Saúde Pública/Universidade de São Paulo
IIFaculdade de Ciências Médicas/UNICAMP
RESUMO
Nas últimas décadas o perfil de morbimortalidade da população brasileira foi substancialmente alterado, sendo um traço marcante das modificações o declínio no peso relativo das doenças infecciosas e parasitárias. No presente trabalho procura-se resgatar tendências de evolução das principais doenças transmissíveis no País, buscando compreender, em cada momento, o papel desempenhado pelas ações de controle e o papel que se pode atribuir a outros fatores. Os dados reunidos neste trabalho, quando analisados em grupos específicos de doenças, permitem vislumbrar três situações paradigmáticas: 1) situações favoráveis que indicam que o controle está a caminho no qual destacam-se o declínio substancial das gastroenterites; a redução notável das doenças imunopreveníveis, em particular da poliomielite, doença considerada eliminada do país a partir de 1994; o declínio das enteroparasitoses; as perspectivas para a interrupção da transmissão natural da Doença de Chagas e a redução das formas graves da esquistossomose; 2) situações que sugerem que a doença subsistirá por longo tempo em nosso meio, representadas pelas grandes endemias urbanas - a tuberculose e a hanseníase e outras endemias como a malária e as leishmanioses; e 3) situações que apontam para doenças com grande potencial de expansão no país como a dengue e a cólera.
Palavras-Chave: Doenças Infecciosas e Parasitárias; Doenças Transmissíveis; Tendência das Doenças Infecciosas no Brasil.
SUMMARY
In the last decades the pattern of morbidity and mortality in the Brazilian population has undergone important changes. One of the main changes corresponds to the decrease in the relative weight of infectious and parasitic diseases. Trends in the evolution of the main transmissible diseases in the country are reviewed in this work and the role of controle measures and other factors is considered. Three different situations are apparent when data are analyzed in specific grups of diseases: 1) favorabel situations in which control measures were followed by a marked decrease in the following diseases and conditions: gastroenteritis, vaccine preventable diseases (in particular poliomyelitis, considered eliminated since 1994), enteroparasitosis, severe forms of schistosomiasis and the interruption of the natural transmition of Chagas `disease; 2) situations where diseases may persist for a long time as in the case of urban endemic diseases, such as tuberculosis and Hansens' disease and other endemic diseases, such as malaria and leishmaniasis; and 3) situations that point to diseases with a great expansion potential, such as dengue and cholera.
Key Words: Infectious and Parasitic Diseases; Transmissible Diseases; Infectious Diseases Trends in Brazil.
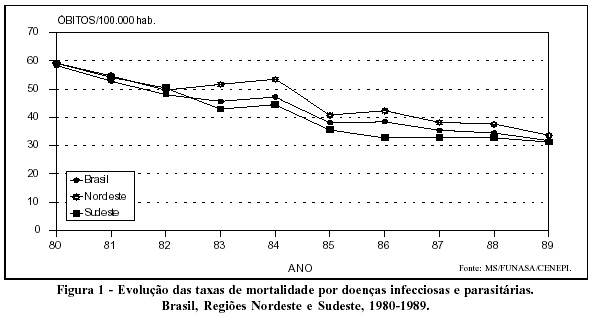
Nas últimas décadas, o perfil de mortalidade da população brasileira foi substancialmente alterado, sendo um traço marcante das modificações o declínio no peso relativo das doenças infecciosas e parasitárias. Responsáveis por quase metade de todos os óbitos ocorridos nas capitais dos estados brasileiros na primeira metade do século, as causas infecciosas determinaram 35,9% do total de mortes em 1950, 25,9% em 1960, 15,7% em 1970, 11,4% em 19801 e apenas 6,0% em 1989.2
A Figura 1 evidencia que não é apenas relativo o declínio da mortalidade por doenças infecciosas. As taxas de mortalidade, que expressam o risco de morte por enfermidades infecciosas, mostram-se efetivamente declinantes em todo o país.
Entre as causas infecciosas de mortalidade foram as gastroenterites as que apresentaram queda mais acentuada na última década (Figura 2).
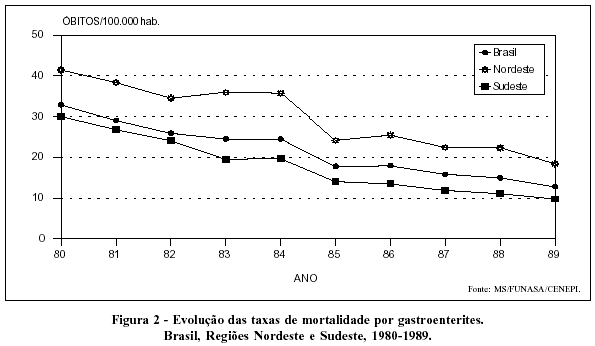
Apesar dessa evolução favorável, o Brasil ainda apresentava, na segunda metade da década de 80, coeficiente de mortalidade por doenças infecciosas e parasitárias em torno de 33,0 por 100.000 habitantes, próximo das taxas encontradas na Colômbia e Suriname e bem acima das verificadas em países como o Chile (19,2 por 100.000 habitantes), Costa Rica (11,8 por 100.000 habitantes) e Cuba (9,1 por 100.000 habitantes).3
A tendência geral da morbidade por doenças infecciosas e parasitárias nos últimos vinte anos foi igualmente declinante. No entanto, houve, no mesmo período, o ressurgimento de doenças infecciosas há muito consideradas erradicadas e o aparecimento de outras até então desconhecidas.
O ressurgimento de antigas enfermidades tem sido interpretado, com freqüência, como evidência da deterioração das condições sanitárias do país e do seu retrocesso à situação vigente no início do século. Na realidade, esse raciocínio expressa equívocos que resultam da falta da compreensão mais ampla de como se dá a dinâmica do processo infeccioso, de erros conceituais a respeito do que venha ser controle e erradicação de doenças transmissíveis e da ausência de informações sistematizadas sobre o comportamento do conjunto das doenças infecciosas, lacuna essa que se procurará suprir, ao menos em parte, no correr deste capítulo.
As novas doenças e o ressurgimento de antigos problemas
Nas últimas décadas, o comportamento das doenças infecciosas tem mudado em todo mundo. Por trás das mudanças estão, entre outros aspectos, o próprio progresso científico e tecnológico, transformações econômicas e sociais de caráter mundial que determinam transformações radicais na vida do homem e a influência de tecnologias médicas.
A probabilidade de introdução de agentes patogênicos exóticos nos países foi significativamente ampliada pela intensificação do intercâmbio internacional. Um exemplo é o dengue, cujo vírus é disseminado por indivíduos infectados que se deslocam de países afetados para outros ainda indenes, enquanto os vetores responsáveis pela transmissão da doença invadem continentes utilizando vias de transporte inusitadas, como o comércio internacional de pneus usados.
Há que se reconhecer, também, o aumento na velocidade de identificação de "novas" doenças, seja pelo aprimoramento de técnicas de diagnóstico e vigilância, seja por modificações no comportamento de microrganismos já conhecidos, seja ainda pelo surgimento de novos agentes etiológicos.
Como exemplo de doença infecciosa recentemente reconhecida pelo desenvolvimento de novas técnicas de diagnóstico, pode citar-se a doença dos legionários, que pode apresentar manifestações respiratórias graves, com letalidade elevada, quando não tratada adequadamente. A caracterização desse novo agravo deu-se no final dos anos 70. Seu agente etiológico, com alguma freqüência, mantém-se e multiplica-se em instalações hidráulicas e de ar condicionado, especialmente de grandes edifícios, afetando, na forma de casos isolados ou de surtos, pessoas expostas a esse tipo de ambiente.4
Em meados da década de 80, além do notório exemplo da Aids, assiste-se a introdução, em amplo espaço do território nacional, de um novo enterovírus, o EV-70, identificado poucos anos antes na África e originário, provavelmente, da mutação de um vírus que normalmente infecta a população felina.5 Sabe-se que a infecção por ele determinada está relacionada a manifestações neurológicas, algumas delas similares à síndrome poliomielítica.
Alterações de ambientes naturais também podem favorecer o contato do homem com vírus que circulam naturalmente entre animais silvestres. Como conseqüência desse contato, podem ocorrer epidemias, muitas vezes graves, geralmente causadas por arbovírus e que, posteriormente, podem tornar-se endêmicas na população humana. Enquadra-se nessa situação a epidemia de encefalite pelo vírus Rocio, no vale do Ribeira, Estado de São Paulo, no final dos anos 70.6,7
Outra nova doença, que tem assumido características de problema de saúde pública no Brasil, é a febre purpúrica brasileira (FPB). O H. ægyptius, bactéria responsável pela doença, é conhecido desde o final do século passado; até a década de 80, pelo que se sabe, era responsável, exclusivamente, por doenças de pequena gravidade, como a conjuntivite aguda purulenta, comum em regiões de clima tropical. A alteração do comportamento da bactéria, determinando o aparecimento da nova doença, deve-se, possivelmente, a uma modificação de sua estrutura genética que resultou em aumento de virulência, tornando-a capaz de invadir o organismo humano.8
Outro problema que chama a atenção são os riscos derivados do desenvolvimento da biotecnologia. Constituem exemplos desses riscos o desenvolvimento dos chamados inseticidas biológicos e de algumas vacinas de quarta geração, produtos elaborados com vírus modificados por meio de técnicas moleculares e de engenharia genética. Ainda que a comercialização desses produtos seja, ao menos em países desenvolvidos, cuidadosamente controlada, não se pode afastar a possibilidade, mesmo que remota, de um acidente com grandes repercussões.9,10
Por fim, deve-se lembrar que, com alguma freqüência, as próprias autoridades sanitárias declaram algumas doenças como erradicadas quando não o foram, passando para a população uma visão incorreta da situação.
Foi o que aconteceu com o tracoma no Estado de São Paulo. Após a desmobilização dos serviços de controle dessa doença, por cerca de duas décadas, verifica-se hoje sua ampla disseminação no território paulista, ainda que apresentando quadro de menor gravidade.11
O último exemplo mostra a importância de se conhecer os significados precisos, em saúde pública, dos termos erradicação, eliminação e controle.
De modo sucinto, pode-se dizer que a erradicação de doença transmissível implica a extinção, por métodos artificiais, do agente etiológico em questão, ou de seu vetor, sendo por conseqüência impossível sua reintrodução e totalmente desnecessária a manutenção de quaisquer medidas de prevenção. Cumpre salientar que esse objetivo raramente é factível, sendo a erradicação da varíola uma exceção e não a regra em Saúde Pública.12
Uma alternativa próxima à erradicação, mais viável, é a eliminação de uma doença, que se obtém pela cessação da sua transmissão em extensa área geográfica, persistindo, no entanto, o risco de sua reintrodução, seja por falha na utilização dos instrumentos de controle, seja pela modificação de seu comportamento.13 Por outro lado, no controle aceita-se a convivência com determinadas doenças, desde que em níveis considerados toleráveis.
Tanto na eliminação como no controle de doenças, é indispensável a manutenção, regular e contínua, não só das medidas de intervenção pertinentes, mas também de instrumentos que permitam acompanhar o comportamento das doenças e o desempenho dos serviços de saúde.13
O sistema de informação relativo às doenças transmissíveis
A vigilância epidemiológica foi introduzida no Brasil, como atividade dos serviços gerais de saúde, durante a Campanha de Erradicação da Varíola, no início da década de 70.14
A partir de 1976, o Ministério da Saúde inicia, efetivamente, a implantação em todo o território nacional do Sistema de Vigilância Epidemiológica, com a finalidade de organizar a coleta e análise da informação voltada à agilização e ao aperfeiçoamento das atividades de controle das doenças infecciosas.
Direta ou indiretamente ligadas à implantação da vigilância epidemiológica no país, várias medidas contribuíram para o aperfeiçoamento da qualidade da informação sobre doenças infecciosas. Dentre as medidas mais notáveis, cabe mencionar a implantação do formulário padronizado de declaração de óbito, que permitiu o desenvolvimento, a partir de 1976, do sistema nacional de informações de mortalidade, um marco no aprimoramento das estatísticas vitais no país. Outras medidas importantes envolveram a padronização das fichas de notificação e de investigação das doenças de notificação compulsória, assim como o estabelecimento de fluxos de informação e a delimitação das responsabilidades no nível nacional e estadual.
Apesar de serem ainda elevadas, tanto a proporção de óbitos de causa não especificada, como a subnotificação das doenças notificáveis, o sistema nacional de informações de mortalidade e de doenças de notificação compulsória permite identificar tendências, constituindo, portanto, importante instrumento de análise epidemiológica de situação.
Entre os esforços despendidos, para aprimorar a qualidade das informações disponíveis relativas à morbimortalidade, cabe citar a implantação a partir de 1977 do Sistema Nacional de Laboratórios de Saúde Pública, que propiciou a criação, em todo país, com apoio do Ministério da Saúde, de 515 unidades de laboratório com diferentes níveis de complexidade.
Por fim, merece menção especial o recente esforço do Centro Nacional de Epidemiologia (CENEPI) em compilar, analisar e publicar informações anteriormente dispersas pelos diferentes órgãos do Ministério da Saúde, as quais facilitaram, significativamente, a análise que segue.
Evolução das doenças transmissíveis
Fazer um balanço do desempenho do país no controle das doenças transmissíveis nas últimas décadas é tarefa a ser cumprida com cautela. Não só pela qualidade das informações, mas também pelos múltiplos fatores que interferem na efetividade das ações de controle, ora predominando questões técnicas, ora operacionais, sempre influenciadas por determinantes sociais e políticas.
O presente trabalho procura resgatar tendências de evolução das principais doenças transmissíveis no Brasil, buscando compreender, em cada momento, o papel desempenhado pelas ações de controle e o papel que se pode atribuir a outros fatores.
Na análise apresentada a seguir, ainda que se enfoque por vezes esta ou aquela doença, em virtude da ausência de um denominador epidemiológico comum, procurar-se-á, sempre que possível, agrupar as enfermidades segundo a existência de medidas comuns de controle.
Doenças imunopreveníveis
Trata-se aqui de avaliar o comportamento da poliomielite, do sarampo, do tétano, da coqueluche e da difteria, doenças que, não obstante situações sociais e econômicas as mais diversas, são controláveis e potencialmente elimináveis mediante imunização em massa.
Outras doenças imunopreveníveis, como por exemplo a rubéola e a caxumba, não serão aqui analisadas, em face da precariedade das informações disponíveis.
O Programa Ampliado de Imunizações (PAI) instituído em 1974 pela Organização Mundial da Saúde (OMS), incluindo seis doenças - poliomielite, sarampo, tétano, difteria, coqueluche e tuberculose — constituiu marco importante para a ampliação do controle de doenças por meio de vacinas.
Quando do início do PAI, a cobertura vacinal em nível mundial girava em torno de apenas 5% e a meta do programa era imunizar, até 1990, todas as crianças menores de um ano do planeta.
Como resultado efetivo do programa, tem-se atualmente uma cobertura vacinal mundial média, em torno de 80,0%. Na Europa e nas Américas foram alcançadas coberturas vacinais geralmente superiores às da média mundial. Por outro lado, na África e na Ásia, excetuando-se alguns poucos países, as coberturas ficaram entre 40% e 70%. Apesar de a meta de universalização da imunização não ter sido atingida, os resultados alcançados pelo PAI são, no mínimo, animadores.
No Brasil, o PAI foi incorporado às metas do Ministério da Saúde e das Secretarias Estaduais de Saúde no início da década de 80. Porém, somente no início da década de 90 foram conseguidas, de forma razoavelmente homogênea para o país, coberturas de vacinação de rotina, em menores de um ano, em torno de 70% a 80%. O pior desempenho é o da vacinação de rotina contra a poliomielite, compensado largamente por bem-sucedidas campanhas de vacinação em massa.15
Na análise que segue não se inclui a tuberculose, que será objeto de um item específico.
Poliomielite
Entre as atividades de controle das doenças imunopreveníveis nos anos 80, sem dúvida alguma, a que obteve melhor resultado foi a de combate à poliomielite. Desde 1980, com o início das campanhas nacionais de imunização em massa, a queda na incidência da doença foi rápida e intensa, tendo o último caso confirmado da doença ocorrido em 1989 (Figura 3).
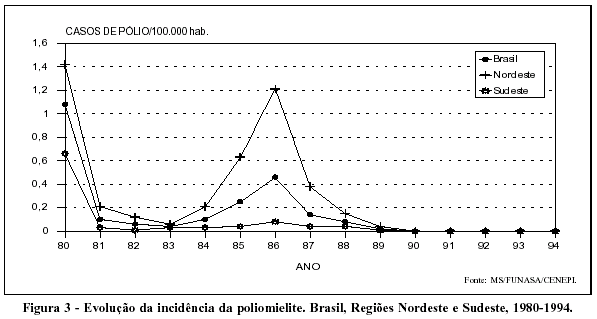
Os resultados obtidos no Brasil com os Dias Nacionais de Vacinação foram tão importantes, que serviram de subsídio para a elaboração da estratégia do programa global de erradicação do poliovírus "selvagem", promovido pela Organização Mundial da Saúde a partir de 1987.16,17
Vale assinalar, no entanto, que a trajetória da eliminação da poliomielite no Brasil não foi tranqüila. Em 1986, em conseqüência, sobretudo, das baixas coberturas vacinais atingidas no Nordeste e da menor imunogenicidade do poliovírus 3 vacinal, houve extensa epidemia em estados daquela região (Figura 3).
Essa situação foi solucionada por meio da ampliação das atividades de imunização em massa, que passaram a ser aplicadas três vezes ao ano na Região Nordeste, e por modificações na composição da vacina utilizada no país, com aumento da concentração do poliovírus 3.18
Assim feito, o Brasil retomou sua caminhada em direção à eliminação do poliovírus "selvagem"; desde 1989 não são detectados casos clínicos determinados pelo poliovírus "selvagem" ou mesmo a presença desse vírus em portadores assintomáticos ou ainda no meio ambiente. Estágio semelhante do programa foi alcançado, a partir de 1991, em todo o continente americano.
A eliminação do poliovírus "selvagem" não afasta a possibilidade de ocorrência, ainda que rara, de casos paralíticos, semelhantes à poliomielite, associados à vacina de vírus vivos atenuados, ou a infecções causadas por outros enterovírus. A ocorrência de paralisias por outros enterovírus, que não o poliovírus, pode apresentar-se na comunidade tanto na forma de casos esporádicos como de epidemias. Um exemplo são as epidemias de "poliomielite-like" que ocorreram no Leste Europeu, no final dos anos 70, causadas pelo enterovírus-71 (EV-71).19,20
Deve-se notar que a virtual eliminação do poliovírus "selvagem" foi obtida no Brasil por meio de campanhas sucessivas de vacinação em massa, com coberturas próximas a 90% da população de menores de cinco anos. Essa estratégia permitiu uma ampliação significativa da proporção de indivíduos imunes, especialmente entre as crianças maiores de seis meses. No entanto as condições determinantes da infecção precoce pelo poliovírus que se expressavam pela concentração de casos nos dois primeiros anos de vida possivelmente não se alteraram no país.21 Essa hipótese é reforçada pela distribuição etária dos casos da doença na epidemia verificada em 1986 no Nordeste.18
A situação atual da poliomielite nas Américas constitui exemplo típico do que se conceitua, neste texto, como eliminação de uma doença transmissível.
A propósito, vale lembrar que, no início de 1993, como repercussão de uma epidemia de poliomielite na Europa, que atingiu grupo religioso que recusa a vacinação, foi identificada, no Canadá, o ressurgimento da circulação do poliovírus "selvagem". Tal fato vem demonstrar que, apesar do sucesso do programa, ainda há o risco da reintrodução da poliomielite nas Américas.22
Os excelentes resultados obtidos no continente americano pelo programa de erradicação do poliovírus "selvagem" foram atingidos mediante estratégia muito semelhante à desenvolvida pela campanha de erradicação da varíola. Naquela oportunidade, houve o uso combinado da vacinação em massa, vigilância epidemiológica e vacinação seletiva. Essa estratégia pressupõe a participação de um grupo reduzido de técnicos responsáveis pelo planejamento e acompanhamento do programa, cabendo à rede básica de saúde atividade mais intensa somente nas épocas de vacinação em massa.
O pequeno envolvimento dos serviços básicos de saúde nesse programa explica, ao menos em parte, as baixas coberturas de rotina alcançadas pela vacinação antipólio, sobretudo na Região Nordeste (Figura 4).
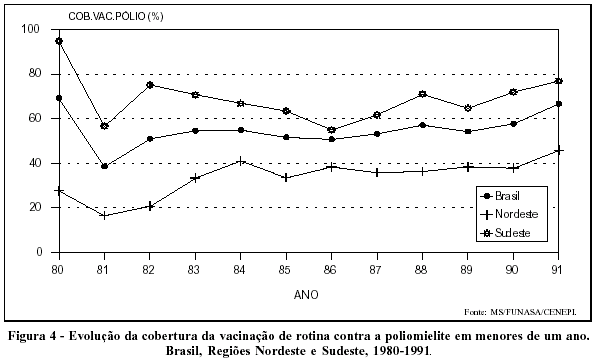
Considerando que o programa de erradicação do poliovírus "selvagem" é ainda incipiente em muitos países da África e da Ásia, haverá que se manter, por muitos anos, no Brasil, as campanhas de vacinação em massa e a rigorosa vigilância sobre o problema.
As demais doenças imunopreveníveis não tiveram no país a ênfase conferida à poliomielite. Ainda assim, como se verá a seguir, progressos substanciais foram obtidos com relação a todas elas.
Sarampo
Considerando a severidade e, principalmente, a magnitude do dano, o sarampo é, em termos mundiais, a doença prevenível por vacinação de maior importância em saúde pública. Em populações não vacinadas, praticamente todos os indivíduos devem apresentar a doença. Estima-se que, nos países em desenvolvimento, as taxas de letalidade pelo sarampo variem entre 1% e 5%. Pesquisa realizada em Sri Lanka, verificou que mais de 50% dos casos estudados demandaram assistência médica. Os custos associados à doença são também elevados; mesmo nos EUA, cerca de 15% dos casos notificados necessitam hospitalização.23
Os esforços do PAI permitiram, a partir de 1974, substancial elevação das coberturas vacinais em todo mundo; ainda assim, estima-se que, em 1990, tenham morrido em todo o globo cerca de 880.000 crianças em decorrência do sarampo.23 É interessante notar que alguns estudos estimam que o controle do sarampo, pela imunização, poderia prevenir 0,6% a 3,8% de todos os episódios de diarréia, podendo também diminuir a mortalidade por diarréias numa proporção que varia entre 6% a 26% dos óbitos.24
Vários problemas operacionais dificultam o controle do sarampo, entre eles as diferenças regionais quanto à velocidade de perda da proteção conferida pelos anticorpos maternos, fator que determina a idade oportuna da vacinação contra a doença. De modo geral, ainda que por mecanismos não completamente esclarecidos, verifica-se que a proteção conferida pelos anticorpos maternos esvai-se mais rapidamente nos países pobres. Por outro lado, justamente nesses países, observa-se maior risco de infecção precoce pelo vírus do sarampo, o que resulta em elevadas taxas de mortalidade já no primeiro ano de vida.
A cobertura da vacinação de rotina contra o sarampo no Brasil flutuou entre 60% e 70% ao longo da maior parte da década de 80. Coberturas superiores à média foram registradas na Região Sudeste e coberturas inferiores na Região Nordeste. No início dos anos 90, a vacinação contra o sarampo é intensificada em todo o país, propiciando cobertura de 80% na Região Nordeste e de quase 90% na Região Sudeste (Figura 5).
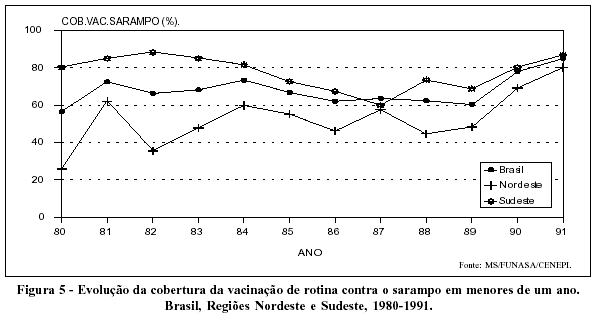
Ainda que alternando ciclos epidêmicos e endêmicos, o comportamento da incidência do sarampo sugere declínio da enfermidade em todo país (Figura 6).
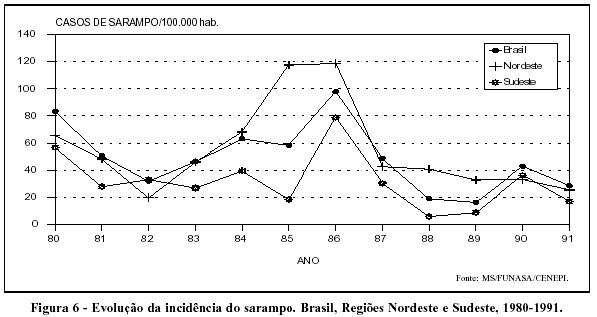
A tendência declinante da morbidade por sarampo na década de 80 é mais bem evidenciada no Estado de São Paulo, onde também se observa a redução da mortalidade pela doença (Figura 7). Ainda que a qualidade dos dados recomende cautela, o comportamento da relação morbidade/mortalidade sugere queda na letalidade da doença, o que estaria de acordo com a melhoria na nutrição infantil.
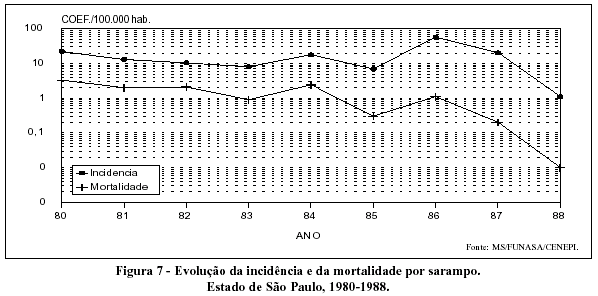
As metas estabelecidas em 1989 pela Organização Mundial da Saúde eram reduzir a morbidade e a mortalidade por sarampo, até 1995, em, respectivamente, 90% e 95%. Tomando o número de casos notificados em 1982 e 1992, tem-se uma queda de cerca de 80% da morbidade no país e de 95% no Estado de São Paulo. Por outro lado, no período 1980-1988, a diminuição da mortalidade foi de 88% no Brasil como um todo e de 93% no Estado de São Paulo.
De fato, no Estado de São Paulo, a mortalidade por sarampo praticamente deixou de existir nos últimos anos: 75 óbitos em 1987, 20 óbitos entre 1988 e 1990 e apenas 2 óbitos entre 1991 e 1993, sendo os dois casos de morte por sarampo em adultos (Antonio B.M. Camargo, Fundação SEADE, Comunicação pessoal).
Como conseqüência dos bons resultados obtidos no controle do sarampo no Estado de São Paulo e na Região do Caribe, a Organização Pan-Americana da Saúde (OPAS) propôs como meta a eliminação da doença nas três Américas. Tal proposta merece alguns comentários. Como sugere a experiência do Estado de São Paulo, para o controle do sarampo é necessário manter, com regularidade, coberturas de vacinação, em menores de um ano, superiores a 80,0%. Por sua vez, para a virtual eliminação do sarampo seria necessária uma proporção de imunes, homogeneamente distribuída na comunidade, de aproximadamente 95,0%. Considerando ser esta a eficácia da vacina, o sucesso da proposta de eliminação estaria condicionado a uma cobertura vacinal contra o sarampo de 100,0%, algo certamente não muito fácil de alcançar com a estrutura de serviços de saúde de que dispõe o país. Vale lembrar que a eliminação do sarampo não foi alcançada mesmo em países industrializados.22 Um exemplo claro se refere aos Estados Unidos: após ter quase eliminado a doença em meados dos anos 80, o país voltou a enfrentar sérias epidemias, especilmente em suas grandes cidades, no início da década seguinte.25
Tétano neonatal e acidental
O tétano caracteriza-se mais como enfermidade relacionada a riscos ambientais do que como doença transmissível; como tal, não se apresenta de forma epidêmica na comunidade. Tanto crianças como adultos adquirem a infecção tetânica por meio de ferimentos tratados inadequadamente. Entre mulheres adultas, é causa relativamente freqüente de tétano a contaminação uterina por falta de assepsia no parto ou em abortos.
Tanto o tétano acidental como o neonatal são causas importantes de morbimortalidade na maioria dos países do Terceiro Mundo.
Depois do sarampo, o tétano neonatal é a doença imunoprevinível que determina o maior número de mortes, tendo sido estimados em 400 mil os óbitos causados pela doença, em todo mundo, em 1992. Pequena parcela desses óbitos, cerca de 2%, ocorreu nas Américas, sendo a grande maioria das mortes originárias da África e do Sudeste Asiático.26
Ainda nos anos 50, o tétano neonatal virtualmente desapareceu dos países industrializados, antes, portanto, da disseminação do uso da vacina antitetânica em crianças e adultos. A incidência da doença nos EUA, no início da década de 60, era de 1 caso por 100.000 nascidos vivos.27
O tétano acidental também é responsável por taxas elevadas de mortalidade. Algumas projeções elaboradas em meados da década de 80 estimavam a ocorrência no mundo, excluída a China, de 120 a 300 mil óbitos anuais pela doença, boa parte deles atingindo indivíduos em idade economicamente ativa.27
As taxas de letalidade nas duas formas de apresentação da doença são altas; para o tétano neonatal variam entre 50% e 90%; para o tétano acidental ficam em torno de 40% a 50%. Os custos do tratamento hospitalar são muito elevados. Todas essas características conferem ao tétano grande importância em saúde pública, especialmente nos países não industrializados.27
A Organização Mundial da Saúde, em 1989, estabeleceu como meta para o PAI a eliminação do tétano neonatal até 1995.26
Em estudo realizado no final da década de 80, em onze países do continente americano, abrangendo 2.212 áreas geográficas, verificou-se que somente 9% das áreas estudadas apresentavam alto risco para tétano neonatal, concentrando 79% de todos os casos notificados de tétano neonatal. Preocupa notar que 58% dos casos ocorreram em áreas urbanas, em populações que tinham acesso a serviços de pré-natal e, ainda, que 78% dos casos se deram em crianças cujas mães já haviam tido ao menos duas gestações e que, portanto, poderiam ter sido facilmente alcançadas pelo programa de vacinação.28
O controle do tétano implica manter cobertura vacinal elevada, não só no primeiro ano de vida, mas ao longo de toda a existência dos indivíduos, até mesmo, no caso das mulheres, durante a gestação. No entanto, a experiência da maioria dos países industrializados demonstra que o controle do tétano passa igualmente pela assistência adequada ao parto e a ferimentos que possam determinar a instalação da doença. Na verdade, em boa parte dos países industrializados, o desaparecimento do tétano neonatal e o significativo decréscimo do tétano acidental foram obtidos quando ainda eram precárias as coberturas vacinais, devendo-se o controle da doença essencialmente a um bom padrão de assistência médica. De fato, tudo leva crer que o caminho para que se elimine a doença dos países do Terceiro Mundo passa, simultaneamente, pela elevação da cobertura vacinal e pelo aperfeiçoamento da assistência à saúde.
A partir de 1980, com a implementação do PAI no Brasil, as coberturas vacinais de menores de um ano com a vacina tríplice tenderam a aumentar, alcançando níveis próximos a 80% em todo o país no ano de 1991 (Figura 8).
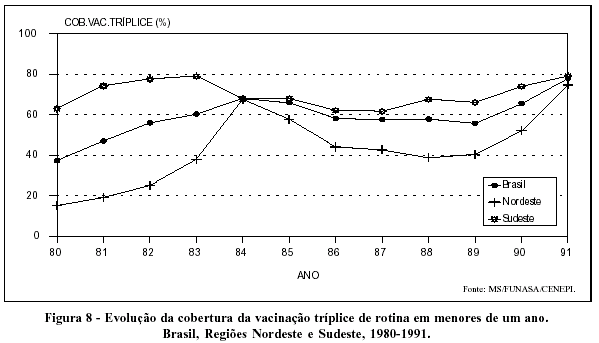
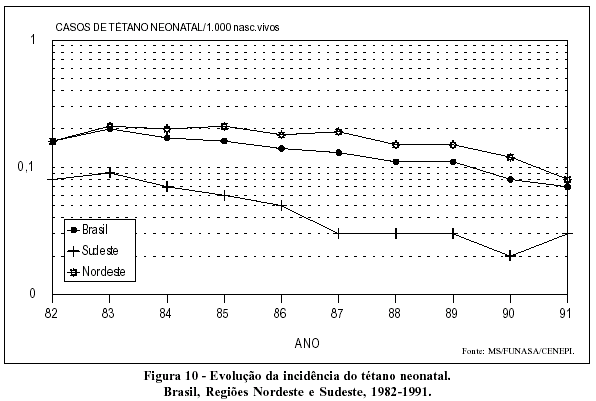
Tendências declinantes caracterizam a evolução da evidência do tétano acidental em todo o país (Figura 9). Situação semelhante é vista quanto à incidência do tétano neonatal, ainda que, nesse caso, o declínio seja bastante mais intenso na Região Sudeste (Figura 10).
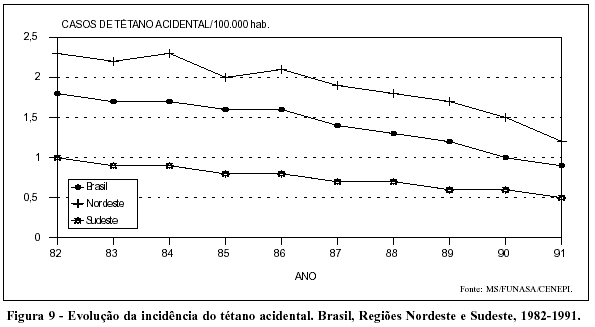
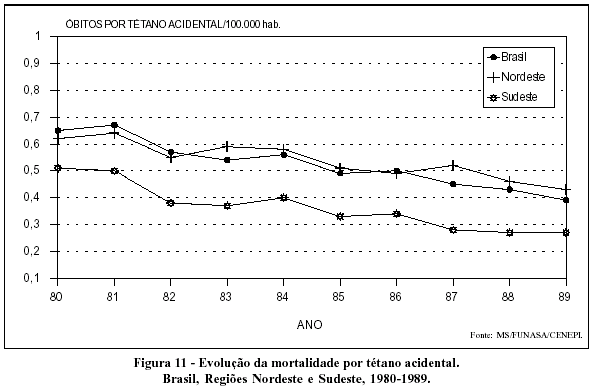
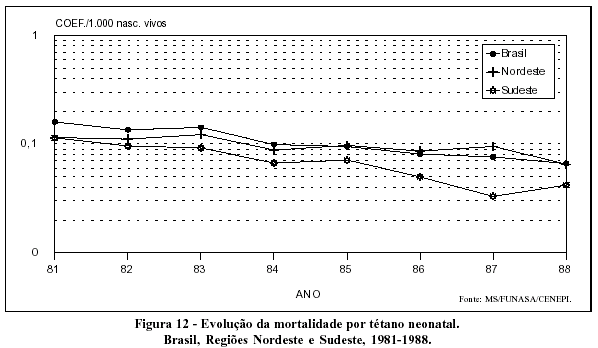
A mortalidade por tétano também se apresenta em declínio em todo o país (Figuras 11 e 12).
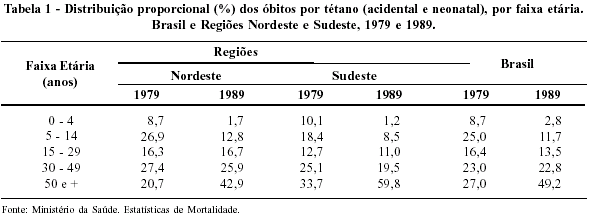
É interessante notar o crescimento relativo dos óbitos por tétano em indivíduos com cinqüenta ou mais anos de idade (Tabela 1). Tal fato, expressa, possivelmente, o menor sucesso das atividades de imunização com adultos, apontando a existência de deficiências quanto à qualidade da assistência médica prestada à população. Essa tendência é encontrada mesmo em unidades da Federação mais desenvolvidas economicamente, como é caso do Estado de São Paulo.29
Coqueluche e Difteria
A coqueluche ainda constitui sério problema de saúde pública nos países em desenvolvimento. Estima-se a ocorrência anual de 60 milhões de casos em todo o mundo, o que leva, aproximadamente, a 350 mil óbitos. O grupo etário submetido a maior risco de mortalidade é constituído pelos menores de um ano, sendo, nesse caso, pequena a proteção conferida pelos anticorpos maternos.30
Nas Américas, entre 1980 e 1990, observa-se redução de 67% nos casos de coqueluche notificados. Essa redução coincide com o aumento da cobertura vacinal em menores de um ano, que passou de 36,6% para 75,5%. No período houve também uma queda expressiva na mortalidade, algo em torno de 70%.30
Vale assinalar, porém, uma série de restrições à qualidade das informações disponíveis para o continente americano; entre elas a falta de padronização na definição de caso e o reduzido número de países que fornecem dados de morbimortalidade com regularidade.
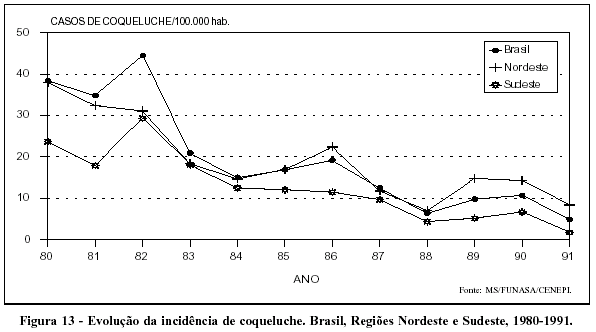
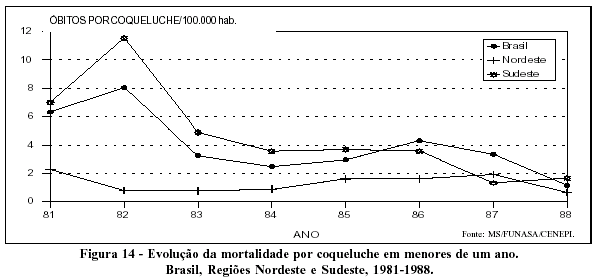
No Brasil, os dados disponíveis apresentam tendências semelhantes às do resto do continente americano. O aumento de cobertura da vacina tríplice em menores de um ano coincide com a queda da incidência da coqueluche (Figura 13). A mortalidade pela doença igualmente demonstra tendência declinante no período (Figura 14).
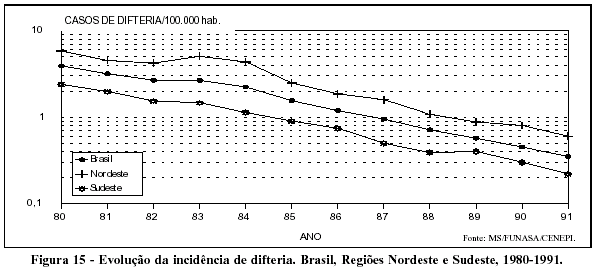
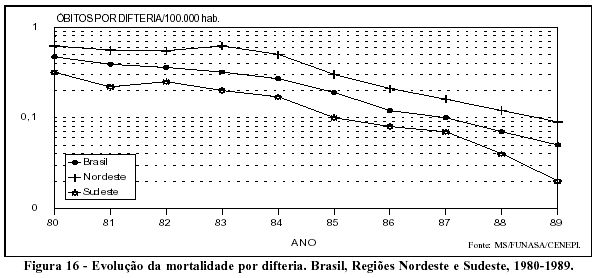
Os coeficientes de incidência relativos à morbidade por difteria nos anos 80 apresentam nítido decréscimo (Figura 15), observando-se também a relação inversa com a cobertura por vacina tríplice em menores de um ano e a relação direta com a queda da mortalidade (Figura 16).
Tanto no caso da difteria, quanto no da coqueluche, o conhecimento epidemiológico é ainda insuficiente, fato que tem impedido a elaboração de estratégias seguras que levem à eliminação da doença. De qualquer maneira, acredita-se que tal objetivo dependerá do controle da doença na população adulta, o que implica a utilização de vacinas produzidas com tecnologias mais avançadas e, portanto, mais caras.
Em síntese, pode-se afirmar que as medidas de controle das doenças imunopreveníveis no Brasil, durante a década de 80, obtiveram resultados muito favoráveis. Tendências de diminuição acentuada das taxas de morbimortalidade por essas doenças são verificadas em todo o país, sem que, entretanto, as desigualdades historicamente existentes entre regiões tenham sido significativamente alteradas.
O Estado de São Paulo foi a unidade da Federação onde o programa de controle das doenças imunopreveníveis manteve maior regularidade e onde foram colhidos os melhores resultados. A prioridade conferida à questão pelo estado propiciou o fortalecimento do seu sistema de vigilância epidemiológica, tendo também salutar efeito sobre o desenvolvimento de tecnologias médico-sanitárias como, por exemplo, as destinadas à operacionalização de vacinações em massa e de bloqueio.
Evolução da Tuberculose e da Hanseníase
Tratar-se-á em um mesmo item das tendências da tuberculose e da hanseníase, considerando que o comportamento de ambas é muito influenciado, de um lado, pelo nível de desenvolvimento sócioeconômico e condições de vida da população e, de outro, pela qualidade dos serviços de saúde na implementação de programas específicos de controle.
Para o estudo apropriado das tendências da morbidade por tuberculose e hanseníase, é indispensável a obtenção de informações, não só relativas às notificações dos casos que espontaneamente procuram as agências de saúde, mas também por meio da busca ativa de novos doentes entre os contatos domiciliares. Importante para a avaliação do desempenho dos programas são as informações relativas à evolução clínico-laboratorial dos pacientes e a freqüência com que ocorrem os abandonos de tratamento.
Tuberculose
No começo do século, a tuberculose era, possivelmente em todo mundo, a moléstia infecciosa que determinava o maior número de mortes.
A melhora das condições de vida, no correr do século, a introdução, na década de 40, de quimioterapia eficaz e o desenvolvimento subseqüente de tecnologias para a operacionalização de programas permitiram o controle da tuberculose no mundo desenvolvido. Na década de 70, alguns países, como por exemplo os Estados Unidos, chegaram a pensar na eliminação da doença. Nos países não desenvolvidos, a introdução da quimioterapia determinaria a queda significativa da mortalidade, sem afetar de modo substancial o risco da infecção tuberculosa.31
Estima-se que atualmente ocorram em todo o mundo cerca de 2,7 milhões de óbitos anuais por tuberculose, 95% dos quais nos países não desenvolvidos; nesses países a tuberculose é a única, entre as principais causas de óbito, que atinge, de forma importante, praticamente todas as faixas etárias.32
Tem merecido destaque o fato de que a queda contínua da tuberculose nos países industrializados tenha sido interrompida em meados da década de 80 e que venha mesmo elevando-se nos últimos anos.31 Essa situação está relacionada a um conjunto de fatores, destacando-se, entre eles, a epidemia de aids, o aparecimento de cepas multi-resistentes de M. tuberculosis e a ampliação, por problemas políticos e econômicos, da migração em direção aos países industrializados. Nesses países, certos segmentos sociais - minorias étnicas, imigrantes e habitantes de áreas urbanas deterioradas - apresentam taxas de tuberculose iguais ou, algumas vezes, superiores às encontradas em países não desenvolvidos.33
A perspectiva do recrudescimento da tuberculose tem levado a previsões pessimistas quanto à tendência da doença nos próximos anos. Estima-se que a incidência global da tuberculose aumentará de 7,5 milhões de casos em 1990 para 10,2 milhões no ano 2000; cerca de 70% dos casos atingirão pessoas na faixa etária de 15 a 59 anos, grupo etário de grande importância econômica. No final do século, estima-se que ocorrerão, anualmente, 1,4 milhões de casos de tuberculose atribuíveis à infecção pelo vírus da aids.34
Antes de que se inicie a análise dos dados disponíveis sobre a morbimortalidade por tuberculose no Brasil, cabe registrar que, desde a introdução da quimioterapia específica nos anos 40, houve queda importante na letalidade da doença no Brasil, tornando os coeficientes de mortalidade instrumentos menos sensíveis para avaliar a tendência de evolução da doença. Esse aspecto é assinalado por Guimarães,35 que registra, no período 1945-1960, queda de 73% nas taxas de mortalidade por tuberculose nas capitais brasileiras, sem diminuição correspondente na prevalência e incidência da doença.
Por sua vez, o estudo da tendência da tuberculose pela evolução dos coeficientes de morbidade deve ser efetuado com cautela, pois a subnotificação da doença é certamente importante, podendo variar conforme as condições dos serviços de saúde.
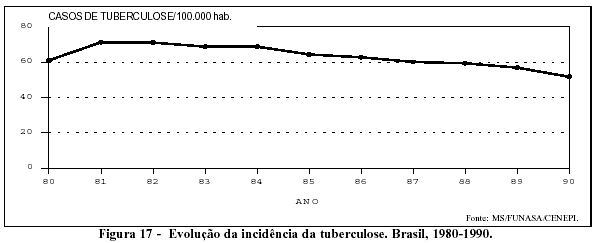
Os coeficientes de morbidade por tuberculose relativos ao período 1980-1990 apresentam decréscimo a partir de 1985 (Figura 17). No entanto, essa tendência deve ser analisada com cuidado em face ao processo de reorganização por que passam os serviços de saúde no país.
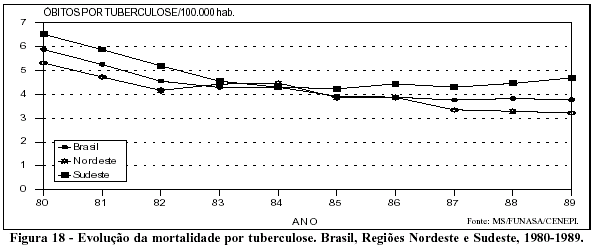
Com referência aos dados de mortalidade, observa-se queda dos coeficientes na primeira metade da década de 80 seguida de estabilidade (Figura 18). As taxas mais elevadas observadas na Região Sudeste, devem-se, provavelmente, à melhor qualidade da notificação da doença nessa região.
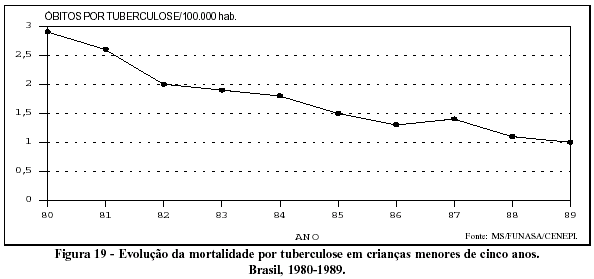
Chama a atenção, no entanto, a queda importante e contínua da mortalidade por tuberculose nos primeiros cinco anos de vida (Figura 19). Esse fato provavelmente expressa o impacto do aumento da cobertura da vacinação com BCG intradérmico em menores de um ano. A eficácia da vacina BCG tem gerado controvérsias, mas vários autores aceitam-na, no que tange à prevenção da meningite tuberculosa em crianças.36
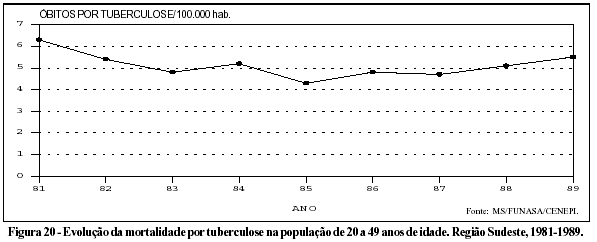
Um ponto que deve merecer atenção, pois expressa tendência que futuramente poderá atingir todo o país, é o aumento da mortalidade por tuberculose na população jovem da Região Sudeste (Figura 20). Tal aumento, observado nos últimos anos da década de 80, quase que certamente resulta do crescimento da epidemia de aids.37 Dados mais recentes da Fundação SEADE relativos à população de 15 a 49 anos da cidade de São Paulo indicam que a mortalidade por tuberculose aumentou em cerca de 50% em um período de apenas seis anos: 235 óbitos em 1987 e 359 óbitos em 1993.
Para que se tenha uma idéia da magnitude da tuberculose como problema de saúde pública no país, toma-se como exemplo o ano de 1991. Nesse ano foram identificados 78.581 casos novos da doença, sendo que 67.363 deles eram formas pulmonares, das quais 61,4% bacilíferas. Sabendo-se que esses números são subdimensionados e ainda que cerca de 17% dos pacientes com manifestações respiratórias não se submete a exames bacteriológicos, não é difícil imaginar em que nível se encontra o risco de infecção tuberculosa no Brasil.38
Outro aspecto a ser considerado na dimensão do problema da tuberculose é o custo social da doença, pois ela atinge justamente o grupo economicamente ativo, o da faixa etária de 20 a 49 anos. Segundo Hijjar,39 em 1986, a tuberculose foi responsável no Brasil por 4,7% e 1,2% dos anos potenciais de vida perdidos, respectivamente, por Doenças Infecciosas e Parasitárias e por todas as causas de óbitos bem-definidas.
A intervenção com que contam os serviços de saúde para o controle da tuberculose restringe-se ao diagnóstico e tratamento precoce, uma vez que a vacina BCG apresenta, como referido anteriormente, impacto limitado na incidência e prevalência da doença.
Dados relativos ao desempenho do programa de controle da tuberculose no Estado de São Paulo são preocupantes. Em 1992, a avaliação dos resultados do tratamento de 13.414 pacientes com tuberculose, sete meses após a introdução da terapêutica, verificou 40,8% de casos curados e 18,4% de abandono de tratamento (Centro de Vigilância Epidemiológica da Secretaria de Estado da Saúde de São Paulo, comunicação pessoal). Deve-se notar que, certamente, a qualidade do programa de controle da tuberculose no Estado de São Paulo não é inferior à média do país.
Resumindo, pode-se afirmar que a tuberculose continua sendo uma das mais importantes endemias urbanas no Brasil, não se afastando a hipótese de recrudescimento do problema ante a rápida expansão da epidemia de aids, ao possível surgimento de cepas multi-resistentes de M. tuberculosis, e à fragilidade da rede pública de serviços públicos de saúde do país.
Hanseníase
A hanseníase é das doenças mais antigas da humanidade. Os primeiros relatos a seu respeito são originários da Índia, de onde, acredita-se, a hanseníase se teria disseminado para a China, o Japão e, posteriormente, para os países banhados pelo Mediterrâneo. A epidemia de hanseníase na Europa teria atingido seu pico no século XIV, perdendo depois progressivamente sua importância em Saúde Pública, para praticamente desaparecer a partir do século XIX, muito antes, portanto, da existência de terapêutica específica.40
A queda na incidência da hanseníase na Europa é atribuída, sobretudo, às mudanças sociais e econômicas determinadas pela revolução industrial.40
Até a introdução da moderna quimioterapia, a evolução da hanseníase caracterizava-se por sua cronicidade. A importância da doença para a Saúde Pública derivava não do seu impacto sobre a mortalidade, mas das severas mutilações que determinava nos doentes. Entre pacientes não tratados, estima-se a freqüência de formas leves de incapacidade em cerca de 50%, ao passo que a freqüência das formas severas ficaria em torno de 30%.40
A adoção, na década de 80, da poliquimioterapia constituiu significativo avanço na tecnologia disponível para o controle da hanseníase. Os bons resultados obtidos com a utilização do novo esquema terapêutico ensejaram que a Organização Mundial da Saúde propusesse o controle da doença, estabelecendo, como meta, taxas inferiores a 1 caso por 10.000 habitantes.41
A partir de 1991, o programa de controle da hanseníase obteve consideráveis progressos em quase todo mundo. Entre os resultados favoráveis devem ser assinalados a redução da prevalência mundial da doença de 7 para 3 por 10.000 habitantes entre 1990 e 1994 e a ampliação da cobertura média mundial da poliquimioterapia para 89% dos casos conhecidos de hanseníase.41
Apesar do progresso, a hanseníase ainda se situa entre os principais problemas de Saúde Pública dos países desenvolvidos. Segundo estimativas recentes da Organização Mundial da Saúde, existiriam atualmente cerca de 2,2 milhões de hansenianos em todo o mundo, estando mais de 80% concentrados em apenas cinco países: Índia, Brasil, Bangladesh, Indonésia e Mianmá.41
O número de casos de hanseníase no Brasil é o segundo mais elevado do mundo, sendo superado somente pelo encontrado na Índia. Estimativa de 1994 situa a prevalência da doença no país em torno de 14,3 por 10.000 habitantes, três vezes maior do que a média do continente americano.41
Dados publicados pelo Ministério da Saúde, relativos a 1991, revelam a existência de 250.000 casos conhecidos da doença no país. Esses casos aparecem concentrados nas Regiões Sudeste (40,0%) e Norte (22,9%), mas também são encontrados nas Regiões Nordeste (12,7%), Centro-Oeste (12,7%) e Sul (11,7%).42
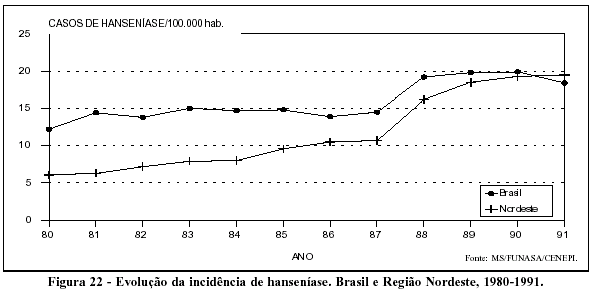
Analisando a tendência da hanseníase no Brasil no período de 1980 a 1990, chamam a atenção os elevados coeficientes de prevalência, especialmente nas Regiões Norte e Centro-Oeste, e a alta taxa de crescimento da endemia, cerca de 11,0% ao ano, no Nordeste brasileiro (Figuras 21 e 22). É possível que parte desse aumento esteja relacionado ao fortalecimento do programa específico de controle da doença, porém não se pode descartar a hipótese de a hanseníase estar em fase de expansão no país.
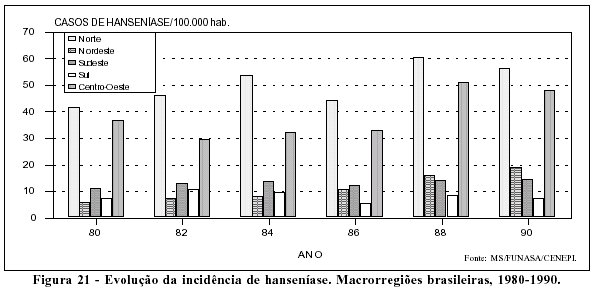
Reforça a hipótese de expansão a análise feita por Albuquerque e cols.43 a respeito da hanseníase em Recife (PE), durante o período 1960 a 1985. Nesse trabalho, os autores verificaram o predomínio da forma tuberculóide e elevado porcentual de doentes menores de quinze anos, dados que sugerem a expansão da endemia. Relatam também os autores que, a partir de 1979, ocorreu a diminuição e estabilização do intervalo de tempo decorrido entre o aparecimento dos primeiros sintomas e o diagnóstico da doença, fato que sugere a melhora do desempenho do programa e, por decorrência, a melhora no registro da doença.
Publicação recente da Organização Mundial da Saúde assinala que, nos últimos quatro anos, a média anual do decréscimo da incidência da hanseníase, em várias partes do mundo, variou de 7% a 18%; revela, também, que o único país a relatar um aumento de incidência foi o Brasil. Analisando a situação brasileira, a organização internacional considera que o aumento verificado pode refletir tanto uma expansão da endemia, como a ampliação das atividades de controle, ou, mesmo, uma combinação dos dois fatores. No entanto, alerta para a cobertura muito baixa da poliquimioterapia - menos de 40%.41
Outro dado preocupante é o fato de 49,2% dos casos identificados de hanseníase apresentarem-se nas formas virchowiana ou dimorfa, o que sugere o diagnóstico tardio da doença e a existência de maior proporção de casos multibacilares (Tabela 2).
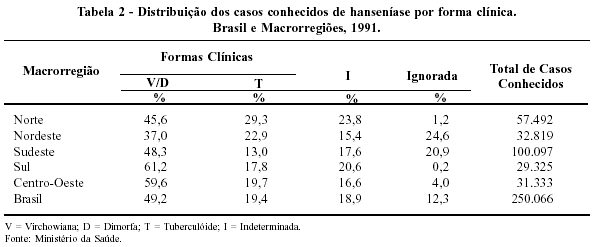
Ao lado de indicadores preocupantes, como os que acabam de ser apresentados, há pelo menos um dado sugestivo de que possa estar havendo melhora do programa de controle da doença: a diminuição da proporção de incapacidades severas detectadas em casos novos, que passa de 15,9%, em 1987, para 8,8%, em 1991. Outro dado positivo é o aumento da cobertura da poliquimioterapia que de 0,6%, em 1985, passa para 38,8%, em 1994.
Não resta dúvida de que o combate à hanseníase em países não desenvolvidos é difícil: as precárias condições de vida da população facilitam a disseminação da doença, e a usual desarticulação dos serviços de saúde compromete a eficácia dos programas de controle. No entanto, os avanços recentes da quimioterapia específica podem oferecer perspectivas favoráveis para o futuro.
Vale notar o contraste que se estabelece no país entre o êxito do controle de doenças como a poliomielite, o sarampo e o tétano e a imensa dificuldade em se combater a tuberculose e a hanseníase. Tal situação reflete, em essência, o fato de o primeiro grupo de doenças poder ser controlado mediante intervenções pontuais, como as campanhas de vacinação, ao passo que tuberculose e hanseníase dependem para seu controle da existência de uma rede básica de saúde bem estruturada que garanta a qualidade e regularidade dos serviços prestados.
Evolução das endemias parasitárias
Tratar-se-á aqui do comportamento de antigos flagelos da humanidade, típicos das sociedades essencialmente rurais.
Malária
A malária destacou-se na primeira metade deste século como um dos mais importantes problemas de Saúde Pública do Brasil. As áreas originalmente atingidas pela endemia abrangiam quatro quintos do território nacional. A área malarígena praticamente se sobrepunha à dos seus vetores biológicos: Anopheles darlingi, Anopheles aquasalis e a Kertezia cruzi. Os dados de incidência da malária no Brasil nunca foram precisos no país: estimativas para o ano de 1954 registravam a ocorrência de 8 milhões de casos.44
Nos anos 40, chegam ao Brasil os inseticidas de ação residual e as drogas eficazes para o tratamento da malária; na década seguinte, a utilização racional e articulada desses novos instrumentos em programas específicos de controle possibilitaria quedas acentuadas da morbimortalidade em todo o país; em 1970, atingem-se os menores níveis de ocorrência da malária: "apenas" cerca de 50.000 casos notificados.45 A partir de 1970, no entanto, observa-se o aumento progressivo e acentuado da incidência da malária, que somente se estabilizaria, a partir de 1989, quando mais de meio milhão de casos da doença passam a ser anualmente notificados pelos serviços de saúde (Figura 23).
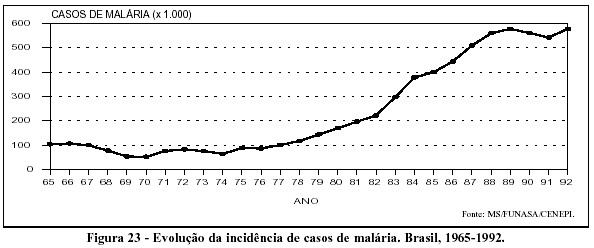
A significativa ascensão da incidência da malária deu-se à custa, principalmente, do aumento da transmissão da doença na Amazônia legal. Esse fato resultou da forma pela qual se deu a ocupação da floresta por projetos agropecuários, pela mineração e pela construção de grandes usinas hidroelétricas, além da abertura de rodovias, que facilitaram o acesso à região (Tabela 3). Deve-se notar que as correntes migratórias que se dirigiram à Amazônia - assim como os capitais - tiveram sua origem nas Regiões Sul e Sudeste do país, o que determinou a rápida expansão da proporção de indivíduos altamente suscetíveis à malária. Entre as atividades econômicas que exerceram papel mais importante nesse processo, cabe mencionar o garimpo, pelo elevado número de indivíduos envolvidos, por sua disseminação na região e pelo baixo nível de organização da atividade, fatores que dificultavam qualquer ação de controle da doença.
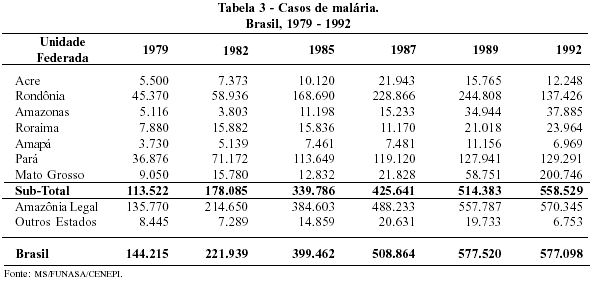
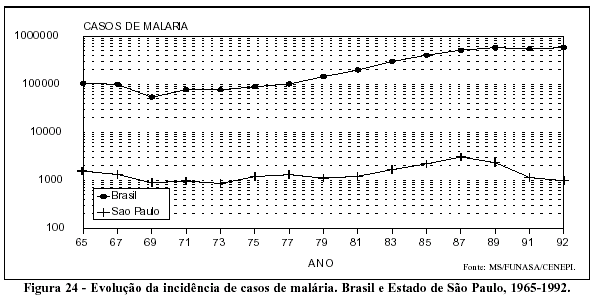
Há que se registrar também as repercussões nos estados que deram origem às correntes migratórias, com freqüentes reintroduções da malária, também sob a forma de epidemias, em áreas em que a doença havia sido eliminada. Foi o que aconteceu no Estado de São Paulo, onde o número de casos identificados passou de 651, em 1970, para 3.038, em 1987; aumento determinado, em sua maior parte, por indivíduos infectados em outros estados (Figura 24). Analisando a origem dos casos importados de malária identificados em São Paulo, verifica-se que eles refletem, em linhas gerais, a variação da incidência da malária nos diferentes estados da Amazônia Legal (Figura 25).
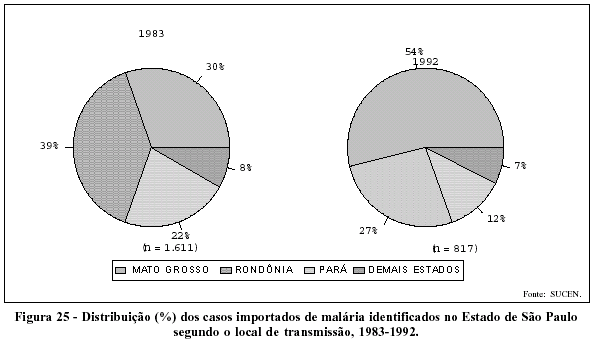
A distribuição geográfica da malária no Brasil, nas duas últimas décadas, apresenta alguns aspectos que merecem registro. Dos casos ocorridos em 1970, 55,6% atingiram a Amazônia Legal. Já em 1992, essa proporção aumenta para 98,0%, reforçando a hipótese de que a malária, nesse período, foi progressivamente controlada fora da Amazônia. Mesmo na Amazônia, os maiores coeficientes de incidência da malária concentram-se em alguns poucos municípios, ainda que a doença ocorra, de forma endêmica, em grande número deles.
A estabilização da incidência da malária a partir de 1989 deve estar associada, em boa parte, à diminuição dos projetos agropecuários e do ritmo de construção de hidroelétricas em decorrência da recessão econômica enfrentada a partir daquele ano. Outro fator diz respeito às pressões internacionais para a proteção do ambiente que resultaram em mudanças positivas na política de ocupação da Amazônia. Vale assinalar, entretanto, que em alguns estados, como no Mato Grosso, por exemplo, a tendência da doença ainda é de ascensão.
Vê-se, assim, que o efetivo controle da malária no Brasil está condicionado, de um lado, ao estabelecimento de um modelo ordenado de desenvolvimento da Amazônia, que privilegie o desenvolvimento humano e, de outro lado, à solução de questões técnicas relativas aos instrumentos de controle da doença, destacando-se o desenvolvimento de uma vacina eficaz.
Esquistossomose mansônica
Nunca se conheceu de forma muito precisa as dimensões da esquistossomose no Brasil. Projeções feitas para a década de 70, fundamentadas em inquérito realizado por Pellon & Teixeira,46 o único inquérito nacional realizado até hoje, estabeleciam algo em torno de 8 milhões de infectados em todo o país.47
Na década de 70, a área endêmica da esquistossomose era muito extensa, distribuindo-se, em regiões descontínuas, desde o Estado do Pará até Santa Catarina, adquirindo maior importância nas áreas quentes e úmidas da Região Nordeste. A distribuição dos hospedeiros intermediários do parasita abrange território maior do que o da doença, sugerindo um perigoso potencial de expansão.48
Uma das características da esquistossomose no Brasil é a concentração da sua transmissão em áreas razoavelmente delimitadas, os chamados focos de transmissão. Tal fato torna pouca informativa a análise de prevalência em nível estadual, recomendando-se que ela se faça em unidades geopolíticas menores.
Em 1974, entre 1.287 municípios pesquisados pelo Ministério da Saúde, abrangendo uma população de aproximadamente 40 milhões de habitantes, verificou-se a presença da esquistossomose em 944 deles. Desse total, 478 apresentaram índices superiores a 4% de infecção. À essa época, as maiores prevalências de infecção pelo S. mansoni eram encontradas em regiões dos Estados de Pernambuco, Alagoas e Sergipe, atingindo taxas, respectivamente, de 16,3%, 23,0% e 32,0%.49,50
De grande importância para a Saúde Pública foi o aparecimento na década de 70 de drogas terapêuticas de grande eficácia no controle da esquistossomose. A incorporação dessas drogas no tratamento em massa da esquistossomose tem oferecido resultados animadores, seja na diminuição da prevalência, logo após a intervenção, seja pela diminuição de formas graves da parasitose. As ações sistematizadas de controle da esquistossomose em âmbito nacional, já utilizando esse novo instrumental tecnológico, iniciam-se efetivamente na segunda metade da década de 1970, com o Programa Especial de Controle da Esquistossomose (PECE).
O PECE foi um programa extremamente ambicioso, que almejava o controle da esquistossomose no país. Adotando um modelo baseado no conceito estocástico da transmissão da parasitose, o ponto crucial da estratégia era a diminuição da probabilidade de o Schistosoma mansoni completar seu ciclo biológico, por meio do ataque simultâneo a cada uma das etapas desse ciclo. O PECE preconizava a quimioterapia em massa, acompanhada da aplicação de moluscocidas no momento mais vulnerável da vida do planorbídeo. Desenvolveu-se, em paralelo, um programa combinado de saneamento e educação sanitária.
A proposta era logicamente atraente. A experiência na ilha de Santa Lúcia, no Caribe, já apontava para a efetividade da intervenção combinada, tal como a proposta por Machado,51 mas reconhecia a dificuldade prática e o alto custo das medidas.
Por motivos vários, o PECE não conseguiu atingir sua meta - reduzir a prevalência nas áreas hiperendêmicas a 4% - e as obras de saneamento, com algumas exceções, não foram realizadas. O programa foi extinto em 1980, sendo substituído por ações regulares da SUCAM.
A área de abrangência do PECE, nos seus quatro anos de existência, limitou-se ao Nordeste. Foi um programa extremamente verticalizado, podendo ser usado como exemplo da visão marcadamente tecnocrática que caracterizou os governos militares pós-1964. Foi uma tentativa de reviver os princípios dos programas de erradicação da malária da década de 50. Durante os quatro anos em que foi implementado, efetuaram-se cerca de 3 milhões de tratamentos com "oxamniquine", menos da metade do número estimado de infectados pelo S. mansoni, no Brasil.
A quimioterapia como forma de intervenção para o controle da esquistossomose manteve-se mesmo após a desativação do PECE. No ano de 1980, já descaracterizadas as atividades de controle da doença na forma prevista pelo programa, foram realizados 1.640.191 tratamentos. Esse número ficou acima de 700 mil tratamentos anuais até 1986. A partir desse ano, houve significativa redução no emprego do "oxamniquine" como conseqüência da realocação dos recursos da SUCAM para combater as epidemias de dengue que então se espraiavam pelo país.
O controle da esquistossomose vem lentamente passando para os serviços estaduais e locais de saúde, principalmente em decorrência de a quimioterapia constituir a principal, quando não a única, forma de intervenção utilizada.
A distribuição da esquistossomose em 1991 não era muito diferente da encontrada há vinte anos. As áreas endêmicas continuam predominando no litoral nordestino, do Ceará à Bahia, com maior intensidade em Pernambuco, Alagoas, Sergipe e Bahia. Outras áreas endêmicas, ainda que apresentando importância secundária, podem ser encontradas no Maranhão, no Ceará, em Minas Gerais e no Paraná. No restante do território a transmissão é focal, não constituindo um contínuo.48
A crescente urbanização da população brasileira e a gradual ocupação e modificação do espaço geográfico têm determinado a lenta e contínua expansão da endemia. A constante deterioração do ambiente urbano cria condições para o estabelecimento de focos de transmissão nas cidades, como já ocorreu em Belo Horizonte, São Paulo e, mais recentemente, em Fortaleza.52 No entanto, vale notar que as áreas de transmissão urbana da esquistossomose são, geralmente, mais instáveis do que as rurais, determinando infecções mais leves no homem, diminuindo, portanto, a gravidade dos casos.
O avanço da esquistossomose para o oeste do país, em virtude dos processos migratórios iniciados na década de 70, não se fez da maneira temida, ainda que existam condições para que a transmissão ocorra, como é o caso de Rondônia.48 Nos Estados de São Paulo e do Paraná, o avanço da esquistossomose em direção ao oeste tem sido limitado. Apenas recentemente, a endemia parece ter-se disseminado para o sudoeste e oeste de Minas Gerais.
Analisando a situação atual da esquistossomose no Brasil, verifica-se que ainda existem localidades na Região Nordeste com prevalências superiores a 20%. A evolução da mortalidade por esquistossomose, no país, apresenta tendência de queda nos anos 80, especialmente na Região Sudeste; na Região Nordeste a mortalidade tem-se mantido estável, não acusando, aparentemente, o impacto do tratamento em massa promovido pelo PECE.53
Em suma, embora não se deva esperar, para os próximos anos, uma queda substancial da prevalência da esquistossomose no país, a urbanização da população e a disponibilidade de drogas eficazes criam condições para a diminuição da magnitude dos danos causados pela doença.
Doença de Chagas
A área de transmissão da doença de Chagas ocupa ampla porção do território brasileiro, algo em torno de 3,5 milhões de km2, espalhando-se desde os estados do Nordeste até o Rio Grande do Sul, abrangendo 2.450 municípios e uma população de cerca de 35 milhões de pessoas expostas ao risco de infecção.54 A doença só não é endêmica na Região Amazônica.
A importância em Saúde Pública da doença de Chagas decorre, principalmente, das formas graves da cardiopatia crônica chagásica, atingindo especialmente homens na faixa etária de 35 a 50 anos.
No final dos anos 70, Camargo e cols,55 em inquérito sorológico de âmbito nacional, estimou a prevalência da doença de Chagas no meio rural brasileiro em torno de 4,4%. Segundo estimativas feitas com fundamento nesse levantamento, as taxas mais altas ocorriam nas áreas rurais do Rio Grande do Sul (8,84%), Minas Gerais (8,83%) e Goiás (7,40%). Ainda à mesma época, estimava-se a incidência anual da doença de Chagas no Brasil em cerca de 100.000 casos novos, a grande maioria transmitidos por vetor, cabendo à transmissão transfusional a maior parte do restante.54
A partir de 1983, o programa nacional de controle da doença de Chagas recebe maiores recursos, ampliando seu espectro de ação, logrando borrifar mais de 700.000 casas por ano e fazer levantamento triatomínico em 5 a 7 milhões de residências por ano. Em 1986 o programa estava consolidado, observando-se em dezenas de municípios o controle da transmissão da doença.54
A partir de 1986, mais uma vez em virtude da necessidade de combate ao dengue, houve diminuição da regularidade das atividades desenvolvidas pelo programa de controle da doença de Chagas. Tal fato permitiu um lento ressurgimento de colônias domiciliares de triatomínios, sem que houvesse, porém, um retorno à situação anterior.
Em 1988, as infecções transmitidas por transfusões sanguíneas passam a receber maior atenção em conseqüência, principalmente, da epidemia de Aids. Tem-se, então, significativa melhora no controle do uso terapêutico de sangue e hemoderivados, fato que repercute favoravelmente no combate à doença de Chagas.
No início dos anos 90, a área endêmica da doença de Chagas apresentava-se semelhante a existente na década de 70, porém com a densidade triatomínica sensivelmente reduzida.54 O T. infestans desapareceu de 85% dos municípios brasileiros onde era encontrado há uma década, determinando uma redução significativa na transmissão natural da doença.
Cabe lembrar que a redução na transmissão da doença não resulta somente das ações do programa específico de controle, mas também dos intensos processos migratórios que diminuíram relativa e absolutamente o contingente rural da população. A migração fez com que cerca de 90% dos 5 milhões de infectados pelo Trypanosoma cruzi estejam hoje nas cidades, reduzindo assim o reservatório humano do agente na zona rural. Considerando que a transmissão vetorial da doença de Chagas não ocorre na zona urbana, não é difícil perceber o grande impacto que a urbanização exerceu sobre a trajetória da enfermidade no país.
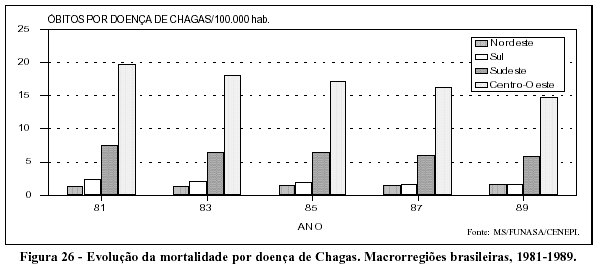
Dada a evolução crônica da doença de Chagas, a diminuição do risco de infecção não teve ainda impacto significativo na mortalidade pela doença. Como se pode ver na Figura 26, os coeficientes de mortalidade pela doença de Chagas, principalmente nas Regiões Sudeste e Centro-Oeste, permanecem em níveis elevados.
Quanto aos riscos de transmissão pela transfusão sanguínea, anteriormente muito importantes, estima-se que hoje tenham diminuído em mais de 90%, graças às medidas de controle exercidas sobre a hemoterapia. Estudo recente estima que 94% dos serviços de hemoterapia do Estado de São Paulo estejam fazendo triagem sorológica para doença de Chagas e que 94,7% deles utilizem dois ou mais testes.56
Em suma, desde que sejam mantidas as medidas de controle da enfermidade, as perspectivas de evolução da doença de Chagas são favoráveis. Mais ainda, a intensificação das referidas medidas poderá levar, em prazo não muito longo, à interrupção definitiva da transmissão da doença em todo o país.
Leishmanioses
A leishmaniose tegumentar tem ampla distribuição no continente americano; sua presença já foi assinalada desde o Sul dos EUA (Texas) até a República Argentina, alcançando maior importância no Brasil e Peru.57,58
Como boa parte das zoonoses, a intensidade com que a leishmaniose tegumentar atinge o homem depende, principalmente, de alterações do meio ambiente. As descrições clássicas da doença caracterizavam-na como de distribuição essencialmente rural e intimamente vinculada a atividades profissionais exercidas na mata ou próximas a ela, ainda que existam relatos do início do século a respeito da transmissão da doença em áreas urbanas e suburbanas das cidades do Rio de Janeiro e de São Paulo.57
A importância da leishmaniose tegumentar para a Saúde Pública está relacionada ao fato de a doença poder comportar-se de forma epidêmica em áreas recém-desmatadas. Também relevante é a diminuição da capacidade de trabalho dos indivíduos afetados pela doença.
A leishmaniose tegumentar ocorre, praticamente, em todo país, destacando-se como área de alta endemicidade, como conseqüência do desmatamento, a Região Norte.
O comportamento da leishmaniose tegumentar no Brasil varia de acordo com diversos fatores; entre eles estão: as características ecológicas de cada região; a infectividade das espécies de leishmânias; os hábitos e a biologia dos flebotomíneos de importância na transmissão da doença; a diversidade dos ciclos biológicos dos parasitas; e, ainda, a proporção de indivíduos suscetíveis existente em cada área.59
Acreditava-se, até recentemente, que a incidência de leishmaniose tegumentar tenderia a diminuir no país, acompanhando a das florestas tropicais, até ficar restrita a regiões próximas das matas residuais. No entanto, de 1985 a 1988, viu-se um incremento da incidência da doença, principalmente nas Regiões Norte e Nordeste (Figura 27). Vale notar que cerca de um terço dos casos ocorridos no Nordeste referem-se ao Estado do Maranhão, cujo território pertence, em parte, ao ecossistema amazônico.59 Na Região Sudeste, ainda que em patamares inferiores aos das Regiões Norte e Nordeste, observa-se, nos últimos cinco anos, a elevação da incidência da endemia.
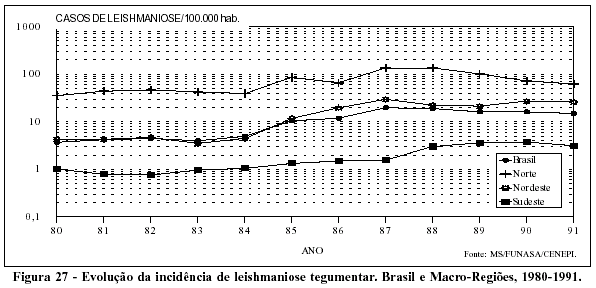
O que tem se visto nos últimos anos, particularmente nas Regiões Nordeste e Sudeste, é que a leishmaniose tegumentar está deixando de ser uma doença com características epidêmicas e própria de trabalhadores em contato com a mata. A distribuição dos casos da doença em cidades do vale do Ribeira e da região de Campinas, no Estado de São Paulo, ilustra adequadamente o processo de urbanização e endemização da leishmaniose tegumentar no Brasil.60
Gomes,59 buscando estabelecer um perfil da leishmaniose tegumentar no Brasil, resume os três tipos básicos de comportamento da doença: leishmaniose epidêmica da floresta virgem; leishmaniose endêmica com surtos epidêmicos isolados ou casos esporádicos, na ausência do processo de domiciliação do vetor; e, finalmente, a leishmaniose endêmica com casos esporádicos e na presença do processo de domiciliação do vetor.
A outra leishmaniose de importância em Saúde Pública é a leishmaniose visceral ou calazar, endemia de ampla distribuição geográfica, podendo ser encontrada na Ásia, Europa, África e nas Américas. Nessa última região, são encontrados focos de transmissão desde o México até a Argentina.61
Na década de 70, as principais áreas de transmissão do calazar, em território brasileiro, encontravam-se no Piauí, no Ceará, na Bahia e em Minas Gerais.61 A princípio, o calazar foi considerado uma endemia parasitária exclusivamente rural; datam, porém, dos anos 50 os primeiros relatos da ocorrência da doença em áreas urbanas.61
A tendência do calazar a partir do final dos anos 70 mostra duas características: a primeira sinaliza um aumento do número de casos, em sua maioria concentrados na Região Nordeste (Figura 28). A segunda apresenta indícios de uma acentuação do processo de urbanização da endemia com o aparecimento de novas áreas de transmissão localizadas em grandes cidades, incluída a área metropolitana de São Paulo.62
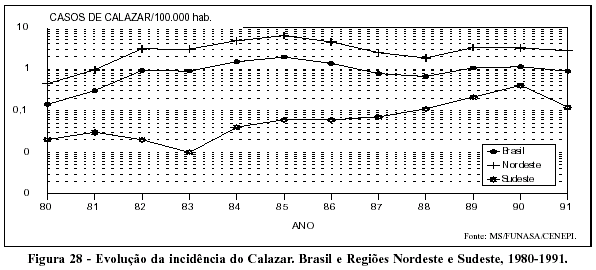
O processo de urbanização do calazar no país não está suficientemente explicado, porém entre os fatores possivelmente implicados estão: a domiciliação do principal vetor da doença; a maior importância do cão como reservatório da leishmânia; e a possível participação do indivíduo infectado, não sintomático, como fonte de infecção.63 Vale também mencionar que, em várias cidades da Região Nordeste, a urbanização está relacionada a processos migratórios resultantes de períodos de secas mais intensas. Nessas oportunidades, os migrantes trazem consigo cães infectados para as regiões urbanas, onde existe o vetor, propiciando, assim, condições para a transmissão da doença.
Parasitoses intestinais
Os parasitas intestinais apresentam ampla distribuição geográfica, alcançando prevalências elevadas nos países do Terceiro Mundo. Algumas estimativas recentes assinalam que mais de um terço da população mundial estaria infectada por um ou mais enteroparasitas, sendo as crianças o grupo de maior risco.64
A presença de parasitas intestinais representa um fator agravante da desnutrição, seja pela diarréia crônica, seja pela competição pelo alimento ingerido.65,66 Nos países não desenvolvidos o papel patogênico das enteroparasitoses faz-se sentir com maior intensidade pela existência de amplos segmentos populacionais vivendo em áreas sem saneamento, sob condições habitacionais precárias e submetidos a condições alimentares deficientes.
Desde a década de 40, é elevado o número de trabalhos buscando dimensionar a prevalência das parasitoses intestinais no Brasil. No entanto, essas publicações refletem, em sua maioria, a realidade de pequenas localidades, tornando difícil um diagnóstico abrangente da situação do país. Levantamentos sistemáticos permitem avaliar a tendência de evolução do problema no Estado de São Paulo.
Alguns levantamentos feitos em São Paulo, no final da década de 30, relativos à ascaridíase, indicavam prevalência em torno de 55% para toda a população, e em escolares essa taxa ficava próxima dos 70%.57 Outros levantamentos parasitológicos realizados nas décadas de 40 e 50 obtiveram como resultado taxas igualmente elevadas de ancilostomíase em escolares: 53% no Município de São Paulo, 87% em Ribeirão Preto e 100% na região litorânea do Estado de São Paulo.57
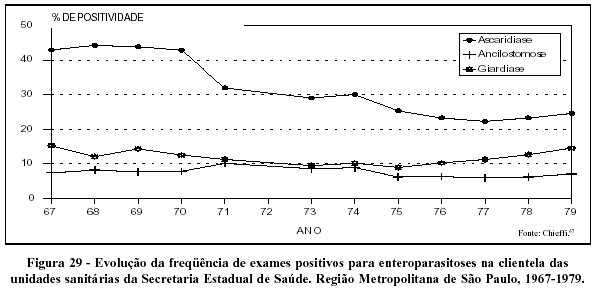
Levantamento feito por Chieffi e col67 relativo a séries históricas de resultados de exames parasitológicos realizados nas décadas de 60 e 70 pela clientela das unidades sanitárias da Secretaria Estadual de Saúde traz importantes informações sobre a evolução das enteroparasitoses no Estado de São Paulo (Figuras 29 e 30). Expressivos declínios na freqüência de exames positivos para ascaridíase - a enteroparasitose mais prevalente no estado - são observados ao longo da década de 70, tanto para a região metropolitana quanto para o interior do estado. A evolução da positividade para ancilostomíase indica declínio no interior e estabilidade na região metropolitana, onde o problema, de qualquer forma, alcança menor magnitude. A freqüência de exames positivos para giardíase pouco se modifica ao longo de todo o período estudado (entre 10 e 15% de exames positivos, seja na região metropolitana, seja no interior do Estado de São Paulo).
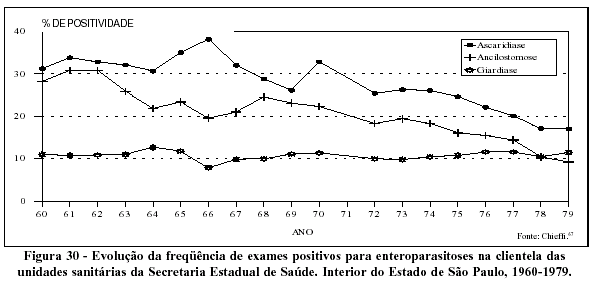
Informações complementares às de Chieffi e col67 (1982), relativas ao ano de 1987, confirmam as tendências apontadas na década de 70, envolvendo o declínio da ascaridíase e da ancilostomíase e a relativa estabilidade da giardíase. Analisando esses mesmos dados, dessa vez por regiões administrativas do estado, verifica-se que a freqüência da ascaridíase nas regiões do vale do Ribeira e na Baixada Santista é duas a três vezes maior do que nas demais regiões. O mesmo acontece com a ancilostomíase nas regiões do vale do Ribeira e Araçatuba.68
A comparação de inquéritos domiciliares realizados nas décadas de 70 (1973/74) e 80 (1984/85), em amostras representativas da população de menores de cinco anos residentes na cidade de São Paulo, evidenciam redução de cerca de 50% na prevalência da ascaridíase e da triquiuríase e declínio de 29% na prevalência de giardíase.69
No estudo realizado na cidade de São Paulo em meados da década de 80, verificou-se que 30,9% das crianças examinadas abrigavam ao menos uma espécie de enteroparasita, sendo, respectivamente, de 16,4%, 14,5% e 12,6% as prevalências da ascaridíase, giardíase e triquiuríase (apenas uma das 695 crianças examinadas encontrava-se infectada pela ancilostomíase). Ainda nesse estudo, observou-se que 13,1% e 4,8% das crianças examinadas abrigavam, respectivamente, mais de uma e mais de duas espécies de parasitas. Tanto o poliparasitismo intestinal quanto a prevalência específica de ascaridíase e triquiuríase variaram intensamente conforme o estrato sócioeconômico da família, observando-se menores contrastes sociais com relação à giardíase.69
O conjunto de evidências aponta para um substancial declínio da prevalência da ascaridíase, da triquiuríase e da ancilostomíase no Estado de São Paulo. Considerando a inexistência de programas específicos de controle, o declínio deve estar relacionado, principalmente, à melhora das condições do saneamento básico. Especificamente no caso da ancilostomíase, deve existir também uma relação com o processo de urbanização, especialmente no interior do estado.
A menor variação das taxas de infecção por giardíase, nos diversos estudos citados, e a freqüência elevada da infecção mesmo em estratos da população de melhor nível socioeconômico sugerem uma estrutura epidemiológica mais complexa para a giardíase. Esse comportamento poderia ser explicado, ao menos em parte, pela existência da transmissão direta da protozoose, fato que também justificaria o aparente menor impacto sobre a doença determinado pela ampliação das redes de água e tratamento de esgoto verificada nas últimas duas décadas no Estado de São Paulo.
Tendências de evolução da Febre Amarela
A febre amarela silvestre é uma zoonose cujo principal reservatório é o macaco; acidentalmente pode atingir o homem não vacinado ao entrar em contato com a mata. Sob o aspecto epidemiológico, a febre amarela urbana distingue-se da forma silvestre, por ter o homem como reservatório.
As regiões silvestres, nas quais o vírus amarílico circula entre animais, são denominadas áreas enzoóticas. Por sua vez, as regiões que são invadidas, periodicamente, pelo vírus, provocando surtos epidêmicos, são denominadas áreas epizoóticas.
O Brasil possui a maior área enzoótica de febre amarela silvestre do mundo, compreendendo as zonas de mata das Regiões Amazônica e Centro-Oeste (a segunda área, em extensão, situa-se na região do Congo, na África).
No início da era republicana, a febre amarela situava-se entre os principais problemas de Saúde Pública do país, por causar epidemias devastadoras nas regiões urbanas economicamente mais importantes, entre elas a cidade do Rio de Janeiro e as sedes dos municípios do interior paulista produtores de café.
A transmissão urbana da febre amarela deixa de existir no Brasil, em 1942, graças ao combate eficaz ao Aedes ægypti. Entretanto, o mosquito, que foi virtualmente eliminado do país na década de 50, reaparece transitoriamente no final dos anos 60,49 voltando a infestar permanentemente o território nacional a partir de 1976.
O Brasil possui duas áreas bem definidas de circulação do vírus amarílico: a enzoótica, abrangendo Pará, Amazonas, Acre, parte de Mato Grosso e Rondônia, Amapá, Roraima, Mato Grosso do Sul, Goiás, Tocantins e Maranhão; e a epizoótica, que abrange Rio Grande do Sul, Santa Catarina, Paraná, São Paulo e Minas Gerais.
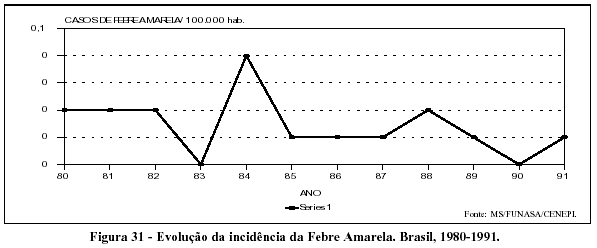
A febre amarela, em que pese a ameaça potencial de sua urbanização, em conseqüência da reintrodução do Aedes ægypti e da ocorrência de surtos periódicos atingindo a área enzoótica, é doença cuja ocorrência vem diminuindo nos últimos anos (Figura 31). Vale notar que a disponibilidade de uma vacina efetiva e a existência de condições de fabricação de grandes quantidades de doses coloca, como remota, a perspectiva de um retorno à situação vigente no início do século.
Endemias recentemente reintroduzidas no país
Cólera
A cólera foi descrita, pela primeira vez, como entidade mórbida distinta das demais diarréias, na Índia, no século XVI. Permaneceu desconhecida no Ocidente até o século XIX, quando uma epidemia originária do subcontinente indiano atingiu a Europa, a África e a América do Sul. A partir do início do século XX, a cólera é aparentemente eliminada do hemisfério ocidental, desaparecendo mesmo em regiões onde as condições sanitárias eram precárias.70
Em 1961, tem início a sétima pandemia de cólera que prossegue até hoje. Dessa vez, o Vibrio choleræ, biotipo clássico, responsável pela pandemia anterior, é substituído pelo biotipo El Tor. Duas principais repercussões dessa substituição, do ponto de vista epidemiológico, são o fato de o biotipo El Tor determinar menor proporção de doentes entre os infectados e sua capacidade de permanecer no meio ambiente como um organismo de vida livre, o que torna pouco viável sua eliminação.71
Merece destaque a recente identificação, no subcontinente indiano, de nova cepa toxigênica do V. choleræ, o V. choleræ sorogrupo 0139. Esta cepa tem elevada patogenicidade e determina quadro diarréico grave. Caso essa nova bactéria venha substituir a cepa El Tor, na atual pandemia, haverá aumento significativo da importância da doença para a Saúde Pública, quer pelo aumento da letalidade, quer pela elevação do custo do tratamento hospitalar.72
Em 1991, 54 países em todo o mundo, 13 dos quais localizados na América Latina, notificaram à Organização Mundial de Saúde cerca de 600.000 casos e 20.000 óbitos causados pela cólera.73
A América Latina foi a última região a ser atingida pela sétima pandemia de cólera, que se iniciou no Peru em 1991. Nesse país, a epidemia foi explosiva com taxas de incidência chegando a 15 casos de cólera por 1.000 habitantes.74 Nos quinze meses seguintes à introdução da cólera na América do Sul, a Organização Pan-Americana da Saúde recebeu cerca de 460.000 notificações de casos da doença com 4.300 óbitos, de dezenove países.70 Essas cifras dão uma idéia da magnitude do problema da cólera na América Latina.
Os primeiros casos de cólera surgem no Brasil em abril de 1991, inicialmente na região amazônica, em área limítrofe ao Peru e Colômbia, disseminando-se, a seguir, principalmente para os estados do Norte e Nordeste do país.
A cólera, o problema de Saúde Pública mais recente introduzido no país, traz uma conotação de miséria e ausência de infra-estrutura urbana. Realmente, trata-se de doença que somente ocorre, sob a forma epidêmica, em áreas com precárias condições de vida.
A possibilidade de epidemias de grande porte que varreriam as metrópoles brasileiras foi muito comentada desde quando a doença surgiu no país (1991). Essa expectativa felizmente não se confirmou. A disseminação da cólera se deu, fundamentalmente, nas pequenas cidades do Norte e Nordeste e apenas em algumas capitais; entre essas, a mais atingida, a partir de 1993, foi Fortaleza (Tabelas 4 e 5). Tal fato sugere que as condições de saneamento das cidades brasileiras, ainda que não satisfatórias, estão melhores do que se suspeitava. De fato, a diminuição expressiva da morbimortalidade por diarréias, na última década, já evidenciava bem esse ponto.
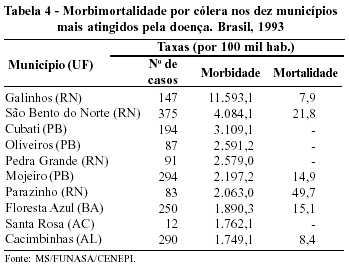
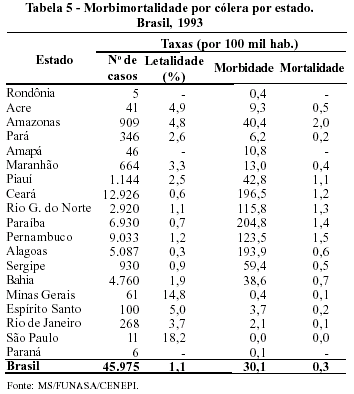
Tudo sugere que a cólera tende a assumir, no Brasil, o papel de doença de cidades e vilas, nas quais inexiste saneamento básico. Aparentemente, a simples disponibilidade de água potável seria suficiente para evitar um número maior de casos.
Os bolsões de miséria existentes nos centros urbanos constituem, porém, ameaça constante de epidemias de maiores proporções.
Independentemente da magnitude das repercussões da doença sobre a morbimortalidade da população, a cólera certamente vem determinando efeitos desastrosos sobre atividades econômicas importantes, como o turismo e a produção de alimentos para exportação. No Peru, uma estimativa conservadora aponta em 500 milhões de dólares os prejuízos causados pela doença para a indústria pesqueira e para o turismo.75 Espera-se que esse fato possa sensibilizar autoridades governamentais eventualmente ainda não convencidas da necessidade de se dotar todo o país das condições mínimas de saneamento básico.
Dengue
Na atualidade, o dengue situa-se entre as mais importantes doenças causadas por vírus. Sua distribuição geográfica é ampla, abrangendo a África, a Ásia, a América Latina e o Caribe e tudo indica que sua incidência esteja aumentando.
No Sudeste asiático, entre 1970 e 1987, a incidência da doença aumentou de 15 para 170 casos por 100.000 habitantes. Em 1987, as taxas de incidência do dengue na Tailândia e Vietnã atingiram níveis de 3.700 e 6.400 por 100.000 habitantes, respectivamente. Ainda que parte desse aumento possa ser atribuída à melhora da notificação, em conseqüência do maior conhecimento do problema, a tendência da doença é de crescente ascensão.76
A importância em Saúde Pública atribuída ao dengue deve-se particularmente a suas formas graves, especialmente ao dengue hemorrágico. Em 1987, foram notificados no sudeste asiático mais de 600.000 casos de dengue hemorrágico que determinaram 24.000 óbitos, dos quais 95% atingiram indivíduos menores de quinze anos.76
O impacto do dengue nos serviços de saúde tem sido enorme. Em 1981, durante uma epidemia de dengue hemorrágico em Cuba, em pouco mais de três meses foram hospitalizados cerca de 116.000 pacientes, mais de 1% da população da ilha. Entre os custos diretos e indiretos, estima-se que os gastos atingiram 100 milhões de dólares americanos.76
Entre os determinantes que podem estar facilitando a disseminação do dengue, merecem registro: a intensificação das trocas comerciais entre países; os movimentos migratórios; a alta densidade populacional nas áreas metropolitanas; o crescimento desordenado das cidades, onde o abastecimento irregular da água e a inadequada coleta e armazenamento do lixo facilitam a proliferação de mosquitos.77
Os vetores mais eficientes na transmissão do dengue são o A. aegypti e o A. albopictus. Este último, originário da Ásia, pode vir a assumir importante papel na manutenção da endemia, pois é capaz de perpetuar a circulação do vírus do dengue, mesmo sem a participação do homem ou de outro reservatório. O A. albopictus possui a capacidade de infectar seus descendentes, em sucessivas gerações, pela transmissão transovariana.
A reintrodução do A. aegypti no Brasil, em 1976, e sua progressiva disseminação por todo o país, sugeriam, já no final da década de 70, previsões sombrias quanto à ocorrência de epidemias de dengue.
O primeiro surto de dengue, após a reintrodução do A. aegypti, deu-se em Roraima, em 1982, com 12.000 casos notificados.
Após o surto de Roraima, o dengue volta a ocorrer de forma epidêmica, em 1986, nos Estados do Ceará, Alagoas e Rio de Janeiro. O mais atingido, nesse ano, foi o Rio de Janeiro, onde foram notificados, entre 1986 e 1987, cerca de 93.000 casos.
Esses dados estavam possivelmente subestimados, pois levantamento epidemiológico efetuado, na mesma oportunidade, em escolares do Rio de Janeiro, encontrou uma taxa de ataque de 22,4%.77
A partir de 1986, o dengue dissemina-se pelo país, determinando a ocorrência de epidemias em vários centros urbanos, de grande e pequeno porte, em estados do Nordeste, Sudeste e Centro-Oeste (Tabela 6).
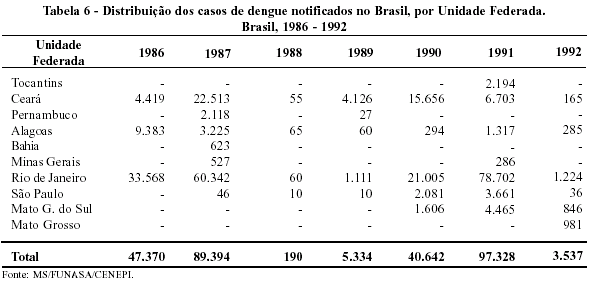
As maiores epidemias ocorreram em Fortaleza e na área metropolitana do Rio de Janeiro. O episódio mais preocupante ocorreu no Rio de Janeiro entre 1991 e 1992, quando foram notificados quase 100.000 casos, sendo 237 deles classificados como dengue hemorrágico, com três pacientes evoluindo para óbito.
Do Rio de Janeiro a Tocantins, o risco de uma grave epidemia de dengue hemorrágico é uma séria ameaça. A estratégia adotada pelos sanitaristas brasileiros do início do século não pode ser adaptada à atual realidade urbana do país. Na impossibilidade de se eliminar novamente o A. aegypti, em face do elevado custo e à necessária adesão de todos os países do continente, não parece restar outra alternativa a não ser a busca de formas aceitáveis de conviver com o problema.
Vale registrar que, além da presença do A. aegypti, houve também a introdução, no Brasil, durante a década de 80, do Aedes albopictus, cuja origem e dispersão no país se deve, em parte, à comercialização de pneus usados. O controle desse mosquito é difícil, pois ele prolifera tanto em criadouros artificiais como em naturais. Hoje, o A. albopictus tem ampla distribuição no território brasileiro. Apesar de ser considerado transmissor do dengue, não foi comprovada sua participação em nenhuma das epidemias ocorridas no país.
O controle do dengue constitui enorme desafio para as autoridades sanitárias, não existindo, ainda, vacina eficaz contra a doença.
Na realidade, a doença constitui um dos mais sérios problemas de Saúde Pública, na atualidade, em vastas regiões do mundo, preocupando não só países em desenvolvimento, mas também os industrializados.
Novas tecnologias no controle das doenças transmissíveis
Em que pese a ausência, no passado recente, de políticas bem-definidas de incorporação de novas tecnologias no setor saúde, alguns avanços são inegáveis.
Um dos mais importantes foi o desenvolvimento da tecnologia necessária para a utilização eficaz da imunização pela rede básica de saúde. A campanha de vacinação em massa contra a meningite meningocóccica, em 1975, foi um marco que merece registro especial: não só porque, a partir dela, passou-se a dominar a tecnologia indispensável à utilização regular de campanhas de vacinação, como também pela maior aceitação que as vacinas passaram a ter na população.
As campanhas de vacinação, apesar de serem alvo de críticas severas, muitas vezes procedentes, de inúmeros sanitaristas, são as principais responsáveis pelos bons resultados no controle das doenças imunopreveníveis no país; em conseqüência, claro está, das deficiências da rede básica de saúde.
Merece também registro a incorporação, pela rede de serviços de saúde, de técnicas de tratamento simplificado para doenças infecciosas de grande importância na morbidade e mortalidade, como é o caso das diarréias e, em menor grau, das doenças respiratórias agudas.
Um aspecto importante na incorporação e no desenvolvimento de tecnologias no campo da Saúde Pública foi a já citada criação do Sistema Nacional de Laboratórios de Saúde Pública (SNLSP), em 1977. Esse sistema foi implementado em duas vertentes, uma voltada para a ampliação e aprimoramento do apoio laboratorial, visando principalmente o diagnóstico das doenças transmissíveis e a fiscalização de alimentos, e a outra centrada no fortalecimento da pesquisa científica e tecnológica no âmbito do sistema de saúde.
Como modelo da primeira vertente se destacou o Instituto Adolfo Lutz de São Paulo; na segunda vertente desponta como a maior e mais complexa instituição a Fundação Osvaldo Cruz do Rio de Janeiro. Deve ser lembrado também por seu bom desempenho o Instituto Evandro Chagas sediado no Pará.
No âmbito do SNLSP foi criada a figura do Laboratório Nacional de Referência com o credenciamento de várias unidades para áreas específicas. Merecem destaque três Laboratórios de Referência Nacional: o laboratório de arbovírus, localizado no Instituto Evandro Chagas, com serviços relevantes principalmente na Amazônia; o laboratório de enterovírus, sediado na Fundação Osvaldo Cruz e principal suporte técnico do programa de eliminação da poliomielite no Brasil; e o laboratório para meningites bacterianas, de responsabilidade do Instituto Adolfo Lutz.
Vale destacar ainda a Fundação Osvaldo Cruz, reorganizada, a partir de 1975, em torno de quatro núcleos: a Escola Nacional de Saúde Pública; um complexo laboratorial destinado a pesquisas no campo da Medicina Experimental; outro complexo laboratorial formando o Instituto Nacional de Controle de Qualidade em Saúde (INCQS) voltado, principalmente, ao controle de qualidade de produtos de consumo humano e de tecnologias médicas; e, finalmente, um centro de produção de imunobiológicos (Bio-Manguinhos).
O Instituto Butantã, de São Paulo, passa também, a partir de 1983, por um processo de reorganização de menor dimensão que o da Fiocruz, mas de inegável importância. Essa instituição, que segue o modelo do Instituto Pasteur, de Paris, ergue-se sobre dois pilares, um voltado à pesquisa científica e tecnológica e outro à produção de imunobiológicos. Nos últimos anos, o Instituto Butantã conseguiu bons resultados na ampliação e no aprimoramento da qualidade de sua produção de vacinas, porém o marco principal do período talvez tenha sido a criação do seu Centro de Biotecnologia.
Finalmente, cabe notar que dois projetos de grande relevância para o desenvolvimento e de tecnologias de controle de doenças infecciosas foram implementados com sucesso na década de 80.
O primeiro desses projetos foi a criação da rede de hemocentros, com unidades distribuídas em vários pontos do país. Esse programa permitiu não só a incorporação de novas tecnologias para produção de hemoderivados, mas também melhorou de forma significativa a qualidade e segurança das transfusões sanguíneas, com a conseqüente diminuição da ocorrência de infecções transfusionais. Cabe salientar que o surgimento da aids constituiu fator de importância na priorização desse programa.
O segundo projeto foi o Programa de Auto-Suficiência Nacional em Imunobiológicos (PASNI), criado em 1986. Sua origem está ligada à implantação, em 1981, de um sistema de controle de qualidade de vacinas utilizadas pelo Programa Nacional de Imunizações (PNI) e com a própria criação do INCQS, nesse mesmo ano. Outro fator foi a expansão operacional do PNI na década de 80, quando o país passou a ser o terceiro mercado consumidor de imunobiológicos do mundo. Como exemplo, tem-se a vacina contra a poliomielite, cujo consumo anual saltou de 20 milhões para 80 milhões de doses em decorrência das campanhas de vacinação em massa.78
Durante o período de 1985 a 1990, o PASNI centrou sua atuação na recuperação e modernização da infra-estrutura e equipamentos, construções de novas unidades, apoio à incorporação e desenvolvimento de novas tecnologias e formação de recursos humanos.78
Comentários finais
Os dados reunidos neste trabalho indicam grande variedade de situações no que se refere à trajetória das doenças transmissíveis no Brasil. Levando-se em conta a evolução da mortalidade geral por doenças infecciosas e parasitárias, o panorama é, sem dúvida, favorável e induz mesmo a certo otimismo. Outro é o quadro, entretanto, quando se analisam grupos específicos de enfermidades e quando se atenta para a evolução simultânea da mortalidade e da morbidade. Esquematicamente e, portanto, correndo risco de simplicar demasiadamente a questão, vislumbram-se três situações paradigmáticas:
1) situações favoráveis que indicam que o controle da enfermidade está a caminho;
2) situações que sugerem que a enfermidade deverá permanecer em seus níveis costumeiros ainda por longo tempo;
3) situações preocupantes que apontam expansão da enfermidade.
Como exemplos marcantes de situações favoráveis, destacam-se o declínio substancial das gastroenterites - principal causa da mortalidade infantil no Brasil - e a redução notável das doenças imunopreveníveis - em particular da poliomielite, enfermidade considerada eliminada do país a partir de 1994. A esses exemplos poder-se-iam acrescentar o declínio das enteroparasitoses (bem demonstrado no Estado de São Paulo) e as boas perspectivas para a interrupção da transmissão natural da doença de Chagas em grande parte da área endêmica do país e para a redução das formas severas da esquistossomose.
No grupo das enfermidades infecciosas que aparentemente subsistirão por longo tempo em nosso meio, avultam as grandes endemias urbanas representadas pela tuberculose e pela hanseníase e, em áreas mais restritas do território nacional, a malária e as leishmanioses.
Finalmente, são exemplos de doenças com grande potencial de expansão no Brasil: o dengue (e sua forma clínica mais temida - o dengue hemorrágico), a cólera (em extensas áreas do país) e a aids.
As diferenças no comportamento da evolução das doenças infecciosas no país revela a complexidade dos fatores envolvidos em sua determinação. A apreciação da evolução de diferentes enfermidades, tal como feita neste trabalho, indica a importância de um amplo conjunto de determinantes, que incluem desde a industrialização e conseqüente urbanização do país, até o grau de organização e cobertura da rede dos serviços de saúde, ambos fatores permeados pelas profundas desigualdades sociais e regionais que caracterizam o Brasil. Uma análise mais específica das diferentes enfermidades infecciosas leva também a considerar o surgimento e a incorporação de diferentes tecnologias médico-sanitárias, a expansão do comércio internacional e das correntes migratórias, a variação na virulência de microorganismos e parasitas e mesmo o aparecimento de novos agentes patogênicos.
Uma abordagem interessante e abrangente para o estudo e a discussão do comportamento da evolução das doenças infecciosas é apresentada por Cherkasskii.79 Esse autor, aplicando enfoque sistêmico, afirma que, para melhor compreensão do comportamento das doenças infecciosas, estas devem ser estudadas não só por sua distribuição no tempo, espaço e segundo os atributos da população, mas, também, com fundamento em seus determinantes ao nível dos sistemas biológico, econômico e político, estes entendidos como um todo inter-relacionado e interdependente. O antagonismo e a heterogeneidade da estrutura dos sistemas e subsistemas que interagem na determinação do processo infeccioso forçam os movimentos e a auto-regulação interna a cada nível de organização. Nessas condições, a compreensão do processo infeccioso se dá pela observação contínua dos diversos fenômenos que ocorrem de forma interdependente e inter-relacionada no âmbito dos sistemas e subsistemas envolvidos. Com fundamento nesse referencial teórico, apresentado de forma sintética e simplificada, pode-se entender melhor fenômenos como o recrudescimento da malária na Amazônia a partir dos anos 70, o aparecimento de novas doenças como a febre purpúrica brasileira e mesmo a introdução e disseminação da aids no país.
Finalizando, vale comentar que os resultados favoráveis quanto ao controle das doenças transmissíveis foram obtidos, em grande parte, com fundamento em estratégias que se mostrarão progressivamente menos viáveis à proporção que avança o processo de descentralização dos serviços de saúde. O grande desafio, daqui para frente, para o Sistema Único de Saúde (SUS), é, justamente, gerenciar o processo de mudanças, garantindo saltos quantitativos e qualitativos na assistência integral à saúde. Para tanto, o SUS deverá estabelecer políticas institucionais de médio e longo prazo no setor e oferecer os recursos humanos e a infra-estrutura necessários para que todas as regiões do país incorporem conhecimentos científicos e tecnológicos que garantam o aprimoramento constante dos serviços prestados à população.
Agradecimentos
Os autores agradecem a Mauricio Lima Barreto (Universidade Federal da Bahia), Pedro Luiz Tauil (Universidade de Brasília), Luiz Augusto Marcondes Fonseca (pesquisador do Nupens/USP) e Alvaro Escrivão (Secretaria de Estado da Saúde de São Paulo), por valiosas críticas e sugestões em matérias em que são especialistas.
Referências Bibliográficas
1. Bayer GF & Paula SG. Mortalidade nas Capitais Brasileiras 1930-1980. Radis/FIOCRUZ. Dados. 1984; 7:1-8.
2. Fundação Nacional de Saúde. Ministério da Saúde. Estatísticas de Mortalidade-Brasil. Brasília (DF); 1993.
3. OPS. Health Conditions in the Americas. Washington ( DC); 1990.
4. Fraser DW et al. Legionnaires' Disease. Description of an Epidemic of Pneumonia. New England Journal of Medicine 1977; 297(22):1189-1197.
5. Linhares AC et al. I - AHC Caused by EV-70 in Brasil. In: Ishii K et al. Acute Hemorrhagic Conjunctivitis. Etiology, Epidemiology and Clinical Manifestations. Japan: University of Tokio Press; 1989. p.210-217.
6. Lopes OSS et al. Emergency of a New Arbovirus Disease in Brazil. II - Epidemiological Study on 1975 Epidemic. American Journal of Epidemiology 1978; 108(5):394-401.
7. Iversson LB. Rocio Encephalitis. In: Monath, T.P. (ed.). The Arbovirus: Epidemiology and Ecology. vol.IV. Boca Raton: CRC Press; 1989. p.77-92.
8. Brazilian Purpuric Fever Study Group. Haemophilus aegyptius Bacteremia in Brazilian Purpuric Fever. Lancet 1987; 2:761-763.
9. Bishop DHL. Release of Genetically Altered Virus into the Environment. British Medicine Journal 1988; 296:1685-1686.
10. Ledeberg J. Medical Science, Infectious Diseases and the Unity of Humankind. Journal American Medicine Association 1988; 260:684-685.
11. Luna EJA. A epidemiologia do tracoma no Estado de São Paulo [dissertação de mestrado]. São Paulo: Faculdade de Ciências Médicas da Unicamp; 1993.
12. Last JM. A Dictionary of Epidemiology. New York: Oxford University Press; 1988.
13. Evans AS. The Eradication of Communicable Diseases: Myth or Reality? American Journal of Epidemiology 1985; 122:199-207.
14. Juarez E. Vigilância epidemiológica no Brasil. In: Ministério da Saúde. Anais da V Conferência Nacional de Saúde; 1975; p.140-144.
15. Fundação Nacional de Saúde. Centro Nacional de Epidemiologia. Informe Epidemiológico do SUS 1992; I(5):139-148.
16. Hinman AR. et al. The Case for Global Eradication of Poliomyelitis. Bulletin WHO 1987; 65(6):835-840.
17. Ward N et al. A Global Overview and Hope for the Eradication of Poliomyelitis by the Year 2000. Tropical Geografic Medicine 1993; 45(5):198-202.
18. Patriarca PA et al. Randomised Trial of Alternative Formulations of Oral Poliovaccine in Brasil. Lancet 1988; 1(8583):429-432.
19. Chumakov M, Voroshilov M, Shindarov L. et al. Enterovirus 71 Isolated from Cases of Epidemic Poliomyeliteis-like Disease in Bulgaria. Archives Virology 1979; 60:329-340.
20. Nagy G, Takatsy S, Kukan E, Mihaly I, Domok I. Virological Diagnosis of Enterovirus Type-71 Infections: Experiences Gained during an Epidemic of Acute CNS Diseases in Hungary in 1978. Archives of Virology 1982; 71:217-227.
21. Waldman EA et al. Aspectos epidemiológicos e imunitários da poliomielite em crianças de menos de um ano em áreas da Região da Grande São Paulo. Revista de Saúde Pública 1983; 17:9-22.
22. CDC. MMWR 1993; 42(17):337-339.
23. Foster SO et al. Measles. In: Disease Control Priorities in Developing Countries. New York: Oxford University Press; 1993. p.161-187.
24. Feachem RG, Koblinsky MA. Interventions for the Control of Diarrhoeal Diseases among Young Children: Measles Immunization. Bulletin WHO 1983; 61:641-652.
25. Gindler JS et al. Update - the United States Measles Epidemic, 1989-1990. Epidemiologic Reviews 1992; 14:270-276.
26. WHO. Weekly Epidemiology Record 1993; 38:277-282.
27. Steinglass R et al. Tetanus. In: Jamison, D.T. et al. Disease Control Priorities in Developing Countries. Oxford Medical Publications. New York: Oxford University Press; 1993. p.189-220.
28. OPS. Boletín Informativo do PAI 1990; 4:3-5.
29. Litvoc JJ et al. Aspectos epidemiológicos do tétano no Estado de São Paulo (Brasil). Revista do Instituto de Medicina Tropical 1991; 33(6):477-484.
30. OPS. Boletín Informativo do PAI 1992; 2:2-4.
31. Young LS, Wormser GP. The Resurgence of Tuberculosis. Scandinavy Journal of Infectious Disease 1994; 93:9-19.
32. Murray C, Styblo K, Rouillon A. Tuberculosis. In: Jamison DT et al. Disease Control Priorities in Developing Countries. Oxford Medical Publication. New York: Oxford University Press; 1993. p. 233-259.
33. Raviglione MC et al. Secular Trends of Tuberculosis in Western Europe. Bulletin WHO 1993; 71(3/4):297-306.
34. Dolin PJ, Raviglione MC, Kochi A. Global Tuberculosis Incidence and Mortality during 1990-2000. Bulletin WHO 1994; 72(2):213-220.
35. Guimarães R. Determinação social e doença endêmica. O caso da tuberculose. In: XVIII Congresso da Sociedade Brasileira de Medicina Tropical 1982; Ribeirão Preto, São Paulo; 1982.
36. Schwoebel V, Hubert B, Grosset J. Tuberculous Meningitis in France in 1990: Chacteristics and Impact of BCG Vaccination. Tubercle and Lung Disease 1994; 75:44-48.
37. Buchalla CM. A síndrome da imunodeficiência adquirida e a mortalidade de masculino de 10 a 49 anos no município de São Paulo - 1983 a 1986 [tese de doutorado]. São Paulo: Faculdade de Saúde Pública da Universidade de São Paulo; 1993.
38. Fundação Nacional de Saúde. Centro Nacional de Epidemiologia. Informe Epidemiológico do SUS 1992; I(6):128.
39. Hijjar MA. Epidemiologia da tuberculose no Brasil. Informe Epidemiológico do SUS 1992; 6:53-87.
40. Htoon MT, Bertolli J, Kosasik LD. Leprosy. In: Jamison DT et al. Disease Control Priorities in Developing Countries. New York: Oxford University Press. 1993. p.261-280.
41. WHO. Weekly Epidemiology Record 1994; 69(20):145-151.
42. Fundação Nacional de Saúde. Ministério da Saúde. Avaliação independente do Programa Nacional de Controle e Eliminação da Hanseníase. Relatório Final, novembro; Brasília (DF); 1992.
43. Albuquerque MFPM, Morais, HMM; Ximenes R. A expansão da hanseníase no nordeste brasileiro. Revista de Saúde Pública 1989; 23(2):107-116.
44. Sabrosa PC. Malária. In: Guimarães R. Saúde e medicina no Brasil. Contribuição para um debate. Rio de Janeiro: Ed. Graal; 1978.
45. Tauil P. Malária: agrava-se o quadro no Brasil. Ciência Hoje 1984; 2(12):58-64.
46. Pellon AB, Teixeira I. Distribuição geográfica da esquistossomose mansônica no Brasil. Rio de Janeiro: Departamento Nacional de Saúde, Div. Org. Sanit.; 1950.
47. Freitas CA. Situação atual da esquistossomose no Brasil. Revista Brasileira de Malaria e Doenças Tropicais 1972; 24:3-63.
48. Silva LJ. A esquistossomose mansônica no Estado de São Paulo: origens, distribuição, epidemiologia e controle [tese de livre-docência]. Campinas, São Paulo: Faculdade de Ciências Médicas da Unicamp; 1992.
49. Motta EGF. Programa de controle das grandes endemias. In: Ministério da Saúde. V Conferência Nacional de Saúde; Brasília, DF; 1975. p.153-202.
50. Motta EGF. Situação atual do controle das grandes endemias. In: Ministério da Saúde. VI Conferência Nacional de Saúde; Brasília, DF; 1977. p.45-56.
51. Machado PA. O modelo. In: Anais da VI Conferência Nacional de Saúde; Brasília: Brasília, DF; 1977. p.167-284.
52. Almeida et al. Movimentos migratórios e a expansão da esquistossomose mansônica no Estado do Ceará. Revista do Instituto de Medicina Tropical 1991; 33 (supl.):48.
53. Silveira AC. Mortalidade por esquistossomose no Brasil 1977-1988. Revista da Sociedade Brasileira de Medicina Tropical 1990; 23:133-140.
54. Pinto Dias JCP. Doença de Chagas no Brasil - situação atual e perspectivas. Informe epidemiológico do SUS 1992; 1(4):17-25.
55. Camargo ME, Silva GR, Castilho EA, Silveira AC. Inquérito sorológico da prevalência de infecção chagásica no Brasil, 1975/1980. Revista do Instituto de Medicina Tropical 1984; 26(4):192-204.
56. Wanderley DMV et al. Controle da doença de Chagas transfusional: 1988 e 1990. Revista de Saúde Pública 1993; 27(6):430-435.
57. Pessoa SB. Endemias parasitárias da zona rural brasileira. São Paulo: Editora Fundo Editorial Procienx; 1963. p.788.
58. Neva FA. Leishmaniasis. In: Wyngaarden JB, Smith Jr. LH. Cecil Textbook of Medicine. 17.a ed. Igaku- Shoin: Saunders International Edition; 1985. p.1786-1792.
59. Gomes AC. Perfil epidemiológico da leishmaniose tegumentar no Brasil. Anais Brasileiros de Dermatologia 1992; 67(2):55-60.
60. Gomes AC. et al. Aspectos ecológicos da leishmaniose tegumentar americana. 9. Prevalência/incidência da infecção humana nos Municípios de Pedro de Toledo e Miracatu, São Paulo, Brasil. Revista do Instituto de Medicina Tropical 1992; 34(2):149-158.
61. Pessoa SB, Martins AV. In: Pessoa parasitologia médica. 9a ed. Rio de Janeiro: Guanabara Koogan; 1974. p. 117-140.
62. Iversson LB et al. Investigação epidemiológica de um caso de leishmaniose visceral autóctone da Grande São Paulo, Brasil. Revista de Saúde Pública 1979; 13:159-167.
63. Gomes AC. American Leishmaniasis Epidemiology in Brazil. Insecticide Science Application 1986; 7(2):161-169.
64. Warren KS et al. Helminth Infection. In: Jamison, D.T. et al. Disease Control Priorities in Developing Countries. New York: Oxford University Press; 1993. p.131-160.
65. Gupta MC. Intestinal Parasitic Infections and Malnutrition. Indian Journal of Pediatry 1980; 47:503-509.
66. Blumenthal DS, Schultz MC. Effects of Ascaris Infection on Nutritional Status in Children. American Journal Tropical Medicine and Hygiene 1976; 25:682-690.
67. Chieffi PP. et al. Aspectos epidemiológicos das enteropasitoses no Estado de São Paulo, Brasil. Revista Paulista de Medicina 1982; 99(3):34-36.
68. Waldman, E.A. & Chieffi, P.P. Enteroparasitoses no Estado de São Paulo: questão de saúde pública. Revista do Instituto Adolfo Lutz 1989; 49(1):93-99.
69. Monteiro CA et al. Estudo das condições de saúde das crianças das Município de São Paulo (Brasil), 1984/1985. VII. Parasitoses intestinais. Revista de Saúde Publica 1988; 22:8-15.
70. Blake PA. Epidemiologic Aspects of Cholera. In: Castro AFP, Almeida WF. Cholera on the American Continents. Washington: ILSI Press; 1993. p.11-19.
71. Simeant S. Choléra, 1991 - viel ennemi, nouveau visage. World Health Statistic Quartely 1992; 45:208-219.
72. Cholera Working Group. International Centre for Diarrhoeal Diseases Research, Bangladesh. Large Epidemic of Cholera-like in Bangladesh Caused by Vibrio cholerae 0139 Synonym Belgel. Lancet 1993; 342:387-390.
73. Tulloch J. Global Considerations in the Control of Cholera. In: Castro, A.F.P. & Almeida, W.F. Cholera on the American Continents. Washington: ILSI Press; 1993. p.3-9.
74. Sagarnaga RV. The Epidemiologic Situation of Cholera in the American Continent. In: Castro AFP, Almeida WF. Cholera on the American Continents. Washington: ILSI Press; 1993. p.27-34.
75. Salazar-Lindo E. Cholera in Peru, 1991: the Extent of the Epidemic, Modes of Transmission, and Lessons Learned. In: Castro AFP, Almeida WF. Cholera on the American Continents. Washington: ILSI Press; 1993. p.21-26.
76. Shepard DS, Halstead SB. Dengue (with Notes on Yellow Fever and Japanese Encephalitis). In: Jamison DT et al. Disease Control Priorities in Developing Countries. New York: Oxford University Press; 1993. p.303-319.
77. Lo SS. Epidemiologia e controle do dengue no Estado de São Paulo. Avaliação do processo de municipalização das atividades de controle do Aedes aegypti na Região de Presidente Prudente - 1985-1991 [dissertação de mestrado]. Campinas, São Paulo: Faculdade de Medicina da Unicamp; 1993.
78. Fundação Nacional de Saúde. Ministério da Saúde. Programa de auto-suficiência nacional em imunobiológicos. Brasília (DF); 1993.
79. Cherkasskii BL. The System of the Epidemic Process. Journal of Hygiene and Epidemiology 1988; 32:321-328.
 Endereço para correspondência:
Endereço para correspondência:
Av. Dr. Arnaldo, 715, Cerqueira César
São Paulo/SP
CEP: 01246-904
E-mail:eawaldma@usp.br
* Trabalho originalmente publicado no livro: "Velhos e novos males da saúde no Brasil - a evolução do país e de suas doenças"; organizado por Carlos Augusto Monteiro. Editora HUCITEC/NUPENS/USP. Republicado com autorização da editora HUCITEC. Está prevista uma segunda edição revista e ampliada da obra original.











 Curriculum ScienTI
Curriculum ScienTI