Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Informe Epidemiológico do Sus
versão impressa ISSN 0104-1673
Inf. Epidemiol. Sus v.8 n.4 Brasília dez. 1999
http://dx.doi.org/10.5123/S0104-16731999000400002
Epidemiologia e medidas de prevenção do Dengue
Epidemiology and preventive measures of Dengue
Maria da Glória TeixeiraI; Maurício Lima BarretoI; Zouraide GuerraII
IUniversidade Federal da Bahia
IIFundação Nacional de Saúde
RESUMO
O dengue apresenta-se nos grandes centros urbanos de várias regiões do mundo, inclusive do Brasil, sob a forma de epidemias de grande magnitude, e sob a forma hiperendêmica, nos lugares onde um ou mais sorotipos circularam anteriormente. Mesmo considerando-se as lacunas dos conhecimentos disponíveis para prever, sob firmes bases científicas, as futuras ocorrências de epidemias das formas graves desta enfermidade, a atual situação epidemiológica e entomológica de extensas áreas de vários continentes evidencia grandes possibilidades para agravamento do cenário atual, pois os fatores que determinam a reemergência destas infecções são difíceis de serem eliminados. O acompanhamento da atual situação de circulação dos quatro sorotipos dos vírus do dengue e o conhecimento das dificuldades que estão sendo enfrentadas para impedir a ocorrência destas infecções e do risco potencial do reflexo destes acontecimentos para a população são fundamentais para que dirigentes e profissionais da rede de serviços do SUS possam discutir, posicionar-se e orientar suas estratégias de intervenção neste campo. Este artigo tem como objetivo fazer uma revisão dos fatores determinantes destas infecções, assim como apresentar e discutir as medidas de prevenção disponíveis, apontando algumas reflexões úteis para o debate.
Palavras-Chave: Dengue; Fatores Determinantes; Epidemiologia; Prevenção.
SUMMARY
In the past years dengue has been present in epidemic or endemic form in a large number of urban centers worldwide. The epidemiologic and entomological situation found in those centers, the technical difficulties or the lack of political determination to change the situation as well as the gaps in the knowledge to predict on scientifical basis new epidemics of the severe form of dengue, are evidences of the potential to increase the occurence of dengue and, in special, the hemorragic dengue fever in the near future. The surveillance of the occurrence and spread of each of the four serotypes of the dengue virus, the problems related with its control and the potential risks to the population are fundamental to generate informations to increase the competence of professionals and managers of the health network of the Unified Health System (SUS) to discuss and take positions towards the strategies of intervention to tackle this problem. The aim of this article is present a commented review of the determinant factors of those infections and to discuss the available preventive measures calling attention to some useful reflections for debate.
Key Words: Dengue; Determinants Factors; Epidemiology; Prevention.
Introdução
O processo dinâmico e progressivo de seleção adaptativa para a sobrevivência das espécies, que ocorre cotidianamente na natureza, envolve importantes fenômenos que interferem no estado de saúde das populações humanas. Isto pode ser bem evidenciado na força da reemergência das infecções causadas pelos vírus do dengue, pois as agressões dos quatro sorotipos destes agentes às populações humanas vêm crescendo em magnitude e extensão geográfica, desde meados do século XX,1 em função da velocidade de circulação e replicação viral, facilitada pela extraordinária capacidade de adaptação das populações de mosquitos que lhes servem como transmissores, e pela incapacidade do homem, neste momento, de se proteger contra estas infecções.
Por questões econômicas, sociais e políticas, os países das Américas que erradicaram o Aedes aegypti, principal transmissor do vírus do dengue, nas décadas de cinqüenta e sessenta, em virtude da necessidade de eliminar a febre amarela urbana, não utilizaram oportunamente e com o rigor necessário, os conhecimentos técnicos e científicos adquiridos durante a execução daquela campanha, quando detectaram nos anos setenta a reinfestação de algumas áreas, por este vetor. Como o ambiente dos centros urbanos favorece sobremaneira a dispersão e a elevação da densidade das populações desse mosquito, e há falhas nas estratégias de combate, a circulação dos vírus do dengue se estabeleceu e se expandiu, passando a constituir um grave problema de saúde pública neste final de século.
Estima-se que cerca de 3 milhões de casos de febre hemorrágica do dengue e síndrome do choque do dengue e 58 mil mortes já foram registradas nos últimos quarenta anos.1 Os mecanismos que definem a ocorrência das formas graves destas infecções ainda não estão reconhecidos integralmente, e estudos populacionais e individuais devem ser conduzidos para que se possa esclarecer os pontos obscuros. Neste sentido, tem-se que buscar aliar esforços de epidemiologistas, virologistas e clínicos na perspectiva de trabalhos interdisciplinares capazes de contribuir para o avanço do conhecimento dos mecanismos envolvidos na circulação viral nas populações humanas, visando identificar os fatores que influenciam nesta dinâmica, e que modulam a transição entre o aparecimento do dengue clássico e febre hemorrágica do dengue.
Mesmo considerando-se as lacunas dos conhecimentos disponíveis para predizer sob firmes bases científicas as futuras ocorrências de epidemias das formas hemorrágicas do dengue, a atual situação epidemiológica e entomológica de extensas áreas de vários continentes evidencia maiores possibilidades para um agravamento deste cenário, pois os fatores que determinaram a reemergência destas infecções são difíceis de serem eliminados. A Organização Mundial da Saúde, desde 1984, colocou em sua pauta de prioridades o apoio às pesquisas direcionadas para a produção de imunobiológicos capazes de conferir proteção contra os quatro sorotipos dos vírus do dengue, como parte do seu programa para desenvolvimento de vacinas, mas, apesar de alguns avanços, ainda não se tem disponível nenhum imunoprotetor para uso em populações.2
Tendo em vista a magnitude e relevância deste problema, este artigo tem como propósito fazer uma breve revisão comentada dos fatores identificados como determinantes destas infecções, da distribuição da doença no mundo com especial destaque para as Américas e Brasil, assim como apresentar e discutir os instrumentos e estratégias de controle disponíveis, apontando algumas reflexões para debate.
O Vírus e seus Transmissores
Os agentes etiológicos da febre amarela e do dengue foram os primeiros microorganismos a serem denominados vírus, em 1902 e 1907, respectivamente, descritos como agentes filtráveis e submicroscópicos. Somente 36 anos depois desta precoce observação foi que se alcançaram o conhecimento e a tecnologia necessários para o desenvolvimento de pesquisas laboratoriais com estes agentes. Em 1906, as primeiras evidências do ciclo de transmissão do dengue foram publicadas por Bancroft, que levantou a hipótese de o Aedes aegypti ser o vetor da infeçcão, o que, logo depois, foi confirmado por Agramonte e outros pesquisadores.3 Com isto, foi possível estabelecer os elos epidemiológicos envolvidos na transmissão da doença resumidos na cadeia:

O isolamento dos vírus só ocorreu na década de quarenta, por Kimura, em 1943, e Hotta, em 1944, tendo-se denominado Mochizuki a esta cepa. Sabin e Schlesinger, em 1945, isolaram a cepa Havaí, quando o primeiro, neste mesmo ano, ao identificar outro vírus em Nova Guiné, observou que as cepas tinham características antigênicas diferentes e passou a considerar que eram sorotipos do mesmo vírus. Às primeiras cepas ele denominou sorotipo 1 e à da Nova Guiné sorotipo 2. Em 1956, no curso da epidemia de dengue hemorrágico no Sudeste Asiático, foram isolados os vírus 3 e 4, definindo-se, a partir daí, que o complexo dengue é formado por quatro sorotipos: DEN-1, DEN-2, DEN-3 e DEN-4.3
Esses vírus, que pertencem à família Flaviviridae, são sorologicamente relacionados, mas antigenicamente distintos, e têm sido isolados in natura de mosquitos do gênero Aedes, subgênero Stegomya espécies aegypti, albopictus e polynesiensis. Na África e na Ásia, tem-se demonstrado que os vírus circulam entre os macacos, não estando claro se é um ciclo primitivo ou um ciclo humano retrógrado.4 Recentemente, Silva e cols.5 realizaram um inquérito sorológico que diagnosticou uma epizootia focal em macacos no Sri Lanka.
Nas Américas, o Aedes aegypti é o único transmissor desses vírus com importância epidemiológica. Esta espécie de mosquito é originária da África subsahariana, onde se domesticou e se adaptou ao ambiente criado pelo homem, tornando-se antropofílico, sendo suas larvas encontradas em depósitos artificiais. Estas características de adaptação permitiram que se tornassem abundantes nas cidades e fossem facilmente levados para outras áreas, pelos meios de transporte, o que aumentou sua competência vetorial, ou seja, a sua habilidade em tornar-se infectado por um vírus, replicá-lo e transmiti-lo.6 Da África, o Ae. aegypti se dispersa para todo o hemisfério ocidental no século XVII, para o Mediterrâneo no século XVIII, para a Ásia tropical no século XIX e para as Ilhas do Pacífico no final do século XIX e início do século XX.4
O Ae. aegypti foi erradicado do Mediterrâneo, na década de 50, e de grande parte das Américas, nos anos 50 e 60. No entanto, houve reinfestação na maioria das áreas de onde havia sido erradicado e, hoje, este vetor é considerado uma espécie "cosmotropical",4 observando-se que sua capacidade de adaptação está se ampliando pois, em 1987, foi registrada a sua sobrevivência em áreas situadas a 1.200 metros acima do nível do mar.7 Além disto, ao contrário do que se pensava anteriormente, o Ae. aegypti tem a capacidade de fazer ingestões múltiplas de sangue durante um único ciclo gonadotrófico, o que amplia a sua possibilidade de infectar-se e de transmitir os vírus.8
O Aedes albopictus é uma espécie oriunda das selvas asiáticas e até recentemente restrita àquele continente. Nos últimos quatorze anos, em conseqüência do intenso comércio intercontinental de pneus por intermédio dos transportes marítimos, dissemina-se para as Américas, sendo incialmente detectado nos Estados Unidos, em 1985, onde já está presente em 25 estados. Logo depois, em 1986, é identificado no Brasil, já tendo se disseminado para 1.465 municípios distribuídos em 14 unidades federadas. Atualmente, está presente também em mais seis países da América Central e do Sul, na África, na Nigéria, em algumas Ilhas do Pacífico e no Sul da Europa.4
O Ae. albopictus não é doméstico como o aegypti. Prefere os ocos de árvores para depositar seus ovos e tem hábitos antropofílicos e zoofílicos diurnos e fora dos domicílios. Sua competência vetorial vem sendo objeto de investigação, vez que tais hábitos podem estabelecer um elo entre o ciclo dos vírus do dengue nos macacos e no homem, além de haver referência quanto à sua responsabilidade pela transmissão de surtos epidêmicos de dengue clássico e hemorrágico na Ásia.9,10
Ibanez-Bernal e cols.,11 de outro lado, em 1997, registram, pela primeira vez nas Américas, a infecção natural do Aedes albopictus pelos vírus do dengue, em espécimes coletadas durante um surto que ocorreu na cidade de Reynosa no México. Estes autores chamam a atenção para o fato de que os sorotipos 2 e 3 foram detectados em um "pool" de dez mosquitos machos, o que indica haver transmissão transovariana nesta espécie, como acontece com o Ae. aegypti. Este novo achado é de grande importância epidemiológica pelo potencial de transmissão dos vírus do dengue para outras áreas geográficas livres do Ae. aegypti, mas que estão infestadas pelo Ae. albopictus, a exemplo do sul da Europa e dos Estados Unidos.
Dinâmica de Transmissão do Vírus do Dengue
É muito complexa a inter-relação dos fatores envolvidos na dinâmica da circulação dos quatro sorotipos dos vírus do dengue, o que gera confusão e incertezas em vários campos do conhecimento, principalmente no que diz respeito aos determinantes das suas apresentações clínicas e epidemiológicas que são pleomórficas. Assim, observam-se epidemias graves, como as ocorridas no Sudeste Asiático, onde as formas hemorrágicas têm sido freqüentes;12,13 as epidemias clássicas consideradas benignas, como a de 1979, em Cuba, causada pelo sorotipo DEN-1, e que logo foi seguida por outra, em 1981, vinculada ao sorotipo DEN-2, surpreendentemente grave, com milhares de casos hemorrágicos.14 Em contraponto, as primeiras epidemias dos grandes centros urbanos brasileiros foram seguidas de outras, nas mesmas áreas e provocadas por agentes pertencentes a sorotipos diferentes, com poucos registros de dengue hemorrágico, não confirmando, desta forma, as previsões de gravidade feitas a partir dos eventos de Cuba.15
A capacidade de predição e de explicação das apresentações epidemiológicas e clínicas, no atual estado da arte, ainda é muito limitada, o que demanda esforços de pesquisadores de todas as áreas do conhecimento para a elucidação dos intricados fenômenos envolvidos. Dentre estes, devem-se destacar a importância do estudo dos fatores que influenciam na dinâmica da circulação viral, ou seja, dos determinantes e condicionantes da produção das infecções no que diz respeito a sua freqüência, distribuição e gravidade que se expressam em distintas apresentações epidemiológicas, ressaltando-se as epidemias explosivas ou mais limitadas, com ou sem casos graves; os períodos endêmicos com maior ou menor incidência de casos aparentes; e as epidemias com exacerbação de formas clínicas graves.3,15,16,17
Em 1995, Kuno17 chama a atenção para o fato de que, nas últimas décadas, as investigações sobre dengue estão centradas no controle vetorial, na biologia molecular dos vírus, no desenvolvimento de vacinas e na patogênese do dengue hemorrágico e da síndrome do choque do dengue. São poucos, segundo este autor, os esforços dirigidos para a compreensão dos fatores que modulam a dinâmica da transmissão viral, cuja análise tem sido negligenciada, embora seja fundamental do ponto de vista científico e para a adoção das estratégias de controle.
Condicionantes da circulação viral
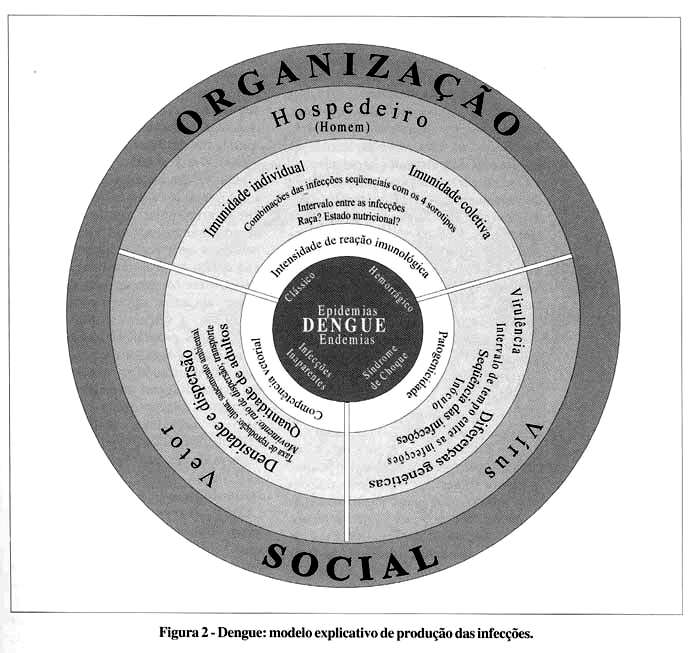
Os principais fatores que têm sido apontados como condicionantes das apresentações epidemiológicas e clínicas do dengue são relacionados na Figura 1. No modelo explicativo de produção das infecções que apresentamos (Figura 2) além dos fatores listados, incluem-se com destaque e consideram-se como fundamental na determinação da circulação dos vírus, a forma em que se organiza o espaço geográfico dos centros urbanos, o modo de vida de suas populações e os seus reflexos no ambiente, que criam as condições para a proliferação dos vetores.18,19 O espaço social organizado influencia na interação sinérgica dos três elementos (vetor, homem e vírus) da cadeia biológica e epidemiológica. Entretanto, o dengue distingue-se das outras doenças infecciosas e parasitárias, porque a ocorrência da maioria delas está estreitamente relacionada com as más condições sociais e econômicas das populações, produzindo diferenciais na sua freqüência e distribuição, refletindo as desigualdades de cada sociedade.20,21 Já a distribuição e a freqüência das infecções pelos vírus do dengue estão intrinsecamente relacionadas com a plasticidade e poder de adaptação do Ae. aegypti ao ambiente habitado pelo homem, principalmente, e aos espaços com grandes adensamentos populacionais como os encontrados nas metrópoles modernas, pois a transmissão e a circulação destes vírus são condicionadas pela densidade e dispersão deste mosquito. Cada sorotipo específico dos vírus do dengue, quando introduzido em grandes cidades indenes, com elevada densidade vetorial, transmite-se rapidamente provocando epidemias explosivas. De acordo com Rodhain & Rosen,4 a persistência destas infecções nas populações humanas só ocorre nos espaços urbanos que mantêm elevados índices de infestação de Ae. aegypti e grandes adensamentos populacionais, o que, aliado às taxas de nascimentos, vai repondo o estoque de indivíduos susceptíveis à infecção. Isto porque a principal ou talvez única fonte de infecção do vetor é o homem e a viremia humana persiste por apenas sete dias na fase aguda da infecção e nunca foi demonstrada viremia recorrente com o mesmo sorotipo.
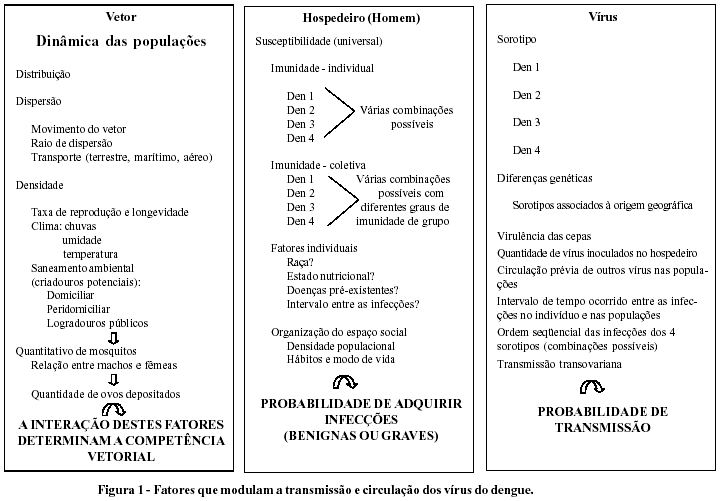
Estas condições descritas acima são propiciadas pela forma de organização social do espaço, pois são inerentes a estes centros urbanos a grande densidade populacional. O modo de vida de suas populações gera, em escala exponencial, os habitats para a oviposição e conseqüente proliferação do Ae. aegypti,18,22 tanto em locais onde as condições sanitárias são deficientes, quanto em outros, onde se considera que existe adequada infra-estrutura de saneamento ambiental. Nas áreas mais pobres, que correspondem àquelas deficientes em estrutura urbana, os criadouros potenciais mais encontrados são vasilhames destinados ao armazenamento de água para consumo, devido à freqüente intermitência ou mesmo inexistência dos sistemas de abastecimento, e recipientes que são descartados mas permanecem expostos ao ar livre no peridomicílio, por não se dispor de coleta de lixo adequada. Os hábitos culturais das populações de classe mais elevada também mantêm no ambiente doméstico, ou próximo a este, muitos criadouros do Ae. aegypti, mas que têm diferentes utilidades, pois, em geral, são destinados à ornamentação (vasos de plantas com água) ou tanques para armazenamento de água tratada sem tampas. Por outro lado, o processo de apropriação do espaço destas metrópoles favorece a proximidade espacial das populações de diferentes classes sociais, seja pela favelização de áreas situadas dentro de bairros nobres, seja pela ocupação de prédios antigos onde se instalam moradias sob a forma de cortiços.23
Ainda nestes centros, outro aspecto que permite a manutenção da infestação vetorial são as dificuldades para o desenvolvimento das intervenções sobre a população de mosquitos, que também decorrem de distintos hábitos de vida. Como exemplos marcantes e antagônicos observa-se que em muitas residências de bairros nobres, por questões de segurança, não se consegue a permissão dos moradores ou síndicos para a atuação intra e peridomiciliar dos agentes de saúde dos programas de controle do mosquito, básica para a atuação química e físico contra o vetor, e, em algumas áreas de favelas com registro maior de violências, particularmente quando dominadas pelas quadrilhas do narcotráfico, onde os agentes têm receio de trabalhar, preocupados com sua própria segurança ou são impedidos de fazê-lo. Desta forma, as taxas de recusas nestas áreas são muito elevadas, constituindo-se verdadeiras ilhas de difícil intervenção que, não só permanecem infestadas como prejudicam a eliminação do vetor nas áreas em torno, mesmo onde o programa alcança cobertura próxima ao ideal, qual seja, o tratamento com larvicida de 100% dos domicílios com presença das formas imaturas do Ae. aegypti. Isto prejudica sobremaneira a eficiência e efetividade destas ações nos complexos urbanos.
Assim, os contrastes que resultam da organização social dos espaços urbanos modernos favorecem a proliferação dos mosquitos transmissores do dengue, tanto por fatores ligados ao conforto, bem-estar, e suposta segurança, como por outros associados às suas mazelas, expressos em grandes adensamentos populacionais, violência, precariedade de infra-estrutura de saneamento, produção desenfreada e disposição no meio ambiente de recipientes descartáveis e pneus, dentre outros. Assim, pode-se observar em nível macro que os depósitos predominantes de Ae. aegypti na Região Nordeste, a mais pobre do país, são aqueles que se destinam ao armazenamento de água no domicílio, enquanto na mais rica, Região Sudeste, são vasos de planta (Figura 3).
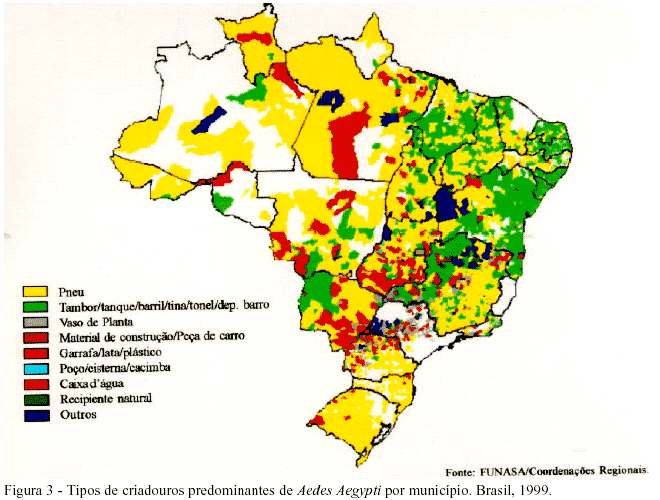
Alguns inquéritos soroepidemiológicos nacionais que utilizaram amostras populacionais evidenciaram que a distribuição das infecções dos vírus circulantes em grandes capitais não poupou os bairros nobres,24,25,26 entretanto, embora estes achados não sejam concordantes com outros que utilizaram inquéritos de alunos de escolas públicas27,28 ou taxas de incidência dos dados oficiais do sistema de notificação compulsória.29 Entende-se que estas discrepâncias se devem ao fato de que alunos da rede pública de ensino e em parte os indivíduos com registros de notificação compulsória de doença, residem nas áreas mais pobres das cidades, o que pode propiciar distorções nas análises de freqüência da distribuição espacial.
Condicionantes das formas hemorrágicas
Algumas teorias têm sido desenvolvidas para explicar a ocorrência das formas hemorrágicas do dengue. A primeira, denominada teoria imunológica de Halstead,30,31,32 associa a ocorrência destas formas a duas infecções seqüenciais, por diferentes sorotipos, após ter transcorrido um tempo mínimo entre elas de, aproximadamente, três anos, quando, então, a resposta imunológica do indivíduo sensibilizado seria amplificada pela segunda infecção, em função da existência prévia de anticorpo heterotípico (Antibody dependent enhancement-ADE). A segunda, defendida por Rosen,33,34 relaciona as formas graves a uma maior virulência de determinadas cepas dos vírus. Watts e cols.35 em estudo de vigilância das características clínicas e sorológicas de casos de dengue no Peru, que tiveram como agente etiológico o genotipo americano do vírus DEN-2, concluem que, possivelmente esta cepa não detém as propriedades necessárias para causar formas severas da doença, o que, em parte, reforça o pensamento de Rosen. A terceira teoria reconhece que as duas primeiras não explicam de forma isolada os eventos epidemiológicos que vêm ocorrendo no mundo e propõe uma teoria integral de multicausalidade, segundo a qual se aliam vários fatores de risco: individuais - idade, sexo, raça, estado nutricional, pré-existência de enfermidades crônicas, presença de anticorpos, intensidade da resposta imunológica a infecções anteriores (ADE)-; fatores virais - virulência da cepa circulante, sorotipo(s) viral(is) envolvido(s) em cada evento epidemiológico; e os fatores epidemiológicos - imunidade de grupo, competência vetorial, densidade vetorial, intervalo de tempo entre as infecções por diferentes sorotipos e intensidade da circulação viral.3,36,37 Esta última teoria é uma tentativa de explicação mais totalizadora, ao reconhecer que o resultado das apresentações epidemiológicas e clínicas no indivíduo e nas populações depende de todos os elos e fatores interligados, aproximando e considerando a complexidade dos fenômenos envolvidos na determinação destas infecções. O esquema explicativo proposto (Figura 2) adota esta como referencial teórico, por ser mais abrangente e articular as três espécies de seres vivos envolvidos no processo de transmissão, ao tempo em que coloca em maior evidência o papel da organização social do espaço.
Todavia, as investigações epidemiológicas e/ou biológicas, por fragmentar o processo de estudo, buscando associações lineares e, em virtude dos limites metodológicos e técnicos disponíveis, não fornecem subsídios suficientes para a compreensão das condições em que se dá o aparecimento das formas graves da doença, mesmo quando se adota como referencial a terceira teoria. Discussões continuam acerca do potencial explicativo de cada uma destas três teorias com relação ao aparecimento de epidemias de dengue hemorrágico. Os conhecimentos biológicos e epidemiológicos são insuficientes para o estabelecimento de previsões, sob firmes bases científicas, qualquer que seja a teoria que nos referencie.
Epidemiologia
A descrição das epidemias atribuídas ao dengue, ocorridas antes da identificação dos microrganismos causadores da doença, dá margem a dúvidas quanto ao fato de todas terem os vírus do dengue como agentes, e se foram causadas pelo mesmo sorotipo ou pela mesma cepa. Relatos clínicos e epidemiológicos potencialmente compatíveis com dengue são encontrados em uma enciclopédia chinesa datada de 610 DC, não havendo precisão quanto ao ano exato desta ocorrência. São descritos, também, surtos de uma doença febril aguda no oeste da Índia Francesa, em 1635, e no Panamá, em 1699, não existindo consenso quanto a terem sido febre do dengue ou Chikungunya.12 Os eventos de melhor documentação na literatura, neste período anterior à identificação dos agentes, são as da ilha de Java, em Jacarta, e as do Egito, ambas em 1779, além da de Filadélfia, USA, no ano seguinte.3
Ao longo dos três últimos séculos, tem-se registrado a ocorrência do dengue em várias partes do mundo, com pandemias e epidemias isoladas, atingindo as Américas, a África, a Ásia, a Europa e a Austrália. De acordo com Howe,38 ocorreram no mundo oito pandemias, com duração de três a sete anos, no período compreendido entre 1779 e 1916.
Um inquérito sorológico retrospectivo indicou que o sorotipo DEN-1 predominou nas Filipinas, na década de vinte e durante uma intensa circulação nas regiões do Pacífico Sul e na Ásia, iniciada nos anos trinta e que perdurou por todo o período da Segunda Guerra. Existem algumas evidências de que no século XIX e primeiras décadas do século XX, quando os meios de transporte ainda não eram tão rápidos, um sorotipo único persistia circulando em determinadas regiões, por alguns anos, causando surtos epidêmicos periódicos, devido a alterações na coorte de susceptíveis.12
Por um longo período essa virose foi considerada doença benigna e, somente após a Segunda Guerra Mundial, que favoreceu a circulação de vários sorotipos em uma mesma área geográfica, ocorreram surtos de uma febre hemorrágica severa que, posteriormente, seria identificada como uma forma do dengue. O primeiro destes eventos é descrito nas Filipinas, em 1953, sendo confundido com a febre amarela e com outras arboviroses do grupo B e, só depois, em 1958, com a epidemia de Bangcoc, Tailândia, a febre hemorrágica é associada ao dengue.3 De acordo com Gubler,12 esta forma clínica já ocorria antes do século XX, pois, desde 1780, há relatos esporádicos de doença hemorrágica associada a severas epidemias de dengue. Na Grécia, em 1927/1928, por meio de diagnóstico retrospectivo, identificou-se a ocorrência de uma grave epidemia de dengue hemorrágico de incidência alarmante e alta letalidade. A investigação de soros de sobreviventes indicou a circulação dos vírus DEN-1 e DEN-2.39
Progressivamente, outros países do Sudeste Asiático foram apresentando surtos de dengue hemorrágico: Vietnã do Sul (1960), Singapura (1962), Malásia (1963), Indonésia (1969) e Birmânia (1970). Nesta região, nos anos oitenta, a situação agrava-se e a doença expande-se para a Índia, Sri Lanka, Maldivas e leste da China. Atualmente, sob a forma de epidemia ou endemia, milhares de casos e de óbitos vêm ocorrendo a cada ano, predominantemente em crianças.12
Em 1964, após 20 anos sem registro da doença, um pequeno surto de DEN-3 é diagnosticado no Taiti, ilha do Pacífico Sul, que não se dissemina para as outras ilhas próximas. Cinco anos após, um novo episódio causado pelo mesmo vírus evidencia que este permaneceu circulando no local, sob a forma endêmica. Nos anos seguintes, epidemias de DEN-2 ocorreram em várias ilhas do Pacífico e, em 1975, o DEN-1 foi introduzido nesta Região. Na Austrália, registros de dengue vêm sendo feitos desde 1800, com múltiplas epidemias ocorrendo até 1955. Em 1981, a virose reaparece provocando severas epidemias em várias cidades. A circulação dos vírus DEN-1 e DEN-2 vem-se mantendo até o momento atual.12
Dengue nas Américas
Nas Américas, o vírus do dengue circula desde o século passado até as primeiras décadas do século XX, quando então há um silêncio epidemiológico, registrando-se nos anos sessenta a reintrodução dos sorotipos 2 e 3, associada à ocorrência de várias epidemias de dengue clássico. Em 1963, detectam-se os primeiros casos na Jamaica relacionados ao DEN-3, que depois se disseminam para a Martinica, Curaçau, Antigua, Saint Kitts, Sanguilla, e Porto Rico. Logo após, atinge o norte da América do Sul, Venezuela e Colômbia, e são notificados nos Estados Unidos casos importados15. Entre 1968 e 1970, epidemias com os vírus 2 e 3 são registradas no Caribe, na Guiana Francesa e na Venezuela.
Na década de setenta, da mesma forma, ocorrem epidemias na Colômbia, em Porto Rico e em Saint Thomas, com isolamento dos mesmos vírus. Em 1977, o sorotipo 1 é introduzido na Jamaica, disseminando-se por todas as ilhas do Caribe e na América Tropical. No início da década de oitenta, é isolado o vírus DEN-4, mas este período se destaca pela intensa circulação dos vírus no continente americano e os países que mais notificaram casos foram: Brasil, Colômbia, Guatemala, Honduras, México, Nicarágua, Paraguai, Porto Rico e Venezuela.40
O acontecimento epidemiológico mais relevante na história do dengue nas Américas é a epidemia de dengue hemorrágico e síndrome de choque do dengue (DH/SCD) que ocorre em Cuba, no ano de 1981, quando são notificados 344.203 casos, com 116.143 hospitalizações. Dentre os 10.312 casos considerados graves, 158 resultaram em óbitos e, destes, 101 foram em crianças. O vírus DEN-2 é associado a esta epidemia, que foi precedida por outra, causada pelo vírus DEN-1, em 1977.14 Esse país implantou um programa de erradicação do Ae. aegypti a partir de 1982 e manteve índices de infestação próximos a zero, até os primeiros anos da década de noventa. Em 1997, uma nova epidemia explode em Santiago de Cuba, quando se confirmam 2.946 casos, com 102 de febre hemorrágica do dengue, e 12 óbitos. Observou-se que os casos hemorrágicos foram em adultos em quase sua totalidade, sendo a menor idade 17 anos, em um único indivíduo. O vírus circulante foi o DEN-2, e os casos hemorrágicos apresentavam anticorpos para duas infecções. A análise destas informações associadas à história das duas epidemias anteriores permitiu concluir que os casos hemorrágicos ocorreram em indivíduos que foram infectados em 1977, pelo vírus 1.41 O estudo desta epidemia revelou que o fenômeno da imunoamplificação pode se manter durante muitos anos ou talvez por toda a vida,41 e não de seis meses até cinco anos, como se pensava anteriormente, em função do padrão de intervalo das epidemias de dengue hemorrágico no Sudeste Asiático.30
Em outubro de 1989, eclode na Venezuela um surto de DH /SCD com um total de 8.619 casos e 117 óbitos, com isolamento dos vírus DEN-1, DEN-2 e DEN-4. Dois terços dos casos ocorrem em crianças menores de 14 anos, sendo considerado o segundo episódio mais grave nas Américas.40
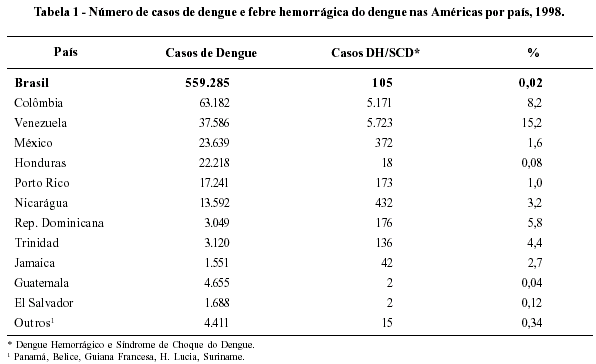
Nos anos 90, o quadro epidemiológico das Américas e do Caribe agravou-se e epidemias de dengue clássico são freqüentemente observadas em vários centros urbanos, muitas delas associadas a ocorrência de casos de dengue hemorrágico. Atualmente, os quatro sorotipos estão circulando neste continente e só não há registro de casos no Chile, Uruguai e Canadá (Figura 4), com ocorrência sistemática de casos de dengue hemorrágico. Até 1998, houve 54.248 casos, com 689 óbitos, o que corresponde a uma letalidade média de 1,3%. Os países que mais vêm contribuindo para este quantitativo são Venezuela, com 28.479 casos, México, com 12.422, Cuba, com 10.517, Colômbia com 8.236, Nicarágua, com 2.709, e o Brasil, com 821.42
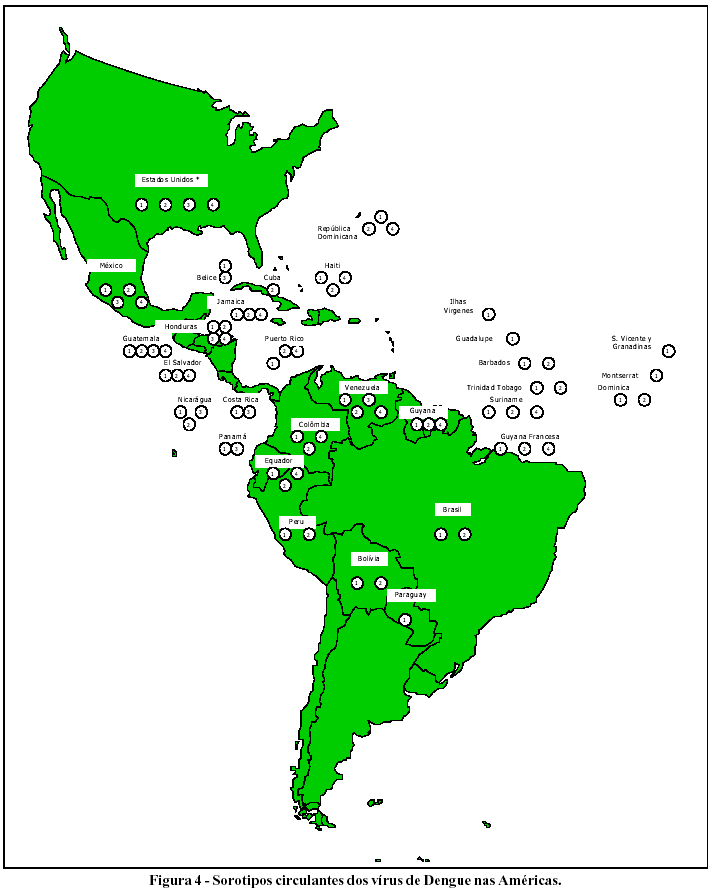
Em 1998, 17 países notificaram casos de dengue nas Américas (Tabela 1), com proporção muito variável de casos hemorrágicos (de 0,02% a 15,2%). Estas variações podem ser imputadas a múltiplos fatores, destacando-se o número de sorotipos e o tempo em que estão circulando em cada espaço; à magnitude das epidemias de dengue clássico anteriores e atuais que determinam o estado imunológico das populações expostas a novas infecções; às diferenças genéticas entre as cepas; aos atributos pessoais como idade e raça dos indivíduos; às diferenças nos critérios de classificação diagnóstica das formas de dengue, o que confere maior ou menor sensibilidade ao sistema de detecção de casos, bem como à qualidade e cobertura dos sistemas de saúde de cada país.
Dengue no Brasil
Algumas evidências apontam para a ocorrência de epidemias de dengue no Brasil desde 1846, nas cidades de São Paulo e Rio de Janeiro. Outros surtos relacionados a esta virose em São Paulo, no período compreendido entre 1851 e 1853, também estão referidos.43 Entretanto, as primeiras referências a casos de dengue na literatura médica datam de 1916, naquela cidade, e de 1923, em Niterói44. Neste último ano, um navio francês, com casos suspeitos, aportou em Salvador, Bahia, mas não foram registrados casos autóctones nesta cidade.45
Um inquérito sorológico realizado na Amazônia em 1953/1954, encontrou soropositividade para dengue, sugerindo que houve circulação viral na região.46 Entretanto, a primeira epidemia de dengue com confirmação laboratorial acontece em 1982, na cidade de Boa Vista, capital do Estado de Roraima, com a ocorrência de 11 mil casos segundo estimativas, o que correspondeu a aproximadamente uma incidência de 22,6%, e foram isolados dois sorotipos dos vírus no curso do evento: DEN-1 e o DEN-4.47 Estes agentes estavam circulando em diversos países do Caribe e no norte da América do Sul e sua introdução, possivelmente, se deu por via terrestre, pela fronteira da Venezuela.15 A propagação viral para o resto do país não se dá a partir desse episódio pelo fato de o mesmo ter sido rapidamente controlado e porque o Ae. aegypti não estava ainda disperso no território brasileiro.
O dengue só reaparece no Brasil cinco anos depois, na cidade de Nova Iguaçu, Estado do Rio de Janeiro, com identificação do sorotipo DEN-1. A partir daí, a virose dissemina-se para outras cidades vizinhas, inclusive Niterói e Rio de Janeiro, notificando-se 33.568 casos em 1986 e 60.342 em 1987, com taxas de incidência de 276,4 e 491,1 por 100 mil habitantes, respectivamente. Também em 1986, registram-se casos de dengue em Alagoas e em 1987 no Ceará, com elevadas taxas de incidência de, respectivamente, 411,2 e 138,1 por 100 mil habitantes. Ainda em 1987, ocorre epidemia em Pernambuco, com 31,2 casos por 100 mil habitantes, e surtos localizados em pequenas cidades de São Paulo, Bahia, e Minas Gerais.
Após essas primeiras epidemias de dengue clássico, observa-se um período de dois anos que se caracteriza pela baixa endemicidade. Em 1990, ocorre um recrudescimento de grandes proporções, conseqüente ao aumento da circulação do DEN-1 e da introdução do DEN-2 no Rio de Janeiro, onde a incidência atinge 165,7 por 100 mil habitantes, naquele ano, e, em 1991, 613,8 casos por 100 mil habitantes. É neste período que surgem os primeiros registros de dengue hemorrágico, com 1.316 notificações, 462 confirmações diagnósticas e oito óbitos.48
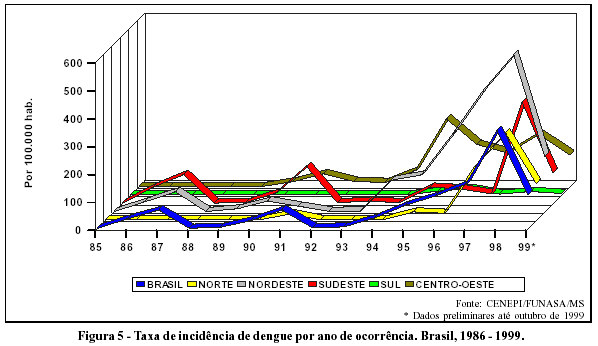
Nos dois primeiros anos da década de noventa a incidência da doença manteve-se quase que inteiramente restrita aos estados citados anteriormente, acrescentando-se poucas notificações oriundas de Mato Grosso e de Mato Grosso do Sul. Nos anos subseqüentes, a circulação viral (DEN- 1 e DEN-2) se expande rapidamente para outras áreas do território brasileiro (Figura 5). Cabe destacar a gravidade da epidemia de 1994 no Ceará, com 47.221 notificações e uma taxa de incidência de 711,88 por 100 mil habitantes. São registrados 185 casos suspeitos de dengue hemorrágico, com 25 confirmações e 12 óbitos.49
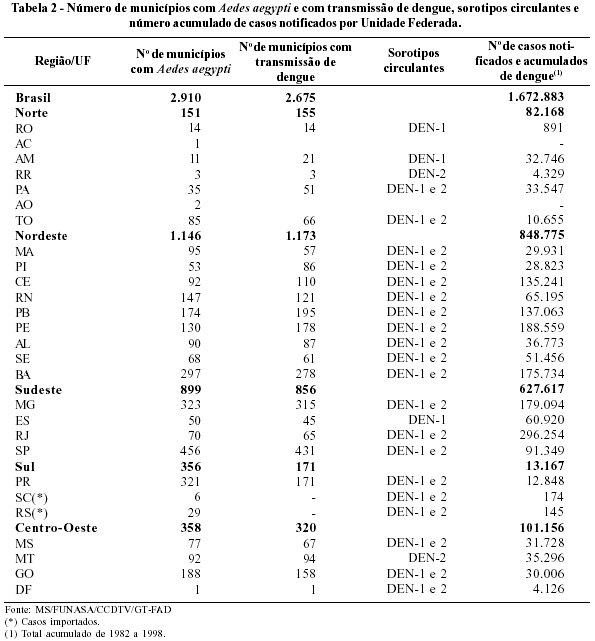
Na Tabela 2 observa-se que a transmissão já se estabeleceu em 2.756 municípios situados em 23 estados, e existe circulação simultânea dos sorotipos DEN-1 e DEN-2 em 19 das 27 unidades federadas brasileiras. Santa Catarina e Rio Grande do Sul só notificaram casos importados e apenas o Acre e o Amapá não têm nenhum registro de dengue. O número de notificações acumuladas no período de 1981 a 1998 ultrapassa mais de um milhão e meio de indivíduos. Todos os estados têm municípios infestados, perfazendo um total de 2.910. As epidemias de maior magnitude estiveram concentradas nos grandes centros urbanos e a intensidade da circulação viral coloca sob risco milhões de brasileiros a adquirirem as formas mais graves da doença.50
Entre 1990 e 1999 foram diagnosticados 888 casos de dengue hemorrágico, com 39 óbitos, letalidade média de aproximadamente 4,4% (Figura 6). Esta incidência relativamente baixa quando comparada à de dengue clássico e o fato de haver circulação de dois sorotipos no país há mais de oito anos, tem levado a considerar-se que os rígidos critérios diagnósticos estabelecidos para confirmação de caso podem estar subestimando a incidência das formas graves da doença. Possivelmente, alguns casos de DH/SCD estão passando despercebidos, mas infere-se que a incidência não deve ser de grande magnitude, visto não haver registro de óbitos com quadro clínico compatível com dengue hemorrágico. A elevada letalidade esperada para esta forma da doença, na ausência de diagnóstico e tratamento adequado, certamente chamaria a atenção da população e das autoridades sanitárias. Possivelmente, a cepa de DEN-2 que está circulando no Brasil também não exibe as condições necessárias para produzir grande quantidade de casos de doença hemorrágica,35 mesmo na vigência de infecções seqüenciais.
Os padrões epidemiológicos no Brasil
O vírus do dengue altera seu potencial epidêmico e as suas apresentações clínicas quando se move entre as populações,12 o que faz com que as apresentações epidemiológicas das infecções se expressem de modo muito variado. Assim, as epidemias podem ser explosivas, evoluindo em curto período de tempo, seguidas de circulação endêmica, outras delineiam dois picos epidêmicos em anos consecutivos e só depois é que se estabelece um período de baixa endemicidade, também de maior ou menor duração. Estas distintas apresentações dependem da interação entre os fatores relacionados nas Figuras 1 e 2 . Contudo, alguns padrões podem se repetir, particularmente quando se trata da introdução de um sorotipo do vírus em populações virgens de exposição, em locais com grandes densidades populacionais e com índices elevados de infestação pelo Ae.aegypti. Nestas situações, tem-se observado que durante algumas semanas a epidemia se anuncia com o aparecimento de alguns casos, próximos entre si, para logo depois configurar uma epidemia explosiva de duração variável.51
No Brasil, no período compreendido entre 1986 e 1993, as epidemias atingem mais os grandes centros urbanos, e em alguns estados (Rio de Janeiro, Ceará e Alagoas) delineiam-se duas ondas epidêmicas, em anos consecutivos, com intervalos de alguns meses entre elas.15 Em seguida, observava-se um período de dois anos com baixa incidência da doença. A partir de 1994 esta tendência de elevação bienal se altera significativamente.
Na Figura 7, observa-se que, excluindo-se o episódio isolado de 1982 ocorrido em Boa Vista, três ondas epidêmicas foram delineadas nos últimos 13 anos. A primeira, biênio 86/87, corresponde à introdução do vírus DEN- 1 em grandes centros urbanos, dos quais se destacaram as cidades que compõem a grande região metropolitana do Rio de Janeiro (incluindo Niterói), Fortaleza e Maceió. A incidência para o país como um todo atinge um pico de 65,1 casos por 100 mil habitantes. Com o recrudescimento da circulação do DEN- 1 e a introdução do vírus DEN-2, uma segunda alça foi registrada em 1990 e 1991, com níveis epidêmicos semelhantes à anterior, e registros de casos nas cidades citadas anteriormente, acrescido de outras nos Estados de Pernambuco, Minas Gerais e São Paulo. Nota-se que, logo após dois anos de altas incidências, estas se reduzem bruscamente a menos de cinco casos por 100 mil habitantes.
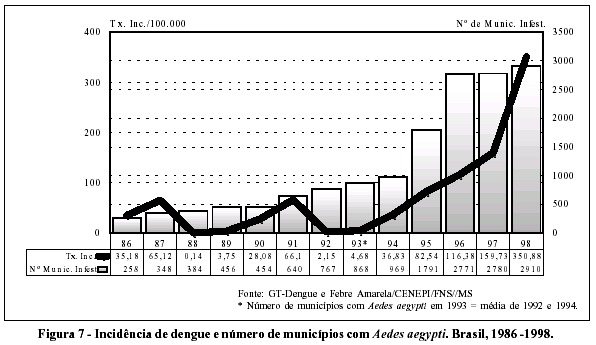
Diferentemente, a terceira onda epidêmica do Brasil, iniciada em 1994, vai se elevando nos anos subseqüentes, sem apresentar o declínio das anteriores. Os vírus DEN-1 e DEN-2 vão rapidamente sendo introduzidos e circulam em muitas outras cidades intensamente infestadas pelo Ae. aegypti e, seqüencialmente, as epidemias vão se sucedendo. A circulação estabelece-se não só por contiguidade, como, também, pela introdução de casos índices importados em áreas indenes, distantes dos centros onde os vírus foram isolados anteriormente. Este crescimento e expansão acompanha a dispersão do Ae. aegypti, que progrediu de modo também exponencial, como pode ser notado na superposição da curva de tendência temporal da doença à progressão do número de municípios infestados (Figura 7).
Em 1998, algumas unidades federadas registram taxas de incidência superiores a 1000 por 100 mil habitantes, sendo mais elevada na Paraíba, com 1807,4 por 100 mil habitantes. A Região Nordeste (Figura 5) é a que apresenta o maior risco de adoecer desde 1996, e neste ano atinge 556 por 100 mil habitantes, mais de 60% acima da média nacional (341 por 100 mil habitantes).
Em 1999, vem-se observando (Figura 5) um declínio significativo na incidência do dengue no país (121,6 por 100 mil habitantes até 20/10) que possivelmente se deve ao esgotamento de susceptíveis nas áreas onde a circulação viral foi muito intensa nos últimos anos, e a algum efeito na redução nos índices de infestação do vetor, conseqüente ao combate que vem sendo implementado em muitos municípios.
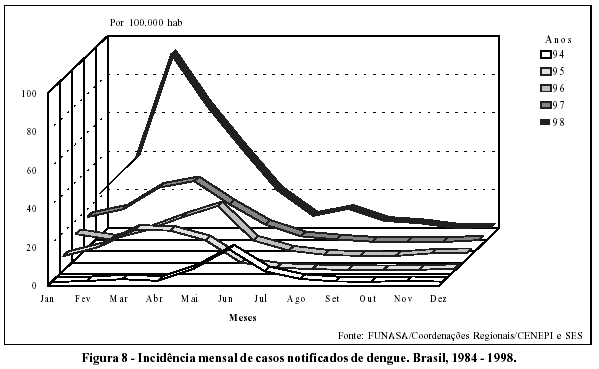
A sazonalidade das infecções (Figura 8) pelos vírus do dengue é bem evidente no Brasil, na maioria dos estados. A sua incidência se eleva significativamente nos primeiros meses do ano, alcançando maior magnitude de março a maio, seguida de redução brusca destas taxas a partir de junho. Este padrão sazonal, que nem sempre é observado em outros países, tem sido explicado pelo aumento na densidade das populações do Ae aegypti, em virtude do aumento da temperatura e umidade, que são registradas em grandes extensões de nosso território, durante o verão e outono.
Magnitude dos eventos epidêmicos
São muito freqüentes as infecções oligossintomáticas e inaparentes causadas pelos vírus do dengue. Em conseqüência, a subnotificação de casos é muito expressiva, mesmo quando o indivíduo apresenta a forma clássica sintomática da doença, em virtude de o quadro clínico ser confundido com muitas viroses febris e/ou exantemáticas, ou por ser considerada pela população como uma virose benigna, o que nem sempre impõe a busca de atenção médica. Deste modo, os dados oriundos das notificações oficiais são muito subestimados e não revelam a força da circulação viral, embora apontem a tendência de incidência da doença.
Para se estimar esta magnitude, são realizados inquéritos sorológicos que determinam a soroprevalência de anticorpos para os vírus do dengue. No Brasil, vários inquéritos foram realizados e os principais, nas grandes cidades, revelam soroprevalência média muito elevada como Rio de Janeiro (44,5%),27 Niterói (66%),28 Salvador (67%),26 Fortaleza (44%)24 e São Luís (41,4%),25 indicando que centenas de milhares de indivíduos foram infectados em cada um destes centros, o que evidencia que as epidemias foram de magnitude surpreendente e que, para cada caso notificado, dezenas de infecções deixaram de ser conhecidas. Chama a atenção a taxa reduzida encontrada em Ribeirão Preto (5,4%),52 cidade de médio porte, o que pode decorrer de medidas de combate vetorial mais efetivas que já vinham sendo implementadas antes e durante a epidemia.
Prevenção
Por não se dispor de vacina, a prevenção primária do dengue só pode realmente ser efetivada nas áreas sob risco quando a vigilância entomológica ou o combate ao vetor antecede a introdução do vírus. Quando a circulação de um ou mais sorotipos em uma região já está estabelecida, as medidas de combate ao vetor e a vigilância epidemiológica da doença têm baixa efetividade e os órgãos responsáveis pela prevenção do dengue enfrentam uma série de dificuldades técnico-científicas e operacionais, relacionadas à complexidade epidemiológica dessa doença.
Combate ao Aedes aegypti
As ações de combate ao Ae. aegypti, único elo vulnerável da cadeia epidemiológica do dengue, estão centradas em duas estratégias, controle ou erradicação, que se diferenciam quanto às suas metas, o que implica distintas extensões de cobertura, estrutura e organização operacional. Entretanto, ambas incluem três componentes básicos: saneamento do meio ambiente; ações de educação, comunicação e informação (IEC); e combate direto ao vetor (químico, físico e biológico).51,53,54,55,56
O componente de saneamento visa reduzir os criadouros potenciais do mosquito mediante: aporte adequado de água para evitar o seu armazenamento em recipientes que servirão para oviposição; proteção (cobertura) de recipientes úteis; reciclagem ou destruição de recipientes inservíveis; e tratamento ou eliminação de criadouros naturais. Dependendo da estratégia e meta do programa, este componente pode ser restrito às atividades específicas que são desenvolvidas pelos recursos humanos do próprio programa por meio de orientações aos moradores de cada residência para promoção de saneamento intra e peridomiciliar, ou mesmo limitado apenas a estas últimas, ou ser mais amplo, com envolvimento dos órgãos setoriais de saneamento responsáveis pela melhoria do sistema de abastecimento de água e coleta de resíduos sólidos.55,57
Da mesma forma, o segundo componente varia conforme as definições estratégicas e a importância que é dada às ações de educação, comunicação e informação, que podem ser confinadas apenas à atuação dos agentes de saúde em cada residência, associada ou não a algumas campanhas pontuais de educação e/ou comunicação de massa, ou ser bem mais abrangente com participação efetiva de setores sociais e governamentais; e à busca da participação das comunidades no processo de prevenção, implementação de metodologias pedagógicas capazes de proporcionar mudanças de comportamento no que diz respeito aos cuidados individuais e coletivos com a saúde, com ênfase na necessidade de redução e eliminação dos criadouros potenciais do mosquito transmissor da dengue.55,57
O combate físico e químico ao vetor inclui: a) tratamento focal, que é a eliminação das formas imaturas do Ae. aegypti, por meio de aplicação de larvicidas nos recipientes de uso doméstico que não podem ser destruídos, eliminados, ou tratados por outras formas e a flambagem da parede de recipientes não elimináveis que contêm ovos deste vetor, em pontos estratégicos; b) tratamento perifocal, que é polêmico quanto a sua eficácia, por utilizar aspersão de inseticidas em torno do foco, sem ação residual e sujeita às intempéries. A justificativa para seu uso é a eclosão do inseto adulto e seu pouso nas imediações do foco. Este procedimento, é feito mediante rociadores manuais ou a motor, nas paredes internas e externas dos recipientes preferenciais para ovoposição das fêmeas do vetor, e no seu entorno; c) aplicação espacial de inseticidas a ultrabaixo volume (UBV), para redução das formas aladas do Ae. aegypti. Esta técnica, só indicada em situações epidêmicas, pode ser feita por aplicação no intra e peridomicílio, empregando-se equipamentos portáteis, ou nas ruas, com máquinas pulverizadoras mais pesadas montadas em veículos. A efetividade desta última forma de combate é bastante questionada, mesmo quando são observados cuidadosamente todos os critérios técnicos preconizados, por se constatar pouco efeito na redução da população das formas adultas.51 As normas e procedimentos técnicos e operacionais das atividades de combate químico, nos diversos países, têm fundamentos comuns, e as variações observadas, atendem à realidade de cada área, ou à seleção de técnica ou rotina específica com a qual se tem maior experiência.55,56
O controle biológico é baseado no uso de organismos vivos capazes de competir, eliminar ou parasitar as larvas ou formas aladas do vetor, e ainda não se tem experiência de aplicação em larga escala. O Bacillus thuringhiensis H-14(BTI) e peixes larvicidas das espécies Gambusia afinis e Poecilia spp têm sido os mais utilizados e preconiza-se o seu uso mais amplo nos programas de combate. Ensaios com larvas de outros mosquitos (Toxorhynchites) e algumas pulgas d'água (Mesoscyclops; Macrocyclops), também vêm sendo experimentados.55
Atualmente, tanto nas estratégias de erradicação como nas de controle, tem sido orientado o uso integrado das várias técnicas de combate ao Ae. aegypti disponíveis, associadas aos outros dois componentes descritos (saneamento e IEC). O que as diferencia é que na primeira tem-se uma meta estabelecida a ser alcançada (índice de infestação zero), a implantação é planejada para ser executada em quatro fases bem definidas (ataque, consolidação, manutenção e vigilância entomológica) e preconiza-se que os componentes de saneamento e educação, comunicação e informação sejam os mais amplos possíveis e antecedam o início da fase de ataque, permanecendo em todas as outras fases, para não criar condições mais propícias à reinfestação. Além disso, alguns princípios técnicos científicos fundamentam a organização dos programas de erradicação, que são o da universalidade da implantação das atividades em cada território; o de sincronicidade de ações dos três componentes; e a continuidade programática para que não haja desperdícios de recursos e/ou atraso na consecução da meta. Distintamente, os programas de controle, além de não definirem qual a meta a ser alcançada, indicando apenas que se deve reduzir e manter as populações de vetores a "níveis aceitáveis", não são obrigatoriamente organizados dentro dos princípios e fundamentos acima referidos.55
Vigilância Epidemiológica
O principal objetivo da vigilância epidemiológica de uma doença é a detecção precoce de casos para indicar a adoção das medidas de controle capazes de impedir novas ocorrências. A única forma de prevenção do dengue é a drástica redução da população do mosquito transmissor (a zero, ou níveis muito próximos de zero) e, desse modo, as vigilâncias entomológica e epidemiológica devem ser indissociáveis e, idealmente, aliadas às ações de combate ao vetor do dengue. Portanto, estas atividades devem se constituir em um programa global em cada território, sob responsabilidade de uma única instituição, mesmo que operacionalizado por profissionais com distintos perfis de capacitação.
Como são bastante variadas as situações entomológicas e de ocorrência de casos e/ou circulação viral em cada local, particularmente no Brasil, para efeito de orientação das condutas de investigação epidemiológica e adoção de medidas de controle, após a notificação de caso(s) suspeitos e/ou confirmados de dengue, consideram-se as diferenças entre áreas: não infestadas; infestadas porém sem transmissão; no curso de epidemia; com transmissão endêmica; infestada com ou sem transmissão mas com maior risco de urbanização da febre amarela.58 Os propósitos da vigilância epidemiológica e dos programas de controle são definidos de acordo com esta estratificação e vão, desde o impedimento de introdução de circulação dos vírus do dengue em áreas indenes, até a simples redução do número de casos em áreas epidêmicas e endêmicas. Além disso, institui-se o acompanhamento dos vírus circulantes e monitoramento das formas clínicas graves.
Esta diversidade de situações, aliada ao pleomorfismo das apresentações epidemiológicas e clínicas do dengue, impõe uma vigilância ativa da doença em virtude da baixa sensibilidade da vigilância passiva. Várias são as maneiras de se implementar uma vigilância ativa sendo quatro os componentes fundamentais: notificação, busca ativa e investigação de casos; vigilância laboratorial; vigilância das formas clínicas; e vigilância entomológica. As dificuldades da vigilância iniciam-se desde a suspeita e/ou diagnóstico clínico - epidemiológico já que a forma clássica da doença pode ser clinicamente confundida com muitas doenças febris, exantemáticas ou não, e as formas hemorrágicas graves são ainda pouco conhecidas, para a maioria dos profissionais de saúde dos países americanos, o que leva à subnotificação e/ou diagnóstico de casos graves, só após o aparecimento de óbitos. Por outro lado, a não existência de terapia específica faz com que muitos pacientes não busquem atenção médica, principalmente, quando apresentam quadros leves. Deste modo, epidemias explosivas assim como a detecção dos sorotipos circulantes, em muitas situações só são diagnosticadas tardiamente.54,55,58,59
Neste sentido, o apoio laboratorial, tanto sorológico como o isolamento viral, é considerado pedra angular da vigilância ativa do dengue, em virtude da necessidade de confirmação diagnóstica, particularmente logo aos primeiros casos suspeitos em uma área indene, e, também para a determinação da extensão geográfica da circulação e identificação dos sorotipos presentes; e informar sobre a possibilidade de ocorrência de formas severas de acordo com os sorotipos circulantes.59 A coleta de material para isolamento viral e exames sorológicos deve ser feita de todos casos suspeitos de área indene, e em amostra de indivíduos com manifestações clínicas compatíveis com dengue, nas áreas onde já se estabeleceu a circulação.58
Além desta vigilância ativa que visa conferir maior sensibilidade ao sistema, tem-se buscado incluir estratégias alternativas que visam superar as deficiências dos sistemas. A vigilância especial de formas clínicas graves, particularmente nas áreas de circulação de mais de um sorotipo dos vírus, tem como propósito a emissão de "sinais de alerta", logo aos primeiros casos suspeitos, para instituição de terapêutica adequada e conseqüente redução da letalidade. Para facilitar a detecção das formas severas tem-se indicado a eleição de unidades de saúde sentinelas (básicas e hospitalares) ou redes de profissionais sentinelas, que são selecionados de acordo com o perfil de enfermidades que atendem (clínica geral, infecciosas, hematológicas, emergências, etc.), base geográfica, conveniência e cooperatividade.54 Para a detecção precoce de aumento de incidência em áreas endêmicas e introdução de um novo sorotipo, principalmente, em locais onde o sistema de notificação é deficiente, as unidades de saúde e/ou os profissionais sentinelas devem ser sensibilizados para solicitar os exames laboratoriais de um quantitativo de pacientes que apresentarem doenças febris. Para otimizar os recursos da rede de diagnóstico, recomenda-se articulação com os programas de eliminação de doenças febris exantemáticas, acrescentando-se ao rol de exames laboratoriais os de dengue, de acordo com rotina e critérios pré-definidos.54 Em áreas populosas onde a transmissão já se estabeleceu e a doença está se manifestando com baixa endemicidade, a estratégia de delimitação de "áreas sentinelas" para instituição de sistema de monitoramento especial de doenças febris agudas, com implantação de diagnóstico laboratorial, pode ser útil no acompanhamento das alterações de freqüência. Estes espaços servirão como "áreas de alerta" de modificações da situação epidemiológica do dengue.26,60 Nos países indenes, principalmente onde já se detectou a presença de vetores potenciais, têm sido implantados programas de vigilância de viajantes que apresentam enfermidades febris,54 visando à adoção de medidas que impeçam o estabelecimento da circulação viral.
Inquéritos soroepidemiológicos podem ser realizados no curso ou após as epidemias, com técnicas de detecção de IgM e/ou IgG. O desenho amostral deve ser feito de acordo com os objetivos do estudo, considerando-se a situação epidemiológica da área, no momento da coleta de material. Estes inquéritos fornecem informações mais acuradas de incidência (quando se usa teste para detecção de IgM) e de soroprevalência (IgG) que os dados de notificação de demanda espontânea, ou mesmo de busca ativa de casos; quantifica a ocorrência das infeçcões nos indivíduos na vigência de circulação de mais de um sorotipo dos vírus; identifica as áreas de maior intensidade de circulação, possibilitando o estudo dos fatores de risco associados às taxas de infeçcão. A determinação das taxas de soroprevalência das populações dimensionam a imunidade de grupo que, associadas a outros indicadores, podem ser utilizadas como parâmetro de avaliação da efetividade das atividades de controle desenvolvidas em cada região.25,26
Vacinas
A produção de uma vacina contra os quatro sorotipos do dengue, que seja segura e efetiva, tem sido apontada pela OMS como prioridade em face da gravidade da situação epidemiológica e a baixa efetividade da maioria dos programas de combate ao Ae. aegypti. Em 1984, foi criado um comitê específico com o objetivo de facilitar as investigações para o desenvolvimento de vacinas contra o dengue e a encefalite japonesa.2 Importantes fatores são limitantes deste objetivo, dentre os quais podem-se destacar: a existência de quatro diferentes sorotipos e o fenômeno da imunoamplificação viral, implicando a necessidade de se obter um imunógeno efetivo para todos os vírus simultaneamente; a presença de anticorpos nas populações onde um ou mais sorotipos já circulou; baixas produções de partículas virais após a passagem do agente em diferentes sistemas celulares; possibilidade de inversão da virulência quando se usa vírus atenuado; não se dispor de um modelo animal experimental que desenvolva as formas graves da doença, o que implica necessidade de se incorrer em riscos ao se utilizar voluntários humanos para a verificação definitiva de atenuação da cepa.2
Atualmente, existem vacinas candidatas convencionais ou de primeira geração, atenuadas ou inativadas; de segunda geração que incluem a expressão de proteínas recombinantes em diferentes sistemas; e as de terceira geração, que são as de DNA.61 No primeiro grupo têm-se monovalente de vírus vivo atenuado e tetravalente. Esta segunda está sendo considerada bastante promissora por: conter os quatro sorotipos dos vírus do dengue; já ter sido testada em ratos apresentando baixa neurovirulência, e em macacos Rhesus produzindo baixa viremia, com desenvolvimento de anticorpos neutralizantes sorotipos específicos; conferir imunidade por mais de cinco anos; ter níveis de viremia pós-vacinal baixos; apresentar soroconversão em humanos em torno de 95%; e manter os marcadores de atenuação depois de passar pelo homem e mosquito.62,63 As vacinas de proteína recombinante utilizam como modelo animal macacos cynomolgus (Macaca fascicularis) e é específica contra o DEN-2, cepa Jamaica 1409, preparada em Aedes pseudoscutellaris (AP61). Os estudos vêm demonstrando que esta vacina tem potencial, por induzir resposta humoral e celular. Embora ela só tenha sido testada em seis macacos, os dados apresentados mostram que este animal pode constituir um modelo experimental adequado.64 As de terceira geração são de material genético purificado e infere-se que seja possível a imunização com uma mescla de seqüências de DNA.65
As vacinas candidatas estão em diferentes estágios de desenvolvimento. Apesar das investigações serem bastante promissoras ainda não se tem nenhuma vacina disponível para uso em populações. Entretanto, a tetravalente de vírus vivo atenuado já está em fase avançada e deverá, em breve, entrar em fase III, o que abre alguma perspectiva de nos próximos anos dispor-se de uma vacina eficaz.
Efetividade das Intervenções
Quando o combate ao vetor é instituído após a introdução primária de um ou mais sorotipos do vírus do dengue, em grandes e populosos centros urbanos, as chances de se conseguir a interrupção da transmissão tornam-se reduzidas quando há elevada densidade de mosquitos, e as características climáticas favorecem a sua proliferação. Esta dificuldade ocorre ainda que se disponha de uma vigilância ativa da doença e o diagnóstico de casos seja feito precocemente. Mesmo que se reforcem as atividades de combate ao vetor, o tempo que decorre até a redução das populações de mosquito é muito maior que a velocidade de circulação viral, pois nestas situações a população de hospedeiros encontra-se quase que universalmente susceptível.66
Por outro lado, não procede a concepção de que a simples redução da população do Ae. aegypti pode impedir a ocorrência de casos, pois, tem-se observado que mesmo na vigência de baixa densidade vetorial (1 ou 2% de Índice de Infestação Predial), a transmissão dos vírus continua se processando se a população não for imune ao(s) sorotipo(s) circulante(s). Muitas das vezes, a redução da incidência em uma área tropical epidêmica ocorre "naturalmente", mais em função da imunidade de grupo que vai se estabelecendo do que pelos resultados obtidos com as ações de controle estabelecidas.51 Ou seja, quando a epidemia se instala, ela segue seu curso e as ações de combate vetorial mostram pouca ou nenhuma efetividade.66 Desta forma, a vigilância epidemiológica, mesmo quando ativa, não tem conseguido subsidiar as ações de controle para impedir a ocorrência e disseminação da doença. Exerce apenas as funções de coleta de informações para estimativa da magnitude e gravidade do evento e de organização da rede de serviços de saúde, para evitar a ocorrência de óbitos na vigência de casos de dengue hemorrágico.
A vigilância epidemiológica é mais efetiva e necessária nas áreas livres de circulação viral, ou que estão em fases interepidêmicas, pois nestas últimas, onde o risco de ocorrência de formas graves é muito alto, quando da introdução de um novo sorotipo, ações contínuas de combate visando à eliminação do vetor e à vigilância ativa da doença, não podem ser negligenciadas.
Desafios e Perspectivas
A prevenção das infecções causadas pelos vírus do dengue ainda é um desafio visto ser centrada na atuação sobre o único elo vulnerável da cadeia epidemiológica que é a eliminação do seu principal transmissor, o Ae. aegypti Esta envolve agressão ao meio ambiente pelo uso de inseticidas; investimentos substanciais em saneamento ambiental; necessidade de participação das comunidades com indução de modificações comportamentais; permissão da população para o tratamento químico de depósitos de água intra e peridomiciliares não elimináveis; atividades programáticas contínuas até a completa eliminação desta espécie de mosquito; manutenção de vigilância entomológica; e problemas inerentes à biologia do próprio vetor.
Mesmo com todas estas dificuldades, experiências vitoriosas de erradicação do Ae. aegypti foram conduzidas neste século, em vários países americanos em função das epidemias de febre amarela urbana, o que contribuiu significativamente para diminuir, ou mesmo impedir, a circulação dos vírus do dengue neste continente até a década de sessenta. Entretanto, a reinfestação de muitos destes países nos anos setenta não foi combatida com eficiência e, como as condições ambientais dos centros urbanos estavam mais favoráveis à proliferação do vetor, rapidamente ocorreu a sua dispersão por extensas áreas territoriais. A grande preocupação, até a década de sessenta, era apenas com a febre amarela urbana, que passou a dispor de uma potente vacina, pois, equivocadamente, o dengue era considerado uma doença benigna. Com a erradicação da febre amarela urbana, os programas de prevenção da sua forma silvestre centraram suas atividades na vacinação das populações residentes em áreas de risco, onde havia circulação viral, ou próximas a estas.
A vigilância entomológica do Ae. aegypti deixou de ser prioridade, a estrutura do programa de erradicação foi sendo paulatinamente desmontada, e as reinfestações das grandes cidades coincidiram com um momento de grandes restrições dos recursos destinados aos programas de Saúde Pública, tanto no Brasil como em grande parte dos países latino americanos. Esta limitação e a crença na benignidade do dengue fizeram com que a estratégia de erradicação dos programas de combate vetorial fosse substituída, em 1985, pela de controle.55
De acordo com a Organização Pan-America da Saúde (OPAS),55 o reconhecimento da impossibilidade de que todos os países adotassem uma estratégia de erradicação, e passassem a organizar programas de controle, constituía um avanço na política de prevenção do dengue. Entretanto, considera-se incorreta a concepção de que a redução da densidade vetorial, pressuposto básico dos programas de controle, diminui a incidência do dengue.51,66 Evidências desta má concepção podem ser constatadas nas sucessivas epidemias dos países americanos que mantêm programas de controle. Também em Singapura, cidade onde o programa de controle é considerado muito eficiente e vinha mantendo índices de infestação do Ae. aegypti abaixo de 3%, com o declínio da imunidade de grupo, epidemias de dengue voltaram a ocorrer.66,67 Fatos semelhantes a este têm sido registrado em cidades brasileiras.15
Mesmo os países que adotaram a estratégia de erradicação tiveram problemas nos últimos anos, sendo o exemplo mais marcante o de Cuba, que instituiu um forte programa de erradicação do vetor desde 1981, mantendo índices de infestação próximos a zero e livre de circulação viral por 15 anos. Em 1997, este país registrou uma epidemia em um centro urbano, logo após uma elevação da densidade populacional do Aedes aegypti.41 Assim, torna-se evidente a importância de se estabelecerem metas de redução da população vetorial, que devem ser permanentemente zero ou próxima a zero, para evitar a transmissão do dengue, pois índices superiores criam as condições necessárias à ocorrência de epidemias onde as populações não apresentam elevada imunidade de grupo para o vírus introduzido.
Existem grandes evidências de que as condições atuais e as perspectivas futuras das Américas e particularmente do Brasil favorecem a expansão e agravamento dos eventos relacionados com o dengue, visto estar se estabelecendo uma situação de hiperendemicidade, e a circulação de vários sorotipos aumenta a probabilidade de imunoamplificação.53 Grandes contingentes populacionais residentes em dezenas de centros urbanos brasileiros já possuem anticorpos contra os vírus DEN-1 e/ou DEN-2, e os índices de infestação pelo Ae. aegypti se mantêm elevados. Outros centros, onde ainda não se estabeleceu a circulação viral, estão expostos a infecções massivas em função das situações entomológicas que exibem. Por outro lado, o processo de globalização com os intercâmbios internacionais torna iminente a introdução dos outros dois sorotipos, que já estão circulando em países americanos. Ou seja, as condições epidemiológicas e entomológicas são muito favoráveis para a ocorrência das formas hemorrágicas destas infecções, mesmo considerando-se a baixa virulência da cepa do sorotipo DEN-2, que circula nas Américas.35
Como em outras regiões, a atual estratégia de combate ao vetor, no Brasil, não tem se demonstrado efetiva na maioria das áreas onde vem sendo implementada, e além disso muitos municípios infestados não estão sendo contemplados com recursos para o combate vetorial. Por outro lado, nas cidades onde os vírus circularam intensamente, está se recompondo a coorte de indivíduos susceptíveis, o que significa que as populações de lactentes estão expostas tanto às formas clínicas benignas, pela circulação endêmica dos vírus presentes, quanto às mais graves, em virtude da transmissão vertical de anticorpos contra um ou mais sorotipos dos vírus do dengue, o que favorece o fenômeno da imunoamplificação (ADE), na vigência de introdução de outro sorotipo ou de cepas mais virulentas das que já circulam.
A possibilidade do Ae. albopictus se tornar um transmissor destes vírus no continente americano, como o é no Sudeste Asiático, agrava a situação continental pela sua presença em amplas faixas territoriais de países indenes e livres do Ae. aegypti. O desenvolvimento e testagem de vacinas tetravalentes considerada por muitos como único instrumento capaz de modificar o grave curso da circulação dos vírus do dengue, apesar dos avanços das vacinas candidatas, ainda levará alguns anos para exibirem os requisitos para uso massivo.
Deste modo, tem-se que se debruçar na única alternativa de prevenção disponível que é o combate vetorial. A definição de estratégias técnicas e operacionais efetivas para sua utilização deve constituir prioridade dos governos dos países infestados. Tem-se que ter como pressuposto que ações de controle mal conduzidas devem ser abandonadas, por não produzir nenhum impacto epidemiológico, desperdiçar recursos, promover o desenvolvimento de resistência aos inseticidas, poluir o meio ambiente sem qualquer benefício para a população, além de abalar a credibilidade dos serviços de Saúde Pública.
O reduzido impacto das ações do programa de combate ao Ae. aegypti que vem sendo implementado desde a segunda metade da década de oitenta, nos países americanos e particularmente no nosso, evidenciado pela evolução da incidência da doença e mais ainda pelos resultados dos inquéritos sorológicos realizados em várias capitais brasileiras, indica a necessidade de os dirigentes dos órgãos governamentais refletirem sobre a pertinência da sua manutenção. Os recursos públicos que vêm sendo alocados para este combate, embora sejam insuficientes para o desenvolvimento de todas as atividades necessárias à erradicação, são de grande vulto, quando se considera o total do montante destinado aos programas de Saúde Pública. Os dados entomológicos apresentados e o curso e percurso das epidemias indicam o agravamento da situação (Figuras 5 e 8) e que, optando-se por manutenção desta estratégia, não se vislumbra qualquer perspectiva de controle das infecções, o que não justifica os dispêndios para este tipo de combate vetorial.
Embora seja objeto de grandes controvérsias a possibilidade de erradicação do Ae. aegypti,51,57 a comunidade científica brasileira, por convocação do Conselho Nacional de Saúde57 e um comitê de especialistas da OPAS,68 discutiu esta questão, considerando-a factível. As bases técnicas e científicas foram apresentadas culminando na elaboração do Plano Diretor de Erradicação do Ae. aegypti (PEA), para o Brasil.57 Este plano não vem sendo executado e, em substituição, foi implementada outra proposta,69 denominado PEAa, baseada na estratificação de risco dos municípios, que privilegia o repasse de recursos onde as condições epidemiológicas são mais graves, desconsiderando princípios e pressupostos básicos ao combate vetorial que são: a universalidade, a sincronicidade e a continuidade das ações.70 Além disso, não incorporou os três pilares propostos no plano de erradicação elaborado para o Brasil (saneamento ambiental, educação, informação e comunicação), estando centrado apenas no combate químico e eliminação de alguns criadouros dos mosquitos (saneamento domiciliar). O componente de educação, informação e comunicação também foi bastante restringido.
Na impossibilidade de implantar na totalidade as ações definidas no plano de erradicação de 1996, a revisão das bases da atual estratégia se impõe, com estabelecimento de metas regionais mínimas, que se aproximem da eliminação do vetor, respeitando-se os princípios das quatro fases de programas de combate vetorial e implantação de vigilância entomológica ativa em áreas geográficas livres do Ae. aegypti. Desta forma, utilizar-se-ão os conhecimentos técnicos - científicos que já estão bem estabelecidos e das experiências vitoriosas, atuais e passadas, tanto do Brasil como dos outros países.
Referências Bibliográficas
1. Halstead SB. Epidemiology of dengue and dengue hemorrhagic fever. In: Gubler DJ, Kuno G, Editors. Dengue and dengue hemorragic fever. New York: CAB International; 1997. p. 23-44.
2. World Health Organization–WHO. Global Programme for Vacines and Imunization Vaccine. Research & Development. 1996.
3. Martinez-Torres ME. Dengue hemorrágico em crianças: editorial. Havana: José Marti; 1990. 180 p.
4. Rodhain F, Rosen L. Mosquito vectors and dengue virus-vector relations ships. In: Gubler, DJ, Kuno, G. Editors. Dengue and dengue hemorragic fever. New York: CAB International; 1997. p. 45-60.
5. Silva AM, Dittus WPJ, Amerasinghe PH, Amerasinghe FP. Serologic evidence for an epizootic dengue virus infecting toque macaques (Macaca Sinica) at Polonnaruwa, Sri Lanka. American Journal Tropical Medicine Hygiene 1999; 60 (2): 300-306.
6. Dye C. The analysis of parasite transmission by bloodsuccking insects. Annual Review Entomology 1992; 37:1-19.
7. Herrera-Basto IE, Prevots DR, Zarate ML, Silva JL. First reported outbreak of classical dengue fever at 1700 meters above sea level in Guerrero State, Mexico, June, 1998. The American Society of Tropical Medicine and Hygiene 1992; 46 (6):649-653.
8. Scott WT, Clark GG, Lorenz LH, Amerasinghe PH, Reiter P, Edman J. Detection of multiple blood feeding in Aedes aegypti (Diptera: culicidae) during a single gonotrophic cycle using a histologique technique. Journal Medical Entomology 1993; 30 (1):94-99.
9. Jumali S, Gubler DJ, Nalim S, Eram S, Sulianti S. Epidemic dengue hemorragic fever in rural Indonésia. III. Entomological studies. American Journal of Tropical Medicine and Hygiene 1979; 28:717-724.
10. Metselaar D, Grainger CR, Oei KG, Reynalds DG, Pudlney M, Leake CJ e cols. An outbreak of type 2 dengue fever in the seychelles, probaly transmited by Aedes albopictus (Skuse). Bulletin of theWorld Health Organization 1980; 58: 937-943.
11. Ibánez-Bernal S, Briseno B, Mutebi JP, Argot E, Rodriguez G, Martinez- Campos C, Paz R, Roman PF, Tapia- Conyer R, Flisser A. First record in America of Aedes albopictus naturally infected with dengue virus during the 1995 outbreak at Reynosa, Mexico. Medical and Veterinary Entomology 1997; 11:305-309.
12. Gubler DJ. Dengue and dengue hemoragic fever: its history and resurgence as a global health problem. In: Gubler D.J., Kuno G., editors. Dengue and dengue hemorragic fever. New York: CAB International; 1997. p.1-22.
13. Rigau-Perez JG, Clark GG, Gubler DJ, Reiter P, Sanders EJ, Vorndam VA. Dengue and dengue haemorrhagic fever. Lancet 1998; 352 (9132):971-977.
14. Kouri GP, Guzman MG, Bravo J. Dengue hemorrágico en Cuba. Crônica de una epidemia. Boletin de la Oficina Sanitaria Panamericana 1986; 100 (3):322-329.
15. Donalisio MR de C. O enfrentamento de epidemias: as estratégias e perspectivas do controle do dengue [Tese de Doutorado]. Campinas: UNICAMP; 1995.
16. Gluber, DJ. Vigilancia activa del dengue y de la fiebre hemorragica del dengue. Boletin de la Oficina Sanitaria Panamericana 1989; 113 (2):22-30.
17. Kuno G. Review of the factors modulating dengue transmission. Epidemiologic Reviews 1995; 17:321-335.
18. Teixeira MG, Barreto ML. Porque devemos, de novo, erradicar o Aedes aegypti. Ciência & Saúde Coletiva 1996; 1:122-135.
19. Costa MCN, Teixeira MG. A concepção de "espaço" na investigação epidemiológica. Cadernos de Saúde Pública 1999; 15 (2):271-279.
20. Barreto ML, Carmo EH. Situação de saúde da população brasileira: tendências históricas, determinantes, e implicações para as políticas de saúde. Informe Epidemiológico do SUS 1994; III (3/4):7-34.
21. Paim JS. Abordagens teórico conceituais em estudo de condições de vida e saúde: algumas notas para reflexão e ação. In: Barata RB. Condições de vida e situação de saúde. Rio de Janeiro: ABRASCO; 1997. p.7-30.
22. Montesano-Castellanos R, Ruiz- Matus C. Vigilancia epidemiológica del dengue en Mexico. Salud Publica del Mexico 1995; 37:(Supl):64-76.
23. Cardoso R. O preconceito: a cidadania em sociedades multiculturais [on line] Disponível na Internet via www.justica.sp.gov.br/ Arquivo capturado em 1999.
24. Vasconcelos PFC, Lima JWO, Travassos da Rosa PA, Timbó MJ, Travassos da Rosa, ES, Lima HR, Rodrigues SG, Travassos da Rosa, JFS. Epidemia de dengue em Fortaleza, Ceará: inquérito soro-epidemiológico aleatório. Revista de Saúde Pública 1998; 32 (5):447- 454.
25. Vasconcelos PFC, Lima JW, Raposo ML, Rodrigues S.G, Travassos da Rosa, JFS, Amorim SMC, Travassos da Rosa ES, Moura CMP, Fonseca AN, Travassos da Rosa, PA. Inquérito soro-epidemiológico na Ilha de São Luís durante epidemia de dengue no Maranhão. Revista da Sociedade Brasileira de Medicina Tropical 1999; 32 (2):171-179.
26. Teixeira MG, Travassos da Rosa A, Vasconcelos P, Barreto ML. Diferenças intraurbanas na circulação dos vírus do dengue em uma grande cidade – Salvador/Bahia, 1998. Revista da Sociedade Brasileira de Medicina Tropical 1999; 32(Supl. 1):174.
27. Figueiredo LTM, Cavalcante SMB, Simões MC. Encuesta serológica sobre el dengue entre escolares de Rio de Janeiro, Brasil,1986 y 1987. Boletim de la Oficina Sanitaria Panamericana 1991; 111 (6):525-533.
28. Cunha RV. Estudo soro-epidemiológico sobre dengue em escolares do Município de Niterói, Rio de Janeiro, 1991 [Dissertação de Mestrado]. Rio de Janeiro: Instituto Oswaldo Cruz, Fundação Oswaldo Cruz; 1993.
29. Medronho AR. Geoprocessamento e saúde: uma nova abordagem do espaço no processo saúde doença. Rio de Janeiro: Fundação Oswaldo Cruz; 1995.
30. Halstead SB. Observations related to pathogenesis of dengue hemorrhagic fever. Yale Journal of Biology and Medicine 1970; 42:350-360.
31. Halstead SB. Dengue haemorragic fever. A public health problem and a field for research. Bulletin World Health Organization 1980; 58 (1):1- 21.
32. Halstead SB. The pathogenesis of dengue. Molecular Epidemiology in Infections Disease. American Journal of Epidemiology 1981; 114 (5):632-648.
33. Rosen L. La pathogenèse de la dengue hemorragique: discussion critique des hypothèses Actuelles. Bulletin Society of Pathology 1986; 79:342-349.
34. Rosen L.The emperor's new clothes revisited, or reflections on the pathogenesis of dengue hemorragic. The American Journal of Tropical Medicine and Hygiene 1977; 26(3):337-343.
35. Watts DM, Porter KR., Putvatana P, Vasquez B, Calampa C, Hayes CG, Halstead SB. Failure of secondary infection with American genotype dengue 2 to cause dengue haemorrhagic fever. Lancet 1999; 354 (9188):1431-1434.
36. Pang T. Dengue haemorrahagic fever: virus or host response? Bioessays 1987; 6 (3): 141-144.
37. Kouri GP, Guzman MG, Bravo J. Why dengue Haemorragic fever in Cuba? 2.An integral analysis. Transactions of the Royal Society of Tropical Medicine and Hygiene 1987; 81 (5):821-823.
38. Howe GM. A world geography of human diseases. New York: Academic Press; 1977. p. 302-317.
39. Halstead SB, Papavangelou G. Transmission of dengue 1 and 2 viruses in Greece in 1928. American Journal of Tropical and Hygiene 1980; 29 (4):635-637.
40. Pinheiro FP. Los programas de erradicacion y de control del Aedes aegypti en las Americas. OPS/HCP/ HCT/96.63, 1996.
41. Kouri GP, Guzmán MG, Valdés L, Rosário D, Vazquez S, Laferté J, Delgado J, Cabrera M. Remergence of dengue in Cuba: a 1997 epidemic in Santiago de Cuba. Emerging Infectious Diseases Disptaches. 1998; 4 (1): 89-92.
42. PAHO. Country reports to PAHO. Number of reported cases of dengue hemorragic fever, 1999.
43. Meira R. 'Urucubaca" Gripe ou dengue? Dengue. In:_____Clínica Médica. Gráfica. O Estado de São Paulo, 1916; 273-85.
44. Pedro A. O dengue em Nictheroy. Brazil-Médico 1923; 1:173-177.
45. Soares P. Etiologia Symptomatologia e Prophylaxia da dengue - a epidemia do aviso francês "Antarès" no porto da Bahia. Arquivo do Hospital de Isolamento em Mont'Serrat. Salvador-Bahia, 1928.
46. Causey OR, Theiler M. Virus antibody survey on sera of residents of the Amazon valley in Brazil. Revista Serviços Especiais de Saúde Pública 1962; 12 (1):91-101.
47. Osanai CH. A epidemia de Dengue em Boa Vista, território Federal de Roraima, 1981-1982 [Dissertação de Mestrado]. Rio de Janeiro: Escola Nacional de Saúde Pública; 1984.
48. Fundação Nacional de Saúde. Ministério da Saúde. Boletim Epidemiológico (in press). Brasília (DF); 1999.
49. Dina CL, Paula Pessoa ETF, Evangelista CM. Dengue hemorrágico, Ceará, 1994. In: Resumos do III Congresso Brasileiro de Epidemiologia, II Congresso Ibero- Americano, I Congresso Latino Americano - EPID95; Salvador, Bahia; Resumo 1023. 1995.
50. Fundação Nacional de Saúde. Ministério da Saúde. Informe de Dengue. Brasília (DF); 1999.
51. Reiter P, Gubler DJ. Surveillance and control of urban dengue vectors. In: Gubler DJ, Kuno G. Editors. Dengue and dengue hemorragic fever. New York: CAB International; 1997. p. 45-60.
52. Figueiredo LTM, Owa MA, Carlucci RH, Oliveira L. Encuesta serológica sobre el dengue em Ribeirão Preto, São Paulo, Brasil. Boletin de la Oficina Sanitaria Panamericana 1995; 118:499-509.
53. Gluber DJ, Clark GG. Community based integrate control of Aedes aegypti: a brief overview of currents programs. American Journal of Tropical Medicine and Hygiene 1994; 50 (6):50-60.
54. Rigau-Perez, Gubler DJ. Surveillance for dengue and dengue hemorrahagic fever In: Gubler DJ, Kuno G. Editors. Dengue and dengue hemorragic fever. New York: CAB International; 1997. p. 45-60.
55. Organização Panamericana de Saúde- OPS. Dengue y dengue hemorrágico en las Americas: guias para su prevención y control. Washington DC: OPS; 1995. (Publicación Científica, 548).
56. Fundação Nacional de Saúde. Ministério da Saúde. Instruções para pessoal de combate ao vetor: manual de normas técnicas. PEAa. Brasília (DF); 1997. 82 p.
57. Fundação Nacional de Saúde. Ministério da Saúde. Plano Diretor de Erradicação do Aedes aegypti do Brasil. Brasília (DF); 1996. 158 p.
58. Fundação Nacional de Saúde. Ministério da Saúde. Manual do dengue: vigilância epidemiológica e atenção ao doente. Brasília (DF); 1996. 82 p.
59. Clark GG. Situación epidemiologica del dengue en América: desafios para su vigilancia y control. Salud Publica del Mexico 1995; 37(Supl.):5-11.
60. Samaja J. Muestras y representatividad en vigilancia epidemiológica mediante sitios centinelas. Cadernos de Saúde Pública 1996; 12:309-319.
61. Guzman MG. Avances para la obtención deuna vacina contra el dengue. Acta Científica Venezuelana 1998; 49 (1):38-45.
62. Bhamarrapravati N. Dengue vaccine developement. Monograph on Dengue/DengueHaemorrhagic fever. New Delhi: WHO; 1993. Chapter 10. (Regional publications, SEARO# 22).
63. Bhamarapravati N, Yorksan S. Study of bivalent dengue vaccine in volunters. Lancet 1999; 1(8646): 1077.
64. Velzing J, Groen J, Drouet MT, Amerogen VG, Copra C, Osterhaus ADME, Deubel V. Induction of protective immunyti against Dengue virus type 2: comparasion of canidate attenuate and recombinant vaccines. Vaccine 1999; 17:1312-1320.
65. Schodel F, Aguado MT, Lambert, PH. Introduction: nucleic acid vaccines. Vaccine 1994; 12: 1491-1492.
66. Reiter P. Status of current Aedes aegypti control methodology. In: Halstead, SB, Hector Gomez-Dantes, editors. Dengue: a world problem a common strategy. Mexico: Ediciones Copilco, As de CV; 1992. p. 41-48.
67. Goh KT. Changing epidemiology of dengue in Singapore. Lancet 1995; 346(8982):1098.
68. Panamerican Health Organization- PAHO. Meeting of the Task Force to study the feasibility, timeliness and appropriateness of eradicating Aedes aegypti from the Americas. PAHO/ HCP/HCT/96.068. Rio de Janeiro: FIOCRUZ; 1996.
69. Fundação Nacional de Saúde. Ministério da Saúde. Plano Diretor de Erradicação do Aedes aegypti do Brasil ajustado. Brasília (DF); 1997.
70. Instituto de Saúde Saúde Coletiva/ Universidade Federal da Bahia. Projeto piloto para erradicação do Aedes aegypti- Salvador-Bahia. Salvador; 1996.
 Endereço para correspondência:
Endereço para correspondência:
Instituto de Saúde Coletiva/UFBA
Rua Padre Feijó, 29
Canela, Salvador/BA
CEP: 40.110-170
E-mail:magloria@ufba.br












 Curriculum ScienTI
Curriculum ScienTI
