Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Informe Epidemiológico do Sus
versão impressa ISSN 0104-1673
Inf. Epidemiol. Sus v.9 n.2 Brasília jun. 2000
http://dx.doi.org/10.5123/S0104-16732000000200005
Sistema de informações hospitalares fonte complementar na vigilância e monitoramento das doenças de transmissão vetorial
Hospital information system - complementary source for surveillance and monitoring of vector - borne diseases
Antônio da Cruz Gouveia Mendes; Paulette Cavalcanti de Albuquerque; Fábio Delgado Lessa; Rômulo Maciel Filho; Sidney Feitosa Farias; Tadzia Oliveira Montenegro
Departamento de Saúde Coletiva-NESC/CPqAM/FIOCRUZ
RESUMO
Este trabalho teve como objeto explorar as potencialidades do Sistema de Informações Hospitalares - SIH/SUS na vigilância epidemiológica e monitoramento de doenças de transmissão vetorial (dengue, leishmaniose e febre amarela). Foram utilizados dados de internações do SIH, do período de 1984 a 1998, e de notificação de casos do Centro Nacional de Epidemiologia-CENEPI, do período de 1980 a 1997. Os dados demonstram que houve ressurgimento da dengue em 1982, registrando-se até 1997 poucas internações, quando se elevou a freqüência dos internamentos nas Regiões Sudeste, Nordeste e Norte, indicando ocorrência de formas mais graves da doença. Já para a febre amarela, há incoerência entre os aspectos clínicos da doença e o grande número de internações registradas, sugerindo erro sistemático na informação hospitalar. Para a leishmaniose, observa-se coerência entre os dados do SIH e CENEPI, seguindo o caráter cíclico descrito para a doença. De forma geral, o SIH demonstrou qualidade como fonte complementar de informações na vigilância da dengue hemorrágica e leishmaniose, e apresentou problemas no monitoramento da febre amarela, sugerindo ajustes ao sistema.
Palavras-Chave: Sistemas de Informações Hospitalares, Doenças de Transmissão Vetorial, Vigilância Epidemiológica, Monitoramento.
SUMMARY
The objective of this paper was to explore the potentialities of the Hospital Information System - SIH/SUS for epidemiologic surveillance and monitoring of vector-borne diseases (dengue, leishmaniasis, and yellow fever). Hospital admittance data from the SIH, during the period from 1984 to 1998, and from the case reporting system of the National Center of Epidemiology – CENEPI, during the period from 1980 to 1997 were used. The data demonstrate that there was resurgence of dengue in 1982, with small amount of hospital admittances up to 1997. In the latter year the frequency of admittances increased, mainly in the Southeast, Northeast and North regions, indicating the occurrence of severe dengue cases. Already for yellow fever, incoherence between the clinical aspects of the disease and the large number of admittances reported was observed, suggesting systematic errors in the hospital information system. For leishmaniasis, coherence was observed between SIH and CENEPI data, which showed the recurrent character described for this disease. In a general way, SIH demonstrated quality as a complementary source of information for surveillance of hemorrhagic dengue and leishmaniasis however, problems were detected for monitoring yellow fever, suggesting the need for system adjustments.
Key Words: Hospital Information Systems; Vector-Borne Diseases; Epidemiologic Surveillance; Monitoring.
Introdução
A dengue, uma doença aguda de etiologia viral, apresenta duas formas de evolução: uma forma benigna, chamada de clássica, e uma forma grave, a hemorrágica. É transmitida pela picada do mosquito Aedes aegypti, vetor com ampla distribuição nas regiões tropicais e subtropicais do mundo, que possui hábitos domésticos, com habitat ligado a condições domiciliares e peridomiciliares. Identifica-se, hoje, a existência de quatro sorotipos para dengue: DEN 1, DEN 2, DEN 3 e DEN 4, além de possuírem várias cepas diferentes. Cada um destes sorotipos pode provocar a forma hemorrágica.1 A susceptibilidade do homem para doença é universal, embora a infecção pelo vírus provoque uma imunidade completa para o mesmo sorotipo, provavelmente pelo resto da vida.2
No período mais recente, a primeira epidemia de dengue hemorrágica ocorreu em Cuba, em 1981, que resultou, no período de três meses, em 344.203 notificações, gerando 116.151 internações das quais evoluíram para óbito 158 casos, dentre os 24.000 classificados como hemorrágicos.2
Embora ocorram mais formas benignas, a dengue é uma doença de importante implicação socioeconômica, pois, com incidência nos grandes centros urbanos, repercute em absenteísmo ao trabalho, redução da capacidade da força de trabalho, além de diminuir o fluxo turístico.3 Por outro lado, aumenta a demanda por serviços de saúde, exigindo uma importante quantidade de recursos financeiros. Durante epidemias de dengue hemorrágica, Prata e colaboradores advertem para o risco de haver colapso entre a demanda e oferta de serviços de saúde ante um quadro de emergência.4
No Brasil, há registro de dengue desde 1846: epidemia com duração de dois anos que atingiu o Rio Janeiro, São Paulo e Salvador, além de cidades de outros Estados. Há relatos de epidemias em 1851, 1853 e 1916 em São Paulo.5 Porém, é só entre 1981 e 1982 que ocorre a primeira epidemia de dengue com isolamento viral, sendo detectados os sorotipos DEN 1 e DEN 4, em Roraima.5,6
A partir de 1986, encontram-se registros de epidemias no Rio de Janeiro, Pernambuco, Alagoas e Ceará, verificando-se transmissão para os Estados de São Paulo, Minas Gerais e Bahia. Causadas pelo sorotipo DEN-1, as epidemias de caráter explosivo reduziam paulatinamente o universo de susceptíveis a este sorotipo, mas, diante do insucesso das medidas de combate adotadas, observou-se sua extensão para outros municípios.
Em 1990, identificou-se a circulação do sorotipo DEN-2, no Rio de Janeiro, quando simultaneamente passaram a ser registrados os primeiros casos de óbitos por dengue hemorrágica neste Estado. Em Fortaleza, ocorreram 25 casos em 1994, sendo 12 com evolução letal.6
Em 1996, excetuando-se o Amapá, todos os Estados do Brasil apresentaram municípios com casos de dengue, com predomínio da Região Nordeste. Neste mesmo ano, verificaram-se 63 casos de dengue hemorrágica no Rio de Janeiro, e seis casos em Pernambuco.
Atualmente identifica-se a transmissão de dengue em 20 Estados, estando em circulação os sorotipos 1 e 2 em 14 destes.7
A estratégia de erradicação continental do Aedes aegypti foi proposta pelo governo brasileiro, em 1947, no Conselho Diretor da Organização Panamericana de Saúde (OPS), como a única forma capaz de solução para o problema, já que não bastam medidas exclusivas em apenas um país. Mesmo com a proposta aprovada, nos anos 60, somente 18 países atingiram o objetivo, ficando a Venezuela, Ilhas Antilhas e o sul dos Estados Unidos sem erradicar a doença, favorecendo a sua reintrodução no cenário das Américas.2
O programa brasileiro, o PEAa (Programa de Erradicação do Aedes aegypti - Versão 1997), embora seja um programa direcionado ao controle químico, físico e biológico dos vetores, reduzindo os níveis de infestação para patamares mais baixos, prevê também outros componentes de ação integrada como saneamento básico, informação, educação e comunicação social. Outra medida relevante é o uso de um sistema de vigilância ativa, visando à detecção precoce de epidemias.8
A febre amarela é uma doença infecciosa aguda de natureza viral. Tem como agente etiológico o vírus amarílico, sendo seu reservatório o homem quando se trata da forma urbana, sendo os outros primatas reservatórios e hospedeiros vertebrados para a febre amarela silvestre. No ciclo urbano desta patologia são vetores potenciais o Aedes aegypti e o Aedes albopictus, embora não haja registro de transmissão por este último, no Brasil. Os mosquitos dos gêneros Haemagogus e Sabethes são os principais transmissores da febre amarela silvestre na América Latina, com destaque para o Haemagogus janthinomys, no Brasil7. O homem contrai a doença quando picado pelo vetor, caso não esteja imunizado3. A doença pode levar ao óbito em aproximadamente uma semana, tendo como manifestações clínicas a insuficiência hepática e a renal.7 São medidas de controle para a doença: vacinação, educação sanitária e vigilância epidemiológica.5
A febre amarela consta da lista de doenças de notificação internacional.2 A doença é endêmica nas regiões tropicais das Américas e da África. No Brasil sua presença é referida desde 1685, onde é registrada a primeira epidemia no estado de Pernambuco.
Os últimos casos notificados de febre amarela urbana datam de 1942, sendo desde então considerada erradicada nos centros urbanos. Entretanto, para a febre amarela silvestre identificam-se como zonas endêmicas as áreas rurais das regiões Norte, Centro-Oeste e Nordeste (pré-amazônica do Maranhão).
A leishmaniose visceral, também conhecida como calazar, é uma zoonose que acomete o homem e outros animais. Trata-se de uma doença crônica sistêmica, com período de incubação que varia de dez dias a um ano. Na sua sintomatologia, há febre de longa duração, além de outras manifestações como: astenia, adinamia, anorexia, perda de peso, caquexia, hepatoesplenomegalia. A susceptibilidade humana para esta patologia é universal, embora apresente maior incidência em crianças. A doença, quando não tratada, pode evoluir a óbito, no período de um ou dois anos, após o aparecimento dos sintomas.2
A doença é causada pela Leishmania chagasi, protozoário da família tripanosomatidae, que é transmitida através da picada do mosquito flebótomo Lutzomia longipalpis. São reservatórios do parasita o cão e a raposa.9
O comportamento epidemiológico da leishmaniose visceral é caracterizado por ciclos com picos epidêmicos a cada dez anos.10,11 Identifica-se que a manutenção de níveis endêmicos em algumas áreas está condicionada a baixos padrões de qualidade de vida.6
Um elemento que cria obstáculos à intervenção nos casos de leishmaniose visceral é a demora no diagnóstico, até mesmo em áreas endêmicas. Este aspecto eleva a letalidade da doença. Atividades de educação em saúde, com ampla participação da comunidade, são de fundamental importância ao programa de controle da leishmaniose visceral, além de orientações para o diagnóstico precoce e tratamento da doença, e adoção de medidas que visem a uma melhoria nos níveis de saúde.6
Além do diagnóstico precoce em humanos, torna-se uma medida importante a eliminação de cães infectados, já que não existe o tratamento eficaz para esta espécie, sendo também usual a aplicação de inseticidas residuais no domicílio.6
Questões Metodológicas Específicas
Os dados sobre internamentos registrados no SIH, no período de 1984 a 1992, encontram-se agregados segundo o diagnóstico da CID-9. Só a partir de 1993, foi possível trabalhar com o diagnóstico mais específico ou desagregado, como também através dos procedimentos realizados. Neste sentido, para as patologias de dengue e febre amarela, utilizou-se o diagnóstico referente a toda a série histórica. Note-se que, para dengue, as informações no banco de dados só estão disponíveis a partir de 1991, o que restringiu a descrição das internações ao período de 1991 a 1998.
Para a leishmaniose visceral (calazar), consideraram-se os procedimentos realizados referentes às internações totais por leishmanioses. Mesmo com a disponibilidade do diagnóstico específico a partir de 1993, identificou-se que a grande maioria das internações é registrada como leishmaniose não especificada, variando entre 52,68% (1994) e 73,97% (1996) do total de internações por leishmanioses. No entanto, sabe-se que a leishmaniose visceral, ao contrário da forma tegumentar, é geradora de grande número de internações. Desse modo, o total de internações reflete melhor a realidade epidemiológica da leishmaniose visceral, embora aí esteja inserida uma pequena proporção de leishmaniose cutânea (máximo de 15% das internações do país).
Os dados de notificação, fornecidos pelo CENEPI, apresentam registros nas três patologias, no período de 1980 a 1997.
Resultados
A distribuição de freqüência de casos notificados/internados de febre amarela e leishmaniose visceral nas Regiões Norte e Nordeste reflete os problemas resultantes da ocupação do espaço urbano desordenado e de precariedade das condições de vida. Especialmente para a leishmaniose visceral, assinalam-se as conseqüências de um processo econômico onde a exploração agressiva e nociva ao ambiente natural implica a urbanização da doença, já que o vetor adapta-se a áreas domiciliares e peridomiciliares, colaborando no ciclo de sua transmissão. Entretanto, observa-se uma redução no número de casos em ambas patologias, apesar de algumas controvérsias observadas nos sistemas, especialmente no caso da febre amarela, onde se verificaram importantes limitações do SIH como sistema complementar para vigilância epidemiológica.
Com relação à dengue, vale ressaltar que a doença é reintroduzida no Brasil como importante problema de saúde pública no início da década de 80, expandindo-se para vários municípios, e causando uma epidemia na Região Sudeste, em 1991, com o surgimento dos primeiros casos de dengue hemorrágica. Verifica-se que o Nordeste, a partir de 1996, passa a concentrar o maior número de internações e que o Norte, desde 1997, ocupa o segundo lugar entre as Regiões com maior número de internações.
Dengue
A Figura 1 apresenta o comportamento da dengue nos dois Sistemas de Informações. Nos dados referente às notificações (CENEPI), a dengue ressurge no Brasil em 1982 com 12.000 casos notificados (epidemia no estado de Roraima). Em 1986-1987, apresenta nova epidemia no país com 47.370 e 89.394 casos, respectivamente, atingindo as Regiões Sudeste e Nordeste. Desde então, a doença permanece no território nacional de forma expansiva e com uma tendência crescente. Quanto aos registros do SIH, note-se que o diagnóstico de dengue só é admitido em 1991. Desde então, observa-se um momento epidêmico em 1991, e, a partir de 1996, a patologia apresenta uma tendência crescente, gerando 6.338 internações em 1998. Conforme o esperado, devido ao comportamento da doença na sua forma clássica, observam-se que as internações são bastante inferiores aos casos notificados.
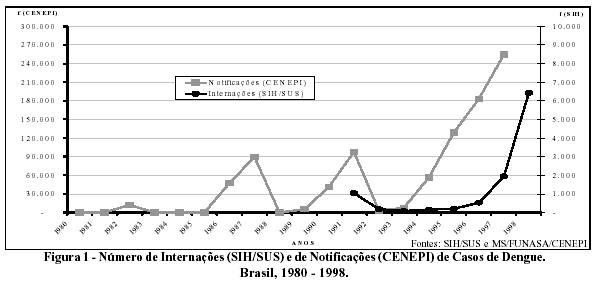
Na Tabela 1, verifica-se que a Região Sudeste foi responsável por 64,47% das internações do país em 1993, sendo o Rio de Janeiro responsável por 38,16% das internações nacionais. Em 1994, o Nordeste produziu 60,71% das internações por dengue, e, a partir de 1996, mantém-se na liderança das internações do país com percentuais superiores a 70%. Vale salientar que em 1997 a Região Norte passou a ocupar o segundo lugar em registros de internações, demonstrando a expansão da doença no Brasil. No período 1993-1998, os estados com destaque nacional em número de internações são: Bahia, Pernambuco, Rio Grande do Norte e Pará.
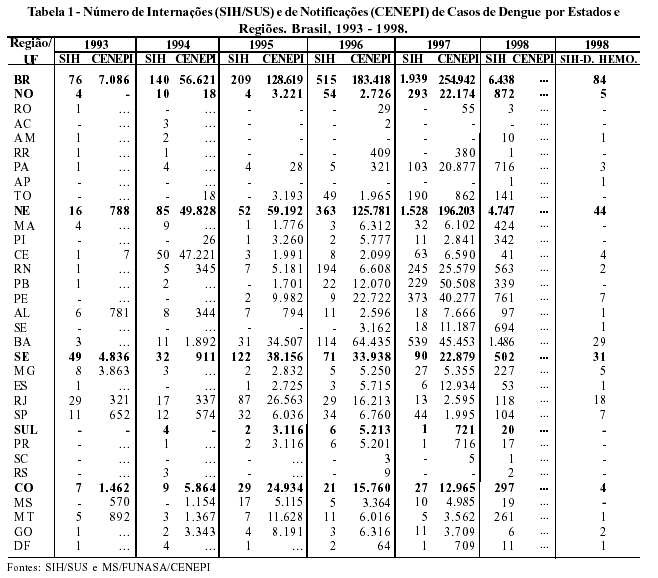
Ainda com relação às internações, observaram-se, em 1998, 84 internações por dengue em sua forma hemorrágica. Estas internações distribuíram-se em todas as Regiões do país, exceto na Região Sul, e localizaram-se fundamentalmente na Bahia e Rio de Janeiro, com 29 e 18 internações, respectivamente. Vale ressaltar que o SIH utilizou a CID-9 até 1997, em que a forma hemorrágica não estava no subgrupo dengue (061) e sim nas febres hemorrágicas transmitida por artrópodes (065.4). A partir de 1998, é adotada pelo sistema a CID-10, onde a patologia é colocada como diagnóstico principal, dengue hemorrágica (A91), o que possibilitará um melhor acompanhamento dos casos.
Quanto aos registros do CENEPI, observa-se uma distribuição espacial dos casos de dengue bastante semelhante àquela descrita para as internações (SIH) ocorridas nas regiões e estados do país (Tabela 1).
Os coeficientes de internação apresentam tendência de crescimento progressivo no período de 1993 a 1998, passando de 0,05 para 3,98 internações por 100.000 habitantes. Entre as Regiões, destacam-se o Nordeste seguido do Sudeste, acometendo todos os Estados do país. A mesma tendência é observada no coeficiente de notificação que passa de 4,68, em 1993, para 159,70 por 100.000 habitantes, em 1997 (Tabela 2).
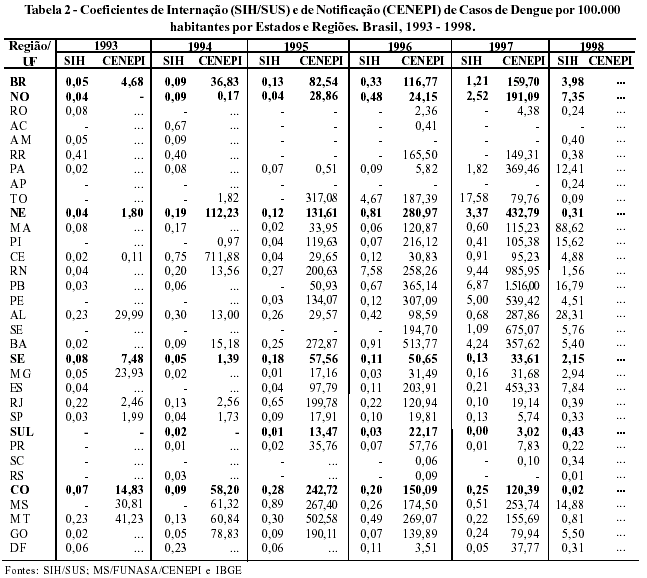
A razão entre internações e o número de casos notificados passou de 1/1.000, em 1995, para 11/1.000, em 1998, refletindo o aumento da gravidade da doença, com maiores suspeitas de casos de dengue hemorrágica.
Febre Amarela
A Figura 2 apresenta os dados de febre amarela produzidos pelo SIH e CENEPI. Observa-se nas duas fontes de informações, uma tendência acíclica no período de 1984 a 1998, chamando a atenção para o grande número de internações em relação às notificações, exceto em 1993, quando ocorre um incremento de casos notificados (CENEPI).
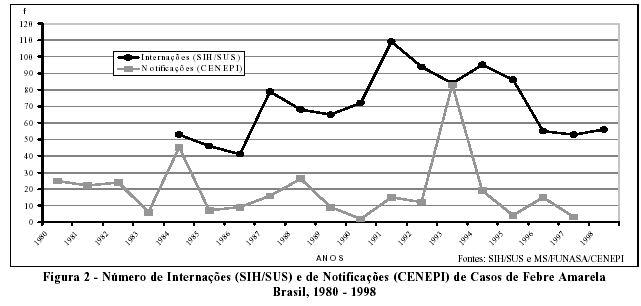
Na Tabela 3, os dados do CENEPI mostram um número pequeno de notificações (22 casos), no período de 1995 a 1997, concentrados na Região Norte. Destoando do número de notificações, as internações por febre amarela, além de apresentarem, um número muito superior, distribuem-se por todas as Regiões do país. Percebem-se, no período analisado, alguns casos nos Estados do Maranhão e Minas Gerais, consideradas áreas de risco pelo Ministério da Saúde. Tais achados geram preocupação, pois aumenta o risco para transmissão da doença em outras regiões, já que o vetor Aedes aegypti encontra-se difundido em todos os Estados do país.
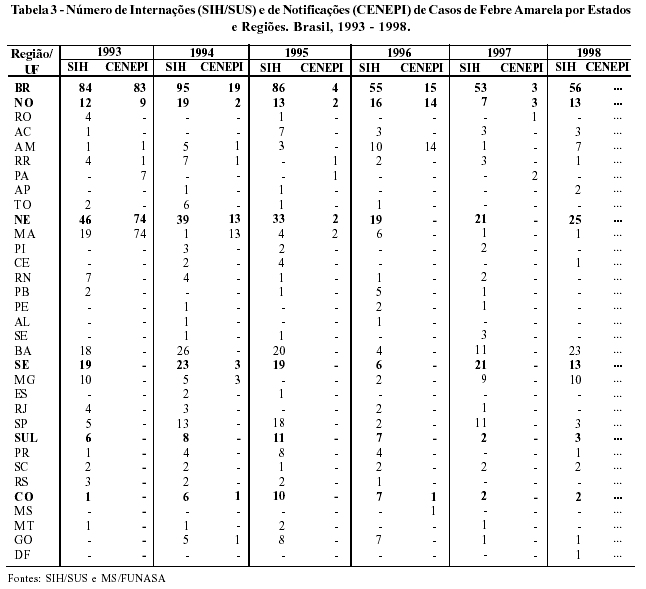
Se consistentes, os registros de internações por Estado e Região no SIH sugerem que residentes no Norte e Centro-Oeste, acometidos nos Estados de origem, tenham migrado para se hospitalizarem em outros Estados. Os resultados poderiam apontar também para casos autóctones que, embora residentes de Estados não endêmicos, infectar-se-iam no Norte e Centro-Oeste, sendo hospitalizados nos Estados de residência. Uma outra hipótese consiste no erro sistemático no preenchimento da autorização de internação hospitalar, invalidando seu uso para vigilância e monitorização. Os aspectos clínicos da doença, levando à agudização do quadro, parecem validar esta última hipótese.
Do ponto de vista do risco de transmissão, a Região Norte apresentou maiores coeficientes de notificações no período de 1993 a 1997, em média 0,05 por 100.000 habitantes (Tabela 4).
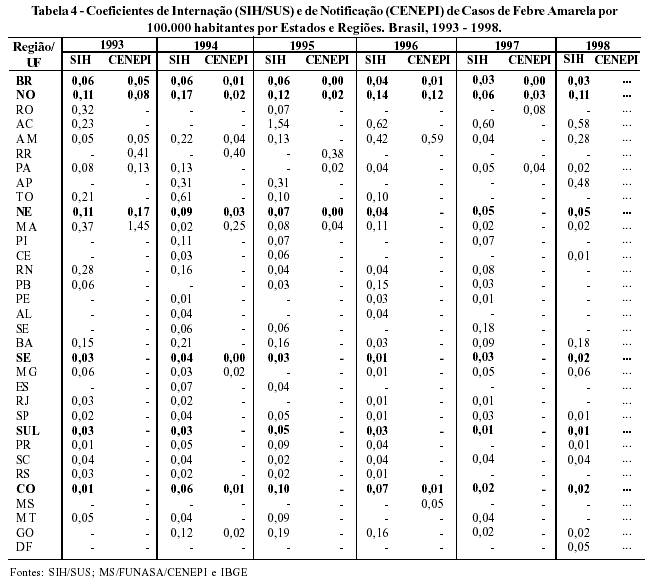
A razão de internação/notificação (SIH/CENEPI) demonstrou uma variação, de 1,01 (1993) a 17,66 (1997), sugerindo uma subnotificação do CENEPI ou registro de falsos positivos no SIH.
Leishmaniose Visceral
Notificada em 17 dos 27 Estados brasileiros, nas Regiões Nordeste, Sudeste, Norte e Centro-Oeste a leishmaniose visceral é uma doença em expansão geográfica, inclusive nas áreas urbanas.7,12
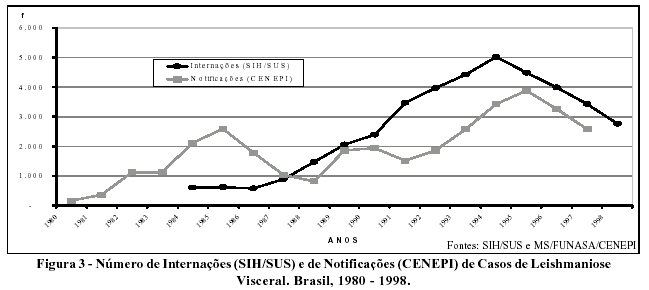
No SIH, a leishmaniose visceral apresenta uma tendência crescente até 1994, chegando a 5.000 internações. Nos anos subseqüentes (1995 a 1998), ocorre uma inversão nesta tendência. Nos registros de notificação do CENEPI, no período de 1980 a 1997, percebem-se dois ciclos com picos epidêmicos em 1985 e 1995, apresentando uma tendência crescente no período, com 3.885 casos em 1995. Este comportamento cíclico da doença corrobora a literatura10,11 (Figura 3).
Na Tabela 5, verifica-se que os Estados com as maiores internações estão concentrados no Nordeste (Bahia, Piauí, Ceará e Pernambuco). Estes achados também são observados nos registros de notificação do CENEPI, embora os dados de internações do SIH apresentem-se superiores ao número de casos notificados, sendo registradas também internações em Estados, sem notificação. Tal fato sugere uma subnotificação pelo CENEPI, embora os dados do SIH contenham as internações por leishmaniose tegumentar e algumas reinternações. Mesmo assim, os dados de internações podem ser utilizados como eventos sentinelas para investigar a expansão geográfica da doença no país.
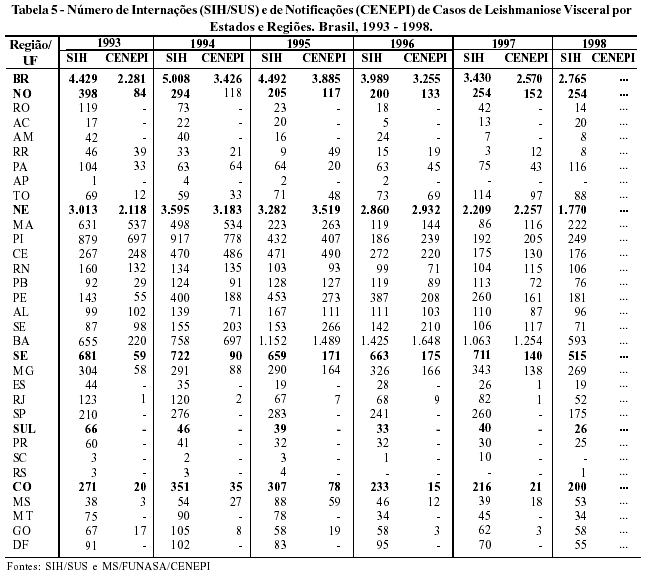
Do ponto de vista do risco de transmissão (Tabela 6), o coeficiente de internação hospitalar por leishmaniose visceral, no Brasil, apresentou uma tendência à redução de 1994 a 1998, caindo de 3,26 para 1,71 internações por 100.000 habitantes. Contudo, quando descrito por Região, o Nordeste apresentou maior coeficiente médio no período 1993-1998, com 6,22 por 100.000 habitantes, seguido do Centro-Oeste (2,53) e do Norte (2,38). Quanto aos Estados, o Piauí deteve maior coeficiente (17,67), seguido do Tocantins (7,64); Roraima (7,51) e Bahia, com 7,48 internações por 100.000 habitantes no referido período.
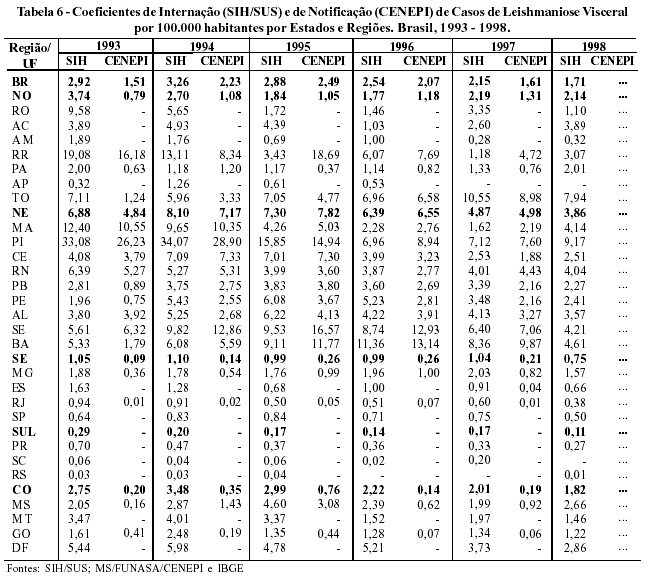
Quanto aos coeficientes de casos notificados por leishmaniose visceral, registrados pelo CENEPI, o país apresentou uma média de 1,98 casos por 100.000 habitantes no período 1993 - 1997. Neste período, o Nordeste apresentou um coeficiente médio de 6,27, seguido do Norte (1,09) e Centro-Oeste (0,33). Entre os Estados, os maiores destaques são: Piauí (17,30); Sergipe (11,15); Roraima (11,14); e Bahia com 8,47 casos por 100.000 habitantes. Observa-se uma grande semelhança entre as Regiões e Estados com maiores destaques nos dois sistemas (internação / notificação), embora com o número de internações sempre superior aos casos notificados (Tabela 6).
Neste sentido, ainda comparando os dos dois sistemas de informações, percebe-se que a razão entre SIH/CENEPI apresenta pouca variação no período de 1993 a 1997 (1,16 a 1,72 internações para cada caso notificado, respectivamente). Portanto, o SIH se configura como um bom sistema, podendo ser utilizado de forma complementar para a vigilância e o monitoramento de casos de leishmaniose visceral.
Comentários Finais
Há uma tendência de crescimento de internações por dengue no país, destacando-se nos últimos dois anos a Região Nordeste.
O comportamento das internações por dengue, no período de 1991 a 1997, explicita o deslocamento da doença nas Regiões do país, iniciada no Sudeste, dirigindo-se para o Nordeste, sugerindo uma tendência de multiplicação dos casos no Norte, a partir de 1997.
O SIH poderá ser um bom instrumento de vigilância e monitorização da dengue hemorrágica; primeiro, admitindo-se que uma maior razão entre as internações e os casos detectados implicariam uma maior investigação deste tipo de dengue; segundo, com a adoção do CID-10 a partir de 1998, em que há uma maior especificidade para a dengue hemorrágica, o que não ocorre nas notificações compulsórias, que ainda usam o CID-9.
No caso da febre amarela, o SIH apresenta limites para ser usado como sistema de informação complementar para vigilância e monitorização, devendo ser melhorado quanto ao preenchimento do diagnóstico.
Para leishmaniose visceral, o SIH constitui um importante sistema de informação complementar ao CENEPI.
Referências bibliográficas
1. Pontes RJS, Netto AR. Dengue em localidade urbana da Região Sudeste do Brasil: aspectos epidemiológicos. Revista de Saúde Pública 1994; 28(3) : 218-227.
2. Costa NR. Lutas urbanas e controle sanitário: origens das políticas de saúde no Brasil. Petrópolis: Vozes; Rio de Janeiro: Associação Brasileira de Pós-graduação em Saúde; 1986.
3. Nobre A, Antezana D, Tauil PL. Febre Amarela e Dengue no Brasil: epidemiologia e Controle. Revista da Sociedade Brasileira de Medicina Tropical 1994; 27 (Supl. 3) : 59-66.
4. Prata A, Rosa APAT, Teixeira G, Coelho ICB, Neto JT, Dias J, Figueiredo LTM, dietze R, Valls R, Maris S, Alecrim W. Condutas Terapêuticas e de Suporte no Paciente de Dengue Hemorrágico. Informe Epidemiológico do SUS 1997; VI(2) : 87-101.
5. Sabroza PC, Kawa H, Campos WSQ. Doenças transmissíveis: ainda um desafio. In.: Minayo MCS (Org). Os muitos Brasis: saúde e população na década de 80. São Paulo: Hucitec; Rio de Janeiro: ABRASCO; 1995. p. 177-244.
6. Braga JCS, Paula SG. Saúde e Previdência: estudos de Política Social, 2 ed. São Paulo: HUCITEC, 1986.
7. Fundação Nacional de Saúde. Guia Brasileiro de Vigilância Epidemiológica. 5. ed. rev. e ampl. Brasília: Ministério da Saúde/ Fundação Nacional de Saúde; 1998.
8. Fundação Nacional da Saúde. Programa de Erradicação do Aedes aegypti: roteiro para elaboração dos planos municipais - versão preliminar. Brasília: Ministério da Saúde/Fundação Nacional de Saúde; 1997.
9. Braga MDM, Coelho ICB, Pompeu MMl, Evans TG, MacAullife IT, Teixeira MJ, Lima JWO. Controle do calazar canino: comparação dos resultados de um programa de eliminação rápida de cães sororreagentes por ensaio imunoenzimático com outro de eliminação tardia de cães sororreagentes por teste de imunofluorescência indireta de eluato de papel filtro. Revista da Sociedade Brasileira de Medicina Tropical 1998; 31(5) : 419-424.
10. Costa CHN, Pereira HF, Araújo MV. Epidemia de leishmaniose visceral no estado do Piauí, 1980-1986. Revista de Saúde Pública 1990; 24(5) : 361-372.
11. Sherlock IA. Ecological Interactions of visceral leishmaniasis in state of Bahia, Brazil. Memórias do Instituto Oswaldo Cruz 1996; 91(6) : 671-683.
12. Cesse E. Expansão urbana da leishmaniose visceral: estudo epidemiológico do processo de transmissão ativa em área urbana, Petrolina/Penambuco, 1992-1997 [dissertação]. Recife (PE): Nesc/CPqAM/Fiocruz; 1999.
 Endereço para correspondência
Endereço para correspondência
Depto de Saúde Coletiva - NESC / Centro de Pesquisas Aggeu Magalhães / FIOCRUZ
Rua dos Coelhos, 450, 1o andar
Coelhos - Recife/PE
CEP: 50.070-550
e-mail:nesc@cpqam.fiocruz.br













