Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.13 n.2 Brasília jun. 2004
http://dx.doi.org/10.5123/S1679-49742004000200005
Estudos de utilização de medicamentos – considerações técnicas sobre coleta e análise de dados
Drug utilization studies – technical considerations for data collection and analysis
Suely Rozenfeld; Joaquim Valente;
Departamento de Epidemiologia e Métodos Quantitativos em Saúde, Escola Nacional de Saúde Pública/Fundação Oswaldo Cruz, Rio de Janeiro-RJ
RESUMO
A presente nota técnica trata das estratégias de coleta e análise das informações sobre medicamentos nos estudos epidemiológicos, particularmente nos estudos transversais. São focalizados aspectos relacionados à qualidade da informação sobre os medicamentos e à preparação do banco de dados. São apresentados os comandos de um programa, para o Epi-Info, que permite ";verticalizar"; o banco de dados.
Palavras-chave: estudos de utilização de medicamentos; estudos transversais; Epi-Info.
SUMMARY
This technical note deals with strategies for data collection and analysis of drug information from epidemiological studies, in particular cross-sectional studies. The focus is on aspects concerning the quality of information of medicines, and on how to prepare data banks for data analysis. We also present Epi-Info software commands, which allow one to "verticalize" databases.
Key words: drug utilization studies; cross-sectional; Epi-Info.
Os delineamentos epidemiológicos
A escolha do delineamento epidemiológico apropriado à avaliação da eficácia e da segurança dos medicamentos depende dos objetivos do estudo.
Os ensaios clínicos controlados (experimentais) são ideais para avaliar a probabilidade de um medicamento, quando comparado a outro ou a placebo, curar doenças ou aliviar sintomas; porém, são limitados para identificar e quantificar as reações adversas.
Os estudos de coortes são úteis para avaliar as reações adversas freqüentes, com tempo de latência curto, e os estudos de casos-controle para as reações raras, com tempo de latência prolongado. Esses delineamentos (observacionais) são realizados durante o período de consumo do produto por amplos contingentes populacionais, e o seu foco costuma ser a segurança, ou seja, a magnitude, a gravidade e os fatores associados às reações adversas.
A Figura 1 apresenta o diagrama lógico dos estudos epidemiológicos. Seleciona-se um par, composto por uma classe ou subclasse terapêutica, ou um princípio ativo (exposição) – substância com ação farmacológica – e um problema de saúde a ele relacionado (desfecho; efeito benéfico ou adverso). Isso permite estimar a associação entre os medicamentos e as "doenças" (síndromes, sintomas, acidentes, efeitos adversos, parâmetros biológicos, etc.). Por exemplo, estuda-se o efeito dos hormônios femininos sobre a perda óssea, dos anti-hipertensivos sobre a diminuição da pressão arterial, dos antineoplásicos sobre a qualidade de vida dos pacientes, dos antiinflamatórios não esteróides sobre o desenvolvimento de patologia gástrica.
Entre os estudos observacionais, destacam-se os transversais ou seccionais, realizados por meio de inquéritos, empregados para levantar hipóteses e testar associações. Segundo a definição de Rothman e Greenland,1 "A study that includes as subjects all persons in the population at the time of ascertainment or a representative sample of all such persons, including those who have the disease, and that has an objective limited to describing the population at the time, is usually referred to as a cross-sectional study" (Um estudo que inclui como sujeitos todos os indivíduos de uma população no momento da captação da informação ou uma amostra representativa da mesma população, incluindo os que têm a doença, e cujo objetivo se limita a descrever a população em um certo momento, é conhecido como estudo transversal). Nos estudos transversais ou seccionais, a captação da informação sobre todas as variáveis (de exposição, de desfecho e os confundimentos) é simultânea. Eles são econômicos, pois permitem investigar inúmeras variáveis, ao mesmo tempo, e possibilitam comparar subgrupos. A sua maior limitação é a ausência de garantias sobre a relação temporal entre as exposições e os desfechos. Tal limitação é, em parte, compensada pela replicação das estimativas nos sucessivos estudos, o que fortalece a validade dos resultados. Segundo Babbie,2 "el minucioso informe de la metodología de una encuesta dada promove la duplicación posterior, por otros investigadores y/o entre outras muestras y subgrupos. De esta manera, se puede poner a prueba una y outra vez la generalización de los descubrimientos" (a informação detalhada da metodologia de um determinado inquérito favorece a duplicação posterior, por outros investigadores e/ou entre outras amostras e subgrupos. Dessa maneira, é possível testar, mais de uma vez, a generalização dos achados).
A Figura 2 apresenta o diagrama lógico dos estudos transversais ou seccionais. Neles, os aspectos sociais, econômicos, demográficos, de doença, de hábitos de vida e outros são as variáveis independentes, preditivas do uso de medicamentos, sendo esta a variável dependente, isto é, o desfecho. Os estudos transversais ou seccionais permitem caracterizar as especialidades farmacêuticas (EF) – cada marca com os seus respectivos princípios ativos, apresentação e forma farmacêutica –, os usuários, as associações entre ambos, e identificar subgrupos vulneráveis e riscos potenciais.
A presente nota técnica trata das estratégias de coleta e análise das informações nos estudos transversais ou seccionais que envolvem o estudo das EF. Embora voltadas para esse delineamento, algumas observações aplicam-se aos demais desenhos.
Os estudos tranversais ou seccionais
Esses estudos fornecem informações sobre os medicamentos consumidos, quem os consome, como e para qual finalidade. Os resultados são úteis para o planejamento das políticas de assistência farmacêutica e de regulação sanitária (registro e fiscalização), e para promover o uso racional de EF. Permitem identificar os grupos populacionais vulneráveis ao uso irracional e as classes terapêuticas empregadas de modo inadequado, seja como resultado dos apelos da propaganda dos fabricantes, dos erros na posologia, da negligência quanto às contra-indicações e precauções, ou outras causas.
Os estudos transversais ou seccionais têm como "grande vantagem ... a capacidade de inferência dos resultados observados para uma população definida no tempo e no espaço, uma possibilidade muitas vezes remota em estudos que se utilizaram de outras estratégias de estudo epidemiológico".3 Assim, graças à sua aplicabilidade no campo dos medicamentos, os estudos transversais ou seccionais com amostras populacionais permitem, por exemplo, elaborar planos de fomento do uso racional da totalidade das classes terapêuticas, para o conjunto da população. Essa característica deve-se ao aumento da sua eficiência, na razão direta da abrangência da informação coletada sobre as EF utilizadas. Os estudos transversais ou seccionais podem, também, revelar associações entre os fármacos e os seus efeitos indesejáveis, a serem testadas em estudos de coortes e de casos-controle.
No Brasil, os estudos transversais ou seccionais têm focalizado o uso de medicamentos sob diversos ângulos,4-6 em grupos terapêuticos7 ou faixas etárias específicas.8,9
Nos próximos tópicos, serão abordados aspectos do desenho, da coleta e da análise nos inquéritos que contemplam informações sobre os medicamentos.
Acurácia da informação sobre o uso de medicamentos
No Brasil, ao contrário de outros países, não há informações sobre o consumo de medicamentos geradas a partir de bancos de dados de abrangência nacional. Por isso, é preciso lançar mão de prontuários, fichas clínicas ou informações coletadas ad hoc. Em qualquer dos casos, é preciso rigor e objetividade para garantir a acurácia da informação e a manutenção de padrões de qualidade nas etapas que precedem a preparação dos bancos de dados para análise. Deve-se ter cuidado especial com a definição da variável uso de medicamentos.
Uma característica importante dessa variável é a diversidade. Há produtos cujos componentes da fórmula resultam de síntese química ou biológica; há os opoterápicos, os hemoderivados, os homeopáticos, os fitoterápicos e os caseiros. Cada grupo contém imensa variedade de substâncias, são diferentes formas farmacêuticas, doses e apresentações. A seleção de um grupo não impede a exclusão de subgrupos; podem-se selecionar, para o estudo, os produtos de síntese química e excluir, por exemplo, os produtos de uso dermatológico ou oftalmológico.
Há inúmeros fatores que afetam a validade da informação sobre a variável uso de medicamentos. Entre eles, destacam-se:
- a informação que é captada no emprego de nomes de fantasia. Os indivíduos não consomem diazepam, mas uma EF, cujo componente ativo é o diazepam. É preciso partir do nome comercial, de marca ou de fantasia, identificar os componentes da fórmula e classificá-los em classes químico-terapêuticas.
- cada usuário consumindo uma combinação singular de EF. Ao considerar os idosos, por exemplo – nos quais, a prevalência de uso de medicamentos pode alcançar 90% –, as combinações são inúmeras, não obedecem a critérios científicos e, ao contrário, expressam um uso irracional.
- além do problema da lembrança (recall), há fatores culturais que interferem na definição leiga de medicamento. Muitas vezes, os consumidores não consideram analgésicos, fitoterápicos, produtos de uso local ou para o tratamento de quadros leves, como medicamentos.
Sendo assim, para aumentar a validade das informações sobre o uso de medicamentos, é recomendável:
- selecionar, criteriosamente, os grupos a serem estudados ou excluídos;
- empregar instrumentos de coleta padronizados e testados;
- treinar entrevistadores no manejo da coleta de informações sobre as marcas comerciais;
- coletar, de modo exaustivo, informações sobre todas as EF utilizadas, em cada um dos grupos selecionados para o estudo;
- coletar, para cada produto, informações sobre o nome do fabricante, a forma farmacêutica, a dose, a duração de uso, o prescritor; e
- solicitar aos entrevistados a apresentação de comprovante de uso dos medicamentos (embalagens, bulas ou receitas).
Definição da unidade de análise
Os inquéritos permitem abordar dois universos de indagações, um relacionado às EF, o outro aos seus usuários.
Ao considerar como unidade de análise as especialidades farmacêuticas, o foco está na avaliação crítica da oferta de produtos. Obtêm-se informações sobre os produtos disponíveis, em um dado tempo e lugar, e a sua qualidade. São gerados elementos úteis aos gestores dos programas de assistência farmacêutica e de regulação e fiscalização sanitária. As marcas comerciais, transformadas em classes ou subclasses terapêuticas, grupos químicos, substâncias ativas, passam a compor indicadores de qualidade cuja referência são os livros-texto de farmacologia clínica, os formulários terapêuticos8 e as listas de medicamentos essenciais recomendadas por organismos nacionais9 ou internacionais.10
Ao considerar os usuários como unidade de análise, o foco está na avaliação crítica do consumo. Assim, é possível identificar: associações entre a terapêutica farmacológica e as características sociais, econômicas, demográficas, as condições de saúde e os hábitos de vida e trabalho dos usuários; associações entre eventos adversos (ocorridos/potenciais) e emprego de classes terapêuticas selecionadas; e subgrupos populacionais mais expostos ao uso irracional, passíveis de intervenção.
Plano de análise
O plano de análise deve contemplar a avaliação global das EF usadas e dos seus usuários, baseada em indicadores, entre os quais os de:
Oferta
- Proporção de EF, segundo o número de princípios ativos (PA).
- Proporção de PA proibidos/com restrições de uso em outros países; incluídos nas listas de medicamentos essenciais nacional (Rename) ou internacional [Organização Mundial da Saúde (OMS)] concordantes com critérios preconizados por publicações especializadas. 8,11
Consumo
- Número médio de EF usadas por pessoa
- Número médio de PA usados por pessoa
- Proporção de usuários segundo número de EF
- Proporção de usuários segundo: número de PA; PA incluídos nas listas de medicamentos essenciais nacional (Rename) ou internacional (OMS); PA concordantes com critérios preconizados por publicações especializadas;8,11 PA proibidos/com restrições de uso em outros países; PA com restrições relativas à faixa etária, à gravidez, à insuficiência renal, etc; e PA com efeitos superpostos (redundância) ou capazes de causar interações farmacológicas.
- Proporção de usuários do PA/1000 pessoas
- Número de doses diárias definidas (ou de doses diárias prescritas) do PA/1000 pessoas
Assim, é possível comparar grupos de usuários de medicamentos, ou o comportamento de um grupo no tempo. Diferentes variáveis sociais, demográficas, econômicas, de saúde ou de hábitos de vida – fatores preditivos – são selecionados para serem submetidos às técnicas correntes de modelagem estatística, desde que atendam às indagações formuladas pela investigação.
Preparação do banco de dados
A criação de variáveis de interesse segue as seguintes etapas:
- transformação dos nomes de marca em fórmulas químicas por meio dos bulários de livros-texto ou de dicionários de EF;
- padronização das fórmulas químicas quanto à grafia (diazepan ou diazepam); denominação das substâncias ativas (vitamina C ou ácido ascórbico); unidades (miligramas, gramas) e outras; e
- quando necessário, classificação das fórmulas químicas, isto é, atribuição de códigos numéricos aos princípios ativos. Para isso, emprega-se a classificação anatômico-terapêutica-química (ATC).12
Organização dos bancos de dados relacionais
Para atender aos objetivos do plano de análise de dados, é fundamental organizar os bancos de dados de forma coerente. É importante criar dois arquivos básicos. Porém, é preciso considerar que tais arquivos, geralmente, podem ser insuficientes; e que uma combinação dos dois arquivos seria mais eficiente no atendimento de alguns pontos da análise.
O primeiro arquivo (Características dos participantes/ consumidores) diz respeito aos consumidores de medicamentos – ou participantes da pesquisa, dependendo do desenho do estudo e suas respectivas variáveis. Por exemplo, variáveis sociodemográficas, como sexo, idade e escolaridade, são variáveis típicas dos consumidores e precisam ser mantidas nesse primeiro arquivo. Cada linha (registro) desse arquivo representa um consumidor, com o seu número de ordem (variável: n_cons) correspondente ao questionário aplicado, que será utilizado para fazer o relacionamento (link) entre os vários bancos de dados. Mesmo indivíduos que não consomem medicamentos devem ser incluídos nesse arquivo, para análises comparativas. Um exemplo desse arquivo encontra-se na Tabela 1.

O segundo arquivo deve conter os nomes comerciais dos medicamentos. Cada linha de registro corresponderá a um medicamento citado por um determinado consumidor. A primeira variável é o número do consumidor (n_cons), mesmo número que ele/ ela recebe no arquivo de consumidores (n_cons). Receber o mesmo número é fundamental para o relacionamento (link) dos arquivos. A segunda variável obrigatória é o número do medicamento (n_ef). Portanto, cada medicamento citado por um consumidor recebe um número, que identifica, simultaneamente, o consumidor e o medicamento. A seguir, vêm as variáveis relacionadas a cada produto, isto é, a forma farmacêutica, o nome do fabricante e outras (Tabela 2).
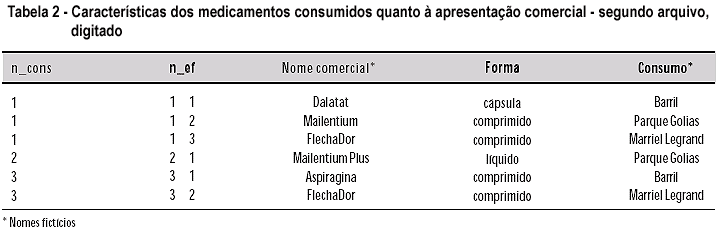
Não há limites para o número de medicamentos que cada consumidor pode apresentar, desde que cada medicamento ocupe uma linha do arquivo de nomes comerciais.
A etapa seguinte diz respeito aos princípios ativos, ou PA, contidos em cada EF. Novos campos devem ser abertos, para que outras variáveis sejam incluídas no arquivo, seja com os PA, os códigos das classes terapêuticas ou as reações adversas. O terceiro arquivo pode ser chamado "horizontalizado".
A seguir, as variáveis são transformadas e o banco de dados preparado para as análises. Podem ser incluídas variáveis como: número de PA em cada EF (qtpa); presença, ou não, da dosagem correta; participação, ou não, nas listas de medicamentos essenciais; e outras. Essas variáveis podem ser criadas facilmente, mediante comandos do tipo if...then.
No exemplo da Tabela 3, observa-se que o arquivo transformado contém até dois PA; porém, podem ser abertos tantos campos quantos sejam necessários. Também foram incluídas duas variáveis, apenas, para cada PA (nome e dose). Observe-se que os nomes das variáveis terminam em algarismos arábicos, que identificam a que PA se referem. Também foi incluída uma variável obtida na fase de transformação, com o número de princípios ativos de cada medicamento, a partir de um contador simples (qtpa). No Epi-Info, procede-se da seguinte maneira: define qtpa ##; qtpa=0; if p_ativ1<>. then qtpa=qtpa+1; if p_ativ2<>. then qtpa=qtpa+1; . . . ; if p_ativnn<>. then qtpa=qtpa+1

A seguir, produz-se um quarto arquivo, criado por transformação do terceiro arquivo, que é o de nomes comerciais, em um processo denominado "verticalização". Trata-se de um arquivo de PA, onde cada linha (registro) indicará um PA incluído em uma EF mencionada por um consumidor. Assim, se uma EF contém seis PA, o arquivo conterá seis linhas.
A primeira variável desse arquivo é o número do consumidor (n_cons), a segunda é o número da EF (n_ef) e a terceira identifica a posição do PA na EF (n_pa). O arquivo pode conter outras variáveis pertinentes a cada PA, como, por exemplo, a dose, o órgão-alvo da ação farmacológica e outros (Tabela 4).

Ressalte-se que os nomes das variáveis não contêm algarismos arábicos em seu final, pois a variável n_pa é a que indica o número da coluna que, no terceiro arquivo, deu origem ao PA. Assim, a dipirona é n_pa 1 e a orfenadrina é n_pa 2 no arquivo 3. Ambas estão no produto FlechaDor e são identificadas como p_ativ1 e p_ativ2 no arquivo 2b. Em outras palavras, o que, no terceiro arquivo, estava em duas colunas, no arquivo 3 está em duas linhas; houve, portanto, uma "verticalização" de um arquivo anteriormente horizontalizado.
Esse arquivo permite gerar uma tabela com todos os diferentes princípios ativos da amostra estudada, com um único comando no Epi-Info (freq nome_pativo). Pode-se, também, obter uma tabela de contingência, com todos os princípios ativos e segundo as diferentes doses de cada um deles, com um único comando no Epi-Info (tables nome_pativo dose_pativo).
Esse processo de verticalização pode ser realizado de maneira bastante simples, por meio do Epi-Info, após a leitura do arquivo horizontal e a aplicação do comando run no programa descrito na Figura 3. O Epi-Info é um pacote de domínio público, que pode ser obtido livremente, pelo site http://www.cdc.gov/ epiinfo/downloads.htm, sendo bastante conhecido e utilizado na área de epidemiologia. O Epi-Info conta com uma versão para DOS (6.04) e outra para Windows (2003), com diversos módulos: um módulo para edição de texto, adaptado para construção de questionários, incluindo a criação de filtros de entrada de dados; um módulo para elaboração de bancos de dados, a partir de um questionário; um poderoso módulo de análise de dados; um módulo para análise de tabelas (statcalc, epitable e datacompare); módulos para importação, exportação, junção e atualização de arquivos; e um módulo para verificação de entrada dupla de digitação (validate).

Formação dos arquivos secundários
Para as análises dos dados, os arquivos devem ser relacionados (por links). As junções dos arquivos são sempre do mais específico (geralmente, aquele com mais registros) para os menos específicos (com menos registros).
Nos exemplos apresentados, as junções são do arquivo de princípios ativos com o arquivo de nomes comerciais, e deste com o arquivo de participantes/ consumidores. São gerados dois arquivos: um deles, resultado da junção dos arquivos 2 + 1 (Tabela 5); e o outro, resultado dos arquivos 3 + 2 + 1 (Tabela 6).
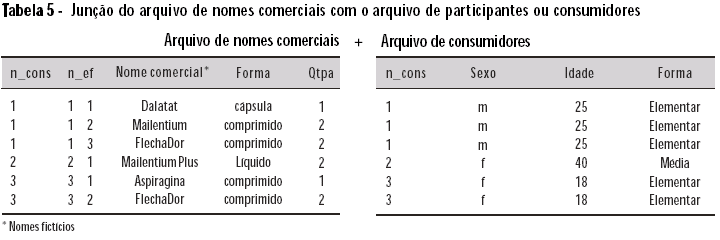

Para a junção dos arquivos de princípios ativos com o de nomes comerciais, utiliza-se a variável n_ef, que identifica cada EF utilizada por cada consumidor. Para a junção do arquivo de nomes comerciais com o de consumidores, utiliza-se a variável n_cons, que identifica cada participante/consumidor incluído na pesquisa.
Para obter a distribuição proporcional por sexo, ou a idade média dos consumidores, segundo os nomes comerciais, utiliza-se o arquivo-junção da Tabela 5. Por exemplo: ";As mulheres utilizam mais medicamentos com associações em doses fixas?" Pode-se utilizar o comando (tables sexo qtpa), aplicado a ele. Para obter informações sobre características sociodemográficas dos consumidores, segundo PA, deve-se utilizar o arquivo-junção da Tabela 6. Esse arquivo pode ser utilizado, também, para obter informações sobre variáveis do arquivo de princípios ativos, como por exemplo: "O hidróxido de magnésio é mais empregado do que o hidróxido de alumínio?" (freq nome_pativo).
Em resumo, o cuidado na coleta das informações, a definição da unidade de análise, a escolha dos indicadores de interesse, assim como a organização e preparação dos bancos de dados, fazem dos delineamentos transversais poderosas ferramentas para o estudo dos medicamentos.
Referências bibliográficas
1. Rothman KJ, Greenland S. Types of epidemiologic study. In: Rothman KJ, Greenland S. Modern Epidemiology. 2nd ed. Philadelphia: Lippincott williams & Wilkins;1998.p. 67-78.
2. Babbie ER. Métodos de investigación por encuesta. 1a ed. México: Biblioteca de la salud; 1999.
3. Klein CH., Bloch KV. Estudos seccionais. In: Medronho R, Epidemiologia.1a ed. Rio de Janeiro: Atheneu; 2002. p. 125-150.
4. Barros MBA. Saúde e classe social: um estudo sobre morbidade e consumo de medicamentos. [Tese de Doutorado]. Ribeirão Preto: Faculdade de Medicina/ USP;1983.
5. Rozenfeld S. O uso de medicamentos em mulheres da Terceira Idade - As quedas como iatrogencia farmacoterapêutica. [Tese de Doutorado]. Rio de Janeiro: Instituto de Medicina Social/UERJ; 1997.
6. Mosegui GBG, Rozenfeld S, Veras RP, Vianna CMM. Avaliação da qualidade do uso de medicamentos em idosos. Revista de Saúde Pública 1999; 33:437- 444.
7. Tancredi FB. Aspectos epidemiológicos do consumo de medicamentos psicotrópicos pela população adulta do Distrito de São Paulo. [Dissertação de Mestrado]. São Paulo: Faculdade de Saúde Pública/USP;1979.
8. British National Formulary [updated 2004 May 19]. Available from http://www.bnf.org/bnf/.
9. Portal da Assistência Farmacêutica [updated 2004 May 19]. Brasilia: Dapartamento de Assistência Farmacêutica. Available from http://www.opas.org.br/medicamentos/.
10. WHO. int. Geneva: Department of Essential Drugs and Medicines Policy (EDM). World Health Organization. Essential drugs and medicines policy [updated 2004 May 19]. Available from http://www.who.int/medicines/
11- Fundació Institut Català de Farmacologia [updated 2004 May 19]. Barcelona: Fundació Institut Català de Farmacologia. Available from http://www.icf.uab.es/.
12. Who Collaborating Centre for Drug Statistics Methodology. Oslo: Norwegian Institute of Public Health [updated 2004 May 19]. Available from http:/ /www.whocc.no/atcddd/.
 Endereço para correspondência:
Endereço para correspondência:
Rua Leopoldo Bulhões, 1480, 8o andar
Manguinhos, Rio de Janeiro-RJ.
CEP: 21041-200
E-mail:rozenfeld@ensp.fiocruz.br; jvalente@ensp.fiocruz.br












 Curriculum ScienTI
Curriculum ScienTI
