Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.15 n.2 Brasília jun. 2006
http://dx.doi.org/10.5123/S1679-49742006000200004
Detecção precoce de epidemias de malária no Brasil: uma proposta de automação
Early detection of malaria epidemics in Brazil: a proposal for automation
Rui Moreira BrazI; Valeska Lima AndreozziII; Pauline Lorena KaleIII
ICoordenação-Geral do Programa Nacional de Controle da Malária, Secretaria de Vigilância em Saúde, Ministério da Saúde, Brasília-DF
IIDepartamento de Epidemiologia e Métodos Quantitativos em Saúde, Escola Nacional de Saúde Pública Sérgio Arouca, Fundação Instituto Oswaldo Cruz, Rio de Janeiro-RJ
IIINúcleo de Estudos de Saúde Coletiva, Universidade Federal do Rio de Janeiro, Rio de Janeiro-RJ
RESUMO
A Amazônia Legal do Brasil concentra 99% dos casos de malária do país; porém, falta um sistema automatizado para detectar as epidemias da doença que ocorrem na região. O estudo propõe alguns métodos estatísticos para detecção precoce de epidemias de malária. Foram testados cinco tipos de gráficos: média +1,96 desvio-padrão (método de Cullen); amplitude interquartilar (método de Albuquerque); método do 3o quartil; método Cusum-tabular; e alisamento da linha base (método de Stern & Lightfoot). A taxa de alarmes verdadeiros (TAV) disparada pelos cinco métodos no Município de Manaus, Estado do Amazonas, foi de 100%; e em Machadinho D’Oeste, Estado de Rondônia, foi de 100% para o método do 3o quartil, de 25% para os métodos de Cullen e de Stern & Lightfoot e, para os demais métodos, de 0%. Em Amarante do Maranhão, Estado do Maranhão, não houve mês epidêmico e nenhum alarme foi disparado pelos cinco métodos, correspondendo a 100% de acerto. O método do 3o quartil mostrou-se mais adequado para a detecção precoce de epidemias de malária na Amazônia Legal Brasileira, sendo recomendado para implantação na rotina da vigilância da doença na região.
Palavras-chave: malária; epidemias; vigilância epidemiológica; gráficos estatísticos.
SUMMARY
In Brazil, 99% of reported malaria cases occur in the Amazon Region. To date, however, an automated system has not yet been defined to detect epidemics in this area. This study proposes several statistical methods that could be useful for early detection of malaria epidemics. Five types of graphs were investigated: average +1.96 standard deviations (Cullen method); inter-quartile range (Albuquerque method); 3rd quartile method; Cusum-tabular method; and smoothing of baselines (Stern & Lightfoot method). The true alarm rate (TAV) detected by these methods was as follows: 100% by all five methods in the Municipality of Manaus, Amazonas State; and in the Municipality of Machadinho D’Oeste, Rondônia State 100% were detected by the 3rd quartile method; 25% using the Cullen, and Stern & Lightfoot methods, and 0% for other methods. In the Municipality of Amarante do Maranhão, Maranhão State, there were no epidemic months, and no alarm was given by any of the five methods, corresponding to 100% success. The 3rd quartile method is the most appropriate for early detection of malaria epidemics in municipal districts of the Brazilian Amazon Region, and recommended for implantation in routine malaria surveillance.
Key-words: malaria; epidemics; epidemiology surveillance; statistical graphs.
Introdução
No Brasil, 99% dos casos de malária se concentram na região da Amazônia Legal, onde, no ano de 2003, notificaram-se 407.995 casos da doença, 70% de P. vivax, 29% de P. falciparum e 1% P. malariae.1 Esses casos foram transmitidos, principalmente, pelo mosquito Anopheles darlingi;2 computaram-se 10.291 internações, correspondendo a 2,5% do total de casos,3 e 82 casos evoluíram para óbito, com taxa de letalidade de 0,02%.4
Para apoiar os Estados e Municípios da região, o Ministério da Saúde (MS), por intermédio de sua Secretaria de Vigilância em Saúde (SVS), implantou, no ano de 2003, o Sistema de Informações de Vigilância Epidemiológica (Sivep-Malária), destinado à notificação de casos da doença. O sistema representa um avanço por utilizar tecnologia da Internet, podendo, também, ser aplicado em locais que não dispõem dessa tecnologia. As notificações são enviadas para uma base de dados centralizada, a que os três níveis de gestão – municipal, estadual e federal – têm acesso rápido e simultâneo às informações, para análise e tomada de decisões. Apesar do avanço tecnológico, o atual sistema de informação prescinde de ferramenta para detecção precoce das epidemias de malária que ocorrem naquela região.
A Amazônia Legal é uma região endêmica para malária, altamente favorável à interação dos fatores colaboradores da elevada incidência da doença, onde o risco da ocorrência anual de casos é estimado pela Incidência Parasitária Anual (IPA), em graus variados e expressos pelo número de exames positivos de malária por mil habitantes, em determinado espaço geográfico: baixo risco (<10); médio risco (10-49); alto risco (>50).5 No ano de 2003, foram identificados 71 Municípios com alto risco para transmissão da doença, ou seja, com IPA igual ou maior que 50 casos por 1.000 habitantes. Desses Municípios, 34 (47,8%) registraram IPA acima de 100 casos por 1.000 habitantes, chegando a situações extremas, por exemplo, em Cujubim e em Candeias do Jamari, no Estado de Rondônia, Anajás, no Estado do Pará, e Machadinho D’Oeste, também em Rondônia, localidades onde o IPA chegou a 585, 356, 328 e 327 casos por 1000 habitantes, respectivamente.1 Apesar de apresentarem-se taxas tão altas de incidência, não se dispõe de sistema de informação que permita afirmar quais Municípios se encontravam em situação epidêmica, ou seja, onde ocorrera excesso ou aumento de casos acima do esperado, de acordo com os conceitos técnicos de epidemias.6-8
Na região, o grande desafio está na definição do limiar epidêmico da doença, para identificar quais os limites de transmissão esperados, para cada Município, e quando esses limites podem ser ultrapassados, tornando-se uma eventualidade epidêmica. Responder a essa questão constitui uma necessidade para a vigilância da malária.
Com a implantação do sistema de detecção precoce de epidemias de malária, espera-se a ampliação das opções de informação junto aos gestores e técnicos do setor Saúde, de forma a possibilitar a adoção de medidas de controle da doença mais oportunas. Os gestores terão maior sustentação técnica ao declarar uma epidemia, evitando problemas de ordem ética, política e financeira quanto a possíveis questionamentos sobre a existência de uma verdadeira epidemia. Os três níveis de gestão poderão realizar monitoramento simultâneo das possíveis epidemias de malária, para evitar ou minimizar a ocorrência do evento. Assim, poder-se-á reduzir a incidência da enfermidade nas populações e diminuir o sofrimento humano e as perdas sociais e econômicas decorrentes, conforme preconiza o Programa Nacional de Controle da Malária.9
A vigilância deve prover uma base quantitativa para prática de Saúde Pública, incluindo a prevenção.10,11 Prevenir tem o significado de "preparar, chegar antes de, dispor de maneira que (se) evite dano ou mal, impedir que se realize".12 As ações preventivas definem-se como intervenções orientadas a evitar o surgimento de doenças específicas, reduzindo a sua incidência ou prevalência na população. Várias técnicas estatísticas foram desenvolvidas para ajudar a prevenir a ocorrência de epidemias;13-15 a aplicação de cada uma, entretanto, depende das características de distribuição da doença. Entre as técnicas disponíveis, procurou-se selecionar aquela que apresentasse melhor aplicabilidade no serviço, visando ao desenvolvimento de um sistema de informações capaz de subsidiar a adoção de medidas antecipatórias de controle de epidemias de malária.
Os sistemas de detecção precoce de epidemias são o meio pelo qual a vigilância se transforma em medidas de Saúde Pública oportunas.16 Os grandes sistemas de informação devem ser, principalmente, instrumentos de antecipação aos eventos que ponham em risco a saúde da população.11,17,18 Assim, diversos sistemas têm-se desenvolvido para detecção precoce de epidemias de malária, de forma automatizada, destacando-se aqueles utilizados na Tailândia,19 no Quênia,20,21 na Etiópia, em Uganda e em Botswana.22,23
A detecção de surtos e epidemias, visando ao controle oportuno, consta das principais preocupações da vigilância da malária no Brasil.2 O presente estudo teve o objetivo de propor um método estatístico para automação do processo de detecção precoce de epidemias de malária na região da Amazônia Legal e, assim, contribuir para o aprimoramento dos procedimentos de vigilância da doença.
Metodologia
A região da Amazônia Legal, ao norte do País, compreende os Estados do Acre (AC), Amapá (AP), Amazonas (AM), Maranhão (MA), Mato Grosso (MT), Pará (PA), Rondônia (RO), Roraima (RR) e Tocantins (TO) – os quais somavam, em 2002, uma população de 22 milhões de habitantes. A área total da região, de 5,1 milhões de km2 (60% da área do Brasil), abrigava, naquele ano, 805 Municípios (14% do total do País).
Os registros de casos de malária no período de 1996 a 2002, obtidos do antigo Sistema de Informações do Programa Nacional de Controle da Malária (Sismal/Centro Nacional de Epidemiologia/Fundação Nacional de Saúde/Ministério da Saúde), foram utilizados para a construção dos gráficos de controle estatístico. Os dados do ano de 2003, obtidos do atual Sistema de Informação de Vigilância Epidemiológica da Malária (Sivep-Malária/Secretaria de Vigilância em Saúde/Ministério da Saúde), foram aplicados como ano de monitoramento. Para o tratamento estatístico dos dados, aplicaram-se os seguintes softwares: Epi Info (versão 6.4);24 Epi Info 2000 (versão 3.2.2);25 R (versão 1.9.1);26 e Statistica (versão 6).27
Foram selecionados três Municípios, de acordo com o risco de transmissão da doença: Amarante do Maranhão-MA (baixo risco); Manaus-AM (médio risco); e Machadinho D’Oeste-RO (alto risco). Excluíram-se os dois anos com maior número de casos, considerados anos epidêmicos, em cada Município, para a aplicação dos métodos de detecção de epidemias. As séries temporais resultantes de cada Município foram obtidas ao se reunir os dados segundo o mês e ano, resultando em 60 pontos de dados brutos (5 anos x 12 meses). Foram selecionados cinco métodos estatísticos: diagrama de controle segundo a média +1,96 desvio-padrão (método de Cullen); diagrama de controle segundo a amplitude interquartilar (método de Albuquerque); diagrama de controle segundo a distribuição por quartis (método do 3o quartil); método das somas cumulativas (método do Cusum-tabular); e método de alisamento da linha base (método de Stern & Lightfoot).
Os métodos estatísticos analisados por este estudo baseiam-se na utilização de gráficos de controle, compostos de uma linha central representativa do valor médio da característica da qualidade correspondente ao estado do processo "sob controle", ou seja, a variabilidade esperada em função do acaso ("causas-chances"). Duas linhas horizontais também fazem parte do gráfico de controle, chamadas de "limite superior de controle" (LSC) e "limite inferior de controle" (LIC). Se os dados das amostras de um processo de controle de qualidade situam-se dentro dos limites de controle, o processo é dito "sob controle" e, portanto, nenhuma ação corretiva é necessária. Não obstante, se algum ponto da amostra apresentar-se fora desses limites, o processo é considerado "fora de controle"; assim, uma ação corretiva faz-se necessária para eliminar as denominadas "causas assinaláveis" ou "causas responsáveis" por esse comportamento. Mesmo que os pontos da amostra permaneçam dentro dos limites de controle, porém de forma sistemática não aleatória, há indicação de que o processo se encontra "fora de controle" e, portanto, medidas investigativas e corretivas devem ser adotadas.28
No controle da malária, se algum ponto da amostra apresentar-se abaixo do LIC, será necessário investigar a existência de subnotificação de casos da doença, para correção do problema. Se essa situação decorrer dos resultados das intervenções para controle da doença, nenhuma ação corretiva será requerida; a identificação e a manutenção das intervenções que resultaram na redução da doença, entretanto, serão demandadas.
Na construção dos gráficos de controle, foram excluídos os LIC por considerar-se que o propósito do estudo foi medir a capacidade de detectar epidemias de cada método estatístico, mediante o confronto dos dados monitorados do ano de 2003, contra a linha do limiar epidêmico ou LSC.
Na seleção dos métodos estatísticos, consideraram-se os critérios de possibilidade de automação e facilidade de entendimento dos resultados pelos gerentes dos serviços de saúde. Foi considerado adequado para detecção precoce de epidemias de malária o método estatístico que apresentou maior taxa de alarmes verdadeiros de meses epidêmicos (TAV) disparados por cada método. Esse indicador foi adotado visando à identificação do método mais sensível para detecção de verdadeiras epidemias, evitando a ocorrência de dois tipos de erros: I e II. O erro de tipo I equivale ao falso positivo, ou seja, aceitar a existência de uma epidemia quando ela realmente não existe. O erro de tipo II equivale ao falso negativo, rejeitar a existência de uma epidemia quando ela, realmente, existe.28
Para avaliar a TAV, foi elaborado e aplicado o critério do "mês com maior número de casos". Por esse critério, considerou-se verdadeiramente epidêmico o mês do ano de 2003 – que apresentou número de casos de malária maior que o valor máximo dos meses correspondentes –, da série de dados dos cinco anos considerados não epidêmicos e que serviram para construção dos gráficos de controle. Por exemplo, em Machadinho D’Oeste, o mês de junho de 2003, que apresentou 810 casos da doença, foi considerado epidêmico porque superou o número de casos dos anos anteriores: junho de 1996 (510); junho de 1997 (687); junho de 1999 (696); junho de 2000 (563); e junho de 2001 (520). Nesse Município, também foram considerados epidêmicos os meses de agosto, outubro e novembro de 2003, ao se adotar o mesmo critério.
Método de Cullen
Também conhecido como gráfico de controle de Shewhart, esse método, modificado na área da Saúde, baseia-se em um limiar calculado a partir da média +1,96 desvio-padrão de uma série temporal de cinco anos de casos mensais de malária. Constrói-se o intervalo de variação esperado para a média mensal da doença, considerando-se que, em uma distribuição normal, 95% dos valores se encontram entre a média +1,96 desvio-padrão (LSC) e a média -1,96 desvio-padrão (LIC).19
Método de Albuquerque
O método pressupõe que, em três quartos do tempo, o número de casos de malária esteja abaixo do limiar. Assim, o LSC, ou limiar epidêmico, é calculado com base no valor do terceiro quartil (Q3) da série temporal mais o desvio quartilar (Q) – este, resultante da semidiferença entre o terceiro e o primeiro quartis. Qualquer freqüência de casos maior que o limite superior de controle deve ser considerada representativa de um episódio não habitual, uma eventualidade epidêmica. A aplicação desse método, no presente estudo, teve como referência o trabalho desenvolvido por Albuquerque29 na implantação da vigilância de diversos agravos no Brasil.
Método do 3o quartil
Na construção do diagrama de controle segundo a distribuição por quartis, são incorporados os mesmos pressupostos do método de Albuquerque.29 O fator diferencial entre as duas técnicas está em que, na primeira (método do 3o quartil), os limites de controle, inferior e superior, são construídos a partir do primeiro e terceiro quartis (Q1 e Q3), desprezando-se os demais procedimentos. Neste estudo, adotou-se a metodologia recomendada pela Organização Mundial da Saúde (OMS).22,23
Método Cusum-tabular
O pressuposto para construção de um gráfico de controle Cusum é de que os dados da amostra possuem distribuição normal e são independentes, o que torna o método mais efetivo na detecção de pequenas trocas ou variações na média desse processo, da ordem de 0,5 a 2 desvios-padrão. Nesse intervalo, o Cusum pode detectar mudanças duas vezes mais rápido que os outros gráficos de controle, com amostra de tamanho menor. No Cusum-tabular, duas somas acumuladas são calculadas: SH(i), o Cusum tabular unilateral superior para o período i; e SL(i), o Cusum-tabular unilateral inferior para o período i. Essas somas são calculadas pelas seguintes equações:
SH(i) = max [0,Xi – (µ0 + K) + SH(i – 1)]
e
SL(i) = max [0, (µ0 – K) – xi + SL(i – 1)]
Em que:
Xi = disposição das observações em coluna, em ordem temporal;
µ0 = valor-alvo ou média do processo esperada, ou seja, a média amostral inicial, antes de adicionar novas observações ao processo;
K = valor de referência correspondente ao estado do processo fora de controle (é igual a kσ);
SH = soma cumulativa superior (Cusum superior); e
SL = soma cumulativa inferior (Cusum inferior).
Os limites, superior e inferior, de controle correspondem ao intervalo de decisão H, o qual é encontrado aplicando-se diversos parâmetros, de acordo com Montgomery.28 Quando as somas acumuladas ultrapassam o intervalo de decisão H, o processo é dito "fora de controle".
O Cusum-tabular foi testado com os dados brutos e dados padronizados/normalizados pela técnica da diferenciação da série histórica dos três Municípios, adicionando-se o valor absoluto da menor diferença, o que resultou em uma série com valores positivos, tão-somente.
Método de Stern & Lightfoot
Ou alisamento da linha base. Trata-se de uma suavização não paramétrica, cujo objetivo principal é minimizar a contribuição de dados extremos na análise de uma série temporal.
Para execução do alisamento, primeiramente, são reunidos os 60 pontos de dados brutos que correspondem às séries temporais de malária de cada Município. Esses dados são alisados pela passagem sucessiva de um filtro, onde cada ponto é substituído por outro que contenha informação dos pontos vizinhos. Em seguida, calculam-se medianas sucessivas de 4, 2, 5 e 3 pontos vizinhos; finalmente, calcula-se a média corrente, ou Hanning running average (H). Para o cálculo de H, os pontos dos dados no tempo t, denominado d(t), são substituídos aplicando-se a seguinte equação:
H = 1/4 d(t – 1) + 1/2 d(t) + 1/4 d(t + 1)
Sobre os resíduos, resultantes dos dados brutos menos os valores dos dados alisados, aplica-se a mesma sucessão de alisamento (4253H). Os resíduos alisados são somados com os dados alisados. A diferença entre o valor dos dados alisados e o valor dos dados brutos é usada para calcular o desvio-padrão. A linha de base é calculada convertendo-se os pontos de dados mensais alisados, em um ciclo anual (12 meses), e calculando-se a mediana de cinco diferentes valores alisados para cada mês. A expressão gráfica desse diagrama é composta pelas linhas do limite inferior (LIC = linha base -2 desvios-padrão) e limite superior (LSC = linha base +2 desvios-padrão), plotando-se sobre elas os dados referentes ao ano de monitoramento (2003), cujos meses epidêmicos são aqueles que ultrapassam o LSC. Os procedimentos adotados para alisamento da linha base seguiram o método de Stern & Lightfoot.16
Considerações éticas
O presente estudo foi apreciado pela Comissão de Ética da Escola Nacional de Saúde Pública Sérgio Arouca (ENSP), da Fundação Instituto Oswaldo Cruz, e obteve seu parecer favorável.
Resultados
Malária nos Municípios de Amarante do Maranhão, Manaus e Machadinho D’Oeste
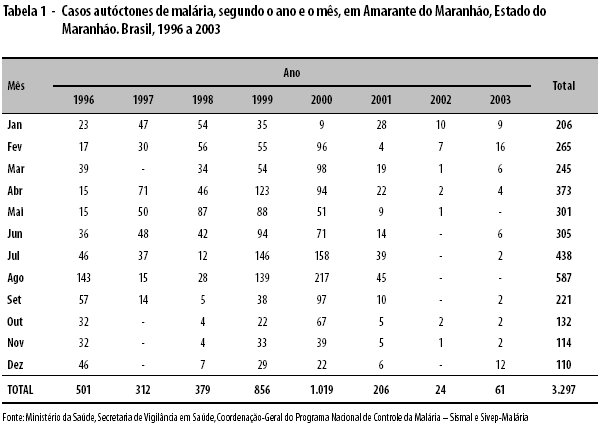
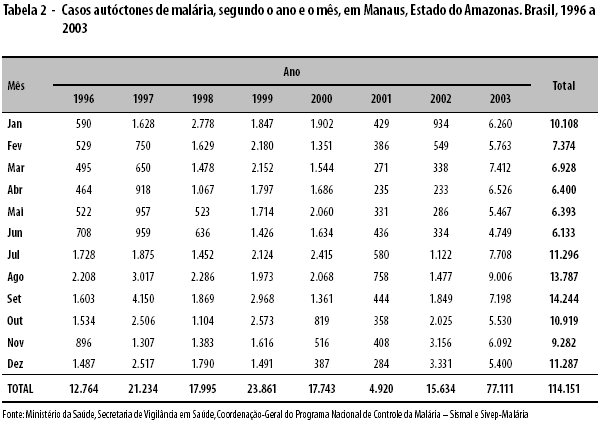
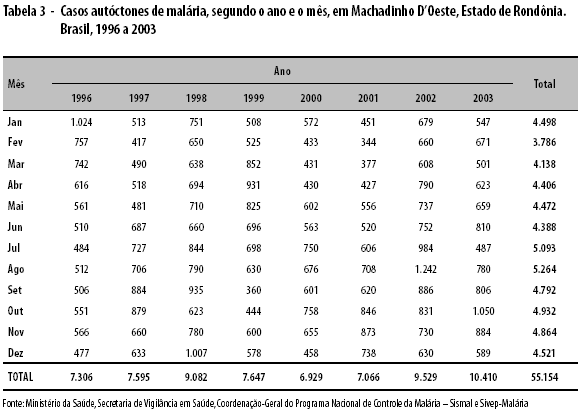
As tabelas 1, 2 e 3 apresentam os casos autóctones de malária por mês e ano de ocorrência (1996 a 2003), segundo os três Municípios selecionados. Os anos considerados epidêmicos e excluídos do cálculo dos LIC e LSC dos gráficos de controle foram: 1999 e 2000, em Amarante do Maranhão; 1997 e 1999, em Manaus; e 1998 e 2002, em Machadinho D’Oeste. Pode-se observar ampla variação de dados, não aleatória, nos Municípios de Amarante do Maranhão e Manaus.
Aplicação dos métodos estatísticos para detecção precoce de epidemias de malária
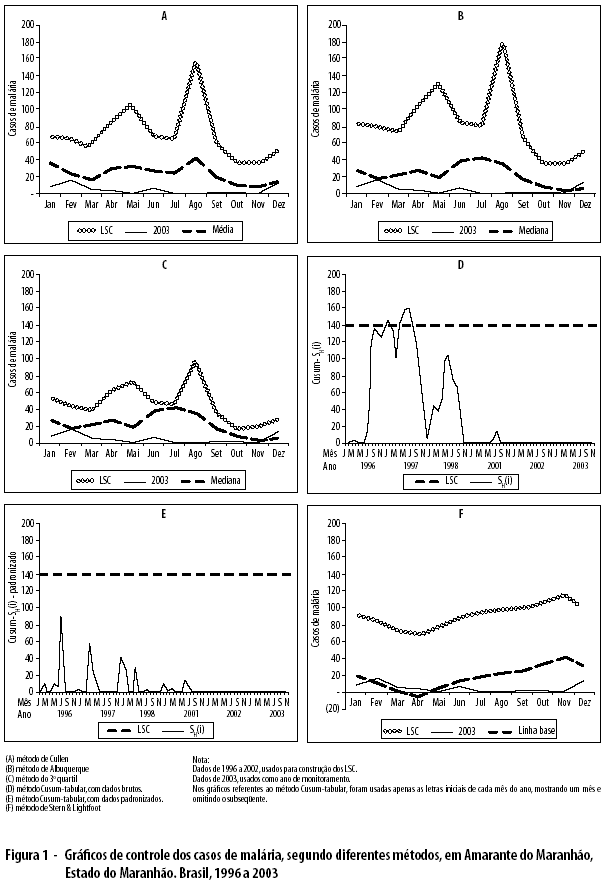
A Figura 1 apresenta os gráficos de controle aplicados às séries temporais de casos de malária no Município de Amarante do Maranhão. Nenhum método detectou epidemias no período analisado.
No Município de Manaus, foi detectada epidemia nos meses de janeiro a dezembro de 2003, pelos métodos de Cullen, do 3o quartil, Cusum-tabular (com dados brutos) e de Stern & Lightfoot. O método Cusum-tabular (com dados padronizados) caracterizou como epidêmicos os meses de janeiro, fevereiro, março, abril, julho e agosto (Figura 2).
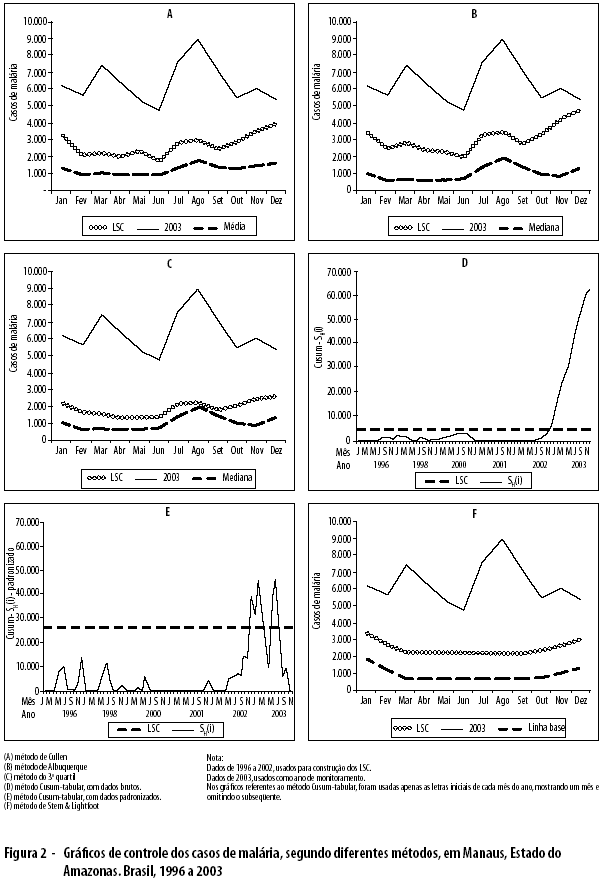
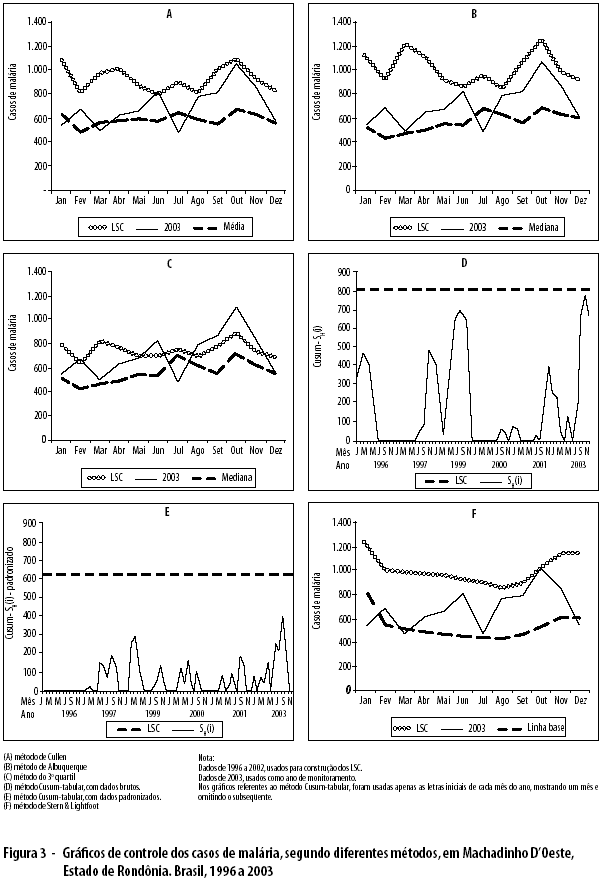
Em Machadinho D’Oeste, foram detectados os seguintes meses epidêmicos: junho, pelo método Cullen; fevereiro, junho, agosto, setembro, outubro e novembro, pelo método do 3o quartil; e outubro, pelo método de Stern & Lightfoot (Figura 3).
De acordo com o critério do "mês com maior número de casos", encontraram-se os seguintes meses epidêmicos, verdadeiramente: em Amarante do Maranhão, nenhum mês (n=0); em Manaus, os meses de janeiro a dezembro (n=12); e em Machadinho D’Oeste, os meses de junho, agosto, outubro e novembro (n=4).
Analisando a taxa de alarmes verdadeiros (TAV) disparada pelos cinco métodos, verifica-se que, em Amarante do Maranhão, não houve mês epidêmico e nenhum tipo de alarme falso foi disparado (TAV de 100% para os cinco métodos). Em Manaus, todos os meses foram considerados epidêmicos, pelos cinco métodos, e todos os alarmes disparados foram verdadeiros (TAV de 100% para os cinco métodos). Em Machadinho D’Oeste, os métodos de Cullen e de Stern & Lightfoot apresentaram um alarme verdadeiro, cada um, nos meses de junho e outubro, respectivamente (TAV de 25%); o método do 3o quartil apresentou quatro alarmes verdadeiros, nos meses de junho, agosto, outubro e novembro (TAV de 100%), e dois alarmes falsos, nos meses de fevereiro e setembro; os métodos de Albuquerque e Cusum-tabular não dispararam qualquer tipo de alarme (TAV de 0%).
Discussão
Métodos estatísticos
Os cinco métodos estudados puderam ser reproduzidos em planilha eletrônica, demonstrando possibilidade de automação. A sua forma gráfica de apresentação mostrou ser de fácil entendimento e, portanto, não oferecer dificuldades à sua interpretação pelos gerentes dos serviços de saúde, seja no nível municipal, estadual ou federal.
O método do 3o quartil apresentou maiores TAV, identificando, igualmente, todas as epidemias detectadas pelos outros métodos; demonstrou ser o mais adequado para detecção precoce de epidemias da malária nos Municípios da Amazônia Legal Brasileira.
Em estudos realizados para controle de epidemias de malária no Quênia, o método do 3o quartil também obteve maior sensibilidade;20 outrossim, tem apresentado bom desempenho na detecção de epidemias de malária na Etiópia, em Uganda e em Botswana.22,23 Seus bons resultados, seguramente, devem-se ao fato de o método não sofrer a influência de valores extremos e usar a mediana como linha central, além de não utilizar parâmetros dos desvios (padrão ou interquartilar), aumentando a probabilidade de detecção de meses epidêmicos ao aproximar os LSC e LIC da linha central, o que poderia aumentar o erro de tipo I (rejeitar-se a hipótese nula quando ela é verdadeira – falso positivo) e diminuir o erro de tipo II (não se rejeitar a hipótese nula quando ela é falsa – falso negativo);28 porém, a aplicação do critério do "mês com maior número de casos" para detectar alarmes verdadeiros e falsos possibilita melhor controle desses dois tipos de erros e evita problemas de ordem ética e política sobre o questionamento da existência ou não de uma verdadeira epidemia. Se os dados usados para cálculo dos valores esperados foram retirados de anos não epidêmicos, é racional que, para ser declarado o início de uma epidemia, seja mais seguro que os casos observados resultem superiores aos dos anos não epidêmicos.
Por outro lado, para potencializar a confirmação de epidemia, pode-se adicionar outro critério: o "vínculo cronológico", pelo qual são considerados epidêmicos os dois meses ou mais consecutivos, detectados por cada método estatístico; por exemplo, em Machadinho D’Oeste, os meses de outubro e novembro foram considerados epidêmicos pelo método do 3o quartil, ao estarem ligados cronologicamente. Assim, podem-se evitar gastos desnecessários com recursos financeiros, humanos e materiais na adoção das medidas de controle de uma epidemia, graças à confirmação do evento a partir do segundo mês. Tal procedimento reforça as decisões técnicas e políticas de se declarar existência de epidemia.
Com esses dois critérios, "mês com maior número de casos" e "vínculo cronológico", o erro de tipo I sofreria rigoroso controle e o erro de tipo II seria minimizado pelas características de maior sensibilidade do método do 3o quartil. Levando-se em conta que a Amazônia Legal Brasileira possuiu características geográficas, ecológicas e socioculturais altamente favoráveis à transmissão da malária, acredita-se que, para o controle da doença sob tais condições, é mais seguro aplicar o método do 3o quartil, por apresentar maior taxa de alarmes verdadeiros (TAV).
Anos epidêmicos
Os dados mensais de cinco anos retrospectivos, com exclusão dos anos epidêmicos, utilizados para os cálculos das linhas centrais e dos LSC dos gráficos de controle, estão de acordo com o que preconiza a OMS.22,23 Esse procedimento também foi adotado nos sistemas de detecção precoce de malária na Tailândia e no Quênia,19,20 bem como no controle de salmonelas, na Austrália.16 Em função da dinâmica da malária, que apresenta grande variabilidade de um ano para outro – como ocorre em Amarante do Maranhão e em Manaus –, é importante manter o conjunto de sete anos retrospectivos, com exclusão de dois anos epidêmicos, na construção do Sistema de Detecção Precoce de Epidemias de Malária (SDEM), conforme procedimento adotado por estes autores, para que o limiar epidêmico não sofra grandes distorções.
O Sistema de Detecção Precoce de Epidemias de Malária (SDEM)
A implantação do SDEM deve fortalecer a vigilância em saúde e consolidar o processo informação-decisão-ação. É inquestionável a melhoria no controle da malária após a implantação de sistemas de informação automatizados como o Sismal, em 1996, e o Sivep-Malária, em 2003. O uso dessas informações, todavia, deve ser potencializado com outras técnicas que permitam antecipar a ocorrência de epidemias. O SDEM deverá somar mais opções para "chegar antes" ou "impedir que se realizem" – nesse caso, as epidemias de malária.
A implantação do SDEM não deve ser mero ato de programação em computador e distribuição entre os Municípios; dessa forma, não ajudaria a modificar, em grau satisfatório, a atual forma de vigilância da malária o bastante. Faz-se necessário um projeto bem elaborado, com quatro etapas definidas: planejamento, desenvolvimento, implantação e avaliação do sistema. Todas essas etapas demandarão profundo conhecimento da doença e participação de epidemiologistas e técnicos da área de Informática. Sua principal importância será a de enviar as mensagens de alerta aos gestores estaduais e municipais de áreas onde o processo estiver "fora de controle" ou a caminho dessa situação. Para tanto, o SDEM deve atuar com níveis de alerta, que auxiliem na eliminação das "causas assinaláveis".
Limitações do estudo
A falta de outro método estatístico como padrão-ouro pode ter afetado os resultados do estudo, por falta de um parâmetro de comparação; assim, os gráficos testados foram comparados entre si. É possível, também, que a grande variabilidade nos registros de malária, nos três Municípios estudados, tenha afetado o desempenho dos gráficos estatísticos. A detecção de epidemias de malária por meio de métodos estatísticos deverá ser aprimorada com a incorporação, no futuro, de técnicas de controle entomológico e de geoprocessamento para monitoramento dos fatores ambientais que interferem na produção da malária. Modelos matemáticos também podem ser úteis na antecipação de eventos epidêmicos.
Referências bibliográficas
1. Secretaria de Vigilância em Saúde. Diretoria de Gestão. Brasília: Ministério da Saúde; 2004.
2. Fundação Nacional de Saúde. Guia de vigilância epidemiológica – vol. II. 5a ed. Brasília: Ministério da Saúde; 2002.
3. Ministério da Saúde. Informações sobre internação por malária [dados na Internet][acesso durante o ano de 2005, para informações de 2003]. Disponível em: http://www.datasus.gov.br
4. Secretaria de Vigilância em Saúde. Departamento de Análise de Situação de Saúde. Brasília: Ministério da Saúde; 2004.
5. Rede Interagencial de Informações para Saúde. Indicadores básicos para saúde no Brasil: conceitos e aplicações. Brasília: Opas; 2002.
6. Medronho RA, Perez MA. Distribuição das doenças no espaço e no tempo. In: Medronho RA, Carvalho DM, Bloch KV, Luiz RR, Werneck GL. Epidemiologia. São Paulo: Editora Atheneu; 2003. p. 57-71.
7. Rouquayrol MZ, Filho NA. Epidemiologia & saúde. Rio de Janeiro: Editora Médica e Científica; 2003.
8. Brookmeyer R, Stroup D. Monitoring the health of populations: statistical principles & methods for public health surveillance. New York: Oxford University Press; 2004.
9. Secretaria de Vigilância em Saúde. Programa Nacional de Controle da Malária. 2a ed. Brasília: Ministério da Saúde; 2004.
10. Thacker SB, Berkelman RL. Public health surveillance in the United States. Epidemiologic Reviews 1988;10:164-190.
11. Thacker SB, Berkelman RL, Stroup DF. The Science of public health surveillance. Journal of Public Health Policy 1989;10(2):187-203.
12. Czersnia D. O Conceito de saúde e a diferença entre prevenção e promoção. Cadernos de Saúde Pública 1999;15(4):701-710.
13. Costa AJL. Revisão das técnicas estatísticas propostas na literatura para detecção de epidemias de doenças infecciosas [dissertação de Mestrado]. Rio de Janeiro (RJ): Universidade do Estado do Rio de Janeiro; 1994.
14. Sanches O. Princípios básicos de procedimentos estatísticos aplicados na análise de dados de vigilância em Saúde Pública: uma revisão. Cadernos de Saúde Pública 2000;16(2):317-333.
15. Braz RM. Detecção precoce de epidemias de malária no Brasil: uma proposta de automação [dissertação de Mestrado]. Rio de Janeiro (RJ): Escola Nacional de Saúde Pública.
16. Stern L, Lightfoot D. Automated outbreak detection: a quantitative retrospective analysis. Epidemiology Infectious 1999;122:103-110.
17. White ME, McDonnell SM. Public health surveillance in low-and middle-income countries. In: Teutsch SM, Churchill RE. Principles and practice of public health surveillance. New York: Oxford University Press; 2000. p.287-315.
18. Farrington P, Andrews N. Outbreak detection: application to infectious disease surveillance. In: Stroup DF, Brookmeyer R. Monitoring the health of populations: statistical principles & methods for public health surveillance. New York: Oxford University Press; 2004. p. 203-230.
19. Cullen JR, Chitprarop U, Doberstyn EB, Sombatwattanangkul K. An Epidemiological early warning system for malaria control in northern Thailand. Bulletin of the World Health Organization 1984;62(1):107-114.
20. Hay SI, Rogers DJ, Shanks GD, Myers MF, Snow RW. Malaria early warning in Kenya. Trends in Parasitology 2001;17(2):96-99.
21. Hay SI, Simba M, Busolo M, Noor AM, Guyatt HL, Ochola SA, Snow RW. Defining and detecting malaria epidemics in the highlands of western Kenya. Emerging Infectious Diseases 2002;8(6):555-562.
22. World Health Organization. Malaria early warning system, a framework for field research in Africa: concepts, indicators and partners [monography on the Internet] [acesso durante o ano de 2005] Available from: http://www.who.int/malaria/cmc upload/0/000/ 014/807/ mews2.pdf.
23. Organisation Mondiale de la Santé. Manuel pour l’évaluation et la déclaration des épidémies de paludisme sur le terrain: version a tester sur le terrain [monografia na Internet] [acessado durante o ano de 2005]. Disponível em: http://www.who.int/malaria/cmc_upload/ 0/000/016/569/FTest_fr.pdf.
24. Epi Info, version 6.04. Produzido pelos Centers for Disease Control and Prevention (CDC), USA. Geneva: Word Health Organization; 1996.
25. Epi Info 2000, version 3.2.2. Produzido pelos Centers for Disease Control and Prevention (CDC), USA; 2004.
26. Development Core Team R. A Language and environment for statistical computing. Foundation for Statistical Computing, Vienna, Austria. Available from: http://www.R-project.org
27. Statistica, versão 6. StatSoft, Inc. STATISTICA [data analysis software system] version 6 2003. Available from: http://www.statsoft.com
28. Montgomery DC. Introduction to Statistical Control. Unite State of America: Hamilton Printing Company; 1990.
29. Albuquerque AM. Indicadores gráficos de controle epidemiológico. Revista da Fundação SESP 1975;20(1):105-125.
 Endereço para correspondência:
Endereço para correspondência:
Coordenação-Geral do Programa Nacional de Controle da Malária/SVS/MS,
SEPN (W3 Norte), Quadra 511, Bloco C,
Edifício Bittar IV, 3o andar,
Unidade III do Ministério da Saúde,
Brasília-DF.
CEP: 70750-593
E-mail:rui.braz@saude.gov.br













