Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.17 n.2 Brasília jun. 2008
http://dx.doi.org/10.5123/S1679-49742008000200004
Validação do teste imunocromatográfico rápido IT-LEISH® para o diagnóstico da leishmaniose visceral humana*
Validation of the rapid immunochromatographic test IT-LEISH® for the diagnosis of human visceral leishmaniasis
Tália Santana Machado de AssisI; Alexandre Sérgio da Costa BragaI; Mariana Junqueira PedrasI; Aldina Maria Prado BarralII; Isadora Cristina de SiqueiraIII; Carlos Henrique Nery CostaIV; Dorcas Lamounier CostaIV; Thiago Ayres HolandaIV; Vítor Yamashiro Rocha SoaresIV; Mauro BiáIV; Arlene de Jesus Mendes CaldasV; Gustavo Adolfo Sierra RomeroVI; Ana RabelloI
ICentro de Pesquisa René Rachou, Fundação Oswaldo Cruz, Ministério da Saúde, Belo Horizonte-MG, Brasil
IICentro de Pesquisa Gonçalo Muniz, Fundação Oswaldo Cruz, Ministério da Saúde, Salvador-BA, Brasil
IIICentro de Pesquisa Gonçalo Muniz, Fundação Oswaldo Cruz, Ministério da Saúde, Salvador-BA, Brasil. Hospital da Criança, Obras Sociais de Irmã Dulce, Salvador-BA, Brasil
IVInstituto de Doenças Tropicais Natan Portela, Universidade Federal do Piauí, Teresina-PI, Brasil
VCentro de Ciências da Saúde, Universidade Federal do Maranhão, São Luís-MA, Brasil
VIFaculdade de Medicina, Universidade de Brasília, Brasília-DF, Brasil
RESUMO
O teste imunocromatográfico rápido IT-LEISH® (DiaMed IT-LEISH®) foi validado para o diagnóstico da leishmaniose visceral (LV) em quatro áreas endêmicas do Brasil. O desempenho do IT-LEISH® foi comparado ao da reação de imunofluorescência indireta; e ao da reação imunoenzimática, usando-se antígeno solúvel de Leishmania chagasi e recombinante K39 (rK39). O estudo incluiu 332 pacientes com quadro clínico sugestivo de LV: 213 casos de LV confirmados parasitologicamente; e 119 não-casos, com confirmação de outra etiologia. O teste IT-LEISH® apresentou sensibilidade de 93% e especificidade de 97%. As técnicas RIFI (imunofluorescência indireta), ELISA L. chagasi e ELISA rK39 apresentaram sensibilidade de 88%, 92% e 97% e especificidades de 81%, 77% e 84%, respectivamente. Os resultados confirmam a validade do teste IT-LEISH® para o diagnóstico da LV no Brasil.
Palavras-chave: IT-LEISH®; leishmaniose visceral; diagnóstico, Leishmania chagasi; antígeno rK39.
SUMMARY
The rapid immunochromatographic test IT-LEISH® (DiaMed IT-LEISH®) was validated for the diagnosis of visceral leishmaniasis (VL) in four endemic areas of Brazil. The performance of the IT-LEISH® was compared with that of the indirect fluorescent antibody test, and that of enzyme-linked immunosorbent assay, using soluble antigen of Leishmania chagasi and the recombinant K39 (rK39). The study group was composed by 332 patients with clinical suspicion of VL: 213 cases confirmed by parasitological tests; and 119 with confirmation of another etiology. The sensitivity of the test IT-LEISH® was of 93% and the specificity of 97%. Immunofluorescent antibody test, ELISA L. chagasi and ELISA rK39 showed sensitivity of 88%, 92%, and 97%, and specificity of 81%, 77%, and 84%, respectively. The results confirm the validity of the test IT-LEISH® for the diagnosis of the VL in Brazil.
Key words: IT-LEISH®; visceral leishmaniasis; diagnosis; Leishmania chagasi; rK39 antigen.
Introdução
A leishmaniose visceral (LV) é considerada pela Organização Mundial da Saúde (OMS) uma das doenças parasitárias de maior impacto sobre a Saúde Pública mundial, afetando, aproximadamente, 500.000 pessoas por ano em 65 países. Cerca de 90% dos casos notificados ocorrem em regiões pobres da Índia, Bangladesh, Nepal, Sudão e Brasil.1 A doença é causada por protozoários pertencentes ao complexo Leishmania donovani, sendo a Leishmania (Leishmania) chagasi a espécie responsável pela doença no Brasil, que registrou média anual de 3.642 casos notificados ao Ministério da Saúde nos últimos três anos.2 A apresentação clínica habitual caracteriza-se por febre prolongada, perda de peso, hepato-esplenomegalia e pancitopenia. Uma das preocupações atuais com a LV é sua elevada letalidade: próxima a 100% em pacientes não tratados. Mesmo com a instituição do tratamento, 1 a 5% dos afetados morrem como resultado da resistência à quimioterapia, pela toxicidade dos quimioterápicos; ou como conseqüência de complicações da doença, principalmente quando o diagnóstico é tardio.3 O diagnóstico clínico-epidemiológico da LV é insuficiente para justificar o tratamento, já que a apresentação clínica é comum a diversas outras patologias.4
Os exames parasitológicos são considerados métodos de referência no diagnóstico da LV, embora pressuponham procedimentos invasivos, requeiram laboratoristas experientes, sejam laboriosos e não apresentem sensibilidade ideal. A confirmação de LV pode ser feita pela demonstração direta em esfregaços ou cultivo do parasito obtido de baço, fígado, medula óssea ou linfonodos. A sensibilidade da pesquisa direta em esfregaços em lâmina varia de 95 a 98% para o aspirado de baço,5 76 a 91% para o de fígado, 52 a 89% para o de medula-óssea6 e 52 a 69% para o de linfonodos.6,7 O cultivo dos parasitos aumenta a sensibilidade da pesquisa (acima de 80%) mas pode retardar o diagnóstico em semanas.8
O diagnóstico molecular possibilita a detecção do DNA [deoxyribonucleic acid, ou ácido desoxirribonucleico (ADN)] do parasito mediante reação de polimerização em cadeia [polymerase chain reaction (PCR)], usando-se diversas amostras biológicas, tais como sangue e aspirado de medula. Na maioria das publicações, o método apresenta elevada sensibilidade (acima de 90%) e especificidade (100%).9,10 Ainda assim, sua realização é complexa e apresenta custo elevado.
O diagnóstico sorológico é favorecido pela expressiva resposta imune humoral que caracteriza a doença. A pesquisa de anticorpos, entretanto, deixa a desejar no que concerne à especificidade. Além disso, essas técnicas demandam tempo, equipamentos e laboratoristas treinados. A reação de imunofluorescência indireta (RIFI) tem sido amplamente usada no diagnóstico da LV desde 196411 e é o teste atualmente disponibilizado pelo Sistema Único de Saúde (SUS), com a desvantagem de requerer microscópio de imunofluorescência. Sensibilidade de 82 a 95% e especificidade de 78 a 92% são relatadas, dependendo da preparação antigênica e da espécie de Leishmania utilizadas.12,13 São também utilizados os métodos imunoenzimáticos [enzyme-linked immunosorbent assay (ELISA)], que empregam grande variedade de antígenos e têm sido avaliados desde 1971.14 Embora os valores de sensibilidade apresentem reprodutibilidade, variando entre 90 e 100%, os valores de especificidade são bastante inconsistentes, variando de 71 a 100%.15-17 O teste de aglutinação direta (DAT) é um dos testes mais simples e de baixo custo já desenvolvidos para o diagnóstico da LV, com sensibilidade de 91 a 100% e especificidade de 72 a 100%,17-19 tendo sido validado em diversas áreas endêmicas.
A baixa especificidade é a desvantagem comum aos métodos que utilizam antígenos não purificados, causada pela reatividade cruzada e persistência de anticorpos após a cura. Para tentar contornar esse problema, alguns antígenos purificados sintéticos ou recombinantes têm sido identificados. Entre eles, a proteína recombinante K39 (rK39), uma seqüência de 39 aminoácidos clonada da região quinase de Leishmania chagasi, complexo donovani-específico,20 tem sido a mais amplamente avaliada. Quando utilizada em métodos baseados em ELISA, ela resultou em sensibilidades de 93 a 99% e especificidades de 93 a 100%.17,21,22A mesma proteína foi utilizada em plataformas imunocromatográficas, que permitem execução simples e interpretação visual das reações, apresentando valores de sensibilidade e especificidade que variam de 67 a 100% e de 59 a 100%, respectivamente.4,23-25 Estudos de validação desses testes têm mostrado resultados variáveis, de acordo com a região geográfica do estudo, do produto e da metodologia empregada.4
O uso de métodos de diagnóstico sensíveis e específicos, de fácil execução e interpretação, que não necessitem de infra-estrutura laboratorial e profissionais especializados, deverá trazer benefício importante para o diagnóstico acurado e rápido da LV, principalmente nas localidades onde o acesso a exames laboratoriais mais complexos é limitado.
Com o objetivo de validar o teste imunocromatográfico rápido IT-LEISH® para o diagnóstico da leishmaniose visceral humana em beira de leito, realizou-se estudo multicêntrico com pacientes portadores de quadro clínico sugestivo da doença.
Metodologia
Trata-se de estudo multicêntrico realizado entre maio de 2005 e maio de 2007, conduzido, simultaneamente, em quatro Estados brasileiros: no Maranhão, pela Universidade Federal do Maranhão (UFMA); no Piauí, pela Universidade Federal do Piauí (UFPI); na Bahia, pelo Centro de Pesquisa Gonçalo Muniz, Fundação Oswaldo Cruz, Salvador-BA (CPqGM); e em Minas Gerais, pelo Centro de Pesquisa René Rachou, Fundação Oswaldo Cruz, Belo Horizonte-MG (CPqRR). Foram avaliados 213 casos e 119 não-casos de LV, incluindo, como sujeitos da pesquisa, pacientes portadores da síndrome clínica sugestiva de LV residentes em áreas endêmicas. Os pacientes foram examinados clinicamente e submetidos ao aspirado de medula óssea, à coleta de sangue periférico para realização de testes sorológicos e à punção capilar digital para realização da pesquisa de anticorpos anti-rK39 mediante o teste IT-LEISH®, cedido pela empresa Diamed Latino-America S.A (Lagoa Santa, Brasil). O diagnóstico parasitológico foi realizado pelos laboratórios de cada local de estudo. Os testes RIFI, ELISA L. chagasi e ELISA rK39 foram realizados no Laboratório de Pesquisas Clínicas do CPqRR.
A amostra foi calculada com base nos dados de um estudo-piloto realizado no CPqRR. Considerou-se sensibilidade estimada de 95%, especificidade estimada de 95%, nível de confiança de 95% e precisão de 4%. Foi calculado o mínimo de 115 pacientes em cada grupo. O estudo teve início simultâneo nos quatro centros. Foram incluídos pacientes que apresentaram febre acompanhada de, pelo menos, uma das seguintes alterações: esplenomegalia; hepatomegalia; anemia; leucopenia; ou plaquetopenia. Foram excluídos pacientes com qualquer uma das seguintes condições: imunodeficiência conhecida; uso de imunossupressores; história pregressa de LV; e ausência de definição de diagnóstico etiológico definitivo até o momento da análise dos resultados.
Foram considerados casos de LV os pacientes que apresentaram síndrome clínica sugestiva da doença e que tiveram a presença confirmada de Leishmania spp. em aspirado de medula óssea pelo exame do esfregaço corado ou por cultivo. Foram considerados não-casos de LV pacientes portadores de síndrome clínica sugestiva de LV, que apresentaram pesquisa de Leishmania spp. negativa no aspirado de medula óssea e confirmação de outra etiologia. A pesquisa direta de amastigotas em aspirado de medula óssea ou promastigotas no cultivo da amostra foi definida como método-referência.
Na pesquisa de Leishmania spp. em aspirado de medula óssea, as lâminas foram fixadas com metanol e imediatamente cobertas com solução de Giemsa. A leitura das lâminas coradas foi realizada em microscópio óptico – aumento de 100X. O aspirado de medula óssea foi cultivado em 3ml de meio NNN e 500µl de LIT a 26oC. A pesquisa de formas promastigotas de Leishmania spp. foi realizada a cada sete dias, durante 21 dias, em lâmina-lamínula em microscópio.
A reação de imunofluorescência indireta e as reações imunoenzimáticas usando-se antígeno solúvel de L. (L.) chagasi e antígeno recombinante K39 foram realizadas conforme descrito por Pedras e colaboradores.17
O DiaMed IT-LEISH® é um teste imunocromatográfico produzido pela DiaMed AG (Cressier sur Morat, Suíça) e distribuído pela DiaMed Latino América S.A., (Lagoa Santa, Minas Gerais, Brasil). O produto, que permite a detecção rápida de anticorpos contra Leishmania spp., é composto de uma membrana de nitrocelulose acoplada a uma bandeja destacável, uma ampola contendo tampão, uma lanceta, um tubo capilar plástico e álcool. Na membrana de nitrocelulose, são absorvidos o antígeno rK39, formando a linha-teste, e o anticorpo anti-IgG humano, constituindo a linha-controle. A bandeja destacável possui dois orifícios: o primeiro contém conjugado; e o segundo é reservado para lavagem da fita-teste. A realização do teste seguiu, estritamente, as instruções do fabricante. Resumidamente, cerca de 10μL de sangue, obtido beira do leito em cada local de estudo, foi transferido para o primeiro poço da bandeja destacável homogeneizado com uma gota de tampão por um minuto. Em seguida, a tira-teste foi colocada nesse poço verticalmente e o sangue diluído, absorvido pela membrana em fluxo ascendente. Após dez minutos, tira-teste foi lavada durante dez minutos em solução-tampão (quatro gotas), depositada previamente no segundo poço. A leitura visual foi realizada por três pesquisadores diferentes, participantes deste estudo. O teste foi considerado positivo quando foi possível visualizar as duas linhas, teste e controle; e negativo, quando somente a linha controle foi visualizada na membrana de nitrocelulose. Em ambos os casos, visualização da linha-controle, localizada logo acima da linha-teste, indicou que a execução do teste foi adequada. Os pesquisadores não tinham conhecimento do diagnóstico definitivo do paciente no momento da interpretação dos resultados.
O Microsoft Office Excel foi o aplicativo usado para a construção do banco de dados, contendo características epidemiológicas, clínicas e resultados dos exames laboratoriais. A análise estatística foi realizada pelo programa SPSS® 10.0.5 (SPSS, Inc., Chicago, Illinois, USA). Foram calculadas sensibilidade, especificidade e respectivos intervalos de confiança de 95% para todos os testes estudados. Para o cálculo dos valores preditivos, foi considerada a positividade de cada local de estudo. A concordância entre os testes sorológicos a reprodutibilidade da leitura do teste IT-LEISH® por três observadores independentes foi determinada pelo índice de Kappa e interpretada de acordo com Shrout:26 k<0,1, ausente; k=0,10 a 0,40, fraca; k=0,41 a 0,60, discreta; k=0,61 a 0,80, moderada; e k=0,81 a 1,00, substancial. O teste qui-quadrado foi empregado para comparação de proporções. O valor de significância adotado foi de p<0,05.
Considerações éticas e de boas práticas laboratoriais
As amostras clínicas foram colhidas, transportadas e analisadas segundo as regras das boas práticas de laboratório preconizadas pela Organização Mundial da Saúde27 e de acordo com as recomendações constantes do Manual de Vigilância e Controle da Leishmaniose Visceral, publicação da Secretaria de Vigilância em Saúde do Ministério da Saúde.28 A participação no estudo foi voluntária e todos os pacientes incluídos na pesquisa assinaram um termo de consentimento livre e esclarecido. O projeto de pesquisa foi aprovado pelos comitês de ética em pesquisa envolvendo seres humanos de todas as instituições de pesquisa envolvidas no estudo e cumpriu com as recomendações da Resolução do Conselho Nacional de Saúde No 196, de 10 de outubro de 1996, sobre pesquisa envolvendo seres humanos.
Resultados
Trezentos e trinta e dois pacientes foram incluídos no estudo: 213 casos de LV; e 119 não-casos. Cinqüenta e sete (17,2%) foram provenientes do CPqRR, 119 (35,8%) do CPqGM, 121 (36,4%) da UFPI e 35 (10,5%) da UFMA (Tabela 1). Setenta e dois pacientes foram excluídos do estudo por não preencherem os critérios de inclusão.
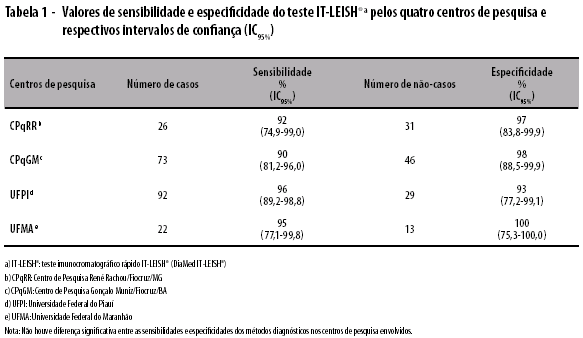
A média de idade dos pacientes foi de 12,7 anos (um mês a 76,8 anos) e 57,7% eram do sexo masculino. A média do tempo de sintomas do grupo 'Casos' foi de 53 dias (cinco a 360 dias; DP=56,1) e do grupo 'Não-casos' de LV foi de 71 dias (três a 720 dias, DP=135,8). Os portadores de LV apresentavam os seguintes sintomas e sinais: emagrecimento (83,3%); palidez (72,3%); tosse (41,1%); diarréia (26,9%); dor abdominal (49,6%); icterícia (13,7%); e sangramento (15,1%). Os sintomas e sinais apresentados pelos pacientes 'Não-casos' foram: emagrecimento (66,4%); palidez (86,2%); tosse (41,7); diarréia (22,2%); dor abdominal (44,8%); icterícia (22,5%); e sangramento (23,4%).
A sensibilidade do teste IT-LEISH® variou de 90 (81,2-96,0) a 96% (89,2-98,8) entre os diferentes centros de pesquisa participantes, enquanto a especificidade variou de 93 (77,2-99,1) a 100% (75,3-100). Não houve diferença significativa na sensibilidade e especificidade observadas pelos centros de pesquisa envolvidos (Tabela 1).
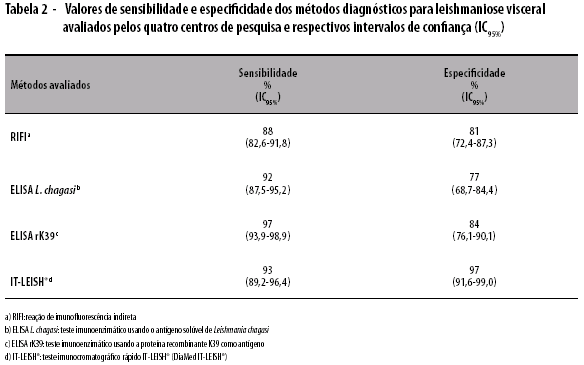
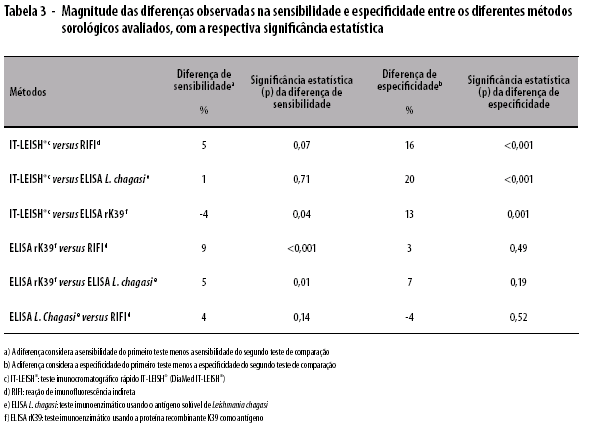
Quando analisada a amostra total, o teste IT-LEISH® apresentou sensibilidade de 93% (89,2-96,4) e especificidade de 97% (91,6-99,0). No total, a sensibilidade dos métodos avaliados variou de 88 (82,6-91,8) a 97% (93,9-98,9), enquanto os valores de especificidade variaram de 77 (68,7-84,4) a 97% (91,6-99,0). As técnicas de ELISA L. chagasi e IT-LEISH® apresentaram sensibilidades semelhantes: 92% (87,5-95,2) e 93% (89,2-96,4), respectivamente (Tabela 2). Diferença significativa foi observada entre os valores de sensibilidade de IT-LEISH® (93%) e ELISA rK39 (97%) (p=0,04), ELISA rK39 (97%) e ELISA L. chagasi (92%) (p=0,01), ELISA rK39 (97%) e RIFI (88%) (p<0,001). Com relação à especificidade, observou-se diferença significativa entre IT-LEISH® (97%) e ELISA rK39 (84%) (p=0,001), ELISA L. chagasi (77%) (p<0,001) e RIFI (81%) (p<0,001) (Tabela 3).
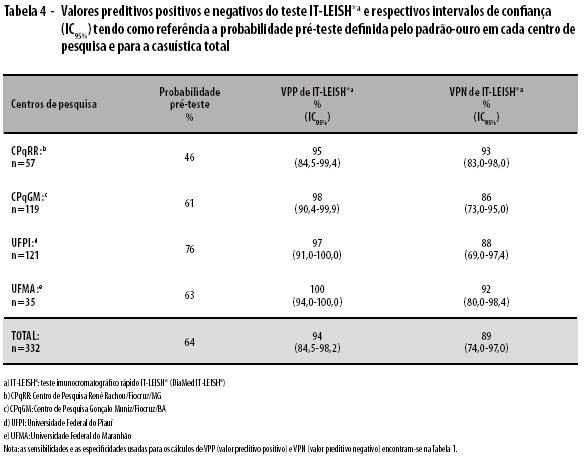
Quatorze amostras apresentaram reações falsas-negativas e quatro apresentaram reações falsas-positivas com o teste IT-LEISH®. Os valores preditivos positivo (VPP) e negativo (VPN) do teste IT-LEISH® são apresentados na Tabela 4. Usando-se a positividade do grupo de pacientes estudados em cada localidade, o VPP variou de 95 (84,5-99,4) a 100% (94,0-100); e o VPN, de 86 (73,0-95,0) a 93% (83,0-98,0). O teste IT-LEISH® apresentou VPP de 94% (84,5-98,2) e VPN de 89% (74,0-97,0), quando avaliado para o total de pacientes dos quatro centros.
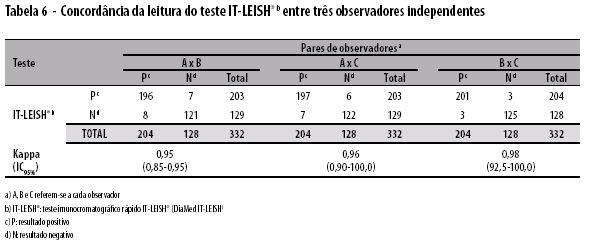
O índice Kappa mostrou concordância classificada como 'moderada' entre IT-LEISH® e os demais métodos sorológicos avaliados (Tabela 5). Concordância 'substancial' foi observada na avaliação da leitura do teste IT-LEISH® por pares de observadores (Tabela 6).

Discussão
Embora o avanço tecnológico ocorrido no século XX tenha resultado em uma variedade de técnicas laboratoriais que significaram importante contribuição ao diagnóstico de doenças em geral e das infecciosas em particular, o diagnóstico da LV avançou pouco nas últimas décadas, provavelmente por duas razões principais: por se tratar de doença negligenciada, que prevê pequeno retorno comercial ao investimento em pesquisa e desenvolvimento e pela complexidade biológica própria da infecção.
No Brasil, o Programa Nacional de Controle de Leishmanioses, coordenado pela Secretaria de Vigilância em Saúde do Ministério da Saúde, recomenda que o diagnóstico da LV seja realizado por métodos parasitológicos, preferencialmente o exame miscroscópico de aspirado de medula e, alternativamente, usando-se técnicas baseadas na detecção de anticorpos: RIFI ou ELISA. Atualmente, o kit de RIFI é produzido por Biomanguinhos, unidade da Fundação Oswaldo Cruz no Rio de Janeiro-RJ, e distribuído pelo Ministério da Saúde para laboratórios públicos locais e nacionais. Esse método, entretanto, requer microscópio de imunofluorescência e profissional treinado para sua execução, tornando o diagnóstico lento e difícil.
Frente à complexidade do diagnóstico da LV, métodos laboratoriais de fácil realização e interpretação e que forneçam resultado rápido são cada vez mais necessários. Testes de imunocromatografia de fluxo lateral para ao diagnóstico da LV usando-se o antígeno rK39 têm sido avaliados em vários países, com sensibilidade e especificidade variáveis.
No presente estudo, a sensibilidade do método ELISA usando-se o antígeno rK39 foi superior à obtida com o teste imunocromatográfico rápido IT-LEISH®. A especificidade desse teste, entretanto, foi superior à dos demais métodos avaliados, que não apresentaram diferença significativa entre si. É importante ressaltar que o padrão-ouro utilizado é imperfeito e que foram excluídos da análise 61 pacientes que apresentavam quadro clínico compatível e sorologia positiva para LV, embora o resultado de seu exame parasitológico fosse negativo. Considerando-se que os pacientes com LV não detectados pelo padrão-ouro são aqueles que apresentam, presumivelmente, menor carga parasitária, seria razoável esperar que também apresentassem menor intensidade na resposta de anticorpos. Se essa premissa for verdadeira, o resultado da sensibilidade do teste IT-LEISH® pode estar superestimado. Na prática, entretanto, é comum a observação de sucesso de testes terapêuticos com drogas leishmanicidas em pacientes com resultados parasitológicos negativos na medula óssea e que apresentam diagnóstico sorológico positivo. Esse fato sugere que pelo menos alguns desses pacientes realmente apresentam LV e a imperfeição do padrão-ouro pode, inclusive, ter prejudicado tanto a sensibilidade quanto a especificidade do novo teste avaliado. As limitações na interpretação dos resultados decorrentes da imperfeição do padrão-ouro ressaltam a necessidade de mais pesquisas na área de diagnóstico da LV, com o objetivo de aprimorar as abordagens metodológicas utilizadas em estudos de validação de métodos diagnóstico.
Os valores de sensibilidade (93%) e especificidade (97%) verificados para o teste IT-LEISH® aproximam-se de dados obtidos em outros estudos que, ao avaliarem a detecção de anticorpos anti-rK39, observaram valores de sensibilidade variando de 90 a 100%; e de especificidade, de 93 a 100%.4,23-25 Na literatura, contudo, há relatos de pior desempenho de testes imunocromatográficos, como a sensibilidade de 80% comparada com a de 86% para RIFI em estudo realizado no Kuwait;29 ou a comparação do TRALd® (Teste Rápido Antígeno para L. donovani) com o ELISA rK39 e com o DAT em 55 pacientes com LV confirmada no Sudão, com sensibilidades de 67%, 100% e 91%, respectivamente.30 No Brasil, o TRALd® foi comparado ao DAT com antígeno liofilizado, em número pequeno de casos, com sensibilidade de 85,7% e 100% e especificidade de 82% e 100%, respectivamente.31 Baixa sensibilidade de testes imunocromatográficos usando-se o antígeno rK39 também foi relatada em estudo realizado no Sudão.30 Outros autores sugerem que o formato do teste poderia ser a causa da baixa sensibilidade, bem como diferenças entre subespécies do complexo donovani, diferenças genéticas individuais ou raciais e diferenças de regionais geográficas e ecológicas.4
Os elevados valores preditivos positivo e negativo encontrados por este estudo referem-se a valores de positividade detectada pelo padrão-ouro entre os pacientes que procuraram os serviços especializados com quadro sugestivo de LV e são válidos para essas condições de atenção à saúde. Os dados devem ser interpretados com cautela, não devendo ser extrapolados para situações de levantamentos epidemiológicos ou para pacientes que não apresentem quadros clínicos compatíveis com LV. A concordância observada na avaliação da leitura do teste IT-LEISH® por pares de observadores demonstra sua adequada reprodutibilidade.
O estudo validou o uso do teste IT-LEISH® para o diagnóstico da leishmaniose visceral em beira de leito, em pacientes que apresentavam quadro clínico sugestivo de LV sem infecção concomitante pelo vírus da imunodeficiência humana (HIV). Os resultados obtidos permitem recomendar o teste IT-LEISH® para diagnóstico rápido de LV com o devido acompanhamento de sua implantação nos serviços de saúde, para avaliar seu desempenho em condições de uso rotineiro. Os dados obtidos por este estudo de validação também permitirão a realização de avaliações de custo-efetividade, para fortalecer a tomada de decisão sobre a implantação do método nos serviços.
Referências bibliográficas
1. World Health Organization. Strategic Direction for Research – Leishmaniasis [monograph on the Internet]. Geneva: WHO; 2005 [cited 2007 Dec. 12]. Available from: http://www.who.int/tdr/diseases/leish/ direction.htm
2. Secretaria de Vigilância em Saúde. Brasil, 2007 [monografia na Internet]. Brasília: Minisério da Saúde; 2006 [acessado 12 dez. 2007]. Disponível em: http://dtr2004.saude.gov.br
3. Berman JD. Human leishmaniasis: clinical, diagnostic and chemotherapeutic developments in the last years. Clinical Infectious Diseases 1997; 24:684-703.
4. Ritmeijer K, Melaku Y, Mueller M, Kipngetich S, O'Keeffe C, Davidson RN. Evaluation of a new recombinant K39 rapid diagnostic test for Sudanese visceral leishmaniasis. The American Journal of Tropical Medicine and Hygiene 2006;74:76-80.
5. Chulay JD, Bryceson AD. Quantitation of amastigotas of Leishmania donovani in smears of splenic aspirates from patients with visceral leishmaniasis. The American Journal of Tropical Medicine and Hygiene 1983;32:475-479.
6. Zijlstra EE, Siddig AM, El-Hassan AM, El-Toum IA, Satti M, Ghalib HW, Kager PA. Kala-azar: a comparative study of parasitological methods and the direct agglutination test in diagnosis. Transactions of the Royal Society of Tropical Medicine and Hygiene 1992;86:505-507.
7. Siddig M, Ghalib H, Shillington DC, Petersen EA. Visceral leishmaniasis in the Sudan: comparative parasitological methods of diagnosis. Transactions of the Royal Society of Tropical Medicine and Hygiene 1988;82:66-80.
8. Guerin PJ, Olliaro P, Sundar S, Boelaert M, Croft SL, Desjeux P, Wasunna MK, Brycesosn ADM. Visceral leishmaniasis: current status of control, diagnosis and treatment, and a proposed research and development agenda. The Lancet 2002;83:93-101.
9. Wu Z, Bao Y, Yu M, Lu L, Zhang, Y. An experimental study on application of PCR in detection of Kala-azar. Southeast Asian Journal of Tropical Medicine & Public Health 1997;28:167-172.
10. Disch J, Maciel FC, Oliveira MC de, Orsini M, Rabello A. Detection of circulating Leishmania chagasi DNA for the non-invasive diagnosis of human infection. Transactions of the Royal Society of Tropical Medicine and Hygiene 2003;97:1-5.
11. Duxbury RE, Sadun EH. Fluorescent antibody test for the serodiagnosis of visceral leishmaniasis. American Journal of Tropical Medicine and Hygiene 1964;13:525-529.
12. Cahil, KM. Field technique in the diagnosis of calazar. Transactions of the Royal Society of Tropical Medicine and Hygiene 1970;83:499.
13. Sengupta PC. Immunodiagnosis of Kala-zar. Transactions of the Royal Society of Tropical Medicine and Hygiene 1969;63:46.
14. Ho M, Leeuwenburg J, Mbugua G, Wamachi A, Voller A. An enzyme-linked immunosorbent assay (ELISA) for field diagnosis of visceral leishmaniasis. American Journal of Tropical Medicine and Hygiene 1983;32:943-946.
15. Bray RS. Immunodiagnosis of leishmaniasis. In: Cahng KP, Bray RS. Leishmaniasis. Amsterdam: Elsevier Science Publishers; 1985.
16. Choudhry A, Guru PY, Saxena RP, Tandon A, Saxena KC. Enzyme linked immunosorbent assay in the diagnosis of Kala-zar in Bhadohi (Varanasi), India. Transactions of the Royal Society of Tropical Medicine and Hygiene 1990;84:363-366.
17. Pedras MJ, Viana LG, Oliveira EJ de, Rabello A. Comparative evaluation of direct agglutination test, rk39 and soluble antigen-ELISA and RIFI for the diagnosis of visceral leishmaniasis in Brazil. Transactions of the Royal Society of Tropical Medicine and Hygiene 2008; 102:172-178.
18. Harith A, Kolk AH, Kager PA, Leeuwenburg J, Muigai R, Kiugu S, Laarman JJ. A simple and economical direct agglutination test for serodiagnosis and seroepidemiological studies of visceral leishmanisis. Transactions of the Royal Society of Tropical Medicine and Hygiene 1988;1321-1325.
19. Sundar S, Sing GS, Singh VP, Singla N, Kumar K, Vinayak VK. Comparative evaluation of DAT, IFAT and micro-ELISA in the serodiagnosis of Indian Kala-azar. Journal of Parasitic Disease 1996;20:41-43.
20. Burns JM, Schreffler WG, Benson DR, Ghalib HW, Badaró R, Reed SG. Molecular characterization of a Kinesis-related antigen of Leishmania chagasi that detects specific antibody in African and American visceral leishmaniasis. Proceedings of the National Academy of Sciences of the United States of America 1993;90:775-779.
21. Zijlstra EE, Daifalla NS, Kager PA, Khalil EAG, El- Hassan AM, Reed SG, Ghalib HW. rk39 enzyme-linked immunosorbent assay for diagnosis of Leishmania donovani infection. Clinical and Diagnostic Laboratory Immunology 1998;5:717-720.
22. Braz RFS, Nascimento ET, Martins DRA, Wilson ME, Pearson RD, Reed SG, Jeronimo SMB. The Sensitivity and specificity of Leishmania chagasi recombinant K39 antigen in the diagnosis of american visceral leishmaniasis and in differentiating active from subclinical infection. American Journal of Tropical Medicine and Hygiene 2002;67:344-348.
23. Sundar S, Reed SG, Singh R, Kumar PC, Murray HW. Rapid accurate field diagnosis of Indian visceral leishmaniasis. Lancet 1998;351:563-565.
24. Bern C, Jha SN, Joshi AB, Thakur GD, Bista MB. Use of the recombinant K39 dipstick test and the direct agglutination test in a setting endemic for visceral leishmaniasis in Nepal. American Journal of Tropical Medicine and Hygiene 2000;63:153-157.
25. Carvalho SF, Lemos EM, Corey R, Dietze R. Perfomance of recombinant K39 antigen in the diagnosis of Brazilian visceral leishmaniasis. American Journal of Tropical Medicine and Hygiene 2003;68:321-324.
26. Shrout P. Measurement reliability and agreement in psychiatry. Statistical Methods in Medical Research 1998;7:301-317.
27. Handbook: good laboratory [monography on the Internet]. Geneva: WHO [cited 2007 Jul. 11]. Available from: http://www.who.int/tdr/publications
28. Secretaria de Vigilância em Saúde. Manual de vigilância e controle da Leishmaniose Visceral [monografia na Internet]. Brasília: Ministério da Saúde; 2006 [acessado 11 ju. 2007]. Disponível em: http://portal.saude.gov.br/portal/arquivos/pdf/leish_ visceral_serie_2006.pdf
29. Iqbal J, Hira PR, Saroj G, Philip R, Al-Ali F, Madda PJ, Sher A. Imported visceral leishmaniasis: diagnostic dilemmas and comparative analysis of three assays. Journal of Clinical Microbiology 2002;40:475-479.
30. Zijlstra EE, Nur Y, Desjeux P, Khalil EA, El-Hassan AM, Groen J. Diagnosing visceral leishmaniasis with the recombinant K39 strip test: experience from the Sudan. Transactions of the Royal Society of Tropical Medicine and Hygiene 2001;6:108-113.
31. Schallig HD, Canto-Cavalheiro M, Silva ES da. Evaluation of the direct agglutination test and the rK39 dipstick test for the serodiagnosis of visceral leishmaniasis. Memórias do Instituto Oswaldo Cruz 2002;97:1015-1018.
 Endereço para correspondência:
Endereço para correspondência:
Av. Augusto de Lima, 1715, Barro Preto,
Belo Horizonte-MG, Brasil
CEP: 30190-002
E-mail:ana@cpqrr.fiocruz.br
Recebido em 18/08/2007
Aprovado em 03/01/2008
*Pesquisa financiada com recursos da Secretaria de Vigilância em Saúde do Ministério da Saúde e do Conselho Nacional de Desenvolvimento Científico e Tecnológico do Ministério da Ciência e Tecnologia.












 Curriculum ScienTI
Curriculum ScienTI
