Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Epidemiologia e Serviços de Saúde
versión impresa ISSN 1679-4974versión On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.19 n.2 Brasília jun. 2010
http://dx.doi.org/10.5123/S1679-49742010000200003
Ecologia de Haemagogus e Sabethes (Diptera: Culicidae) em áreas epizoóticas do vírus da febre amarela, Rio Grande do Sul, Brasil*
Ecology of Haemagogus and Sabethes (Diptera: Culicidae) Mosquitoes in epizootic yellow fever regions of Rio Grande do Sul State, Brazil
Almério de Castro GomesI; Maria Amélia Nascimento TorresII; Marcia Bicudo de PaulaI; Aristides FernandesI; Ana Maria MarassáIII; Cleide Aschenbrenner ConsalesIV; Daltro Fernandes FonsecaII
IDepartamento de Epidemiologia, Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo-SP, Brasil
IICentro Estadual de Vigilância em Saúde, Secretaria de Estado da Saúde, Governo do Estado do Rio Grande do Sul, Porto Alegre-RS, Brasil
IIISeção de Parasitoses Sistêmicas, Instituto Adolfo Lutz, São Paulo-SP, Brasil. Doutoranda do Departamento de Epidemiologia, Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo-SP, Brasil
IVLaboratório de Imunologia, Instituto Pasteur, São Paulo-SP, Brasil
RESUMO
Objetivou-se com este estudo investigar característica ecológica e o hábito alimentar de Haemagogus e Sabethes em área epizoótica da febre amarela silvestre em duas localidades do Rio Grande do Sul, capturados com aspirador, armadilha de Shannon e puçá. Para identificação do sangue ingerido pelas fêmeas foi utilizada a técnica imunoenzimática ELISA de captura. Obteve-se maior atividade de Hg. leucocelaenus na primavera e outono, entre 12 e 17 horas, enquanto Sabethes albiprivus e Sa. quasycianus durante todo o ano. Para fêmeas de Hg. leucocelaenus em Santo Antônio das Missões, houve predomínio de sangue humano e para as demais espécies destaca-se a atratividade para bovinos nos dois municípios. A capacidade vetorial do Hg. leucocelaenus fundamenta vigilância entomológica em seu papel de estratificar áreas problemas ou a sustentabilidade do programa de imunização da população.
Palavras-chave: febre amarela silvestre; epizootia; hábito alimentar; Haemagogus e Sabethes.
SUMMARY
The study was conducted in epizootic areas of sylvatic yellow fever in two municipalities in Rio Grande do Sul State, with the objective to investigate ecological characteristics of Haemagogus and Sabethes mosquitoes. Mosquitoes were collected using Shannon traps and insect nets. The host-feeding pattern was tested by an enzyme-linked immunosorbent assay. The highest activity levels were observed for Hg. leucocelaenus during spring and autumn, between 12 and 17 hours, while Sabethes albiprivus and Sa. quasycianus were common throughout the year. The blood of females of Hg. leucocelaenus at one municipality, Santo Antonio das Missoes, was of human origin. Considering the other species, in both municipalities of the study, bovine blood was predominant. The vectorial capacity of Hg. leucocelaenus justifies the entomological surveillance in order to stratify problematic areas or the sustainability of an immunization program.
Key words: sylvatic yellow fever; epizootic area; feeding behavior; Haemagogus and Sabethes.
Introdução
O vírus da febre amarela vem sendo identificado no Brasil, de Norte ao Sul, com manifestações de ocorrências epizoóticas cíclicas, casos humanos e isolamento do vírus de mosquitos Haemagogus janthinomys e Haemagogus leucocelaenus.1-3
Diversas circulações do vírus amarílico emergem sob diferentes feições paisagísticas entre primata não humano e humano, sendo a forma silvestre de exposição das pessoas aos mosquitos infectados a mais comum, mas dependente do estado de susceptibilidade em que se encontra e de seus deslocamentos para focos silvestres do vírus. Apesar de o Aedes aegypti estar amplamente disseminado nos estados brasileiros, a forma urbana da doença permanece não registrada por várias décadas, significando que seus vetores naturais têm baixa capacidade para transportá-los além das matas. Preocupa-se com Aedes albopictus face ao potencial para formar um elo entre esses dois ambientes.4
No Brasil, Hg. janthinomys é encontrado da Amazônia ao Sudeste, notadamente até Minas Gerais, enquanto Hg. leucocelaenus, se estende de Norte a Sul.5 Assim sendo, a exposição humana ao vírus está assegurada pela antropofília e capacidade vetorial por extensas áreas do território brasileiro.
Do ponto de vista ecológico essas duas espécies parecem diferenciar-se pelo grau de tolerância às ações antrópicas, uma vez que a primeira estabelece-se em matas mais úmidas e preservadas, enquanto a segunda mostra aptidão para distribuir-se por ambientes sob condições adversas de uso do solo. Também, parece dispersar-se por até seis km.4
Espécies do gênero Sabethes encontram-se presentes nos habitats dos Haemagogus, porquanto Sabethes chloropterus, vetora com destaque epidemiológico, tem sido pouco assinalada nos estudos mais recentes sugerindo baixa capacidade adaptativa nas áreas com elevada devastação.6 As espécies predominantes como Sa. albiprivus e Sa. glaucodemon, comuns em focos epizoóticos do vírus da febre amarela, pouco se sabe de suas participações nesses ciclos.7
Registram-se anualmente no Brasil casos isolados de febre amarela silvestre (FAS) por 19 estados, manifestando-se de forma cíclica a cada 5 a 7 anos, consequentes às epizootias em primatas não humanos. No período de 2000 a 2009 foram registrados 320 casos de FAS, com 152 óbitos distribuídos por 15 estados, destacando-se os anos de 2007 a 2009 com 105 casos e 53 óbitos (Sinan/SVS/MS), envolvendo os estados de Goiás, Minas Gerais, São Paulo, Paraná e Rio Grande do Sul. Este quadro alerta para mudanças no padrão de ocorrência temporal e espacial da FAS. Infelizmente não existem estudos que expliquem uma possível nova feição dessa doença no Brasil e as razões de um perfil epidemiológico que revela alteração nos tradicionais intervalos inter-epidêmicos ou epizoóticos.
O Sistema de Vigilância para a FAS, baseado em eventos epizoóticos envolvendo primatas não humanos e a imunização rápida das pessoas expostas, geralmente residentes em áreas com ausência ou baixa cobertura vacinal, tem sido insuficientes para interromper o processo de transmissão da FAS entre humanos. Este cenário apresenta um desafio que seria ter uma cobertura vacinal capaz de evitar surpresas, por vezes, de vários casos humanos, particularmente nas áreas fora do bioma amazônico. Portanto, se o critério do uso da vacina contraria o desafio acima, a pretensão de vacinar todos os residentes antes da re-emergência do vírus, exige conhecimento de um modelo de predição mais sensível, baseada na clareza do que possa ser área de risco para a FAS.
Chama atenção na vigilância da FAS a ausência de estudos ecológicos dos vetores e vírus nas suas dinâmicas de inter-relacionamentos, particularmente referentes aos mecanismos de sobrevivência dos vírus nos períodos inter-epizoóticos centrados na transmissão vertical transovariana e nas inter-relações dos vetores com outros hospedeiros animais não primatas.8 A identificação da infecção natural de Hg. janthinomys e Hg. leucocelaenus e outros artrópodes não é sistemático, mas sim durante eventos epizoóticos, fato utilizado apenas na incriminação vetorial da espécie.1,2 Corrobora com essa afirmação o registro de outros culicídeos portando o vírus, como Aedes scapularis e Psorophora ferox, em eventos epizoóticos, sem nenhuma investigação posterior do papel dessas espécies nos focos da FAS.7 Assim sendo, necessita-se conhecer as relações ecológicas do vírus à luz dos estudos biomoleculares incluindo espécies exóticas como Aedes albopictus que invade os nichos ecológicos do vírus amarílico, sem qualquer preocupação em monitorá-lo.4 Portanto, o que poderia ser indicadores para cobertura vacinal não é considerado no sistema de vigilância da FAS.
Objetivou-se com este estudo investigar as características ecológicas e os hábitos alimentares de Haemagogus e Sabethes em área epizoótica da febre amarela silvestre em duas localidades do Rio Grande do Sul, onde ocorreram epizootias do vírus da febre amarela em macacos do gênero Alouatta.
Metodologia
Na região noroeste do Rio Grande do Sul, normalmente a vegetação de floresta está distribuída em formações pouco extensas e separadas uma das outras por áreas abertas, onde se cultiva plantas rotativas (cereais) ou usadas pela pecuária. A hipótese é de que esses habitats abrigam baixa diversidade e densidade de culicídeos, principalmente aos pertencentes ao gênero Haemagogus.
Baseado em registro de eventos epizoóticos,9 foram escolhidos os Municípios de Santo Antônio das Missões (28o30'39"S e 55o13'40"O) e Garruchos (28o11'01"S e 55o38'20"O). Os locais de trabalho corresponderam às áreas rurais denominadas Distrito de Cerro Ouro no primeiro município e fazenda chamada de Cachoeirinha situada à margem do Rio Uruguai e outra localizada a 5km desse local, denominado Distrito São José, ambos no Município de Garruchos. Em Cerro Ouro, foi investigada a área urbanizada e a mata, enquanto em Cachoeirinha e no Distrito São José, apenas a mata. A captura em São José foi exclusivamente para exame do conteúdo sanguíneo das fêmeas de culicídeos uma vez que o tempo e o número de técnicos envolvidos no trabalho de campo eram insuficientes para a realização das capturas de 13 horas.
Nas capturas dos mosquitos foram utilizadas as técnicas de aspiração, armadilha de Shannon e puçá de adultos em vôos, nos abrigos silvestres e peridomiciliares. O período do estudo foi de setembro de 2005 a agosto de 2006. As atividades nos dois municípios foram desenvolvidas durante uma semana de cada mês com o horário de captura padronizado de hora em hora para armadilha de Shannon e 15 minutos para a técnica aspiração.
Para a armadilha de Shannon os locais de capturas foram à margem e o interior da mata, começando às sete horas e terminando às 20 horas, operada por dois técnicos, portando um puçá, um no interior e outro externo à armadilha. Utilizou-se um lampião a partir do crepúsculo vespertino. A cada hora os adultos capturados foram colocados numa caixa entomológica rotulada conforme local e hora para identificação posterior no Laboratório de Entomologia da Faculdade de Saúde Pública/USP.,
A aspiração compreende um tubo de sucção acionado por bateria onde os mosquitos eram retidos por um puçá interno.10 Executada mensalmente com duração de duas horas ou a soma de oito capturas de 15 minutos por mês na localidade Cachoeirinha e 12 em Cerro Ouro devido à inclusão de peridomicílios. Esses pertenciam a habitações distribuídas num transecto da mata ao centro de Cerro Ouro. Os mosquitos adultos dos puçás foram mortos sob vapor de clorofórmio e preservados em caixas entomológicas rotuladas. Houve o descarte dos demais insetos capturados. Todas as capturas de mosquito transcorreram apenas ao nível do solo. Os espécimes Culicidae ingurgitados foram colocados individualmente em tubos de 1,5ml, preservados a frio até chegar ao laboratório, onde permaneceram a - 20oC até o momento do teste.
O ensaio imunoenzimático ELISA de captura foi realizado no período de setembro de 2005 a abril de 2007, em Santo Antônio das Missões e no período de setembro de 2005 a março de 2007, em Garruchos. Os exemplares congelados, bem como os controles, foram macerados em 750ul de solução salina tamponada com fosfatos 0,01M, ph7.2 (Na2HPO4, KH2PO4, NaCl) acrescido de gelatina 0,1% (DIFCO) (PBS-gelatina). A seguir foram centrifugados a 10.000g, por dez minutos e os sobrenadantes colhidos para a realização do teste. Para o controle positivo utilizaram-se fêmeas (14 exemplares) ingurgitadas nas respectivas fontes analisadas, e para o controle negativo utilizaram-se 14 exemplares machos. Os exemplares ingurgitados e identificados foram testados para verificação de sangue ingerido no conteúdo abdominal de possíveis fontes suscetíveis. Foram testadas seis fontes alimentares: ave, bovino, equino, humano, macaco e rato. Os anticorpos de captura utilizados no teste foram: anti-ave IgG (H+L) (61-3100, Zymed, USA) lote no 10364141; anti-bovino IgG (H+l) (01-12-06 Kirkegaard & Perry (KPL), USA) lote no ZJ044; anti-equino IgG (H+L) (01-21-06, KPL, USA) lote no ZA031; anti-humano IgG (γ) (62-8400, Zymed, USA) lote no 51202564; anti-macaco IgG (γ) (617-101-012, Rockland,USA) lote no 16324, anti-rato IgG (H+L) (62-9500, Zymed, USA) lote no 31079948 e anti-humano IgG1(05-3300, Zymed, USA).
Os conjugados biotinilados adicionados ao teste foram: anti-ave IgG (H+L) (61-3140, Zymed, USA) lote no 00861444; anti-bovino IgG (H+L) (16-12-06 KPL, USA) lote no WJ139; anti-equino IgG (h+L) (16-21-06 KPL, USA) lote no XH048; anti-humano IgG (γ) (628440, Zymed, USA) lote no 51000935R; anti-macaco IgG (γ) (617-106-012, Rockland, USA) lote no 17692; anti-rato IgG (B7139, Sigma, USA e anti-humano IgG1(05-3340, Zymed, USA) lote no 60706099).
A técnica empregada para determinar a presença de sangue ingerido no conteúdo abdominal foi o ELISA de captura no sistema avidina-biotina.11,12
Microplacas de 96 cavidades de fundo chato de alta afinidade (Nunc®, Maxisorp, Denmark) foram sensibilizadas com 50µL/cavidade de anti IgG de cada fonte pesquisada, na concentração de 1,25µg/mL diluídas em solução salina tamponada (PBS 0,1%) e incubadas a 4oC por 18 horas. Após este período, as placas foram lavadas com PBS-Tween20 por cinco vezes e os sítios livres, bloqueados com 200µL/cavidade com PBS-gelatina 1%, por três horas à temperatura ambiente.
Após este período e a cada etapa da reação, foram realizadas lavagens, como mencionado anteriormente, sendo a seguir adicionados 50µL/cavidade dos sobrenadantes das amostras, em duplicata, e dos controles positivo e negativo, sendo as microplacas incubadas a 4oC por 18 horas.
A seguir, acrescentou-se 50µL/cavidade de anti-IgG biotinilado da fonte a ser pesquisada na concentração de 1µg/mL e as placas foram incubadas por uma hora em temperatura ambiente. Após a incubação e lavagem, foram adicionados 50µL/cavidade de avidina-fosfatase alcalina (A7294, Sigma, USA), na diluição de 1:40.000, permanecendo por mais uma hora à temperatura ambiente.
Como última etapa, foram adicionados 50µL/cavidade do substrato P-nitrophenil-phosphastase disodium (PNPP,#104-105, Sigma, USA) na concentração de 1mg/mL diluído em tampão dietanolamina acrescido de 0,05mmol/L MgCl2 (MERCK). A reação foi interrompida após 30 minutos, com adição de 100µL/cavidade de NaOH 3N/cavidade e a leitura realizada em leitor de ELISA (Multiskan®) em comprimento de onda 405nm. As amostras reagentes para humano e macaco, respectivamente, foram refeitas com a sub-classe IgG1 humano e a concentração utilizada para a sensibilização das placas foi 5µg/mL e para o conjugado biotinilado, utilizou-se a mesma concentração das demais fontes.12
O ponto de corte da reação foi estipulado pelo emprego de três vezes o valor da média do branco de cada placa, do dia em que foi realizado o teste.
A comparação das frequências do sangue ingerido pelos espécimes de culicídeos capturados foi feita pelo teste de Qui-Quadrado (χ2) para proporções. Os resultados foram analisados em nível de significância 5% (p<0,050) e utilizou-se o programa MS-Excel em sua versão Windows XP para a obtenção dos resultados.
Resultados
Apresenta-se na tabela 1 o resultado das coletas de mosquito Culicidae durante os 12 meses de atividade. A distribuição dos espécimes foi de 5.756 para Santo Antônio das Missões e 4.290 para Garruchos. Na lista de espécie Culicidae consta de representantes participativos nos ciclos vitais de agentes infecciosos. Em termos de predominância sobressaíram Ae. scapularis (42,2%), Hg. leucocelaenus (8,5%), Ps. ferox (6,9%) e Sa. quasicyaneus (6,8%).
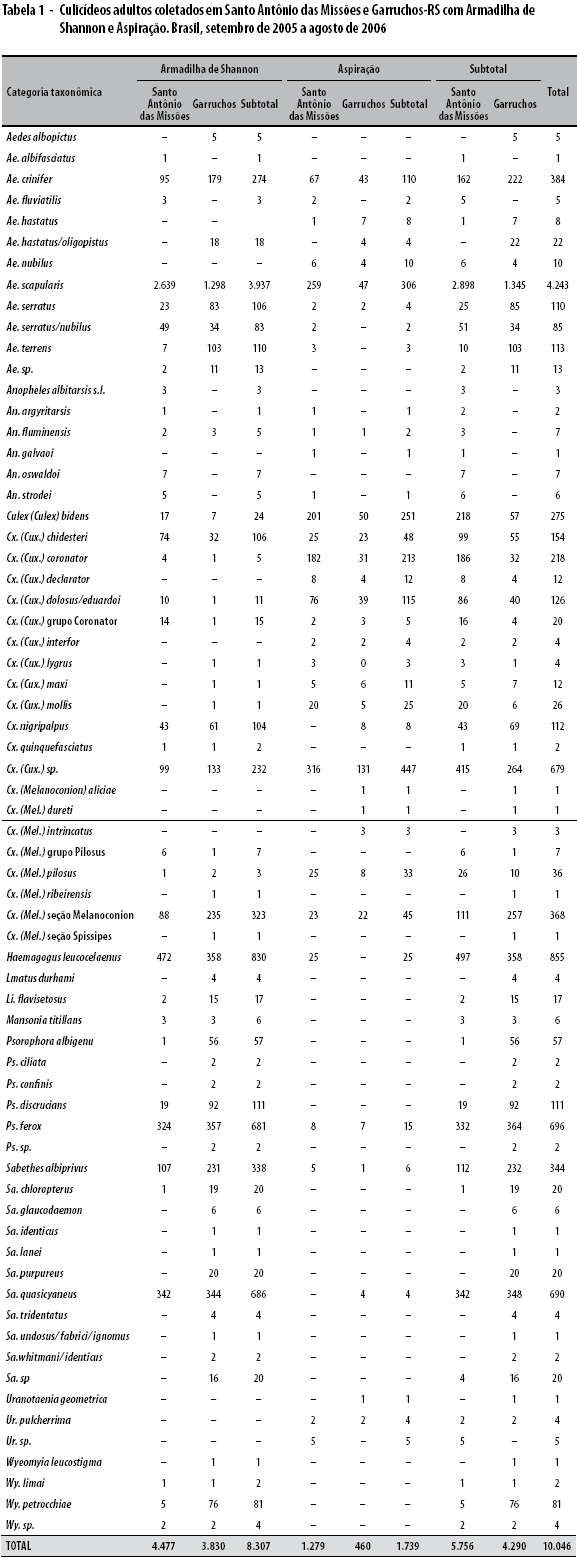
Da composição conhecida foram escolhidas cinco espécies como medidas de sazonalidade (Tabela 2). A primeira anotação é que as espécies tiveram reprodução diferenciada segundo a estação. Por exemplo, Ae. scapularis foi mais abundante no outono e inverno, enquanto Hg. leucocelaenus apresentou dois momentos, sendo observado o maior em outubro, o qual correspondeu a estação primavera e outro em abril quando já era outono. Para Sabethes a estação primavera foi a mais representativa nas duas localidades trabalhadas. Para Hg. leucocelaenus, quase não houve divergência numérica quando as coletas foram iguais para os dois municípios.
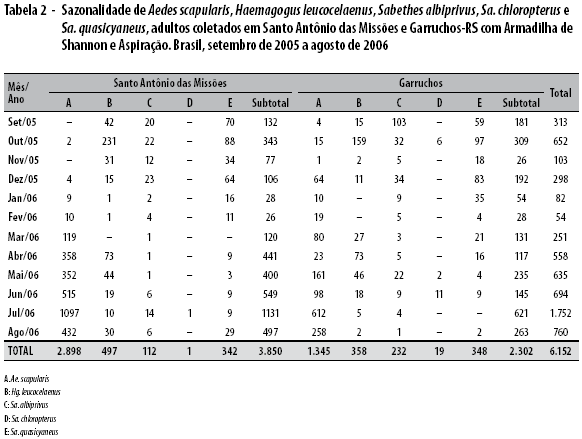
A figura 1 mostra a atividade horária de Hg. leucocelaenus, calculada para 12 meses com a Armadilha de Shannon, em Santo Antônio das Missões e para Garruchos. Nessas localidades essa atividade começou nas primeiras horas da manhã e terminou no final do dia, mas as maiores médias de Williams ocorreram entre 12 e 17 horas.
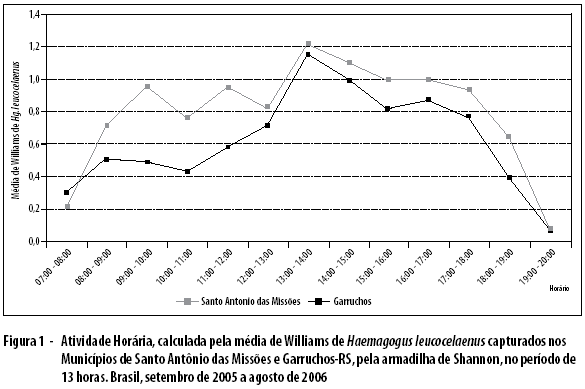
Na figura 2, mostra-se a relação entre a quantidade de chuvas e a abundância de Hg. leucocelaenus. A chuva teve uma distribuição anual, porém com os maiores picos em outubro e março. Quando comparada ao pico bimodal de atividade hematofágica do Hg. leucocelaenus, verificou-se uma sobreposição na estação primavera, enquanto no outono a espécie apresentou um pico em abril.
Nas tabelas 3 e 4 são apresentados os resultados referentes ao ELISA de captura, para identificação de sangue ingerido em exemplares capturados nas áreas de mata e peridomicílio nos respectivos percentuais para os dois municípios investigados. Na tabela 3, referente a Santo Antônio das Missões, o total de 190 fêmeas reagentes foi de 84,7% para as fontes sanguíneas incluídas na bateria de anticorpos para humanos e animais. As fêmeas apresentaram sangue ingerido de boi (60,9%), humano (23,6%), ave (9,9%), mistos (3,7%) e macaco (1,9%).
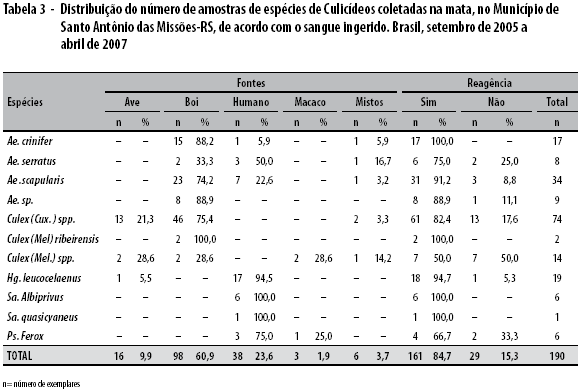
O grupo Culex (Culex) spp. e as espécis Ae. scapularis, Ae. crinifer e Hg. leucocelaenus apresentaram maior número de exemplares ingurgitados. Alguns mosquitos dessa amostragem apresentaram combinações de sangue ingerido, com o envolvimento de duas diferentes fontes. Essas combinações foram em seis casos: um Ae. crinifer, um Ae. serratus para macaco e bovino; um Ae. scapularis para humano e bovino, enquanto dois Cx. (Cux.) spp. e um Cx. (Mel.) spp foram para macaco-ave e bovino-ave.
Ao comparar as proporções obtidas em exemplares dessa área, constatou-se diferença significativa segundo a fonte de sangue ingerido apenas para o grupo Cx. (Cux.) spp. (p=0,037) e Hg. leucocelaenus (p<0,001).
Foram realizadas comparações entre pares de hospedeiros, com a inclusão das demais combinações entre fontes para cada uma dessas duas espécies, com o seguinte resultado: humano-bovino; humano-macaco; humano-macaco-bovino; e humano-bovino-ave. O teste de significância entre pares de hospedeiros e combinações referidas apresentaram diferenças estatisticamente significativa (p=0,027).
Quanto aos exemplares capturados em área adjacente à mata e extradomiciliar, foram identificadas 35 fêmeas ingurgitadas representadas pelo grupo Culex ( Culex) spp. cujo resultado constatou a combinação bovino e rato.
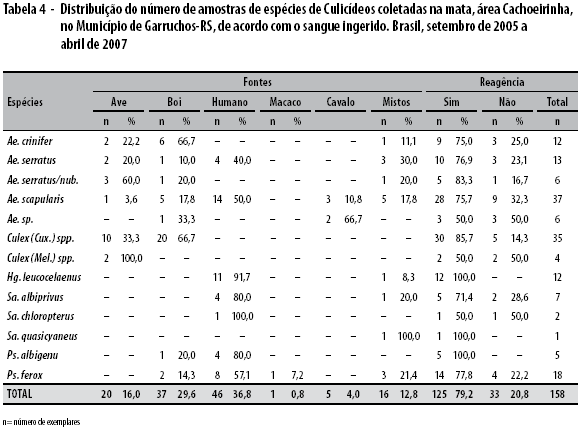
A tabela 4 apresenta o resultado das capturas no Município de Garruchos onde, de um total de 158 fêmeas ingurgitadas na área Cachoeirinha, 79,2% corresponderam a exemplares reagentes.
Em relação às amostras da área Cachoeirinha, pode-se observar que 16% foram reagentes para ave, 29,6% para boi, 36,8% para humano, 4% para cavalo, 0,8% para macaco e 12,8% para fontes mistas. O grupo Culex (Culex) sp. e as espécies Ae. scapularis, Ps. ferox e Hg. leucocelaenus contribuíram com o maior número de exemplares.
Nessa população as combinações de sangue ingerido foram identificadas em 16 casos, onde dois Ae. crinifer foram positivos para bovino-ave e bovino-macaco; três Ae. serratus para humano-ave; cinco Ae. scapularis para humano-ave, humano-bovino, bovino-equino e humano-ave-equino; um Hg. leucocelaenus para bovino-ave; um Sa. albiprivus para humano-ave; um Sa. quasiscyaneus humano-ave e finalmente Pso-rophora ferox com três reagentes para humano-ave.
Ao considerar as comparações entre proporções obtidas das fontes utilizadas pelos mosquitos em Cachoeirinha, Culex (Culex) spp. foi a única espécie em que se observou diferença estatisticamente significativa (p<0,001). Na fonte representada pelos bovinos quando comparada às demais e respectivas combinações, observou-se diferença significativa (p=0,025).
Quanto à mata situada no Distrito de São José, detecta-se a presença de dez amostras reagentes para quatro exemplares do grupo Culex (Culex) spp. com sangue de macaco, três para Ae. scapularis, dois para Hg. leucocelaenus e um Sa. albiprivus. As comparações entre esses pares de fontes e respectivas combinações apresentaram diferenças significativas para amostra de sangue ave (p=0,018) e para sangue bovino (p=0,021)
O grupo Culex (Culex) spp., Ae. scapularis eAe. crinifer foram as espécies com maior número de exemplares ingurgitados, entretanto o grupo Culex ( Culex) spp. foi o único a apresentar diferença significativa em relação às demais fontes (p=0,002).
Discussão
Devido às epizootias em primatas do gênero Alou-atta, na Região Noroeste do Estado do Rio Grande do Sul, nos anos de 2001, 2002 e 2003, a Secretaria de Vigilância em Saúde/Ministério da Saúde considerou aquela área como sendo de transição da febre amarela silvestre. Com a repercussão de novas epizootias de 2008 a 2009, dessa vez envolvendo maior número de municípios pertencentes a outras regiões do Estado,13 este estudo representou a necessidade de uma análise sobre o papel de dispersão vetorial para o vírus da doença.
A priori, esse papel de dispersão vetorial, na ausência de Hg janthinomys na área estudada, leva a suspeitar que essa incriminação recaia sobre Hg. leucocelaenus. Alguns relatos sobre o registro de sua infecção natural com o vírus amarflico, na região noroeste do Estado do Rio Grande do Sul, concorrem também para essa suspeita, ou no mínimo mostrar a sua sobreposição aos focos naturais do vírus envolvendo florestadas e áreas degradadas.2,6 Além disso, o fato de Hg. leucocelaenus mostrar-se apto para sobreviver em ambientes alterados pelo homem, não foi marcante no estudo por ser capturado adultos apenas dentro das matas. Por outro lado, a questão da abundância parece ser compensada pela estreita associação da espécie com primatas, fato que explicaria a existência de um elo entre o foco natural do vírus e as habitações situadas nos limites de dispersão da espécie. Conforme resultado encontrado em Santo Antônio das Missões, Hg. leucocelaenus apresentou maior percentual de fêmeas com sangue humano (p=0,027), corroborando com a suspeita de ser a espécie vetora mais importante para a região. Porém, permanece claro que o risco mais significativo para infecção humana ainda é a penetração dos indivíduos nos ambientes de floresta.14
Quanto ao comportamento de Hg. leucocelaenus, foi observado períodos com maior e menor atividade sazonal, porquanto apresentou dois picos mais proeminentemente distribuídos nas estações primavera e outono. No Estado de São Paulo, cujas matas residuais possuem muitos elementos florísticos secundários, o resultado das capturas de adulto foi semelhante numericamente a Santo Antônio das Missões e Garruchos, sendo comuns, em ambas localidades, as modificações ambientais e predomínio da agropecuária. Pelas tabelas e gráficos, as frequências maiores de adultos de mosquitos nas capturas estiveram influenciadas pela situação climática, mostrando uma relação direta da abundância com as chuvas (Figura 1). Corrobora com esses resultados o estudo feito em Trinidad, quando Hg. leucocelaenus passa ser mais frequentes nos meses de junho a dezembro,15 coincidindo com uma pluviometria elevada.
Como visto, são vários os fatores que modulam a atividade do mosquito Haemagogus, acresce-se o resultado de estudo na Ilha de Marajó que sugere baixa competência vetorial de Hg. leucocelaenus ao vírus amarílico, observada na ausência de Hg. janthinomys por ocasião do estudo.7 É possível que numa distribuição tão ampla de Hg. leucocelaenus na América Central e Sul haja linhagens com elevada ou baixa susceptibilidade ao vírus, podendo suspeitar da primeira situação assinalada para as Regiões Sudeste e Sul do Brasil.
Sabethes chloropterus, notadamente vetora do vírus noutras localidades brasileiras e na América Central,16 teve uma frequência considerada baixa em Garruchos e rara em Santo Antônio das Missões. Situação semelhante foi assinalada na região oeste do Estado de São Paulo, com apenas oito exemplares capturados. Subsequentemente, a chance dessa espécie contactar humanos parece ser acidental, o que reforça mais ainda o papel vetorial de Hg. leucocelaenus, fato que não impede sua participação no ciclo enzoótico da febre amarela, cujo hábito acrodendrófilo favorece uma inter-relação com os bugios.
Haemagogus leucocelaenus apresentou atividade diurna com predominância no período da tarde, fato comum em localidades de São Paulo e Trinidad.17 A observação da capacidade dispersiva mais restrita dos mosquitos sabetíneos5 para contato com humanos, dependeria da penetração do homem no ambiente florestal. Haemagogus leucocelaenus apresentou antropofilia e zoofilia, as quais somadas à sua capacidade dispersiva de ir além do ambiente florestal podem expor as pessoas residentes às picadas, como por exemplo, em Santo Antônio das Missões as fêmeas mostram atividade fora das matas. Desta forma, as pessoas susceptíveis, visitantes e nativos teriam uma maior probabilidade de contrair o vírus da febre amarela.9 Para complicar esse quadro existe a presença simpátrica de Ae. albopictus, o qual representa potencial para envolver-se com esse vírus na região e alterar o quadro atual de exposição humana ao vírus. O relato do encontro de Hg. leucocelaenus em criadouros artificiais acidentalmente relatado em Turmalina e Populina,18 abre perspectivas para maior exposição do homem, quando somado ao Ae. albopictus. Essa suspeita tem alicerce no seu papel vetorial exercido na Ásia quando lhe é atribuído a transferência do vírus da dengue do ambiente rural para o periurbano.
Uma questão que chama a atenção é a captura de Hg. leucocelaenus por aspiração em abrigos situados ao nível do solo da floresta, evidenciando que a acrodendrofilia da espécie representa uma parte da feição de seu comportamento. Para o Hg. janthinomys foi observado picando ao nível do solo e assim ficando mais próximo das pessoas que entram na mata.14
Todavia, embora em número reduzido de fêmeas testadas para as diferentes fontes sanguíneas representam aquelas que têm envolvimento com a enzootia e endemia (macaco e homem). Quanto às fontes bovinas e aves, estas representam opções alimentares para elevar sua chance de sobrevivência, enquanto primatas não humanos seriam sinalizadores da presença viral, após epizootia em Alouatta, com mortalidade de 100% dos casos, ausentes por algum tempo. Assim sendo, os múltiplos hospedeiros envolvidos no seu ciclo de vida pode ser uma estratégia populacional definida pela evolução adaptativa necessária para vencer barreiras impostas pelas epizootias e pelas alterações das matas. Embora menos adaptados a grandes modificações ambientais, Hg. janthinomys mostra caráter de comportamento alimentar semelhante, pois inclui no seu perfil humanos, pássaros, bovinos, cães, roedores e equinos,18 talvez evidenciando um potencial adaptativo mais retardado ao ambiente modificado. Esses fatos sugerem que existam várias opções para circulação do vírus amarílico, ficando a extensão por conta da distribuição geográfica das duas espécies vetoras. Por outro lado, se é visível a redução de Alouatta durante os eventos epizoóticos, o relacionamento eclético de ambas as espécies ou de outros culicídeos que têm infectividade ao vírus amarílico convergiriam para suspeitar que outros animais tenham a chance de participar do processo enzoótico natural do vírus amarílico. Como pressuposto está o relato de estudos na África mostrando que animais silvestres, não primata humanos, garantem os focos naturais do vírus amarílico.19 Nesse sentido, o potencial de Ae. albopictus para infectar com o vírus e sua característica de espécie oportunista, põe em risco mudanças no quadro atual de epidemiologia da febre amarela. Para Sa. chloropterus e Ae. scapularis fica a recomendação de novos estudos, bem como de sua inclusão no programa de vigilância entomológica, como parte do monitoramento que tem por objetivo prevenir a febre amarela silvestre no Rio Grande do Sul, uma vez que ambos têm relatos de competência para arbovírus.20,21
O desenvolvimento da vacina contra a febre amarela necessita ter critérios mais sensíveis para determinar as áreas cujas populações humanas devem ser vacinadas para evitar a introdução do vírus em ambiente urbano e reduzir o risco de transmissão entre seres humanos do ciclo silvestre da doença. Basear-se em serviço não sistematizado de investigação vetorial, praticada atualmente pelo programa de vigilância da febre amarela silvestre, fornece informação pontual e rapidamente superada, perdendo-se assim a perspectiva de antecipação do recrudescimento de áreas velhas ou o aparecimento de novos focos epizoóticos, como foi o observado no Rio Grande do Sul em 2008 e 2009.13 Também, deixa incompleto o plano da vigilância e a adequada conduta para garantir uma cobertura vacinal no padrão mais universal ou nos limites geográficos desejado das imunizações.
Sendo assim, diante de perfis epidemiológicos distintos da FAS recomendam-se estudos que visem esclarecer os diferentes cenários existentes no país para fundamentar um sistema integrado de vigilância incluindo a intensificação do monitoramento, pelo menos de Hg. leucocelaenus, Ae. albopictus e Sa. chloropterus, de forma a corroborar como indicativo do tamanho da área de cobertura vacinal preventiva, na qual a vigilância entomológica teria o papel de estratificação das áreas problemas ou a sustentabilidade do programa de imunização da população das áreas de risco.22 Além do que, a entomologia continuará sendo indispensável pela oportunidade oferecida no aprofundamento dos mecanismos de transmissão e exposição humana a FAS, obviamente prevendo áreas de risco potenciais à circulação viral.
Agradecimentos
À equipe de campo da 12a CRS/Santo Ângelo e Secretarias Municipais de Saúde de Santo Antônio das Missões e Garruchos. Ao técnico de informática, Rodrigo Alexandre Sportello, Departamento de Epidemiologia, Faculdade de Saúde Pública/USP.
Referências
1. Mondet B, Vasconcelos PFC, Travassos da Rosa APA, Travassos da Rosa ES, Rodrigues SG, Travassos da Rosa JFS, et al. Isolation of yellow fever virus from nulliparous Haemagogus (Haemagogus) janthinomys in Eastern Amazonia. Vector Borne and Zoonotic Diseases 2002;2:47-50.
2. Vasconcelos PFC, Sperb AF, Monteiro HAO, Torres MAN, Sousa MRS, Vasconcelos HB, et al. Isolations of yellow fever virus from Haemagogus leucocelaenus in Rio Grande do Sul state, Brazil. Transactions of the Royal Society of Tropical Medicine Hygiene 2003;97:60-62.
3. Costa ZGA. Estudo das características epidemiológicas da febre amarela no Brasil, nas áreas fora da Amazônia Legal, período de 1999-2003 [dissertação de Mestrado]. Brasília (DF): Escola Nacional de Saúde Pública Sergio Arouca; 2005.
4. Gomes AC, Torres MAN, Gutierrez MFC, Lemos FL, Lima MLN, Martins JF, et al. Registro de Aedes albopictus em áreas epizoóticas de febre amarela das Regiões Sudeste e Sul do Brasil (Diptera: Culicidae). Epidemiologia e Serviços de Saúde 2008;17:71-76.
5. Forattini OP. Culicidologia médica. São Paulo: Edusp; 2002.
6. Camargo-Neves VLF, Poletto DW, Rodas LAC, Pachioli ML, Cardoso RP, Scandar SAS, et al. Entomological investigation of a sylvatic yellow fever area in São Paulo State, Brazil. Cadernos de Saúde Pública 2005;21:1278-1286.
7. Vasconcelos PFC, Travassos da Rosa APA, Rodrigues SG, Travassos da Rosa ES, Monteiro HAO, Cruz ACR, et al. Yellow fever in Pará State, Amazon Region of Brazil, 1998-1999: entomologic and epidemiologic findings. Emerging Infectious Diseases 2001; 7:565-569.
8. Tauil PL. Aspectos críticos do controle do dengue no Brasil. Cadernos de Saúde Pública 2002;18:867-871.
9. Torres MAN, Almeida MAB, Santos E, Monteiro HAO, Cardoso JC, Costa IA, et al. Vigilância entomológica da febre amarela silvestre no Rio Grande do Sul. Boletim Epidemiológico do Centro Estadual de Vigilância em Saúde/RS 2004;6(1).
10. Nasci RS. A lightweight battery-powered aspirtor for collecting resting mosquitoes in the field. Mosquito News 1981;41:808-811.
11. Marassá AM, Rosa MDB, Gomes AC, Consales CA. Biotin/avidin sandwich enzyme-linked immunosorbent assay for Culicidae mosquito blood meal identification. Journal of Venomous Animals and Toxins Including Tropical Diseases 2008;14:303-312.
12. Marassá AM, Paula MB, Gomes AC, Consales CA. Biotin-avidin sandwich Elisa with specific human isotypes igg1 and igg4 for culicidae mosquito blood meal identification from an epizootic yellow fever area in Brazil. Journal of Venomous Animals and Toxins Including Tropical Diseases 2009;15:696-706.
13. Ministério da Saúde. Febre amarela silvestre, Rio Grande do Sul, 2008 e 2009 [Internet]. Brasília: MS [acesso em 1 abr 2009]. Disponível em: http://saude.gov.br/portal/aquivos/pdf/Boletim_FARS_18_03_09.pdf
14. Alencar J, Lorosa ES, Dégalier N, Serra-Pierre NM, Pacheco JB, Guimarães AE. Feeding patterns of Haemagogus janthinomys (Diptera: Culicidae) in different regions of Brazil. Journal of Medical Entomology 2005;42:981-985.
15. Tikasingh ES, Hull B, Laurent E, Chadee DD. Entomological activities during the yellow fever epidemic in Trinidad, 1978-1980. Bulletin of the Society Vector Ecology 1990;15:41-47.
16. Chadee DD. Seasonal abundance and diel landing periodicity of Sabethes chloropterus (Diptera: Culicidae) in Trinidad, West Indies. Journal of Medical Entomology 1990;27:1041-1044.
17. Chadee DD, Tikasingh ES, Ganesh R. Seasonality, biting cycle and parity of the yellow fever vector mosquito Haemagogus janthinomys in Trinidad. Medical and Veterinary 1992;6:143-148.
18. Tauil PL. Haemagogus leucocelaenus em ambiente urbano. Revista da Sociedade Brasileira de Medicina Tropical 1985;18:1-5.
19. Barrett ADT, Monath TP. Epidemiology and ecology of yellow fever virus. Advances in Virus Research 2003;61:291-315.
20. Rawlins SC, Hull B, Chadee DD, Martinez R, Le Maitre A, James F, et al. Sylvatic yellow fever activity in Trindad, 1988-1999. Transation of the Royal Society Tropical Medicine and Hygiene 1990;84:142-143.
21. Mitchell CJ, Forattini OP, Miller BR. Vector competence experiments with Rocio virus and three mosquito species from the epidemic zone in Brazil. Revista de Saúde Pública 1986;20:171-177.
22. Schermann MT, Porto MA. Estratégia específica de vacinação contra a febre amarela em regiões do Estado do Rio Grande do Sul. Boletim Epidemiológico do Centro Estadual de Vigilância em Saúde/RS 2008;10(1).
 Endereço para correspondência:
Endereço para correspondência:
Universidade de São Paulo,
Faculdade de Saúde Pública,
Departamento de Epidemiologia,
Av. Dr. Arnaldo, 715, São Paulo-SP, Brasil.
CEP:01246-904
E-mail:agcastro@usp.br
Recebido em 11/05/2009
Aprovado em 02/10/2009
*Estudo financiado com recursos do Ministério da Saúde, por meio de sua Secretaria de Vigilância em Saúde, em cooperação técnica com a Organização Pan Americana da Saúde - OPAS/OMS. Parte desse estudo foi publicada no Boletim Epidemiológico do Centro Estadual de Vigilância em Saúde do Rio Grande do Sul em dezembro de 2008; v.10, n.4












 Curriculum ScienTI
Curriculum ScienTI
