Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.21 n.2 Brasília jun. 2012
http://dx.doi.org/10.5123/S1679-49742012000200005
ARTIGO ORIGINAL
Sobrevivência e infectividade do Trypanosoma cruzi na polpa de açaí: estudo in vitro e in vivo*
Survival and infectivity of Trypanosoma cruzi in açaí pulp: in vitro and in vivo study
Luiz Augusto Corrêa PassosI; Ana Maria Aparecida GuaraldoII; Rodrigo Labello BarbosaIII; Viviane Liotti DiasI; Karen Signori PereiraIV; Flavio Luis SchmidtV; Regina Maura Bueno FrancoVI; Delma Pegolo AlvesVII
IDivisão de Pesquisa, Centro Multidisciplinar para Investigação Biológica na Área da Ciência em Animais de Laboratório, Universidade Estadual de Campinas, Campinas-SP, Brasil
IIDepartamento de Biologia Animal, Instituto de Biologia, Universidade Estadual de Campinas, Campinas-SP, Brasil
IIIDoutorando do Programa de Pós-Graduação em Parasitologia, Universidade Estadual de Campinas, Campinas-SP, Brasil
IVDepartamento de Engenharia Bioquímica, Escola de Química, Universidade Federal do Rio de Janeiro, Rio de Janeiro-RJ, Brasil
VDepartamento de Tecnologia de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Campinas-SP, Brasil
VILaboratório de Protozoologia, Departamento de Biologia Animal, Instituto de Biologia, Universidade Estadual de Campinas, Campinas-SP, Brasil
VIICentro Multidisciplinar para Investigação Biológica na Área da Ciência em Animais de Laboratório, Universidade Estadual de Campinas, Campinas-SP, Brasil
RESUMO
OBJETIVO: estudar a sobrevivência e a infectividade de Trypanosoma cruzi na polpa de açaí.
MÉTODOS: foram realizados experimentos in vitro e in vivo. Alíquotas de polpa provenientes da cidade de Belém (capital do estado do Pará, região Norte do Brasil) foram misturadas a 105 tripomastigotas e mantidas às temperaturas ambiente, 4oC e -20oC, com diferentes períodos de incubação; posteriormente, os parasitos foram isolados e inoculados em camundongos imunodeficientes CB-17-Prkdcscid/PasUnib pelas vias intraperitoneal, oral ou gavagem.
RESULTADOS: todas as vias foram eficientes. Houve retardo de 5 dias no início da parasitemia na infecção oral. À temperatura ambiente por 48 horas, a polpa preservou a virulência do parasito. Refrigeração a 4oC por 144 horas e congelamento a -20oC por 26 horas não eliminaram o parasito.
CONCLUSÃO: os testes sugerem a possibilidade de os surtos de doença de Chagas aguda no Norte do Brasil estarem relacionados ao consumo de polpa de açaí.
Palavras-chave: Trypanosoma cruzi; Doença de Chagas; Sucos; Camundongos; Hospedeiro Imunocomprometido.
ABSTRACT
OBJECTIVE: to evaluate infectivity by Trypanosoma cruzi and its survival in açaí pulp.
METHODS: experiments were performed in vitro and in vivo; aliquots of pulp from Belém City (capital of the state of Pará, Northern Region of Brazil) were mixed with 105 trypomastigotes, and maintained at room temperature, and at temperatures of 4oC and -20oC, within different incubation periods; following that, the parasites were isolated and inoculated into immunodeficient mice CB-17-Prkdcscid/PasUnib, by intraperitoneal, oral, orgavage routes.
RESULTS: all routes showed effectiveness. There was a delay of 5 days in the beginning of the parasitemia by oral infection; the pulp at room temperature for 48h kept the parasite virulence preserved. Keeping the samples cooled at 4oC during 144h and the freezing at -20oC for 26h did not kill the parasite.
CONCLUSION: tests suggest that açaí pulp consumption may be related to outbreaks of acute Chagas' disease in Northern Brazil.
Key words: Trypanosoma cruzi; Chagas Disease; Juices; Mice; Imunocompromised Host.
Introdução
A doença de Chagas está entre as mais importantes infecções parasitárias da América Latina, podendo ser transmitida por diferentes vias, como a vetorial, congênita e transfusional, por secreções das relações sexuais, decorrentes de acidentes de laboratório ou por órgãos transplantados não inspecionados.1
Na região Norte do Brasil, a via oral tem assumido importância maior, principalmente em razão de sua associação com microepidemias. Na transmissão oral, a ingestão de formas tripomastigotas metacíclicas de Trypanosoma cruzi presentes em diferentes alimentos2 conduz a um quadro agudo que, em muitos casos, evolui para a morte.
Apesar de a doença de Chagas aguda (DCA) relacionada ao consumo de alimentos não ser recente,3 ela constituía, até o ano de 2004, evento pouco conhecido ou investigado. Nos últimos anos, foram relatados surtos de DCA de transmissão alimentar em diversos estados brasileiros4,5 e entre eles, os mais conhecidos são a contaminação do caldo de cana em Navegantes-SC (2005)4 e a da água em Macaúbas-BA (2008).6
A partir de 2007, na região Norte, microepidemias de DCA têm sido associadas à veiculação do T. cruzi pela polpa de açaí. Nesses surtos, as principais hipóteses foram a contaminação dos frutos ou da polpa por dejetos de animais reservatórios ou triatomíneos infectados.
Aspectos culturais, aliados às propriedades nutricionais do fruto do açaí, contribuem para que esse alimento seja bastante consumido em toda a região amazônica, especialmente no Estado do Pará onde é o principal suplemento da dieta alimentar da população, ampliando sua importância na veiculação da DCA de etiologia alimentar. Em função de sua alta produtividade, a comercialização do açaí representa importante fonte de renda, principalmente para a população carente, o que o torna fundamental para a economia e,7 consequentemente, para a qualidade de vida das populações locais.
Segundo o Laboratório de Doença de Chagas do Instituto Evandro Chagas no Estado do Pará (IEC/PA), e da Secretaria de Vigilância em Saúde/Ministério da Saúde (SVS/MS), entre 1968 e 2007, foram registrados 592 casos de doença de Chagas na Amazônia brasileira. Desse total, 587 foram confirmados como DCA, 440 deles (74,9%) associados a surtos familiares. Apesar de pouco divulgados pela mídia, até 2006 foram notificados na região amazônica brasileira, aproximadamente, 430 casos de DCA relacionados ao consumo de alimentos contaminados.8 Em 2006, ano em que a forma oral foi identificada como de potencial risco para a Saúde Pública, foram notificados 116 casos de DCA em todo o Brasil.9,10
A contaminação de alimentos pelo T. cruzi pode ocorrer quando insetos triatomíneos depositam suas fezes infectadas na superfície de alimentos ou de ingredientes alimentícios ou, eventualmente, quando os insetos são triturados durante o processamento das frutas. Esta última é a principal hipótese explicativa para os diversos surtos ocorridos nos últimos anos, no Norte brasileiro, associados à ingestão de açaí possivelmente contaminado com o protozoário.11
Uma vez que o açaizeiro não é ecótopo do vetor, a forma de contaminação do fruto está associada à falta de higiene durante a colheita, debulha, transporte, processamento, armazenamento e/ou comercialização do produto.11 Igualmente importante, a possibilidade de transmissão da DCA por equipamentos e utensílios contaminados, pela urina e secreções anais de marsupiais reservatórios, assim como pelas fezes de triatomíneos infectados, reforça a necessidade de cuidados na sanidade dos frutos e materiais empregados em seu manuseio. Não obstante os aspectos sanitários, deve-se considerar, também, a influência das mudanças ambientais decorrentes da invasão humana, que aproximam o homem do ciclo silvestre do parasito.1
Quanto a achados epidemiológicos associando os casos de DCA ao consumo de açaí, há uma evidente carência de estudos que demonstrem ser essa via factível. Aspectos relacionados à sobrevivência e infectividade de formas tripomastigotas na polpa do fruto são todavia desconhecidos.
Por se tratar de uma questão relevante para a Saúde Pública e a pesquisa aplicada em doença de Chagas, tendo em vista que o açaí foi o alimento associado ao maior número de casos ocorridos na região Norte do Brasil nos últimos anos, o presente trabalho teve por objetivo estudar, por meio de ensaios in vitro e in vivo, a sobrevivência e infectividade de T. cruzi na polpa de açaí submetida a diversos períodos de incubação, sob temperaturas ambiente, refrigeração e congelamento.
Métodos
Foram realizados testes in vitro e in vivo.
Utilizou-se a forma sanguícola da cepa Y de T. cruzi, mantida em camundongos CBA/J/Unib, proveniente do Centro Multidisciplinar para Investigação Biológica na Área da Ciência em Animais de Laboratório, da Universidade Estadual de Campinas (CEMIB/Unicamp). Os tripomastigotas foram empregados na contaminação da polpa de açaí utilizada nos testes in vitro e in vivo.
Foram utilizados camundongos isogênicos imunodeficientes, machos e fêmeas da linhagem CB-17-Prkdcscid/PasUnib (scid) contando oito a 12 semanas de idade e peso médio de 30g, oriundos de colônias do CEMIB. Os animais foram marcados individualmente, por amputação de falange.
A polpa in natura de açaí utilizada foi adquirida no comércio local da cidade de Belém-PA e congelada para transporte até o laboratório onde, em câmara de fluxo laminar, foi distribuída em alíquotas de 50mL e mantida em freezer a -20oC, até o momento do uso. Na data da utilização, cada alíquota foi descongelada e, quando necessário, previamente submetida ao processo de autoclavagem a 121oC, durante 20 minutos.
Para a avaliação da mortalidade imediata dos parasitos, um volume de 100µL da polpa de açaí recebeu 5µL de plasma contendo 105 tripomastigotas. A atividade dos parasitos foi monitorada após contato inicial com a polpa, a intervalos regulares de 15 minutos, por um período de até 60 minutos. A observação foi feita em triplicata, por microscopia óptica comum, com e sem a coloração vital pelo azul de trypan.
Para a recuperação dos tripomastigotas misturados à polpa do açaí, desenvolveu-se um processo denominado 'tamisação forçada', no qual colunas de filtração foram preparadas em fluxo laminar, empregando-se seringas plásticas de 3mL e microesferas estéreis com 3mm de diâmetro, confeccionadas em plástico e metal. Na montagem das colunas, uma primeira camada de lã de nylon foi colocada na base para, em seguida, de forma intercalada, serem adicionadas as microesferas até alcançar, aproximadamente, 1/3 da altura máxima da seringa. Finalmente, antes da aplicação da amostra, a extremidade superior foi coberta com nova camada de lã de nylon estéril. A tamisação forçada empregada na mistura da polpa de açaí e tripomastigotas facilitou a separação das fases sólida e líquida da polpa. O sistema proporcionou livre passagem dos parasitos ao longo da coluna e permitiu que eles fossem recuperados no eluato.
Misturas de polpa de açaí e plasma contendo tripomastigotas foram preparadas nas proporções de 1:2, 1:3 e 1:4, em um volume final de 1mL. Em seguida, as misturas foram aplicadas às colunas individualmente, e o êmbolo cuidadosamente recolocado. No decorrer da tamisação, uma pequena pressão foi exercida gerando o eluato, logo coletado em alíquotas individuais com volume máximo de 50µL. Frações de 5µL foram recolhidas e examinadas por microscopia óptica comum.
Após a coleta de todas as frações de eluato, cada coluna de tamisação foi lavada com 200µL de solução de NaCl 0,15M; e os eluatos obtidos, igualmente examinados.Os tripomastigotas foram determinados quantitativamente, pelo método de Brener.12
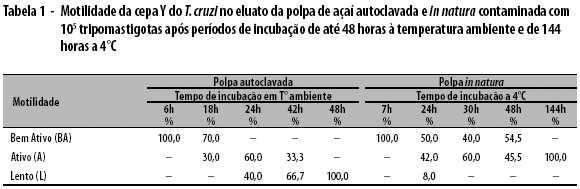
Para avaliação da motilidade, as misturas de polpa de açaí e plasma com T. cruzi (1:3) contendo 105 tripomastigotas foram mantidas à temperatura ambiente durante 6, 18, 24, 42 e 48 horas; e a 4oC durante 7, 24, 30, 48 e 144 horas. Após a tamisação forçada, os tripomastigotas observados no eluato foram classificados como bem ativos, ativos ou lentos; para classificá-los, realizou-se uma comparação com o comportamento observado no controle positivo, formado pelo plasma com parasitos e mantido sob as mesmas condições experimentais.
A infectividade do T. cruzi foi investigada pela infecção de camundongos scid com a mistura da polpa e plasma contaminado. Nos testes, foram utilizados eluatos da tamisação forçada, obtidos após diferentes tratamentos térmicos, para inoculação pelas vias i.p., gavagem ou oral.
Para eliminar os efeitos prejudiciais da contaminação bacteriana da polpa in natura,7 os camundongos a serem inoculados com o eluato da tamisação pela via i.p. receberam tratamento prévio com cefalexina 500mg. Foi administrada aos animais a dose de 1,75mg de antibiótico/dia, baseada no peso médio de cada animal (30g), com a ingestão média de água de 15mL/100g de peso-animal/dia para os camundongos13 (volume do bebedouro: 200mL). No esquema de cobertura, foi administrada uma primeira dose em 100µL pela via i.p., dois dias antes da infecção experimental. Posteriormente, os animais receberam o antibiótico por gavagem (100µL), um dia antes da inoculação com o parasito. Finalmente, no dia da infecção e nos sete dias subsequentes, o antibiótico foi mantido na água do bebedouro.
Na realização dos ensaios, foram preparados os seguintes grupos experimentais: controles negativos, formados pelos animais que receberam polpa in natura de açaí ou polpa de açaí autoclavada; controles positivos, formados pelos animais que receberam plasma contendo 105 tripomastigotas da cepa Y de T. cruzi; e grupos teste, constituídos pelos animais que receberam os eluatos obtidos a partir da tamisação forçada da mistura da polpa de açaí com as formas tripomastigotas. Nos grupos teste, foram adotadas as seguintes condições: a) polpa autoclavada, infectada com T. cruzi em fluxo laminar e mantido na temperatura ambiente por até 14 horas; b) polpa in natura, infectada e mantida (b1) à temperatura ambiente por 24 horas, (b2) à temperatura ambiente por 48 horas + 72 horas na geladeira (tratamento combinado), (b3) na geladeira (4oC) por até 144 horas e (b4) congelada (-20oC) por até 26 horas.
Os camundongos CB-17-Prkdcscid/PasUnib (scid) receberam ração autoclavada e água ad libitum e foram mantidos em salas com 22oC (±2), fotoperíodo de 12-14 horas/24 horas14 e umidade relativa (UR) entre 65,0 e 70,0%, de acordo com as recomendações internacionais.15 Após a infecção experimental, os animais foram alojados em mini-isoladores e mantidos em prateleiras ventiladas (modelo ALESCO); passado o período de observação, foram descartados conforme os padrões vigentes de biossegurança.16
A constatação da parasitemia seguiu a metodologia preconizada por Brener.12 Todos os animais foram observados por um período mínimo de 40 dias; e a mortalidade, registrada diariamente.
Todos os ensaios experimentais com camundongos foram aprovados pela Comissão de Ética no Uso de Animais (CEUA) da Universidade Estadual de Campinas - Unicamp -, sob o no 1.569.
Resultados
Nos testes in vitro de sobrevivência após contato com a polpa, 100,0% dos parasitos apresentaram-se bem ativos, tanto no momento imediato após a deposição dos parasitos como nos 15, 30, 45 e 60 minutos subsequentes.
Nos testes de sobrevivência de longa duração, a mistura mantida à temperatura ambiente por 6, 18, 24, 42 e 48 horas, quando comparada com o controle positivo (plasma) mantido nas mesmas condições, apresentou formas bem ativas de parasitos no período de até 18 horas, parasitos ativos por até 42 horas e parasitos lentos a partir de 24 horas de incubação. Na mistura mantida a 4oC por 24, 30, 48 e 144 horas, foram observados 100,0% de parasitos bem ativos no período de até 7h e 100,0% de parasitos ativos no período de 144 horas (Tabela 1).
Quanto aos testes in vivo, todos os animais do controle negativo - que receberam a polpa in natura ou a polpa autoclavada - sobreviveram, independentemente da via de inoculação utilizada. Quanto aos animais do controle positivo - que receberam o plasma contaminado -, morreram todos após a inoculação, tanto pela via i.p. como pelas vias oral ou gavagem. No grupo infectado com o plasma congelado a -20oC durante 14 horas, entretanto, 75,0% dos camundongos morreram.
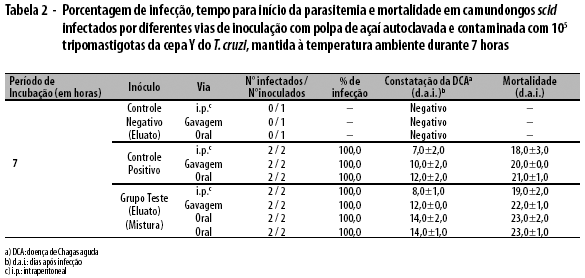
Nos ensaios com a polpa autoclavada contaminada com 105 parasitos e mantida à temperatura ambiente por até 7 horas, os animais do grupo controle positivo apresentaram, para cada uma das vias, início da parasitemia e dia de morte, respectivamente, nos seguintes dias: 7,0±2,0 e 18,0±3,0 (i.p.); 10,0±2,0 e 20,0±0,0 (gavagem); e 12,0±2,0 e 21,0±1,0 (oral). Paralelamente, os animais inoculados com o eluato apresentaram início de parasitemia e dia de morte, respectivamente, nos seguintes dias: 8,0±1,0 e 19,0±2,0 (i.p.); 12,0±0,0 e 22,0±1,0 (gavagem); e 14,0±2,0 e 23,0±2,0 (oral). Os animais que receberam a mistura total pela via oral apresentaram início de parasitemia e dia de morte, respectivamente, nos dias 14,0±1,0 e 23,0±1,0 (Tabela 2).
Nos testes realizados com a polpa autoclavada contaminada com 105 parasitos e congelada a -20oC por até 14 horas, observou-se que 75,0% dos animais do controle positivo e 25,0% do grupo teste adoeceram. No controle positivo, o início da parasitemia e a morte ocorreram, respectivamente, nos dias 10,0±2,0 e 18,0±3,0. Nos animais do grupo teste inoculados via i.p. com o eluato da tamisação forçada, o início da parasitemia e a morte ocorreram, respectivamente, nos dias 12,0±0,0 e 20,0±0,0 (Tabela 3).

Nos testes com a polpa in natura infectada com 105 parasitos, os animais inoculados com a mistura, mantida em diferentes condições, apresentaram os seguintes resultados:
- polpa in natura mantida à temperatura ambiente por 24 horas
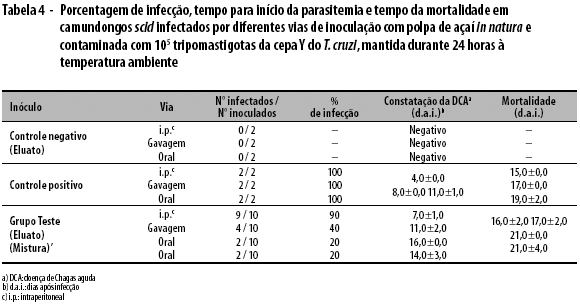
No controle positivo, 100,0% dos animais apresentaram infecção, com o início da parasitemia e a morte, respectivamente, nos seguintes dias: 4,0±0,0 e 15,0±0,0 (i.p.); 8,0±0,0 e 17,0±0,0 (gavagem); e 11,0±1,0 e 19,0±2,0 (oral). No grupo teste, os animais que receberam o eluato da tamisação apresentaram infecção com início de parasitemia e morte, respectivamente, nos seguintes dias: 7,0±1,0 e 16,0±2,0 (i.p.); 11,0±2,0 e 17,0±2,0 (gavagem); e 16,0±0,0 e 21,0±0,0 (oral). E um percentual de 20,0% dos animais que receberam a mistura total pela via oral também apresentaram infecção, com início de parasitemia e morte, respectivamente, nos dias 14,0±3,0 e 21,0±4,0. Foi possível constatar um atraso de 5 dias no início da parasitemia, no caso da infecção pela via oral (Tabela 4).
- polpa in natura mantida em temperatura ambiente por 48h + 72h na geladeira (4oC) (tratamento combinado)
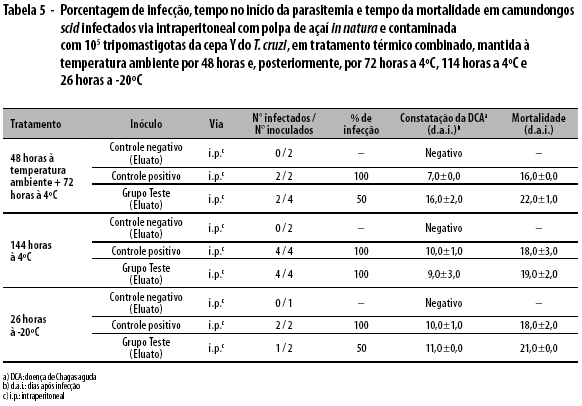
No controle positivo, a virulência foi preservada em 100,0% dos animais. O início da parasitemia e a morte ocorreram, respectivamente, nos dias 7,0±0,0 e 16,0±0,0 (i.p.). No grupo teste, a preservação da virulência foi observada em 50,0% dos animais, com início da parasitemia e morte, respectivamente, nos dias 16,0±2,0 e 22,0±1,0 (i.p.) (Tabela 5).
- polpa in natura mantida em geladeira (4oC) por até 144h
Os animais infectados do controle positivo (i.p.) apresentaram-se positivos, com o início da parasitemia no 10o dia e a morte aos 18 dias pós-infecção, enquanto os animais do grupo teste inoculados com o eluato apresentaram início de parasitemia e morte, respectivamente, nos dias 9,0±3,0 e 19,0±2,0 (Tabela 5).
- polpa in natura congelada a -20oC por até 26h
Sob estas condições, 100% dos animais do controle positivo e 50% do grupo teste, ambos inoculados pela via i.p., infectaram-se. No controle positivo, o início da parasitemia e a morte ocorreram, respectivamente, nos dias 10,0±1,0 e 18,0±2,0 (i.p.), enquanto os animais do grupo teste que receberam o eluato apresentaram início de parasitemia e morte, respectivamente, nos dias 11,0±0,0 e 21,0±0,0 (i.p.) (Tabela 5).
Discussão
Apesar dos avanços no controle da doença de Chagas em vários estados do Brasil, na região Norte, todavia, ela continua ativa e compromete a qualidade de vida de uma parcela importante da população da Bacia Amazônica. A existência de surtos familiares decorrentes da transmissão oral do T. cruzi tem possibilitado o crescimento da doença e exigido dos órgãos de Saúde Pública a adoção de diversas medidas para sua prevenção e controle.
Segundo dados da bibliografia relacionados com a investigação da transmissão oral da doença de Chagas experimental, alimentos contaminados com a forma tripomastigota do T. cruzi podem apresentar parasitos viáveis após períodos que variam de algumas horas, à temperatura ambiente, até dias e mesmo semanas a baixas temperaturas.17,18 Estudos de sobrevivência do T. cruzi em diferentes alimentos, como banana, pêssego, cana-de-açúcar, mamão, maçã, batata, cenoura e tomate, todos armazenados a 26oC, demonstraram que em 73,0% das amostras, os parasitos permaneciam vivos por um período entre 6 e 72 horas, sendo estimado o maior número de parasitos vivos entre 6 e 18 horas após a contaminação. Nesses estudos, apenas o abacaxi contaminado (pH 3) não apresentou parasitos vivos.19 Porém, segundo Rogez,7 a polpa de açaí apresenta um pH ligeiramente ácido. Os resultados aqui apresentados evidenciam que a viabilidade do parasito na polpa ficou preservada.
A infecção experimental em modelos animais por alimentos contaminados com as fezes de Triatoma pallidipennis demonstraram ser possível a transmissão da DCA pela via oral, mediante a ingestão de água potável, leite pasteurizado, carne moída crua ou cozida, queijo fresco e arroz cozido. Entretanto, os autores admitiram existir uma variação na eficiência da infecção relacionada com o tipo de alimento administrado aos animais.20
No presente trabalho, foram realizados testes de sobrevivência in vitro e infecção experimental empregando a polpa de açaí contaminada com tripomastigotas metacíclicos do T. cruzi. Inicialmente, foi conduzida uma avaliação com o propósito de investigar a morte imediata do T. cruzi após o contato com a polpa de açaí íntegra ou com seu sobrenadante. A não visualização dos parasitos diretamente na polpa de açaí íntegra durante a inspeção microscópica foi associada, principalmente, a sua coloração escura, devido à grande quantidade de matéria orgânica e antocianinas.7
Em contrapartida, a observação de 100,0% de formas tripomastigotas bem ativas no sobrenadante da polpa de açaí indicou que, apesar de o pH ideal para o parasito estar entre 7,2 e 7,3 e ser conhecida sua morte em meios muito ácidos ou alcalinos,21,22 ele, o parasito, sobreviveu na polpa in natura de açaí (pH 5,3) produzida em Belém-PA.
Em razão dos elevados índices de matéria orgânica, especialmente fibras vegetais, e das características físico-químicas da polpa de açaí íntegra,7 desenvolveu-se uma metodologia para o isolamento e observação de formas tripomastigotas na polpa. Diversos protocolos foram utilizados e o que apresentou melhor resultado foi a tamisação realizada sob pressão, ou tamisação forçada. Adotada esta metodologia, a separação entre as frações sólida e líquida da polpa de açaí resultou em um eluato que permitiu a quantificação exata e visualização da motilidade dos tripomastigotas. A comparação com as formas sanguícolas obtidas do plasma de camundongos infectados possibilitou a adoção de critérios de motilidade dos parasitos depositados na polpa. Outrossim, o eluato eliminou a indução de eventual peritonite nos animais que receberam a injeção intraperitoneal e permitiu a administração da polpa via gavagem.
Considerando-se que a temperatura poderia alterar as propriedades físico-químicas da polpa de açaí e interferir na relação parasito-polpa, foram realizados testes com a polpa autoclavada. Segundo dados da literatura, a autoclavagem a 121oC por 15 minutos acarreta a perda de aproximadamente metade do conteúdo de polifenóis e antocianinas da polpa de açaí, além de alterar outros nutrientes do produto.7
Os resultados referentes à contaminação da polpa autoclavada e logo mantida à temperatura ambiente por 48 horas demonstraram 100,0% de tripomastigotas lentos. A despeito das modificações oriundas do aquecimento do produto, esses dados indicam que a sobrevivência dos parasitos não foi comprometida.
Com relação à polpa in natura mantida sob refrigeração a 4oC, foram observadas 100,0% de tripomastigotas ativas após 144 horas de exposição, sugerindo que o microambiente proporcionou condições para a sobrevivência do parasito. Contudo, não foram encontrados parasitos no eluato das misturas obtidas de polpa in natura após as mesmas terem sido mantidas congeladas a -20oC, fato devido, principalmente, à impossibilidade da observação da totalidade do eluato: do volume total, triplicatas de alíquotas de 5µL eram analisadas na microscopia óptica e o restante reservado à infecção dos animais. Outra hipótese é a de que o congelamento foi capaz de matar ou inativar grande quantidade dos tripomastigotas, não sua totalidade.
A avaliação da capacidade da polpa de açaí atuar na preservação da virulência dos tripomastigotas recuperados da mistura e, consequentemente, provocar infecção chagásica aguda e morte exigiu testes in vivo utilizando camundongos certificados. Foram realizados ensaios de infecção experimental empregando-se camundongos isogênicos da linhagem scid, os quais são deficientes em linfócitos funcionais T e B23 e, por esse motivor, não resistem à presença do parasito, ainda que em baixa concentração. Alguns autores já demonstraram mortalidade de 100,0% em machos e fêmeas infectados experimentalmente, com 102 tripomastigotas da cepa Y do T. cruzi, por via intraperitoneal.24
No presente trabalho, a mortalidade na fase aguda ocorreu em 100,0% dos camundongos scid com parasitemia confirmada, independentemente da polpa autoclavada ou in natura, do tratamento térmico ou do período de incubação.
A sensibilidade desse modelo de animal foi capaz de denunciar a presença de quantidades mínimas de T. cruzi no eluato obtido após diferentes tratamentos, indicando que a virulência fora preservada. Além disso, a polpa de açaí in natura comercializada na Região Norte apresenta elevados índices de contaminação sanitária, seja por bactérias, seja por fungos,7 devendo ser consumida com cuidado por pacientes imunocomprometidos. Em razão desses patógenos e da suscetibilidade dos animais scid, os ensaios de infecção experimental com a polpa in natura somente foram conduzidos após o tratamento com antibiótico.
Desde que não houve morte entre os animais que receberam as amostras de polpa in natura sem T. cruzi (controle negativo), pôde-se desconsiderar a interferência dos contaminantes da polpa nos resultados de infecção experimental e validar a antibioticoterapia.
As condições de congelamento da mistura possibilitaram a comparação da viabilidade dos parasitos mantidos sob estresse térmico. O dado é importante, uma vez que a polpa de açaí congelada pode ser consumida de diversas maneiras, pela população.25
A confirmação da sobrevivência do T. cruzi na polpa de açaí submetida a diferentes tratamentos, aliada à preservação da virulência do parasito na mistura mantida por até 24 horas à temperatura ambiente, por 144 horas sob refrigeração (4oC) e por até 26 horas sob congelamento (-20oC) demonstram que a transmissão da DCA por açaí é possível. Principalmente, o achado indica a necessidade de atenção sanitária em todas as fases da cadeia produtiva, iniciando-se com a orientação dos produtores na colheita dos frutos, passando por seu armazenamento e transporte e finalizando com a adoção de métodos de higienização no preparo da polpa.
É lícito ressaltar que o presente estudo foi conduzido utilizando-se tripomastigotas metacíclicos sanguíneos (T. cruzi), visando a priori a obtenção de dados sobre a sobrevivência desse protozoário em polpa de açaí e respectivos efeitos sobre sua infectividade - ainda que tripomastigotas sanguíneos não sejam as formas que contaminam a polpa de açaí e infectem pela via oral.
Os resultados obtidos contribuem com evidências demonstrativas da manutenção da viabilidade e virulência após o contato com a matriz alimentícia do açaí. Embora animais infectados pelas três vias utilizadas tenham apresentado DCA, o estudo foi realizado em condições de laboratório e sugere a necessidade de pesquisas com isolados de cepas nativas do Norte do país.
No estudo, não foi considerado qualquer método de tratamento sanitário do fruto ou da polpa, embora os dados observados ressaltem a importância da higiene quanto a esses itens. Se por um lado, os resultados obtidos com a polpa contaminada são consistentes em demonstrar a transmissão da DCA pela via oral, por outro, estudos adicionais de tratamento da matriz alimentícia, tais como o branqueamento dos frutos e a pasteurização da polpa, poderão ser necessários para conciliar a eficiência do método na eliminação do parasito, com possíveis mudanças na palatabilidade, uma vez que alterações sensoriais no produto poderão ser responsáveis por sua rejeição pelos consumidores.
São cuidados importantes a se tomar, pois uma redução em sua comercialização será acompanhada de prejuízos em vários segmentos e terá reflexos diretos no desenvolvimento da região e na qualidade de vida das pessoas que habitam a Bacia Amazônica.
Os parasitos recuperados da polpa de açaí experimentalmente contaminada e mantida em temperatura ambiente, sob refrigeração e congelada, mostraram-se virulentos e causaram DCA em camundongos imunodeficientes infectados pelas três vias: oral, gavage e intraperitoneal. Por essa razão, os resultados observados não permitem descartar o consumo da polpa de açaí contaminada pelo T. cruzi como a principal hipótese da ocorrência dos surtos de doença de Chagas aguda no Norte do Brasil.
Agradecimentos
Ao Ministério da Saúde, órgãos e equipes, e à Secretaria de Estado de Saúde do Pará - SESPA - , pelo apoio à realização do presente estudo.
Contribuição dos autores
Passos LAC coordenou o estudo.
Guaraldo AMA e Franco RMB conduziram estudos relacionados com o protozoário e sua infectividade.
Barbosa RL e Dias VL realizaram os ensaios biológicos.
Pereira KS e Schmidt FL conduziram estudos relacionados com o açaí e seu processamento.
Alves DP foi responsável pela infraestrutura e produção dos modelos animais imunocomprometidos (scid).
Referências
1. Organização Pan-Americana da Saúde. Doença de Chagas. Guia para vigilância, prevenção, controle e manejo clínico da doença de Chagas aguda transmitida por alimentos. Rio de Janeiro: Organização Pan-Americana da Saúde; 2009. [Série Manuais Técnicos, 12]
2. Camandaroba EL, Pinheiro Lima CM, Andrade SG. Oral transmission of Chagas disease: importance of Trypanosoma cruzi biodeme in the intragastric experimental infection. Revista do Instituto de Medicina Tropical de São Paulo. 2002; 44(2):97-103.
3. Pereira KS, Schmidt FL, Guaraldo AMA, Franco RMB, Dias VL, Passos LAC. Chagas' disease as a foodborne illness. Journal of Food Protection. 2009; 72(2):441-446.
4. Pérez-Gutiérrez E, Agrelo RS, Figueroa R. Consulta técnica em epidemiologia, prevenção e manejo da transmissão da doença de Chagas como doença transmitida por alimentos. Revista da Sociedade Brasileira de Medicina Tropical. 2006; 39(5):512-514.
5. Pereira KS, Schmidt FL, Barbosa-Labello R, Guaraldo AMA, Franco RMB, Dias VL, et al. Transmission of Chagas' disease (American trypanosomiasis) by foods. In: Taylor S. Advances in food and nutrition research. California: Elservier; 2010. p. 63-85.
6. Dias JP, Bastos C, Araújo E, Mascarenhas AV, Martins Netto E, Grassi F, et al. Surto de doença de Chagas aguda associada à transmissão oral. Revista da Sociedade Brasileira de Medicina Tropical. 2008; 41(3):296-300.
7. Rogez H. Açaí: preparo, composição e melhoramento da conservação. Belém: EDUFPA; 2000.
8. Ministério da Saúde. Secretaria de Vigilância em Saúdel. Doença de Chagas aguda: Nota Técnica 2007 [Internet]. Brasília: Ministério da Saúde; 2007 [acessado em 12 dez. 2007]. Disponível em http://portal.saude.gov.br/portal/arquivos/pdf/nota_chagas_091007.pdf.
9. Nóbrega AA, Garcia MH, Tatto E, Obara MT, Costa E, Sobel J, et al. Oral transmission of Chagas disease by consumption of açaí palm fruit, Brazil. Emerging Infectious Diseases. 2009; 15(4):653-655.
10. Ministério da Saúde. Secretaria de Vigilância em Saúde. Doença de Chagas aguda por transmissão oral: Nota Técnica 2007 [Internet]. Brasilia: Ministério da saúde; 2007 [acessado em 12 dez. 2007]. Disponível em http://portal.saude.gov.br/portal/arquivos/pdf/nota_chagas2609.pdf
11. Valente SAS, Valente VC, Pinto AYN. Por que ocorrem episódios familiares de doença de Chagas associado à transmissão oral na Amazônia brasileira? Revista da Sociedade Brasileira de Medicina Tropical; 2002; 35(I):165. In: Anais do 38a Congresso da Sociedade Brasileira de Medicina Tropical; 2002; Foz do Iguaçu. Brasil. Foz do Iguaçu: Sociedade Brasileira de Medicina Tropical; 2002.
12. Brener Z. Therapeutic activity as criterion of cure on mice experimentally infected with Trypanosoma cruzi. Revista do Instituto de Medicina Tropical de São Paulo. 1962; 4(6):389-396.
13. Mezadri TJ, Tomaz VA, Amaral VLL. Animais de Laboratório: cuidados na iniciação experimental. Florianópolis: UFSC; 2004.
14. Santos BF. Macro e micro ambientes. In: Animais de laboratório: criação e experimentação. Rio de Janeiro: Fiocruz; 2002.
15. Merusse JLB, Lapichik VBV. Instalações e equipamentos. In: Manual para técnicos em bioterismo. 2a ed. São Paulo: EPM; 1996.
16. Araújo-Jorge TC, Pirmez C. Normas de segurança para o trabalho com Trypanosoma cruzi. In: Araújo-Jorge TC, Castro SL, organizadores. Doença de Chagas: manual para experimentação. Rio de Janeiro: Fiocruz; 2000. p.125-132.
17. Amato-Neto V, Lopes MH, Umezawa ES, Ruocco RMSA, Dias JCP. Outras formas de transmissão do Trypanosoma cruzi. Revista de Patologia Tropical. 2000; 29 Suppl:S115-130.
18. Dias JCP. Notas sobre o Trypanosoma cruzi e suas características bio-ecológicas, como agente de enfermidades transmitidas por alimentos. Revista da Sociedade Brasileira de Medicina Tropical. 2006; 39(4):370-375.
19. Añez N, Crisante G. Supervivencia de formas de cultivo de Trypanosoma cruzi en alimentos experimentalmente contaminados. Boletín de Malariología y Salud Ambiental. 2008; 48(1):91-94.
20. Calvo-Méndez ML, Nogueda-Torres B, Alejandre-Aguilar R, Cortés-Jiménez M. Infección experimental con Trypanosoma cruzi a través de agua y alimentos contaminados. Revista Latino-Americana de Microbiología. 1994; 36(1):67-69.
21. Diaz-Ungría C. Estudio experimental del Trypanosoma cruzi en el perro y otros vertebrados. El problema de la transmisión. Kasmera (Venezuela). 1968; 3:73-88.
22. Soares VA, Dias JCP, Marsden PD. Sobrevivência do Trypanosoma cruzi em caldo de cana: resultados preliminares. Revista da Sociedade Brasileira de Medicina Tropical. 1987; 20 Suppl 2:S38.
23. Bosma GC, Custer RP, Bosma MJ. A severe combined immunodeficiency mutant in the mouse. Nature. 1983; 301:527-530.
24. Alves DP. Trypanosoma cruzi: A influência dos linfócitos T na regulação da infecção experimental em camundongos SCID. [Dissertação de Mestrado]. Campinas (SP): Universidade Estadual de Campinas; 1998.
25. Oliveira MSP, Carvalho JEU, Nascimento WMO, Muller CH. Cultivo do açaizeiro para produção de fruto: Circular Técnica 26. Belém: Empresa Brasileira de Pesquisa Agropecuária; 2002.
 Endereço para correspondência:
Endereço para correspondência:
Rua 5 de Junho, s/no,
Cidade Universitária Zeferino Vaz,
Barão Geraldo, Campinas-SP, Brasil.
CEP: 13083-877
E-mail: luizaugusto@cemib.unicamp.br
Recebido em 17/01/2011
Aprovado em 26/05/2012
*Estudo financiado pelo convênio no 667/2008, firmado entre o Ministério da Saúde e a Universidade Estadual de Campinas, intitulado 'Análise da interferência da polpa de açaí na transmissão oral de Trypanosoma cruzi, contribuindo para o surgimento de surtos de doença de Chagas aguda na Região Norte do Brasil'.













