Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Epidemiologia e Serviços de Saúde
versión impresa ISSN 1679-4974versión On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.21 n.2 Brasília jun. 2012
http://dx.doi.org/10.5123/S1679-49742012000200006
ARTIGO ORIGINAL
Avaliação da performance de metodologias de detecção de Cryptosporidium spp. e Giardia spp. em água destinada ao consumo humano, para o atendimento às demandas da Vigilância em Saúde Ambiental no Brasil
Performance evaluation of different methodologies for detection of Cryptosporidium spp. and Giardia spp. in water for human consumption to meet the demands of the Environmental Health Surveillance in Brazil
Regina Maura Bueno FrancoI; Elayse Maria HachichII; Maria Ines Zanolli SatoII; Rita Maria L. NaveiraIII; Eduardo de Carvalho SilvaIII; Marcela M. de C. CamposIII; Romeu Cantúsio NetoIV; Daniel Adolpho CerqueiraV; Nilson BrancoI; Diego Averaldo Guiguet LealI
ILaboratório de Protozoologia, Instituto de Biologia, Universidade Estadual de Campinas, Campinas-SP, Brasil
IICompanhia Ambiental do Estado de São Paulo, São Paulo-SP, Brasil
IIIFundação Ezequiel Dias, Belo Horizonte-MG, Brasil
IVSociedade de Abastecimento de Água e Saneamento, Campinas-SP, Brasil
VCompanhia de Saneamento de Minas Gerais, Belo Horizonte-MG, Brasil
RESUMO
OBJETIVO: avaliar a performance de três protocolos de concentração de cistos e oocistos em amostras de água bruta de rios brasileiros.
MÉTODOS: os protocolos estudados foram precipitação química, filtração em membranas de 47mm de diâmetro e 3µm de porosidade nominal e filtração com o sistema Filta-Max®. Amostras de água bruta coletadas de rios nos estados de São Paulo e Minas Gerais foram analisadas após contaminação artificial. Os resultados de precisão inicial e recuperação de organismos marcados (Color-Seed®) foram comparados com os critérios da Agencia de Proteção Ambiental dos Estados Unidos da América (USEPA).
RESULTADOS: Nos ensaios de precisão inicial para cistos de Giardia, a filtração em membranas e com Filta-Max® atingiram os critérios da USEPA para recuperação de cistos. Para Cryptosporidium, somente o procedimento com Filta-Max® alcançou os critérios.
CONCLUSÃO: o sistema Filta-Max® foi o único método que atingiu todos os critérios para identificação de Cryptosporidium e Giardia em água.
Palavras-chave: Cryptosporidium; Giardia; Métodos de Detecção; Água.
ABSTRACT
OBJECTIVE: this study aimed to evaluate three different concentration protocols of cysts and oocysts in raw water samples in Brazilian rivers.
METHODS: the protocols studied were chemical precipitation, filtration in membranes of 47mm of diameter versus nominal porosity of 3µm and filtration using Filta-Max® system. The raw water samples collectedfrom rivers in the states of São Paulo andMinas Gerais were analyzed after being seeded with Color-Seed®. The results of initial precision using filtration in membranes and recovery of Color-Seed® organisms were compared to the acceptance criteria established by the United States Environmental Protection Agency (USEPA).
RESULTS: The study of initial precision to Giardia using filtration in membranes and recovery of Color-Seed® met the USEPA criteria; for Cryptosporidium only the Filta-Max® achieved the established criteria.
CONCLUSION: Filta-Max® system showed to be the only method that achieved all the performance criteria for identification of Giardia and Cryptosporidium in water.
Key words: Cryptosporidium; Giardia; Detection Methods; Waters.
Introdução
Hoje, 2,5 a 3 bilhões de pessoas no mundo não têm acesso a água de qualidade e em quantidade suficiente para viver. Dados globais da Organização Mundial da Saúde - OMS - estimam que 3,4 milhões de pessoas, principalmente crianças, morrem de enfermidades relacionadas à água, anualmente. As doenças diarreicas, associadas à falta de saneamento, à higiene precária e aos suprimentos inadequados de água, matam 2,2 milhões de pessoas/ano.1,2 As doenças de veiculação hídrica particularmente, sobretudo aquelas causadas por protozoários intestinais, emergiram como um dos principais problemas de Saúde Pública nos últimos 25 anos.
Após 1980, os protozoários parasitas Cryptosporidium spp e Giardia spp têm-se destacado como os principais contaminantes associados à veiculação hídrica: no mínimo, 325 surtos epidêmicos associados aos protozoários parasitas e transmitidos pela água já foram reportados no globo.3,4
Embora a presença de protozoários em águas para consumo humano revele-se como um importante problema de Saúde Pública em diversos países, o conhecimento sobre esses riscos todavia é escasso no Brasil.5 A inexistência de dados devidamente documentados e comprovados sobre a ocorrência de surtos de giardiose e de criptosporidiose de transmissão hídrica no país3 mostrou a necessidade da implantação e otimização dos métodos de detecção e quantificação de cistos de Giardia spp e oocistos de Cryptosporidium spp em amostras de água. É mister ressaltar que a pesquisa de cistos e oocistos em suprimentos de águas naturais é difícil, as técnicas atuais ainda estão sujeitas à grande variabilidade e baixa reprodutibilidade, proporcionalmente ao aumento da turbidez, e representam um alto custo frente aos métodos usados para medir outros parâmetros de qualidade de água.6
No Brasil, os surtos descritos até o momento, em sua maioria, referem-se a episódios entre crianças frequentadoras de creches, decorrentes da transmissão por contato interpessoal. Entretanto, a demanda da Saúde Pública pela implantação de pesquisa dos protozoários patogênicos é real no país, haja vista o período de 1999 a 2001, quando surtos epidêmicos de ciclosporose (n=2) e de toxoplasmose (n=1), de transmissão pela água distribuída à população, ocorreram nos estados de São Paulo e Paraná, atingindo aproximadamente 1.075 pessoas.3
A qualidade dos recursos hídricos é um aspecto fundamental para a água de abastecimento público. A legislação brasileira representa um avanço ao priorizar o uso das águas para abastecimento e determinar parâmetros de qualidade: recentemente, na atualização da legislação que estabelece o padrão de potabilidade e os procedimentos relativos ao controle e vigilância da qualidade da água para consumo humano (Portaria MS no 518/2004,7 substituída pela Portaria MS no 2.914/2011),8 foi introduzido o monitoramento da presença desses protozoários, que deverá ser realizado quando a média geométrica anual de E. coli encontrada na água bruta superficial for maior ou igual a 1000 E. coli /100 ml. Se a pesquisa desses protozoários patogênicos é uma meta a ser implantada pelas Estações de Tratamento de Água e órgãos de vigilância sanitária e epidemiológica, pouco se tem registrado sobre a verdadeira extensão do problema no país, incluindo informações epidemiológicas e de qualidade parasitológica da água.9
Para o diagnóstico da presença de Cryptosporidium spp. e de Giardia spp. em água, as metodologias propostas incluem a filtração em cartuchos10,11 ou método ICR, a filtração em membranas,12 a floculação em carbonato de cálcio13 e o Método 1623 da Agência de Proteção Ambiental dos Estados Unidos da América (USEPA).14 Deve-se ressaltar que essas metodologias foram delineadas e padronizadas em países como os EUA, Austrália e Canadá, cujos recursos hídricos são preservados por leis específicas visando ao controle da poluição e degradação dos mananciais.15 Desse modo, torna-se interessante avaliar a performance das principais metodologias de detecção de protozoários em água quando aplicadas em mananciais que representam a realidade do Brasil, com presença de contaminantes, elevada turbidez e matéria orgânica. Apenas 28,5% dos municípios brasileiros tratam todo o esgoto coletado, o que "...impacta negativamente na qualidade de nossos recursos hídricos".16
Foi objetivo deste estudo avaliar a performance das diferentes metodologias de concentração para a pesquisa de Cryptosporidium spp. e Giardia spp. em águas captadas para consumo humano, coletadas de rios localizados nos estados de São Paulo e Minas Gerais no ano de 2011. Trata-se de uma avaliação interlaboratorial visando à implantação da capacidade de pesquisa de oocistos e cistos em amostras de água bruta superficial, em atendimento à demanda da Vigilância em Saúde Ambiental.
Métodos
Foi proposta a experimentação de três metodologias para concentração das amostras de água destinadas às análises de Cryptosporidium spp e Giardia spp. Três instituições participaram dessa comparação de metodologias, considerando-se a experiência previa do laboratório na execução do método:
- A Fundação Ezequiel Dias - Funed - de Minas Gerais (MG), com a colaboração da Companhia de Saneamento de Minas Gerais (COPASA, MG), avaliou a técnica de concentração por floculação com carbonato de cálcio.13 Neste procedimento, a amostra de água é submetida a agitação rápida, com a adição de 100ml das soluções de cloreto de cálcio (1M) e bicarbonato de sódio (1M); a seguir, o pH é elevado até 10, com solução de hidróxido de sódio (1M). Após um período de sedimentação (overnight), o sobrenadante é descartado e o precipitado formado é dissolvido empregando-se 200ml da solução de ácido sulfâmico a 10,0%, concentrado por sucessivas centrifugações (3000 x g; 10 min).
- A Companhia Ambiental do Estado de São Paulo - Cetesb - avaliou o Método 1623 da USEPA empregando a concentração por filtração com sistema Filta-Max® (fluxo de 4L/min). Após a filtração, a matriz filtrante (espumas filtrantes) é retirada do módulo do filtro, acondicionada em saco plástico, lavada com adição de solução tampão de fosfato contendo Tween 80 e comprimida; o liquido resultante é centrifugado a 1250 x g (15 min.).
- A Universidade Estadual de Campinas - Unicamp -, com a colaboração da Sociedade de Abastecimento de Água e Saneamento - Sanasa - de Campinas-SP, executaram a avaliação do método de concentração por filtração empregando membrana de ésteres mistos de celulose de porosidade nominal de 3µm e 47mm de diâmetro. Esta metodologia foi modificada para a detecção de protozoários em água no Laboratório de Protozoologia da Unicamp, com a colaboração da Sanasa/Campinas-SP, e foi objeto de várias publicações nacionais e internacionais.17-20 A amostra de água é filtrada mediante bomba de vácuo (fluxo de 4L/min.) e sistema porta-filtro; após filtração, o material é eluído a partir da superfície da membrana mediante a lavagem e raspagem da mesma com solução de Tween 80 a 0,01%. O material resultante é concentrado por dupla centrifugação (1050 x g; 10 min.).
Após a concentração e eluição dos organismos-alvos nas diversas amostras de água analisadas pelas metodologias escolhidas para avaliação, acrescentando-se a etapa de purificação mediante a separação imunomagnética (Dynabeads® GC-Combo IMS kit; Dynal), a detecção dos protozoários foi realizada por microscopia de imunofluorescência, pelos três laboratórios, empregando-se anticorpos monoclonais anti-Cryptosporidium e anti-Giardia adquiridos comercialmente, tendo-se como critérios de positividade o tamanho, o formato dos organismos e a cor e intensidade de fluorescência.
No caso da purificação dos organismos-alvo mediante separação imunomagnética, foi utilizada a dissociação ácida para o procedimento de filtração em membranas, enquanto para as metodologias de floculação em carbonato de cálcio e o Método 1623, empregou-se a dissociação térmica.
A avaliação interlaboratorial das metodologias foi realizada em duas etapas diferentes, a saber:
- Na primeira etapa, o objetivo era verificar o comportamento de cada um dos três métodos, em termos de recuperação e precisão, na ausência de interferências de matriz. Foram utilizadas amostras de 10L de água reagente, contaminada com uma suspensão padronizada de cistos e oocistos (Easy-Seed®) adquirida comercialmente. Cada laboratório preparou suas amostras. Foram processadas quatro réplicas e um controle negativo.
- Na segunda etapa, foram utilizadas amostras de águas brutas superficiais de mananciais das cidades de Belo Horizonte-MG (Córrego Ressaca - tributário do reservatório da Pampulha, Belo Horizonte-MG; latitude 19o51.750'; longitude 043o58.877') e São Paulo-SP (Baixo Cotia, localizado na região Metropolitana de São Paulo-SP; latitude 23o32.25'; longitude 46o51.45'), uma vez que o objetivo era verificar o efeito das características da matriz (água bruta superficial, sob influencia de lançamentos de esgotos domésticos e industriais) sobre a recuperação de organismos. As amostras foram contaminadas (quatro réplicas) com Color-Seed® - suspensão padronizada contendo 100 cistos de Giardia e 100 oocistos de Cryptosporidium corados com corante fluorescente vermelho (sulforodamina, que recebe o nome de Texas-Red®) -, o que permite diferenciação entre os organismos inoculados dos ambientais. Também foi processada uma amostra negativa. Foi avaliado o efeito de matriz da água sobre a sensibilidade e precisão das três metodologias.
Os resultados obtidos (média de porcentagem de recuperação dos oocistos e cistos, desvio-padrão e coeficiente de variação (CV, expresso como desvio-padrão relativo máximo) foram comparados aos critérios de performance estabelecidos pela Agência de Proteção Ambiental dos EUA, como descrito por Bellamy21 e Cantusio Neto e colaboradores.22 A recuperação média aceitável para cistos e oocistos nos ensaios de precisão inicial é de 24,0-100,0%; e para os testes de efeito da matriz, de 13,0-111,0% para cistos e de 15,0-118,0% para oocistos (Tabela 1). Os critérios de performance adotados neste estudo estão fundamentados na Seção V, artigo 22 da Portaria MS no 2.914/2011.8

Para as formas naturalmente presentes nas amostras, o número de oocistos/litro foi estimado com base na seguinte fórmula:
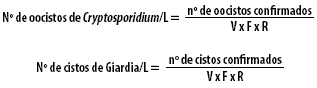
Onde:
V = fração do pellet purificado por IMS
F = fração da amostra analisada ao microscópio
R = volume (em litros) da amostra filtrada
Resultados
Nos ensaios de precisão inicial para cistos de Giardia, as metodologias de filtração em membranas e filtração pelo sistema Filta-Max® atingiram os critérios para recuperação de cistos adotados por este estudo (Tabelas 1 e 2); para Cryptosporidium, somente o procedimento de filtração pelo sistema Filta-Max® alcançou os critérios de performance estabelecidos pela Agência de Proteção Ambiental dos EUA. Devese salientar que para a metodologia de filtração em membranas, um ensaio detectou um valor anômalo de recuperação de oocistos, pois no vial do inóculo Easy-Seed® foi observada agregação de oocistos (o número de oocistos detectados no ensaio 3 foi de 315, valor excluído por estes autores para o calculo da média). No caso da floculação em carbonato de cálcio, não houve recuperação de oocistos (Tabela 2).

Na segunda etapa, quando analisadas as amostras de água bruta superficial do Córrego Ressaca (Belo Horizonte-MG), não foi possível obter resultados para a metodologia empregando a filtração pelo sistema Filta-Max® (Tabela 3), devido à turbidez da amostra. Apenas a metodologia de floculação em carbonato de cálcio atendeu aos critérios de performance estipulados pela USEPA para ambos os protozoários: recuperação média de cistos de 39,9±22,1; e recuperação média de oocistos de 26,8±5,3 (Tabela 3).

Em relação aos cistos e oocistos naturalmente presentes nas amostras do Córrego Ressaca, foram obtidos os seguintes resultados: para a metodologia de filtração em membranas, foram detectados 95, 43, 07 e 65 cistos; e para Cryptosporidium, apenas 1 oocisto foi visualizado nas amostras. Quando empregada a metodologia de floculação em carbonato de cálcio, foram detectados: 283, 242, 125 e 65 cistos; e 39, 22, 159 e 115 oocistos.
Quando examinadas as amostras do Baixo Cotia, região Metropolitana de São Paulo-SP, as três metodologias empregadas geraram resultados: para cistos de Giardia, tanto a filtração em membranas como pelo sistema Filta-Max® alcançaram eficiência de recuperação: respectivamente, 45,8% e 41,3% (Tabela 4). Entretanto, para oocistos de Cryptosporidium, apenas o sistema Filta-Max® apresentou performance de acordo com os critérios de aceitação estabelecidos pela USEPA. As seguintes condições foram observadas para as amostras do Baixo Cotia: a turbidez variou de 17,9 a 18,5 ntu; o valor de pH, de 7.15 a 7.25; e a cor, de 90,4 a 91 Hz.
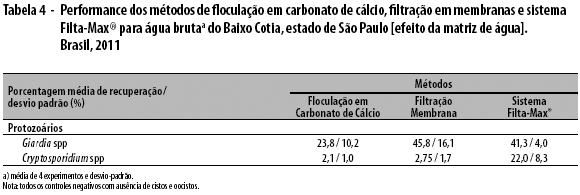
Consideradas as formas de resistência naturalmente presentes nas amostras da água superficial do Rio Cotia, na captação da Estação de Tratamento de Água do Baixo Cotia, foram encontrados 144, 100, 94, 97 cistos de Giardia e 4, 7, 9, 1 oocistos de Cryptosporidium, ao empregar o sistema Filta-Max®; e ao utilizar a filtração em membranas, foram detectados, no mesmo manancial, 159, 273, 238, 196 cistos de Giardia e 3, 2, 1, 1 oocistos de Cryptosporidium. Os resultados gerados pelo procedimento de floculação em carbonato de cálcio foram: 159, 86, 140, 72 cistos; e <1, 3, 5, 1, 2 oocistos.
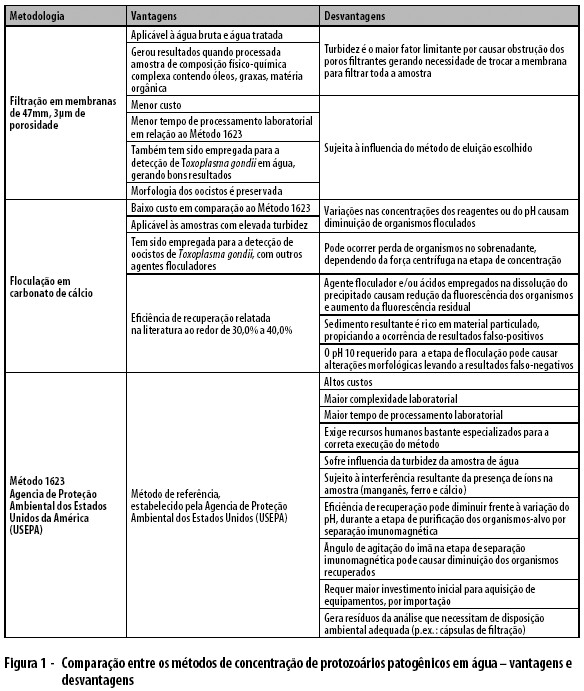
Finalmente são apresentadas, para apreciação e comparação, as vantagens e desvantagens no uso de cada uma das metodologias de concentração de protozoários patogênicos em água, analisadas neste estudo (Figura 1).
Discussão
Considerando-se que a dose mínima infectante para o ser humano, tanto no caso da criptosporidiose como na giardiose, é baixa - ao redor de 10 a 100 cistos e 9 a 1042 oocistos,23,24 a depender da cepa -, é importante que as metodologias de detecção de protozoários em água apresentem sensibilidade e especificidade efetivas no sentido de concentrar pequenos números de (oo) cistos usualmente presentes nas amostras ambientais.
Não existe um procedimento universalmente aceito.25 Nos EUA, a Agencia de Proteção Ambiental desenvolveu o Método 1623, que permanece como referencia, empregando pequenos volumes (10 litros); e no Reino Unido, os SOP (standard opperating procedures, ou procedimentos operacionais padrão) empregam grandes volumes de água tratada. Ambos os métodos são baseados na performance, requerendo o uso de filtração, separação imunomagnética para purificação de organismos-alvo e detecção empregando imunofluorescência direta e teste confirmatório de morfologia com corantes vitais fluorogênicos, além de DIC (differential interference contrast, ou contraste de interferência diferencial).25
A concentração da amostra durante a filtração resulta no acúmulo de partículas de tamanho similar ao dos oo/cistos. A presença de sujidades na amostra concentrada é um dos principais fatores limitantes da eficiência de recuperação das metodologias. De acordo com Smith e Nichols,25 é grande a probabilidade de os oocistos ficarem encobertos nessa sujidade, ao redor de 108:1 em 10 litros de água bruta. São considerações possíveis de explicar a dificuldade na obtenção de resultados quando empregada a metodologia Filta-Max® pela Cetesb/SP para a análise de uma amostra complexa como a do manancial de Belo Horizonte-MG. Nessas situações, quando a amostra contém grande quantidade de material particulado, pequenos volumes devem ser amostrados e os oocistos recuperados, por filtração ou por floculação [(anônimo) 1999; disponível em //www.epa.gov/microbes/1623de05.pdf], o que justifica a inclusão de metodologias alternativas como a floculação química e a filtração em membranas nesta avaliação de performance de métodos mais adequados à realidade nacional.
A metodologia de floculação com carbonato de cálcio não apresentou bons resultados nos testes com água reagente (controle) - primeira etapa. Explicações para esse fato podem se encontrar tanto na constatação de que a floculação funciona melhor para águas com alguma turbidez ou substâncias passíveis de floculação (diferentemente da água reagente), como na possível perda de (oo)cistos durante a etapa de aspiração do sobrenadante, devido à ausência de material floculado. Em se tratando de água reagente, essa perda pode ser acentuada nessa etapa.
O método de filtração em membrana apresentou boa recuperação média de cistos e oocistos. Porém, o sistema Filta-Max® foi o que mostrou melhores taxas de recuperação, tanto para cistos de Giardia spp quanto para oocistos de Cryptosporidium spp, um resultado esperado para este que é o método de referência internacional.
Nos testes com água bruta - segunda etapa -, um dos principais fatores que influenciaram o desempenho das diversas metodologias foi a complexidade da matriz de água colhida do Córrego Ressaca (Belo Horizonte-MG): a presença de óleos, graxas, ferro, matéria orgânica e grande quantidade de material em suspensão (possivelmente algas) dificultaram o processo analítico, principalmente a visualização ao microscópio dos (oo)cistos provenientes do produto Color-Seed® (fluorescência vermelha). Essas condições interferiram principalmente na execução do teste da metodologia de filtração pelo sistema Filta-Max®. Por isso, a Cetesb/SP não apresentou resultados referentes a essa amostra, embora as metodologias de filtração em membranas e floculação em carbonato de cálcio tenham se mostrado adequadas para um processamento de amostras complexas como essas.
Sabe-se que a turbidez muito elevada de amostras pode influenciar negativamente na separação imunomagnética, esta que é uma etapa para captura de cistos e oocistos livres e não daqueles ligados a sedimentos e outras partículas. Além disso, metais pesados, presentes na amostra, também interferem na ligação dos complexos 'esferas magnéticas-anticorpos de captura-protozoários'. Quanto maior o precipitado obtido na etapa de centrifugação, menor a eficiência de recuperação pela separação imunomagnética.
Quando o interesse é avaliar a capacidade infectante, a metodologia de floculação com carbonato de cálcio é contraindicada, considerando o alto valor de pH no qual a precipitação química ocorre (pH 10) e o tempo prolongado em que permanece nessas condições (overnight), o que pode alterar ou lesar cistos e oocistos, comprometer ensaios de infectividade e, dessa forma, representar uma restrição para situações de investigação de surtos. Durante a floculação, outrossim, a precipitação química em pH elevado, por período prolongado (overnight), e a posterior dissolução do sedimento em ácido sulfâmico podem acarretar deformações nos cistos e oocistos, implicando maior dificuldade no reconhecimento dos parasitas ao microscópio. A floculação com carbonato de cálcio não é um procedimento rápido (a amostra permanece floculando overnight) e há, também, a manipulação de reagentes ácidos e bases fortes, o que implica maior cuidado laboratorial e procedimentos de biossegurança.
A metodologia de filtração em membrana com 47mm de diâmetro apresentou bons resultados de recuperação de cistos e oocistos. Essa metodologia é de menor custo e muitos laboratórios (Laboratórios Centrais de Saúde Públicas - Lacen -; e empresas de saneamento) já contam com a infraestrutura (equipamentos de filtração) necessária para esse procedimento. Ademais, o volume menor de amostra (um litro) pode ser um fator facilitador para a coleta, transporte de amostras e realização desse tipo de análise. Essa metodologia também sofre os efeitos de alta turbidez, o que pode levar ao processamento de um maior número de membranas para filtrar o volume desejado da amostra, como foi o caso da amostra do Córrego Ressaca, em que foram necessárias 4 membranas para processar uma amostra.
Fator importante a considerar é que os métodos de filtração (em membrana; e pelo sistema Filta-Max®) podem manter a capacidade infectante dos protozoários e permitir a realização de PCR (técnica de biologia molecular) a partir do material retido na membrana.
A metodologia de filtração utilizando o sistema Filta-Max® alcançou os melhores resultados de recuperação de cistos e oocistos, confirmando o motivo pelo qual esse é o método de referência internacional, validado pela USEPA. Trata-se de um método relativamente rápido (semelhante à filtração em membrana), que apresenta como desvantagem o alto custo da análise: R$ 19.837,00 para a aquisição do Filta-Max Sarter Kit® e dos filtros de espuma suficiente, suficientes para a análise de 10 amostras (preço consultado na data de conclusão deste relato).
Na comparação dos resultados obtidos, relativamente aos critérios de controle de qualidade estabelecidos pelo Método 1623/USEPA (2005) para determinação da precisão e recuperação inicial (contaminação de amostras de água reagente com Easy-Seed®), precisão e recuperação contínua (contaminação de amostras de campo com Color-Seed®), apenas a metodologia de filtração pelo sistema Filta-Max® atende a todos os critérios de aceitação para métodos de análise de Cryptosporidium e Giardia.
Em conjunto, os resultados obtidos pelo presente estudo demonstram o grau de performance das principais metodologias de detecção de protozoários em água, quando aplicadas em mananciais representativos da realidade nacional: existência de contaminantes, elevada turbidez e alta presença de matéria orgânica. Deve-se ressaltar que pH, presença de cátions divalentes, ferro e algas afetam a ligação dos anticorpos na separação imunomagnética.26 Além disso, no caso da filtração em membranas, alguns fatores podem explicar a menor recuperação para os oocistos de Cryptosporidium.
Na filtração em membranas, foi utilizada a dissociação ácida, enquanto nas duas outras metodologias, empregou-se a dissociação térmica, que, sabidamente, resulta em maiores recuperações, e, de acordo com o protocolo discutido nas reuniões, apenas uma etapa de dissociação foi empregada. Já nos processamentos pelo sistema Filta-Max® e por floculação, a fase de dissociação térmica foi repetida duas vezes, o que pode ter contribuído para a maior sensibilidade destas metodologias na etapa de efeito da matriz de água. Durante a leitura microscópica da amostra, levou-se em consideração apenas os oocistos na cor verde-maçã brilhante, não sendo enumerados os que mostraram fluorescência fraca.
A contaminação dos recursos hídricos por protozoários patogênicos de veiculação hídrica tem ocorrido em todo o mundo e aí está um grande desafio para os sistemas produtores e distribuidores de água. Uma estruturação laboratorial adequada faz-se necessária no país, portanto.
As diferentes metodologias empregadas para a pesquisa de protozoários patogênicos em água estão sujeitas a várias limitações. Além dos altos custos e da necessária importação dos insumos imprescindíveis, elas requerem recursos humanos especializados para sua correta execução. Também é grande a variabilidade dos resultados gerados e baixa a eficiência de recuperação (em geral, variando de 1,0 a 50,0%, mesmo quando empregado o método de referencia - Método 1623/USEPA), pois a obtenção de resultados é influenciada pela turbidez e composição físico-química da amostra. Outrossim, é relevante que em situação de surto epidêmico, essas metodologias não permitem a identificação da espécie de protozoário - o que pode ser útil para determinar a fonte da contaminação -, tampouco fornecem informações sobre a infectividade dos organismos detectados na amostra ambiental.
Em suma, a escolha da metodologia de detecção de protozoários em água deve levar em consideração o propósito da análise, as vantagens e desvantagens de cada metodologia, o tipo de amostra de água e sua qualidade físico-química e microbiológica, assim como a prática desenvolvida pelo laboratório na execução da análise parasitológica, além dos custos implicados.
Contribuição dos autores
Todos tiveram igual participação no projeto de pesquisa e redação do artigo.
Referências
1. Brundtland GH. Water Supply Sanitation and Hygiene Links to Health. Geneva: World Health Organization; 2002 [Internet]. [Acessado em 15 de mar. 2002]. Disponível em http://www.who.int/docstore/water_sanitation_health/general/facts&fig.pdfdiseases/shlinks.pdf.
2. Oliveira PW. Ocorrência de cistos de Giardia spp. e oocistos de Cryptosporidium spp. no Rio Atibaia, Bacia do Rio Piracicaba, Campinas, São Paulo, Brasil [Dissertação de Mestrado]. Campinas (SP): Universidade Estadual de Campinas; 2005.
3. Franco RMB. Protozoários de veiculação hídrica: relevância em Saúde Pública. Revista Panamericana de Infectologia. 2007; 9(4):36-43.
4. Karanis P, Kourenti C, Smith H. Waterborne transmission of protozoan parasites: a worldwide review of outbreaks and lessons learnt. Journal of Water and Health. 2007; 5:1-38.
5. Heller L, Bastos RKX, Vieira MBCM, Bevilacqua PD, Brito LLA, Mota SMM, et al. Oocistos de Cryptosporidium e cistos de Giardia: circulação no ambiente e riscos à saúde humana. Epidemiologia e Serviços de Saúde. 2004; 13(2):79-92.
6. Atherholt TB, LeChevalier MW, Norton WD, Rose JS. Effect of rainfall on Giardia and Crypto. Journal of American Water Works Association. 1998; 90(9):66-80.
7. Ministério da Saúde. Secretaria de Vigilância em Saúde. Coordenação-Geral de Vigilância em Saúde Ambiental. Portaria n. 518, de 24 de março de 2004. Padrão de Potabilidade da Água para Consumo Humano. Brasília. 2004. Ministério da Saúde. Brasília: Ministério da Saúde; 2005. (Série E. Legislação em Saúde)
8. Portaria n. 2914, de 12 de dezembro de 2011. Dispõe sobre os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. Diário Oficial da União, Brasília, p. 39, 12 dez. 2001. Seção 1.
9. Bastos RKX, Bevilacqua PD, Heller L, Vieira MBCM, Brito LLA. Abordagem sanitário-epidemiológica do tratamento e da qualidade parasitológica da água: entre o desejável e o possível. In: Anais do 21o congresso Brasileiro de Engenharia Sanitária e Ambiental; 2001; João Pessoa, Brasil. João Pessoa: Associação Brasileira de Engenharia Sanitária; 2001.
10. Fricker CR, Crabb JH. Water-borne cryptosporidiosis: detection methods and treatment options. Advances in Parasitology. 1998; 40:241-278.
11. Musial CE, Arrowood MJ, Sterling CR, Gerba CP. Detection of Cryptosporidium in water using polypropylene cartdrige filters. Applied and Environmental Microbiology. 1987; 53(4):687-692.
12. Ongerth JE, Stibbs HH. Identification of Cryptosporidium oocysts in river water. Applied and Environmental Microbiology. 1987; 53(4):672-676.
13. Vesey G, Slade JS, Byrne M, Shepperd K, Fricker CRA. A new method for the concentration of Cryptosporidium oocysts from water. Journal of Applied Bacteriology. 1993; 75(1):82-86.
14. United States Environmental Protection Agency. Method 1623: Cryptosporidium and giardia in water by filtration/IMS/FA. 2005. United States: United States Environmental Protection Agency; 2005.
15. Veiga LBE, Magrini EA. Gestão da Qualidade da Água: o Modelo Brasileiro e o Modelo Americano. In: International Workshop Advances in Cleaner Production; 2009; São Paulo, Brazil. São Paulo: Universidade Paulista; 2009
16. Instituto Brasileiro de Geografia e Estatística. Pesquisa Nacional de Saneamento Básico. Ministério das Cidades; 2010 . Rio de Janeiro: Instituto Brasileiro e Estatística; 2010 [Acessado em 20 maio. 2011]. Disponível em http://www.ibge.gov.br/home/estatistica
17. Franco RMB, Rocha-Eberhardt R, Cantusio Neto R. Occurrence of Cryptosporidium oocysts and Giardia Cysts in raw water from the Atibaia River, Campinas, Brazil. Revista do Instituto de Medicina Tropical de São Paulo. 2001; 43(2):109-111.
18. Franco RMB, Cantusio Neto R. Occurrence of cryptosporidial oocysts and Giardia cysts in bottled mineral water commercialized in the city of Campinas, State of São Paulo, Brazil. Memórias do Instituto Oswaldo Cruz. 2002; 97(2):205-207.
19. Cantusio Neto R, Santos LU, Franco RMB. Evaluation of activated sludge treatment and the efficiency of the disinfection of Giardia species cysts and Cryptosporidium oocysts by UV at a sludge treatment plant in Campinas, SP. Water Science and Technology. 2006; 54(3):89-94.
20. Cantusio Neto R, Santos LU, Sato MIZ, Franco RMB. Cryptosporidium spp. and Giardia spp. in surface water supply of Campinas, Southeast Brazil. Water Science and Technology. 2010; 62(1):217-222.
21. Bellamy JEC. Quality assurance considerations for detection of waterborne zoonotic parasites using Cryptosporidium oocyst detection as the main example. Veterinary Parasitology. 2004; 126(1-2):235-248.
22. Cantusio Neto R, Santos LU, Sato MIZ, Franco RMB. Controle de qualidade analítica dos métodos utilizados para a detecção de protozoários patogênicos em amostras de água. Arquivos do Instituto Biológico de São Paulo. 2011; 78(1):169-178.
23. Okhuysen PC, Chappel CL, Sterling CR, DuPont HL. Virulence of three distinct Cryptosporidium parvum isolates for healthy adults. Journal of Infectious Disease. 1999; 180(4):1275-80.
24. Rendtorff RC. The experimental transmission of human intestinal protozoan parasites. II. Giardia lamblia cysts given in capsules. American Journal of Hygiene. 1954; 59(2):209-220.
25. Smith HV, Nichols RAB. Cryptosporidium: detection in water and food. Experimental Parasitology. 2010; 124(1):61-79.
26. Paton CA, Kelsey DE, Reeve EA, Punter K, Crabb JH, Smith HV. Immunomagnet isabel separation for the recovery of Cryptosporidium sp. Oocysts. In: Smith HV, Thompson K. Cryptosporidium: the analytical challenge. Cambridge: The Royal Society of Chemistry; 2002. p.1-3.
 Endereço para correspondência:
Endereço para correspondência:
Instituto de Biologia,
Departamento de Biologia Animal,
Rua Monteiro Lobato, 255,
Campinas-SP, Brasil.
CEP: 13083-862
E-mail: mfranco@unicamp.br
Recebido em 10/08/2011
Aprovado em 30/05/2012













