Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Epidemiologia e Serviços de Saúde
versión impresa ISSN 1679-4974versión On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.21 n.3 Brasília sep. 2012
http://dx.doi.org/10.5123/S1679-49742012000300011
ARTIGO ORIGINAL
Infecção natural de Haemagogus janthinomys e Haemagogus leucocelaenus pelo vírus da febre amarela no Distrito Federal, Brasil, 2007-2008
Haemagogus janthinomys and Haemagogus leucocelaenus naturally infected with yellow fever virus in Federal District, Brazil, 2007-2008
Marcos Takashi ObaraI; Hamilton MonteiroII; Marcia Bicudo de PaulaIII; Almério de Castro Gomes (in memorian)III; Maria Amélia Cavalcanti YoshizawaIV; Ana Raquel LiraIV; Maria Isabel Rao BoffilV; Maria do Socorro Laurentino de CarvalhoIV
ICoordenação-Geral de Laboratórios de Saúde Pública, Secretaria de Vigilância em Saúde, Ministério da Saúde, Brasília-DF, Brasil
IILaboratório de Entomologia da Seção de Arbovirologia e Febres Hemorrágicas, Instituto Evandro Chagas, Secretaria de Vigilância em Saúde, Ministério da Saúde, Belém-PA, Brasil
IIIDepartamento de Epidemiologia, Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo-SP, Brasil
IVNúcleo de Pesquisas Entomológicas e Animais Peçonhentos, Diretoria de Vigilância Ambiental em Saúde, Subsecretaria de Vigilância à Saúde, Secretaria de Estado de Saúde do Distrito Federal, Brasília-DF, Brasil
VNúcleo de Animais Sinantrópicos, Diretoria de Vigilância Ambiental em Saúde, Subsecretaria de Vigilância à Saúde, Secretaria de Estado de Saúde do Distrito Federal, Brasília-DF, Brasil
RESUMO
OBJETIVO: investigar a infectividade natural de Haemagogus janthinomys e Haemagogus leucocelaenus pelo vírus da febre amarela em áreas com notificação de casos humanos e epizootia em primatas não humanos no Distrito Federal (DF), Brasil.
MÉTODOS: realizaram-se capturas de Culicidae utilizando capturador de Castro e puçá, no período de dezembro de 2007 a fevereiro de 2008; a identificação taxonômica e o isolamento viral foram realizados no Instituto Evandro Chagas/Ministério da Saúde; a inoculação em camundongo e o teste de imunofluorescência indireta foram realizados para identificar o agente viral.
RESULTADOS: amostras de Hg. janthinomys e Hg. leucocelaenus procedentes da Região Administrativa de São Sebastião/DF apresentaram positividade para o vírus amarílico.
CONCLUSÃO: a confirmação de infectividade natural por Hg. janthinomys e Hg. leucocelaenus sugere que as áreas pesquisadas são receptivas e vulneráveis ao vírus da febre amarela, tornando imprescindível aprimorar as estratégias de sua vigilância epidemiológica no Distrito Federal.
Palavras-chave: Febre Amarela; Culicidae; Insetos Vetores; Controle de Vetores.
ABSTRACT
OBJECTIVE: to investigate the natural infectivity of Haemagogus janthinomys and Haemagogus leucocelaenus for yellow fever virus in areas with reported human cases and epizootics in non-human primates, in the Federal District (DF), Brazil.
METHODS: Culicidae specimens were captured using hand net and oral aspirator, in the period since December 2007 to February 2008; taxonomic identification and virus research were performed at the Evandro Chagas Institute/Ministry of Health; mouse inoculation and indirect immunofluorescence tests were performed to isolate the viral agent.
RESULTS: pools of Hg. janthinomys and Hg. leucocelaenus proceeding from the Administrative Region of São Sebastião/DF were positive for yellow fever virus.
CONCLUSION: confirmation of natural infectivity by Hg. janthinomys and Hg. leucocelaenus suggests that the area surveyed is receptive and vulnerable to yellow fever virus; therefore, it is essential to improve the strategies for epidemiological surveillance of yellow fever in the Federal District.
Key words: Yellow Fever; Culicidae; Insect Vectors; Vector Control.
Introdução
O vírus da febre amarela ocorre, principalmente, em países das Américas Central e do Sul e da África, onde, desde 1984 até 1996, são notificados, anualmente, cerca de 20.000 casos e 5.447 mortes.1 Na América do Sul, a febre amarela distribui-se por vários ecossistemas florestados, nos quais circula sob ciclos enzoóticos/epizoóticos. Apenas na Região Amazônica, notifica-se cerca de 200 a 300 casos anuais.2 Após o ano 2000, eventos epizoóticos reemergiram fora da Região Amazônica, rompendo uma estabilidade de mais de 50 anos.3
Notificações de casos humanos e de epizootias foram registradas nos estados da Bahia, Minas Gerais, São Paulo e Rio Grande do Sul.4 Entre 2008 a 2009, o número de casos humanos suspeitos e de casos confirmados, registrados pelos serviços de vigilância e monitoramento da febre amarela, foi de 274 e 50 casos, respectivamente. A taxa de letalidade foi de 40,0% (21 óbitos), sendo que grande parte dos óbitos ocorreram na Região Sul do país.5
A inexistência de informações técnicas e pesquisas científicas para o melhor entendimento da dinâmica de circulação viral nas extensas áreas do território brasileiro ainda faz com que sejam necessários estudos, para desencadear medidas de prevenção e controle da transmissão humana. Atualmente, a vigilância de casos humanos, assim como do vetor e de epizootias, inicia-se a partir dos registros de manifestação do vírus. Nessas situações, o vírus tem sido encontrado infectando naturalmente Haemagogus janthinomy6 e Haemagogus leucocelaenus.7,8 Também têm sido registrados Aedes serratus8 e Psorophora ferox9 naturalmente infectados pelo vírus da febre amarela.
O histórico de registros sucessivos dos casos humanos de febre amarela na região Centro-Oeste é referido desde a década de 1970.10 No Distrito Federal (DF), no período de dezembro de 2007 a fevereiro de 2008, confirmou-se a notificação de seis casos humanos confirmados, cujos locais prováveis de infecção foram as áreas rurais das Regiões Administrativas de Planaltina, Sobradinho e Gama.11 No mesmo período, também foi confirmada a positividade para o vírus amarílico em macaco da espécie Callitrix penicillata, procedente de área urbana da Região Administrativa do Guará I.12
O objetivo do presente trabalho foi caracterizar a infecção natural das amostras capturadas durante investigação entomológica de febre amarela em áreas com epizootias de primatas não humanos, no Distrito Federal, Brasil, entre dezembro de 2007 e fevereiro de 2008.
Métodos
O Distrito Federal está localizado entre os paralelos de 15o30' e 16o03' de latitude sul e os meridianos de 47o25' e 48o12' de longitude WGr (48o12' a Oeste do Meridiano de Greenwich), na região Centro-Oeste, ocupando o centro do Brasil e o centro-leste do estado de Goiás. Sua área é de 5.789,16km2 e a população, de 2.455.903 habitantes. O DF está dividido em trinta regiões administrativas. Segundo a classificação de Köppen, o clima é tropical, concentrando-se no verão as precipitações. O período mais chuvoso corresponde aos meses de novembro a janeiro, e o período seco coincide com o inverno, especialmente nos meses de junho e agosto.13 A vegetação é do tipo cerrado, em gradiente de formas fisionômicas que dependem do substrato.14
Os pontos de captura de Culicidae foram selecionados e definidos a partir da notificação de casos e/ou óbitos humanos confirmados de febre amarela silvestre e de epizootia de primatas não humanos. As capturas foram realizadas em: áreas urbanas das Regiões Administrativas do Guará I (15o55'22.05"S e 47o46'36.96"O) e do Lago Norte (15o46'07.07"S e 47o48'47.20''O); áreas periurbanas das Regiões Administrativas de São Sebastião (15o49'5.67"S e 47o58'17.29"O) e Sobradinho II (15o33'45.87''S e 47o46'27.52''O); áreas rurais das Regiões Administrativas do Gama (16o02'31.99''S e 42o14'29.82''O); e áreas silvestres do Parque Nacional de Brasília (15o44'13.90"S e 47o55'39.06"O), localizado na área urbana da Região Administrativa de Brasília (Figura 1).
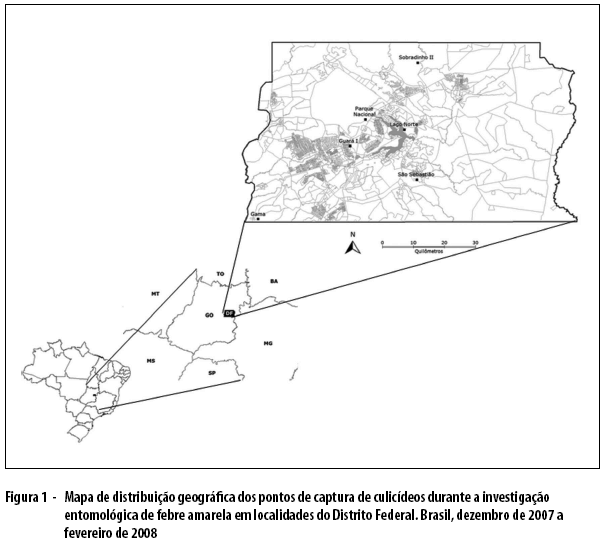
No Guará I, as capturas de mosquitos foram realizadas no Parque Ecológico Urbano Ezequias Hering, a 100m de distância das residências em que foi detectado um macaco morto da espécie Callitrix penicilata. Esse parque apresenta várias espécies da fauna e flora do Bioma Cerrado, entre elas algumas espécies arbóreas de mata de galeria.
As capturas de mosquitos no Lago Norte foram realizadas em um pequeno fragmento de cerrado e nos quintais das residências. Essa região caracteriza-se pelo alto poder econômico da população e possui lotes residenciais extensos em superfície, com fragmentos de cerrado nas áreas adjacentes às habitações.
Em São Sebastião, as capturas foram realizadas em chácara situada na localidade Morro da Cruz, às margens do Córrego Tororó. Nessa chácara, havia quatro residências, com ocupação humana permanente, plantação de milho e frutíferas, e presença de fragmentos de mata de galeria.
Em Sobradinho II, as capturas foram realizadas na atual Região Administrativa da Fercal, localizada na Área de Proteção Ambiental de Cafuringa, onde se encontra a maior reserva de mata mesofítica do Distrito Federal.15 No Gama, as capturas foram realizadas em uma chácara destinada ao ecoturismo, em propriedade situada às margens do Rio das Lages.
No Parque Nacional de Brasília, as capturas foram realizadas em matas próximas às piscinas de visitação pública. Essa área, de cerca de 30.000 hectares, é considerada área de preservação do Bioma Cerrado.
A partir da identificação precisa do local da morte do primata e/ou do caso humano, foram estabelecidos quatro raios de captura, nas direções norte, sul, leste e oeste. A distância entre os pontos de captura foi de 200 a 300m. Em cada ponto permaneceram dois capturadores, os quais trabalharam no período diurno de 09:00h a 15:00h.
As capturas foram realizadas no nível do solo, por um total de dez capturadores devidamente protegidos, em todas as áreas estudadas e por cinco dias consecutivos em cada local, no período de 31 de dezembro de 2007 a 1o de fevereiro de 2008.
Os mosquitos foram capturados com auxílio de capturador de Castro e puçá e introduzidos em recipientes cilíndricos de plástico (9,0 x 11,5 cm), etiquetados com dados de procedência. Após a captura, os mosquitos foram anestesiados em congelador doméstico (-6oC) durante 15 minutos; em seguida, foram transferidos para tubos de criopreservação utilizando-se mesa refrigerada a -20oC e armazenados em nitrogênio líquido a -196oC, para envio ao Laboratório de Entomologia da Seção de Arbovirologia e Febres Hemorrágicas do Instituto Evandro Chagas, do Ministério da Saúde (IEC/MS). A identificação das espécies de mosquitos capturados foi realizada por técnicos do Laboratório de Entomologia da Seção de Arbovirologia e Febres Hemorrágica/IEC/MS, utilizando-se chave dicotômica.16
Para as tentativas de isolamento viral em cultura de células VERO, os lotes de artrópodes hematófagos foram macerados (gral e pistilo) e diluídos em solução salina contendo albumina bovina (0,75%), penicilina (100UI/mL) e estreptomicina (100µg/mL). Cada tubo foi inoculado com um lote de artrópodes e cada inoculação teve um controle positivo (células inoculadas com vírus suscetível ao cultivo celular) e um controle negativo (células não inoculadas). Após a inoculação, todos os tubos foram observados diariamente, durante 14 dias, em microscópio ótico invertido.
O teste de imunofluorescência indireta (IFI) foi realizado com o objetivo de confirmar a infecção celular e identificar o agente viral. Foram utilizados oito grupos de anticorpos policlonais: grupo A (Toga-viridae, Alphavirus); grupo B (Flaviviridae, Flavivirus); grupo C; grupo Bunyamwera; grupo Guamá; grupo Capim; grupo Simbu (Bunyaviridae, Orthobunyavirus); e grupo Phlebotomus (Bunyaviridae, Phlebovirus). As lâminas foram incubadas durante 30 minutos em estufa a 37oC, lavadas em PBS pH 7,4, secadas e adicionadas com 10uL de conjugado antimouse na diluição de uso (1:900), em cada orifício da lâmina; finalmente, foram montadas com lamínula em glicerina tamponada e observadas ao microscópio de fluorescência. A positividade foi caracterizada pela presença de fluorescência nas células infectadas.
Também foi realizada a inoculação em camundongo albino suíço (Mus musculus) entre 2-3 dias de idade. Nessa parte do estudo, os insetos vetores foram macerados (em gral e pistilo) em uma concentração de 1:10, usando uma solução borato-salina tamponada de albumina bovina contendo penicilina (100UI/mL) e estreptomicina (100µg/mL). As suspensões foram inoculadas via intracerebral (ic) em camundongos recém-nascidos, sendo a dose do inóculo de 0,02 ml. Após a infecção, os animais foram observados diariamente, por até três semanas. Os camundongos que apresentaram sinais de doença foram sacrificados e identificados com rótulo constando número de seu registro, passagem (?), dia de doença e data de colhidos (?), sendo depois congelados à temperatura de -70oC.
Posteriormente, ao ocorrer isolamento viral, um estoque viral foi preparado mediante passagem da suspensão viral isolada, conforme descrito anteriormente. Esses estoques virais foram usados subsequentemente, na preparação de antígeno e soro imune, e para os testes sorológicos de caracterização do isolado viral.
Resultados
Nas seis áreas pesquisadas, foram capturados 922 Culicidae, distribuídos entre os gêneros Aedes (14,0%),Anopheles (0,6%), Coquillettidia (0,4%), Culex (4,6%), Haemagogus (23,0%), Limatus (20,0%), Psorophora (2,9%), Sabethes (30,0%) e Wyeomyia (4,5%). As espécies capturadas em maior quantidade foram Sabethes albiprivus, Limatus durhami, Hg. janthinomys e Hg. leucocelaenus, embora Sabethes chloropterus, Sabethes soperi e Aedes albopictus estivessem presentes em menor número nas áreas do Parque Nacional de Brasília e na localidade do Guará I (Tabela 1).
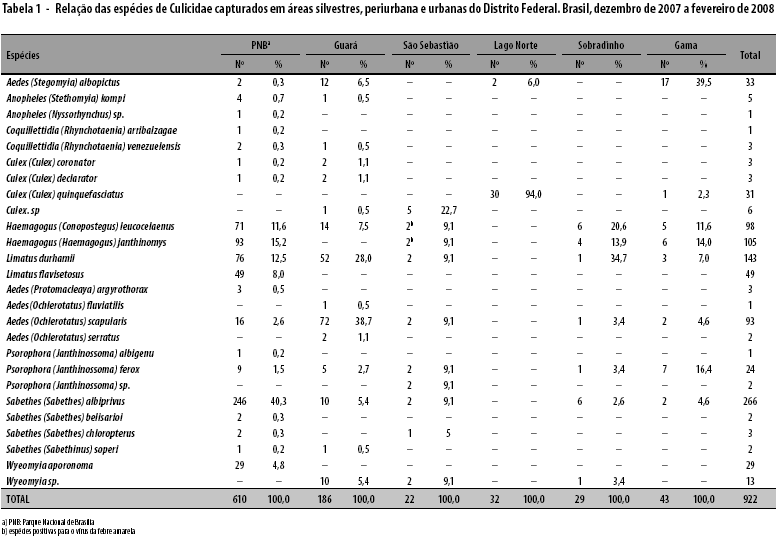
As análises de cultura de célula e inoculação em camundongo demonstraram positividade para o vírus amarílico em pool de amostras de Hg. janthinomys, sob registro de no 740524, capturado em 11 de janeiro de 2008, na Chácara Santa Helena/Morro da Cruz/São Sebastião-DF.
Nesta mesma área, também foi possível o isolamento viral em Hg. leucocelaenus - capturado em 10 de janeiro de 2008, sob registro de no 740535 -, pela técnica de cultura de célula.
Discussão
Em 2008, as investigações entomológicas de febre amarela realizadas em áreas rurais dos municípios de Caibaté e Coronel Barros, estado do Rio Grande do Sul, obtiveram um total de 358 mosquitos. As espécies Hg. leucocelaenus (52,8%) e Ae. serratus (14,8%) foram consideradas as mais abundantes, e Hg. leucocelaenus foi incriminado como potencial vetor responsável pela ocorrência dos casos e Ae. serratus como espécie secundária, na transmissão de febre amarela no estado do Rio Grande do Sul.8
No mesmo ano, a confirmação laboratorial de febre amarela em quatro macacos procedentes da região de São José do Rio Preto e a ocorrência de dois óbitos humanos em Ribeirão Preto, ambos os municípios do Estado de São Paulo, levou à obtenção de um total de 3.049 mosquitos: 931 espécimes em São José do Rio Preto-SP e 2.118 em Ribeirão Preto-SP. Foi possível o isolamento do vírus da febre amarela em lotes da espécie Psorophoraferox.9 Contudo, os autores não associaram a transmissão do vírus à espécie, atribuindo ao encontro da infecção natural um caráter acidental.
Os resultados obtidos por este trabalho detectaram espécies do gênero Haemagogus positivas para o vírus amarílico. A presença de Hg. janthinomys e Hg. leucocelaenus, vetores potenciais do vírus da febre amarela, a comprovação da presença de primatas não humanos infectados com o vírus amarílico e a ocorrência de casos humanos confirmam a receptividade e vulnerabilidade ao vírus, evidenciando a possibilidade de risco de transmissão no Distrito Federal. Acrescente-se a isso que o risco de transmissão é potencializado pela espécie exótica, Ae. albopictus, uma preocupação que evolui com sua presença em focos naturais no Brasil,17 aumentando assim a probabilidade de seu envolvimento com o vírus.18
A detecção da presença de Hg. janthinomys e Hg. leucocelaenus naturalmente infectados com o vírus da febre amarela sugere o relacionamento dessas duas espécies na transmissão da febre amarela silvestre, no DF. Essas informações de novos registros têm sua importância para a região Centro-Oeste, haja vista que algumas áreas podem se interligar através de pequenos fragmentos de matas residuais. A formação de "corredores ecológicos" das matas secundárias favorece a mobilidade espacial de Hg. janthinomys e Hg. leucocelaenus, bem como de outras espécies potencialmente transmissoras de febre amarela silvestre. Tal fato poderá contribuir no aumento da distribuição geográfica dessas espécies, como também na emergência de novos casos humanos, se medidas de prevenção e controle da febre amarela não forem realizadas.
Merece destaque o Parque Nacional de Brasília, que recebe, em média, 320 mil visitantes por ano. A influência de tamanho contingente, associada à presença local de populações de espécies vetoras do vírus da febre amarela e de primatas não humanos - dos gêneros Alouatta, Callithrix e Cebus -, demanda atenção especial por parte dos órgãos de controle, principalmente nas ações de vigilância epidemiológica, imunização e diagnóstico precoce.
Finalmente, para aprimorar as estratégias de vigilância epidemiológica da febre amarela no DF, indica-se a necessidade de monitoramento vetorial sistemático e periódico da ação dos respectivos vetores na transferência do vírus silvestre para o Aedes aegypti em área urbana. Desse modo, fazem-se necessários estudos entomológicos aprofundados sobre a dinâmica das populações dos vetores da febre amarela no Distrito Federal, da mesma forma que em diferentes localidades do Brasil.
Agradecimentos
Aos Técnicos de Laboratório, Solange Ribeiro Alves, Crispim Carvalho da Silva, Maria de Lourdes Oliveira, Maurício Leyedecker de Lima, Enilce de Oliveira, Maria do Socorro Moreira Serra, Maria de Lourdes Moraes, Maria de Lourdes Regino Figueredo, Maria Rodrigues Pinto Landim e Gabriel de Alencar, da Diretoria de Vigilância Ambiental em Saúde, da Subsecretaria de Vigilância à Saúde/Secretaria de Estado de Saúde do Distrito Federal, pelo auxílio e empenho na realização das capturas.
E ao técnico Daniel Garkauskas Ramos, da Secretaria de Vigilância em Saúde do Ministério da Saúde, pelo apoio na confecção dos mapas.
Contribuição dos autores
Todos os autores contribuiram igualmente para a concepção, elaboração e revisão do artigo.
Referências
1. World Health Organization. Yellow fever stockpile investment case. Submitted by yellow fever task force to the de global aliance for vaccines and immunization. Geneva: World Health Organization; 2003.
2. Tauil PL, Santos JB, Moraes MAP. Febre Amarela. In: Coura JR. Dinâmica das doenças infecciosas e parasitárias. Rio de Janeiro: Guanabara Koogan; 2005. p. 1775-1765.
3. Bicca-Marques JC, Freitas DS. The role of monkeys, mosquitoes, and human in the ocurrence of a yellow fever outbreak in a fragmented landscape in south of Brazil: protecting howler monkeys is a matter of publica health. Tropical Conservation Science. 2010; 3(1):78-89.
4. Gomes AC, Torres MAN, Paula MB, Fernandes A, Marassá AM, Consales CA, et al. Ecologia de Haemagogus e Sabethes (Diptera: Culicidae) em área epizoótica do vírus da febre amarela, Rio Grande do Sul, Brasil. Epidemiologia Serviço Saúde. 2010; 19(2):101-113.
5. Costa ZGA. Estudo das características epidemiológicas da febre amarela no Brasil, nas áreas fora da Amazônia Legal, período 1999-2003. [Dissertação de Mestrado]. Brasília (DF): Escola Nacional de Saúde Pública Sergio Arouca; 2005.
6. Mondet B, Vasconcelos PFC, Travassos da Rosa APA, Travassos da Rosa ES, Rodrigues SG, Travassos da Rosa JFS. Isolation of yellow fever virus from nulliparous Haemagogus (Haemagogus) janthinomys in Western Amazonian. Vector Borne and Zoonotic Diseases. 2002; 2(1):47-50.
7. Vasconcelos PFC, Sperb AF, Monteiro HA, Torres MA, Sousa MR, Vasconcelos HB, et al. Isolation of yellow fever virus from Haemagogus leucocelaenus in Rio Grande do Sul State Brazil. Transactions of the Society of Tropical Medicine Hygiene. 2003; 97(1):60-62.
8. Cardoso JC, Almeida MAB, Santos E, Fonseca DF, Sallum MAM, Noll CA, et al. Yellow fever virus in Haemagogus leucocelaenus and Aedes serratus mosquitoes, southern Brazil, 2008. Emerging Infectious Disease. 2010; 16(12):1918-1924.
9. Moreno ES, Rocco IM, Bergo ES, Brasil RA, Siciliano MM, Suzuki A, et al. Reemergence of yellow fever: detection on transmission in the State of São Paulo, Brazil, 2008. Revista da Sociedade Brasileira de Medicina Tropical. 2011; 44 (3):290-296.
10. Ministério da Saúde. Secretaria de Vigilância em Saúde. Boletim de atualização. Febre amarela silvestre, 2009, Brasil. Emergências em saúde pública de importância nacional (ESPIN) de febre amarela silvestre em São Paulo e no Rio Grande do Sul e a situação epidemiológica atual no Brasil (2008/2009). Brasília: Ministério da Saúde; 2011 (Acesso em 01 dez. 2011). Disponível em http://portal.saude.gov.br/saude/
11. Ministério da Saúde. Secretaria de Vigilância em Saúde. Boletim da Secretaria de Vigilância em Saúde. Situação da Febre amarela silvestre no Brasil, 2007 e 2008. Ministério da Saúde: Brasília; 2008 (Acesso em 25 de maio. 2008). Disponível em http://portal.saude.gov.br/saude/
12. Ministério da Saúde. Manual de vigilância de epizootias em primatas não-humanos. Secretaria de Estado da Saúde do Distrito Federal. Subsecretaria de Vigilância em Saúde. Diretoria de Vigilância Ambiental. Brasília: Ministério da Saúde; 2008.
13. Instituto Brasileiro de Geografia e Estatística. Informações sobre população do Distrito Federal. Brasília: Instituto Brasileiro de Geografia e Estatística (acessado em 25 ago. 2009). Disponível em www.ibge.gov.br/home/estatística/população/ contagem2007/DE.pdf.
14. Eiten G. Vegetação do Cerrado. In: Pinto MN. Cerrado: caracterização, ocupação e perspectivas. 2 ed. Brasília: Universidade de Brasília; 1994. p. 17-73.
15. Governo do Distrito Federal. Instituto Brasília Ambiental. Informações sobre a região da Fercal (acessado em 10 jan. 2012). Disponível em www. ibram.df.govr.br
16. Consoli RAGB, Oliveira RL. Principais mosquitos de importância sanitária no Brasil. Rio de Janeiro: Fiocruz; 1994.
17. Gomes AC, Bitencourt MD, Natal D, Pinto PLS, Mucci LP, Paula MB. Aedes albopictus em área rural do Brasil e implicações na transmissão de febre amarela silvestre. Revista de Saúde Pública. 1999; 33(1):95-97.
18. Gomes AC, Torres MAN, Gutierrez MFC, Lemos FL, Lima MIN, Martins JF, et al. Registro de Aedes albopictus em áreas epizoóticas de febre amarela das regiões Sudeste e Sul do Brasil (Diptera: Culicidae). Epidemiologia e Serviços de Saúde. 2008; 17(1):71-76.
 Endereço para correspondência:
Endereço para correspondência:
Ministério da Saúde,
Secretaria de Vigilância em Saúde,
Coordenação-Geral de Laboratórios de Saúde Pública,
SCS, Quadra 4, Bloco A, Lote 67/97,
Brasília-DF, Brasil.
CEP: 70304-000
E-mail: marcos.obara@saude.gov.br
Recebido em 29/05/2012 Aprovado em 22/08/2012












 Curriculum ScienTI
Curriculum ScienTI
