Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.22 n.4 Brasília dez. 2013
http://dx.doi.org/10.5123/S1679-49742013000400014
ARTIGO ORIGINAL
Queixas técnicas e eventos adversos a medicamentos notificados em um hospital sentinela do interior de São Paulo, 2009-2010*
Technical complaints and adverse drug events reported in a sentinel hospital in the state of São Paulo, 2009-2010
Paula Ferraz de LimaI; Ana Claudia Molina CavassiniII; Flavia Aparecida Toledo SilvaI; Meline Rossetto KronII; Simone Fernanda GonçalvesIII; Ariadne SpadottoIII; Silvana Andréa Molina LimaIII
IFaculdade Marechal Rondon, Botucatu-SP, Brasil
IIPrograma de Pós-Graduação em Ginecologia, Obstetrícia e Mastologia, Universidade Estadual Paulista, Botucatu-SP, Brasil
IIIFaculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu-SP, Brasil
RESUMO
OBJETIVO: descrever queixas técnicas e eventos adversos a medicamentos notificados em hospital sentinela no interior do estado de São Paulo, Brasil, incluindo todas as notificações realizadas nos anos de 2009 e 2010.
MÉTODOS: trata-se de estudo descritivo, a partir de informações obtidas do banco de dados da Gerência de Risco do hospital sentinela.
RESULTADOS: foram realizadas 199 notificações relacionadas a medicamentos, sendo 70,0% de queixas técnicas, 21,0% por ineficácia terapêutica e 9,0% por reações adversas a medicamento; os grupos farmacológicos com maior número de notificações foram drogas com ação sobre o aparelho digestivo e metabolismo (25,1%), sobre o sistema nervoso (25,1%), e anti-infecciosos gerais para uso sistêmico (22,1%).
CONCLUSÃO: as queixas técnicas e eventos adversos a medicamentos foram frequentes, apesar da reconhecida subnotificação; a caracterização desses eventos pode subsidiar a adoção de medidas de controle e ações de educação permanente nos serviços de saúde, voltadas a sua prevenção.
Palavras-chave: Farmacovigilância; Sistema de Medicação no Hospital; Sistemas de Notificação de Reações Adversas a Medicamentos; Toxicidade de Drogas; Epidemiologia Descritiva.
ABSTRACT
OBJECTIVE: to describe technical complaints and adverse drug events reported in a sentinel hospital in São Paulo state in 2009 and 2010.
METHODS: This is a descriptive study. Information was obtained from the sentinel hospital Risk Management database.
RESULTS: we found 199 reports related to drugs: 70.0% were technical complaints, 21.0% ineffective therapy and 9.0% adverse reaction to medication. The pharmacological groups with highest number of reports were: drugs that act on alimentary tract and metabolism (25.1%), the nervous system (25.1%) and anti-infective drugs for systemic use (22.1%).
CONCLUSION: technical complaints and adverse drug events were frequent, despite recognized underreporting. The characterization of these events could inform the adoption of control measures and permanent educational actions in health services in order to prevent their occurrence.
Key words: Pharmacovigilance; Medication Systems, Hospital; Adverse Drug Reaction Reporting Systems; Drug Toxicity; Epidemiology, Descriptive.
Introdução
A preocupação com o uso de medicamentos - e seus riscos - é antiga. Somando-se a essa preocupação, a tragédia internacional provocada pela talidomida, cujo uso durante a gestação desencadeou o aparecimento de malformações em recém-nascidos, evidenciou a necessidade de monitoramento dos medicamentos mesmo com a aprovação para comercialização. Cientes da questão, as agências reguladoras passaram a organizar os serviços de forma a realizarem buscas de reações adversas a medicamentos, dando origem às atividades de Farmacovigilância.1,2
A Farmacovigilância tem como finalidade detectar, avaliar, compreender e prevenir riscos de incidentes relacionados ao uso de medicamentos.1,3,4 Esses incidentes devem ser notificados aos setores responsáveis das instituições de saúde e/ou agências reguladoras, para adoção de medidas preventivas5 e garantidoras de maior segurança aos pacientes, isto é, redução dos riscos de danos associados com a assistência prestada.6
Os incidentes são eventos que poderiam resultar ou resultaram em danos aos pacientes.6 Entre eles, podem haver circunstâncias notificáveis (problemas ocorridos com produtos que não tenham sido utilizados no paciente, ou queixa técnica), near miss (quase erro, isto é, o incidente poderia atingir o paciente mas o problema foi detectado antes, sendo chamado de potencial evento adverso),5,7 e incidentes sem danos e com danos (evento adverso).6
O evento adverso (EA) é definido como a ocorrência, em seres humanos, de qualquer efeito não desejado, decorrente da utilização de produtos sob vigilância sanitária,8 podendo ser evitável ou não.6 O evento adverso a medicamento (EAM) envolve diferentes situações, entre elas a reação adversa a medicamento (RAM) e a ineficácia terapêutica (IT).4
A RAM é definida pela Organização Mundial da Saúde - OMS - como qualquer acontecimento danoso, não intencional e indesejado, ocorrido durante o uso de um medicamento empregado com doses terapêuticas habituais para tratamento, profilaxia ou diagnóstico.1,9
Considera-se a perda de eficácia terapêutica - ou IT - como falha inesperada da atividade de um medicamento em produzir o efeito desejado (redução ou ausência de efeito), como comprovada por meio de investigação científica anterior.1
Já a queixa técnica ou desvio de qualidade é qualquer alteração ou irregularidade de um produto ou empresa, relacionada a aspectos técnicos ou legais, podendo ou não causar dano à saúde do indivíduo.10
De acordo com Tomás e Gimena,14 a incidência de EA nos serviços de emergências é estimada entre 1,6 e 14%, considerando-se diferentes estudos e metodologias adotadas.
Estudos norte-americanos mostraram que, na última década, a cada 100 admissões hospitalares, ocorreram 6,5 EAM,11 e que as pessoas idosas e as crianças estão mais susceptíveis ao EAM quando comparadas à população adulta.12,13 Estudo realizado na Índia evidenciou que os EAM ocorreram em cerca de 9,8% das admissões hospitalares.1,2
No Brasil, estudo realizado com pacientes internados em hospitais do Rio de Janeiro observou 5,6% de EAM.15 Outro estudo realizado no país, na região Centro-Oeste, revelou uma frequência de 8% de EAM16 em pacientes hospitalizados. Silva e colaboradores17 citam que os EAM graves são os mais notificados, por causarem danos aos pacientes.
Evidencia-se, dessa forma, a importância do monitoramento e da necessidade de se conhecer os eventos adversos e queixas técnicas na área de Farmacovigilância, justificando assim a realização desta pesquisa, que teve como objetivo descrever as queixas técnicas e eventos adversos a medicamentos, notificados em um hospital sentinela do interior do estado de São Paulo no período 2009-2010.
Métodos
Trata-se de um estudo descritivo, realizado com dados do Hospital das Clínicas da Faculdade de Medicina de Botucatu (HCFMB), que é um hospital geral, de caráter público, universitário e de ensino, com atendimento secundário, terciário e quaternário, que conta com centros de referência para atendimentos em áreas terciárias e quaternárias: Neurologia e Neurocirurgia, pediátrica e de adulto; Cirurgia Cardíaca intervencionista, pediátrica e de adulto; Cirurgia Vascular; Cirurgia Bariátrica; Ortopedia e Traumatologia; Gestação de alto risco; unidade de terapia intensiva (UTI) neonatal e pediátrica; Nefrologia; Moléstias infectocontagiosas; Transplantes e captação de órgãos e tecidos no setor de transplantes renais; e Oftalmologia. O HCFMB está localizado no centro-oeste do estado de São Paulo, distante cerca de 250 km da capital, e pertence à região da Diretoria Regional de Saúde (DRS) VI/Bauru-SP, que corresponde à área de abrangência de 68 municípios.
A capacidade do hospital é de 415 leitos, distribuídos entre as diversas especialidades, e de 52 leitos de UTI (30 leitos para adultos, 15 neonatais e sete pediátricos), 194 consultórios médicos e 31 salas especializadas. O hospital também é utilizado como campo de ensino, pesquisa e extensão para alunos e profissionais de Medicina, Enfermagem e outros cursos da Universidade Estadual Paulista; e possui uma unidade de Gerência de Risco Sanitário Hospitalar, que desenvolve as atividades de monitoramento e notificações de ocorrências à Agência Nacional de Vigilância Sanitária (Anvisa), nas áreas de Farmacovigilância, Tecnovigilância, Hemovigilância e Saneantes.
Esta unidade recebe notificações de forma espontânea, ou seja, voluntária (realizada pelos profissionais de saúde e encaminhada diretamente à Gerência de Risco da unidade), e por busca ativa (realizada por estagiárias bolsistas - alunas do curso de graduação em Enfermagem - em visitas semanais às unidades do hospital). Queixas técnicas de medicamentos, RAM e IT são notificadas voluntariamente ou por busca ativa, mediante formulários impressos ou preenchidos em formato eletrônico, enviados à área de Farmacovigilância.
Os dados foram obtidos a partir do banco de dados informatizado da Gerência de Risco Sanitário Hospitalar, sendo incluídas todas as queixas técnicas, RAM e IT de notificação espontânea ou resultantes de busca ativa pela área de Farmacovigilância junto às unidades de internação, de emergência e ambulatoriais, no período de 1o de janeiro de 2009 a 31 de dezembro de 2010. Foi analisado o conteúdo das fichas de notificações, sendo as ocorrências de queixas técnicas e eventos adversos registradas em um formulário, especialmente elaborado pelos próprios pesquisadores.
Os seguintes dados foram obtidos:
- número de queixas técnicas, RAM e IT;
- número de notificações por busca ativa e espontânea;
- notificações por grupos farmacológicos, segundo a classificação Anatomical Therapeutic Chemical,18 que classifica as drogas de acordo com o sistema anatômico, terapêutico e químico (ATC) do WHO Collaborating Centre for Drug Statistics Methodology (órgão da OMS);
- notificadores por categoria profissional;
- notificações por unidade hospitalar;
- ocorrências relacionadas às queixas técnicas (vazamentos, coloração, deformidades, ausência ou alteração de conteúdo, entre outros);
- sintomas relacionados à RAM (diarreia, taquicardia, rash cutâneo, alucinações, vômitos, dispneia, dor, hiperemia, entre outros); e
- conduta adotada em IT (substituição ou suspensão do medicamento).
Os dados foram codificados e tabulados pelo software Microsoft Office Excel versão 2007. Foi realizada a análise descritiva dos dados, a partir de tabelas de distribuição de frequências absoluta e relativa.
O estudo obteve autorização da direção da instituição e foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Botucatu (Parecer no 429-2008).
Resultados
No período do estudo, foram realizadas 199 notificações à área de Farmacovigilância. Ocorreu aumento acentuado de notificações no período de abril a junho, 70,0% delas relacionadas aos desvios de qualidade (queixas técnicas), 21,0% à IT e 9,0% à RAM. A menor parte das notificações foi realizada voluntariamente (36,2%) e 63,8% decorreram das atividades de busca ativa.
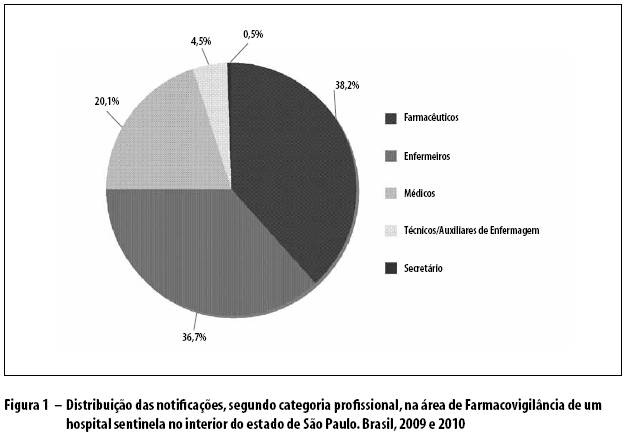
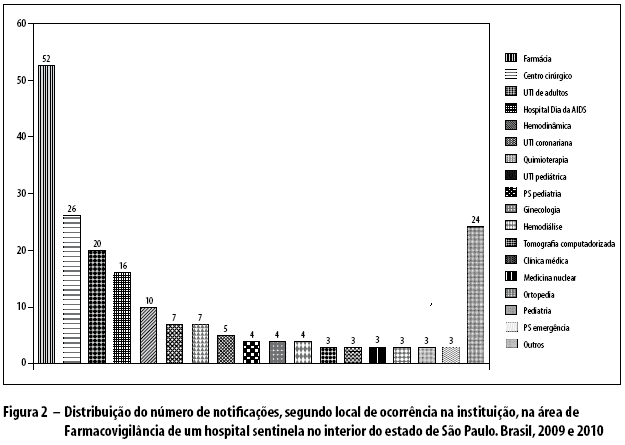
Os profissionais que realizaram notificações foram farmacêuticos (38,2%), enfermeiros (36,7%), médicos (20,1%), técnicos e auxiliares de enfermagem (4,5%) e secretários (0,5%) (Figura 1). Os locais que mais notificaram foram os setores da Farmácia (26,1%) e do Centro Cirúrgico (13,0%) (Figura 2).
As ocorrências mais frequentes foram relacionadas aos grupos de drogas que agem sobre: A - Aparelho digestivo e metabolismo (25,1%); N - Sistema Nervoso (25,1%); e J - Anti-infecciosos gerais para uso sistêmico (22,1%) (Tabela 1).

As queixas técnicas mais notificadas foram vazamento (17,3%), coloração diferente do habitual (10,8%) e dificuldade de abertura do frasco (10,0%) (Tabela 2).

Entre as 30 RAM observadas, os sintomas de maior ocorrência apresentados pelos pacientes foram: diarreia intensa (n=4); taquicardia (n=3); e acidose lática, rash cutâneo, alucinações, vômitos, dispneia, dor, hiperbilirrubinemia e hiperemia (n=2).
Na maioria dos casos (59,0%), a conduta após a ocorrência de ineficácia terapêutica foi a substituição da medicação.
Discussão
O número total de ocorrências na área de Farmacovigilância do serviço estudado foi elevado, quando comparado aos dados da literatura, sendo a maior parte considerada como queixa técnica. Estudo realizado em outro hospital sentinela de grande porte identificou, em um período de dois anos e meio, 100 notificações, sendo que 55,0% dos eventos notificados foram relacionados às queixas técnicas a medicamentos e 8,0% aos EAM.16
Essa predominância da queixa técnica pode ser consequência da fácil visualização do problema antes mesmo da utilização do medicamento no paciente. Os EAM são de difícil identificação, seja por fatores relacionados ao paciente, seja pela própria droga e sua interferência na resposta a um medicamento.2 A subnotificação pelos profissionais de saúde pode ser outro fator explicativo para o baixo número de notificações de EAM no serviço estudado.
De acordo com Silva e colabs.,17 essa subnotificação ocorre devido aos hospitais identificarem apenas os EAM com maior gravidade e não notificarem os de menor gravidade, tanto pela falta de mecanismos de identificação e registro como pelo medo de punição/exposição do profissional,17 senão por falta de conhecimento.16
O presente estudo evidenciou a importância da adoção do método de busca ativa das ocorrências junto às unidades hospitalares, além da notificação voluntária, tendo em vista a quase duplicação do número de notificações realizadas na instituição.
Autores relatam que a subnotificação, principal dificuldade do método de notificação voluntária, ocorre por diversos fatores como medo, culpa, tipo de sistema de notificação, entre outros.5
Segundo este estudo, os profissionais que mais notificaram problemas com medicamentos foram os farmacêuticos, seguidos dos enfermeiros. Esse resultado pode ser explicado pelo fato de o farmacêutico ser o profissional responsável pela aquisição, controle e dispensação do medicamento, identificando as ocorrências técnicas antes do encaminhamento do produto às unidades.
Estudos evidenciam que o enfermeiro é o profissional que mais notifica problemas com produtos de saúde, incluindo medicamentos.5,16 Segundo Capucho,19 os enfermeiros são em maior número na instituição, permanecem maior tempo ao lado do paciente e contam com treinamento para realização dos registros.
No hospital estudado, as notificações de queixas técnicas e EAM ocorreram em diversas unidades do serviço. Entretanto, os setores mais citados foram a Farmácia e o Centro Cirúrgico. Estudos realizados em instituições de grande porte, integradas à Rede Sentinela (rede de hospitais que notifica e monitora eventos adversos e queixas técnicas de produtos sob vigilância sanitária,10 caso do hospital estudado), também observaram maior número de notificações de produtos de saúde em setores de Farmácia e Clínica Médica,16 assim como em unidades de Ortopedia, Clínica Geral e Oncologia.20 O grande número de notificações pode ser justificado pela presença do farmacêutico no setor de Farmácia e pela elevada utilização de medicamentos por outras unidades, citadas em diferentes estudos.
Quanto aos grupos farmacológicos, a literatura aponta que diversos medicamentos estão associados às RAM, como a fenilbutazona, contraceptivos orais, anti-inflamatórios, antibióticos e outras drogas.3 Outros autores verificaram que medicamentos atuantes sobre o sistema cardiovascular (66,6%),21 antibióticos (26,1%) e analgésicos (22,0%)20 foram responsáveis por RAM. Esses dados, entretanto, divergem dos encontrados por este estudo. Essa divergência pode ocorrer por diferentes aspectos, como o tipo de população estudada, especificidades dos processos de cada hospital e do julgamento subjetivo da ocorrência do evento adverso, dificultando a comparação entre pesquisas sobre reações adversas a medicamentos realizadas com populações e instituições distintas.22
A diarreia e a taquicardia foram os sintomas mais frequentes de reação adversa a medicamento. A literatura aponta para a ocorrência de anemia aplástica, tromboembolismo, hemorragia gástrica, colite pseudomembranosa, hipersensibilidade aguda, entre outras reações.3 Estudo realizado em hospital terciário, no município de Palmas-TO, verificou maior ocorrência de RAM na pele (34,5%) e no sistema gastrointestinal (14,2%).20
Em relação à conduta após a ocorrência de ineficácia terapêutica, observou-se que, na maioria dos casos, houve a necessidade de substituição da medicação ou aumento de sua dose. Isto evidencia a importância da identificação dos EAM e/ou da conduta adotada, para um melhor gerenciamento dos medicamentos em diferentes aspectos como consumo, qualidade do produto e garantia da assistência segura ao paciente.
Segundo alguns autores, pacientes que sofreram EAM apresentaram aumento do tempo de internação e custos elevados para as instituições de saúde.11,23 Neste estudo, particularmente, uma das limitações encontradas pelas autoras foi a ausência de dados que possibilitassem a correlação entre as ocorrências de ineficácia terapêutica - IT - e os custos/tempo de internação. Apenas foi possível identificar a necessidade de substituição de medicamento e/ou aumento da dose, medidas que, possivelmente, também contribuiriam para o aumento dos custos hospitalares.
O estudo permitiu visualizar a importância da vigilância pós-comercialização dos medicamentos, nos âmbitos interno e externo da instituição. No âmbito interno, o monitoramento dos medicamentos contribui para as atividades de educação permanente sobre o uso dos medicamentos, garantindo maior segurança do paciente e melhoria do produto adquirido. Já no âmbito externo da instituição, o serviço contribui com a vigilância sanitária do país, fornecendo informações qualificadas para a tomada de decisão em nível nacional.
Este estudo permitiu descrever as notificações de medicamentos de maior ocorrência na instituição. Verificou-se um número elevado de ocorrências na área da Farmacovigilância. Todavia, a possibilidade de subnotificação pode ser considerada uma limitação importante do estudo. Para reduzir essa subnotificação, é mister a participação dos trabalhadores dos serviços de saúde. A notificação de ocorrências de eventos adversos a medicamentos - EAM - e de queixas técnicas deve ser orientada e incentivada por toda a equipe, contribuindo para a melhoria da qualidade dos medicamentos e garantindo maior segurança aos pacientes.
Recomenda-se uma investigação mais aprofundada dos medicamentos utilizados na instituição e das unidades notificadoras, a fim de reduzir a subnotificação, além de uma pesquisa mais ampla para avaliar a associação de eventos adversos a medicamentos com o tempo de internação e os custos hospitalares. Sugere-se, ademais, a realização de outros estudos na área de Farmacovigilância, haja vista a escassez de literatura disponível e a relevância do tema.
Contribuição das autoras
De Lima PF, Cavassini ACM e Lima SAM participaram na concepção e delineamento do estudo, análise e interpretação dos dados, redação do conteúdo intelectual do manuscrito e aprovação final da versão a ser publicada.
Silva FAT, Kron MR, Gonçalves SF e Spadotto A participaram na análise e interpretação dos dados, redação e revisão crítica relevante do conteúdo intelectual do manuscrito e aprovação final da versão a ser publicada.
Todos os autores aprovaram a versão final do manuscrito e são responsáveis por todos os aspectos do trabalho, incluindo a garantia de sua precisão e integridade.
Referências
1. Organização Mundial da Saúde. Departamento de Medicamentos Essenciais e Outros Medicamentos. A importância da Farmacovigilância: monitorização da segurança dos medicamentos. Brasília: Organização Pan-Americana da Saúde [Internet]. 2005 [citado 2013 jan 17]. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/importancia.pdf
2. Rozenfeld S. Farmacovigilância: elementos para a discussão e perspectivas. Cad Saude Publica. 1998 abr;14(2):237-63.
3. Coêlho HL. Farmacovigilância: um instrumento necessário. Cad Saude Publica. 1998 out-dez;14(4):871-5.
4. Mota DM. Investigação em farmacoepidemiologia de campo: uma proposta para as ações de farmacovigilância no Brasil. Rev Bras Epidemiol. 2011 dez;14(4):565-79.
5. Capucho HC, Arnas ER, Cassiani SHB. Segurança do paciente: comparação entre notificações voluntárias manuscritas e informatizadas sobre incidentes em Saúde. Rev Gaucha Enferm. 2013 mar;34(1):164-72.
6. World Health Organization. The conceptual framework for the international classification for patient safety. Version 1.1. Final technical report. Chapter 3. The international classification for patient safety. Key concepts and preferred terms. Geneva: World Health Organization [Internet]. 2009 [cited 2012 Jul]. Available from: http://www.who.int/ patientsafety/taxonomy/icps_chapter3.pdf
7. Capucho HC. Near miss: almost error or potential adverse event? Rev Latino-Am Enfermagem [Internet]. 2011 Sep-Oct [cited 2012 Oct 14];19(5):1272-3. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-11692011000500027&lng=en
8. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Resolução-RDC no 23, de 4 de abril de 2012. Dispõe sobre a obrigatoriedade de execução e notificação de ações de campo por detentores de registro de produtos para a saúde no Brasil. Diário Oficial da União, Brasília, p. 77, 9 abr. 2012. Seção 1 [Internet]. [citado 2012 jun 5]. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2012/rdc0023_04_04_2012.html
9. World Health Organization. Model formulary 2008 [Internet]. 2009 [cited 2011 Jan 13]. Available from: http://www.who.int/selection_medicines/list/WMF2008.pdf
10. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Pós-Comercialização Pós-Uso / Rede Sentinela [Internet]. [citado 2013 out 30]. Disponível em: http://portal.anvisa.gov.br/wps/content/Anvisa+Portal/Anvisa/Pos+-+Comercializacao+-+Pos+-+Uso/Rede+Sentinela
11. Cassiani SHB, Miasso AI, Silva AEBC, Fakin FT, Oliveira RC. Aspectos gerais e número de etapas do sistema de medicação de quatro hospitais brasileiros. Rev Latino Am Enfermagem. 2004 set-out;12(5):781-9.
12. Arulmani R, Rajendran SD, Suresh B. Adverse drug reaction monitoring in a secondary care hospital in South India. Br J Clin Pharmacol. 2007 Feb;65(2):210-6.
13. Holdsworth MT, Fichtl RE, Behta M, Raisch DW, Mendez-Rico E, Adams A, et al. Incidence and impact of adverse drug events in pediatric inpatients. Arch Pediatr Adolesc Med. 2003 Jan;157(1):60-5.
14. Tomás S, Gimena I. La seguridad del paciente en urgencias y emergencias. An Sist Sanit Navar. 2010;33(Supl. 1):131-48.
15. Mendes W, Martins M, Rozenfeld S, Travassos C. The assessment of adverse events in hospitals in Brazil. Int J Qual Health Care. 2009 Aug;21(4):279-84.
16. Bezerra ALQ, Silva AEBC, Branquinho NCSS, Paranaguá TTB. Análise de queixas técnicas e eventos adversos notificados em um hospital sentinela. Rev Enferm UERJ. 2009 out-dez;17(4):467-72.
17. Silva AEBC, Reis AMM, Miasso AI, Santos JO, Cassiani SHB. Eventos adversos a medicamentos em um hospital sentinela do estado de Goiás. Rev Latino-Am Enfermagem [Internet]. 2011 mar-abr [citado 2013 jan 3];19(2):[09 telas]. Disponível em: http://www.scielo.br/pdf/rlae/v19n2/pt_21.pdf
18. World Health Organization. Collaborating Centre for Drug Statistics Methodology. Norwegian Institute of Public Health. Guidelines for ATC classification and DDD assignment 2013. Oslo, 2012. [cited 2013 May 3]. Available from: http://www.whocc.no/filearchive/publications/1_2013guidelines.pdf
19. Capucho HC. Sistemas manuscrito e informatizado de notificação voluntária de incidentes em saúde como base para a cultura de segurança do paciente [tese]. Ribeirão Preto (SP): Universidade de São Paulo; 2012.
20. Lobo MGAA, Pinheiro SMB, Castro JGD, Momenté VG, Pranchevicius MCS. Adverse drug reaction monitoring: support for pharmacovigilance at a tertiary care hospital in Northern Brazil. BMC Pharmacol Toxicol [Internet]. 2013 Jan [cited 2013 May 25];14:5. Available from: http://www.biomedcentral.com/content/pdf/2050-6511-14-5.pdf
21. Pfaffenbach G, Carvalho OM, Bergsten-Mendes G. Reações adversas a medicamentos como determinantes da admissão hospitalar. Rev Assoc Med Bras. 2002 jul-set;48(3):237-41.
22. Roque KE, Melo ECP. Avaliação dos eventos adversos a medicamentos no contexto hospitalar. Esc Anna Nery Enferm. 2012 mar;16(1):121-7.
23. Bates DW. Improving medication safety across institutions. Jt Comm J Qual Improv. 2000;26(6): 319-20.
 Endereço para correspondência:
Endereço para correspondência:
Silvaria Andréa Molina Lima
- Departamento de Enfermagem,
Faculdade de Medicina de Botucatu,
Universidade Estadual Paulista,
Rua Rubião Junior, s/n, Botucatu-SP,
Brasil. CEP: 18618-970
E-mail: smolina@fmb.unesp.br
Recebido em 20/02/2013
Aprovado em 21/11/2013
*Este artigo é parte do trabalho de conclusão do Curso de Enfermagem da Faculdade Marechal Rondon, em São Manuel-SP, no ano de 2011.













