Introdução
O controle do Aedes tem constituído um importante desafio, especialmente nos países em desenvolvimento. Mesmo considerando-se situações em que os recursos destinados ao controle do vetor sejam apropriados para a implementação de programas, muitas vezes não se tem alcançado sucesso. Aspectos relacionados a problemas de infraestrutura das cidades, tais como baixas coberturas na coleta de lixo e intermitência no abastecimento de água, são fatores que comprometem a efetividade dos métodos tradicionais de controle do Aedes.1,2
Há duas espécies principais de mosquitos do gênero Aedes capazes de transmitir, além da dengue, outras arboviroses como chikungunya, Zika e febre amarela: Aedes aegypti e Aedes albopictus.3-6
A ocorrência do Ae. aegypti foi primeiramente descrita no Egito por Linnaeus, em 1762,7 estando o mosquito presente nos trópicos e subtrópicos - em praticamente todo o continente americano, no Sudeste da Ásia, e em toda a Índia.8 Suspeita-se que a introdução dessa espécie no Brasil tenha ocorrido no período colonial, entre os séculos XVI e XIX, durante o comércio de escravos.9,10 Com a destruição dos habitat naturais, devido às pressões antrópicas, uma parte da população silvestre sofreu um processo seletivo que favoreceu a disseminação e sobrevivência da espécie em aglomerados humanos.7,11
A etologia do Ae. aegypti beneficia sua ampla dispersão, favorecida nos ambientes urbanos, preferencialmente no intra e no peridomicílio humano. Raramente são encontrados em ambientes semissilvestres ou onde não há presença intensa do homem. Seus criadouros preferenciais são recipientes artificiais, tanto aqueles abandonados a céu aberto, que servem como reservatório de água de chuva, como os utilizados para armazenar água para uso doméstico.9 A presença dos criadouros em ambiente de convívio com o homem favorece a rápida proliferação da espécie, por dois aspectos: condições ideais para reprodução e fontes de alimentação.
A partir do século XX, o combate ao Ae. aegypti foi sistematizado e intensificado no Brasil, com o objetivo de reduzir o número de casos de febre amarela urbana, que havia levado milhares de pessoas a óbito. O controle vetorial era feito por meio da eliminação mecânica de criadouros; quando não era possível a eliminação, tratavam-se os criadouros com larvicidas e ainda aplicavam-se outros tipos de inseticidas.12
Entre 1958 e 1973, o Ae. aegypti chegou a ser erradicado do país por duas vezes.13-15 Entretanto, em 1976, surgiram os primeiros registros da reintrodução do vetor no Brasil, ocasionada por falhas na vigilância epidemiológica e pelo crescimento populacional acelerado.16-18 Desde então, o Ae. aegypti está presente em todas as Unidades da Federação, distribuído em, aproximadamente, 4.523 municípios.6
Adaptações do Ae. aegypti permitiram que se tornassem abundantes nas cidades e fossem facilmente levados para outras áreas pelos meios de transporte, o que aumentou sua competência vetorial, ou seja, a sua habilidade em tornar-se infectado por um vírus, replicá-lo e transmiti-lo.19 A fêmea consegue fazer ingestões múltiplas de sangue durante um único ciclo gonadotrófico, o que amplia a sua capacidade de se infectar e de transmitir os vírus. Este comportamento torna o Ae. aegypti um vetor eficiente.20 A quiescência dos ovos permite a manutenção do ciclo na natureza durante as variações climáticas sazonais, uma vez que a viabilidade dos ovos de Ae. aegypti chega até 492 dias na seca, eclodindo após contato com a água.21
O Ae. albopictus, originário da Ásia, possui a capacidade de tolerar baixas temperaturas8 e demonstra preferências por ambientes rurais, semissilvestres e silvestres, e, na ausência de artefatos humanos, alimenta-se de néctar e de sangue de animais silvestres e se reproduz em depósitos naturais.22
No Brasil, o primeiro registro de Ae. albopictus ocorreu em 1986, no estado do Rio de Janeiro,10 posteriormente em Minas Gerais e em São Paulo e, no ano seguinte, no Espírito Santo.23 Em 2014, foi relatada presença do Ae. albopictus em 3.285 municípios brasileiros, e sua ausência em quatro estados: Sergipe, Acre, Amapá e Roraima.23
Embora existam semelhanças entre o comportamento do Ae. aegypti e do Ae. albopictus, as diferenças entre eles são determinantes para a dinâmica de transmissão das doenças, propagação dos vírus e disseminação da espécie.10 As condições climáticas (temperatura, pluviosidade, altitude) interferem no ciclo vital do Ae. aegypti, além da domiciliação, dispersão, repasto e reprodução.24
Diante dos desafios de controle do vetor e de um quadro grave e preocupante em relação às arboviroses delineado pela expansão destes vírus em todo o mundo, torna-se imprescindível a adoção de estratégias específicas, com maiores investimentos em métodos adequados, que forneçam sustentabilidade às ações estabelecidas pelas redes de vigilância, além de ensejarem a análise de sua efetividade.
Assim, em face do atual cenário de surtos e epidemias de Zika, chikungunya e dengue, este estudo torna-se relevante, pois descreve as principais estratégias de controle do Ae. aegypti, com ênfase nas inovações tecnológicas promissoras para utilização no Brasil. Esta revisão não sistemática da literatura aborda tópicos sobre programas de controle, mecanismos, estratégias e inovações tecnológicas para controle vetorial. Espera-se que esses dados possam contribuir para a reflexão sobre o tema, bem como para a orientação ou direcionamento das ações de controle.
Programas de controle do Ae. aegypti no Brasil
A partir de 1996, o Ministério da Saúde colocou em prática o Plano de Erradicação do Ae. aegypti (PEAa), que preconizava a atuação multissetorial e previa um modelo descentralizado com a participação das três esferas de governo, cujo principal objetivo se concentrava na redução dos casos de dengue hemorrágica. Mesmo com esforços para a estruturação do combate ao vetor nos municípios, o PEAa não conseguiu a necessária atuação multissetorial, o que pode ser apontado como um dos fatores responsáveis pelo insucesso na contenção do aumento do número de casos de dengue e pelo avanço da infestação do Ae. aegypti.25,26
Em 2001, o governo desistiu da meta de erradicar o mosquito e passou a considerar o controle do vetor, com a implantação do Plano de Intensificação das Ações de Controle da Dengue (PIACD), priorizando ações em municípios com maior transmissão de dengue. Em 2002, o Plano Nacional de Controle da Dengue (PNCD) foi elaborado em função do aumento do risco de epidemias, ocorrência de casos graves de dengue e reintrodução e rápida disseminação do sorotipo 3 no país.25-27
Com apoio do Ministério da Saúde e dos estados, as secretarias municipais de saúde passaram a gerir e a executar as ações do PNCD, que envolviam dez componentes principais: vigilância epidemiológica, combate ao vetor, assistência aos pacientes, integração com atenção básica, ações de saneamento ambiental, ações integradas de educação em saúde, comunicação e mobilização social, capacitação de recursos humanos, legislação, sustentação político-social e acompanhamento e avaliação do PNCD.25,27,28 Assim, o Programa deixou de ser exclusivamente direcionado ao combate do vetor e sugeriu adequações condizentes com as especificidades locais, inclusive com a possibilidade de elaboração de planos sub-regionais.28
Estratégias de controle
No Brasil, os Agentes Comunitários de Saúde (ACS) e Agentes de Combate a Endemias (ACE), em parceria com a população, são responsáveis por promover o controle mecânico e químico do vetor, cujas ações são centradas em detectar, destruir ou destinar adequadamente reservatórios naturais ou artificias de água que possam servir de depósito para os ovos do Aedes. Outra estratégia complementar preconizada pelo Ministério da Saúde é a promoção de ações educativas durante a visita domiciliar pelos Agentes Comunitários, com o objetivo de garantir a sustentabilidade da eliminação dos criadouros pelos proprietários dos imóveis, na tentativa de romper a cadeia de transmissão das doenças.26
Nessa tarefa, é possível a utilização de basicamente três tipos de mecanismos de controle: mecânico, biológico e químico.
- Controle mecânico: consiste na adoção de práticas capazes de eliminar o vetor e os criadouros ou reduzir o contato do mosquito com o homem. As principais atividades de controle mecânico envolvem a proteção, a destruição ou a destinação adequada de criadouros, drenagem de reservatórios e instalação de telas em portas e janelas.26,29-32
- Controle biológico: é baseado na utilização de predadores ou patógenos com potencial para reduzir a população vetorial. Entre as alternativas disponíveis de predadores estão os peixes33,34 e os invertebrados aquáticos, que comem as larvas e pupas, e os patógenos que liberam toxinas, como bactérias, fungos e parasitas.26,29,30 Outra alternativa é a utilização do Bacillus thuringiensis israelensis (Bti), um bacilo com potente ação larvicida, por sua produção de endotoxinas proteicas.35-37 Entretanto, apesar de o Bti ser eficaz na redução do número de Aedes imaturos nos recipientes tratados em curto prazo, não há evidências de que esse método isolado possa impactar na redução da morbidade da dengue em longo prazo.30,35,38
- Controle químico: consiste no uso de produtos químicos, que podem ser neurotóxicos, análogos de hormônio juvenil e inibidores de síntese de quitina,29,30 para matar larvas e insetos adultos. É um tipo de controle recomendado mediante uso racional e seguro para o meio ambiente e para a população, complementar às ações de vigilância e manejo ambiental, devido à possibilidade de seleção de vetores resistentes aos produtos e da geração de impactos ambientais.29,30
O uso de inseticidas para controle de populações de mosquitos adultos (adulticidas) e na sua forma larvária (larvicidas) pode ser feito por meio do tratamento focal e perifocal e da aspersão aeroespacial de inseticidas em ultra baixo volume (UBV). O tratamento focal ocorre com a aplicação de um produto larvicida (químico ou biológico) nos depósitos positivos para formas imaturas de mosquitos que não possam ser eliminados mecanicamente.26,29,39 O tratamento perifocal consiste na aplicação de uma camada de adulticida de ação residual nas paredes externas dos criadouros situados em pontos estratégicos, por meio de aspersor manual, e está indicado para localidades recém-infestadas como medida complementar ao tratamento focal em pontos estratégicos.26,29,39
O tratamento de aspersão aeroespacial de inseticidas em UBV, feito com equipamento portátil costal ou acoplado a veículos, tem como função específica eliminar formas adultas de Ae. aegypti, e deve ser utilizado somente para bloqueio de transmissão e para controle de surtos ou epidemias. Essa nebulização não é seletiva, promovendo a eliminação de qualquer mosquito que esteja no ambiente, e seu uso indiscriminado para combate de outros insetos não é recomendado.26,29
Em razão da ocorrência de resistência em amostras de populações de Ae. aegypti aos inseticidas em uso, o PNCD vem, ao longo dos anos, promovendo a sua substituição. Os organofosforados (malationa, fenitrotiona e temefós) foram os primeiros a substituir os organoclorados. Por sua vez, os piretroides (cipermetrina e deltametrina) têm sido usados como alternativa para substituição dos organofosforados, por sua alta eficiência contra mosquitos adultos, sendo necessárias menores quantidades de produto ativo. Além do impacto ambiental, a desvantagem está no alto custo dos piretroides.26,30,39,40 O monitoramento da susceptibilidade a inseticidas em diferentes áreas do país é uma estratégia racional importante para ampliar o conhecimento sobre os mecanismos de resistência e para o controle dos níveis de infestação vetorial em âmbito local.41
Inovações tecnológicas de controle vetorial
Diversas tecnologias têm sido desenvolvidas como alternativas no controle do Ae. aegypti, utilizando-se diferentes mecanismos de ação, tais como medidas sociais, monitoramento seletivo da infestação, dispersão de inseticidas, novos agentes de controle químico e biológico e procedimentos moleculares para controle populacional dos mosquitos, inclusive considerando-se combinações entre técnicas.
Abordagem eco-bio-social
A abordagem eco-bio-social se destaca pela aplicação de conceitos e práticas relacionados à educação social e ao cuidado com o meio ambiente como aliados do controle do mosquito. Essa abordagem possui três elementos principais: (i) transdisciplinaridade: implica uma visão inclusiva dos problemas de saúde relacionados com o ecossistema; (ii) participação dos interessados: envolve diversos parceiros, inclusive a comunidade local; e (iii) equidade: compreende a participação equânime de homens e mulheres e diferentes grupos sociais no envolvimento com as ações de combate ao Aedes.42,43 Na prática, essa abordagem é conduzida por vários setores da comunidade, incluindo a educação em saúde e ambiental e o uso de ferramentas mecânicas, sem a utilização de inseticidas para controle vetorial. Materiais de educação em saúde apropriados social e culturalmente são desenvolvidos e utilizados por vários grupos - mulheres, estudantes, gestores, novos grupos de voluntários para a saúde ambiental. As atividades são centradas na eliminação dos reservatórios de água, na colocação de tampas nos recipientes mais propícios para proliferação dos mosquitos e na instalação de telas sobre as janelas e portas.42,43
Mapeamento de risco
O mapeamento de risco também se apresenta como uma estratégia promissora, desenvolvida para avaliar e identificar áreas de risco aumentado para transmissão das arboviroses em determinados territórios, utilizando estatísticas espaciais locais. Ao relacionar os dados espaciais com dados da vigilância entomológica (características, presença, índices de infestação, avaliação da eficácia dos métodos de controle), da vigilância epidemiológica, da rede laboratorial e de saneamento, as ações específicas de controle vetorial são direcionadas para áreas prioritárias.44,45
Compostos naturais
Como uma alternativa de controle químico, alguns compostos naturais, como óleos essenciais de plantas, têm sido investigados para constatação de atividade larvicida contra o Ae. aegypti.46-48 As características de determinados grupamentos químicos estruturais desses compostos ou a combinação entre eles podem conferir aumento ou redução da atividade larvicida.46-48
Essa é uma área de pesquisa que vem despertando muito interesse, tendo em vista que é necessário produzir inseticidas eficazes e seguros para a população e para o meio ambiente.46,47 Em estudo realizado por Santos et al.,46 21 compostos apresentaram boa atividade larvicida contra o Ae. aegypti, com aumento da potência entre aqueles com grupamentos químicos mais lipofílicos. São compostos considerados inofensivos, visto que já são utilizados como aditivos aromatizantes em alimentos para consumo humano - por exemplo, o limoneno, encontrado na casca de frutas cítricas como limões e laranjas.47 Importante destacar que esses novos compostos devem, além do efeito larvicida, demonstrar um efeito residual prolongado nos depósitos onde são aplicados. Essa é uma característica importante para a adoção de um determinado composto em atividades de campanha de saúde pública.
Wolbachia
Como controle biológico do vetor, está sendo investigado o uso da Wolbachia, uma espécie de bactéria simbionte intracelular, inofensiva ao homem e a animais domésticos, encontrada naturalmente em mais de 60% dos insetos.49 A Wolbachia é capaz de reduzir pela metade o tempo de vida de um mosquito adulto e é capaz de produzir incompatibilidade citoplasmática completa, o que resulta em uma progênie estéril.50,51 Esta é uma abordagem inovadora, cujo objetivo é reduzir a transmissão do vírus da dengue pelo mosquito vetor de forma natural e autossustentável.49,50,52-54
A estratégia consiste em infectar o mosquito Ae. aegypti com cepas específicas da Wolbachia, capazes de produzir mosquitos estéreis. A interrupção do ciclo reprodutivo do Ae. aegypti ocorre quando mosquitos machos com Wolbachia acasalam com mosquitos fêmeas sem Wolbachia, e essas fêmeas fazem a postura de ovos que não eclodirão. Por sua vez, a transmissão da bactéria para as gerações descendentes ocorre quando mosquitos machos com Wolbachia acasalam com fêmeas que já estejam transportando a bactéria e vice-versa. Espera-se, com isso, que a cadeia de transmissão do vírus seja interrompida quando a população de mosquitos estiver infectada.49,55,56 A Wolbachia também se mostrou capaz de suprimir ou eliminar a transmissão de arbovírus, pela competição por aminoácidos entre o mosquito hospedeiro e o vírus, o que não implica a indução de mutações no patógeno.55,57,58 Não há evidências de que a Wolbachia promova mutações no vírus Zika e, por conseguinte, cause microcefalia.
Pesquisas de campo para avaliar a interação Wolbachia-Ae. aegypti foram iniciadas na Austrália, em 2008, e estão sendo desenvolvidas no Vietnã e no Brasil. O método baseia-se na liberação semanal de mosquitos com Wolbachia, para avaliar a capacidade desses mosquitos infectados de se estabelecerem no meio ambiente e se reproduzirem com os mosquitos já existentes nos locais.54,59-61
Mosquitos dispersores de inseticidas
Os mosquitos dispersores de inseticidas estão sendo empregados com êxito de forma experimental. A estratégia consiste em atrair as fêmeas do Aedes até pequenos recipientes, chamados de "estações de disseminação", tratados com o inseticida piriproxifeno. Nas estações de disseminação, as micropartículas do inseticida em pó grudam no corpo do mosquito e são levadas por eles até os criadouros por um raio de até 400 metros. Quando as fêmeas pousam nos reservatórios para ovipor, as partículas do inseticida são deixadas por elas na água, e assim os reservatórios passam a ser letais para as larvas dos mosquitos.62,63
Nebulização espacial intradomiciliar residual (IRS)
A IRS também está em fase experimental e consiste na aplicação de inseticida residual (a exemplo da deltametrina) dentro das residências, em pontos específicos que atraem os mosquitos adultos - como locais escuros atrás e embaixo dos móveis, o interior dos armários, dentro dos sapatos, atrás das cortinas, entre outros. Há evidências de efeito imediato e duradouro na redução de populações de Ae. aegypti imaturos e adultos.64,65
Dispositivos com inseticidas
Como alternativa prática em ambientes domiciliares estão os dispositivos plásticos contendo inseticidas de liberação lenta e contínua, com durabilidade do efeito por até 20 dias. A estratégia se mostrou efetiva para evitar as picadas e matar as fêmeas do Ae. aegypti.66,67 Os mosquitos expostos a formulações de 5% ou 10% de metoflutrina são quase totalmente inibidos de picar; dentro de poucos minutos as fêmeas do Ae. aegypti ficam desorientadas e procuram locais de repouso. Segundo os pesquisadores responsáveis pelo desenvolvimento do dispositivo, 80% a 90% dos mosquitos morrem em menos de uma hora.66,67 Configuram-se como desvantagens no uso dessa tecnologia a limitação do efeito do inseticida em ambientes muito amplos e a substituição dos dispositivos após a perda do efeito do inseticida.66,67
Mosquitos transgênicos
As estratégias genéticas também estão sendo desenvolvidas para o controle de vetores,68-70 e geralmente são divididas em duas etapas. A primeira etapa consiste em reduzir ou mesmo eliminar espécies de mosquitos por meio do desenvolvimento de genes letais ou capazes de tornar os insetos estéreis. A segunda etapa envolve a transformação ou substituição da população, pela introdução de um gene efetor para reduzir ou bloquear a transmissão da doença na população selvagem.71,72
No caso de mosquitos, para a criação em massa e liberação no meio ambiente, é essencial o uso de tecnologias de sexagem, porque apenas os machos podem ser liberados, uma vez que não se alimentam de sangue, como as fêmeas, reduzindo-se o risco de picadas e a transmissão de doenças.69,71-73
No Brasil, a partir de 2010, pesquisas de campo para avaliação dos riscos e da efetividade da liberação de mosquitos geneticamente modificados começaram a ser realizadas em Juazeiro e em Jacobina, na Bahia, e em Piracicaba, São Paulo.74-76 Resultados preliminares mostraram que, após a liberação dos mosquitos transgênicos em Juazeiro-BA, houve redução de 80% a 95% da população de Ae. aegypti.76 Em abril de 2014, a OX513A, uma cepa de mosquitos transgênicos produzida pela empresa britânica Oxitec, recebeu aprovação técnica da Comissão Técnica Nacional de Biossegurança (CTNBio) para liberação comercial no Brasil.
Esterilização de insetos por irradiação
Outra alternativa de controle vetorial promissora é a técnica de esterilização de insetos (sterile insect technique - SIT)77-79 por irradiação, que consiste em tratar os insetos machos com uma dose mínima de raios gama ou raios X para induzir rearranjos cromossômicos aleatórios e provocar esterilização dos machos. O acasalamento de machos estéreis liberados com fêmeas selvagens nativas pode levar a uma diminuição do potencial reprodutivo das fêmeas e, assim, contribuir para a eliminação local ou supressão da população de vetores, caso o número de machos liberados seja suficiente e ocorra durante o tempo necessário.80-82
Wolbachia e SIT por irradiação
Pela necessidade de minimizar o risco de substituição populacional pelo uso da Wolbachia e o risco de transmissão do patógeno pelos mosquitos submetidos à SIT por irradiação, está sendo testada uma combinação das técnicas de SIT e de insetos incompatíveis pela Wolbachia (incompatible insect technique - IIT).80,83 Essa estratégia combinada consiste em infectar os mosquitos com Wolbachia e depois submetê-los à exposição de raios X ou raios gama. Uma das vantagens é que a tecnologia dispensa o processo de sexagem dos mosquitos, que é um procedimento relativamente caro e demorado.80,83
Roupas impregnadas com inseticidas
Uma alternativa de controle vetorial destinada às crianças consiste no uso de uniformes impregnados com inseticidas. Essa é uma tecnologia já utilizada em uniformes militares para evitar a picada de insetos em combate na selva.84-86 Essa estratégia tem como finalidade prevenir picadas dos mosquitos durante o período em que as crianças permanecem na escola. A desvantagem dessa tecnologia é que o uniforme é usado somente em determinado período do dia e nos dias letivos.87-89 Pode ser uma tecnologia útil para gestantes, com o intuito de prevenir a infecção pelo vírus Zika, implicado na causalidade da microcefalia e de outras complicações neurológicas.
Telas impregnadas com inseticidas
As telas impregnadas com inseticidas são instaladas nas janelas e portas dos domicílios, escolas e unidades de saúde próximas às regiões com maior número de casos notificados. As telas são impregnadas com deltametrina e possuem proteção ultravioleta. A desvantangem é que essa tecnologia foi implantada com sucesso em domicílios localizados em regiões com baixo/médio nível socioeconômico e com poucas edificações prediais, não sendo, portanto, representativa para qualquer área.90,91
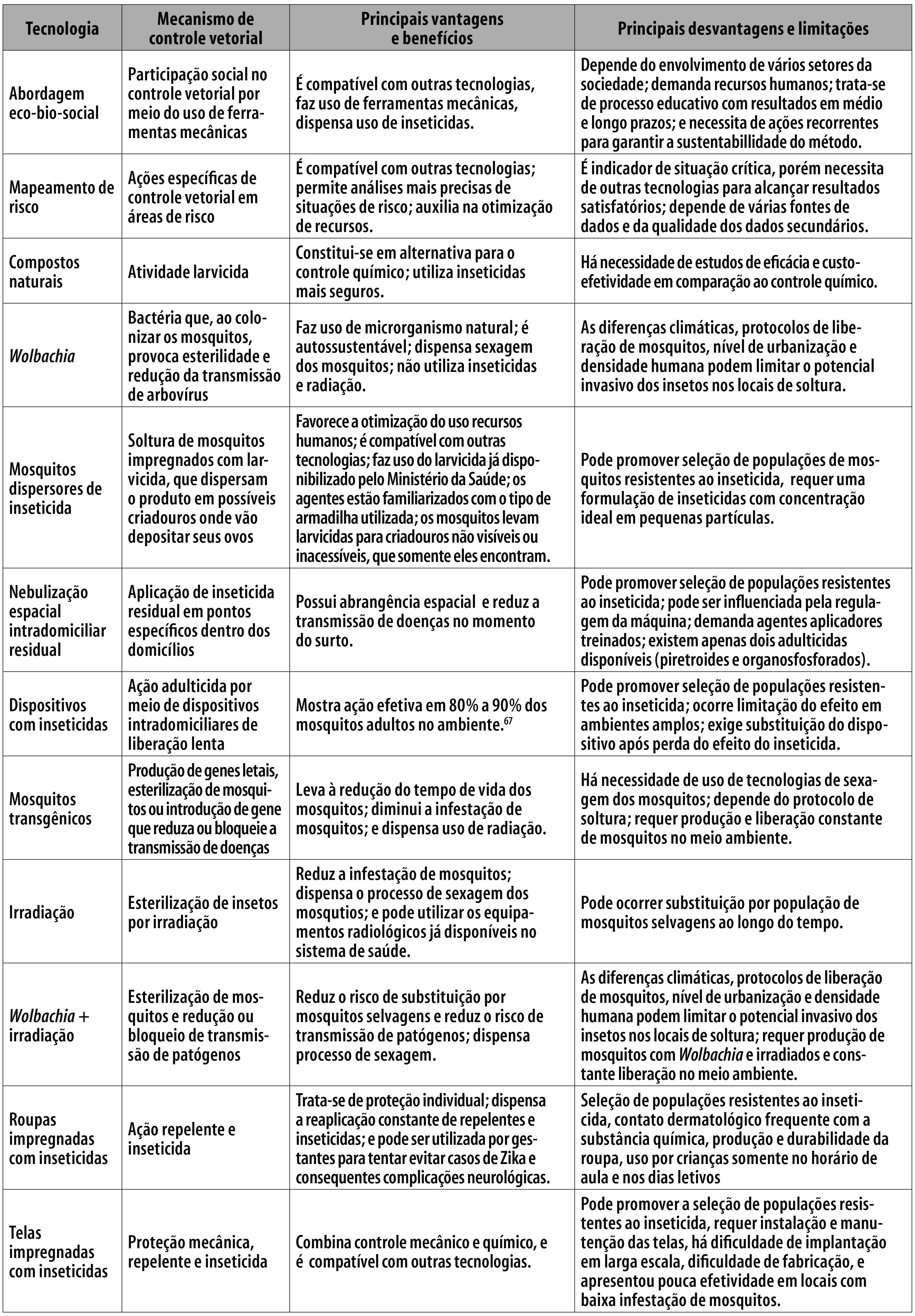
As principais vantagens e limitações das tecnologias promissoras para o controle do Ae. aegypti estão elencadas na Figura1.
Discussão
Este estudo evidencia as principais estratégias de controle vetorial preconizadas no PNCD e aquelas com potencial de uso complementar às atividades do Programa no Brasil, sem a intenção de esgotar todas as estratégias de controle vetorial existentes e em desenvolvimento no mundo. Ressalte-se, no entanto, que as ações preconizadas pelo PNCD desenvolvidas nos municípios não têm demonstrado eficácia na redução da infestação pelo Aedes na maior parte do país, o que se reflete no aumento de casos de dengue, chikungunya e Zika.92
Para ser considerada útil no controle vetorial, é necessário que a tecnologia tenha eficácia e segurança, factibilidade em larga escala e em tempo hábil, compatibilidade com as estratégias já utilizadas, custos razoáveis para implantação e uso contínuo, sustentabilidade do método, e ofereça risco mínimo de externalidades negativas para o meio ambiente e para a população.
A adoção de combinações de estratégias de controle vetorial requer contínua avaliação da efetividade, considerando os possíveis efeitos sinérgicos entre as estratégias compatíveis e a heterogeneidade espacial, a partir da avaliação de áreas de risco dentro dos aglomerados urbanos, principalmente nas capitais e nas regiões metropolitanas. A abordagem eco-bio-social e o mapeamento de áreas de risco constituem tecnologias que podem ser integradas a todas as outras estratégias.
Aliadas às estratégias específicas de combate ao vetor, as ações intersetoriais têm sido cada vez mais necessárias para o êxito do controle das arboviroses. Conforme preconizado pelo PNCD,26 a cooperação de outras áreas além do setor saúde é fundamental para lograr êxito no combate aos vetores, considerado o principal método para evitar os casos de dengue, Zika e chikungunya até o momento. Saneamento básico, manejo adequado de resíduos sólidos e de lixo, abastecimento regular de água, educação em saúde, vigilância de fronteiras, turismo e intensa movimentação de pessoas são exemplos de macrofatores externos à saúde2 que precisam ser priorizados como alvos estratégicos de políticas sólidas, com o envolvimento de todos os setores da sociedade.
Levando-se em consideração as dimensões continentais do Brasil, as diferenças socioeconômicas e de infraestrutura2 e o perfil de susceptibilidade dos mosquitos aos inseticidas,30,41 faz-se necessário o monitoramento das situações regionais a partir do mapeamento de risco, para a adoção de um conjunto adequado de medidas de controle vetorial. Além de compatível com outras tecnologias, esse tipo de mapeamento permite análises mais precisas de situações de risco, auxiliando na otimização de recursos.
Entretanto, podem existir algumas restrições relacionadas à qualidade das informações disponíveis para a realização do mapeamento de risco para arboviroses. Embora o sistema de vigilância da dengue no Brasil tenha se mostrado consistente, oportuno para notificação de casos e representativo,93 após a reintrodução dos vírus chikungunya e Zika, foram impostas dificuldades para o diagnóstico diferencial das arboviroses com sinais e sintomas semelhantes, o que pode comprometer a adequada notificação dos casos.94,95 O sistema de vigilância ainda pode ser aprimorado com o uso de aplicativos para melhorar a oportunidade na notificação e na digitação dos dados,93 por meio de investimentos que garantam a aceitabilidade e a estabilidade do sistema,96 favoreçam a completitude dos dados e ampliem sua representatividade e sensibilidade,97 com o intuito de torná-lo cada vez mais útil para a prevenção e o controle das arboviroses.98
Recomenda-se que a incorporação de novas tecnologias que envolvam o uso de inseticidas, tais como mosquitos dispersores,62,63 pulverização intradomiciliar,64 repelentes espaciais,66,67 roupas e telas impregnadas,32 e larvicidas biológicos,38,46 seja acompanhada de monitoramento do perfil de susceptibilidade dos mosquitos aos inseticidas, considerando a possibilidade de manutenção de populações geneticamente resistentes.30,41
Uma vez incorporadas novas tecnologias no PNCD, serão necessários estudos que avaliem estratégias de implementação e de impacto orçamentário e investimentos financeiros para sustentabilidade e avaliação contínua das intervenções.
A integração de diferentes estratégias de controle vetorial compatíveis e eficazes, considerando as tecnologias disponíveis e as características regionais específicas, parece ser um mecanismo viável para a redução da infestação dos mosquitos e a incidência das arboviroses transmitidas por eles, dado que inexiste uma solução única para o controle do Ae. aegypti no Brasil.
Contudo, ainda há muito a ser investigado sobre estratégias de controle do Ae. aegypti com ênfase nas inovações tecnológicas promissoras. Foram abordadas neste estudo questões relevantes, como a abordagem eco-bio-social, tendo em vista a relevância do envolvimento da sociedade para a sustentabilidade do controle do vetor. Porém, outras investigações igualmente importantes ligadas às estratégias de comunicação social com envolvimento de segmentos da sociedade e de toda a população não foram tratadas neste texto, entre elas as novas abordagens educativas e as de incentivo à participação da comunidade no controle de arboviroses.
Do ponto de vista do planejamento estratégico e contínuo, são de grande relevância no âmbito nacional estudos de revisão da evidência científica e avaliações econômicas completas que busquem apontar ações integradas de controle vetorial viáveis aliadas às inovações tecnológicas, bem como valorizar a atuação coordenada dos diversos setores da sociedade. Esses estudos de revisão podem contribuir para direcionar medidas nos programas já estabelecidos na vigilância em saúde, principalmente diante do cenário de epidemias de dengue, Zika e chikungunya92 no qual o Brasil se encontra.