Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Epidemiologia e Serviços de Saúde
versión impresa ISSN 1679-4974versión On-line ISSN 2237-9622
Epidemiol. Serv. Saúde v.25 n.esp Brasília jun. 2016 Epub 30-Jun-2016
http://dx.doi.org/10.5123/s1679-49742016000500002
CONSENSO
Consenso Brasileño en Enfermedad de Chagas, 2015*
1Centro de Pesquisa René Rachou, Fundação Oswaldo Cruz, Belo Horizonte, Minas Gerais, Brasil
2Faculdade de Medicina, Universidade Federal do Ceará, Fortaleza, Ceará, Brasil
3Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais, Brasil
4Instituto de Patologia Tropical e Saúde Pública, Universidade Federal de Goiás, Goiânia, Goiás, Brasil
5Faculdade de Medicina, Universidade de São Paulo, São Paulo, São Paulo, Brasil
6Instituto Oswaldo Cruz, Fundação Oswaldo Cruz, Rio de Janeiro, Rio de Janeiro, Brasil
7Faculdade de Ciências Médicas, Universidade Estadual de Campinas, Campinas, São Paulo, Brasil
8Faculdade de Ciências Médicas de Pernambuco, Universidade de Pernambuco, Recife, Pernambuco, Brasil
9Organização Pan American de Saúde, Brasília, Distrito Federal, Brasil
10Hospital das Clínicas, Faculdade de Medicina, Universidade Federal de Goiás, Goiânia, Goiás, Brasil
11Hospital das Clínicas, Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais, Brasil
12Instituto de Medicina Tropical de São Paulo, Universidade de São Paulo, São Paulo, São Paulo, Brasil
13Hospital Anis Rassi, Goiânia, Goiás, Brasil
14Instituto de Cardiologia Dante Pazzanese, São Paulo, São Paulo, Brasil
15Instituto Nacional de Infectologia Evandro Chagas, Fundação Oswaldo Cruz, Rio de Janeiro, Rio de Janeiro, Brasil
16Faculdade de Medicina, Universidade Federal do Triângulo Mineiro, Uberaba, Minas Gerais, Brasil
17Instituto Evandro Chagas, Ministério da Saúde, Belém, Pará, Brasil
18Hospital das Clínicas, Faculdade de Medicina, Universidade Federal de Goiás, Goiânia, Goiás, Brasil
19Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais, Brasil
20Fundação Ezequiel Dias, Secretaria de Estado de Saúde de Minas Gerais, Belo Horizonte, Minas Gerais, Brasil
21Faculdade de Medicina, Universidade Estadual de Londrina, Londrina, Paraná, Brasil
22Departamento de Ciências Biológicas, Universidade Federal do Triângulo Mineiro, Uberaba, Minas Gerais, Brasil
23Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, São Paulo, Brasil
24Hospital Universitário Clementino Fraga Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, Rio de Janeiro, Brasil
25Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, São Paulo, Brasil
26Secretaria de Vigilância em Saúde, Ministério da Saúde, Brasília, Distrito Federal, Brasil
27Empresa Brasileira de Hemoderivados e Biotecnologia, Ministério da Saúde, Brasília, Distrito Federal, Brasil
La Enfermedad de Chagas es una condición crónica descuidada con elevada carga de morbilidad y mortalidad e impacto desde los puntos de vista psicológico, social y económico. Representa un importante problema de salud pública en Brasil, con diferentes escenarios regionales. Este documento traduce la sistematización de las evidencias que compone el Consenso Brasileño de Enfermedad de Chagas. El objetivo fue sistematizar estrategias de diagnóstico, tratamiento, prevención y control de la Enfermedad de Chagas en el país, de modo a reflexionar sobre las evidencias científicas disponibles. Su construcción se fundamentó en la articulación y contribución estratégica de expertos brasileños con conocimiento, experiencia y actualización sobre diferentes aspectos de la enfermedad. Representa el resultado de la estrecha colaboración entre la Sociedad Brasileña de Medicina Tropical y el Ministerio de Salud. Se espera, con este documento, fortalecer el desarrollo de acciones integradas para el enfrentamiento de la enfermedad en el país con enfoque en epidemiología, gestión, atención integral (incluyendo familias y comunidades), comunicación, información, educación e investigaciones.
Palabras claves: Enfermedad de Chagas; Epidemiología; Control; Diagnóstico; Tratamiento; Asistencia a la Salud; Consenso; Brasil
ASPECTOS GENERALES DE LA EPIDEMIOLOGÍA DE LA ENFERMEDAD DE CHAGAS, CON ESPECIAL ATENCIÓN A BRASIL
Introducción
La Enfermedad de Chagas representa una condición infecciosa (con fase aguda o crónica) clasificada como enfermedad descuidada por la Organización Mundial de la Salud (OMS).1,2 Es resultante de la pobreza humana, al mismo tiempo que la reproduce y presenta elevada carga de morbilidad y mortalidad en países endémicos, incluyendo a Brasil, con expresión focal en diferentes contextos epidemiológicos.1-4 La distribución espacial de la enfermedad está limitada primariamente al continente americano en virtud de la distribución de más de 140 especies del insecto vector (Triatominae, Hemíptera, Reduviidae), a raíz de eso es también llamada de “tripanosomiasis americana”.5 Progresivamente, sin embargo, la enfermedad está alcanzando a países no endémicos, mediante el desplazamiento de personas infectadas y por medio de otros mecanismos de transmisión, como resultado del intenso proceso de migración internacional.6-13
La OMS estima en, aproximadamente, 6 a 7 millones el número de personas infectadas en todo el mundo, la mayoría en Latinoamérica.14 Estimaciones recientes para 21 países Latinoamericanos, con base en datos de 2010, indicaban 5.742.167 de personas infectadas por Trypanosoma cruzi, de las cuales 3.581.423 (62,4%) eran residentes en naciones de la Iniciativa de los Países del Cono Sur, destacándose Argentina (1.505.235), Brasil (1.156.821) y México (876.458), seguidos por Bolivia (607.186).5 Estos datos divergen de otras estimaciones realizadas por diferentes grupos de investigación y métodos para definición de infección por T. cruzi en varios países, lo que dificulta establecer exactamente la prevalencia de la Enfermedad de Chagas en las Américas. No obstante, los autores están de acuerdo en que el número de infectados es aún muy expresivo en el contexto sanitario y social del Continente, requiriendo prioridad y atención por parte de los países.15,16
La Tabla 1 presenta los cambios en parámetros epidemiológicos específicos para Latinoamérica en años recientes.5,17
Tabla 1 - Cambios en la mortalidad, prevalencia e incidencia por transmisión vectorial de la Enfermedad de Chagas en 21 países endémicos de Latinoamérica, en los años de 1990, 2000, 2006 y 2010
| Parámetros - estimaciones | 1990 | 2000 | 2006 | 2010 |
|---|---|---|---|---|
| Número de muertes/año | >45.000 | 21.000 | 12.500 | 12.000 |
| Número de personas infectadas | 30.000.000 | 18.000.000 | 15.000.000 | 5.742.167 |
| Casos nuevos/año - transmisión vectorial | 700.000 | 200.000 | 41.200 | 29.925 |
| Población total bajo riesgo | 100.000.000 | 40.000.000 | 28.000.000 | 70.199.360 |
Fuente: Adaptado de Pan American Health Organization, 200617 (TDR/WHO, PAHO, WHO); de World Health Organization, 2015.5
Así, a pesar de los avances en el control del vector y en la garantía de la calidad de las transfusiones de sangre en varios de esos países, especialmente a partir de iniciativas intergubernamentales deflagradas en la década de 1990,3,4,10,11,18 todavía es inequívoca la relevancia de la Enfermedad de Chagas como problema de salud pública en América Latina, bajo diferentes estándares regionales de expresión epidemiológica. Los retos se amplían cuándo se sabe que hay estimaciones de 2015 con más de 80% de las personas padeciendo la Enfermedad de Chagas en el mundo sin acceso a diagnóstico y a tratamientos sistemáticos, lo que sostiene el elevado impacto de morbilidad y mortalidad y el costo social de la enfermedad.
Migraciones humanas no controladas, degradación ambiental, alteraciones climáticas, mayor concentración de la población en áreas urbanas y precariedad de las condiciones socioeconómicas (habitación, educación, alcantarillado, renta, entre otras) se insertan como determinantes y condicionantes sociales para la transmisión de T. cruzi al hombre.1,10,11,19-23 Descuidadas en diferentes grados y perspectivas, las poblaciones infectadas presentan mayor vulnerabilidad, la cual se expresa por la superposición y la mayor exposición a otras enfermedades, condiciones y agravamientos, menor cobertura con intervenciones preventivas, mayor probabilidad de enfermar, menor acceso a la red de servicios de salud, peor calidad de atención recibida en los servicios de atención primaria, menor probabilidad de recibir tratamientos esenciales, menor acceso a servicios de nivel secundario y terciario, mayor probabilidad de desarrollo de formas graves de la enfermedad y mayor riesgo de evolución a óbito.24
En esta perspectiva, se torna esencial un mayor conocimiento relativo a escenarios epidemiológicos de la Enfermedad de Chagas y su dinámica de transmisión, involucrando a personas infectadas y en riesgo de infección, diferentes poblaciones del parásito, especies del vector y reservorios de T. cruzi. Este conocimiento integrado representa factor central para la búsqueda de acciones consistentes y sostenibles de gestión, vigilancia, control y atención a la salud y social, coherentes, eficaces, efectivas y eficientes.1,10,11,25-27
A pesar de esta clara necesidad por mayores evidencias, después de más de 105 años desde el descubrimiento de la enfermedad por Carlos Ribeiro Justiniano Chagas (1909), todavía, persisten importantes lagunas en los campos técnico, científico y político que deben ser superadas para el efectivo enfrentamiento de esta condición extensamente descuidada.
Brasil, con sus dimensiones continentales, está pasando por grandes y rápidas transformaciones demográficas, sociales y ambientales, aunque persistan las graves desigualdades socioeconómicas y regionales. Aquí, enfermedades asociadas a los contextos de vulnerabilidad social y descuido, todavía y afligen a parte considerable de la población.28
Poco a poco, sin embargo, se ha observado una mejoría consistente en la situación general de la salud y en la expectativa de vida de la población brasileña, lo que puede ser atribuido a transformaciones en los determinantes sociales de la salud, al avance en el control de enfermedades infecciosas y a la implementación de un sistema nacional de salud más amplio, con relevante participación social.28,29
A pesar de los avances ocurridos en el campo social brasileño, se reconoce la persistencia de grandes desigualdades sociales que resultan en situaciones de vulnerabilidad individual, programática y social potencial que involucran a la Enfermedad de Chagas. Nuevos problemas de salud emergen todavía, como resultado del intenso proceso de urbanización y de los cambios en el campo social y ambiental, mientras que otros tienden a persistir y a coexistir,28 demandando nuevas respuestas de la red de atención a la salud.30
Demandan, por lo tanto, acciones específicas, ajustadas a nuevas realidades, orientadas a un enfoque integrado de los diferentes componentes involucrados en la historia natural de la enfermedad: seres humanos, vectores, reservorios y T. cruzi.3,6,15 La gran extensión y diversidad territorial, con especificidades en las dinámicas ecológica, demográfica, social y económica de las regiones, implica en múltiples escenarios clínicos, epidemiológicos y operacionales.3,4,15
Los próximos años traen, más allá de los desafíos, oportunidades de una acción todavía más concreta y compartida para enfrentar la Enfermedad de Chagas. El año de 2015 fue el año de lanzamiento de los nuevos diecisiete Objetivos de Desarrollo Sostenible (ODS), que se basan en los ocho Objetivos de Desarrollo del Milenio (ODM). La agenda que fue acordada y consolidada en el documento referencial “Transformando Nuestro Mundo: la Agenda 2030 para el Desarrollo Sostenible”, representa una oportunidad histórica y sin precedentes para los países en busca de nuevos caminos globales.31 De una forma más amplia, esas decisiones determinarán el curso global de la acción para el enfrentamiento y la eliminación de la pobreza, con el objetivo de promover la prosperidad y el bienestar para todos, proteger el ambiente y enfrentar las cambios climáticos.31
La Enfermedad de Chagas se inserta en el tercer objetivo de este documento, que tiene como finalidad “asegurar una vida saludable y promover el bienestar de todos, en todas las edades”, en la meta de, hasta 2030, acabar con las epidemias de SIDA, tuberculosis, malaria y enfermedades tropicales descuidadas, y combatir la hepatitis, enfermedades transmitidas por el agua, y otras enfermedades transmisibles.31 Se destaca el avance en la composición del indicador específico para monitorear las enfermedades tropicales descuidadas en el mundo, a partir del reconocimiento del número de personas que requieren intervenciones contra este grupo de enfermedades. Adicionalmente, se visualizan también la Enfermedad de Chagas y otras enfermedades tropicales descuidadas en interfaces con el segundo (hambre cero y agricultura sostenible), quinto (igualdad de género) y sexto (agua potable y alcantarillado) objetivos.31
MORBILIDAD Y MORTALIDAD
Infección por T. cruzi
En Brasil, el número reducido de estudios sistemáticos, de base poblacional, dificulta la evaluación por estimaciones de la magnitud de la Enfermedad de Chagas a lo largo de la historia.
En un período que va hasta, aproximadamente, los años 1950, la Enfermedad de Chagas era reconocida como endemia eminentemente rural, en áreas de elevada vulnerabilidad social, predominando la transmisión vectorial. Con el proceso de industrialización del país, la enfermedad fue siendo moldeada a un nuevo contexto epidemiológico urbano, potenciados por la migración interna en el país, de áreas rurales para áreas urbanas, y por el crecimiento de las ciudades.4
Entre 1975 y 1980, una investigación serológica nacional en la población rural de Brasil (excepto en São Paulo), estimó la prevalencia global en el país en 4,2%, correspondiendo a 6,5 millones de personas infectadas por T. cruzi.20,32,33 En 1996 fue estimada para Brasil la prevalencia de infección por T. cruzi en 3,1% para 1978 y en 1,3% para 1995, llegándose a un número estimado de 1,96 millón de personas infectadas.34 Posteriormente, la Organización Panamericana de la Salud (OPAS) estimó el número de personas expuestas al riesgo en áreas endémicas en Brasil en 21,8 millones, siendo de 1,9 millón (1,019% de la población) el número de personas infectadas.17
En 2014 se publicó el primer estudio con revisión sistemática y metaanálisis para estimar la prevalencia de la Enfermedad de Chagas en Brasil. Incluyendo publicaciones del período entre 1980 y 2012, se estimó la prevalencia agrupada de la Enfermedad de Chagas en 4,2% (Intervalo de Confianza [IC] 95%: 3,1-5,7), variando de 4,4% (IC95%: 2,3-8,3) en la década de 1980 a 2,4% (IC95%: 1,5-3,8) después de 2000.35 En este estudio, las mayores prevalencias fueron verificadas en: mujeres (4,2%; IC95%: 2,6-6,8), mayores de 60 años (17,7%; IC95%: 11,4-26,5), residentes en las regiones Nordeste (5,0%; IC95%: 3,1-8,1) y Sudeste (5,0%; IC95%: 2,4-9,9) y en áreas mixtas, urbana/rural (6,4%; IC95%: 4,2-9,4), estimándose que 4,6 millones (IC95%: 2,9-7,2 millones) de personas estarían infectadas por T. cruzi en Brasil. Destacando la limitación de los hallazgos en la literatura, los autores encarecieron la necesidad de nuevos estudios, con vistas a estimaciones cada vez más cercanas al contexto real.35
A partir de éste y de otros estudios, las estimaciones más recientes en Brasil relativas al número de personas infectadas por T. cruzi varían de 1,9 millón a 4,6 millones de personas,35-37 probablemente más cercano actualmente a la variación de 1,0 a 2,4% de la población.
Este escenario epidemiológico trae para el país el reto, en las próximas décadas, de sostener las acciones de control y establecer un plan consistente en el Sistema Único de Salud (SUS) para diagnóstico, tratamiento y atención integral a millones de ciudadanos,38 aliado a acciones de vigilancia epidemiológica más ajustadas a esta realidad.15,22 Partiéndose del supuesto de que hasta un 30% de las personas crónicamente infectadas podrán presentar alteraciones cardíacas y que, hasta un 10% podrá presentar alteraciones digestivas, neurológicas o mixtas, se amplía la necesidad de estructurar una red de atención a la salud oportuna, resolutiva e integral para la Enfermedad de Chagas en el país.39
Con el objetivo de establecer estimaciones para Brasil con relación al número de personas infectadas por T. cruzi, se tomó como referencia de base poblacional la publicación Proyección de la Población de Brasil por Sexo y Edad para el Período 2000/2060 y Proyección de la Población de las Unidades de la Federación por Sexo y Edad para el período 2000/2030, del Instituto Brasileño de Geografía y Estadística (IBGE). De acuerdo con el IBGE, la población brasileña seguirá creciendo hasta el año de 2042, cuando deberá llegar a 228,4 millones de personas, la mayoría concentrada en centros urbanos. A partir de ahí, habrá una disminución gradual y estará en torno de 218,2 millones en 2060.40
La Tabla 2 presenta la proyección relativa a las estimaciones del número de personas infectadas por T. cruzi y del número de casos con Enfermedad de Chagas en la fase crónica con la forma cardíaca y con la forma digestiva en Brasil, en el período de 2015 a 2055, por quinquenios. En 2015, por ejemplo, teniendo como base la estimación de una población de 204.450.649, se estimaba que entre 1.426.994 y 3.357.633 brasileños estuvieran infectados por T. cruzi, de 142.699 a 335.763 potencialmente con la forma digestiva, y de 428.098 a 1.007.290 con la forma cardíaca. La población estimada con infección por T. cruzi en la forma indeterminada variaba de 856.197 a 2.014.580 personas.
Tabla 2 - Proyecciones de las estimaciones de prevalencia de infección por T. cruzi y de la Enfermedad de Chagas en la fase crónica con la forma cardíaca y con la forma digestiva en Brasil, en el período de 2000 a 2055
| Año | Estimación de la población brasileña | Franja de edad de referencia | Estimación del número de personas infectadas | Estimación de casos con la forma digestiva | Estimación de casos con la forma cardíaca | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Franja de | Infección 1,02%a | Infección 2,4%b | Infección 1,02%a | Infección 2,4%b | Infección 1,02%a | Infección 2,4%b | ||||
| Edad | Población | % | ||||||||
| 2000 | 173.448.346 | ≥5 | 156.133.836 | 90,0 | 1.592.565 | 3.747.212 | 159.257 | 374.721 | 477.770 | 1.124.164 |
| 2005 | 185.150.806 | ≥10 | 150.944.641 | 81,5 | 1.539.635 | 3.622.671 | 153.964 | 362.267 | 461.891 | 1.086.801 |
| 2010 | 195.497.797 | ≥15 | 145.563.676 | 74,5 | 1.484.749 | 3.493.528 | 148.475 | 349.353 | 445.425 | 1.048.058 |
| 2015 | 204.450.649 | ≥20 | 139.901.357 | 68,4 | 1.426.994 | 3.357.633 | 142.699 | 335.763 | 428.098 | 1.007.290 |
| 2020 | 212.077.375 | ≥25 | 133.880.929 | 63,1 | 1.365.585 | 3.213.142 | 136.559 | 321.314 | 409.676 | 963.943 |
| 2025 | 218.330.014 | ≥30 | 127.334.466 | 58,3 | 1.298.812 | 3.056.027 | 129.881 | 305.603 | 389.644 | 916.808 |
| 2030 | 223.126.917 | ≥35 | 120.096.221 | 53,8 | 1.224.981 | 2.882.309 | 122.498 | 288.231 | 367.494 | 864.693 |
| 2035 | 226.438.916 | ≥40 | 112.013.898 | 49,5 | 1.142.542 | 2.688.334 | 114.254 | 268.833 | 342.763 | 806.500 |
| 2040 | 228.153.204 | ≥45 | 102.983.115 | 45,1 | 1.050.428 | 2.471.595 | 105.043 | 247.160 | 315.128 | 741.479 |
| 2045 | 228.116.279 | ≥50 | 92.984.144 | 40,8 | 948.438 | 2.231.619 | 94.844 | 223.162 | 284.531 | 669.486 |
| 2050 | 226.347.688 | ≥55 | 82.097.220 | 36,3 | 837.392 | 1.970.333 | 83.739 | 197.033 | 251.218 | 591.100 |
| 2055 | 222.975.532 | ≥60 | 70.485.475 | 31,6 | 718.952 | 1.691.651 | 71.895 | 169.165 | 215.686 | 507.495 |
Fuente: IBGE - Estimaciones poblacionales globales y por edad. Coordinación de población e Indicadores Sociales. Gerencia de Estudios y Análisis de la Dinámica Demográfica.40
a) Parámetros para estimaciones (mínima y máxima) de la prevalencia de infección por T. cruzi -PAHO, 2006;17 Martins-Melo y colaboradores, 2014.35
b) Parámetros para estimaciones máximas de la prevalencia de Enfermedad de Chagas en la fase crónica con la forma cardíaca (x 30%) y con la forma digestiva (x 10%).
Además de los procesos internos de migración en Brasil, con urbanización de la Enfermedad de Chagas, la aparición en migrantes oriundos de áreas endémicas en países tradicionalmente no endémicos ha traído una discusión ampliada sobre contextos de riesgos y vulnerabilidad, un desafío para el desarrollo de acciones de control para estos países.3,6,7,10-13,16,18,36,37,41,42 Múltiples factores bioecológicos, socioculturales y políticos han sido implicados en este proceso,10 demandando la ampliación del número de investigaciones del área de ciencias sociales y humanas relativas a la enfermedad.43
En 2005, se estimó un total de 501.036 brasileños en Estados Unidos, con una prevalencia de infección por T. cruzi de 1,02%,17 o 5.106 casos.44 De una forma más amplia, se estima que un total que varía de 300 mil a un poco más de 1,0 millón de personas estén infectadas por T. cruzi en aquel país,8,9 con diferentes impactos para el sistema de salud. Recordemos que se trata de un área no endémica.9,45
Se estima que aproximadamente 72 mil personas infectadas por T. cruzi estén viviendo en Europa.12 A partir del análisis de datos agregados de revisión sistemática y metaanálisis investigando la prevalencia de la Enfermedad de Chagas en personas latinoamericanas viviendo en Europa (España, Francia, Suiza, Italia y Alemania), se estimó la prevalencia de esta infección en brasileños en 0,6% (0,16-1,12%) o 4/954.13 Los migrantes oriundos de Bolivia presentaron la mayor prevalencia de la Enfermedad de Chagas (18,1%), seguidos por los migrantes de Paraguay (5,5%). La prevalencia entre migrantes de Argentina ha sido de 2,2%; no ha habido casos de Enfermedad de Chagas detectados entre migrantes de Uruguay, Venezuela, Panamá, Guatemala y México.13
Se reconoce el aparecimiento de otras olas de migración internacional importantes dentro de Latinoamérica, como, por ejemplo, de Bolivia y desde Paraguay hacia Argentina y Brasil, o desde Colombia hacia Venezuela.10 Por otro lado, especialmente a partir de la segunda mitad del siglo XX, se destaca la intensificación del movimiento de miles de ciudadanos de Latinoamérica para países de América del Norte (principalmente a los Estados Unidos y también a Canadá), Europa (en especial España, además de otras naciones), Asia (Japón) y Oceanía (Australia), ampliando el número de personas con Enfermedad de Chagas viviendo en países no endémicos.2,7,10,12,42 En general este proceso migratorio se asocia a la búsqueda por mejores condiciones de vida de personas en grave situación de vulnerabilidad social, oriundas de países endémicos.10
Además de la presencia de brasileños potencialmente infectados por T. cruzi en el exterior, el país ha recibido considerables flujos migratorios de otros países endémicos, como Bolivia, desde donde se estiman de 80 mil a 200 mil migrantes aproximadamente en el Estado de São Paulo.46 Este hecho ha suscitado en el país, la discusión sobre políticas públicas de salud consistentes en el sentido de ofrecer mayor atención a esta población de migrantes, con vistas, inclusive, a enfrentar las precarias condiciones de vida y de trabajo a las cuales son sometidos.46,47
Además del contexto de migración, hay un claro desplazamiento de la prevalencia de infección por T. cruzi para franjas de edades más avanzadas en el país, lo que trae nuevos desafíos para el SUS. Con el predominio de casos de Enfermedad de Chagas en la fase crónica, resultado en gran parte de infección por vía vectorial en el pasado, se amplió la probabilidad de la aparición de comorbidades, infecciosas o no, la mayoría de carácter crónico degenerativo, en especial, diabetes mellitus, hipertensión arterial sistémica y otras cardiopatías. Entre estas condiciones, se inserta y emerge la coinfección VIH con T. cruzi, o la asociación con otras condiciones inmunosupresoras, adquiridas o inducidas.2,48-51 La mayor supervivencia, aliada a los procesos migratorios y de urbanización en las últimas cinco décadas, entre otros factores, amplificaron este riesgo.49
Como en otras enfermedades infecciosas el T. cruzi puede portarse como microorganismo oportunista en individuos con inmunosupresión2,49-52. A pesar de que el primer caso de coinfección T. cruzi y VIH haya sido relatado en la década de 1980, la frecuencia con que ocurre esta asociación, así como la específica de la reactivación, cual sea el perfil clínico y de laboratorio de la persona con coinfección, los tratamientos específicos para la infección por T. cruzi y VIH más adecuados, el dimensionamiento de la supervivencia y de óbitos en estos individuos persisten como lagunas a nivel global.49,52,53
En Brasil, se estimó la prevalencia de la coinfección en 1,3%.48,49,52 Considerándose que hay aproximadamente 734 mil personas viviendo con VIH (sin SIDA) en Brasil en el año de 2014, correspondiendo a una prevalencia en la población general de 0,4%,51 habría un total estimado de 9.542 casos de coinfección T. cruzi/VIH. Por otro lado, desde el inicio de la epidemia de SIDA en Brasil hasta junio de 2014, fueron registrados en el Sistema Nacional de Agravamientos de Notificación (Sinan) un total de 757.042 casos de SIDA,50 a partir de los cuales, serían estimados 9.842 casos más de coinfección. Se estima, por lo tanto, un total de 19.384 casos con coinfección T. cruzi/VIH-SIDA en Brasil con base en los datos hasta junio de 2014, destacándose que muchos de estos casos probablemente murieron o están sin diagnóstico, sin reconocimiento, por lo tanto, del cuadro de coinfección.
En Brasil, se recomienda para todo caso con infección por VIH o SIDA la solicitud de prueba anti T. cruzi, teniendo en cuenta potenciales contextos epidemiológicos de riesgo.51 Se destaca todavía que, para fines de vigilancia epidemiológica, desde 2004, la reactivación de la Enfermedad de Chagas ha sido insertada en los listados de enfermedades indicativas de SIDA en la vigencia de infección por VIH y ha sido un marcador importante a partir del diagnóstico definitivo de meningoencefalitis y miocarditis de Chagas.39,49,52,54 De modo general, como la coinfección por VIH generalmente ocurre en individuos previamente infectados por T. cruzi, por transmisión sexual, la tendencia esperada en Brasil es de un progresivo decrecimiento de los casos de coinfección, desde que la Enfermedad de Chagas está restringiéndose cada vez más a los grupos de edad más elevada.
Más allá del cuadro de coinfección, de una forma general, a pesar de la elevada carga de morbilidad y mortalidad de la Enfermedad de Chagas en Brasil, los datos relativos a la vigilancia epidemiológica específica de casos humanos de esa enfermedad no permiten estimar su magnitud, una vez que solamente casos en la fase aguda son notificados obligatoriamente por medio del Sinan. Además, se estima que, solamente 10-20% de los casos de Enfermedad de Chagas aguda sean, de hecho, notificados.
En el período de 2000 a 2013 (datos actualizados en mayo/2014) fueron notificados 1.570 casos de Enfermedad de Chagas aguda (un promedio de 112 casos al año), oriundos de registros de la mayoría de los estados brasileños, con excepción de Mato Grosso do Sul y del Distrito Federal en la región Centro-Oeste y de Paraná, en la región Sur. La mayoría de estos casos (1.430, 91,1%) se concentraba en la región Norte, seguida por las regiones Nordeste (73, 4,7%), Sur (28, 0,2%), Centro-Oeste (27, 1,8%) y Sudeste (12, 0,8%). Se destaca que el Estado de Pará ha sido responsable por 75% de todos los casos en el país y por 82% de los casos de la región Norte.55
En relación al municipio de residencia, 163 registraron casos de Enfermedad de Chagas aguda, de los cuales, 97 (60%) pertenecen a la región Norte, 37 (23%) a la región Nordeste, 14 (9%) a la región Centro-Oeste y, en menores proporciones, 9 (6%) y 6 (4%) a los municipios de las regiones Sudeste y Sur, respectivamente.55 Este estándar de notificación es bastante distinto al verificado en los años 1990,4,18,19 pero todavía demarca contextos operacionales de “silencio epidemiológico” en algunas áreas.
Mortalidad
La carga de la mortalidad relacionada a la Enfermedad de Chagas en Brasil persiste en niveles elevados, a despecho de las acciones de control emprendidas.3,29,35,56,57
Un estudio conducido con el objetivo de cuantificar el estándar de mortalidad por Enfermedad de Chagas en el período de 1981 a 1998 identificó que, de los 68.936 de muertes en brasileños con naturalidad conocida, un 32.369 (32%) ocurrió en personas naturales de otras Unidades de la Federación que no la de residencia del fallecido, variando de 0,3% en Rio Grande do Sul a 100% en Roraima y Amapá. La mayoría (67%) de esos casos de muertes en migrantes ocurre en personas naturales de Minas Gerais (51%) y Bahia (16%). Los coeficientes de mortalidad en el período en residentes mostraron una disminución mantenida en las regiones Sudeste, Sur y Centro-Oeste, sin embargo, no en las regiones Nordeste y Norte, donde los promedios de edad, por ocasión de la muerte fueron comparativamente más bajos.58
Posteriormente, de 1999 a 2007, la Enfermedad de Chagas ha sido identificada en 53.924 (0,6%) de las declaraciones de muerte del período (aproximadamente 9,0 millones): 44.537 (82,6%) como causa básica y 9.387 (17,4%) como causa asociada.59 La Enfermedad de Chagas aguda ha estado registrada en la declaración en 2,8% de las muertes. El promedio de muertes al año ha sido de 5.992, con un coeficiente medio de mortalidad estandarizado de 3,36/100 mil habitantes/año, verificando una reducción gradual del coeficiente de mortalidad específico en el país de 226,4%. Se destaca la tendencia decreciente del coeficiente de mortalidad estandarizado (237,9%), en especial en la región Centro-Oeste. La mortalidad proporcional (por causas múltiples) ha sido de 0,60%, mayor en la región Centro-Oeste (2,17%), donde se verificó una reducción del 219,5%, con expresiva tendencia decreciente. Mientras tanto, en este estudio, se verificó un considerable incremento de 38,5% en la región Nordeste, con tendencia creciente. Como factores de riesgo identificados en el análisis bivariado, se insertaron grupos etarios de mayores y que residían en la región Centro-Oeste. Ya en el análisis multivariado, edad superior a 30 años y residencia en los estados de Minas Gerais y Goiás, bien como en el Distrito Federal.59 Destacamos que el país ha sido responsable por más de 40% del total de muertes esperadas asociadas a la Enfermedad de Chagas en Latinoamérica.56,59
Otro estudio con la misma base poblacional del trabajo anterior, en Brasil, analizó 53.930 muertes registradas entre 1999 y 2007, en que la Enfermedad de Chagas ha sido mencionada como una de las causas de óbito; cuando analizada como causa básica, esta enfermedad ha sido la cuarta principal causa de muerte (10,8%) entre todas las enfermedades infecciosas y parasitarias.56 De aquel total, 37.800 (84,9%) fueron de muertes relativas a las formas cardíacas y 4.208 (9,4%) a las formas digestivas. En 1.097 (2,5%) de las muertes hubo mención a comprometimiento cardíaco agudo; en 1.157 (2,6%), comprometimiento de otros órganos; y, finalmente, en 281 (0,6%) de otras presentaciones clínicas de la enfermedad (involucramiento del sistema nervioso central y fase aguda sin involucramiento cardíaco). En relación a las causas asociadas de muerte teniendo la Enfermedad de Chagas como causa básica, ha habido predominancia de enfermedades de los sistemas digestivo, circulatorio y respiratorio. Complicaciones directas de la enfermedad cardíaca, en especial disturbios de conducción/arritmias e insuficiencia cardíaca, fueron definidas en más de 35% de las muertes, seguidas por choque (15%). Entre las causas básicas de muerte en que la Enfermedad de Chagas ha sido mencionada como causa asociada, las más comunes fueron las enfermedades de los sistemas circulatorio y respiratorio, con 59% de las muertes, seguidas por neoplasias y enfermedades del sistema digestivo, con 11,6% y 10,6% de las muertes, respectivamente. Se destaca que las enfermedades cerebrovasculares, las enfermedades isquémicas del corazón y las enfermedades hipertensivas fueron las principales causas básicas de muerte cuando la Enfermedad de Chagas ha sido identificada como causa asociada. Enfermedades pulmonares crónicas y enfermedad pulmonar obstructiva crónica particularmente también representaron importantes causas de óbito.56
Estudio adicional a partir de esta misma base de datos, con utilización de diferentes enfoques analíticos espaciales, identificó un clúster (aglomerado) de alto riesgo de mortalidad por enfermedad de Chagas, involucrando a nueve estados de la región Central de Brasil - casi la totalidad de los municipios de los estados de Goiás y de Minas Gerais, Distrito Federal y algunos municipios de los estados de São Paulo, Mato Grosso, Mato Grosso do Sul, Tocantins, Piauí y Bahia. Esta área ha sido indicada por los autores como prioritaria para planificación integrada de las acciones de fortalecimiento de la red de atención volcada a la Enfermedad de Chagas.60
Estudio que analizó estándares y tendencias regionales en Brasil, en serie temporal más extensa (1979-2009), verificó que, de los 27.560.043 casos de muertes analizados, 172.066 muertes tuvieron a la Enfermedad de Chagas como causa básica.57 La mortalidad proporcional de la Enfermedad de Chagas ha sido de 0,62%, con un coeficiente de mortalidad específico bruto de 3,61 muertes/100 mil hab./año y un coeficiente de mortalidad específico ajustado para edad de 5,19 muertes/100 mil hab./año. Sin embargo, en el país, ha habido una apreciable reducción en el período con importantes diferencias interregionales. Ha habido gran reducción en las regiones Sudeste, Sur y Centro-Oeste, pero relevante crecimiento en las regiones Nordeste y Norte.57
Otra serie histórica, en el período de 1980 a 2008, se verificó que la proporción de muertes atribuibles a la Enfermedad de Chagas como causa básica permaneció estable en el período.29
En el Estado de São Paulo, en el período de 1985 a 2006, fueron identificados 40.002 óbitos relacionados a la Enfermedad de Chagas, de los cuales 34.917 (87,3%) como causa básica y 5.085 (12,7%) como causa asociada. El coeficiente de mortalidad según la causa básica ha tenido una disminución de 56,1%, sin embargo, se verificó estabilidad según la causa asociada. El número de muertes ha sido un 44,5% mayor entre los hombres en comparación con las mujeres, y 83,5% de los casos de muertes que ocurrieron en personas con más de 45 años de edad. Se verificó que las principales causas asociadas que tuvieron la Enfermedad de Chagas como causa básica de muerte fueron: complicaciones directas del comprometimiento cardíaco (trastornos de la conducción, arritmias e insuficiencia cardíaca). Para la Enfermedad de Chagas como causa asociada, las causas básicas más importantes fueron las enfermedades isquémicas del corazón, las enfermedades cerebrovasculares y las neoplasias.61
Por otro lado, a partir de la base de datos nacional sobre mortalidad relativa a la Enfermedad de Chagas como causa básica, en el período de 2000 a 2010, se verificó que la mayoría de las muertes (85,9%) ocurrió en personas del sexo masculino con edad superior a 60 años. Estas muertes fueron causadas principalmente por involucramiento cardíaco, siendo que el coeficiente de mortalidad de esta forma clínica de la enfermedad disminuyó en todas las regiones, excepto en la región Norte, donde ha habido un incremento de 1,6%. La región Nordeste ha tenido la menor reducción, mientras que la Centro Oeste, la mayor. Se destaca que el coeficiente de mortalidad relacionado a la forma digestiva aumentó en todas las regiones.62
Se verificó que el estándar de envejecimiento de la población alcanzada por la Enfermedad de Chagas y de ampliación de las edades para edades más elevadas se ha verificado, no solamente por los estudios anteriores de mortalidad, sino también por otros estudios de base poblacional basados en cohortes de casos en seguimiento por largos períodos.63,64
Datos del Ministerio de Salud relativos a casos de muertes por Enfermedad de Chagas aguda indican que, en el período de 2005 a 2013, el coeficiente de letalidad medio anual del país a lo largo de los 14 años ha sido de 2,7% (37,9/14). La elevada letalidad (20,0%) en el año de 2005 coincidió con el brote epidémico de Chagas aguda por transmisión oral en Santa Catarina, momento en que poco se conocía sobre la etiología y el manejo de la enfermedad por esa forma de transmisión. En 2006, la letalidad siguió elevada (5,9%), con posterior reducción, que se ha mantenido relativamente constante en los años subsecuentes (promedio de 1,7% de 2007 a 2013), variando de 0,5% en 2009 a 4,7% en 2011. Se destaca que la falta de oportunidad de sospecha de la enfermedad y la demora en el diagnóstico pueden agravar el cuadro clínico y la evolución de la enfermedad, pudiendo interferir en el pronóstico de los casos, a ejemplo de muertes que ocurrieron por falta de una intervención más oportuna,55 en especial para las formas cardiovasculares.
En términos de la mortalidad asociada a la coinfección T. cruzi/VIH, estudio de aproximadamente 9 millones de casos de muertes, en el período de 1999 a 2007, identificó 74 de muertes relacionadas a la coinfección T. cruzi/VIH - 57 (77,0%) cuya causa básica ha sido el SIDA y 13 de muertes (17,6%) que tuvieron como causa básica la Enfermedad de Chagas.53 Ha habido asociación con sexo masculino (51,4%), color de piel blanco (50%), edades entre 40 y 49 años (29,7%), y residencia en la región Sudeste (75,7%). El promedio de edad en el momento de la muerte ha sido considerablemente menor entre coinfectados (47,1 años) de que entre aquellos sin coinfección (64,1 años).53 Esos datos probablemente indican sub-dimensionamiento del impacto de esa coinfección en la mortalidad.
Perfil epidemiológico según los modos de transmisión
Para años más recientes (Sinan, 2000 a 2013), con la limitación operacional ya indicada previamente, se verificó que la forma de transmisión oral ha sido la más frecuente en todos los años (1.081, 68,9%), seguida por la transmisión vectorial en 100 casos (6,4%).55 A pesar de la menor proporción, probablemente debido a la menor visibilidad de estos casos, se observa la persistencia de esta última forma desde 2006, año en que Brasil ha obtenido la certificación de interrupción de transmisión por Triatoma infestans. De forma comparativa, estimaciones de la OMS con base en datos de 2010 indicaban un total de 46 casos de Enfermedad de Chagas al año en Brasil originarios de transmisión vectorial.5 Estos datos en conjunto refuerzan la probable subestimación de los casos relativos a esta forma de transmisión, tanto nacional como internacionalmente. En 372 (23,7%) casos notificados no ha sido identificada la forma de transmisión, siendo un 93,0% (306 casos) de estos solamente del Estado de Pará. Fueron notificados además 11 (0,7%) casos por otras formas de transmisión (transfusional o accidental), y 6 (0,4%) casos por transmisión vertical.55 En este último modo de transmisión, la subnotificación también es clara.
Este cambio en los estándares epidemiológicos de transmisión de la Enfermedad de Chagas en el país también ha sido generada como resultado de las acciones de control emprendidas hace cuatro décadas, acompañadas por importantes cambios ambientales, demográficos, económicos y sociales, además de la mayor concentración de la población en áreas urbanas.4,15,33,65 De esa forma, mecanismos relacionados directamente al ciclo enzoótico de la infección, como la transmisión vectorial extradomiciliaria o por visitación de vectores silvestres a los domicilios, además de la transmisión oral (mediada también por vectores, en la mayoría de los casos), pasaron a tener relevancia como modos principales de transmisión de T. cruzi a las poblaciones humanas.22,27,65
Transmisión vectorial
Durante los años de 1950 y 1951 ha sido desarrollada la primera Campaña de Profilaxis de la Enfermedad de Chagas en Brasil, conducida por el entonces Servicio Nacional de Malaria, abarcando, con acciones de control vectorial químico, 74 municipios en la divisa de los estados de Minas Gerais y São Paulo. Hasta el año de 1975, las actividades de control fueron conducidas de forma intermitente, con mayor o menor alcance territorial. El área con riesgo de transmisión vectorial para Enfermedad de Chagas en Brasil conocida al final de los años 1970 incluía 18 estados, con más de 2.200 municipios, en los cuales se comprobó la presencia de Triatominos domiciliados. Se destaca que la región Amazónica estaba excluida de esta área de riesgo.4,19,20,22,66
Desde entonces, con la intensificación de las acciones de control, la transmisión vectorial de T. cruzi en Brasil ha presentado una reducción cuantiosa y sistemática. Alcanzó tal resultado a partir del desarrollo de acciones sistematizadas de control químico de poblaciones domiciliadas del vector, instituidas a partir de 1975, con alcance de la cobertura del área endémica en el año de 1983.20,22,66 Esas acciones fueron mantenidas en carácter regular desde entonces, aunque su alcance en las últimas dos décadas haya sido progresivamente menor en virtud de cambios de priorización técnico política, bien como debido al reordenamiento político institucional en el país.20,22
Este proceso, de forma integrada, culminó con la Certificación de la Interrupción de la Transmisión de la Enfermedad de Chagas por el principal vector domiciliado, Triatoma infestans, concedida en 2006 por la OPAS/OMS, dentro de la Iniciativa de los Países del Cono Sur.18,22,39
El control de la transmisión vectorial ha tenido impacto considerable en relación a las transmisiones transfusional y congénita.4,18,29,10,23 Aún con los avances, el riesgo de transmisión vectorial de la Enfermedad de Chagas persiste y ha sido evaluado bajo diferentes perspectivas,22 en función: de la existencia de especies de Triatominos autóctonos con elevado potencial de colonización; de la presencia de reservorios de T. cruzi y de la aproximación cada vez más frecuente de las poblaciones humanas a esos ambientes; y de la persistencia de enfoques residuales de Triatoma infestans, todavía existentes en algunos municipios de los estados de Bahia y de Rio Grande do Sul.22,23,39,67 Los impactos, incluso durante el proceso de certificación obtenida por Brasil en el año de 2006, en relación a Triatoma infestans, ya habían generado preocupación con relación a la desmovilización de la sociedad en general delante el modo impreciso como la información ha sido apropiada y divulgada para la sociedad.68
Además, otros estudios y análisis han buscado profundizar la evaluación sobre procesos operacionales involucrados dentro de las diferentes estrategias de control/eliminación de la transmisión por vectores autóctonos, incluyendo el modelo de certificación y potenciales alternativas.69-72
Datos del Ministerio de Salud relativos a la vigilancia entomológica (pasiva o activa) específica del período de 2007 a 2011 (Boletín Epidemiológico de Enfermedad de Chagas 2015) indican el registro de la captura de más de 770 mil Triatominos en los contextos locales de domicilios y peridomicilios en el país. De la misma forma que para los casos humanos, considerando la baja cobertura de las acciones de vigilancia entomológica, este registro probablemente engloba menos de 10% de los Triatominos dentro o alrededor de las residencias. Todavía, según estos datos del Ministerio de Salud, entre las 62 especies distribuidas en los espacios del intradomicilio y peridomicilio en Brasil, se destacan como especies de relevancia epidemiológica: Panstrongylus geniculatus, Panstrongylus lutzi, Panstrongylus megistus, Rhodnius nasutus, Rhodnius neglectus, Rhodnius robustus, Rhodnius pictipes, Triatoma infestans, Triatoma brasiliensis, Triatoma maculata, Triatoma pseudomaculata, Triatoma rubrovaria, Triatoma rubrofasciata, Triatoma sordida y Triatoma vitticeps.
Del total de Triatominos capturados, según los datos del Boletín Epidemiológico del Ministerio de Salud sobre enfermedad de Chagas, fueron examinados con relación a la identificación de la infección por T. cruzi, 591.360 (76,8%) de los Triatominos capturados resultando en una tasa de infección natural un total de 2,7% (15.967 Triatominos). Las especies Triatoma vitticeps (52,0%), Rhodnius robustus (33,3%) y Panstrongylus lutzi (29,4%) fueron las que presentaron las mayores tasas de infección natural. Triatoma vitticeps se presenta con mayor frecuencia en los estados de la región Sudeste (Minas Gerais y Espírito Santo), Rhodnius robustus tiene su área de mayor registro según los datos del Ministerio de Salud en la región Norte (Tocantins, Amazonas, Acre y Rondônia), y Panstrongylus lutzi en la región Nordeste (Piauí, Bahia, Sergipe, Alagoas, Paraíba, Rio Grande do Norte, Ceará y Pernambuco).55 En 2012, la investigación de dos casos de Enfermedad de Chagas aguda registrados por transmisión vectorial evidenció el involucramiento de especies silvestres con elevadas tasas de infección natural en municipios que eran considerados no endémicos para Enfermedad de Chagas. Uno de los casos ocurrió en el municipio de Ibitirama (Espírito Santo), donde frecuentemente ejemplares de Triatoma vitticeps adultos infectados son encontrados por habitantes, y otro caso en Mangaratiba (Rio de Janeiro), involucrando Triatoma tibiamaculata encontrado infectado por T. cruzi. Esos episodios reflejan una realidad extendida para todo el país - la existencia de ciclos de transmisión del parásito en ambientes silvestres cercanos a las habitaciones humanas -, lo que favorece la transmisión.55
Para ese período de 2007 a 2011, se identificó, además, la persistencia de focos de Triatoma infestans en cuatro municipios del Estado de Bahia (Itaguaçu da Bahia, Ibipeba, Novo Horizonte y Tremedal) y en 12 municipios de Rio Grande do Sul (Ajuricaba, Alegria, Coronel Barros, Doctor Maurício Cardoso, Giruá, Humaitá, Ijuí, Independencia, Porto Mauá, Salvador das Missões, Santo Cristo y São José do Inhacorá).55 Acciones integradas de control vectorial movilizando gobiernos Federal, Estaduales y Municipales están avanzando en dirección al control de este triatomino.
Actualmente el riesgo relacionado a la transmisión de T. cruzi en Brasil depende principalmente: (i) de la persistencia de focos residuales de Triatoma infestans, con hallazgo episódico en algunos estados, como Bahia y Rio Grande do Sul; (ii) de la existencia de gran número de especies comprobadamente autóctonas o potencialmente vectoras en el país, aunque en algunos casos, poblaciones domiciliadas hayan sido bastante reducidas; (iii) de la emergencia de “nuevas” especies con riesgo de domiciliación (Triatoma rubrovaria, Panstrongylus lutzi); (iv) de la existencia de transmisión en carácter endémico en la región Amazónica, con mecanismos todavía mal caracterizados de transmisión como vectorial domiciliaria sin colonización, vectorial extradomiciliaria y oral; y (v) de la ocurrencia de brotes epidémicos o microepidemias de transmisión oral de T. cruzi.20,33,65,67
La importante alteración en el cuadro epidemiológico de la enfermedad en el país ha generado la necesidad de revisión dinámica de las estrategias de control adoptadas.4,20,23,33,65,67 En esta perspectiva, la identificación de áreas con mayor vulnerabilidad para la aparición de Triatominos sinantrópicos ha sido una herramienta importante para reorientar acciones de prevención, control y vigilancia epidemiológica,39,67 inclusive por la necesidad de optimizar el uso de los recursos disponibles de los programas.20
Por otro lado, la estratificación del riesgo asociado a la transmisión vectorial ha sido propuesta como estrategia importante para la orientación y el mantenimiento de las acciones de control en el país y ha sido incorporada, en diferentes perspectivas, por los programas de control de estados y municipios.4,20,22,39,65
Esta estratificación está basada en tres diferentes escenarios o espacios ecoepidemiológicos de la transmisión vectorial de T. cruzi:22
un área, a principio, considerada endémica con transmisión vectorial domiciliaria registrada y que ha sido sometida por un extenso periodo a intensas operaciones de control químico, lo que resultó en la casi completa eliminación del principal vector existente en el país (Triatoma infestans), siendo el riesgo limitado actualmente a la transmisión más o menos focal, principalmente por especies nativas, abarcando los estados de Alagoas, Bahia, Ceará, Goiás, Mato Grosso do Sul, Minas Gerais, Paraíba, Pernambuco, Paraná, Piauí, Rio Grande do Norte, Rio Grande do Sul, São Paulo y Sergipe, bien como el Distrito Federal;
la región que abarca los estados de Acre, Amazonas, Amapá, Rondônia, Roraima y Pará, antes considerada “indemne” para la Enfermedad de Chagas humana, que se sabe hoy con transmisión, por medio de mecanismos antes considerados extraordinarios o improbables, todavía mal caracterizados, pero capaces de mantener transmisión endémica de intensidad relativamente baja para sostener la transmisión endémica (oral, extradomiciliaria y domiciliaria sin colonización vectorial);
un área de transición entre los dos escenarios anteriores, en la cual coexisten ambos, que engloba los estados del Maranhão, Mato Grosso y Tocantins.
Como discutido previamente, los estados de Santa Catarina, Rio de Janeiro y Espírito Santo, a pesar de no estar encuadrados en la propuesta de estratificación anterior de riesgo, teniendo en vista los estándares históricos observados a partir de la vigilancia entomológica de estados, han registrado casos autóctonos de Enfermedad de Chagas.39,55,73-77
La evaluación y la monitorización sistemáticas de este proceso deben incorporar la posibilidad de colonización en la Amazonía y en otras frentes agropecuarias (creación de gado extensivo, plantación de soja, entre otros) en curso en el país por vectores domiciliados y con importancia epidemiológica en las áreas de migración humana.22,65
La gran diversidad de situaciones de transmisión vectorial de T. cruzi inherentes a los escenarios o espacios ecoepidemiológicos arriba engloban:22,65 (i) el riesgo remoto de su restablecimiento por especie alóctona, como Triatoma infestans; (ii) la transmisión focalizada por especies nativas sabidamente vectoras, como Panstrongylus megistus, Triatoma brasiliensis y, menos probablemente, por Triatoma pseudomaculata y Triatoma sordida; (iii) la domiciliación de algunas especies nombradas clásicamente como exclusivamente silvestres, y el riesgo de que pasen a actuar como vectoras en algunas áreas, como es el caso de Triatoma rubrovaria en el Estado del Rio Grande do Sul y de Panstrongylus lutzi en estados de la región Nordeste; y (iv) la posibilidad de ocurrencia de transmisión extradomiciliaria o por visitación (forma básica de generación de brotes epidémicos por transmisión oral, por lo menos en áreas rurales) de Triatominos a las casas, como ya ha sido observado con Rhodnius brethesi, en la región del Alto Rio Negro, en el Estado de Amazonas, y con Rhodnius pictipes en el Estado de Tocantins.
Delante de los escenarios de coexistencia de áreas con diferentes grados de riesgo, las acciones de vigilancia y control vectorial deben estar ajustadas teniendo como base el riesgo establecido.22,65 Además de considerar la capacidad operacional de municipios, la estratificación de la extensa área tradicionalmente endémica está basada en un conjunto de variables que potencialmente influyen en el proceso de infestación y/o de reinfestación y, de esta manera, de transmisión o de reinstalación de la transmisión vectorial de la Enfermedad de Chagas en el ambiente domiciliar.22
El análisis de impacto ambiental y del riesgo potencial de intensificación de la transmisión de T. cruzi debe incluir necesariamente el estudio de reservorios.15,39,78,79
Se reconoce que el proceso de simplificación de la fauna es resultado de la ocupación no planificada del ambiente y tiene como consecuencias potenciales: (i) menor diversidad de oferta de fuente alimentaria para Triatominos en los diferentes hábitats; (ii) mayor tendencia de desplazamiento de Triatominos en búsqueda de alimento (hematofagia) de sus hábitats originales, para alimentarse en especies más eclécticas de mamíferos que permanecieron y se expandieron numéricamente; (iii) las poblaciones del parásito también serán expandidas a partir de estas especies de mamíferos con este eclecticismo ambiental, en general excelentes reservorios de T. cruzi.21,80 Como estos animales (como marsupiales y algunos roedores) tienen un elevado grado de sinantropización, el riesgo epidemiológico se vuelve claro.78,80
T. cruzi es un parásito flagelado multihospedero capaz de infectar a decenas de especies de mamíferos silvestres y domésticos distribuidos en todas las regiones fitogeográficas de Brasil; se encuentra en los más diversos nichos ecológicos, contribuyendo, en cada tipo de biotopo, para formar modalidades singulares de focos naturales de transmisión.21,23,27,39,78,80
La integración de los reservorios en el proceso de vigilancia de rutina debe ser considerada teniendo en vista que animales domésticos no confinados también pueden actuar como eslabón entre los circuitos de transmisión silvestre y domiciliaria.80,81 Análogamente a lo que pasa con los mamíferos silvestres, la importancia de los animales domésticos (por ejemplo, perros y gatos) como reservorios de T. cruzi varía en los diferentes locales, y pueden ser utilizados como población centinela de la transmisión de T. cruzi en una determinada área.21,81 En general, están siempre expuestos y su infección normalmente precede a la del hombre.78 Por lo tanto, la presencia de animales domésticos infectados por T. cruzi en una determinada área destaca que la transmisión está ocurriendo en las áreas donde esos animales circulan, lo que refuerza la necesidad de ampliar las acciones de control.21
El proceso de investigación entomológica y de reservorios debe estar asociado a acciones sostenidas de vigilancia ambiental.39 Por lo tanto, la comprensión de los procesos de selección de hábitat por los Triatominos es fundamental para la construcción de evidencias epidemiológicas, con vistas a la planificación y al desarrollo de sistemas locales de vigilancia epidemiológica y control, reforzando, por lo tanto, el papel de la vigilancia.22,39,82 No obstante, las fallas operacionales evidenciadas en la detección de vectores pueden generar errores críticos de clasificación y, por lo tanto, impedir el alcance de las acciones, dificultando la composición de escenarios y dinámicas de estos insectos en sus hábitats.70,71,82
Partiendo del principio de que ninguna técnica de muestreo es “perfecta”, algunos estudios han introducido en Brasil la aplicación de métodos que incorporan explícitamente las fallas en la detección de focos de infestación en la investigación de la ecología y en la vigilancia de los vectores de la Enfermedad de Chagas en diferentes ambientes, incluyendo la Amazonía y la región Nordeste.70,71,82 Este enfoque ha posibilitado y posibilitará cada vez más, en el futuro, la mejoría de las estimaciones de indicadores ecoepidemiológicos y podrá reforzar, significativamente, las estrategias de vigilancia y control integrados de vectores.70,71,83,84 Las fallas fueron verificadas en áreas con infestación triatomínica bien establecida, en las cuales las búsquedas activas por agentes entrenados y motivados generalmente detectan aproximadamente de 40 a 60% de los focos de infestación intradomiciliaria y extradomiciliaria mientras los focos no detectados no son eliminados.70 Además de esto, a partir del análisis del proceso de vigilancia por medio de la búsqueda activa conducida por agentes de control, se estimó su sensibilidad en aproximadamente 20% para localidades con infestación de baja intensidad (pocos focos, con pocos Triatominos) y en aproximadamente 40% para localidades con infestación más intensa.71
Adicionalmente a este enfoque, la utilización integrada de técnicas de análisis espacial para ampliar la capacidad analítica, con inserción de las dimensiones espaciales y temporales de la transmisión de la enfermedad de Chagas, está demostrando gran potencialidad, en especial por el expresivo desarrollo de equipos electrónicos portátiles y softwares de procesamiento y análisis de datos.70,85-87
En las últimas dos décadas, fueron publicados estudios con descripción de diferentes grados de resistencia de las poblaciones de Triatominos a insecticidas.88 No obstante, se desconocen los reales factores detrás de la emergencia de estos fenotipos y el impacto que esta situación traerá al desarrollo de las estrategias estandarizadas para control de vectores.89,90 Este nuevo contexto demandará de los países endémicos la composición de redes de cooperación entre laboratorios para la realización de análisis de resistencia en poblaciones de Triatominos de forma estandarizada, integrando esta actividad en el proceso de vigilancia epidemiológica de los países endémicos.88
Transmisión oral
Con el control de la transmisión vectorial de la Enfermedad de Chagas en Brasil por su principal vector, T. infestans, la transmisión oral de T. cruzi viene ampliando su relevancia epidemiológica, en especial en los contextos de la región Amazónica.11,23,39,76,91,92
La transmisión por vía oral es considerada como mecanismo primario, en especial en el ciclo silvestre,93 y seguirá ocurriendo independientemente de las acciones de control emprendidas.21,39 Presenta carácter habitual en el ciclo enzoótico primitivo de este parásito, a través de la ingestión - por mamíferos susceptibles - de vectores y reservorios infectados.21 en el caso del hombre, esta transmisión ocurre de manera esporádica y circunstancial, por medio de alimentos contaminados con el parásito, principalmente a partir de Triatominos o de sus heces, con registros desde la década de 1960.93 Por lo tanto, el análisis de este contexto epidemiológico remite indirectamente a los vectores.
En Brasil, en relación al contexto epidemiológico de los eventos de Enfermedad de Chagas aguda por transmisión oral, la mayor parte de los casos ha sido relatada en la Amazonía en brotes epidémicos de contextos familiares o multifamiliares.11,23,91,92 En la Región Extra -amazónica pocos eventos fueron bien investigados, en general relacionados a la caña de azúcar, el probable alimento conductor en la transmisión de estos casos.76,93
Revisión reciente sobre el tema identificó registros de brotes epidémicos o microepidemias en Brasil, en los estados del Rio Grande do Sul, Pará, Paraíba, Santa Catarina, Bahia y Ceará. Otros países con registros incluían Venezuela y Colombia.76
El Ministerio de Salud de Brasil contabilizó 112 brotes epidémicos en el territorio nacional entre 2005 y 2013, involucrando en su totalidad a 35 municipios de la región Amazónica. La fuente probable de infección ha sido la ingestión de alimentos contaminados con T. cruzi, entre ellos: huasaí, milpesillo, jaci (coquinho), jugo de caña de azúcar y babasú. La mayoría de los brotes epidémicos ocurrió en los estados de Pará, 75,9% (85 brotes epidémicos) y Amapá, 12,5% (14 brotes epidémicos) y, en menor proporción, en los estados de Amazonas, 4,5% (5 brotes epidémicos), Tocantins, 1,8% (2 brotes epidémicos) y Bahia, 1,8% (2 brotes epidémicos).55
El proceso de vigilancia de la Enfermedad de Chagas aguda por transmisión oral principalmente pasó a ser potenciado con incremento de la sensibilidad del sistema de vigilancia, a partir del primer brote epidémico oficialmente investigado de Enfermedad de Chagas aguda en Brasil por transmisión oral, ocurrido en Santa Catarina en 2005, probablemente vinculado a la ingestión de jugo de caña contaminado con T. cruzi.55 Entre los casos de transmisión oral de 2007 a 2013, se destaca que más de 50% presentó inicio de síntomas entre los meses de agosto y noviembre, período que coincide con los meses de zafra del huasaí en Pará.55
Las evidencias experimentales disponibles sugieren que la transmisión oral puede ocurrir a partir de formas tripomastigotes, epimastigotes de T. cruzi y, probablemente, de amastigotes y masas celulares, originarias de mamíferos o vectores contaminados, así como, accidentalmente, por medio de cultivos artificiales del parásito.21,23,94 A depender del dominio del gran grupo o linaje de T. cruzi transmitido, bien como del inóculo en cuestión, se verifica diversidad de patogenicidad, histiotropismo y morbilidad y mortalidad.21
En relación al mecanismo de transmisión oral de T. cruzi, fueron identificadas como situaciones posibles para exposición:21,39,93,94
ingestión de heces u orina de Triatominos o todavía de Triatominos infectados, en la hipótesis de que sean procesados o beneficiados junto con alimentos, como verificado en episodios investigados en los que se atribuyó la infección al consumo de huasaí, fruto típico de la región Amazónica brasileña;92
ingestión de alimentos o bebidas contaminados con formas tripomastigotes metacíclicas presentes en la secreción de la glándula anal o en la orina de marsupiales del género Didelphis infectados;
ingestión de suspensión de T. cruzi en pipetas en contextos de laboratorios de investigación o diagnósticos;
ingestión de leche materna de madre con diagnóstico de Enfermedad de Chagas aguda o de coinfección T. cruzi-VIH en fase avanzada de SIDA o con reactivación documentada de la Enfermedad de Chagas, o en situaciones de sangrado por fisuras.
Y como situaciones en especulación de posibilidad para exposición:21,39,93,94
ingestión de carne cruda o mal cocida o aún, de sangre de mamíferos infectados, especialmente silvestres;
consumo de sangre de animales infectados, que tendría una función terapéutica, según algunos grupos indígenas en la región Amazónica. Este hecho ha sido reportado en Colombia, donde se observa, en algunas regiones, la ingestión de sangre de armadillos y zorrillos; contaminación de utensilios utilizados en la manipulación de carcasas de mamíferos infectados;
ingestión de Triatominos por hábitos primitivos o exóticos.
Se destaca que las heces de Triatominos infectados pueden permanecer durante algunas horas con potencial infectante en ambientes con elevada humedad. De esta manera, pueden contaminar potencialmente tanto alimentos como patas y aparato bucal de los portadores secundarios, como moscas y cucarachas. En alimentos como leche o jugo de caña, a temperatura ambiente, el parásito se mantuvo viable por 24 horas o más en estudios experimentales. A pesar de que el jugo gástrico tiene capacidad para destruir parte considerable de los parásitos, otra parte es capaz de evadir esta acción, mediante mecanismos químicos de protección externa, lo que posibilita su penetración a través de la mucosa intestinal.21,92
La transmisión oral, generalmente, está asociada a brotes epidémicos, sin embargo, también puede ocurrir en casos aislados.21,39 Se pueden identificar dos perfiles principales de brotes epidémicos, de acuerdo con el local: urbanos y rurales. En el caso de los brotes epidémicos urbanos, resulta del consumo de huasaí semi industrializado y comercializado, reflejando un tema de vigilancia sanitaria, asociada a la seguridad alimentaria y a las buenas prácticas de manipulación de alimentos, con alcance más amplio. Ya en los brotes epidémicos rurales, se verifica la participación de varios tipos de alimentos elaborados artesanalmente, con acometimiento local, en general familiar o de personas de la red social/comunitaria de una determinada familia.
Dentro del proceso de investigación, se recomienda: realizar un recordatorio alimentario para identificar la posibilidad de ingestión de alimentos sospechosos, identificar procedencia, local de preparación y de consumo del alimento sospechoso y hacer un listado con todas las personas que puedan haber ingerido el alimento sospechoso.21,39,92 El enfoque de las acciones de vigilancia y control debe incluir, por lo tanto, la cadena productiva, con base en las buenas prácticas de manipulación de los alimentos.21,39
Transmisión por transfusión de sangre y trasplante de tejidos/órganos
La transmisión de T. cruzi en transfusiones de sangre se ha amplificado por el proceso de urbanización de la Enfermedad de Chagas en Brasil y en otros países endémicos en Latinoamérica.3,4,10,95,96 El riesgo de transmisión vía transfusional depende de diferentes factores: (i) presencia del parásito en la sangre o componente transfundido; (ii) tipo y número de producto sanguíneo infectado transfundido; (iii) estado inmunológico del receptor; (iv) calidad en las selecciones clínico-epidemiológicas; (v) nivel de cobertura de la selección serológica de los donantes; y (vi) sensibilidad de las pruebas serológicas empleadas en el proceso de selección de los candidatos a la donación.4,23,95,96
Puesto que la mayoría de los candidatos a la donación de sangre está, generalmente, concentrada en las franja de edad entre 18 y 35 años - el menor número de candidatos potencialmente infectados con T. cruzi -, y que se estableció en los últimos años, la obligatoriedad de la selección clínica-epidemiológica y serológica en la mayoría de los países endémicos, se registró una gran reducción en el riesgo de la transmisión transfusional de la Enfermedad de Chagas en toda Latinoamérica.4,23,95,96 En Brasil, en los años 1950, la prevalencia promedio estimada de serología reactiva para T. cruzi entre candidatos a donación de sangre era de 8,3%, en los años 1960 y 1970 redujo para 6,9% y, al final de los años 1980 e inicio de 1990, alcanzó el 3,2%.96 La prevalencia estimada de la Enfermedad de Chagas por transfusión de sangre en candidatos a donación de sangre en la red pública de hemocentros de las diferentes regiones geográficas del país, a partir de un informe del Ministerio de Salud de enero a junio de 1994, ha sido estimada en 0,75%.95 En 2006, para Brasil esta estimación quedó en 0,21%, una reducción de más de 95% en relación a los datos previos.17 Datos más recientes de la OMS, con base en el año de 2010, estimaron en 0,18% esta prevalencia en el país.5
Brasil ha avanzado no solamente en la búsqueda de la seguridad transfusional, sino también en el proceso de hemovigilancia, con la institución de un sistema nacional integrando hemocentros, vigilancia epidemiológica y vigilancia sanitaria.97,98 Con esto, se cualifica la investigación de los raros, sin embargo posibles, casos de Enfermedad de Chagas transmitidos por la sangre, asociados al riesgo residual transfusional y de eventuales fallas dentro del proceso. De la misma manera, para situaciones asociadas a la selección de candidatos a la donación de tejidos u órganos. Para tal, se aumenta la inspección sanitaria en servicios de hemoterapia y de trasplante (hospitales o hemocentros), comunicación y acción integrada con la hemovigilancia,97,98 sin olvidar que la transmisión transfusional solamente podrá ser definida caso la persona haya recibido sangre o algún otro hemocomponente 120 días antes del inicio de los síntomas.97
Esta tendencia de reducción del riesgo de transmisión a partir de transfusiones de sangre ha disminuido también en otros países endémicos, en mayor o menor grado. Para los países no endémicos, en la última década, varias estrategias están siendo adoptadas para prevención y control de la transmisión transfusional de la Enfermedad de Chagas. Naciones como Estados Unidos, Canadá, España, Francia, Reino Unido, Suiza y Australia, por ejemplo, ya introdujeron estrategias de triaje serológico (universal o selectivo) en el proceso de selección de candidatos a donación de sangre.99
En el caso de trasplante de órganos, deben ser considerados los estándares de endemicidad de las áreas de origen y residencia, tanto de donantes como de receptores, en el sentido de delinear la mejor conducta posible para cada caso en términos del triaje y del manejo de eventual infección por T. cruzi.100
Transmisión Vertical (Congénita)
La transmisión vertical de la Enfermedad de Chagas aún presenta en Brasil relativa importancia, a pesar de la ausencia de acciones sistemáticas de prevención de esta modalidad en el país. Para evaluar su impacto y también las acciones del control vectorial, en el período de 2001 a 2008 ha sido conducida nueva investigación serológica nacional, ahora teniendo como población de referencia a 105 mil niños de 0 a 5 años.101 La prevalencia estimada ha sido de 0,03% (32 casos) niños infectados por T. cruzi. De este total, 20 (0,02%) presentaban positividad materna concomitante, sugiriendo la transmisión congénita (oriundas de los estados de Rio Grande do Sul [12], Minas Gerais [3], Paraná [1], Pernambuco [1], Alagoas [1], Bahia [1] y Acre [1]), y 11 (0,01%) registraron positividad solamente en el niño, indicando probable transmisión vectorial (oriundas de los estados de Piauí [2], Ceará [2], Rio Grande do Norte [1], Paraíba [2] y Alagoas [2], Amazonas [1] y Paraná [1]). Este estudio representa el primero a identificar diferencias regionales en la transmisión congénita de la Enfermedad de Chagas en Brasil, posiblemente relacionada a la existencia de T. cruzi TcV y TcVI.101 Además, señala la inexistencia de transmisión de Enfermedad de Chagas por vía vectorial domiciliaria mantenida en el país.39,101
Los datos oficiales del Ministerio de Salud relativos a la vigilancia epidemiológica por medio de la notificación de casos de Enfermedad de Chagas aguda indican consistencia con los hallazgos de la investigación antes citada: 50% de las notificaciones de esta forma de transmisión fueron identificadas en el Estado de Rio Grande do Sul.55
La estimación global de la prevalencia102-104 de la infección por T. cruzi en mujeres embarazadas ha variado de 1 a 40%, siendo que aproximadamente 1,8 millón de mujeres en edad fértil estaba infectada en Latinoamérica.17 Datos más actuales de la OMS estiman este número en 1.124.930 mujeres entre 15 y 44 años con infección por T. cruzi.5 Metaanálisis reciente estimó el riesgo global de infección congénita por T. cruzi en niños nacidos de madres infectadas en 5%, variando de 0 a 28,6%.105 En Latinoamérica fueron estimados más de 15 mil casos de Enfermedad de Chagas congénita al año,17 con análisis más recientes indicando una estimación de 8.668 niños infectados por transmisión vertical.5
Por otro lado, en áreas no endémicas, es todavía más limitada la disponibilidad de evidencias sobre estimaciones de incidencia.5,17,104 En América del Norte, por ejemplo, la estimación es de 2 mil casos de Enfermedad de Chagas congénita por año.45
Una revisión sistemática con metaanálisis de estudios conducidos en Brasil estimó la prevalencia de infección en mujeres embarazadas como siendo de 1,1%, con una tasa de transmisión vertical de 1,7%.106 Considerando que en Brasil, según datos del Sistema de Informaciones sobre Nacidos Vivos (Sinasc), se registraron 2.861.868 nacidos vivos en 2010, se estimó a partir de estos datos, que habría este año 34.629 mujeres embarazadas infectadas por T. cruzi y que el número de niños con infección congénita variaba de 312 a 1.073 (promedio: 589 casos).106 Estos datos fueron consistentes con la investigación epidemiológica realizada en el estado de Minas Gerais en 1998, extendido a la población brasileña,107 bien como con la estimación global de la OMS de 571 niños brasileños infectados por transmisión vertical en 2010.5 Las estimaciones de la OPAS para el país, en 2006, indicaban 5 mil niños brasileños infectados.17 Considerando la reducción progresiva de la tasa de fecundidad en Brasil, se estima que, a lo largo de las próximas décadas, la transmisión vertical presente tiende a una reducción todavía más sustancial, con posible eliminación como problema de salud pública en el país en los próximos 10 a 20 años.
Un estudio retrospectivo reciente, a partir del hospital de referencia de la Universidad Federal de Goiás (UFG), al analizar a 1.211 individuos nacidos de madres reconocidamente infectadas por T. cruzi, identificó una tasa de transmisión vertical de 2%, consistente con las estimaciones anteriores, y se sugiere que la presencia de TcII en el área estudiada pueda estar asociada a una menor transmisión, cuando comparada a TcV, que predomina en regiones el Sur de Brasil y en otras naciones del Cono Sur, donde las tasas de transmisión vertical son reconocidamente mayores.108 Con relación a las evidencias científicas existentes, importantes lagunas persisten en términos del papel de la diversidad genética de T. cruzi en relación a la evolución de la fase crónica de la enfermedad, al riesgo de transmisión congénita o de reactivación, bien como a la aparición de brotes epidémicos de transmisión por vía oral.27
En Brasil, la Enfermedad de Chagas congénita es considerada aguda y, por lo tanto, de notificación obligatoria.20,39 Sin embargo, no se ha establecido en el país vigilancia de la Enfermedad de Chagas específica en mujeres embarazadas o en niños expuestos/infectados.
Por otro lado, se reconoce que el tratamiento anti T. cruzi en mujeres infectadas en edad fértil, que no están embarazadas, puede representar una estrategia efectiva para reducir la transmisión vertical en futuros embarazos.41,109 Se destaca que la transmisión vertical puede ser repetida a cada embarazo, durante todo el período fértil de la vida de una mujer.104
Transmisión Accidental
Hay registros de accidentes en diferentes contextos: laboratorios de Triatominos, acciones de captura del vector en áreas endémicas, trabajos experimentales con mamíferos infectados y culturas, aerosoles de materiales infectados, infección quirúrgica y recolección de sangre a partir de personas con infección aguda - en esos casos, deficiencias de seguridad en el transporte de materiales contaminados -, entre otros.93 Los factores de riesgo pasan por desconocimiento, la desatención, la falta o el mal uso de equipos de protección individual, instalaciones y equipos inadecuados, iluminación deficiente, falta de capacitación, la no observancia de medidas de precaución estandarizada, la no adopción de protocolos técnicos en la rutina, entre otros.93,110
El proceso de vigilancia y control debe incluir, necesariamente, el desarrollo de acciones de educación permanente en salud y supervisión, con verificación de la utilización apropiada de equipos de protección individual y, caso esté aplicada, la comunicación de accidente de trabajo dentro de los procesos demarcados de vigilancia a la salud del trabajador.39,93,110
Vigilancia Epidemiológica
La vigilancia epidemiológica representa un conjunto de acciones estratégicas que proporcionan el conocimiento, la detección o prevención de cualquier cambio en los factores determinantes y condicionantes de salud individual o colectiva, con la finalidad de recomendar y adoptar las medidas de prevención y control de las enfermedades y agravamientos.39 En el caso de la Enfermedad de Chagas, engloba acciones necesariamente integradas que involucran el abordaje de casos humanos, de vectores y reservorios, con una interfaz estrecha con la red de atención a la salud, con destaque a la atención básica o de atención primaria a la salud.4,15 A seguir están sistematizados los principales elementos en Brasil para el desarrollo del proceso de vigilancia de casos en humanos y de vigilancia entomológica, destacando que varias cuestiones propias de este proceso ya han sido presentadas y discutidas previamente.
Vigilancia de Casos de Enfermedad de Chagas
Las acciones de vigilancia epidemiológica de la Enfermedad de Chagas en Brasil tienen los siguientes objetivos principales:20,39
detectar precozmente casos de Enfermedad de Chagas aguda, con vistas al tratamiento oportuno de los casos diagnosticados, bien como a la aplicación de medidas de prevención de aparición de nuevos casos;
proceder a la investigación epidemiológica de todos los casos agudos, con el objetivo de identificar la forma de transmisión y, consecuentemente, adoptar medidas adecuadas de control;
monitorizar la infección por T. cruzi en la población humana, por medio de investigaciones serológicas regulares en poblaciones estratégicas, bien como a través del análisis nacional del proceso de selección de candidatos a la donación de sangre en hemocentros;
monitoreo del perfil de morbilidad y mortalidad de la Enfermedad de Chagas en el país, delineando escenarios para el fortalecimiento de la red de atención a la salud de las personas infectadas;
mantener eliminada la transmisión vectorial por T. infestans y bajo motorización/control a las otras especies importantes en la transmisión humana de la enfermedad; e
incorporar acciones de vigilancia sanitaria, ambiental, de vectores y reservorios de forma integrada con las acciones de vigilancia epidemiológica.
El cambio de los estándares epidemiológicos de la enfermedad en el país demandó la necesidad de estructurar la Vigilancia Epidemiológica de Chagas en la región Norte en virtud de la transmisión oral, y una interfaz estrecha con la Vigilancia Sanitaria con la finalidad de mejorar las acciones de prevención y control, además de la definición de flujos de referencia para el diagnóstico, tratamiento y acompañamiento de complicaciones de la enfermedad. El elevado porcentual de casos de forma de transmisión ignorada en la base de datos del Ministerio de Salud sugiere la fragilidad del proceso de vigilancia e indica la necesidad de mejorías en la oportunidad de las acciones de vigilancia en lo que se trata de la detección e investigación de casos sospechosos.55 Refuerza la necesidad de cualificación de las acciones de vigilancia en salud en el SUS, potenciadas por medio de acciones de educación permanente, monitoreo y evaluación junto a los equipos de salud.
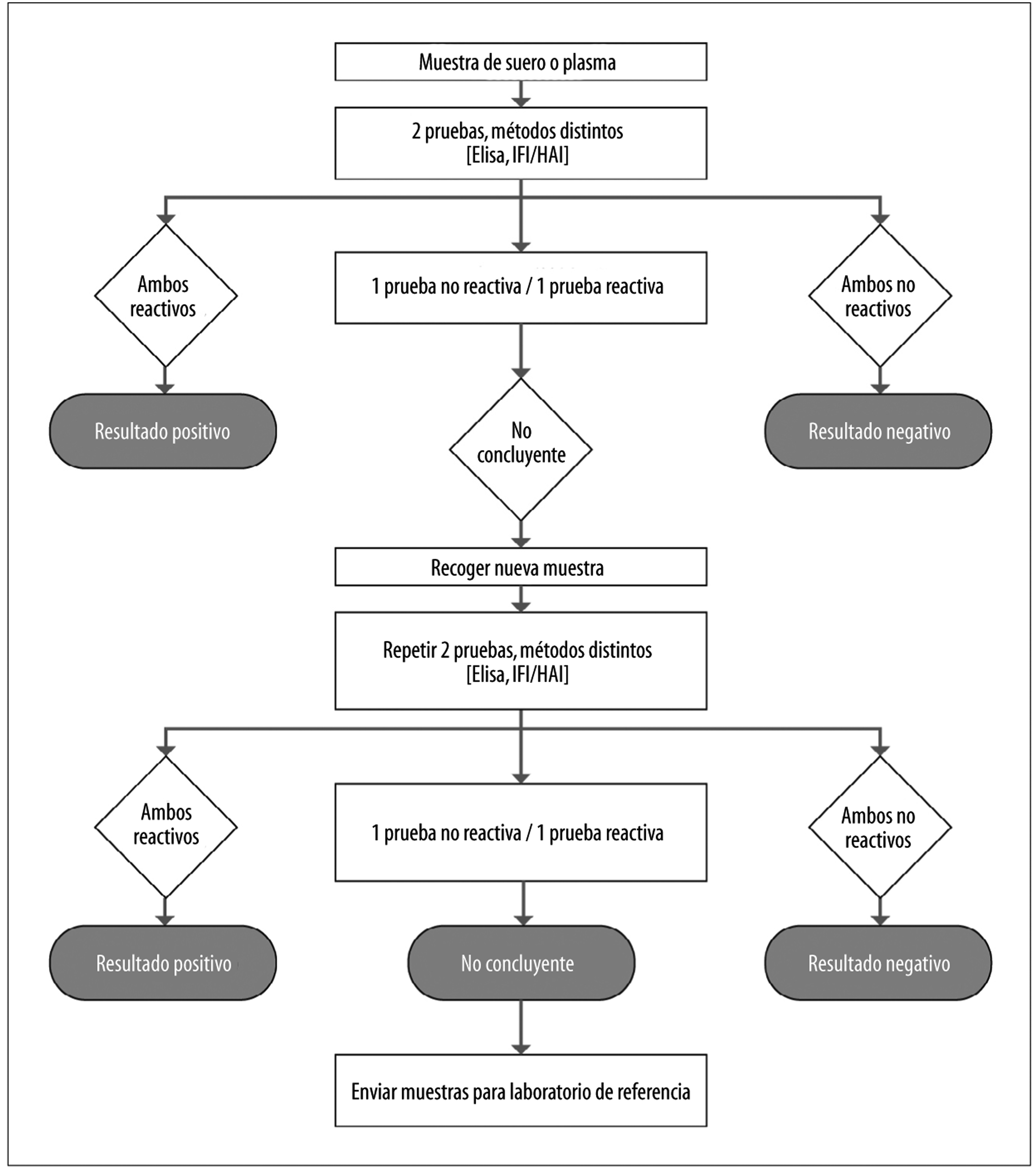
La aparición de casos sospechosos de Enfermedad de Chagas aguda en Brasil requiere inmediata notificación (hasta 24 horas después de la sospecha), en instrumento específico: la Ficha de Investigación de Enfermedad de Chagas Aguda estandarizada en todo el territorio nacional. Para fines de vigilancia epidemiológica, se establecen las definiciones de caso a seguir especificadas.39
1- Caso sospechoso de Enfermedad de Chagas aguda
• Persona con fiebre persistente (por más de 7 días) con una o más de las siguientes manifestaciones clínicas: edema facial o de miembros, exantema, adenomegalia, hepatomegalia, esplenomegalia, cardiopatía aguda (taquicardia, señales de insuficiencia cardíaca), manifestaciones hemorrágicas, ictericia, señal de Romaña, chagoma de inoculación, o que:
- haya tenido contacto directo con triatominae o sus excretos; o
- haya recibido sangre/hemocomponentes o trasplante de células/tejidos/órganos contaminados por T. cruzi; o
- haya ingerido alimento sospechoso contaminado por T. cruzi; o
- sea recién nacido, de madre infectada.
2- Caso confirmado de Enfermedad de Chagas aguda
Criterio de Laboratorio
Parasitológico - T. cruzi circulante en la sangre periférica identificado por medio de análisis parasitológico directo.
Serológico - caso sospechoso con serología reactiva con anticuerpos de la clase IgM anti T. cruzi por IFI; o serología reactiva con anticuerpos de la clase IgG anti T. cruzi por IFI, con alteración en la concentración de IgG de por lo menos 2 títulos en un intervalo mínimo de 21 días en muestras preferentemente pareadas; o seroconversión por cualquier uno de los métodos (ELISA, HAI o IFI).
Criterio clínico epidemiológico
Los casos de Enfermedad de Chagas aguda deben ser confirmados siempre por diagnóstico de laboratorio. Solamente en situaciones eventuales, se puede adoptar un criterio clínico epidemiológico para casos sospechosos con los análisis parasitológicos negativos y serológicos inicialmente no reactivos, y que puedan tener vínculo epidemiológico con casos confirmados de Enfermedad de Chagas aguda por criterio de laboratorio, durante brote epidémico de enfermedad en la fase aguda por transmisión oral.
3- Caso descartado de Enfermedad de Chagas aguda
Caso sospechoso, con resultado de análisis de laboratorio negativos o no reactivos, o que tenga otra enfermedad con diagnóstico. En función de la poca expresión clínica presentada en muchos casos en la fase aguda y del largo y silencioso curso de la enfermedad, el caso notificado puede ser descartado como caso crónico o por reactivación de la enfermedad.
4- Definición de caso según probables formas de transmisión en Brasil
Se reservan para confirmación de casos de Enfermedad de Chagas aguda particularidades según la probable forma de transmisión.
Caso confirmado de Enfermedad de Chagas por transmisión oral
Caso en el que se excluyeron otras vías de transmisión y con evidencia epidemiológica de un alimento como fuente común de transmisión, y habitualmente, la aparición simultánea de más de un caso con vinculación epidemiológica (procedencia, hábitos y elementos culturales).
Caso confirmado de Enfermedad de Chagas por transmisión vectorial
Caso en el que se excluyeron otras vías de transmisión, y con evidencia clínica (señal de Romaña o chagoma de inoculación) y/o epidemiológica de la aparición de Triatominos en el local de infección. Normalmente se observa la aparición de caso aislado.
Caso confirmado de Enfermedad de Chagas por accidente de laboratorio
Caso que haya tenido contacto con cultivo de T. cruzi, exposición a las heces de Triatominos contaminadas o con sangre (de casos humanos o de animales) conteniendo formas infectantes del parásito. Normalmente sucede entre laboratoristas, profesionales de salud o de investigadores.
Caso confirmado de Enfermedad de Chagas por transmisión vertical
Recién nacido de madre con análisis parasitológico positivo o serológico reactivo para T. cruzi y que presente:
análisis parasitológico positivo a partir del nacimiento; o
análisis serológico reactivo a partir del 9º mes de nacimiento (antes de eso, los anticuerpos maternos todavía pueden estar presentes en el niño) y sin evidencia de infección por otras formas de exposición a T. cruzi.
Además de la vigilancia de los focos vigentes para vigilancia específica de la Enfermedad de Chagas en Brasil, con la revisión de la definición de caso para la vigilancia epidemiológica de SIDA en el país, a partir de enero de 2004, en todo el territorio nacional, se incluyó la reactivación de la Enfermedad de Chagas (miocarditis y/o meningoencefalitis) como enfermedad indicativa de SIDA para el SUS.49,54
Aunque no sean objeto de la vigilancia epidemiológica en Brasil hasta el momento,15 los individuos portadores de la forma crónica de la Enfermedad de Chagas deben ser confirmados, considerando la evaluación de personas sin cuadro indicativo de enfermedad febril en los últimos 60 días y la presencia de uno de los siguientes análisis:39
serología anti T. cruzi (IgG) reactiva por dos métodos basados en principios distintos (ELISA, HAI o IFI);
xenodiagnóstico (artificial o indirecto) positivo para T. cruzi; y
hemocultivo positivo para T. cruzi en muestras de sangre o líquido cerebroespinal; o aún, diagnóstico post mortem.
Se destaca que el contexto epidemiológico actual en Brasil trae para debate la ampliación del enfoque y abordajes de la vigilancia epidemiológica en la población humana para la Enfermedad de Chagas en su fase crónica, considerando, entre otros factores, la posibilidad de mayor sensibilidad de las acciones de investigación epidemiológica de otros casos en familiares, red social y comunidades (en las fases aguda o crónica), bien como de delineación de contextos espaciales de transmisión (pasado o reciente, activo o no) de forma integrada a vectores y reservorios. Paralelamente, se debe considerar la ampliación de los criterios para tratamiento específico de la enfermedad de Chagas, considerando que miles de ciudadanos brasileños infectados tendrían beneficios claros con el tratamiento específico.15,59 Estas cuestiones traen, por lo tanto, la necesidad de superación de problemas operacionales de la red de atención a la salud, que debe estar preparada para un manejo longitudinal, cualificado y oportuno de esta condición crónica. Incluye también como necesidad la garantía y sostenibilidad de la producción de medicamentos delante de la potencial ampliación de la demanda para tratamiento específico y los acuerdos internacionales.38
Está en curso en el país, por lo tanto, una amplia discusión para la evaluación de la inclusión de la vigilancia por medio de notificación obligatoria de casos humanos en la fase crónica, tratando de cualificar las acciones tanto de epidemiología y control como de atención a la salud.
Vigilancia Entomológica
La vigilancia entomológica para Enfermedad de Chagas debe estar implantada en todo el país, respaldada principalmente en dos pilares: vigilancia pasiva, con la participación de la población en la notificación de Triatominos; y vigilancia activa, realizada por equipos de entomología de los municipios en alianza con regionales de salud de los estados, sin necesariamente estar basada en la previa notificación por el morador.39
La vigilancia entomológica ha sido potenciada con sostenibilidad en bases comunitarias, responsables por la red de Puestos de Información de Triatominos (PITs), que está siendo consolidada lentamente en el país.22 La investigación domiciliar por equipo técnico institucional ha sido recomendada de forma más sistemática y abarcador, dependiendo del riesgo existente. Sin embargo, pocos municipios brasileños han adoptado este abordaje, y aquellos que lo adoptaron, en general, presentan baja sensibilidad en la búsqueda activa con, por lo menos, mitad de los focos de infestación no siendo detectada. La revisión sistemática abordando impactos de la participación comunitaria en el proceso de vigilancia entomológica verificó que el desarrollo de estrategias para garantizar esa participación debe ser incorporado como un componente del proceso de vigilancia entomológica, destacando que solamente el control químico estandarizado parece ser consistentemente eficaz en eliminar focos de infestación.85 Reforzó, por lo tanto, la necesaria participación de las personas, familias y comunidades de áreas endémicas en todas las etapas de este proceso, desde la planificación hasta la evaluación de las acciones, considerando las dimensiones sociales en las que se insertan18,43,85 y reconociendo el necesario empoderamiento y participación de estas poblaciones.
Las estrategias adoptadas deben ser adecuadas a la realidad de cada local, siendo que la vigilancia pasiva con participación de la población es prioritaria en Brasil y está indicada para la gran mayoría de los escenarios, salvaguardando la necesaria y pronta respuesta por los servicios a las demandas de la población.85 Por otro lado, la vigilancia activa debe ser realizada obligatoriamente en los municipios con focos residuales de T. infestans.23,39
La ampliación del registro de transmisión de T. cruzi en áreas anteriormente consideradas “indemnes” o sin riesgo para transmisión de la enfermedad de Chagas, como la región Amazónica, ha generado la necesidad de mayor atención a los equipos de vigilancia epidemiológica.76,91,92 En varias regiones brasileñas, se están observando alteraciones ambientales que favorecen la adaptación de vectores a los ambientes artificiales, estableciendo nuevos espacios para la aparición de la enfermedad.22,23,39,65,66 De esa manera, también se ha observado la domiciliación de especies secundarias, aunque en escala muy inferior a lo observado antes del control de T. infestans.22,23,39,66
La emergencia o la reemergencia de la Enfermedad de Chagas en Brasil caracteriza un nuevo perfil epidemiológico que independe de la transmisión intradomiciliaria por T. infestans. De esa manera, el control de la transmisión de T. cruzi, en el actual escenario, se debe analizar bajo una nueva perspectiva. La atención de la vigilancia es de extrema importancia, manteniendo principalmente el funcionamiento de la vigilancia entomológica sensible en los municipios, además de las acciones de educación en salud y ambiental.
Retos para Brasil
En Brasil, el SUS está fundamentado en valores centrales y principios fundamentales dentro de la sociedad, como universalidad, equidad, integralidad, participación y control social, que deben ser el fundamento para políticas y programas de interés público. El país representa una de las principales áreas endémicas de la Enfermedad de Chagas en el mundo, en contextos diversos de gran complejidad para prevención y control. Por la elevada carga de morbilidad y mortalidad asociada a la Enfermedad de Chagas y su relativa “invisibilidad” en la sociedad, cabe al gobierno garantizar la prioridad en la salud pública y movilizar los recursos y las capacidades necesarios junto a otros actores gubernamentales o no gubernamentales para su enfrentamiento, reforzando el papel singular que la atención básica tiene para el sistema nacional de salud.
Las estimaciones nacionales de miles de personas infectadas por T. cruzi indican la gran responsabilidad del país en los campos técnico-científico y político, no solamente para la prevención de nuevos casos, sino también, sobre todo, en la implementación de mejores decisiones y beneficios para los portadores de la enfermedad, tanto en la fase aguda como crónica. Brasil y los demás países de Latinoamérica tienen un papel fundamental en la conducción de ese proceso y en la ejecución de los compromisos de acción pactados internacionalmente, con la aprobación y el aval de la OPAS y de la OMS. El movimiento social emergente debe ser valorado y estimulado, con la finalidad de buscar la sostenibilidad de las acciones para el enfrentamiento.
Las acciones de vigilancia a la salud para la enfermedad de Chagas, con base en la atención primaria a la salud, deben tener como principios: territorialización, intersectorialidad, enfoque en las personas y no en la enfermedad, constitución de equipos multiprofesionales, enfoque en las necesidades y expectativas de la población y, por fin, búsqueda de la calidad. El abordaje cualificado y ético de las familias alcanzadas por la Enfermedad de Chagas debe ser integrado a las acciones de promoción y prevención, atención a la salud para diagnóstico y tratamiento oportunos, sin embargo, también para la rehabilitación física, psicológica y social. De la misma manera, para las acciones de vigilancia epidemiológica transversales en estos territorios. Nuevos acuerdos y agendas deben ser construidas, incluyendo a la Enfermedad de Chagas como tema relevante, con el objetivo de garantizar el acceso a los insumos necesarios para diagnóstico y tratamiento de la enfermedad en el SUS.
Por lo tanto, más allá de los elementos presentados previamente, el país debe examinar continuamente los objetivos y focos vigentes de la vigilancia epidemiológica de la enfermedad de Chagas, considerando el acúmulo de evidencias científicas y experiencias exitosas. El desarrollo social y humano debe estar fuertemente asociado al fomento de investigaciones estratégicas con enfoque en la superación de fallas propias de la ciencia, del mercado y del sistema de salud pública,111 con amplia participación popular y del emergente movimiento social en Enfermedad de Chagas. La constitución de la Federación Internacional de personas Afectadas por la Enfermedad de Chagas (Findechagas), con la participación importante de varias representaciones de Brasil y de otros países, fortalece la posibilidad de levantar y catalizar debates y decisiones desde el punto de vista técnico-político basadas en evidencias, para el alcance del verdadero control y de la prevención.
El Ministerio de Salud, en alianza con estados y municipios, ha tenido un papel inductor fundamental, debiendo garantizar el fortalecimiento y la sostenibilidad del Programa Nacional de control de la enfermedad de Chagas, para posibilitar que las evidencias científicas, muchas de las cuales, sintetizadas en este Consenso, sean realmente aplicadas en las diferentes realidades del SUS. Reitera su papel estratégico de garantizar la sostenibilidad de la financiación de investigaciones para el control y la prevención de la Enfermedad de Chagas en Brasil, más ajustadas a las diferentes realidades y contextos en el país.83
La ampliación de las acciones de vigilancia epidemiológica, más allá de los casos agudos de Enfermedad de Chagas, integrando los casos de la enfermedad en la fase crónica, debe ser incorporada estratégicamente en esta perspectiva, ampliando el acceso a la red de atención a la salud para diagnóstico y tratamiento oportunos de la infección y de las potenciales complicaciones de la enfermedad. El tratamiento antiparasitario debe ser garantizado a todos los casos que hayan tenido indicación para su uso, y nuevas opciones terapéuticas seguras y eficaces deben ser continuamente buscadas.
Los espacios prioritarios para el desarrollo de las acciones de vigilancia deben ser pensados tanto para escenarios epidemiológicos actuales cuanto futuros, englobando la redefinición de instrumentos y herramientas con carácter innovador para el desarrollo de los procesos de vigilancia, integrando aspectos ambientales, reservorios, vectores, parásito y población humana. La perspectiva macro ecológica y ecogeográfica debe ser integrada al planeamiento de las acciones en el país, de forma articulada con las demás naciones de la Iniciativa de los Países del Cono Sur.
Considerando los contextos de riesgo delineados para Brasil, debe definir el papel de otras modalidades de vigilancia y como estas estarán integradas a los procesos vigentes de vigilancia, incluyendo: hemovigilancia, tecnovigilancia, farmacovigilancia, transmisión vertical, accidentes con materiales biológicos, trasplantes, infección por VIH/SIDA, otras condiciones de inmunosupresión, eventos agudos inusitados, como brotes epidémicos y microepidemias, entre otros.
Se salienta, además, que es necesaria la integración del programa de control de Enfermedad de Chagas a otros programas de control de enfermedades transmisibles (vectoriales o no) y de enfermedades crónicas no transmisibles en el país (todos vinculados principalmente a la Secretaría de Vigilancia en Salud - SVS), bien como a otras áreas del Ministerio de Salud (Secretaría de Ciencia, Tecnología e Insumos Estratégicos - SCTIE, Secretaría de Atención a la Salud - SAS, Secretaría de Gestión Estratégica y Participativa - SGEP, Secretaría de Gestión del Trabajo y Educación en Salud - SGTES y Secretaría Especial de Salud Indígena - SESAI), con el objetivo de fortalecer acciones intersectoriales para el control efectivo de la Enfermedad de Chagas.
Delante de tales perspectivas, se justifica la construcción del presente Consenso, que, además de enfocar la realidad brasileña, puede venir a ser un instrumento de referencia, estímulo y movilización de todos los actores involucrados en el enfrentamiento global de la Enfermedad de Chagas.
TRANSMISIÓN VERTICAL DE T. cruzi
La transmisión vertical (de madre para hijo) de T. cruzi se mantiene como realidad, a pesar del impacto favorable de las acciones de control de vectores y de la cualificación del proceso transfusional en varios países,104,105,112,113 inclusive en Brasil.20,106,107 La existencia de mujeres en edad fértil infectadas, en países endémicos o no, sostiene este riesgo, que tiende a reducirse a lo largo de las dos próximas décadas.
En Brasil, en 2011, según datos del Sinasc, fueron registrados alrededor de 3 millones de nacidos vivos. Con base en prevalencia estimada de 1% de infección por T. cruzi en mujeres entre 25 y 44 años de edad17 y en un riesgo de transmisión vertical máximo estimado de 1% para el Estado de Minas Gerais, se estima que hasta 300 niños hayan nascido infectados en aquel año.107 La detección de la transmisión vertical se complica en la práctica, pues la inmensa mayoría de los casos congénitos es totalmente asintomática.4,10,102,104,113-116
Se trata de un tema complejo, considerando la existencia de pocas evidencias científicas de base poblacional. En Brasil, como la Enfermedad de Chagas congénita es considerada aguda, su notificación es obligatoria dentro de las acciones de vigilancia epidemiológica.
Diagnóstico y manejo de la infección por T. cruzi durante el embarazo
Se recomienda la realización de evaluación (triaje) serológica para infección por T. cruzi en todas las mujeres embarazadas que viven en áreas endémicas o son de ellas procedentes, preferentemente en la primera consulta del prenatal.20,117 El grupo técnico de la OMS sobre prevención y control de la transmisión congénita de la Enfermedad de Chagas recomienda también este triaje para las mujeres que tienen historial de haber recibido sangre por transfusiones realizadas en áreas endémicas o que hayan nacido en estas áreas.104 Aunque la transmisión dependa fundamentalmente de la parasitemia materna, no hay evidencias claras sobre cuales mujeres podrán transmitir realmente la infección, lo que acentúa la importancia del triaje prenatal.112,116,117
La transmisión puede ocurrir en cualquier momento del embarazo, siendo posiblemente mayor en el tercer trimestre, con el incremento de la parasitemia.116,118 Por otro lado, el diagnóstico oportuno de la infección durante el embarazo posibilita la atención más cualificada a la mujer embarazada infectada, que debe ser acompañada durante toda la gestación.
Relatos de exposición accidental al benznidazol en mujeres embarazadas no indican efectos adversos en el recién nacido. Sin embargo, en virtud de la evidencia de teratogenicidad demostrada en animales, el tratamiento antiparasitario específico de la infección por T. cruzi está contraindicado durante el embarazo y desaconsejado durante el amamantamiento,20,115 debiendo ser indicado solamente después de estos períodos.112 La exposición accidental al antiparasitario durante el embarazo no representa un criterio para interrupción de la gestación.115
Estudios señalan el posible beneficio del tratamiento antiparasitario, con mejor evolución de la Enfermedad de Chagas116,119-122 y la reducción del riesgo de transmisión vertical en futuros embarazos.109,116 La elevada parasitemia materna se asocia a un mayor riesgo de transmisión vertical y de aborto.103,115 Mujeres embarazadas que se encuentran en la fase aguda de la Enfermedad de Chagas deben ser evaluadas caso a caso, preferentemente con la participación de expertos, para definir el riesgo-beneficio de indicar el tratamiento antiparasitario. Las mujeres embarazadas portadoras de cardiopatía de Chagas crónica deben ser acompañadas en los centros de referencia para gestación de alto riesgo, una vez que podrán presentar necesidad de atención de alta complejidad.
La evidencia de infección por T. cruzi no justifica la indicación de parto abdominal (cesárea),115 ya que la infección congénita por T. cruzi puede resultar en crecimiento uterino retardado, detectado en ultrasonografía y parto prematuro.102,115,116,123
Se destaca la importancia de proceder a todas las evaluaciones recomendadas durante el prenatal, incluyendo las pruebas anti VIH. La coinfección T. cruzi y VIH en mujeres embarazadas representa riesgo aumentado de transmisión congénita de T. cruzi, por la elevada parasitemia, también implicando mayor morbilidad y mortalidad perinatal.20,116,120,123,124
Después del parto, la mujer deberá ser evaluada cuanto a la conducción de la Enfermedad de Chagas, a partir de la clínica de la enfermedad presente, con el objetivo de oportuno tratamiento específico.
Diagnóstico y manejo en niños expuestos
El riesgo de transmisión vertical de T. cruzi depende del nivel de parasitemia, del estado inmunológico materno, de la cepa infectante y de factores placentarios, pudiendo ocurrir en cualquier fase de la enfermedad.41,104,113,115,116
Aunque la mayor parte de los casos sean asintomáticos, en algunos puede ocurrir fiebre prolongada, hepatosplenomegalia, insuficiencia respiratoria, prematuridad, bajo peso al nacer y muerte fetal. Señales de meningoencefalitis y miocarditis fueron observados en la coinfección con VIH.102,104,113-115,123 Por lo tanto, están siendo recomendados como evaluaciones de rutina en los niños con indicios clínicos de Enfermedad de Chagas congénita: hemograma completo, bioquímica sérica, análisis de orina, radiografía de tórax, electrocardiograma (ECG), ecocardiograma, además de ultrasonografía cerebral y abdominal.115
La estrategia empleada para el diagnóstico de la infección por T. cruzi dependerá esencialmente de la edad del niño. Niños expuestos a T. cruzi, por transmisión vertical, presentan anticuerpos maternos de la clase IgG circulantes que pueden ser detectados por pruebas serológicas de rutina hasta los 9 meses de edad, siendo que su detección, en este período, no caracteriza necesariamente una infección congénita. En cambio, la persistencia de títulos inalterados de anticuerpos anti T. cruzi, en niños a partir de los 9 meses de edad, es indicativa de infección congénita, y la ausencia de esos anticuerpos aleja la posibilidad de infección en el niño.104,123
El diagnóstico en casos sospechosos de Enfermedad de Chagas por transmisión vertical (excluidas otras formas de transmisión), por tratarse de infección aguda, debe ser confirmado por medio de la utilización de métodos parasitológicos directos (análisis en fresco, microhematocrito, crema leucocitaria y/o método de Strout) en la sangre del cordón umbilical o del recién nacido en los primeros 30 días de edad (preferentemente en la primera semana de vida), con evaluación de dos o tres muestras en la ausencia de señales y síntomas para ampliación de la sensibilidad.20,104,123
Para niños sintomáticos o recién nacidos de madre con infección aguda por T. cruzi o con reactivación en la vigencia de coinfección por VIH/T. cruzi, estos análisis parasitológicos deben ser realizados repetidamente y, caso sean negativos, métodos parasitológicos de enriquecimiento y/o moleculares (en laboratorios de investigación) están siendo utilizados, aunque no estén accesibles y estandarizados para uso en la rutina de los servicios de salud.115,125
En caso de análisis parasitológicos/moleculares negativos en los primeros meses o en la imposibilidad del uso de métodos parasitológicos, se recomienda realizar la investigación de anticuerpos IgG anti-T. cruzi después del noveno mes en dos pruebas.20,104,123,125 La serología convencional reactiva en niños en este período es fuertemente indicativa de transmisión congénita, principalmente cuando excluidas las posibilidades de transmisión vectorial y transfusional.20
En Brasil, la inclusión de la prueba serológica con investigación de IgG para T. cruzi en el Programa Nacional de Triaje Neonatal (“prueba del talón”) es recomendable, especialmente en regiones endémicas para infección por T. cruzi, representando estrategia útil y de bajo costo.20,107
La investigación de anticuerpos anti T. cruzi de la clase IgM presenta baja sensibilidad, y hay, además, dificultades para la estandarización de las técnicas y para la obtención de controles. La utilización de métodos serológicos que emplean antígenos recombinantes, como el shed acute phase antigen (SAPA), puede ser indicada caso esté disponible. Hay relatos de que anticuerpos maternos anti-SAPA desaparecen más precozmente que anticuerpos convencionales - en aproximadamente tres meses.126
Establecido el diagnóstico de la infección por T. cruzi, el niño debe ser tratado con benznidazol, siendo un esquema bien tolerado hasta 10-15mg/kg/día en dos o tres dosis por 60 días.20,104,115 Hay una clara necesidad de desarrollo de formulaciones en suspensión más adecuadas para este tratamiento, a pesar del avance reciente de poner a disposición, pastillas pediátricas (12,5 mg) para estas situaciones clínicas.
El tratamiento es obligatorio en todos los casos de infección congénita, pues su adopción presenta alta eficacia y seguridad para la gran mayoría de los niños tratados. Además de eso, estudios evidencian alta tasa de cura (≥95%) cuando el tratamiento se inicia antes de 1 año de edad, ya en las primeras semanas de vida.104,112,115,127
Se debe proceder a la evaluación clínica y de laboratorio (análisis hematológico) al inicio del tratamiento y en el 30º, 60º y 90º días después del uso de benznidazol. En los niños con síndrome clínico de Enfermedad de Chagas, deben ser realizadas otras evaluaciones complementarias, de acuerdo con el cuadro presentado. El control de curación debe ser realizado con análisis serológico a cada seis meses, con titulación, hasta que el niño presente dos análisis serológicos consecutivos no reactivos. La persistencia de serología reactiva o la evidencia de análisis parasitológicos positivos puede indicar falla terapéutica y el niño debe ser acompañado y evaluado en relación a posibles complicaciones de la enfermedad. En casos refractarios, puede ser repetida la terapéutica con benznidazol o la sustitución por nifurtimox (hasta 15mg/ kg/día, en dos o tres dosis, por 60 días).
recién nacidos de madres infectadas, asintomáticos, siempre que posible, se debe realizar la investigación de T. cruzi. Aquellos con análisis parasitológico inicial, negativo o no, realizado, deben ser sometidos, a los nueve meses de nacido, a pruebas serológicas para investigación de anticuerpos anti T. cruzi de la clase IgG o a la serología convencional para infección por T. cruzi.107,117,127 Análisis serológicos reactivos después de esta edad implican, necesariamente, en iniciar el tratamiento antiparasitario. Por otro lado, la serología no reactiva permite excluir la existencia de infección.
No se recomienda la suspensión del amamantamiento en puérperas con Enfermedad de Chagas en la fase crónica - excepto en los casos en que se verifica sangrado por fisura mamaria, cuando sería conveniente la interrupción de la amamantamiento en la mama comprometida -, o en situaciones de elevada parasitemia, como en la reactivación de la Enfermedad de Chagas o en mujeres en la fase aguda de la enfermedad.112,115 En el caso de exposición a la leche materna de madre con infección aguda o infección crónica con presencia de fisuras del pezón, la monitorización de adquisición de la infección por T. cruzi por el lactante debe ser realizada durante el período de exposición, utilizando los mismos criterios parasitológicos y/o serológicos descritos anteriormente. En algunos de estos casos, el tratamiento térmico de la leche materna antes de la administración a los lactantes puede ser considerado.112
En la coinfección T. cruzi/VIH, se recomienda que toda madre infectada sea orientada a no amamantar, considerando que el amamantamiento, independientemente de la asociación con la Enfermedad de Chagas, está asociado a un riesgo adicional de 7 a 22% de transmisión del VIH. En cambio, en casos de infección materna aguda por VIH, el amamantamiento natural aumenta la probabilidad de transmisión vertical del VIH para 29%. En Brasil, la madre tendrá derecho a recibir fórmula láctea infantil, por lo menos hasta que su hijo cumpla 6 meses de edad.128
La (Figura 1) presenta el diagrama de flujo general para enfoque de la infección por T. cruzi en el binomio madre/hijo.
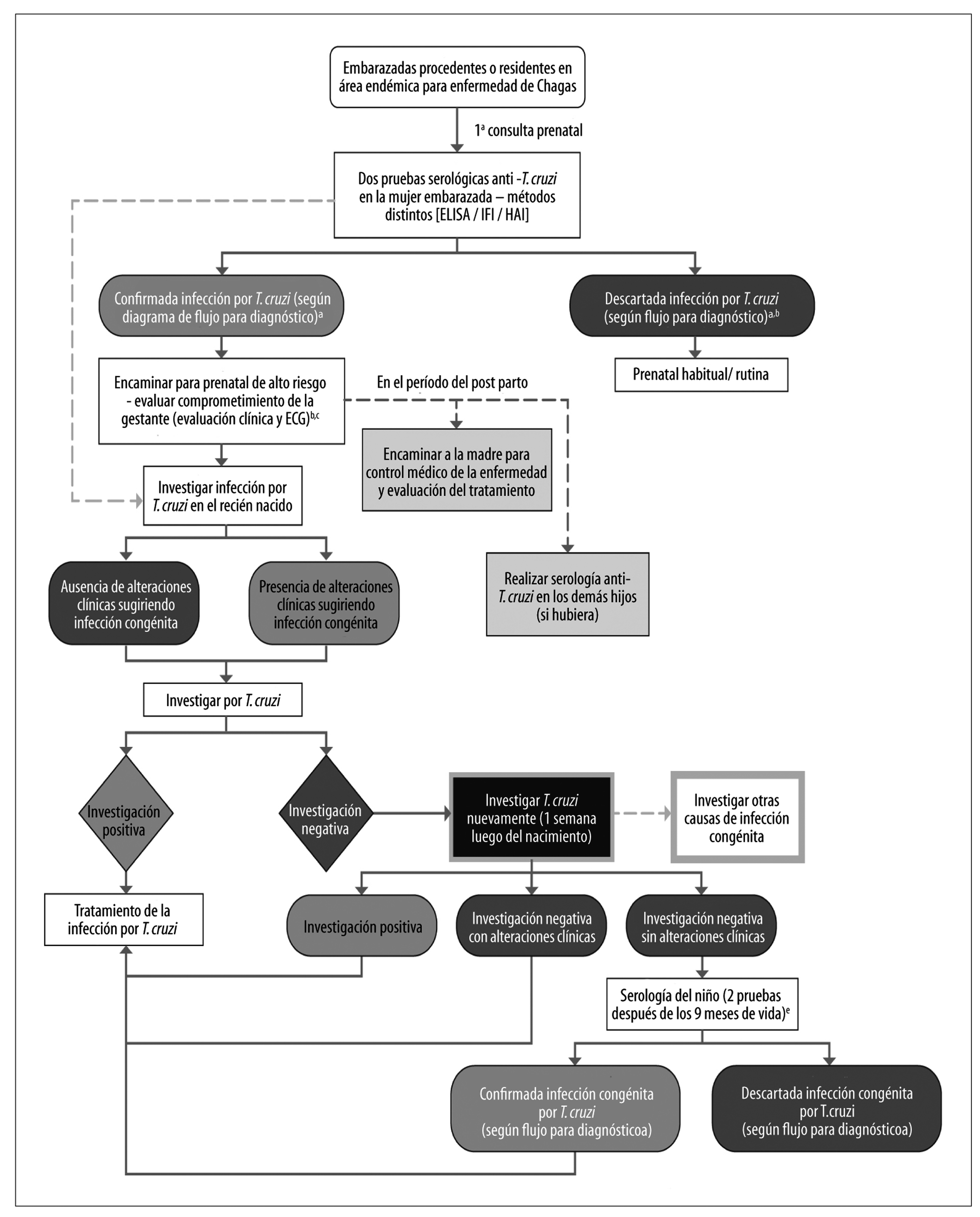
a) Seguir flujo para confirmación del diagnóstico de la infección por T. cruzi (ver sección referente al diagnóstico de laboratorio de la infección por T. cruzi, en este Consenso).
b) Caso los resultados de los análisis complementarios no evidencien alteraciones, el prenatal puede ser realizado dentro de la rutina de Unidad Básica de Salud (atención primaria a la salud). Delante de señales/ síntomas sugestivos de Enfermedad de Chagas, debe seguir el prenatal en unidad asistencial de referencia para gestación de alto riesgo.
c) Evaluación del feto por medio de ultrasonografía obstétrica, debiendo buscar señales de crecimiento intrauterino restricto y otras señales comunes al grupo TORCH (toxoplasmosis, rubéola, citomegalovirus y herpes).
d) Pruebas parasitológicas están recomendadas en los primeros días de vida del niño.
e) Después del 9º mes de vida, utilizar pruebas serológicas para el diagnóstico de la infección.
Figura 1 - Diagrama de flujo para abordaje de la infección por T. cruzi en el binomio madre/hijo
DIAGNÓSTICO DE LABORATORIO DE LA INFECCIÓN POR T. cruzi
El diagnóstico etiológico de la Enfermedad de Chagas en Brasil debe ser realizado en todos los casos sospechosos, tanto en la fase aguda como en la fase crónica.20,39,129 Para esto, es fundamental integrar evidencias epidemiológicas, clínicas y de laboratorio, con la finalidad de aumentar el grado de predicción y el perfeccionamiento del diagnóstico.
El diagnóstico complementario de la infección por T. cruzi por medio de diferentes técnicas de laboratorio debe seguir criterios definidos, a depender de la fase de la enfermedad. Las recomendaciones a seguir incluyen las normas vigentes en Brasil para este diagnóstico.
Fase aguda
Criterio parasitológico
El análisis parasitológico es el más indicado en esta fase. Este criterio es definido por la presencia de formas tripomastigotes de T. cruzi, identificadas por medio del análisis directo de la sangre periférica (con o sin centrifugación previa) con el uso de microscopia (con o sin coloración).39,129-132
Se recomienda la realización simultanea de diferentes modalidades de análisis parasitológicos directos - investigación a fresco de tripanosomátidos, métodos de concentración o lámina coloreada de gota espesa o de frotis. Cuando los resultados del análisis a fresco y de concentración sean negativos en la primera recogida, deben ser realizadas nuevas recogidas hasta la confirmación del caso y/o el desaparecimiento de los síntomas de la fase aguda, o aún, la confirmación de otra hipótesis diagnóstica.20,39,133
Criterio serológico
El criterio serológico se basa en métodos indirectos para diagnóstico que pueden ser realizados cuando los análisis parasitológicos sean negativos y la sospecha clínica persista. Tales métodos tienen utilidad complementaria, y deben siempre ser realizados en casos sospechosos o confirmados de Enfermedad de Chagas aguda.39,134
En los casos en que no se identifica el parásito en la investigación directa, la verificación de la presencia de anticuerpos anti T. cruzi de la clase IgM en la sangre periférica es considerada sugestiva de la fase aguda, particularmente cuando asociada a contexto epidemiológico y manifestaciones clínicas.129,135 Representa una técnica de mayor complejidad de realización, más adecuada a la fase aguda tardía, cuando las repeticiones de los análisis de investigación directa tengan resultados negativos.129,133,134
La seroconversión para infección por T. cruzi se define por la presencia de una primera muestra de suero no reactivo para anticuerpos anti T. cruzi, asociada a una segunda muestra reactiva (recogida 2 a 4 semanas después), con base en un ensayo que incluya ambas las muestras simultaneamente.133,134
Por otro lado, el incremento de por lo menos dos títulos entre dos muestras reactivas con intervalos de 2 a 4 semanas, en un contexto clínico y epidemiológico favorable para Enfermedad de Chagas aguda, puede ser considerado sugestivo también de Enfermedad de Chagas aguda.39,132-134
En las situaciones relacionadas a la posibilidad de transmisión vertical, la estrategia empleada para el diagnóstico de la infección por T. cruzi dependerá esencialmente de la edad del niño, y es discutida en parte específica de este documento. Se destaca que todo caso de transmisión congénita significa un caso agudo de Enfermedad de Chagas, debiendo ser notificado y manejado como tal.104
Fase Crônica
Criterio parasitológico
Debido a la parasitemia subpatente en la fase crónica de la enfermedad de Chagas, los métodos parasitológicos de enriquecimiento/multiplicación, hemocultivo136,137 y xenodiagnóstico138 presentan comprobadamente baja sensibilidad, lo que implica ausencia de valor diagnóstico cuando el resultado sea negativo.20,133,139
Cuando presentan resultados positivos, poseen utilidad principalmente en el control del tratamiento específico o en los casos no usuales, cuando la serología presenta resultados inconclusivos.129,134
Criterio serológico
En esa fase, el diagnóstico es esencialmente serológico, y debe ser realizado utilizando una prueba con elevada sensibilidad en conjunto con otra de alta especificidad.20,39,132-134
Se considera un individuo infectado en la fase crónica aquel que presenta anticuerpos anti T. cruzi de la clase IgG detectados por medio de dos pruebas serológicas con principios/métodos distintos o que posean diferentes preparaciones antigénicas. El diagnóstico diferencial con otras enfermedades (por ejemplo, leishmaniasis visceral, lepra en la forma clínica virchowiana, enfermedades autoinmunes, entre otras) debe ser considerado140-142.
Diagnóstico parasitológico en la fase aguda
El diagnóstico parasitológico de la Enfermedad de Chagas en esta fase basada esencialmente en la identificación del parásito y su sensibilidad depende del nivel de parasitemia. En la fase aguda, el número de parásitos en la sangre periférica es elevado. Se recomienda que, delante de un caso sospechoso de Enfermedad de Chagas en la fase aguda, sean utilizados diferentes métodos de análisis parasitológicos directos, para lectura inmediata y repetida, con la finalidad de aclaración diagnóstica.20,39,104,132-134
La investigación en fresco de tripanosomátidos es de ejecución rápida y sencilla, siendo más sensible que el frotis coloreado. La situación ideal es la realización de la colecta con paciente febril y dentro de 30 días del inicio de síntomas.134
El análisis puede hacerse directamente al microscopio en una gota de sangre entre lámina y cubreobjeto, y la colecta debe ser realizada simultáneamente para métodos de concentración de la sangre.
Los métodos de concentración son de rápida ejecución y bajo costo (método de Strout, microhematocrito y crema leucocitaria), y son recomendados como primera elección de diagnóstico para casos sintomáticos con más de 30 días de evolución, debido a la disminución de la parasitemia con el trascurso del tiempo. Las muestras de sangre deben ser examinadas dentro de 24 horas, debido a la posible lisis de los parásitos.129,134
Las evaluaciones por análisis directo de lámina coloreada de gota espesa o de frotis sanguíneo pueden ser utilizadas, aunque presentan menor sensibilidad que los métodos anteriormente descritos. Mientras tanto, en la región Norte de Brasil, perteneciente a la Amazonía Legal, son ampliamente utilizadas, en virtud de la practicidad y de la disponibilidad al ser integradas a las acciones de diagnóstico de malaria.20,39 Representan métodos importantes para la comprobación y caracterización morfológica, especialmente en áreas geográficas donde la infección por Trypanosoma rangeli puede coexistir con T. cruzi.
Se destaca que los casos de elevada parasitemia - como en la fase aguda de la enfermedad, pero también en la transmisión transfusional y en inmunosuprimidos -, puede ser un hallazgo casual en el análisis de frotis sanguíneo para conteo diferencial de leucocitos.20,39,49,52,100
Delante de fuerte sospecha clínica y epidemiológica de fase aguda de la infección por T. cruzi asociada a análisis parasitológicos directos negativos, el diagnóstico molecular por medio de la reacción en cadena de la polimerasa (PCR) con hibridación ha presentado resultados prometedores, a pesar de ser pruebas internas y realizadas solamente por algunos centros de investigación/referencia. Los métodos, los protocolos y los procedimientos operacionales deben seguir las recomendaciones de la reciente estandarización para el uso de la PCR.143,144 En Brasil, debido a la ausencia de protocolos definidos y de procedimientos operacionales estandarizados, así como de kits comerciales para uso en la rutina de la vigilancia en salud, la PCR no puede ser considerada un método de diagnóstico aislado para confirmación o descarte de caso de Enfermedad de Chagas aguda o crónica.39
Diagnóstico serológico en la fase aguda
Actualmente, existen dificultades en Brasil para la realización de pruebas serológicas en pacientes en la fase aguda, debido a la falta de kits comerciales registrados y aprobados por la Agencia Nacional de Vigilancia Sanitaria (Anvisa) y a la dificultad de obtener controles positivos para la IgM.20,39,133 De esa forma, tradicionalmente se recomienda que sean implantadas metodologías de inmunofluorescencia indirecta (IFI)145 con investigación de IgM en laboratorios de referencia, además de las técnicas convencionales ya utilizadas, como IFI con investigación de IgG, hemaglutinación indirecta (HAI)146 y ensayo inmunoenzimático (ELISA).147
Diagnóstico parasitológico - fase crónica
Los métodos convencionales indirectos para el aislamiento y la identificación de T. cruzi (xenodiagnóstico y hemocultivo) presentan baja sensibilidad, la que puede ser aumentada por medio de su repetición.20,129,133,148,149 Un análisis negativo no aleja la posibilidad de infección, sin embargo, un análisis positivo tiene valor diagnóstico absoluto. La PCR en esta fase, a pesar de su limitación por la ausencia de protocolos estandarizados, es indicada cuando las pruebas serológicas presentan resultado indeterminado o para el control de la cura después del tratamiento antiparasitario. Así, se debe realizar en laboratorios de competencia reconocida, ejecutada por expertos en el área.150
Diagnóstico serológico - fase crónica
El diagnóstico en la fase crónica es esencialmente serológico, y debe ser realizado utilizando una prueba con elevada sensibilidad (ELISA con antígeno total o IFI) en conjunto con otro método con elevada especificidad (HAI).129,133,134 Las pruebas dichas convencionales (HAI, IFI y ELISA)131 pueden determinar el diagnóstico en casi 100% de los casos. Las pruebas no convencionales (con antígenos recombinantes, por ejemplo) pueden ser utilizadas, preferentemente en paralelo con otra prueba convencional clásica.151
La realización de reacciones en eluatos de sangre recogido en papel de filtro es desaconsejada para el diagnóstico de infección, sin embargo, estas son habitualmente utilizadas en etapas de triaje en investigaciones epidemiológicas.152 La reacción de Guerrero y Machado (o fijación de complemento) para Enfermedad de Chagas no atiende a los estándares exigidos actualmente, además de no estar disponible en el mercado, no siendo, por lo tanto, indicada.20,129
La prueba de quimioluminiscencia también permite la identificación de anticuerpos de la clase IgG. Aunque existan algunos kits disponibles en el mercado, la técnica todavía no es recomendada por el Ministerio de Salud de Brasil.133
Evaluación reciente de 11 kits de prueba rápida para diagnóstico serológico de la Enfermedad de Chagas indican la potencialidad de estos métodos. No obstante, nuevos estudios deben ser conducidos en laboratorio y en campo para confirmar estos datos, en especial para evaluar la reproductibilidad en contextos de recursos limitados o de uso de sangre total en los contextos reales de áreas endémicas y no endémicas.153
El diagrama de flujo a seguir (Figura 2) especifica las etapas del diagnóstico de laboratorio de la infección por T. cruzi en la fase crónica de la enfermedad.
FASE AGUDA DE LA ENFERMEDAD DE CHAGAS
La Enfermedad de Chagas aguda se viene convirtiendo en un evento menos frecuente en los países endémicos, inclusive en Brasil, donde el control de la transmisión vectorial (especialmente por T. infestans) y sanguínea ha sido decisivo en este nuevo escenario epidemiológico.20,39
Por otro lado, la aparición de casos y brotes epidémicos por transmisión oral, vectorial domiciliaria sin colonización y vectorial extradomiciliaria, principalmente en la Amazonía Legal, viene ganando importancia epidemiológica.20,21,39,76,154-156
Procesos de urbanización y globalización de la Enfermedad de Chagas resultantes de grandes migraciones, tanto en los países endémicos como no endémicos, contribuyeron para volver todavía más complejos los escenarios epidemiológicos. Adicionalmente, eventos de reactivación de la Enfermedad de Chagas asociados a las inmunodeficiencias están convirtiéndose en retos emergentes para los sistemas de salud.20,39,49,157-159
En ese sentido, la investigación epidemiológica del modo de transmisión de los casos de Enfermedad de Chagas se reviste de especial importancia, no solamente con vista a las acciones de control a ser implementadas, sino también, porque las diferentes vías conllevan potencialmente a especificidades en la expresión clínica de la enfermedad aguda.20,39,76,132
Aspectos clínicos y de análisis complementários
Fase aguda de la Enfermedad de Chagas por transmisión vectorial
El cuadro clínico se caracteriza por el aparecimiento de un conjunto de manifestaciones de intensidad variable, después de un período de incubación que varía en razón inversa entre la carga del inóculo y la vía de inoculación, pudiendo ocurrir o no, una señal de puerta de entrada de la infección.20,21,39,76,91,155,160
El cuadro clínico de la enfermedad aguda en los casos de transmisión vectorial es polimórfico, yendo desde la descripción clásica - señal de puerta de entrada de la infección, fiebre, edema subcutáneo, incremento del volumen de linfonodos, hepatomegalia, esplenomegalia, además de evidencias de miocarditis y de meningoencefalitis - hasta situaciones oligosintomáticas e inaparentes.20,76,91,160 El período de incubación puede variar de 4 a 15 días.
La infección tiene como puerta de entrada, en 50% de los casos, la conjuntiva ocular (señal de Romaña), y en 25%, la piel (chagoma), sin embargo, no es reconocida en los 25% restantes.160 Es de se suponer, por lo tanto, que la vía ocular sea la más frecuentemente diagnosticada, en virtud de su fácil reconocimiento, tanto por el individuo acometido, cuanto por el equipo de salud.
La señal de Romaña se caracteriza, esencialmente, por edema elástico de los párpados en uno de los ojos, indoloro, con reacción de linfonodo satélite (principalmente preauricular). A menudo, el edema se propaga a uno de los lados del rostro correspondiente; es de proporción variable, pudiendo ser tan acentuado al punto de ocasionar la oclusión total de la hendidura palpebral. La divulgación de la señal de Romaña la convirtió en excelente marcador para el diagnóstico de la fase aguda, permitiendo el reconocimiento de mayor número de casos.20,160,161
El chagoma de inoculación se presenta como una formación cutánea poco saliente, endurecida, rojiza, poco dolorosa y circundada por edema elástico. También acompañado de reacción de linfonodo satélite y a veces se ulcera; se ubica en cualquier región del cuerpo, principalmente en las partes descubiertas.20,160
Juntamente con las señales de puerta de entrada, aparecen síntomas generales, como fiebre, malestar, cefalea, astenia e hiporexia. La fiebre es síntoma inicial prácticamente constante, en general no ultrapasando 39,0ºC; a veces es más elevada, especialmente en niños. La curva térmica no es característica, pudiendo registrar los tipos continuos, remitente e intermitente, con elevaciones apreciables en el período vespertino.160,162
Alrededor de la segunda semana de evolución de la enfermedad, puede aparecer edema generalizado o localizado (en el rostro o en los miembros inferiores), independientemente de la relación con la puerta de entrada de la infección o con la insuficiencia cardíaca.160 Su consistencia puede ser elástica o blanda; la elástica es observada solamente en niños de corta edad. De patogenia, todavía no aclarada, varias hipótesis han sido aventadas para explicar esa manifestación.
Los linfonodos comúnmente se presentan rápida a moderadamente aumentados de volumen, aislados, móviles, lisos, indoloros, y tienen consistencia algo aumentada. Entre las pléyades accesibles a la palpación, las que más comúnmente se muestran alteradas son las de las regiones cervicales, axilares e inguinales; esa manifestación es de aparecimiento precoz.160
La hepatomegalia y la esplenomegalia, aisladas o en asociación, son frecuentemente observadas; en general, el incremento de volumen del hígado y del bazo es pequeño o moderado, la consistencia no se muestra alterada, el borde y la superficie son lisos y, a veces, hay dolor a la palpación del hígado; integran precozmente el cuadro clínico.160,163
Aunque menos comunes, otras alteraciones (nerviosas y cutáneas), pueden estar presentes. Las manifestaciones nerviosas son las de una meningoencefalitis (vómitos, agitación, convulsiones, opistódomo, rigidez de la nuca, etc.), observada principalmente en niños de tierna edad. La meningoencefalitis puede presentarse con alteración del líquido cefalorraquídeo, cuyas características son líquido cerebroespinal claro, incremento de la celularidad con discreta linfocitosis (menos de 100 células/ml), hipoglucorraquia e incremento discreto de las proteínas; es posible la visualización de formas tripomastigotes de T. cruzi después de centrifugación del líquido cerebroespinal y tinción específica.20,160
Las manifestaciones cutáneas (raras en Brasil y relativamente frecuentes en Argentina), son exantemas (morbiliforme, urticariforme y macular), denominadas esquizotripanides, y chagomas hematógenos (formaciones generalmente planas), que acometen piel y tejido celular subcutáneo sin hacerles alteraciones en el color, no adherentes a planos profundos, comúnmente indolores, de tamaño variable de una moneda a grandes placas160 y, según Lugones (2001), más palpables que visibles.162
El corazón presenta alteraciones de mayor o menor intensidad; con relativa frecuencia, sin embargo, la exteriorización clínica, radiológica o electrocardiográfica de ese acometimiento es poco expresiva, no guardando paralelismo con los hallazgos histológicos; pueden, inclusive, faltar. Por otro lado, se debe tener en mente la necesidad de realizar análisis radiológico y electrocardiográfico seriados, a corto plazo en busca de señales de comprometimiento cardíaco, dada la transitoriedad de algunas manifestaciones.20,21,160,164
La sintomatología de la miocarditis chagásica aguda prácticamente se superpone a la de las miocarditis agudas de otras etiologías, a veces siendo mascarada por las demás manifestaciones clínicas. La taquicardia es frecuentemente señalada y, regla general, no depende del grado de elevación térmica; en la mayoría de los casos es observada precozmente. Un soplo sistólico con características de soplo funcional puede percibirse en el foco mitral. Las arritmias de excitabilidad solamente son encontradas ocasionalmente. La insuficiencia cardíaca, cuando presente, es global, y su cortejo sintomatológico en nada difiere de las demás. A veces ocurre cierto grado de hipotensión arterial.160,164
Ya en las primeras semanas de la infección, pueden notarse alteraciones radiológicas y/o electrocardiográficas, de mayor o menor significado. No siempre ambos análisis se muestran simultáneamente alterados, pudiendo solamente uno de ellos presentarse anormal; prácticamente tienen el mismo valor diagnóstico, pues ambos, aisladamente, revelan disturbios con la misma frecuencia. Practicados conjuntamente y de manera serial, sin embargo, permiten mostrar un mayor número de veces el comprometimiento del corazón.160,164 Por lo tanto, el estudio del área y la función cardíaca por medio del ecocardiograma está indicado en los casos con evidencias de señales y síntomas de miocarditis.
Radiológicamente, el área cardíaca puede presentarse normal o con leve, moderado o acentuado aumento, globalmente o como resultado de la dilatación de los ventrículos, predominando, en algunos casos, la dilatación del ventrículo izquierdo. Contribuye al incremento de la sombra cardíaca la presencia de exudado en la cavidad pericárdica.160,164
Las alteraciones electrocardiográficas más frecuentemente encontradas son taquicardia sinusal, disminución del voltaje del complejo QRS, bloqueo atrioventricular (BAV) de primer grado, alteración primaria de la repolarización ventricular y aumento de la sístole eléctrica. Las arritmias, exceptuado el BAV de primer grado, solamente son observadas ocasionalmente.160,164
El asincronismo cronológico entre el aparecimiento de la ecocardiografía y la fase aguda ha sido motivo de la no realización generalizada de ese análisis. En estudio conducido en Venezuela que acompañó a 58 pacientes en la fase aguda, el ecocardiograma se mostró anormal en 27 (52%); el más relevante hallazgo ha sido el derrame pericárdico, presente en 42% de los casos, de leve a moderada intensidad en 17 pacientes y acentuado en 5; en 11 pacientes (21%), ha sido demostrada discinesia anterior y/o apical y, en 3 (6%) de ellos, dilatación de ventrículo izquierdo.165 Un estudio abordando a 158 pacientes con Enfermedad de Chagas aguda en la Amazonía, en la mayoría de los casos resultante de transmisión oral, evidenció la presencia de 108 alteraciones, siendo que más de una alteración ha estado presente en el mismo individuo;91 las principales fueron derrame pericárdico de pequeño a gran volumen, regurgitación valvular mitral o tricúspide e hipertrofia simétrica de ventrículo izquierdo. Ocasionalmente, se observa acentuación de la taquicardia sinusal, en contraste con la reducción de la intensidad o el desaparecimiento de las manifestaciones de la fase aguda, inclusive de la fiebre, hecho ya relatado por Chagas.76,91,160
Las principales alteraciones inespecíficas de laboratorio encontradas son, en orden de frecuencia, anemia, leucopenia, linfocitosis relativa e incremento, de leve a moderado, de aminotransferasa. También se describen plaquetopenia y, más raramente, trombocitosis y linfocitosis atípica.21,76
El hemograma revela leucometria global generalmente aumentada, no obstante, a veces, normal o ligeramente disminuida, con linfocitosis intensa, plasmocitosis y neutropenia relativa; se destaca el aparecimiento de elevado porcentual de linfocitos atípicos y leucocitoides después de la segunda semana de enfermedad; con la evolución del proceso para la cronicidad, esas alteraciones desaparecen, surgiendo entonces la eosinofilia.20,21,39,160
Fase aguda de la Enfermedad de Chagas por transmisión sanguínea
En la fase aguda de la Enfermedad de Chagas por transmisión transfusional, el síndrome clínico es prácticamente idéntico al verificado en la transmisión por Triatominos, excepto por la no existencia de chagoma de inoculación. De la misma forma, la evaluación se hace por análisis complementarios. El período de incubación puede variar de 30 a 112 días, siendo un poco más prolongado del que el verificado en la transmisión vectorial, aunque pueden ser verificados períodos bien más cortos, como 8 días, o más largos, como 120 días.160,166 La Enfermedad de Chagas debe ser siempre considerada en casos de fiebre de origen indeterminada, en particular si el paciente en estudio haya sido transfundido en regiones remotas o hiperendémicas.166
La fiebre es el síntoma más frecuente, acometiendo de 80 a 100% de los casos y, muchas veces, es la única sintomatología encontrada. En cambio, la linfadenopatía y la esplenomegalia son observadas también con frecuencia, mientras anemia/palidez cutánea, edema periorbital y perimaleolar, exantemas o hepatomegalia aparecen en menos de 50% de los casos.166
Fase aguda de la Enfermedad de Chagas por transmisión oral
La Enfermedad de Chagas transmitida por vía oral ha sido registrada en la región Amazónica y Extra amazónica,76,91,94,167 con características clínicas peculiares en relación a la transmitida por vía vectorial, y por veces con diferencias de acuerdo con la región.21
La principal diferencia clínica entre las descripciones de área endémica del pasado y la región Amazónica (transmisión predominante por vía oral) es la presentación clínica de elevada morbilidad, destacando la característica epidemiológica regional en lo que se refiere al aparecimiento de la transmisión mucho más eficaz que la vía vectorial.76,94 La evaluación por análisis complementarios inespecíficos es, en general, semejante al verificado previamente.
Señales sugeridas de puerta de entrada discutidos anteriormente - señal de Romaña y chagoma de inoculación - propios de la enfermedad por transmisión vectorial se han descrito raramente en la transmisión por vía oral, enfatizando, así, el diagnóstico diferencial clínico entre las dos formas de transmisión y la baja frecuencia del contacto de personas con vectores no domiciliados en esta región.91,94,160
El período de incubación varía de 3 a 22 días. Las principales señales y síntomas registrados en las Enfermedad de Chagas aguda son, en orden de frecuencia: fiebre prolongada, cefalea, palidez, mialgias, exantema y edemas de faz y miembros inferiores.21,39 Las señales y síntomas característicos de comprometimiento cardíaco incluyen taquicardia sin fiebre, palpitaciones, disnea y dolor torácico.76
La fiebre es la manifestación predominante en la casi totalidad de los casos. En general, cursa con temperatura elevada de inicio continuo y, posteriormente, de carácter vespertino, diario, de duración, promedio, total de 18 días, con intervalos mínimos y máximos entre 3 y 25 días. En aquellos que cursan con fiebre prolongada, esta se presenta de inicio elevada (38,7ºC la 39,0oC), acompañada de escalofríos y dolores generalizados. Después de alrededor de 12 a 15 días, empieza a decaer en lisis, y permanecen temperaturas que varían entre 37,0oC y 37,8oC, de carácter vespertino, diario, hasta desaparecer totalmente.76,91
La palidez (anemia) se revela desde el inicio del síndrome febril, en especial de 3 a 5 días, pudiendo perdurar por hasta 20 a 25 días. En cambio, la mialgia puede ser intensa, frecuentemente descrita por los casos como dolor agudo en puntada, o semejante a los cuadros de dengue (generalizada, confundiendo con poliartralgia).91,168
En la Enfermedad de Chagas por transmisión oral, el exantema se muestra como una señal importante y justificada por parasitemias abundantes, las cuales ocurren con mayor frecuencia de que en la transmisión vectorial. En general, se presenta bajo la forma de exantema macular, no pruriginoso y no doloroso. Surge en torno del 4º al 8º día de la enfermedad, en general en el tórax, dorso, miembros inferiores y cuello, resguardando la cara y las regiones palmoplantares. Tiene relativa fugacidad y, en la mayoría de las veces, pasa desapercibido por el propio paciente, siendo un hallazgo al análisis físico.91,169,170
El edema de miembros inferiores, en general, aparece en torno del 12º al 20º día de la enfermedad, coincidiendo con el desaparecimiento de la fiebre. Invariablemente tiene características de edema inflamatorio, inelástico y poco doloroso, pudiendo acometer solamente la región maleolar o los miembros inferiores por completo. El edema de rostro puede surgir en el mismo período y no tiene características específicas.76,91
En la mayoría de los casos, la miocarditis aguda puede tener inicio poco antes del desaparecimiento de la fiebre, en período medio de 15 a 20 días de enfermedad. Las principales señales y síntomas son disnea, palpitaciones, taquicardia (sin fiebre) y, eventualmente, dolores precordiales, simulando infarto del miocardio. La miocarditis es una de las complicaciones más frecuentes entre enfermos en fase aguda. Los análisis electrocardiográfico y ecocardiográfico deben ser realizados inmediatamente después del diagnóstico.76,160,164
Entre pacientes evaluados en la Amazonía, 52,3% presentó ECG con alteraciones, predominando las alteraciones difusas de repolarización ventricular (ADRV), bajo voltaje de los complejos QRS, desvío del eje eléctrico hacia la izquierda y taquicardia sinusal, demostrando algún involucramiento del sistema de conducción cardíaco más leve y, más frecuentemente, señales de inflamación difusa. Los disturbios de conducción eléctrica cardíaca son más evidentes en adultos y las miopericarditis, evidenciadas por la presencia de ADRV y derrame pericárdico (observados al ECG y al ecocardiograma, respectivamente), siendo importantes tanto en adultos cuanto en niños.154,160,164 En brotes epidémicos fuera de la región Amazónica, se observó también elevada frecuencia de derrame pericárdico,155 enfatizando la necesidad de diagnóstico precoz en vista de la grave evolución, si no es prontamente diagnosticado y tratado.
Derrame pericárdico y/o pleural pueden ocurrir en más de la mitad de los casos por transmisión oral, sugiriendo que la pericarditis pueda ser más importante que el acometimiento del sistema de conducción eléctrica cardíaco durante la fase aguda.154,160,164
Nódulos dolorosos de miembros inferiores pueden estar asociados al edema, y han sido registrados invariablemente en los miembros inferiores en personas del sexo femenino. La expresión de eritema nodoso ha sido más frecuentemente observada en la transmisión oral. Descripciones similares en niños también fueron registradas en casuísticas argentinas, en las cuales algunas lesiones de piel y subcutáneas fueron etiquetadas como chagomas hematogénicos o metastáticos.169,171
Otras manifestaciones asociadas a esta forma de transmisión pueden estar presentes, como dolor abdominal (dolor epigástrico), ictericia de piel y mucosas, hepatomegalia e infarto de linfonodos. Estas son frecuentes en niños, acometiendo especialmente las cadenas de linfonodos cervicales, no siendo difusas. Esplenomegalia y diarrea son eventos raros.91,94
Han sido registrados casos graves en 13,3% de los casos, casi siempre relacionados a la miocarditis aguda y a las manifestaciones hemorrágicas digestivas graves. La presencia de hemorragia digestiva puede ser la expresión de la puerta de entrada,94 con presencia de infiltrado inflamatorio conteniendo amastigotes. Hay raros relatos de meningoencefalitis aguda.172 La hemorragia representó un cuadro exuberante en la epidemia ocurrida en el municipio de Navegantes, en el Estado de Santa Catarina (región Sur de Brasil), propiciando un diagnóstico diferencial con enfermedades graves que cursaban con cuadro ictero-hemorrágico, como leptospirosis, dengue y hantavirus.76 El coeficiente de letalidad ha sido más expresivo entre adultos con edades superiores a los 50 años - en general, de 5,6%.
En poco más de la mitad (54,1%) de los casos en la Amazonía, el diagnóstico ha sido realizado por el análisis parasitológico directo positivo.154,156,169 De esa forma, entre los casos con pruebas parasitológicas negativas, pero con fuerte sospecha clínica, se recomienda la realización de las pruebas serológicos concomitantes, particularmente considerando su mayor sensibilidad después del primer mes de historia clínica.
Tratamiento específico
Los casos en fase aguda tienen indicación de tratamiento específico inmediato y acompañamiento a largo plazo, con la finalidad de identificación de cura serológica.76,156,169 Para más detalles, consultar parte de tratamiento específico de este Consenso.
Considerando casuística de 179 pacientes tratados con benznidazol en la fase aguda de la Enfermedad de Chagas por transmisión oral, y que tuvieron un acompañamiento bajo protocolo de investigación, por un período medio de 5,6 años, hubo cura serológica en 26,3%, más evidente durante el cuarto año luego del tratamiento. Otros 2,7% evolucionaron para cardiopatía crónica de leve a moderada, y un 73,7% persistió con serologías reactivas, aunque con expresiva disminución de los niveles de anticuerpos.156
Reactivación de la Enfermedad de Chagas
El manejo de casos con reactivación de la Enfermedad de Chagas, en la vigencia de contextos de inmunosupresión, se constituye en un importante y emergente problema de salud pública en todos los países que albergan personas portadoras de la Enfermedad de Chagas crónica.
En particular, se destaca la elevada tasa de transmisión congénita en mujeres embarazadas coinfectadas (VIH/T. cruzi), superior a los 50% en los registros de la literatura, aconsejando un acompañamiento cuidadoso, con evaluación clínica e investigación directa periódica del parásito en esas mujeres.20,173-175
La reactivación de la Enfermedad de Chagas crónica en casos previamente infectados es definida por la positividad de los siguientes análisis, independientemente de presencia de otras señales y síntomas:159
1. Presencia del parásito por análisis microscópico directo en la sangre o secreciones biológicas: líquido cerebroespinal, pleura, pericardio, líquido ascítico, entre otros. En términos de sensibilidad, se indica la investigación del parásito en crema leucocitaria o por microhematocrito en la sangre o sedimento de otros materiales, o análisis más sensibles que la investigación directa en material biológico a fresco o mismo en frotis. La gota espesa es de realización e interpretación más difícil, y solo puede ser hecha por un técnico capacitado.
2. Análisis histopatológico de lesiones de los tejidos (paniculitis, miocarditis, encefalitis, enteritis, colpitis, entre otras), con encuentro de nidos del parásito en medio a infiltrado inflamatorio agudo.
La reactivación de la enfermedad de Chagas ha sido registrada inicialmente en pacientes inmunodeprimidos por neoplasias hematológicas;176 en el final de la década de 1980, y a partir de 1990, empezaron a ser relatados casos de reactivación de la Enfermedad de Chagas en personas infectadas por VIH.159,175,177,178-180
En el mayor estudio prospectivo en coinfección, la tasa observada en 53 pacientes ha sido de 20,8%;175 considerándose solamente los pacientes en seguimiento con coinfección (excluidos los internados con diagnóstico de reactivación), este valor ha sido de aproximadamente 10%.175
En trasplantes de riñones, se registran tasas de transmisión por donante infectado de 18,7%, y de reactivación en pacientes crónicos sometidos a trasplante tasas de 21,7%.181 En contextos de trasplante de corazón, se verificó una proporción de 26,4 a 40% de reactivación182 y, aunque sea prohibida la utilización de corazón de donante infectado en trasplante de corazón, se han descrito registros con ausencia de triaje de donantes en países no endémicos.157,158
En Brasil, además de la prohibición de la utilización de trasplantes de corazón y de intestino de donante con infección, se recomienda no utilizar trasplante de otros órganos de donantes infectados; situaciones excepcionales deben ser discutidas caso a caso por equipos especializados.183
La tasa de reactivación en trasplantes alogénicos de células madre hematopoyética es de 27,3%,184 y de 18,7% en hígado.185 La asociación de uso de corticosteroides al aumento de parasitemia y un posible efecto con medicamentos inmunosupresores en el tratamiento de mesenquimopatías han sido registrados, sin relación causal bien definida.186
Diagnóstico de la reactivación de la enfermedad de Chagas
Clínicamente, las manifestaciones más comunes de reactivación son fiebre, paniculitis (nódulos subcutáneos), miocarditis, meningoencefalitis, accidente vascular cerebral y síntomas como anorexia, mialgia, malestar o diarrea. Trabajos de series de casos sugieren que la reactivación asociada a la infección por VIH es seguida de mayor morbilidad y mortalidad que algunas otras situaciones de inmunosupresión, como trasplantes, en que es sugerido el monitoreo de los receptores de órganos, con elevada tasa de éxito para algunos grupos.181,184
En la reactivación asociada a la infección por VIH, hay registro de meningoencefalitis (74% de los casos), miocarditis (17,1%), y concomitancia de ambas (7,9%).48,49,159,175,187 Se diagnosticaron formas oligosintomáticas en madre que dio a luz a un niño con Enfermedad de Chagas grave y en paciente con cuadro febril en seguimiento de largo plazo, con buena respuesta terapéutica al benznidazol. Otras manifestaciones más raras de reactivación en pacientes inmunodeprimidos fueron observadas, como eritema nodoso, mielitis, peritonitis y colpitis.49,159
Análisis complementarios, tales como tomografía computarizada y/o resonancia nuclear magnética de cráneo, son fundamentales para localizar las lesiones y diferenciarlas de otras posibilidades diagnósticas, tales como neurotoxoplasmosis y linfoma primario del sistema nervioso central, y verificar si es posible indicar el análisis de líquido cerebroespinal para confirmación del diagnóstico por medio del reconocimiento de la presencia del parásito (y posterior cultivo), pues este análisis es más sensible que la investigación en sangre periférica. El líquido cerebroespinal revela una discreta pleocitosis (a costa de linfocitos y monocitos), glucorraquia normal o un poco disminuida y hiperproteinorraquia leve o moderada.48,49,159
La miocarditis en la reactivación por insuficiencia cardíaca se manifiesta por arritmia, choque cardiogénico y baja respuesta a los medicamentos sintomáticos para insuficiencia cardíaca congestiva. Son indicados el ecocardiograma y otros análisis complementarios para evaluación de la función cardíaca.49,159,175 El diagnóstico se facilita cuando, concomitantemente, hay un incremento de la parasitemia en la sangre periférica, sin embargo, la reactivación puede ocurrir en el tejido sin repercusión sistémica.49,159
La forma reactivada de la enfermedad de Chagas, en sus manifestaciones de meningoencefalitis y/o miocarditis, es considerada oficialmente en Brasil como enfermedad indicativa de inmunodeficiencia grave en individuos mayores de 13 años de edad, para la definición de caso de SIDA, desde enero de 2004.54
Para fines de vigilancia epidemiológica, solamente son considerados casos de reactivación de la Enfermedad de Chagas los que presenten diagnóstico definitivo de infección por T. cruzi por diagnóstico parasitológico, por medio de investigación directa en la sangre o en fluidos corporales (líquido cerebroespinal, líquidos pericárdico o peritoneal), asociado a:
meningoencefalitis - imagen de lesión cerebral con efecto de masa (resonancia nuclear magnética o tomografía computarizada, con o sin inyección de medio de contraste - captación anelar); y/o
miocarditis aguda - arritmias y/o insuficiencia cardíaca diagnosticadas por medio de electrocardiografía y ecocardiografía.
Factores asociados a la reactivación de la Enfermedad de Chagas
Se observa nivel de linfocitos T CD4+ abajo de 200 células/mm³ en más de 80% de los casos de reactivación,49,159,175 aunque raramente es mayor que 350 células por mm³.48,49
Los datos disponibles no sugieren la importancia de la carga viral del VIH como factor pronóstico para la reactivación o como factor relacionado a la gravedad de los casos. Por otro lado, se ha registrado el incremento de la carga viral del VIH en el contexto de la reactivación.49,159
En relación al papel del protozoario, estudios prospectivos han demostrado la importancia de la parasitemia elevada (observada por métodos cuantitativos) como factor predictivo de la reactivación (50% de los casos). Adicionalmente, se discute la participación de diferentes subpoblaciones de T. cruzi en la génesis de manifestaciones clínicas de la reactivación, siendo tal dato aún controvertido en la literatura.48,49,159
En situaciones de trasplante de corazón, fueron identificados como factores asociados: número de episodios de rechazo, presencia de neoplasias y, de manera tangencial, el uso de micofenolato mofetil.182
Evolución y pronóstico de la reactivación de la Enfermedad de Chagas
Caso no reciban tratamiento precozmente, gran parte de los pacientes con SIDA y reactivación de la Enfermedad de Chagas mueren antes o luego después del diagnóstico.159,175 De los pacientes que completan al menos 30 días de tratamiento, cerca de 80% sobrevive.159
El pronóstico en los casos con infección por VIH y reactivación de la Enfermedad de Chagas era reservado, antes de la aparición de la terapia antirretroviral altamente activa (HAART), con supervivencia con promedio estimado en 10 días.20 En el paciente inmunodeprimido, la gravedad depende del grado de inmunosupresión, de la carga parasitaria y de la sensibilidad del aislado al medicamento antiparasitario, y los registros de desenlaces favorables en trasplante de riñones son resultado de la monitorización, diagnóstico y tratamiento precoz. El cuadro clínico es bastante grave en recién nacidos con infección congénita de madre coinfectada, habiendo elevada morbilidad y mortalidad.173-175
FORMA CRÓNICA INDETERMINADA DE LA ENFERMEDAD DE CHAGAS
La Forma Crónica Indeterminada (FCI) tiene particular relevancia, por ser la forma clínica de mayor prevalencia en la enfermedad de Chagas, además del evidente carácter benigno y del bajo potencial evolutivo a corto y medio plazos.19,20,39,188-191
Con la reducción de la incidencia de la Enfermedad de Chagas aguda y con la mejora del manejo clínico, los casos de Enfermedad de Chagas crónica están teniendo su supervivencia ampliada, con avance en la edad, reflejando la tendencia a la reducción proporcional de la FCI en edades avanzadas.19,189,192-194
Por otro lado, desde el último Consenso Brasileño, en 2005,20 no surgió efectivamente ninguna estrategia aplicable de propedéutica clínica o complementaria pertinente al concepto clásico de FCI.
Criterios diagnósticos
Son considerados portadores de la FCI de la Enfermedad de Chagas los individuos en fase crónica con serología reactiva y/o análisis parasitológico positivo para T. cruzi188,189 que no presentan síndrome clínico específico de la enfermedad, y con resultados de ECG convencional, estudio radiológico de tórax, esófago y colon normales.188 Se destaca que no hay necesidad de utilización de otros análisis complementarios, además de los ya indicados previamente, para la definición de la FCI.
La expresión Forma Crónica Indeterminada fue empleada por la primera vez por Carlos Chagas, que la consagró por su uso,195-198 siendo consolidada por investigadores brasileños en 1984, principalmente para uso en investigaciones científicas.20,142,188,199
En estudios de campo y en la asistencia, para casos asintomáticos y con análisis físico, ECG convencional y radiografías de tórax y de esófago normales, ha sido utilizado el término FCI sin la realización de propedéutica radiológica de colon.19,189-191 Tal conducta se justifica considerando la baja disponibilidad y de ejecución de estos análisis complementarios en el real contexto de los sistemas nacionales de salud.
Tratamiento y seguimiento clínico
El tratamiento antiparasitario específico está indicado para todos los casos con FCI (ver la sección específica sobre tratamiento antiparasitario de este Consenso).20,39 Mientras el ECG esté normal, el pronóstico de los casos con Enfermedad de Chagas en la FCI es semejante al de la población general, siendo que la realización de esos análisis seriados puede detectar la evolución hacia la forma cardíaca.20,189,192,197 Con base en esa noción esencial, no se recomienda realizar otros análisis complementarios de rutina mientras el ECG sea normal.19,20,189-191
Los casos con la FCI deben ser orientados para que no sean candidatos a la donación de sangre, y, en principio, a la donación de tejidos y órganos.20,39 En virtud de esa benignidad, no se justifica la práctica, todavía común, de solicitud de análisis serológicos específicos para Enfermedad de Chagas en la evaluación preocupacional y en los análisis periódicos realizados por instituciones y/o empresas de naturaleza pública o privada.192,200-202
Con relación a los demás análisis complementarios, podrán solicitarse según las especificidades de la actividad laboral que el individuo vaya a ejercer. De la misma manera, en estos casos, no se recomienda el alejamiento temporario o definitivo de las actividades laborales.192,200-203
La práctica de actividades físicas regulares habituales no está contraindicada para portadores de la FCI. Para las actividades profesionales que involucran riesgo individual y colectivo que pueden requerir gran demanda de esfuerzo físico y/o estrés psicológico, se recomienda la adopción de la evaluación específica cardiológica complementaria. No existe restricción a la actividad sexual para los portadores de la FCI.192,200-202
Los portadores de la FCI deberán ser atendidos, preferentemente, en los servicios de atención básica (atención primaria a la salud), con la recomendación de realizar evaluación médica y ECG convencional una vez al año.20,202 Si constatada la evolución de la enfermedad, estos casos deberán ser encaminados para servicios de salud de mayor complejidad, para una orientación más precisa (con vistas a la definición de la secuencia de conductas), para manejo integrado con los equipos de atención básica (referencia y contrarreferencia).
La FCI no interfiere en el manejo de enfermedades asociadas y no justifica que sean descuidados el seguimiento y el tratamiento de comorbilidades que, eventualmente, puedan estar presentes en esa condición.49,197,203,204 Si surge inmunodeficiencia (adquirida o inducida) en casos con la FCI, debe ser dada atención especial a la posible reactivación de la enfermedad (ver parte específica sobre reactivación de la enfermedad de Chagas).20,49,159 El riesgo quirúrgico del portador de FCI no difiere del verificado en la población en general no infectada.20,194,200,202,203
En relación a las mujeres embarazadas infectadas por T. cruzi con esa clasificación, se recomienda atención con relación a la posibilidad de transmisión vertical, dar la oportunidad a evaluación adecuada del recién nacido (ver la parte específica sobre transmisión vertical).20,202,39 Mujeres portadoras de la FCI no deben restringir el amamantamiento, excepto en la vigencia de fisura y/o sangrado mamilar.20,202
Se destaca que los profesionales de salud deben evitar la adopción de cualquier práctica que pueda inducir estigma o prejuicio. Los servicios de salud deben ofrecer espacios y recursos para dar consejos, aclaraciones y orientación a la población con relación a las particularidades de esa forma de la enfermedad, recomendándose fuertemente que este abordaje sea conducido por equipo multiprofesional.20,189-191,193,202
FORMA CARDÍACA DE LA ENFERMEDAD DE CHAGAS
La Cardiopatía Chagásica Crónica (CCC) es la forma clínica sintomática más prevalente de la Enfermedad de Chagas, responsable por la elevada carga de morbilidad y mortalidad, con gran impacto social y laboral.4,19,20 Recientemente, se ha consolido la noción de que la patogenia de la agresión miocárdica en la fase crónica de la Enfermedad de Chagas, depende principalmente de la persistencia parasitaria y de la respuesta del sistema inmunológico desfavorable a ese estímulo infeccioso incesante.205-208
Entre las características más peculiares de la CCC, se destacan por su carácter inflamatorio e intensamente fibrosante, la presencia de arritmias ventriculares complejas en asociación con disturbios de la formación y conducción del estímulo eléctrico atrioventricular e interventricular, elevada incidencia de muerte súbita y de fenómenos tromboembólicos, además de disfunción ventricular directa y aneurismas ventriculares.209-214
Antes restricta a la transmisión vectorial de la Enfermedad de Chagas, hoy rara en Brasil, la Enfermedad de Chagas aguda y, consecuentemente, la carditis chagásica aguda, amplió su importancia epidemiológica tanto en Brasil cuanto en otros países, endémicos y no endémicos, debido a la reactivación de la enfermedad en individuos inmunocomprometidos, favorecida por la diseminación y cronificación de la infección por VIH/SIDA, bien como por el mayor acceso a técnicas de trasplante. Se añade a este escenario el reto representado por la endemia en la Amazonía, atribuida a la transmisión oral. Como consecuencia del cambio de perfil epidemiológico de transmisión de la enfermedad, recrudecieron los casos de cardiopatía chagásica aguda que, en la actualidad, presentan aspectos clínicos y epidemiológicos peculiares.76,91,92,169,170
Se destaca la importancia de la composición de una red de atención a la salud resolutiva para las personas con Enfermedad de Chagas, en especial el papel de la atención básica en el primer contacto y en la prevención secundaria de la enfermedad. A partir del reconocimiento del contexto de los casos clínicos, esta red de atención primaria debe integrarse a la red de apoyos matriciales/referencia para situaciones de mayor complejidad
1 - Miocarditis chagásica aguda por transmisión oral
En la Amazonía Legal, principalmente, se ha observado el registro sistemático de casos de la forma aguda, aislados o en brotes epidémicos , en microepidemias familiares, cuya principal forma de transmisión ocurre por vía oral, involucrando alimentos contaminados con heces de Triatominos.21,76 La presentación clínica difiere de la carditis chagásica aguda clásica (vectorial) principalmente por la ausencia de evidencia de puerta de entrada (chagoma de inoculación) y por el acometimiento de grupos comunitarios o familiares en brotes epidémicos, no siendo identificada una franja de edad de infección o gravedad preferente.91,169
Las manifestaciones clínicas de la enfermedad aguda por transmisión oral son variables, observándose desde cuadros asintomáticos hasta casos que evolucionan a insuficiencia cardíaca grave, choque cardiogénico y aún, muertes. Se puede presentar, también, como síndrome infeccioso inespecífico, con fiebre prolongada, en general por más de tres semanas.
Las manifestaciones de la carditis aguda están descritas en la (Figura 3).215
Análisis de Laboratorio
La telerradiografía de tórax puede ser normal o puede evidenciar cardiomegalia en grados variables y derrame pleural.
El ECG se muestra alterado en la mayoría de los casos agudamente infectados. Las principales señales electrocardiográficas son representadas por alteraciones inespecíficas de la repolarización ventricular, seguidas de intervalo QTc prolongado, sobrecarga de atrio izquierdo, bajo voltaje de los complejos QRS, bloqueos atrioventriculares, bloqueos de ramo, taquicardia sinusal y fibrilación atrial.216
El ecocardiograma puede detectar derrame pericárdico, regurgitación valvular atrioventricular, aumento de las dimensiones de las cámaras cardíacas, presencia de trombos intracavitarios y alteraciones de la función sistólica ventricular izquierda.
Tratamiento
El manejo farmacológico de la cardiopatía chagásica aguda es el mismo preconizado para el tratamiento de la insuficiencia cardíaca (IC) en miocarditis agudas de otras etiologías, basado en la utilización de rutina de la combinación de tres tipos de fármacos: diuréticos, inhibidores de la enzima de conversión de la angiotensina (IECA) o bloqueantes del receptor AT1 de la angiotensina II (BRA) y betabloqueantes, siempre asociados al tratamiento específico de la infección por T. cruzi con benznidazol o nifurtimox.203
La historia natural de la fase aguda de la carditis chagásica por transmisión oral de la Enfermedad de Chagas, todavía no es totalmente conocida. Los casos más graves, con disfunción ventricular, derrame pericárdico y fibrilación atrial, tienden a tener peor evolución en la fase aguda, necesitando de tratamiento en ambiente de terapia intensiva.
2 - Miocarditis chagásica aguda en inmunocomprometidos
Individuos infectados por T. cruzi, cuando también expuestos a agentes inmunosupresores o presentan otra enfermedad concomitante, como neoplasias y otras infecciones, especialmente la infección por VIH, pueden presentar reactivación de la Enfermedad de Chagas. La frecuencia de esta reactivación no es totalmente conocida, sin embargo, en estudio prospectivo en el cual fueron evaluados casos en el período pre y post-terapia antirretroviral, se verificó reactivación en 20% de los casos.48
El corazón parece estar involucrado en aproximadamente 30 a 40% de los casos de reactivación de la Enfermedad de Chagas en individuos coinfectados con VIH. Por lo tanto, la aparición de miocarditis, aisladamente, parece no ser común. El comprometimiento cardíaco es habitualmente caracterizado por cuadro de miocarditis aguda, con acometimiento difuso o focal del órgano. Clínicamente, se caracteriza por señales o síntomas de insuficiencia cardíaca (taquicardia, edema, hepatomegalia) o arritmias graves. En algunos casos se observan solamente alteraciones electrocardiográficas y, en otros, la existencia de miocarditis es confirmada únicamente por análisis histopatológico en material de biopsia endomiocárdica. El análisis anatomopatológico revela miocarditis aguda con infiltrado inflamatorio intenso, agresión a las fibras cardíacas con necrosis focales y gran número de formas amastigotes del parásito.217 En los casos en que hay, previamente, comprometimiento cardíaco (por CCC), se puede haber sobreposición de reactivación de la Enfermedad de Chagas con descompensación de la cardiopatía chagásica preexistente, siendo complejo definir si el cuadro se debe únicamente a la reactivación de la enfermedad de Chagas, a la miocarditis por el propio VIH o a la sobreposición de las dos condiciones.218 La miocarditis aguda por reactivación de la infección por T. cruzi puede ser confundida, también, con progresión y agravamiento naturales de la CCC. El diagnóstico diferencial entre esas dos condiciones es importante para la toma de decisión de realizar o no el tratamiento específico de la infección por T. cruzi, visto que muchos casos no toleran la medicación. Niveles altos de parasitemia son indicativos de reactivación, sin embargo, hay registro de casos que han evolucionado con baja parasitemia.219
Diagnóstico
La confirmación de la reactivación de la Enfermedad de Chagas en la inmunosupresión se realiza por visualización del parásito en la sangre periférica, en los fluidos orgánicos (líquido cerebroespinal, derrames cavitarios etc.), por métodos directos de observación o en los locales de las lesiones orgánicas (corazón, tegumento etc.) en individuos con coinfección.48
Tratamiento
No hay medidas específicas para este grupo de casos, debiendo seguir las recomendaciones basadas en evidencias desarrolladas para el tratamiento de la insuficiencia cardíaca de modo general.
La insuficiencia cardíaca aguda descompensada, resultante del fallo ventricular y de sus repercusiones hemodinámicas, se asocia a la activación neurohumoral y a los síntomas de congestión y/o bajo débito cardíaco. El reconocimiento precoz de esa condición y la aplicación de medidas terapéuticas adecuadas para la IC, asociada al tratamiento específico de la infección por T. cruzi, pueden reducir el elevado coeficiente de letalidad observado en los casos de miocarditis por reactivación en el contexto de los inmunocomprometidos.
Definición
Se define a la CCC como la presencia de alteraciones electrocardiográficas sugestivas de comprometimiento cardíaco, propias de la Enfermedad de Chagas, en individuo sintomático o no. Por tratarse de método de fácil acceso y con elevada sensibilidad y especificidad (cercano a los 90%), el ECG convencional alterado es utilizado, a priori, como elemento sugestivo del diagnóstico de CCC en personas crónicamente infectadas por T. cruzi.20
El acometimiento cardíaco en la fase crónica de la Enfermedad de Chagas incluye un amplio espectro de manifestaciones, variando desde la presencia de anormalidades clínicamente inaparentes, hasta formas graves, como insuficiencia cardíaca terminal, complicaciones tromboembólicas, arritmias ventriculares refractarias y muerte súbita.
Teniendo como referencia solamente el ECG convencional de 12 derivaciones, es posible establecer, de manera simplificada, el grado de comprometimiento cardíaco y la rutina de evaluación del portador de cardiopatía chagásica, de acuerdo a lo demostrado en el diagrama de flujo a seguir20 (Figura 4). Casos con alteraciones electrocardiográficas inespecíficas no serían diagnosticados con CCC, sin embargo, deben ser reevaluados según la concomitancia de síntomas y eventuales alteraciones de otros análisis adicionales.
BIRD = bloqueo incompleto de ramo directo; BDAS = Bloqueo divisional anterosuperior; BAV = bloqueo atrioventricular; ST-T = segmento ST-T; BCRD = bloqueo completo del ramo directo; EV = extrasístole ventricular; T = onda T; FC = frecuencia cardíaca; TVNS = taquicardia ventricular no sostenida; FA = fibrilación atrial; BAVT = bloqueo atrio ventricular total; BRE = bloqueo de rama izquierda; FEVE = fracción de eyección de ventrículo izquierdo; ICC = insuficiencia cardíaca congestiva; ECO = ecocardiograma; IC = insuficiencia cardíaca.
Figura 4 - Algoritmo para evaluación del individuo con Enfermedad de Chagas a partir del electrocardiograma (ECG) convencional
Estadificación de la CCC
Presencia de insuficiencia cardíaca grave (clase funcional III y IV de la New York Heart Asociation - NYHA) y disfunción sistólica global del ventrículo izquierdo son los factores pronósticos más importantes en la CCC.220-223 El ecocardiograma permite evaluar tanto la función miocárdica global cuanto la segmentaria, además de identificar marcadores importantes para estadificación de la cardiopatía, como dimensiones de las cámaras, alteraciones de movilidad segmentaria y presencia de aneurismas y trombosis murales. Por esos motivos y por constituir análisis no invasivo y de bajo costo, es de gran valor para la estadificación inicial de la CCC, en asociación con la clasificación funcional de la NYHA. Bajo el punto de vista pronóstico y terapéutico, es posible identificar cinco subgrupos distintos de casos con CCC, de acuerdo con lo presentado en la (Figura 5).223-226

Fuente: Adaptado de Xavier S y colaboradores, 2005.223
a) FEVE = fracción de eyección de ventrículo izquierdo.
Figura 5 - Estadificación inicial del comprometimiento miocárdico en la cardiopatía de Chagas crónica
Además del comprometimiento de la función miocárdica, disturbios de ritmo y anormalidades de la conducción del impulso eléctrico constituyen relevantes alteraciones en la CCC; en algunos casos, inclusive, las arritmias ocurren aisladamente, sin disfunción ventricular global, o solamente con pequeñas discinesias regionales.227-232
Habiendo disponibilidad de realizar el análisis, y, obligatoriamente, en todos los casos con sospecha de arritmias, el análisis de un registro electrocardiográfico de 24 horas (Holter) es indicado. De modo menos frecuente, se puede recurrir a una prueba ergométrica como sucedáneo al Holter, para poner en evidencia arritmias ventriculares durante el esfuerzo físico estandarizado. Cuando posible, deben realizarse los dos métodos, pues son complementarios en la evaluación de esos casos.
Hay aún, un grupo de casos en la fase crónica de la Enfermedad de Chagas (no incluido en la clasificación anterior), que presenta ECG normal, sin embargo, tiene alteraciones, generalmente discretas y no asociadas a mayor riesgo de óbito, en otras pruebas cardiológicas, como ecocardiograma, cintilografía miocárdica y resonancia nuclear magnética. Mientras tanto, como el riesgo de evolución hacia la forma cardíaca en esos casos, clásicamente definida, parece ser mayor en comparación a casos con Enfermedad de Chagas sin esas alteraciones, los mismos deben ser acompañados desde el punto de vista clínico de modo más frecuente.231,232
Pronóstico de la CCC
En revisión sistemática de los estudios que utilizaron análisis multivariado para evaluación del pronóstico en las CCC,233 cuatro variables pronósticas independientes fueron identificadas: clase funcional III/IV de la NYHA, cardiomegalia a la telerradiografía de tórax, disfunción sistólica del ventrículo izquierdo y taquicardia ventricular no sostenida (TVNS) al Holter. Utilizando esas cuatro variables, de forma integrada, es posible elaborar un algoritmo capaz de estratificar el pronóstico de casos con CCC (Figura 6).
Fuente: Adaptado de Rassi Jr. A y colaboradores, 2007.233
CF = clase funcional; NYHA = New York Heart Asociation; FEVE = fracción de eyección de ventrículo izquierdo; TVNS = taquicardia ventricular no sostenida.
Figura 6 - Algoritmo para estratificación del riesgo en la cardiopatía chagásica crónica
Es importante destacar que la presencia de clase funcional III o IV de la NYHA, per se, identifica casos de alto riesgo, una vez que prácticamente todos estos casos presentan disfunción ventricular sistólica al ecocardiograma y TVNS al Holter. Ya la combinación de disfunción ventricular con TVNS (independientemente de la clase funcional) identifica grupo con riesgo aproximadamente 15 veces mayor cuando comparado los casos sin esas dos variables.222,233,234
Manifestaciones clínicas de la CCC
Las manifestaciones clínicas de la CCC se agrupan en tres síndromes: arrítmica, insuficiencia cardíaca y tromboembólica. Esos síndromes se pueden presentar aisladamente o en asociación en el mismo caso, bien como asociarse a megaesófago y/o megacólon.235,236
Arritmias ventriculares
Las arritmias ventriculares son frecuentes en las Enfermedad de Chagas y son de los más variados tipos, comprendiendo las extrasístoles ventriculares (EVs) aisladas y en pares, la TVNS, la taquicardia ventricular sostenida (TVS) y la fibrilación ventricular (FV).237 Comúnmente se presentan en asociación, pudiendo expresarse, clínicamente, por palpitaciones, lipotimias, síncope y muerte súbita.237,238 Síncope y demás síntomas de bajo débito en casos con CCC deben ser rápidamente investigados, por el riesgo de arritmias ventriculares complejas y muerte súbita.
La extrasístole ventricular representa la arritmia más común. De inicio poco frecuente, monomorfa y aislada, se convierte en polimorfa y repetitiva con la evolución de la enfermedad. Holter y la prueba ergométrica son los métodos de elección para la detección de las arritmias ventriculares y, cuando posible, deben ser realizados en todos los casos con CCC, independientemente de la presencia de síntomas.42 La taquicardia ventricular puede presentarse de forma sostenida (duración igual o superior a 30 segundos o inferior a este período cuando interrumpida, eléctrica o farmacológicamente) y no sostenida (3 latidos cardíacos o más y duración inferior a 30 segundos).
La TVNS se relaciona con el grado de disfunción ventricular, ocurriendo en cerca de 40% de los casos con CCC asociada a alteraciones regionales de la contractilidad ventricular, y en 90% de los casos con disfunción sistólica global de ventrículo izquierdo asociada a insuficiencia cardíaca.222,237 Eventualmente puede ocurrir en casos con función ventricular normal.234 Hay evidencias de que la densidad (frecuencia) de la arritmia ventricular sea mayor en la insuficiencia cardíaca de etiología de Chagas de que en las de otras etiologías.239 La TVS, de peor pronóstico, puede ocurrir espontáneamente o ser reproducida al estudio electrofisiológico, análisis indicado en los casos cuya historia implique esta hipótesis diagnóstica y todavía no se haya conseguido su comprobación por los métodos no invasivos.240 La FV constituye la principal causa de muerte súbita en la CCC, siendo más frecuente cuando hay episodios previos de taquicardia ventricular, sin embargo, puede ser la primera manifestación de la enfermedad o su evento terminal, principalmente en los casos con grave disfunción ventricular y ICC.238
Tratamiento de las arritmias ventriculares
El tratamiento antiarrítmico tiene dos objetivos principales: controlar síntomas y prevenir la muerte súbita.237 Las arritmias ventriculares sencillas (EV aisladas y monomorfas), como no están asociadas a riesgo aumentado de óbito, deben ser tratadas solamente si causan síntomas limitantes a las personas acometidas, siendo que el tratamiento es indicado para utilizar dosis habituales de amiodarona, sotalol o betabloqueantes.
En casos con arritmias potencialmente letales (TVNS, TVS y FV), el antiarrítmico más eficaz y de uso más seguro es la amiodarona.241 Se debe estar atento a los efectos colaterales de este fármaco, que se relacionan generalmente con la dosis total acumulada, que puede desencadenar bradiarritmias graves, debiendo, en esos casos, evaluar la necesidad de implante de marcapasos definitivo. La toxicidad extra cardíaca, la disfunción tiroidea y anormalidades dermatológicas no son raras, mientras que la toxicidad pulmonar grave lo es.242 Se recomienda, como mínimo, evaluación periódica de la función tiroidea en casos bajo tratamiento con amiodarona.
En cambio, los casos con TVS (condición relativamente frecuente) y los recuperados de parada cardiorrespiratoria en ambiente extra hospitalario (condición mucho más rara) presentan riesgo elevado de óbito y merecen evaluación rigurosa. Para estos casos, se dispone no solamente de fármacos antiarrítmicos, sino también de técnicas de ablación del foco arrítmico por catéter (o, raramente, por cirugía) y, principalmente, de Desfibrilador Cardioversor Implantable (DCI).237
El tratamiento de las arritmias ventriculares en la CCC es descrito resumidamente en la (Figura 7). El tratamiento farmacológico y las recomendaciones de DCI están descritos en las Figuras 8 y 9, respectivamente.
Fuente: Adaptado de Rassi Jr A. Abordaje Actual de las Arritmias Ventriculares en la enfermedad de Chagas. Cardios, año 16, n. 51, mayo-junio 2013.
a) Sintomático; b) Asintomático; TVNS = taquicardia ventricular no sostenida; EV = extrasístole ventricular; FEVE = fracción de eyección de ventrículo izquierdo; TVS = taquicardia ventricular sostenida; Amio = amiodarona; AA = antiarrítmicos; CDI = cardioversores-desfibriladores implantables; BB = betabloqueantes adrenérgicos.
Figura 7 - Conducta delante las arritmias ventriculares en la Enfermedad de Chagas
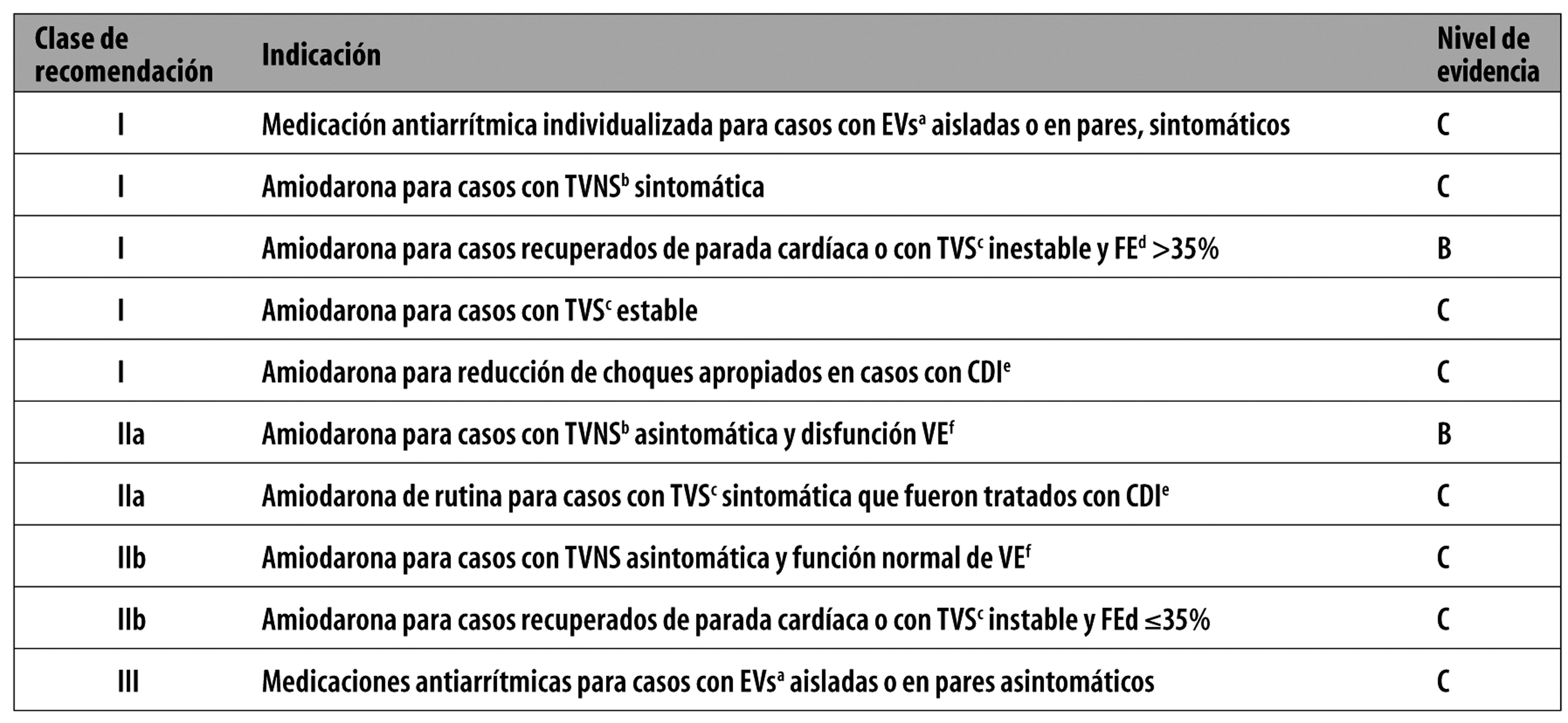
a) EV = extrasístole ventricular.
b) TVNS = taquicardia ventricular no sostenida.
c) TVS = taquicardia ventricular sostenida.
d) FE = fracción de eyección.
e) CDI = cardioversores-desfibriladores implantables.
f) VE = ventrículo izquierdo.
Figura 8 - Recomendaciones y niveles de evidencias para el uso de fármacos antiarrítmicos en el tratamiento de las arritmias ventriculares en la CCC

a) CDI = cardioversores-desfibriladores implantables.
b) TVS = taquicardia ventricular sostenida.
c) FE = fracción de eyección.
d) FEVE = fracción de eyección del ventrículo izquierdo.
e) TVNS = taquicardia ventricular no sostenida.
Figura 9 - Clase de recomendación y niveles de evidencias para el uso de CDI en el tratamiento de las arritmias ventriculares en la cardiopatía chagásica crónica
Arritmias supraventriculares
La fibrilación atrial es la arritmia supraventricular sostenida más frecuente en la CCC, siendo encontrada en 4 a 12% de los casos.229 Tiende a presentarse más tardíamente, frecuentemente asociada a la cardiomegalia pronunciada. El tratamiento consiste en el control de la frecuencia ventricular, que puede ser obtenido por el uso de fármacos que prolongan el período refractario del nodo atrioventricular (Nodo AV). Si hay insuficiencia cardíaca asociada, se da preferencia a los digitálicos y a los betabloqueantes (succinato de metoprolol, carvedilol o bisoprolol). Si la función ventricular es normal, se recomienda el uso de betabloqueantes convencionales (propranolol y atenolol) o de bloqueantes del canal de calcio (verapamilo y diltiazem) para control inicial de la frecuencia cardíaca, con evaluación posterior de la posibilidad de cardioversión eléctrica o farmacológica. La anticoagulación está indicada siempre que la fibrilación atrial esté asociada a la cardiomegalia y a la insuficiencia cardíaca, CHA2DS2VASc≥2, o cuando haya evidencias de trombosis intracavitaria o de episodios embólicos previos. El fármaco de elección es la warfarina, en dosis suficiente para mantener el factor de normalización internacional (RNI) entre 2 y 3.243
Bradiarritmias
El tratamiento de las bradiarritmias en la CCC no difiere del recomendado para las cardiomiopatías de otra naturaleza. Consiste en el implante de marcapaso cardíaco definitivo en casos sintomáticos o de bloqueos de alto riesgo. Esas recomendaciones se encuentran bien definidas en las Directrices Brasileñas de Dispositivos Cardíacos Electrónicos Implantables, publicadas en 2007.244
Es común en la CCC la asociación entre disturbios del sistema de conducción del corazón y arritmias ventriculares frecuentes y complejas. En esos casos, la terapia farmacológica antiarrítmica eficaz puede requerir el implante de marcapaso permanente, con el objetivo de prevenir eventual bloqueo atrio ventricular o bradiarritmia de alto riesgo inducida por el antiarrítmico. La elección del modo de estimulación es, hasta el presente momento, objeto de controversia en la literatura.
II - Síndrome de Insuficiencia Cardíaca (IC)
En la fase aguda de la Enfermedad de Chagas, puede ocurrir insuficiencia cardíaca, resultante de la intensa miocarditis. Aunque el desenlace pueda ser la muerte, en la mayoría de los casos es reversible, con evolución para la forma indeterminada de la enfermedad. Aproximadamente 30 a 40% de los casos con forma indeterminada desarrollaron la forma cardíaca, generalmente después de décadas de evolución.42,236
La forma cardíaca crónica, caracterizada por el aparecimiento gradual de alteraciones electrocardiográficas, es causada, por la lenta - sin embargo, persistente - destrucción de las fibras miocárdicas, causada por proceso inflamatorio crónico incesante, con intensa fibrosis reparativa y remodelado ventricular progresivo.208
En la fase inicial de la cardiopatía crónica, no es poco común que el ECG se muestre alterado, permaneciendo los individuos asintomáticos, capaces de ejercer actividad física irrestricta, por veces extrema. Se encuadran, por lo tanto, en la clase I de la NYHA.227,230,239
Raramente, en ese grupo de casos, la primera y única manifestación de la CCC es la muerte súbita.245 El más de las veces, se instala una progresiva reducción de la capacidad física, acompañando el deterioro de la función contráctil del ventrículo izquierdo, inicialmente en la forma de disinergias regionales y disfunción diastólica, y, posteriormente, con caída de la función sistólica global de la cámara, merced a los factores diversos que se asocian, como la progresiva destrucción de cardiomiocitos, las alteraciones microvasculares, la desestructuración del andamiaje muscular y la fibrosis.208,236,247 No es común que casos con Enfermedad de Chagas en la fase crónica presenten edema pulmonar agudo. También hay muchos casos con CCC en los cuales las manifestaciones iniciales de insuficiencia cardíaca son la fatiga y el edema, sin gran percepción de disnea.246,247 En esos casos hay un acometimiento precoz, a veces intenso, de la función sistólica del ventrículo derecho. En las fases más avanzadas de la enfermedad, cuando la insuficiencia cardíaca se manifiesta en plenitud, pueden surgir síntomas y señales predominantes de congestión sistémica, aunque, con congestión pulmonar poco expresiva. La telerradiografía de tórax muestra acentuada cardiomegalia, con poco refuerzo de la trama vascular pulmonar. Es importante la identificación de señales precoces de insuficiencia sistólica ventricular izquierda, ya que el tratamiento, en esa fase inicial, podría, en tesis, retardar el deterioro de la función cardíaca contráctil.42,227 Además de eso, la disfunción sistólica del ventrículo izquierdo es el más importante indicador de riesgo en la fase crónica de la cardiopatía de la enfermedad de Chagas.222,224,225
Tratamiento de la insuficiencia cardíaca en el caso con CCC
El tratamiento de la insuficiencia cardíaca tiene como objetivo reducir los síntomas, retardar la evolución de la disfunción ventricular y prolongar la vida.20
El tratamiento de la insuficiencia cardíaca de etiología de Chagas, así como de otras etiologías, debe ser abarcador, empezando por medidas generales, remoción de los factores que contribuyen para el agravamiento de la insuficiencia cardíaca y tratamiento de la síndrome propiamente dicha.248,249
Medidas generales
1- Dieta: se debe corregir la obesidad y mantener el peso ideal, evitar ingestión inadecuada de cloruro de sodio y, en casos específicos, aliviar los síntomas de disfagia y constipación intestinal.
2- control de la retención hídrica: ingestión balanceada de sal - hasta 3 a 4g/día de cloruro de sodio (enfermedad leve y moderada) y hasta 2g/día (casos más graves). Un modo sencillo y confiable de evaluar la retención hídrica es la realización del control diario del peso corporal. Variaciones superiores a 1kg por día son indicativas de retención de líquido. Un aumento de peso rápido y constante (1kg/día) constituye un indicio de que la insuficiencia cardíaca se está agravando. Las personas acometidas deben ser estimuladas a controlar el peso diariamente por la mañana (después de orinar y en ayuno). En la insuficiencia cardíaca grave, con hipervolemia y/o hiponatremia, la restricción de la ingestión de líquidos podrá ser necesaria.
3- control de los factores agravantes: conviene evitar la ingestión abusiva de alcohol y el uso de antiinflamatorios; controlar la hipertensión arterial, arritmias cardíacas, anemia o disturbios de la función tiroidea. Otras comorbidades pueden contribuir para el agravamiento de la insuficiencia cardíaca, como la enfermedad arterial coronaria y la diabetes mellitus.
4- Individualizar las recomendaciones de reposo o de actividad física, de acuerdo al grado de insuficiencia cardíaca y a la edad de la persona.
5- Vacunación contra influenza (anualmente) y antineumocócica 23-valente (un refuerzo después de cinco años para los casos con el sistema inmunológico comprometido, o adultos con edad superior a los 60 años que hayan recibido la primera dosis antes de los 65 años de edad).
Tratamiento medicamentoso de la IC causada por la Enfermedad de Chagas
En el momento de finalización de este Consenso, fueron publicados los resultados del estudio BENEFIT, un estudio clínico, doble ciego, multicéntrico, que probó la hipótesis de que el tratamiento tripanosomicida con benznidazol, comparativamente a placebo, podría modificar el pronóstico de pacientes con cardiopatía de Chagas crónica.250,251 Fueron evaluados 2.854 pacientes, designados aleatoriamente para recibir benznidazol o placebo por hasta 80 días, con un tiempo medio de seguimiento de 5,4 años, siendo observada reducción de la carga parasitaria, sin reflejo de agravamiento de los problemas cardíacos (estimado por complicaciones ocurridas durante seguimiento clínico, como muerte, arritmias ventriculares, implante de dispositivos, eventos tromboembólicos, insuficiencia cardíaca o trasplante cardíaco) (27,5% en el grupo con benznidazol y 29,1% en el grupo con placebo, Hazard Ratio (HR) = 0,93; IC 95%, 0,81-1,07; p = 0,31),251 difiriendo de los resultados de estudios observacionales prévios.252,253 Estos resultados desplazan el foco de atención al tratamiento del paciente con CCC para el tratamiento clásico de la disfunción sistólica y de la IC derivada de otras cardiopatías.254
El tratamiento de largo curso de la IC se basa habitualmente en la combinación de las siguientes clases de medicamentos: diuréticos; IECA o BRA; betabloqueantes adrenérgicos (BB); y antagonistas de la aldosterona.248 Fármacos inotrópicos positivos (como catecolaminas o milrinona) tienen su aplicabilidad restricta a condiciones de tratamiento intensivo y poco prolongado de la descompensación cardíaca, a excepción del digitálico, que puede ser administrado crónicamente en individuos sin bradiarritmias para aliviar síntomas, evitando descompensaciones cardíacas e internaciones hospitalarias, especialmente si hubiera fibrilación atrial con respuesta ventricular rápida.255
Los diuréticos del asa y los tiazídicos pueden ser utilizados separadamente o en combinación para aliviar los síntomas y señales de congestión venosa pulmonar y sistémica. Cuando sea imperativo el uso de dosis elevadas de diuréticos del asa, como la furosemida, se debe estar atento a la mayor probabilidad de aparición de hipopotasemia y/o hiponatremia que, en cambio, pueden agravar o desencadenar arritmias.248
En la CCC con IC o disfunción sistólica asintomática (FE <45%), hay indicación de administración crónica de IECA para reducir la morbilidad y la mortalidad o de BRA, cuando haya intolerancia a la IECA.256 Con el mismo objetivo, se recomienda el uso de espironolactona en casos con IC, en las clases funcionales de II a IV - NYHA.248 Además, se considera que los antagonistas de la aldosterona puedan traer beneficio adicional, cuando utilizados en la CCC, por sus propiedades antifibrosantes, demostradas en estudios experimentales. La combinación de hidralazina y nitrato es alternativa recomendable para tratar casos en clase funcional II-III que presenten contraindicación al uso de IECA o BRA (por ejemplo, insuficiencia renal progresiva o hipercalcemia).248
Es recomendable el uso de betabloqueantes adrenérgicos en adición al bloqueo del sistema renina-angiotensina-aldosterona (con IECA o BRA) para reducir la morbilidad y la mortalidad asociada a la enfermedad. Se supone que esos fármacos puedan contribuir para evitar el agravamiento del remodelado ventricular y la instalación de arritmias malignas y muerte súbita.257,258 Mientras tanto, el uso en dosis optimizada de los bloqueantes adrenérgicos puede ser dificultado en la CCC, en virtud de las bradiarritmias y de la necesidad frecuente de administración de amiodarona para el tratamiento de las taquiarritmias. Hasta el momento, no hay un consenso entre los especialistas en el manejo de la enfermedad de Chagas sobre cual de los fármacos, betabloqueantes o amiodarona, deba ser priorizado.
Formas complementarias de tratamiento de la IC causada por la Enfermedad de Chagas
El trasplante cardíaco es el tratamiento de elección en la fase final de la IC, a pesar de las innúmeras limitaciones de cuño médico y social que embargan su uso más amplio en casos con la enfermedad de Chagas. Los resultados obtenidos en series seleccionadas de casos comparativamente a los observados en casos con IC de otras etiologías, muestran evolución más favorable en los casos con Enfermedad de Chagas trasplantados. Entre otros posibles factores, eso posiblemente se debe al hecho de que, en esas series, los casos con Enfermedad de Chagas eran más jóvenes y presentaban número menor de comorbilidades.259,260 No hay indicación definitiva de profilaxis, sin embargo, se recomienda un activo control de la posible reactivación de la enfermedad, principalmente en el primer año post trasplante, cuando la inmunosupresión es más intensa, debiendo ser prontamente iniciado el benznidazol en la dosis de 5mg/kg/día, mantenido por 60 días, obteniendo de esta manera buena evolución clínica.100
No hay evidencias en que se base la indicación de una rutina de la terapéutica de resincronización cardíaca (TRC). Además de que no existen estudios controlados explorando de forma científicamente válida esa posibilidad terapéutica, en la CCC el bloqueo completo de la rama derecha es frecuente y, en presencia de esta condición, las evidencias sobre los beneficios de la TRC, aún en otras etiologías de IC, son todavía más escasas y menos convincentes.203,244
Terapias con base en implantes celulares fueron recientemente exploradas en un único estudio, debidamente controlado. Sus resultados no evidenciaron cualquier beneficio, ni aún sobre desenlaces sustitutos como la fracción de eyección ventricular izquierda.261
Las clases de recomendaciones y los niveles de evidencias para el tratamiento de la insuficiencia cardíaca en la CCC están resumidos en la (Figura 10).

a) IECA = inhibidores de la enzima de conversión de la angiotensina.
b) BRA =bloqueantes del receptor AT1 de la angiotensina II.
c) FEVE = fracción de eyección del ventrículo izquierdo.
d) VE = ventrículo izquierdo.
e) CF = clase funcional.
f) NYHA = New York Heart Association.
g) FC = frecuencia cardíaca.
h) FA = fibrilación atrial.
i) BB = beta bloqueantes adrenérgicos.
j) IC = insuficiencia cardíaca.
Figura 10 - Recomendaciones y niveles de evidencia para el tratamiento de la IC en casos con cardiopatía chagásica crónica
III - Síndrome tromboembólica
Eventos tromboembólicos sistémicos y pulmonares son comunes en la CCC, siendo los pulmonares ciertamente subdiagnosticados cuando considerados los resultados de estudios necroscópicos.262 Los eventos embólicos están favorecidos por combinación de varios factores, siendo los más relevantes la estasis venosa, la reducción del débito cardíaco y la trombosis mural intracardíaca, favorecida por las disinergias ventriculares localizadas (por ejemplo, aneurisma apical), dilatación de las cámaras cardíacas y fibrilación atrial en estadios más avanzados de la cardiopatía.
Prevención de complicaciones tromboembólicas en la CCC
Los accidentes embólicos en el sistema nervioso central constituyen la forma más grave de tromboembolismo en la CCC y contribuyen para la elevada morbilidad y mortalidad de la enfermedad.263 La base científica para el tratamiento antitrombótico en la CCC se apoya en el estudio de cohorte prospectiva de 1.043 casos, que evaluó el riesgo y definió las estrategias de prevención del accidente vascular encefálico (AVE) cardioembólico.264 En ese estudio, la incidencia de AVE ha sido de 3,0% o 0,56% al año, y el análisis estadístico multivariado permitió la composición de una puntuación de riesgo para la aparición de AVE: la presencia de disfunción sistólica del VE contribuyó con 2 puntos; la presencia de aneurisma apical, alteración primaria de la repolarización ventricular en el ECG y edad superior a 48 años contribuyeron con 1 punto cada. La warfarina estaría indicada para casos con 4-5 puntos (en este subgrupo, hay incidencia de AVE de 4,4% versus 2,0% de sangrado grave al año). En el subgrupo con puntuación de 3 puntos, las tasas de embolia y sangrado con anticoagulante oral se equivalen, pudiendo ser indicado AAS o warfarina. En los casos de 2 puntos, con baja incidencia de AVE (1,22% al año), ha sido recomendado AAS o ninguna profilaxis. Los casos con 0-1 punto, con incidencia de evento cercano a cero, no necesitarían de profilaxis. Obviamente que, en casos con trombo intracavitario, fibrilación atrial asociada a CHA2DS2VASc≥2 y accidente embólico previo, el empleo de anticoagulante oral es siempre aconsejable, manteniendo el RNI entre 2 y 3.264 Las recomendaciones para anticoagulación oral en la CCC están descritas en la (Figura 11).
Abordaje del embarazo en la CCC
La CCC ocupa el segundo lugar entre las cardiopatías presentes en el ciclo gravídico puerperal, mostrándose inferior solamente a la cardiopatía reumática. La mayoría de las mujeres embarazadas con Enfermedad de Chagas son asintomáticas u oligosintomáticas, portadoras de las formas indeterminada o cardíaca inicial.
Los riesgos de la gestación en la mujer con cardiopatía de Chagas dependen del estado funcional cardíaco, bien como de la presencia y de la gravedad de las arritmias. Casos con IC y/o arritmias deben ser desaconsejados a embarazarse. Las mujeres embarazadas en esas condiciones requieren acompañamiento y cuidados especiales, por la posibilidad de agravamiento durante el embarazo. En la consulta inicial de la mujer embarazada cardiópata con Enfermedad de Chagas deben ser solicitados, además de los análisis de rutina, ECG y ecocardiograma, para evaluación de las dimensiones cardíacas y función ventricular y Holter de 24 horas, para identificar disturbios de conducción y arritmias.265 Deben ser siempre observadas las contraindicaciones relativas y absolutas para el uso de fármacos con acción sobre el sistema cardiovascular o con potencial teratogénico.
Las mujeres embarazadas portadoras de CCC deben ser acompañadas en centros de referencia para gestación de alto Riesgo, una vez que podrán presentar necesidad de atención de alta complejidad. Se destaca la importancia de proceder a todas las evaluaciones recomendadas durante el prenatal, incluyendo, necesariamente, la prueba anti VIH.20
Riesgo quirúrgico en portadores de cardiopatía chagásica crónica
La evaluación del riesgo quirúrgico en la cardiopatía chagásica se basa en las informaciones disponibles para otras cardiopatías. Mientras tanto, las características peculiares de la CCC, principalmente aquellas relacionadas con la presencia de disfunción autonómica, arritmias complejas y disturbios de la conducción intraventricular del estímulo, pueden provocar respuestas diferentes al trauma quirúrgico.266
Casos con comprometimiento miocárdico más grave (CF IV-NYHA o FE <30%; disfunción sistólica moderada, pero con arritmia compleja; fibrilación atrial; dilatación importante de ventrículo izquierdo; BAV total y disfunción del nodo sinusal) tienen más probabilidad de presentar complicaciones perioperatorias.
Portadores de bradicardia sinusal asintomática que serán sometidos a cirugía bajo anestesia general deben ser monitoreados desde el punto de vista electrocardiográfico durante el procedimiento, que debe ser realizado en locales donde haya posibilidad de implante de marcapaso en carácter de emergencia. Si la bradicardia es sintomática, debe ser evaluado el implante preventivo de marcapaso.
Cuando haya fibrilación atrial con frecuencia ventricular alta, arriba de 90 latidos por minuto, independientemente del tipo de anestesia, los casos deben ser operados bajo monitorización electrocardiográfica continua y bajo digitalización previa. En los casos con fibrilación atrial con frecuencia ventricular inferior a 60 latidos por minuto, se debe considerar la posibilidad de que ocurra una acentuada caída de la frecuencia cardíaca por acción anestésica. Se recomienda, en esos casos, que el procedimiento quirúrgico sea realizado bajo monitorización electrocardiográfica continua y en locales donde haya posibilidad de implante de MP en carácter de emergencia. Los mismos cuidados deben ser tomados en relación a los casos que presenten BAV asociado a bloqueos de rama, por la posibilidad de que desarrollen BAV total durante el acto quirúrgico por acción de los agentes anestésicos.266
Casos con arritmias ventriculares complejas deben ser evaluados al Holter y operados después de instituir la terapéutica antiarrítmica adecuada. El procedimiento quirúrgico debe ser realizado bajo monitorización electrocardiográfica continua y en locales donde haya desfibrilador.
La evaluación preoperatoria de casos portadores de MP cardíaco involucra el conocimiento de la arritmia que motivó su implante, bien como las características del generador. Además de la historia clínica, se pueden obtener datos importantes en la tarjeta que los portadores de MP reciben y que identifica las principales características del dispositivo, como fecha del implante, frecuencia cardíaca programada, modalidad de funcionamiento y fabricante.
Los principales riesgos asociados a la presencia de marcapaso durante procedimientos quirúrgicos o diagnósticos consisten en alteración del umbral de funcionamiento del aparato (por acción de fármacos, alteración de los niveles de potasio sérico y cambios de la impedancia torácica por ventilación pulmonar), fibrilación ventricular (conducción de la corriente eléctrica del electrocauterio por el electrodo intracardíaco del marcapaso) y, finalmente, daño, inhibición o reprogramación del sistema por el electrocauterio, por cardioversión o por resonancia nuclear magnética. Siempre que sea posible, deben utilizarse electrocauterios bifásicos (bipolares), porque en ellos la corriente eléctrica permanece circunscrita entre la región de la cirugía y el electrocauterio, reduciendo el riesgo de escape y de interferencia con el dispositivo.244,267
En todo caso, el bisturí eléctrico debe ser utilizado lo mínimo posible, en intervalos cortos e irregulares, manteniendo la monitorización, no solamente del ECG, sino también del pulso, a través de la pletismografía u oxímetro de pulso. Caso ocurra bradicardia o taquicardia acentuadas durante el uso del bisturí eléctrico, se puede utilizar un imán sobre el marcapaso, lo que lo hace funcionar en su respuesta magnética programada. Conviene prestar atención al hecho de que la colocación del imán debe ser restricta a cortos períodos de utilización del bisturí eléctrico. El paciente debe ser orientado en el postoperatorio a retornar a la clínica de seguimiento del marcapaso para evaluación de su funcionamiento y eventual reprogramación del generador.267
En los casos con CDI, se recomienda la presencia del técnico o experto en la sala de cirugía, debiendo ser apagada la función anti taquicardia, con el equipo preparado para el tratamiento de todas y cualesquiera eventuales arritmias, inclusive con cardioversión eléctrica.244,267
En caso de necesidad de cardioversión eléctrica en los individuos con marcapaso, lo ideal sería utilizar placas adhesivas en posición anteroposterior del tórax, alejadas al máximo del generador, utilizando el mínimo de energía posible para resolución de la arritmia. De la misma forma, los umbrales y el funcionamiento del marcapaso deben ser idealmente evaluados después del procedimiento.244
Evaluación médico laboral
La CCC constituye importante causa de incapacidad laboral en áreas endémicas, en donde debe ser objeto de acciones de vigilancia en salud del trabajador, incluyendo la atención básica. El análisis clínico minucioso, con especial atención al aparato cardiovascular, es un componente básico de las evaluaciones funcional y médico laboral en la CCC.268
En esas evaluaciones, se deben considerar: el grado de disfunción ventricular; la presencia, la magnitud y la complejidad de los trastornos de conducción y de ritmo; y el relato de tromboembolismo. Es importante también considerar las características de la actividad laboral ejercida por el trabajador, especialmente la necesidad de esfuerzo físico intenso o continuado en la actividad, así como el grado de su cualificación profesional y la posibilidad de inscribirlo en el programa de rehabilitación profesional.
La edad del trabajador también debe ser considerada, visto que la posibilidad de evolución de la cardiopatía es tanto mayor cuanto más joven sea el trabajador y viceversa. De modo general, cuanto peor la fracción de eyección y mayor el diámetro ventricular, peor el pronóstico y mayor el grado de incapacidad laboral.269
La presencia de cardiomegalia y de disfunción ventricular significativa implica en incapacidad laboral para actividades que requieren esfuerzo físico y en invalidez, cuando no sea posible la rehabilitación profesional. En toda evaluación funcional, pronóstica y de la capacidad laboral de un individuo con Enfermedad de Chagas, se debe considerar la gran variabilidad clínica de esos casos, aún cuando encuadrados en una misma fase de clasificación de comprometimiento cardíaco. A menudo, aunque no siempre, trastornos avanzados de la conducción del estímulo se asocian a la gravedad del comprometimiento miocárdico, llevando a la necesidad de evaluación complementaria del grado de disfunción miocárdica, especialmente en los casos en que el trabajador ejerza actividad física intensa y de riesgo personal o social (como, por ejemplo, los pilotos de aviación).270
FORMA DIGESTIVA DE LA ENFERMEDAD DE CHAGAS
La forma digestiva de la Enfermedad de Chagas, aunque pueda acometer a todos los órganos del tracto gastrointestinal, se manifiesta, desde el punto de vista práctico, por el acometimiento del esófago y del intestino grueso, llevando al aparecimiento de megaesófago y megacolon, respectivamente.20 La asociación de megaesófago y megacolon en casos con indicación de cirugía es de aproximadamente 92% y de megaesófago, megacolon y cardiopatía, de 65%.271
Casos con síndrome clínica digestiva compatible con las descritas a seguir, en contextos de riesgo y/o vulnerabilidad para enfermedad de Chagas, si todavía no hubieran realizado, deberían ser aconsejados y orientados a la realización de investigación específica de la infección por T. cruzi.20
Manifestaciones digestivas en la fase aguda de la Enfermedad de Chagas
Las manifestaciones clínicas son, la mayoría de las veces, atípicas y discretas, siendo los síntomas relacionados al tracto gastrointestinal prácticamente imperceptibles. Por lo tanto, hay relatos de la aparición de hemorragia digestiva en los casos de transmisión oral y de disfagia en raros casos de transmisión vectorial.20
Manifestaciones digestivas en la fase crónica de la Enfermedad de Chagas
Las manifestaciones digestivas de la Enfermedad de Chagas se concentran en el esófago y en el colon y son, básicamente, disfagia y constipación, resultantes de alteraciones crónicas de los órganos que pueden llevar a megaesófago y/o megacolon.20 Sin embargo, como la enfermedad causa lesiones al sistema nervioso autónomo a lo largo de todo el tracto gastrointestinal, pueden ocurrir alteraciones anátomo-funcionales de las glándulas salivares, del estómago, de las vías biliares extrahepáticas, del duodeno, intestino delgado, intestino grueso y aún, de región no perteneciente al tracto gastrointestinal (TGI), como el uréter. La prevalencia de infección por Helicobacter pylori y de alteraciones características histológicas y endoscópicas gástricas ha sido semejante en pacientes con o sin Enfermedad de Chagas. Además de eso, estudios están demostrando que H. pylori representa la principal causa de gastritis en los pacientes con Enfermedad de Chagas.272
Los síntomas y señales más comunes del sistema digestivo, en la fase crónica de la Enfermedad de Chagas, están descritos a seguir.
Diagnóstico clínico
Disfagia es el principal síntoma de pacientes con acometimiento grave del esófago. Otras quejas, asociadas a la disfagia, ocurren en los casos de megaesófago: ptialismo, hipos, odinofagia, regurgitación, sensación de sofocación nocturna, neumonía aspirativa y desnutrición.20 En las fases iniciales de la enfermedad, el paciente refiere una sensación de obstrucción, en el xifoides, después de la ingestión de sólidos y, tardíamente, después de la ingestión de líquidos, especialmente cuando ingeridos fríos. La disfagia progresa lentamente y es bien tolerada por muchos años. Por eso, pacientes con acalasia frecuentemente no buscan atención en servicios de salud hasta que la disfagia progresiva interfiera en su estilo de vida. Se observa que los propios pacientes modifican espontáneamente sus hábitos alimentarios para atenuar la disfagia.
Pacientes con acalasia se alimentan lentamente, ingieren grandes volúmenes de agua para llevar los alimentos hasta el estómago, suelen flexionar el dorso, elevar el mentón, tender el cuello, o andar para auxiliar el vaciamiento esofágico. La regurgitación del alimento no digerido es común mientras la enfermedad progresa, con riesgo de aspiración, pudiendo llevar a neumonía, absceso pulmonar, bronquiectasia, hemoptisis y broncoespasmo. Grandes distensiones del esófago dilatado pueden producir disnea, por compresión del bronquio fuente o del hilio pulmonar.
El acometimiento esofágico ocurre en varios grados, con gran variación de los aspectos morfológicos y diferencias del comportamiento motor del esófago, variando desde alteraciones mínimas del tránsito esofágico hasta formas avanzadas de dolicomegaesófago, con tiempo de tránsito esofagogástrico de los alimentos extremamente prolongado.20 Teniendo en vista los aspectos prácticos y terapéuticos, los pacientes con megaesófago pueden ser clasificados en grupos, dependiendo del grado de dilatación del órgano, de acuerdo con lo que se verifica en la (Figura 12).273

A = Grupo I; B = Grupo II; C = Grupo III; D = Grupo IV
Grupo I - los pacientes de este grupo presentan diámetro del esófago dentro de los límites normales, sin estasis alimentaria, sin embargo, con el aumento del tiempo de tránsito de los alimentos de la boca hasta el estómago. Predominan disturbios motores funcionales sin dilatación correspondiente. Grupo II - Presenta dilatación moderada del esófago y pérdida de la coordinación motora. Olas secundarias y terciarias pueden ser evidenciadas en el esofagograma. Grupo III - Ocurre dilatación más acentuada que la del grupo II, tiempo de tránsito más prolongado y actividad motora disminuida. El esófago se comporta como un tubo inerte. Grupo IV - Consiste de formas avanzadas con gran dilatación y alongamiento del esófago (dolicomegaesófago).
Fuente: Rezende, 1982.273
Figura 12 - Clasificación radiológica del megaesófago, en grupos
La mayor parte de los casos de megaesófago se encuentra en los grupos II y III. El grado del megaesófago no refleja, necesariamente, la duración de la enfermedad. Hay casos que evolucionan rápidamente para las formas avanzadas, mientras otros permanecen estabilizados en las fases iniciales. La disfunción del esfínter inferior del esófago es mayor en los casos en que la alteración motora del cuerpo del esófago es más evidente. Aunque exista correlación entre el grado de megaesófago y el síntoma disfagia, no es raro encontrar pacientes con voluminosos megaesófagos con queja discreta o aún, sin queja de disfagia.273
La incidencia de cáncer de esófago en pacientes con acalasia idiopática es de 3,3%, correspondiendo a incremento de más de 15 veces en relación a la población general, sin acalasia.274,275
Análisis Complementarios
- Radiografía sencilla de tórax en PA o perfil: en los casos de megaesófago grado III o IV, la gran dilatación del esófago ocupando el mediastino posterior puede ser identificada (Figura 13: la y B).

Fuente: Radiografías de paciente atendido en el Hospital de Clínicas de la Universidad Federal de Minas Gerais (UFMG).
Figura 13 - Radiografía sencillas del tórax en PA y perfil, en que se evidencia gran dilatación del esófago ensanchando el mediastino posterior
- Radiografía contrastada del esófago: demuestra no solamente el grado de dilatación del esófago, permitiendo clasificar el megaesófago, sino también las alteraciones funcionales, tales como olas peristálticas anormales o ausentes y el tiempo de vaciamiento del contenido esofágico al estómago. Son características radiológicas del megaesófago por enfermedad de Chagas: incremento del diámetro y del tiempo de vaciamiento (Figura 14); tercio distal afilado; retención de restos alimentarios; alongamiento del esófago/mediastino; disminución de la cámara de aire gástrica.

Nota: imágenes hechas 2 minutos (A) y 6 horas después de ingestión del contraste (B). Notar hilos de marcapaso implantado en ese paciente debido al bloqueo AV de cardiopatía de Chagas concomitante. Fuente: Radiografías de paciente atendido en el Hospital de Clínicas de la UFMG.
Figura 14 - Estudio contrastado del esófago de paciente portador de megaesófago (grupo III)
- Electromanometría del esófago: método útil en el diagnóstico diferencial de otras afecciones que evalúen con disfunción motora, expresa por disfagia. En los pacientes sin dilatación, o con dilatación discreta del esófago (grupos I y II), pueden ocurrir olas de presión no coordinadas en el cuerpo del esófago y relajamiento incompleto o atípico del esfínter inferior del esófago (EIE), a pesar del estudio radiológico todavía no haber demostrado anormalidad.276
- Endoscopia: aunque no sea fundamental para la confirmación diagnóstica de megaesófago, debe ser realizada para evaluar el grado de inflamación de la mucosa y para alejar la presencia de lesiones neoplásicas en pacientes con disfagia, varices y ulceraciones. Es análisis útil en los casos de haber necesidad de dilatación forzada del cardia con balón y en los casos de inyección de toxina botulínica.
Diagnóstico Clínico
Las principales señales y síntomas del megacolon son constipación, diarrea paradoxal (constipación intercalada por períodos de diarrea), disquecia, distensión abdominal y fecaloma.20 La manometría anorrectal es útil para el diagnóstico de la acalasia del esfínter interno del ano. La dilatación del colon ubicada en el recto y sigmoidea se observa mejor por estudio de radiografía contrastada, pudiendo ser detectada en hasta 80% de los casos, sin embargo, puede ocurrir también solamente en el recto, solamente en el sigmoide o en todo el colon.277 Se debe destacar que casos de constipación grave en pacientes con megacolon idiopático no infectados por T. cruzi son indistinguibles, bajo el punto de vista clínico, del megacolon por Enfermedad de Chagas.278
Análisis Complementarios
- Radiografía sencilla de abdomen: megacólones voluminosos pueden ser detectados en radiografías sencillas de abdomen, especialmente en la presencia de fecaloma. Es útil, todavía, en los casos sospechosos de vólvulo, pues puede demostrar la rotación del sigmoide y la dilatación del asa de delgado causada por la obstrucción (Figura 15).

Fuente: Radiografía de paciente atendido en el Hospital de Clínicas de la UFMG.
Figura 15 - Radiografías sencillas de abdomen en caso de vólvulo del sigmoide. Notar posición anómala del sigmoide causada por la dilatación y la imagen característica del asa de delgado secundaria a la obstrucción en consecuencia del vólvulo
- Radiografía contrastada del colon (enema opaco): es el análisis estándar oro para el diagnóstico de megacolon. Evidencia dilatación y/o alongamiento del colon, presencia de fecaloma y anormalidades en la situación anatómica del sigmoide (Figura 16).
Fuente: Radiografía de paciente atendido en el Hospital de las Clínicas de la UFMG.
Figura 16 - Enema opaco revelando presencia de imagen hipodensa característica de fecaloma
- Tomografía computarizada y resonancia nuclear magnética: esos análisis de imagen, más modernos, vienen ocupando lugar de destaque en la evaluación de los pacientes portadores de Enfermedad de Chagas y, de a poco, sustituyendo los métodos convencionales de imagen. Ambos métodos presentan mayor sensibilidad para la evaluación de tejidos pericolónicos y/o periesofágicos, pudiendo detectar infiltraciones y masas no visibles en la radiografía convencional y fecalomas con más acuidad que el enema opaco (Figura 17: A, B y C).

Fuente: Tomografías computarizadas de pacientes atendidos en el Hospital de Clínicas de la UFMG.
Figura 17 - Tomografía computarizada de abdomen, demostrando gran megaesófago con nivel hidroaéreo del contraste ingerido (A); megacolon con gran dilatación del colon lleno de aire, con fecaloma en el recto (B); y megacolon con imagen predominante de fecaloma en el sigmoide dilatado (C)
- Endoscopia digestiva: es útil en el megacolon, para evaluar el grado de inflamación de la mucosa, detectar ulceraciones, necrosis de la pared, perforación o sangrado, y para alejar presencia de lesiones asociadas, especialmente las neoplásicas.
Es particularmente importante en los casos sospechosos de vólvulo del sigmoide, pudiendo ser procedimiento terapéutico, porque puede evitar laparotomía. Si la reducción del vólvulo del sigmoide no es posible por el análisis endoscópico, el tratamiento quirúrgico de urgencia es de indicación absoluta.
Megaesófago
Considerando que no sea posible restaurar la fisiología normal del órgano debido a las alteraciones irreversibles de la denervación, el objetivo del tratamiento es el de actuar sobre el esfínter inferior del esófago acalásico, removiendo el obstáculo funcional al pasaje de alimentos para el estómago. El tratamiento, excepto el específico, no cura la enfermedad - tiene como finalidad, tan sólo, mejorar la disfagia.20
Tratamiento Clínico
Indicado en pacientes con edad avanzada, sin historia previa de complicaciones, oligosintomáticos, con alto riesgo para tratamiento quirúrgico, que no aceptan someterse a tratamientos invasivos, o a los atendidos en hospital sin infraestructura adecuada para cirugía de ese porte.20 Las bases para el tratamiento son especificadas a seguir.
1. Dar consejos y educación en salud, con la finalidad de ofrecer mayor seguridad al paciente sobre su condición clínica.
2. Adecuación de los hábitos alimentarios.
Se recomienda al paciente masticar bien los alimentos, ingerir pequeños volúmenes cada vez y usar proporción de alimentos líquidos, pastosos y sólidos adecuada a la intensidad de la disfagia que presenta. Alimentos irritantes, muy condimentados, calientes o helados agravan la disfagia y deben ser evitados. Por el riesgo de regurgitación y aspiración, debe ser evitada la ingestión de alimentos por el paciente antes de acostarse.
En casos de megaesófago de los grupos III y IV, en pacientes desnutridos, candidatos al tratamiento quirúrgico, está indicada nutrición enteral balanceada. En los casos en que el pasaje de catéter nasal entérico no sea posible, se puede hacer nutrición parenteral, por catéter venoso central. En las dos situaciones, la intervención posee carácter temporario.
3. Uso de fármacos.
Medicamentos que relajan las fibras musculares lisas del esfínter inferior del esófago pueden aliviar los síntomas de disfagia. Entre estos medicamentos, se incluyen:
Dinitrato de isosorbida, en dosis de 2,5mg a 5mg, por vía sublingual, 15 minutos antes de cada comida.
Nifedipina, en dosis de 10mg, por vía sublingual, 30 minutos antes de cada comida. El uso de nifedipina debe ser realizado con precaución, considerando que la población en enfoque tiene considerable asociación de cardiopatía chagásica crónica, con riesgos de hipotensión y choque por el medicamento.
4. Toxina botulínica - la toxina botulínica del tipo A, aplicada localmente, bloquea la liberación de acetilcolina de las terminaciones nerviosas presinápticas y produce denervación química. El tratamiento es eficaz en 70% de los pacientes, y la duración media de la remisión de los síntomas es de 16 meses. Pacientes con más de 50 años de edad responden mejor al tratamiento.280 El resultado del tratamiento del megaesófago con toxina botulínica es peor cuando comparado al realizado por medio de dilatación o cirugía (nivel IIB). Aunque sus efectos sean temporarios, la inyección de toxina botulínica puede ser indicada en casos seleccionados, presentando la ventaja de poder ser repetida varias veces.
La dosis de toxina botulínica es de 20 unidades, inyectada en cada uno de los cuadrantes del esfínter inferior del esófago. Una limitación de ese tratamiento es que el procedimiento debe ser guiado por endoscopia.
5. Dilatación por balón - la dilatación neumática está indicada a los pacientes del grupo I, pudiendo hacerse, también, en pacientes de los grupos II y III que presenten contraindicación para cirugía. Puede también ser utilizada en el preoperatorio de pacientes de los grupos II y III, candidatos al tratamiento quirúrgico del megaesófago, con el objetivo de mejorar la condición nutricional preoperatoria. En los pacientes del grupo IV, por el riesgo de perforación del esófago redundante, la dilatación no es recomendada.
El procedimiento es realizado por medio de balón acoplado al manómetro, introducido por vía endoscópica, el que torna el método más seguro. El resultado del tratamiento del megaesófago por dilatación con balón trae alivio de la disfagia en 71% de los pacientes,280 sin embargo, el efecto es transitorio, empeorando con las dilataciones sucesivas a lo largo del tiempo.
1. Cirugía convencional (laparotomía)
No trata la causa básica de la enfermedad, sin embargo, restaura la deglución del paciente. Los conocimientos adquiridos sobre la patogénesis y la fisiopatología del megaesófago permiten decir que la cardiomiotomía conocida como cirugía de Heller,281 asociada a algún tipo de funduplicatura parcial,282 es el procedimiento quirúrgico más indicado para los casos de megaesófago de grados I a III. El índice de respuesta es de cerca de 90%,280 tornándose el resultado más duradero y más eficaz que el de la dilatación neumática. Para los dolicomegaesófagos, todavía no hay un consenso entre los cirujanos, lo que hace con que diferentes técnicas quirúrgicas todavía sean indicadas.
2. Cirugía video laparoscópica
Esta técnica fue introducida en Brasil a partir del inicio de los años 1990, concomitantemente con la disponibilidad de modernos instrumentos quirúrgicos, tales como bisturís electrónicos y grapadoras. La experiencia de los cirujanos con la innovación tecnológica y su utilización en el tratamiento de los casos de acalasia por megaesófago relacionado a la Enfermedad de Chagas resultó en reducción de la morbilidad y la mortalidad observada en la cirugía convencional del megaesófago por Enfermedad de Chagas (nivel IA). La cardiomiotomía por videolaparoscopia, asociada el algún tipo de válvula antirreflujo, principalmente las hechas por funduplicatura parcial, se tornó la cirugía estándar y prácticamente uniformizó las conductas quirúrgicas para los pacientes con esa afección.283
3. Cirugía robótica
La cirugía robótica se constituye en una alternativa probablemente ventajosa, en relación a los demás procedimientos. Sin embargo, la complejidad de su ejecución y los elevados costos asociados dificultan la aplicación rutinera en la práctica de los servicios de salud.20
El tratamiento del megaesófago por miotomía asociada a la cirugía antirreflujo presenta riesgo de perforación del esófago durante su realización, constituyendo complicación que puede ser grave. La cirugía robótica por efectuar movimientos programados y precisos disminuirá, ciertamente, el índice de esa complicación.
4. Cirugía endoscópica
El avance tecnológico y la especialización de los profesionales permitieron que la miotomía fuera realizada por medio de procedimiento totalmente endoscópico.
Esa cirugía es hoy conocida por la sigla POEM (per-oral endoscopic myotomy) y constituye la técnica de Heller hecha por cirugía endoscópica transluminal por orificios naturales (Natural orifice translumenal endoscopic surgery - NOTES). La propuesta de ese procedimiento ha sido hecha por profesionales del sector de endoscopia de la Mayo Clinic y, después de test en animales, ha tenido amplia divulgación para aplicación en seres humanos en 2012. La técnica POEM parece ser método seguro, y constituye actualmente, alternativa eficaz para el tratamiento de la acalasia. El procedimiento es realizado con la persona en decúbito dorsal bajo anestesia general, y consiste en abordaje de la luz esofágica con gastroscopio de alta definición con visión frontal. Inyección de solución salina coloreada con índigo carmín es aplicada, para criar un espacio de seguridad entre la mucosa y la submucosa del esófago. En seguida, se procede a la incisión longitudinal de 2cm de extensión, en la posición de dos horas, que es hecha en la mucosa, 10 a 15cm proximal a la junción gastroesofágica, para exposición de la camada submucosa. Se hace un túnel en la submucosa, desde el punto de sección de la mucosa hasta 2 a 3cm más allá de la junción esofagogástrica (JEG).284
La miotomía del esfínter inferior del esófago es generalmente realizada iniciándose a 2cm distal a la apertura de la mucosa hasta abajo de la JEG. Vía de regla, la miotomía debe tener extensión mínima de 6cm (en media, 8 a 10cm), siendo 2cm en el esófago, 2 a 3cm en el esfínter inferior del esófago y 2cm en el cardia. La disección del túnel submucoso se hace en plano anterior al de la muscular de la mucosa, y la sección muscular del esófago se realiza solamente en la camada circular de la muscular propia, no habiendo necesidad de sección de la camada muscular longitudinal.
Datos de 14 publicaciones en lengua inglesa demuestran que, de los 804 pacientes sometidos al procedimiento POEM, ha habido suceso terapéutico documentado en más de 80% (nivel A1).285
La técnica es menos invasiva y los pacientes no presentan reflujo gastroesofágico, como verificado en aquellos casos sometidos a la miotomía por la técnica quirúrgica convencional laparotomía o videolaparoscópica. La familiarización del endoscopista con el método permite el cerramiento seguro de perforaciones menores y la hemostasia adecuada del sangrado (nivel B1).286 Habiendo eventual perforación más extensa del esófago, o sangrado más intenso, la actuación del cirujano puede ser necesaria.
Megacolon
Tratamiento clínico
1. Dar consejos y educación en salud, con el objetivo de proporcionar al paciente mayor seguridad sobre su condición clínica.
2. Adecuación de los hábitos alimentarios - conviene enfocar en el mayor grado de autocuidado. Pacientes que evacuan dos a tres veces por semana sin relato de fecaloma deben ser orientados a ingerir mayor cantidad de líquidos, frutas y vegetales. El uso de dieta rica en fibras en esos pacientes es controvertido, porque existe el recelo de que el exceso de fibras pueda favorecer la formación de fecaloma y el agravamiento de los síntomas. La dieta puede ser la habitual, con restricción de alimentos obstipantes. Se recomienda la ingestión hídrica abundante, en volumen de por el menos 2 litros/día, bien como de alimentos que favorezcan el funcionamiento intestinal.
3. Debe atender sistemáticamente al deseo de evacuar y crear el hábito de evacuar en horas determinadas.
4. Laxativos - están indicados para pacientes que no responden adecuadamente a las medidas dietéticas. Los laxativos osmóticos (manitol la 20% o polietilenoglicol) son los más indicados. Aceite mineral es eficaz también.
5. Medicamentos potencialmente obstipantes - opioides, diuréticos, antidepresivos, antihistamínicos, anticonvulsivantes, antiparkinsonianos, entre otros - solamente deben ser prescritos bajo monitorización médica.
6. Remoción del fecaloma - los fecalomas, localizados en el recto, pueden ser retirados manualmente con uso de anestesia, si no responden a las medidas dietéticas y medicamentosas.
7. Lavado intestinal - pacientes que no responden satisfactoriamente al tratamiento medicamentoso y dietético, o aquellos con fecalomas más altos, deben ser tratados con clister de glicerina o de suero fisiológico. Para los pacientes resistentes al tratamiento clínico, se indica el lavado intestinal con 500 a 1.000ml, dos veces por semana. En los que presentan fecalomas, el procedimiento puede ser repetido dos a tres veces al día, teniendo el cuidado de no utilizar más del que 3,5 litros de solución al día. La experiencia con esos tratamientos demuestra que, con la remoción del fecaloma y la normalización de las evacuaciones, el diámetro del colon tiende a volver a lo normal.
Tratamiento quirúrgico
1. Cirugía electiva
El tratamiento quirúrgico del megacolon está indicado a los pacientes que presenten gran dilatación del sigmoide, episodios repetidos de vólvulo, retención prolongada de heces, recurrencia de fecalomas y dificultades para hacer aplicación de enemas en ambiente domiciliar.
A la similitud del que ocurre con el tratamiento quirúrgico del megaesófago, el objetivo del tratamiento del megacolon es mejorar o normalizar el ritmo intestinal, por lo tanto, el síntoma predominante es la constipación.
Exceptuados los casos de emergencia por vólvulo, sangrado, obstrucción o perforación, en los cuales procedimientos de urgencia deben ser adoptados (colonoscopía o cirugía), la cirugía del megacolon es electiva y debe ser bien planificada.
Las técnicas quirúrgicas convencionales más comúnmente utilizadas son la rectosigmoidectomía anterior y la cirugía propuesta originalmente por DuHamel para tratamiento de la Enfermedad de Hirschsprung.287 Con la aparición y la difusión de la cirugía videolaparoscópica, la realización de la cirugía de DuHamel, por este método, se convirtió en el estándar oro para el tratamiento de esos casos.288
2. Cirugía de urgencia
Las indicaciones quirúrgicas de urgencia para tratamiento del megacolon son:
vólvulo del sigmoide que no se resolvió por endoscopia; y
ulceración, necrosis y/o perforación, en consecuencia del mismo volvo o de la endoscopia.
La cirugía a ser realizada va a depender del estado del paciente y de la situación anatomopatológica, variando de sencillas colostomía a fijación del sigmoide o resección de la parte acometida con anastomose primaria o retardada.
TRATAMIENTO ANTIPARASITARIO DE LA ENFERMEDAD DE CHAGAS
Aunque haya divergencias con relación a los porcentuales de cura en el tratamiento antiparasitario de la enfermedad de Chagas, existen evidencias consistentes sobre su utilidad en ambas fases (aguda y crónica) de la enfermedad y en todas las formas clínicas de la infección crónica, una vez que las lesiones orgánicas dependen exclusivamente (fase aguda) o por el menos en parte (fase crónica) de la presencia del parásito. Además, hay supresión evidente de la parasitemia con la terapéutica antiparasitaria vigente.289,290
Por otra parte, el porcentual de cura y su comprobación dependen de algunos factores, como la fase y el tempo de duración de la enfermedad, la edad del paciente, los análisis utilizados para la evaluación de eficacia terapéutica y el tiempo de seguimiento post tratamiento, las condiciones asociadas y la susceptibilidad de la cepa de T. cruzi a los medicamentos antiparasitarios.
Tratamiento en la fase aguda
En la fase aguda, el tratamiento debe ser realizado en todos los casos y lo más rápido posible, independientemente de la vía de transmisión del parásito (clase I, nivel de evidencia B). Estudios de series de casos seguidos por más de 20 años comprobaron porcentuales de curación arriba superiores a 50% en esta fase de la enfermedad.291
Tratamiento de la Enfermedad de Chagas congénita
Los casos diagnosticados como Enfermedad de Chagas congénita deben recibir tratamiento antiparasitario (más detalles en la parte específica de transmisión vertical),20 independientemente de que el diagnóstico haya sido realizado por métodos parasitológicos en las primeras semanas o por medio de pruebas serológicas convencionales nueve meses después del nacimiento (clase I, nivel de evidencia B).
Tratamiento de la fase crónica
Deben ser tratados todos los niños con edad igual o inferior a 12 años portadores de la Enfermedad de Chagas en su fase crónica (clase I, nivel de evidencia A). Estudios prospectivos, randomizados, doble ciego y controlados con placebo, realizados en niños asintomáticos en edad escolar, demostraron cura de la infección por T. cruzi en 58% a 62% de los casos.292,293 En estudio no controlado que involucró países de Latinoamérica,294 se mostró gran diversidad regional en la respuesta al tratamiento, medida por la tasa de seroconversión de 92,7% en Honduras, para niños de 9 meses a 12 años y de 58,8% en un cuarto de los casos estudiados menores de 15 años; ha habido variaciones en Bolivia - de 0% en Sucre a 5,4% en Entre Ríos, siendo que en las última región esta tasa ha sido mayor en niños menores de 5 años (24,4%) que en niños entre 5 y 9 años de edad (4,6%).294
Para adolescentes con edad entre 13 y 18 años y adultos con infección crónica, cuando se consigue establecer que la fase aguda ocurrió hasta 12 años antes (considerado como infección reciente), es usualmente recomendado el tratamiento antiparasitario,20,294 aunque falten evidencias consistentes a partir de estudios randomizados justificando tal conducta295 (clase IIa, nivel de evidencia C).
Para los individuos con Enfermedad de Chagas en la franja de edad de 19 a 50 años, sin infección reciente documentada, el tratamiento antiparasitario debe ser considerado de forma individualizada, sea en la FCI120,252 (clase IIa, nivel de evidencia B), sea en la forma crónica determinada sin cardiopatía avanzada42,120,122,252 (clase IIb, nivel de evidencia C). De forma específica, el tratamiento de mujeres crónicamente infectadas en edad fértil, realizado antes de embarazo, tiene el efecto de reducir la transmisión congénita.104,109
Algunos estudios observacionales están demostrando que, en este grupo de edad, el tratamiento antiparasitario es capaz de impedir el aparecimiento o retardar la progresión de la enfermedad de los casos en proporción.42,120,252,295,298 Este resultado llevaría a la reducción de las complicaciones de la enfermedad, en especial a las relacionadas a la cardiopatía. Estudios experimentales clásicos en ratones ya documentaron la regresión total o parcial de lesiones miocárdicas iniciales y la prevención del desarrollo de cardiopatía con el tratamiento antiparasitario.299-300 Mientras tanto, la regresión de lesiones inflamatorias y fibróticas, observada en los estudios experimentales, todavía no ha sido verificada en el contexto clínico.20
Estudios provenientes de la observación de series de casos comprobaron un porcentual de curación de, al menos, 20% de los casos tratados en la fase crónica tardía,301 debiendo señalar que la demostración de cura dependió, en varios trabajos, del tiempo de seguimiento de los casos tratados, que deberá ser de más de dos décadas para la fase tardía. Se verificó también el incremento de la seroconversión para casos presentando enfermedad no aguda y sin fallo cardíaco.290
Para individuos con edad superior a 50 años, sin cardiopatía avanzada, no hay estudios justificando el tratamiento antiparasitario. Estudio observacional en individuos mayores con infección por T. cruzi demostró que la enfermedad se encuentra presente y activa, con reducción del porcentual de pacientes en las FCI y aumento de los de la forma cardíaca,195 no estando estos individuos completamente fuera del plano terapéutico etiológico de la Enfermedad de Chagas, el cual puede ser individualizado (clase IIb, nivel de evidencia C).
El tratamiento antiparasitario no debe ser realizado en individuos en la fase crónica de la Enfermedad de Chagas con la forma cardíaca grave, una vez que no hay evidencias de beneficios clínicos en la evolución de estos pacientes251,289,291,295,296,302,303 (clase III, nivel de evidencia C).
Recientemente ha sido publicado251 el conjunto de resultados del BENEFIT, un estudio prospectivo, multicéntrico, randomizado, doble ciego, controlado con placebo (placebo versus benznidazol). Representa el primer estudio a evaluar el efecto del tratamiento específico por hasta 80 días en relación a desenlaces cardíacos y a la infección por T. cruzi.
Fueron evaluados los efectos del benznidazol en la reducción de la morbilidad y la mortalidad en 2.854 pacientes con cardiopatía chagásica crónica establecida.250,251 Después de 5,4 años de seguimiento, los resultados no arrojaron diferencia estadística significativa entre los dos grupos en relación al desenlace primario compuesto, incluyendo muerte, taquicardia ventricular sostenida, insuficiencia cardíaca reciente, implantación de un cardioversor desfibrilador o marcapaso, trasplante cardíaco, parada cardíaca con resucitación, accidente vascular cerebral u otro evento tromboembólico.251 Estos hallazgos, a principio, parecen indicar divergencia de las tasas considerablemente más bajas de detección del parásito por medio de la PCR en la sangre en este mismo estudio después del tratamiento con benznidazol.303
El tratamiento con benznidazol dentro del protocolo utilizado en el estudio BENEFIT probablemente no tiene efecto preventivo relevante sobre la progresión de enfermedad cardíaca en pacientes con Enfermedad de Chagas avanzada251 (clase III, nivel de evidencia B). Entretanto, se destaca la gravedad de la Enfermedad de Chagas a partir de este estudio y la consecuente necesidad de diagnóstico y tratamiento oportunos, fundamentados en manejo cualificado, en especial de la enfermedad cardíaca: 503 pacientes evolucionaron a óbito dentro de 5 años (246 en el grupo con benznidazol y 257 en el grupo placebo), mientras que 63% de los pacientes (en ambos los grupos de tratamiento) que tuvieron fracción de eyección del ventrículo izquierdo inferior a 40% evolucionaron con uno de los desenlaces primarios del estudio.251
Es evidente, por lo tanto, la necesidad apremiante de estructurar una red de atención a la salud cualificada para personas con Enfermedad de Chagas, en la perspectiva del cuidado integral, sin pérdidas de oportunidades de diagnóstico y tratamiento. Menciónese no solamente el manejo clínico longitudinal en sí en términos de las formas clínicas de la enfermedad, en especial las formas avanzadas de cardiopatía con protocolos ajustados a las realidades locales, sino también la posibilidad de dar oportunidad al tratamiento específico para las personas con indicaciones terapéuticas ya basadas en evidencias más consistentes.303
Además de esto, llama la atención en ese estudio la menor frecuencia de efectos adversos graves al benznidazol comparativamente a estudios anteriores,251,303 lo que refuerza la real posibilidad de insertarse, de forma más amplia, el tratamiento específico de la Enfermedad de Chagas en la red de atención básica (primaria) a la salud no solamente en Brasil, sino también en otros países endémicos.
La forma digestiva no contraindica el tratamiento antiparasitario de la enfermedad de Chagas, debiendo realizarse la corrección del megaesófago, con la finalidad de posibilitar el pleno tránsito del medicamento y, consecuentemente, su absorción20,302 (clase IIa, nivel de evidencia C).
Tratamiento de casos con inmunosupresión
Casos con inmunodeficiencia, como los usuarios de medicamentos inmunosupresores para el tratamiento de neoplasias, en trasplantes y otras enfermedades, y casos con inmunodeficiencia, como aquellos con coinfección T. cruzi/VIH, pueden desarrollar un cuadro de reactivación de la enfermedad de Chagas.181,184,304 Las conductas indicadas en estos casos son tematizadas a seguir.
Trasplantes
En trasplantes en general, es necesario saber si el donante o el receptor presentan Enfermedad de Chagas, considerando el riesgo de transmisión o de reactivación de la enfermedad. Así, son tres los escenarios posibles:
Donante con Enfermedad de Chagas y receptor sin enfermedad de Chagas
El candidato a la donación de órganos con serología reactiva para T. cruzi debe recibir tratamiento antiparasitario por 60 días antes del procedimiento. En situaciones especiales que exijan el trasplante antes de terminar el tratamiento, el trasplante podrá ser realizado, en lo posible, no antes de 14 días de tratamiento (clase I, nivel de evidencia C).
2. Orientaciones para el receptor cuando el donante sea tratado
a) Considerar el tratamiento etiológico logo después del trasplante, manteniéndolo por 60 días mediante intensa inmunosupresión (clase IIa, nivel de evidencia C).184
b) No tratar y proceder a la monitorización secuencial con evaluaciones clínica, parasitológica (investigación directa de T. cruzi en la sangre periférico semanalmente, hasta 60 días), métodos parasitológicos indirectos (hemocultivo y/o xenodiagnóstico) - seguimiento del receptor mientras dure la inmunosupresión - y serología (análisis a los 30 y 60 días post trasplante).181,184,305 en los casos en que la monitorización no sea posible, se recomienda tratamiento etiológico.
A seguir, deben ser realizados análisis clínicos y serológicos a los 3 meses y a los 6, 9 y 12 meses de seguimiento, y análisis parasitológicos directos/indirectos (hemocultivo y/o xenodiagnóstico artificial a los 3, 6 y 12 meses) o PCR. Posteriormente, la evaluación es repetida a cada 6 meses, mientras persista la inmunosupresión (Clase IIa, nivel de evidencia B)181,184,305. Se destaca que, en algunos centros de referencia, se realiza la PCR y no los análisis parasitológicos indirectos.
En cualquier momento, caso sea detectada infección aguda por medio de análisis parasitológicos o serológicos, el tratamiento etiológico convencional deberá ser instituido (Clase I, nivel de evidencia C). Fuera de los controles habituales, cualquier señal clínica sospechosa de cuadro infeccioso deberá ser investigada por medio de análisis parasitológicos, y los casos positivos deben recibir el tratamiento convencional para la fase aguda. Desde 2009, la posibilidad de que pacientes con Enfermedad de Chagas sean aceptados como donantes de órganos en Brasil quedó restricta por la legislación vigente en trasplantes de órganos.183
En Brasil, el Decreto nº. 2.600 de 2009, que aprobó el Reglamento Técnico del Sistema Nacional de Trasplantes, establece que es obligatoria la realización de serología para infección por T. cruzi en las siguientes situaciones:183 (i) en todas las donaciones, siguiendo los mismos algoritmos utilizados para triaje de donantes de sangre; (ii) para fines de inscripción de los potenciales receptores de órganos en el Registro Técnico Único; (iii) en todos los potenciales donantes ya fallecidos, de órganos, tejidos, células o partes del cuerpo antes de la asignación de los injertos. Establece, además, criterios de clasificación de donantes vivos y fallecidos y de los potenciales receptores para distribución de órganos, tejidos, células y partes captadas. Hay indicación de que “el equipo informará si acepta o no” para los módulos relativos a riñón, riñón/páncreas, páncreas, hígado y pulmón. En la referida resolución, la no aceptación se refiere solamente el módulo de corazón. Para los módulos tejidos oculares, células madre hematopoyéticas, tejidos musculoesqueléticos, piel y tejidos cardiovasculares, no hay mención sobre temas relativos a la infección por T. cruzi.183
3. Orientaciones con relación al receptor sin Enfermedad de Chagas - en los casos en que el donante con Enfermedad de Chagas no haya sido tratado o haya recibido tratamiento incompleto, tres conductas podrán ser adoptadas en relación al receptor:
a) Iniciar el tratamiento antiparasitario luego después del trasplante, manteniéndolo por 60 días (Clase IIa, nivel de evidencia C). Conducta recomendada caso la monitorización secuencial indicada en el Ítem C abajo no sea posible.
b) Iniciar el tratamiento inmediatamente después de la cirugía, manteniéndolo inicialmente por 14 días. a partir de entonces, proceder la monitorización secuencial con evaluación clínica, parasitológica y serológica (Clase IIa, nivel de evidencia C o sin evidencia). En caso de seroconversión, introducir el tratamiento antiparasitario indicado para la fase aguda.
c) No tratar y proceder a la monitorización secuencial con evaluaciones clínica, parasitológica - Clase IIa nivel de evidencia B181,184,305 (investigación directa de T. cruzi en la sangre periférica semanalmente, hasta 60 días), y análisis parasitológicos indirectos y serológicos (no 30º y 60º días después del trasplante). A seguir, análisis clínicos y serológicos y parasitológicos (directos/indirectos/PCR) deben ser realizados a cada dos meses en hasta un año de seguimiento; posteriormente, a cada seis meses, mientras persista la inmunosupresión (tiempo dependiente de la modalidad y del tipo de trasplante). Se destaca que en algunos centros se realiza la PCR, y no los análisis parasitológicos indirectos.
En cualquier momento, caso sea detectada infección aguda por análisis parasitológicos o serológicos (IgM o seroconversión), el tratamiento antiparasitario convencional deberá ser instituido.
Fuera de los controles habituales, cualquier señal clínica sospechosa de cuadro infeccioso deberá ser investigada por medio de análisis parasitológicos, y los casos positivos deben recibir el tratamiento convencional para la fase aguda.20,302
Hay relatos de pequeño número de casos en trasplante de riñón con profilaxis antiparasitaria por 14 días en receptores de trasplante de riñón sin Enfermedad de Chagas a partir de donantes con Enfermedad de Chagas308 y otro trabajo también realizó profilaxis por 60 días en receptores (sin Enfermedad de Chagas) de hígado de donantes con Enfermedad Chagas306 como estrategia habitual, no observándose seroconversión en los receptores que sobrevivieron que, como se sabe, puede estar ausente en cerca de 20% o más de los pacientes en el período pos trasplante. Se considera profilaxis la utilización de medicamento antiparasitario en pacientes sin infección documentada por identificación del parásito o evidencia de seroconversión. En este texto, aún cuando administrado durante el mismo período de tratamiento (60 días), el término profilaxis ha sido usado si el medicamento ha sido indicado en ausencia de infección documentada en el receptor. Los trabajos citados no son controlados y, aunque hayan sido realizados en pequeño número de casos en trasplante de riñón e hígado, no utilizaron monitorización sistemática de parasitemia, siendo los resultados finales basados en la ausencia de seroconversión en los pacientes que no fallecieron.
Todavía, desde 2009, la posibilidad de que pacientes con Enfermedad de Chagas sean aceptados como donantes de órganos en Brasil es restricta por la reglamentación de trasplantes,184 con el triaje serológico sistemático limitando este tipo de donación en los individuos con infección por T. cruzi. Mientras tanto, estos mismos órganos podrán funcionar como “órganos marginales” en algunas situaciones específicas.184,305,307
Donante sin Enfermedad de Chagas y receptor con enfermedad de Chagas
En estos casos, la complicación esperada es la reactivación de la Enfermedad de Chagas en el receptor, en consecuencia de la utilización de medicamentos inmunosupresores para evitar o tratar rechazos. Habiendo tiempo hábil, el tratamiento antiparasitario convencional pre-trasplante podrá ser instituido. Caso contrario, no deberá impedir la realización del trasplante, y las conductas a seguir podrán ser adoptadas (Clase IIa, nivel de evidencia C).
Profilaxis de los episodios de reactivación. en trasplantes de corazón, el tratamiento antiparasitario puede fallar.100,307
Monitorización clínica y parasitológica del receptor post trasplante, como realizada en el caso con donante con Enfermedad de Chagas y receptor sin enfermedad de Chagas, y tratamiento convencional precoz de los episodios de reactivación.181,184,305 La monitorización durante el período post trasplante en el trasplante cardíaco es obligatorio, tanto de la sangre como de los tejidos, por la mayor sensibilidad de los métodos en el local de reactivación (miocardio).
Donante y receptor con Enfermedad de Chagas
Ambos deben ser considerados como portadores de la forma crónica de la Enfermedad de Chagas y evaluados para tratamiento antiparasitario, de acuerdo con lo descrito para casos con la forma crónica. Después del trasplante, el receptor deberá ser monitoreado desde el punto de vista clínico y parasitológico para el diagnóstico de eventuales episódicos de reactivación, como en el caso de donante con Enfermedad de Chagas y receptor sin enfermedad de Chagas. Caso ocurra reactivación, introducir el tratamiento convencional para la fase aguda (Clase IIa, nivel de evidencia C). Los episodios de reactivación pueden ocurrir más de una vez, debiendo ser tratados cuando documentados, razón por la cual se recomienda la monitorización parasitológica sistemática mientras persista la inmunosupresión.
Coinfección T. cruzi/VIH
Estudios observacionales han demostrado que, en la vigencia de coinfección T. cruzi y VIH, sin ocurrencia de SIDA, ocurre la evolución natural de ambas enfermedades, debiendo seguir las orientaciones para tratamiento antiparasitario de la Enfermedad de Chagas en sus fases aguda y crónica o monitorización de la parasitemia, si posible cuantitativamente49,159,175 (Clase IIa, nivel de evidencia C) (ver parte específica en este Consenso). En la coinfección y en la vigencia de SIDA, puede ocurrir reactivación de la Enfermedad de Chagas, y se recomiendan las siguientes conductas: en la reactivación con síndrome clínica con miocarditis, meningoencefalitis u otras, y análisis parasitológico positivo por microscopia directa en la sangre, líquido cerebroespinal o lesión característica en tejidos, el tratamiento antiparasitario específico está indicado20,49,159 (Clase I, nivel de evidencia C). Esta conducta terapéutica también debe ser adoptada en los casos sin evidencia de reactivación con síndrome clínica asociada, pero con alta parasitemia, definida por Sartori y colaboradores como presencia de más de 20% de las ninfas positivas en un mismo análisis de xenodiagnóstico (análisis parasitológico indirecto, PCR cuantitativo) o parasitemia persistente 49,159,175,308 (Clase IIa, nivel de evidencia C).
Coinfección y profilaxis
Por analogía con otras enfermedades oportunistas en el SIDA, la profilaxis secundaria puede ser realizada en pacientes con reactivación de la Enfermedad de Chagas que fueron tratados y alcanzaron remisión clínica y parasitológica, cuando los niveles de linfocitos T CD4+ sean inferiores a 200 células/mm³ (Clase IIa, nivel de evidencia C).20,49,159,175 Mientras tanto, esta recomendación debe ser validada en estudios prospectivos, considerando la baja frecuencia de recidivas observadas en enfermos bajo HAART.
Inmunosupresión en otras enfermedades asociadas a la enfermedad de Chagas
Situaciones clínicas como neoplasias, enfermedades del colágeno, entre otras, en portadores de la enfermedad de Chagas, pueden estar asociadas a la reactivación. Las recomendaciones son las mismas para la reactivación en trasplante de órganos y en las coinfecciones de Enfermedad de Chagas y VIH.20,49,159,175
Transmisión accidental
En accidentes caracterizados como de riesgo elevado para transmisión de la enfermedad, como punzo cortantes, y contacto con mucosas durante la manipulación de material biológico con parásitos vivos (muestras para cultivo de T. cruzi, líquidos de pacientes con elevada parasitemia y material de necropsia, vectores y animales de laboratorio infectados), se debe hacer la profilaxis primaria, iniciando el medicamento inmediatamente después del accidente y manteniéndolo por 10 días309-311 (Clase IIa, nivel de evidencia C).
Deben ser realizados análisis serológicos antes de iniciarse el tratamiento, y en el 20º, 40º y 60º días pos tratamiento para monitorización de seroconversión. En el caso que los análisis serológicos sean reactivos, el tratamiento antiparasitario convencional deberá ser realizado como descrito previamente para la fase aguda. En situaciones de riesgo mínimo, como contacto con la sangre de paciente con la Enfermedad de Chagas en fase crónica, la profilaxis medicamentosa no está indicada, recomendando la realización de análisis serológicos inmediatamente después del accidente, y en el 20º, 40º y 60º días después de la infección. Habiendo seroconversión, el tratamiento convencional para la fase aguda de la Enfermedad de Chagas deberá ser instituido, y la monitorización post terapéutica debe ser realizada como en la fase aguda. Si la serología permanece positiva después del tratamiento, se debe buscar documentar la falla terapéutica para un nuevo tratamiento con el mismo medicamento o con medicamento alternativo.20
Opciones terapéuticas, posología y modo de administración
El carácter de descuido de la Enfermedad de Chagas es evidenciado por la limitación de opciones terapéuticas, con la existencia de tan sólo dos fármacos antiparasitarios disponibles de eficacia establecida para el tratamiento específico: benznidazol (agente derivado nitroimidazólico) y nifurtimox (compuesto nitrofurano).14,19,20,38,42,293,294,296
El medicamento de primera elección para el tratamiento antiparasitario de la Enfermedad de Chagas en todas las situaciones abordadas anteriormente es el benznidazol.20,38,100,294 Actualmente este medicamento es producido por laboratorio farmacéutico brasileño, distribuido por solicitación al Ministerio de Salud de Brasil, no habiendo distribución al mercado farmacéutico general.20,39
El benznidazol es un medicamento bien tolerado.20,38,251 Los niños en general tiene menos efectos adversos de que los adultos y toleran dosis más elevadas.104 En abril de 2013, el 19o Comité de Especialistas para Selección y Uso de Medicamentos Esenciales de la OMS debatió y aprobó la adición de dos nuevas presentaciones del benznidazol en el listado de medicamentos esenciales para niños.38
El benznidazol está siendo cada vez más prescrito para el tratamiento antiparasitario de la enfermedad de Chagas, no solamente por la amplitud de indicaciones con base en evidencias, sino también, como consecuencia del incremento de la demanda en países endémicos y no endémicos, con la mejor estructura de sus sistemas nacionales de vigilancia y atención a la salud.38,294,295
Benznidazol (Clase 1, nivel de evidencia b): pastillas de 100mg y 50mg (adultos) y de 12,5mg y 50mg (niños).20,42,104,109,122,291,296,299,302,312,313 en Brasil, solamente las presentaciones de 100mg y 12,5mg están disponibles en la red del SUS.
Adultos: 5mg/kg/día, por vía oral, en dos o tres tomas diarias, durante 60 días. La dosis máxima recomendada es de 300mg/día.
El benznidazol, en pastillas de 100mg y de 50mg, es distribuido en Latinoamérica por el Laboratorio Endocrínico Argentino (ELEA, Maprimed) y el Fondo Rotativo de la OPAS; en España, por medio de la Agencia Española de Medicamentos y Productos Sanitarios; y para los demás países del mundo, por el ELEA y la OMS.38
En Brasil, es adquirido por el Ministerio de Salud, y distribuido a las Secretarias Estaduales de salud (SES) mediante solicitud en el Sistema de Información de Insumos Estratégicos (SIES). El flujo de distribución del benznidazol (100mg) para regionales y/o municipios debe ser establecido por cada SES, articulando Asistencia Farmacéutica, Vigilancia Epidemiológica y Atención Básica. Ya la distribución del benznidazol en la dosis de 12,5mg es centralizada, considerando la pequeña ocurrencia de casos de la enfermedad en la franja de edad recomendada para uso del medicamento. Por lo tanto, para requerir la formulación pediátrica, se debe entrar en contacto con el Grupo Técnico de Enfermedad de Chagas, Coordinación de enfermedades Transmisibles de la Secretaría de Vigilancia en Salud, Ministerio de Salud.49
En todos los casos, no se debe ultrapasar la dosis de 300mg/día. Cuando la dosis diaria ultrapasar los 300mg, se recomienda extender el tiempo de tratamiento hasta alcanzar la dosis total calculada para 60 días.
La principal ventaja de la pastilla de 12,5mg es que ella puede ser utilizada para tratar de recién nacidos hasta niños de 2 años de edad, lo que facilita la dosificación adecuada sin la necesidad de fragmentar y manipular partes de pastillas de mayores dimensiones. Además, la principal ventaja de la pastilla de 50mg es que puede ser usada para tratar el restante de la población pediátrica, incluyendo adolescentes y adultos jóvenes.38
Además del tratamiento específico de la infección por T. cruzi, estos antiparasitarios pueden ser utilizados para profilaxis en situaciones específicas.
Se debe considerar la profilaxis secundaria después del tratamiento convencional de la reactivación en la coinfección VIH/SIDA (2,5 la 5mg/kg/día, vía oral, tres veces por semana), pues todavía no hay evidencias consistentes que validen el uso del benznidazol profilácticamente en esta situación.49,159,175
Por su turno, la profilaxis primaria está indicada en situaciones en que se define como vía de transmisión la exposición accidental la T. cruzi. Se recomienda el uso de 5mg/kg/día (adulto) y 10mg/kg/día (niño), por vía oral, en dos tomas diarias, durante 10 días, no ultrapasando los 300mg/día. En caso de alta carga parasitaria del inóculo (igual o mayor que 107 tripomastigotes/ ml), debe realizarse el tratamiento convencional para la fase aguda de la Enfermedad de Chagas por un mínimo de 60 días310 (Clase IIa, nivel de evidencia C). En casos en niños, se debe utilizar la presentación pediátrica del benznidazol, ya disponible.
Los efectos adversos y la toxicidad del benznidazol, juntamente con las respectivas conductas, pueden ser observados en la (Figura 19). Así, cuidados deben ser tomados antes y durante el tratamiento en la monitorización de esos eventos. Antes de iniciarse el tratamiento, deben ser realizados análisis clínicos, hemograma completo, evaluación de enzimas hepáticas y pruebas de función renal. Esta conducta debe ser repetida en el 30º y 60º días del inicio del tratamiento.20
En casos de intolerancia al benznidazol, existe como opción terapéutica el nifurtimox20,42,119,291,292,296,312 (clase 1, nivel de evidencia B): pastillas de 120mg (adultos) y 30mg (niños).
Adultos: 10mg/kg/día, por vía oral, en tres tomas diarias, durante 60 días.
Niños: 15mg/kg/día, por vía oral, en tres tomas diarias, durante 60 días.
Los efectos adversos y la toxicidad del nifurtimox son semejantes a los verificados con el benznidazol, excepto por la menor tolerancia digestiva, reflejada en la anorexia con pérdida de peso y disturbios psíquicos.20 En caso de falla terapéutica con el benznidazol, el nifurtimox puede ser utilizado, aunque haya sido observada resistencia cruzada entre los dos medicamentos.
Es necesario acordar que el nifurtimox no está disponible en el mercado farmacéutico de ningún país hasta el momento. En situaciones en que el uso del nifurtimox es imprescindible, el medicamento deberá ser solicitado vía oficinas de la OPAS y de la OMS. El Ministerio de Salud de Brasil, por intermedio del Grupo Técnico de Enfermedad de Chagas de la SVS, tiene disponibilidad del nifurtimox para dispensarlo en las condiciones anteriormente descritas de intolerancia al benznidazol. El nifurtimox es adquirido por el Ministerio de Salud vía donación de la OPAS y es dispensado directamente por el Grupo Técnico de Enfermedad de Chagas de la SVS.39 El medicamento puede ser solicitado por medio de protocolo estandarizado direccionado a este grupo técnico del Ministerio de Salud.
Otros medicamentos, tales como el alopurinol y los antifúngicos azólicos (ketoconazol, itraconazol, fluconazol, posaconazol), son reconocidos como supresores de la parasitemia por T. cruzi y pueden ser útiles en algunas situaciones específicas, como en las reactivaciones en inmunodeprimidos, cuando haya imposibilidad del uso del benznidazol o del nifurtimox49,159,175 (Clase IIa, nivel de evidencia C). No obstante, no hay evidencias clínicas indiscutibles de comprobada eficacia terapéutica.
El tratamiento antiparasitario con el benznidazol no debe ser instituido en mujeres embarazadas o en mujeres en edad fértil que no estén en uso regular de método contraceptivo reconocidamente efectivo.20 De acuerdo con lo discutido en la parte específica sobre transmisión vertical de T. cruzi en este Consenso, hay evidencias indicando el beneficio del tratamiento antiparasitario, con mejor evolución de la Enfermedad de Chagas,116,119-122 reducción del riesgo de transmisión vertical en futuros embarazos109,116 y menor riesgo de transmisión vertical y de evolución para aborto, por la reducción de la parasitemia.103,115
En el caso de mujer embarazada con indicación de tratamiento antiparasitario, la relación de riesgo-beneficio debe ser considerada, caso a caso, así como las opciones terapéuticas disponibles (en especial, fase aguda y coinfección). La indicación en pacientes con otras afecciones graves, tales como insuficiencia hepática y renal, debe ser evaluada criteriosamente, caso a caso, de acuerdo con la gravedad, así como eventos adversos previos a los componentes del medicamento, constituyendo contraindicaciones relativas.20,38,104
Evaluación de cura de la Enfermedad de Chagas, después de tratamiento antiparasitario
La serología, tornándose negativa, es considerada como el único método traductor de curación después del tratamiento antiparasitario de la Enfermedad de Chagas. El tiempo necesario para que esto ocurra es variable y depende de la fase y del tiempo de la enfermedad, siendo de un año para la infección congénita, 3-5 años para la fase aguda, 5-10 años para la fase crónica reciente y superior a 10 años (usualmente, 20-25 años) para la fase crónica de longa duración. La reducción de los títulos de los análisis serológicos se hace gradualmente. La disminución persistente y progresiva superior a tres diluciones de los títulos de los análisis serológicos es sugestivo de que estos irán a convertirse en negativos. Los análisis parasitológicos no son obligatorios como controles de cura del tratamiento antiparasitario de la Enfermedad de Chagas, sin embargo, en cualquier momento de la evolución del paciente, la respuesta positiva de los mismos indica fracaso terapéutico. En este sentido, la PCR es una opción alternativa a los métodos indirectos (xenodiagnóstico y hemocultivo) en la evaluación parasitológica como criterio de falla terapéutica después del tratamiento antiparasitario de la Enfermedad de Chagas.104,313 Sin embargo, persisten limitaciones con relación a la disponibilidad y a la estandarización de las técnicas en la red de salud de los países endémicos.313
Quien y adonde tratar
Considerando las especificidades operacionales de los sistemas nacionales de salud, el tratamiento antiparasitario para la Enfermedad de Chagas es factible, seguro20,251,294,303,312 y operacionalmente viable para utilización en unidades de atención primaria a la salud,294 por médicos que conozcan las particularidades de los medicamentos y de la Enfermedad de Chagas.20,303 Dependiendo de la gravedad de las condiciones clínicas de cada caso, principalmente los casos con la forma aguda o reactivada y formas crónicas descompensadas, puede haber necesidad de encaminamiento a unidades más especializadas o de referencia, con mayor densidad tecnológica en salud, o aún, de internación hospitalaria.
La (Figura 18) presenta una síntesis de situaciones potenciales para tratamiento específico, tomando como referencia la clase de recomendación y el nivel de evidencia existente. La (Figura 19) presenta los efectos adversos al benznidazol bien como las conductas recomendadas para cada situación indicada.
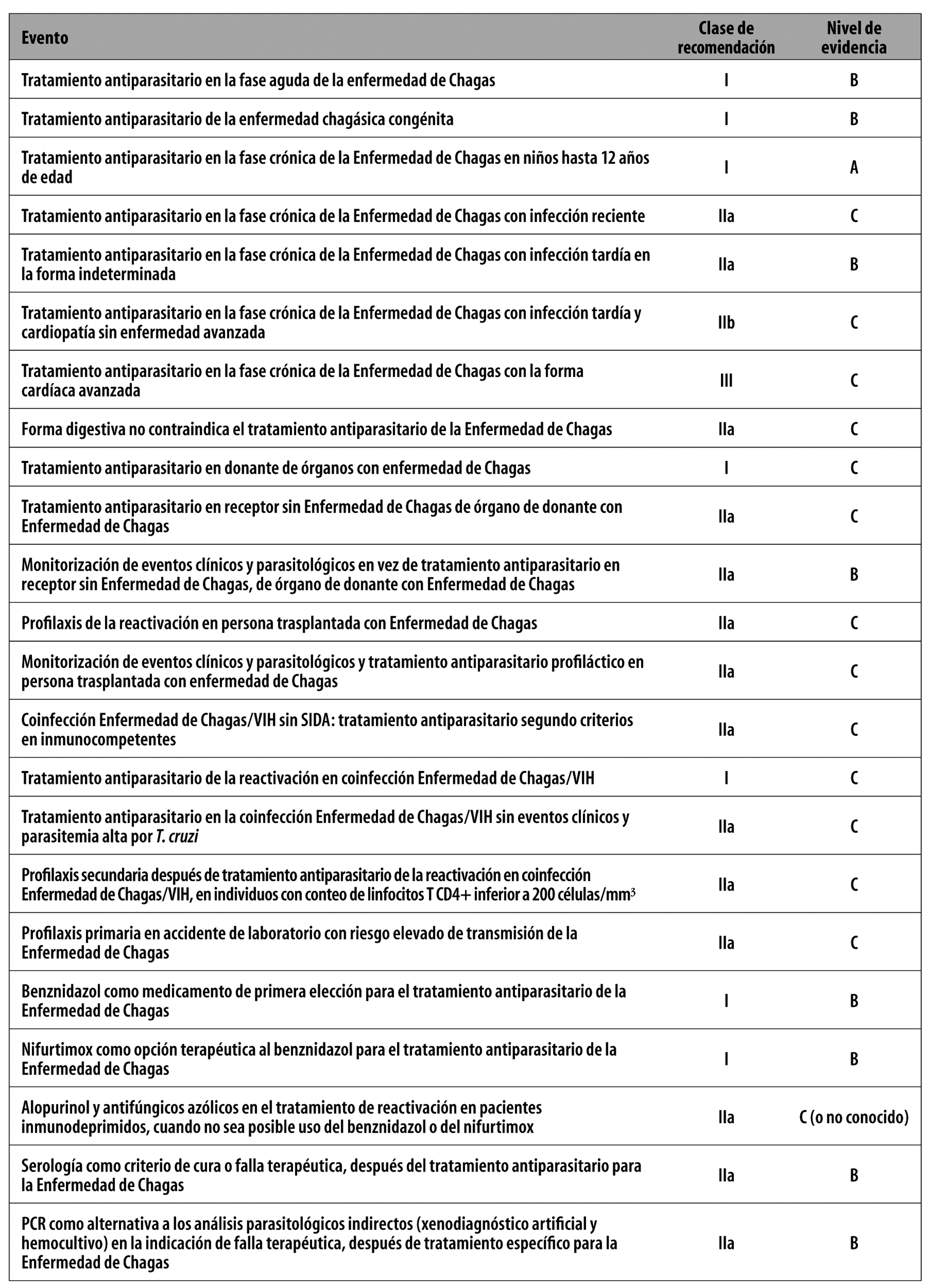
Figura 18 - Síntesis de situaciones de tratamiento, según clase de recomendación y nivel de evidencia
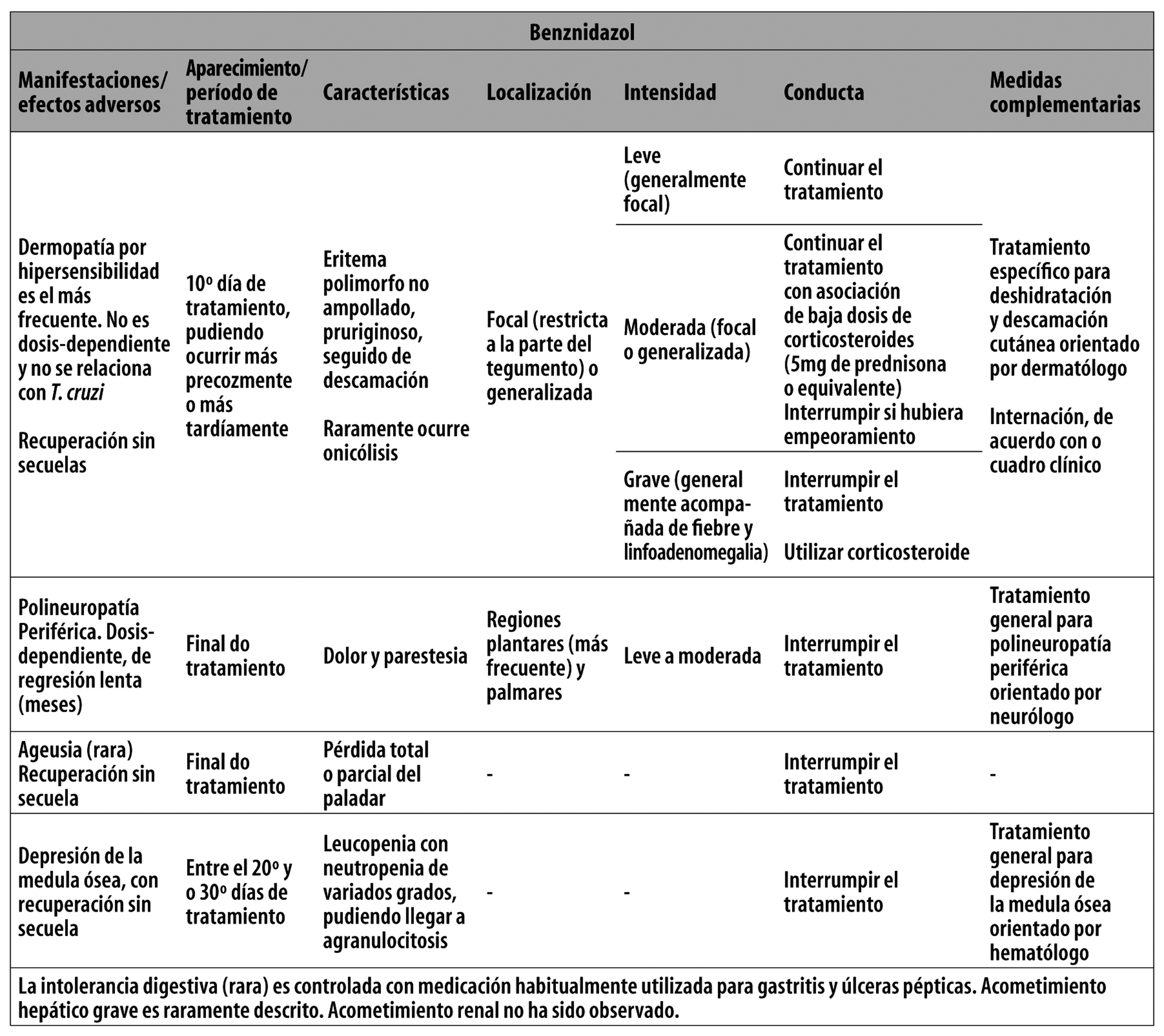
Fuente: Adaptado de Consenso Brasileño en enfermedad de Chagas, 2005.20
Figura 19 - Efectos adversos al benznidazol y conductas recomendadas para cada situación
Agradecimientos
Agradecemos al Doctor Jarbas Barbosa da Silva Jr., Secretario de Vigilancia en Salud del Ministerio de Salud en los períodos de 2003 a 2007 y de 2011 a 2014, por el apoyo en la construcción de las dos ediciones del Consenso en enfermedad de Chagas, de 2005 y 2015. Al Doctor Habib Fraiha Neto y al Doctor Ralph Lainson (in memorian), por las contribuciones en la sección dedicada a la transmisión oral. A la Red Brasileña de Atención y Estudios en la Coinfección T. cruzi/ VIH y en otras condiciones de inmunosupresión. Al Doctor Roberto Salvatella (Representación de Organización Panamericana de la Salud / Organización Mundial de Salud en Uruguay) por el apoyo en la traducción a la versión española del Consenso Brasileño en Enfermedad de Chagas, 2015.
Homenaje
Homenaje a los miembros del grupo responsable por el Consenso Brasileño en Enfermedad de Chagas en 2005 que fallecieron en el período entre los Consensos: Ademir Rocha, Aluízio Rosa Prata, Antônio Carlos Silveira, Guilherme Rodrigues da Silva, Joffre Marcondes de Rezende y Vanize de Oliveira Macedo.
REFERENCIAS
1. World Health Organization. Research priorities for Chagas disease, human African trypanosomiasis and leishmaniasis. WHO: technical report of the TDR Disease Reference Group on Chagas Disease, Human African Trypanosomiasis and Leishmaniasis. Geneva: World Health Organization; 2012. (WHO Technical Report Series, 975). [ Links ]
2. World Health Organization. Sustaining the drive to overcome the global impact of neglected tropical diseases: second WHO report in neglected tropical diseases. Geneva: World Health Organization; 2013. [ Links ]
3. Dias JC, Silveira AC, Schofield CJ. The impact of Chagas disease control in Latin America: a review. Mem Inst Oswaldo Cruz. 2002 Jul;97(5):603-12. [ Links ]
4. Coura JR, Dias JC. Epidemiology, control and surveillance of Chagas disease: 100 years after its discovery. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:31-40. [ Links ]
5. World Health Organization. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Wkly Epidemiol Rec. 2015 Feb;90(6):33-44. [ Links ]
6. Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:17-30. [ Links ]
7. Schmunis GA, Yadon ZE. Chagas disease: a Latin American health problem becoming a world health problem. Acta Trop. 2010 Jul-Aug;115(1-2):14-21. [ Links ]
8. Centers for Disease Control and Prevention. Center for Global Health. Division of Parasitic Diseases and Malaria. Chagas disease in the Americas: 2013. Atlanta: Centers for Disease Control and Prevention; 2013. [ Links ]
9. Hotez PJ, Dumonteil E, Betancourt Cravioto M, Bottazzi ME, Tapia-Conyer R, Meymandi S, et al. An unfolding tragedy of Chagas disease in North America. PLoS Negl Trop Dis. 2013 Oct;7(10):e2300. [ Links ]
10. Dias JCP. Human chagas disease and migration in the context of globalization: some particular aspects. J Trop Med. 2013:789758. [ Links ]
11. Coura JR, Viñas PA, Junqueira AC. Ecoepidemiology, short history and control of Chagas disease in the endemic countries and the new challenge for non-endemic countries. Mem Inst Oswaldo Cruz. 2014 Nov;109(7):856-62. [ Links ]
12. European Centre for Disease Prevention and Control. Assessing the burden of key infectious diseases affecting migrant populations in the EU/EEA: technical report. Stockholm: ECDC; 2014. [ Links ]
13. Requena-Méndez A, Aldasoro E, Lazzari E, Sicuri E, Brown M, Moore DA, et al. Prevalence of Chagas disease in Latin-American migrants living in Europe: a systematic review and meta-analysis. PLoS Negl Trop Dis. 2015 Feb;9(2):e0003540. [ Links ]
14. World Health Organization. Chagas disease (American trypanosomiasis) [Internet]. Geneva: World Health Organization ; 2015 [citado 2015 Nov 13]. Disponível em: Disponível em: http://www.who.int/mediacentre/factsheets/fs340/en/ [ Links ]
15. Ramos Júnior AN, Carvalho DM. Chagas’ disease: past, present and future. Cad Saude Colet. 2009;17(4):787-94. [ Links ]
16. Strasen J, Williams T, Ertl G, Zoller T, Stich A, Ritter O. Epidemiology of Chagas disease in Europe: many calculations, little knowledge. Clin Res Cardiol. 2014 Jan;103(1):1-10. [ Links ]
17. Pan American Health Organization. Estimación cuantitativa de la enfermedad de Chagas en las Americas. Washington: Pan American Health Organization; 2006. [ Links ]
18. Dias JCP. Southern Cone Initiative for the elimination of domestic populations of Triatoma infestans and the interruption of transfusion Chagas disease: historical aspects, present situation, and perspectives. Mem Inst Oswaldo Cruz. 2007 Oct;102 Suppl 1:11-8. [ Links ]
19. Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Dis. 2001 Sep;1(2):92-100. [ Links ]
20. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Consenso Brasileiro em Doença de Chagas. Rev Soc Bras Med Trop. 2005;38 Supl 3:1-29. [ Links ]
21. Organização Pan-americana da Saúde. Guia para vigilância, prevenção, controle e manejo clínico da doença de Chagas aguda transmitida por alimentos. Rio de Janeiro: Organização Pan-Americana da Saúde; 2009. (Série de Manuais Técnicos, 12). [ Links ]
22. Silveira AC, Dias JCP. O controle da transmissão vetorial. Rev Soc Bras Med Trop. 2011;44 supl 2:52-63. [ Links ]
23. Coura JR. The main sceneries of Chagas disease transmission. The vectors, blood and oral transmissions: a comprehensive review. Mem Inst Oswaldo Cruz. 2015 May;110(3):277-82. [ Links ]
24. Victora CG, Wagstaff A, Schellenberg JA, Gwatkin D, Claeson M, Habicht JP. Applying an equity lens to child health and mortality: more of the same is not enough. Lancet. 2003 Jul;362(9379):233-41. [ Links ]
25. Zingales B, Andrade SG, Briones MR, Campbell DA, Chiari E, Fernandes O, et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz. 2009 Nov;104(7):1051-4. [ Links ]
26. Zingales B, Miles MA, Moraes CB, Luquetti A, Guhl F, Schijman AG, et al. Drug discovery for Chagas disease should consider Trypanosoma cruzi strain diversity. Mem Inst Oswaldo Cruz. 2014 Aug;109(6):828-33. [ Links ]
27. Messenger LA, Miles MA, Bern C. Between a bug and a hard place: Trypanosoma cruzi genetic diversity and the clinical outcomes of Chagas disease. Expert Rev Anti Infect Ther. 2015 Aug;13(8):995-1029. [ Links ]
28. Victora CG, Barreto ML, Carmo Leal M, Monteiro CA, Schmidt MI, Paim J, et al. Health conditions and health-policy innovations in Brazil: the way forward. Lancet. 2011 Jun;377(9782):2042-53. [ Links ]
29. Barreto ML, Teixeira MG, Bastos FI, Ximenes RAA, Barata RB, Rodrigues LC. Successes and failures in the control of infectious diseases in Brazil: social and environmental context, policies, interventions, and research needs. Lancet. 2011 May;377(9780):1877-89. [ Links ]
30. Mendes EV. O cuidado das condições crônicas na atenção primária à saúde: o imperativo da consolidação da estratégia da saúde da família. Brasília: Organização Pan-Americana da Saúde; 2012. [ Links ]
31. Nações Unidas. Transformando nosso mundo: a agenda 2030 para o desenvolvimento sustentável [Internet]. [Rio de Janeiro]: Nações Unidas no Brasil; 2015 [citado 2015 out 4]. Disponível em: Disponível em: http://nacoesunidas.org/pos2015/agenda2030/ . [ Links ]
32. Camargo ME, Silva GR, Castilho EA, Silveira AC. Serological survey of the prevalence of Chagas’ infection in Brazil, 1975/1980. Rev Inst Med Trop São Paulo. 1984 Jul-Aug;26(4):192-204. [ Links ]
33. Silveira AC, Silva GR, Prata A. O Inquérito de soroprevalência da infecção chagásica humana (1975-1980). Rev Soc Bras Med Trop. 2011;44 supl 2:33-9. [ Links ]
34. Akhavan D. Análise de custo-efectividade do programa de controle da doença de Chagas no Brasil: relatório final. Brasília: Organização Pan-Americana de Saúde; 1998. [ Links ]
35. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Prevalence of Chagas disease in Brazil: a systematic review and meta-analysis. Acta Trop. 2014 Feb;130:167-74. [ Links ]
36. Hotez PJ, Fujiwara RT. Brazil’s neglected tropical diseases: an overview and a report card. Microbes Infect. 2014 Aug;16(8):601-6. [ Links ]
37. Bern C, Kjos S, Yabsley MJ. Montgomery SP. Trypanosoma cruzi and Chagas disease in the United States. Clin Microbiol Rev. 2011 Oct;24(4):655-81. [ Links ]
38. Dias JC, Coura JR, Yasuda MAS. The present situation, challenges, and perspectives regarding the production and utilization of effective drugs against human Chagas disease. Rev Soc Bras Med Trop. 2014 Jan-Feb;47(1):123-5. [ Links ]
39. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Guia de Vigilância em Saúde. Brasília: Ministério da Saúde; 2014. [ Links ]
40. Instituto Brasileiro de Geografia e Estatística. Projeção da população do Brasil por sexo e idade para o período 2000/2060 e projeção da população das Unidades da Federação por sexo e idade para o período 2000/2030. Brasília: Instituto Brasileiro de Geografia e Estatística; 2013. [ Links ]
41. Bern C, Verastegui M, Gilman RH, Lafuente C, Galdos-Cardenas G, Calderon M, et al. Congenital Trypanosoma cruzi transmission in Santa Cruz, Bolivia. Clin Infect Dis. 2009 Dec 1;49(11):1667-74. [ Links ]
42. Rassi Júnior A, Rassi A, Marin-Neto JA. Chagas disease. Lancet. 2010 Apr;375(9723):1388-402. [ Links ]
43. Ventura-Garcia L, Roura M, Pell C, Posada E, Gascón J, Aldasoro E, et al. Socio-cultural aspects of Chagas disease: a systematic review of qualitative research. PLoS Negl Trop Dis. 2013 Sep 12;7(9):e2410. [ Links ]
44. Bern C, Montgomery SP. An estimate of the burden of Chagas disease in the United States. Clin Infect Dis. 2009 Sep 1;49(5):e52-4. [ Links ]
45. Buekens P, Almendares O, Carlier Y, Dumonteil E, Eberhard M, Gamboa-Leon R, et al. Mother-to-child transmission of Chagas’ disease in North America: why don’t we do more? Matern Child Health J. 2008 May;12(3):283-6. [ Links ]
46. Silveira C, Carneiro Junior N, Ribeiro MC, Barata RC. Living conditions and access to health services by Bolivian immigrants in the city of São Paulo, Brazil. Cad Saude Publica. 2013 Oct;29(10):2017-27. [ Links ]
47. Martes ACB, Faleiros SM. Acesso dos imigrantes bolivianos aos serviços públicos de saúde na cidade de São Paulo. Saude Soc. 2013 abr-jun;22(2):351-64. [ Links ]
48. Almeida EA, Lima JN, Lages-Silva E, Guariento ME, Aoki FH, Torres-Morales AE, et al. Chagas’ disease and HIV co-infection in patients without effective antiretroviral therapy: prevalence, clinical presentation and natural history. Trans R Soc Trop Med Hyg. 2010 Jul;104(7):447-52. [ Links ]
49. Almeida EA, Ramos Júnior AN, Correia D, Shikanai-Yasuda MA. Co-infection Trypanosoma cruzi/HIV: systematic review (1980-2010). Rev Soc Bras Med Trop. 2011 Nov-Dec;44(6):762-70. [ Links ]
50. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Bol Epidemiol. 2014;3(1):1-80 [ Links ]
51. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para manejo da infecção pelo HIV em adultos. Brasília: Ministério da Saúde; 2014. [ Links ]
52. Ministério da Saúde (BR). Recomendações para diagnóstico, tratamento e acompanhamento da co-infecção Trypanosoma cruzi: vírus da imunodeficiência humana. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):392-415. [ Links ]
53. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Mortality related to Chagas disease and HIV/AIDS coinfection in Brazil. J Trop Med. 2012;2012:534649. [ Links ]
54. Ramos Júnior AN. Inclusão da reativação da doença de Chagas como uma condição definidora de AIDS para fins de vigilância epidemiológica no Brasil. Rev Soc Bras Med Trop. 2004 mar-abr;37(2):192-3. [ Links ]
55. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Doença de Chagas aguda no Brasil: série histórica de 2000 a 2013. Bol Epidemiol. 2015;46(21):1-9. [ Links ]
56. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Multiple causes of death related to Chagas’ disease in Brazil, 1999 to 2007. Rev Soc Bras Med Trop. 2012 Sep-Oct;45(5):591-6. [ Links ]
57. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Mortality due to Chagas disease in Brazil from 1979 to 2009: trends and regional differences. J Infect Dev Ctries. 2012 Nov;6(11):817-24. [ Links ]
58. Drumond JAG, Marcopito LF. Internal migration and distribution of Chagas disease mortality, Brazil, 1981-1998. Cad Saude Publica. 2006 Oct;22(10):2131-40. [ Links ]
59. Martins-Melo FR, Alencar CH, Ramos Júnior AN, Heukelbach J. Epidemiology of mortality related to Chagas’ disease in Brazil, 1999-2007. PLoS Negl Trop Dis. 2012 Feb;6(2):e1508. [ Links ]
60. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Lange W, Heukelbach J. Mortality of Chagas’ disease in Brazil: spatial patterns and definition of high-risk areas. Trop Med Int Health. 2012 Sep;17(9):1066-75. [ Links ]
61. Santo AH. Tendência da mortalidade relacionada à doença de Chagas, Estado de São Paulo, Brasil, 1985 a 2006: estudo usando causas múltiplas de morte. Rev Panam Salud Publica. 2009 Oct;26(4):299-309. [ Links ]
62. Nóbrega AA, Araújo WN, Vasconcelos AM. Mortality due to Chagas disease in Brazil according to a specific cause. Am J Trop Med Hyg. 2014 Sep;91(3):528-33. [ Links ]
63. Alves RM, Thomaz RP, Almeida EA, Wanderley JS, Guariento ME. Chagas’ disease and ageing: the coexistence of other chronic diseases with Chagas’ disease in elderly patients. Rev Soc Bras Med Trop. 2009 Nov-Dec;42(6):622-8. [ Links ]
64. Lima-Costa MF, Peixoto SV, Ribeiro AL. Chagas disease and mortality in old age as an emerging issue: 10 year follow-up of the Bambuí population-based cohort study (Brazil). Int J Cardiol. 2010 Nov;145(2):362-3. [ Links ]
65. Silveira AC. Os novos desafios e perspectivas futuras do controle. Rev Soc Bras Med Trop. 2011;44 Supl 2:122-4. [ Links ]
66. Passos ADC, Silveira AC. Síntese dos resultados dos inquéritos nacionais. Rev Soc Bras Med Trop. 2011;44 supl 2:47-50. [ Links ]
67. Vinhaes MC, Oliveira SV, Reis PO, Lacerda Sousa AC, Silva RA, Obara MT, et al. Assessing the vulnerability of Brazilian municipalities to the vectorial transmission of Trypanosoma cruzi using multi-criteria decision analysis. Acta Trop. 2014 Sep;137:105-10. [ Links ]
68. Ramos Júnior AN, Carvalho DM. Os diferentes significados da certificação conferida ao Brasil como estando livre da doença de Chagas. Cad Saude Publica. 2001 nov-dez;17(6):1403-12. [ Links ]
69. Abad-Franch F, Diotaiuti L, Gurgel-Gonçalves R, Gürtler RE. Certifying the interruption of Chagas disease transmission by native vectors: cui bono? Mem Inst Oswaldo Cruz. 2013 Apr;108(2):251-4. [ Links ]
70. Valença-Barbosa C, Lima MM, Sarquis O, Bezerra CM, Abad-Franch F. Modeling disease vector occurrence when detection is imperfect II: drivers of site-occupancy by synanthropic Triatoma brasiliensis in the Brazilian northeast. PLoS Negl Trop Dis. 2014 May;8(5):e2861. [ Links ]
71. Abad-Franch F, Valença-Barbosa C, Sarquis O, Lima MM. All that glisters is not gold: sampling-process uncertainty in disease-vector surveys with false-negative and false-positive detections. PLoS Negl Trop Dis. 2014 Sep;8(9):e3187. [ Links ]
72. Salvatella R, Irabedra P, Castellanos LG. Interruption of vector transmission by native vectors and “the art of the possible”. Mem Inst Oswaldo Cruz. 2014 Feb;109(1):122-30. [ Links ]
73. Maegawa FA, Damerau EF, Beltrame-Botelho IT, Lopes A, Emmanuelle-Machado P, Steindel M, et al. Autochthonous Chagas’ disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement. Rev Soc Bras Med Trop. 2003 Sep-Oct;36(5):609-12. [ Links ]
74. Santos CB, Ferreira AL, Leite GR, Ferreira GE, Rodrigues AA, Falqueto A. Peridomiciliary colonies of Triatoma vitticeps (Stal, 1859) (Hemiptera, Reduviidae, Triatominae) infected with Trypanosoma cruzi in rural areas of the state of Espírito Santo, Brazil. Mem Inst Oswaldo Cruz. 2005 Aug;100(5):471-3. [ Links ]
75. Lorosa ES, Santos CM, Jurberg J. Foco de doença de Chagas em São Fidélis, no estado do Rio de Janeiro. Rev Soc Bras Med Trop. 2008 jul-ago;41(4):419-20. [ Links ]
76. Shikanai-Yasuda MA, Carvalho NB. Oral transmission of Chagas disease. Clin Infect Dis. 2012 Mar;54(6):845-52. [ Links ]
77. Sangenis LH, Saraiva RM, Georg I, Castro L, Santos Lima V, Roque AL, et al. Autochthonous transmission of Chagas disease in Rio de Janeiro State, Brazil: a clinical and eco-epidemiological study. BMC Infect Dis. 2015 Jan;15:4. [ Links ]
78. Xavier SC, Roque AL, Lima VS, Monteiro KJ, Otaviano JC, Ferreira da Silva LF, et al. Lower richness of small wild mammal species and Chagas disease risk. PLoS Negl Trop Dis. 2012;6(5):e1647. [ Links ]
79. Xavier SC, Roque AL, Bilac D, Araújo VA, Costa Neto SF, Lorosa ES, et al. Distantiae transmission of Trypanosoma cruzi: a new epidemiological feature of acute Chagas disease in Brazil. PLoS Negl Trop Dis. 2014 May;8(5):e2878. [ Links ]
80. Roque AL, Xavier SC, Gerhardt M, Silva MF, Lima VS, D’Andrea PS, et al. Trypanosoma cruzi among wild and domestic mammals in different areas of the Abaetetuba municipality (Pará State, Brazil), an endemic Chagas disease transmission area. Vet Parasitol. 2013 Mar;193(1-3):71-7. [ Links ]
81. Roque AL, Xavier SC, Rocha MG, Duarte AC, D’Andrea PS, Jansen AM. Trypanosoma cruzi transmission cycle among wild and domestic mammals in three areas of orally transmitted Chagas disease outbreaks. Am J Trop Med Hyg. 2008 Nov;79(5):742-9. [ Links ]
82. Abad-Franch F, Ferraz G, Campos C, Palomeque FS, Grijalva MJ, Aguilar HM, et al. Modeling disease vector occurrence when detection is imperfect: infestation of Amazonian palm trees by triatomine bugs at three spatial scales. PLoS Negl Trop Dis. 2010 Mar;4(3):e620. [ Links ]
83. Abad-Franch F, Santos WS, Schofield CJ. Research needs for Chagas disease prevention. Acta Trop. 2010 Jul-Aug;115(1-2):44-54. [ Links ]
84. Padilla-Torres SD, Ferraz G, Luz SL, Zamora-Perea E, Abad-Franch F. Modeling dengue vector dynamics under imperfect detection: three years of site-occupancy by Aedes aegypti and Aedes albopictus in urban Amazonia. PLoS One. 2013;8(3):e58420. [ Links ]
85. Abad-Franch F, Vega MC, Rolón MS, Santos WS, Rojas de Arias A. Community participation in Chagas disease vector surveillance: systematic review. PLoS Negl Trop Dis. 2011 Jun;5(6):e1207. [ Links ]
86. Roux E, Fátima Venâncio A, Girres JF, Romaña CA. Spatial patterns and eco-epidemiological systems--part II: characterising spatial patterns of the occurrence of the insect vectors of Chagas disease based on remote sensing and field data. Geospat Health. 2011 Nov;6(1):53-64. [ Links ]
87. Roux E, Fátima Venâncio A, Girres JF, Romaña CA. Spatial patterns and eco-epidemiological systems--part I: multi-scale spatial modelling of the occurrence of Chagas disease insect vectors. Geospat Health. 2011 Nov;6(1):41-51. [ Links ]
88. Mougabure-Cueto G, Picollo MI. Insecticide resistance in vector Chagas disease: evolution, mechanisms and management. Acta Trop. 2015 Sep;149:70-85. [ Links ]
89. Pessoa GCA, Pinheiro LC, Ferraz ML, Mello BV, Diotaiuti L. Standardization of laboratory bioassays for the study of Triatoma sordida susceptibility to pyrethroid insecticides. Parasit Vectors. 2015 Feb;8:109. [ Links ]
90. Pessoa GCA, Trevizani NAB, Dias LS, Bezerra CM, Melo BV, Diotaiut L. Toxicological profile of deltamethrin in Triatoma brasiliensis (Hemiptera: Reduviidae) in State of Ceará, Northeastern Brazil. Rev Soc Bras Med Trop. 2015 Jan-Feb;48(1):39-43. [ Links ]
91. Pinto AYN, Valente SA, Valente VC, Ferreira Júnior AG, Coura JR. Fase aguda da doença de Chagas na Amazônia brasileira: estudo de 233 casos do Pará, Amapá e Maranhão observados entre 1988 e 2005. Rev Soc Bras Med Trop. 2008 nov-dec;41(6):602-14. [ Links ]
92. Nóbrega AA, Garcia MH, Tatto E, Obara MT, Costa E, Sobel J, et al. Oral transmission of Chagas disease by consumption of açaí palm fruit, Brazil. Emerg Infect Dis. 2009 Apr;15(4):653-5. [ Links ]
93. Dias JCP, Amato Neto V. Prevenção referente às modalidades alternativas de transmissão do Trypanosoma cruzi no Brasil. Rev Soc Bras Med Trop. 2011;44 supl 2:68-72. [ Links ]
94. Dias JCP. Notas sobre o Trypanosoma cruzi e suas características bio-ecológicas, como agente de enfermidades transmitidas por alimentos. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):370-5. [ Links ]
95. Dias JCP, Schofield CJ. Controle da transmissão transfusional da doença de Chagas na Iniciativa do Cone Sul. Rev Soc Bras Med Trop. 1998 jul-ago;31(4):373-83. [ Links ]
96. Moraes-Souza H, Ferreira-Silva MM. Controle da transmissão transfusional. Rev Soc Bras Med Trop. 2011;44 supl 2:64-7. [ Links ]
97. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Manual técnico para a investigação da transmissão de doenças pelo sangue. Brasília: Ministério da Saúde; 2004. (Série A. Normas e manuais técnicos). [ Links ]
98. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Manual técnico de hemovigilância. Brasília: Ministério da Saúde; 2004. (Série A. Normas e manuais técnicos). [ Links ]
99. Angheben A, Boix L, Buonfrate D, Gobbi F, Bisoffi Z, Pupella S, et al. Chagas disease and transfusion medicine: a perspective from non-endemic countries. Blood Transfus. 2015 Oct;13(4):540-50. [ Links ]
100. Pinazo MJ, Miranda B, Rodríguez-Villar C, Altclas J, Brunet Serra M, García-Otero EC, et al. Recommendations for management of Chagas disease in organ and hematopoietic tissue transplantation programs in nonendemic areas. Transplant Rev (Orlando). 2011 Jul;25(3):91-101. [ Links ]
101. Ostermayer AL, Passos ADC, Silveira AC, Ferreira AW, Macedo V, Prata AR. O inquérito nacional de soroprevalência de avaliação do controle da doença de Chagas no Brasil (2001-2008). Rev Soc Bras Med Trop. 2011;44 supl 2:108-21. [ Links ]
102. Torrico F, Alonso-Vega C, Suarez E, Rodriguez P, Torrico MC, Dramaix M, et al. Maternal Trypanosoma cruzi infection, pregnancy outcome, morbidity, and mortality of congenitally infected and non-infected newborns in Bolivia. Am J Trop Med Hyg. 2004 Feb;70(2):201-9. [ Links ]
103. Salas NA, Cot M, Schneider D, Mendoza B, Santalla JA, Postigo J, et al. Risk factors and consequences of congenital Chagas disease in Yacuiba, South Bolivia. Trop Med Int Health. 2007 Dec;12(12):1498-505. [ Links ]
104. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al. Congenital Chagas disease: recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis. 2011 Oct;5(10):e1250. [ Links ]
105. Howard EJ, Xiong X, Carlier Y, Sosa-Estani S, Buekens P. Frequency of the congenital transmission of Trypanosoma cruzi: a systematic review and meta-analysis. BJOG. 2014 Jan;121(1):22-33. [ Links ]
106. Martins-Melo FR, Lima MS, Ramos Júnior AN, Alencar CH, Heukelbach J. Prevalence of Chagas disease in pregnant women and congenital transmission of Trypanosoma cruzi in Brazil: a systematic review and meta-analysis. Trop Med Int Health. 2014 Aug;19(8):943-57. [ Links ]
107. Gontijo ED, Andrade GMQ, Santos SE, Galvão LMC, Moreira EF, Pinto FS, et al. Triagem neonatal da infecção pelo Trypanosoma cruzi em Minas Gerais, Brasil: transmissão congênita e mapeamento das áreas endêmicas. Epidemiol Serv Saude. 2009 jul-set;18(3):243-54. [ Links ]
108. Luquetti AO, Tavares SBN, Siriano LR, Oliveira RA, Campos DE, Morais CA, et al. Congenital transmission of Trypanosoma cruzi in central Brazil. A study of 1,211 individuals born to infected mothers. Mem Inst Oswaldo Cruz. 2015 May;110(3):369-76. [ Links ]
109. Sosa-Estani S, Cura E, Velazquez E, Yampotis C, Segura EL. Etiological treatment of young women infected with Trypanosoma cruzi, and prevention of congenital transmission. Rev Soc Bras Med Trop. 2009 Sep-Oct;42(5):484-7. [ Links ]
110. Herwaldt BL. Laboratory-acquired parasitic infections from accidental exposures. Clin Microbiol Rev. 2001 Oct;14(4):659-88. [ Links ]
111. Mahoney RT, Morel CMA. Global Health Innovation System (GHIS). Innovation Strategy Today. 2006;2(1):1-12. [ Links ]
112. Norman FF, López-Vélez R. Chagas disease and breast-feeding. Emerg Infect Dis. 2013 Oct;19(10):1561-6. [ Links ]
113. Gebrekristos HT, Buekens P. Mother-to-Child transmission of Trypanosoma cruzi. J Ped Infect Dis Soc. 2014 Sep;3 Suppl 1:S36-40. [ Links ]
114. De Rissio AM, Riarte AR, Martin García M, Esteva MI, Quaglino M, Ruiz AM. Congenital Trypanosoma cruzi infection. Efficacy of its monitoring in an Urban Reference Health Center in non-endemic area of Argentina. Am J Trop Med Hyg. 2010 May;82(5):838-45. [ Links ]
115. González-Tomé MI, Rivera M, Camaño I, Norman F, Flores-Chávez M, Rodríguez-Gómez L, et al. Recomendaciones para el diagnóstico, seguimiento y tratamiento de la embarazada y del niño con enfermedad de Chagas. Enferm Infecc Microbiol Clin. 2013 Oct;31(8):535-42. [ Links ]
116. Carlier Y, Sosa-Estani S, Luquetti AO, Buekens P. Congenital Chagas disease: an update. Mem Inst Oswaldo Cruz. 2015 May;110(3):363-8. [ Links ]
117. Russomando G, Almirón M, Candia N, Franco L, Sánchez Z, Guillen I. Implementación y evaluación de un sistema localmente sustentable de diagnóstico prenatal que permite detectar casos de transmisión congénita de la enfermedad de Chagas en zonas endêmicas del Paraguay. Rev Soc Bras Med Trop. 2005;38 Supl 2:49-54. [ Links ]
118. Brutus L, Castillo H, Bernal C, Salas NA, Schneider D, Santalla JA, et al. Detectable Trypanosoma cruzi parasitemia during pregnancy and delivery as a risk factor for congenital Chagas disease. Am J Trop Med Hyg. 2010 Nov;83(5):1044-7. [ Links ]
119. Organización Panamericana de la Salud; Organización Mundial de la Salud. Tratamiento etiológico de la enfermidad de Chagas: conclusiones de reunión de especialistas. Rev Patol Trop. 1999;28(2):247-79. [ Links ]
120. Fabbro DL, Streiger ML, Arias ED, Bizai ML, Barco M, Amicone NA. Trypanocide treatment among adults with chronic Chagas disease living in Santa Fe City (Argentina), over a mean follow-up of 21 years: parasitological, serological and clinical evolution. Rev Soc Bras Med Trop. 2007 Jan-Feb;40(1):1-10. [ Links ]
121. Lana M, Lopes LA, Martins HR, Bahia MT, Machado-de-Assis GF, Wendling AP, et al. Clinical and laboratory status of patients with chronic Chagas disease living in a vector-controlled area in Minas Gerais, Brazil, before and nine years after aetiological treatment. Mem Inst Oswaldo Cruz. 2009 Dec;104(8):1139-47. [ Links ]
122. Pérez-Molina JA, Pérez-Ayala A, Moreno S, Fernández-González MC, Zamora J, López-Velez R. Use of benznidazole to treat chronic Chagas’ disease: a systematic review with a meta-analysis. J Antimicrob Chemother. 2009 Dec;64(6):1139-47. [ Links ]
123. CarlierI Y, Torrico F, organizers. Congenital infection with T. cruzi: from mechanisms of transmission to strategies for diagnosis and control. Rev Soc Bras Med Trop . 2003 Nov-Dec;36(6):767-71. [ Links ]
124. Scapellato PG, Bottaro EG, Rodríguez-Brieschke MT. Mother-child transmission of Chagas disease: could infection with human immunodeficiency virus increase the risk? Rev Soc Bras Med Trop . 2009 Mar-Apr;42(2):107-9. [ Links ]
125. Bua J, Volta BJ, Velazquez EB, Ruiz AM, Rissio AM, Cardoni RL. Vertical transmission of Trypanosoma cruzi infection: quantification of parasite burden in mothers and their children by parasite DNA amplification. Trans R Soc Trop Med Hyg. 2012 Oct;106(10):623-8. [ Links ]
126. Mallimaci MC, Sosa-Estani S, Russomando G, Sanchez Z, Sijvarger C, Alvarez IM, et al. Early diagnosis of congenital infection, using shed scute phase antigen, in Ushuaia, Tierra del Fuego, Argentina. Am J Trop Med Hyg. 2010 Jan;82(1):55-9. [ Links ]
127. Chippaux JP, Clavijo AN, Santalla JA, Postigo JR, Schneider D, Brutus L. Antibody drop in newborns congenitally infected by Trypanosoma cruzi treated with benznidazole. Trop Med Int Health. 2010 Jan;15(1):87-93. [ Links ]
128. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Recomendações para profilaxia da transmissão vertical do HIV e terapia antirretroviral em gestantes. Brasília: Ministério da Saúde; 2010. (Série Manuais, 46). [ Links ]
129. Luquetti AO, Rassi A. Diagnóstico laboratorial da infecção pelo Trypanosoma cruzi. In: Brener Z, Andrade Z, Barral-Netto M, editores. Trypanosoma cruzi e doença de Chagas. Rio de Janeiro: Guanabara-Koogan; 2000. p. 344-78. [ Links ]
130. Chiari E. Parasitological diagnosis. In: Wendel S, Brener Z, Camargo ME, Rassi A, editores. Chagas disease (American Trypanosomiasis): its impact on transfusion and clinical medicine. São Paulo: Editora Sociedade Brasileira de Hematologia e Hemoterapia; 1992. p. 153-64. [ Links ]
131. Luquetti AO, Castro AM. Diagnóstico sorológico da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Editora Fiocruz; 1997. p. 99-113. [ Links ]
132. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Programa Nacional de Controle de Chagas. Doença de Chagas aguda: aspectos epidemiológicos, diagnóstico e tratamento: guia de consulta rápida para profissionais de saúde. Rev Patol Trop. 2007 Set-Dez;36(3):1-32 (anexo). [ Links ]
133. Ministério da Saúde (BR). Recomendações sobre o diagnóstico parasitológico, sorológico e molecular para confirmação da doença de Chagas aguda e crônica. Rev Patol Trop. 2013 out-dez;42(4):475-8. [ Links ]
134. Luquetti AO, Schmuñis GA. Diagnosis of Trypanosoma cruzi infection. In: Telleria J, Tibayrenc M, editors. American Trypanosomiasis Chagas disease: one hundred years of research. Amsterdam: Elsevier; 2010. p. 743-92. [ Links ]
135. Camargo ME, Amato Neto V. Anti-Trypanosoma cruzi IgM antibodies as serological evidence of recent infection. Rev Inst Med Trop São Paulo. 1974 Jul-Aug;16(4):200-2. [ Links ]
136. Chiari E, Dias JC, Lana M, Chiari CA. Hemocultures for the parasitological diagnosis of human chronic Chagas disease. Rev Soc Bras Med Trop. 1989 Jan-Mar;22(1):19-23. [ Links ]
137. Chiari E, Galvão LMC. Diagnóstico parasitológico da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz; 1997. p. 85-97. [ Links ]
138. Cerisola JA, Rohwedder R, Segura EL, Del Prado CE, Alvarez M, Martini GJW. El xenodiagnóstico. Buenos Aires: Imp Inst Nac Invest Cardiovasc; 1974. [ Links ]
139. Castro AM, Luquetti AO, Rassi A, Rassi GG, Chiari E, Galvão LMC. Blood culture and polymerase chain reaction for the diagnosis of the chronic phase of human infection with Trypanosoma cruzi. Parasitol Res. 2002 Oct;88(10):894-900. [ Links ]
140. Camargo ME. Serological diagnosis: an appraisal of Chagas disease serodiagnosis. In: Wendel S, Brener Z, Camargo ME, Rassi A, editors. Chagas Disease (American Trypanosomiasis), its impact on Transfusion and Clinical Medicine. São Paulo: Sociedade Brasileira de Hematologia e Hemoterapia; 1992. p. 165-78. [ Links ]
141. Ferreira AW, Ávila SLM. Doença de Chagas. In.: Ferreira AW, Ávila SLM. Diagnóstico laboratorial das principais doenças infecciosas e auto-imunes. 2 ed. Rio de Janeiro: Guanabara Koogan; 2001. p. 241-9. [ Links ]
142. World Health Organization. Control of Chagas disease. Geneva: World Health Organization ; 2002. (Technical Report Series, 905). [ Links ]
143. Hijar G, Padilla C, Balbuena J, Bisio MMC, Bailon H, Vega S, et al. Estandarización y validación del uso clínico de la Reacción en Cadena de la Polimerasa para la detección de infección por Trypanosoma cruzi. In: Anales 9º Congreso Peruano de Enfermedades Infecciosas y Tropicales “Jose Neyra Ramirez”; 2009 nov 18-21; Lima. Lima: Sociedad Peruana de Enfermedades Infecciosas y Tropicales; 2009. [ Links ]
144. Schijman AG, Bisio M, Orellana L, Sued M, Duffy T, Mejia Jaramillo AM, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis. 2011 Jan;5(1):e931. [ Links ]
145. Camargo ME. Fluorescent antibody test for the diagnosis of American trypanosomiasis. Technical modification employing preserved culture forms of Trypanosoma cruzi in a slide test. Rev Inst Med Trop São Paulo. 1966 Sep-Oct;8(5):227-35. [ Links ]
146. Cerisola JA, Chaben MF, Lazari JO. Test de hemaglutinación para el diagnóstico de la enfermedad de Chagas. Prensa Méd Argent. 1962;49:1761-67. [ Links ]
147. Voller A, Draper C, Bidwell DE, Bartlett A. Microplate enzyme-linked immunosorbent assay for Chagas disease. Lancet. 1975 Feb;305(7904):426-8. [ Links ]
148. Castro CN, Alves MT, Macedo VO. Importância da repetição do xenodiagnóstico para avaliação da parasitemia na fase crônica da doença de Chagas. Rev Soc Bras Med Trop. 1983 abr-jun;16(2):98-103. [ Links ]
149. Junqueira AC, Chiari E, Wincker P. Comparison of the polymerase chain reaction with two classical parasitological methods for diagnosis of Chagas disease patients in a north-eastern endemic region of north-eastern Brazil. Trans R Soc Trop Med Hyg. 1996 Mar-Apr;90(2):129-32. [ Links ]
150. Britto CC. Usefulness of PCR-based assays to assess drug efficacy in Chagas disease chemotherapy: value and limitations. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:122-35. [ Links ]
151. Silveira JF, Umezawa ES, Luquetti AO. Chagas disease: recombinant Trypanosoma cruzi antigens for serological diagnosis. Trends Parasitol. 2001 Jun;17(6):286-91. [ Links ]
152. Zicker F, Smith PG, Luquetti AO, Oliveira OS. Mass screening for Trypanosoma cruzi infections using the immunofluorescence, ELISA and haemagglutination tests on serum samples and on blood eluates from filter-paper. Bull World Health Organ. 1990;68(4):465-71. [ Links ]
153. Sánchez-Camargo CL, Albajar-Viñas P, Wilkins PP, Nieto J, Leiby DA, Paris L, et al. Comparative evaluation of 11 commercialized rapid diagnostic tests for detecting Trypanosoma cruzi antibodies in serum banks in areas of endemicity and nonendemicity. J Clin Microbiol. 2014 Jul;52(7):2506-12. [ Links ]
154. Pinto AYN, Valente SAS, Valente VC. Emerging acute Chagas disease in Amazonian Brazil: case reports with serious cardiac involvement. Braz J Infect Dis. 2004 Dec;8(6):454-60. [ Links ]
155. Dias JP, Bastos C, Araújo E, Mascarenhas AV, Martins Netto E, Grassi F, et al. Acute Chagas disease outbreak associated with oral transmission. Rev Soc Bras Med Trop. 2008 May-Jun;41(3):296-300. [ Links ]
156. Pinto AY, Valente VC, Coura JR, Valente SAS, Junqueira AC, Santos LC, et al. Clinical follow-up of responses to treatment with benznidazol in Amazon: a cohort study of acute Chagas disease. Plos One. 2013 May;8(5):e64450. [ Links ]
157. Centers for Disease Control and Prevention. Chagas disease after organ transplantation: United States, 2001. MMWR Morb Mortal Wkly Rep. 2002 Mar;51(10):210-2. [ Links ]
158. Centers for Disease Control and Prevention. Chagas disease after organ transplantation: Los Angeles, California, 2006. MMWR Morb Mortal Wkly Rep. 2006 Jul;55(29):798-800. [ Links ]
159. Rocha A, Ramos Júnior AN, Sartori AM, Correia D, Gontijo ED, Tatto E, et al. Recomendações para diagnóstico, tratamento e acompanhamento da co-infecção Trypanosoma cruzi: vírus da imunodeficiência humana. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):392-415. [ Links ]
160. Rassi A, Rassi Júnior A, Rassi GG. Fase aguda. In: Brener Z, Andrade Z, Barral-Netto M (orgs). Trypanosoma cruzi e Doença de Chagas. 2 ed. Rio de Janeiro: Guanabara Koogan; 2000. p.231-45. [ Links ]
161. Romaña C. Acerca de un síntoma inicial de valor para el diagnóstico de la forma aguda de la enfermedad de Chagas: la conjuntivitis schizotripanosómica unilateral: hipótesis sobre la puerta de entrada conjuntival de la enfermedad. Mision de Estudios de Patologia Regional Argentina (MEPRA)1935;22:16-25. [ Links ]
162. Lugones HS. Enfermedad de Chagas. Diagnóstico de su faz aguda. Santiago del Estero (Argentina): Universidad Católica de Santiago del Estero; 2001. [ Links ]
163. Ferreira HO, Pucci H. Estudo evolutivo da doença de Chagas com fase aguda conhecida. Rev Soc Bras Med Trop . 1982 jan-dez;15(1):125-30. [ Links ]
164. Ferreira HO, Miziara JL. Aspectos clínicos da cardiopatia chagásica aguda. In: Cançado JR, Chuster M (editores). Cardiopatia Chagásica. Belo Horizonte: Imprensa Oficial; 1985. [ Links ]
165. Parada H, Carrasco HA, Añez N, Fuenmayor C, Inglessis I. Cardiac involvement is a constant finding in acute Chagas’ disease: a clinical, parasitological and histopathological study. Int J Cardiol. 1997 Jun;60(1):49-54. [ Links ]
166. Wendell S. Doença de Chagas transfusional. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz ; 1997. p. 411-27. [ Links ]
167. Noya BA, Diaz- Bello Z, Colmenares C, Ruiz-Guevara R, Mauriello L, Zavala-Jaspe R, et al. Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J Infect Dis. 2010 May;201(9):1308-15. [ Links ]
168. Shaw J, Lainson R, Fraiha H. Considerações sobre a epidemiologia dos primeiros casos autóctones de doença de Chagas registrados em Belém, Pará, Brasil. Rev Saude Publica. 1969;3(2):153-7. [ Links ]
169. Pinto AYN, Ferreira Júnior AG, Valente VC, Harada GS, Valente SAS. Urban outbreak of acute Chagas disease in Amazon region of Brazil: four-year follow-up after treatment with benznidazole. Rev Panam Salud Publica. 2009 Jan;25(1):77-83. [ Links ]
170. Shikanai-Yasuda MA, Marcondes CB, Guedes LA, Siqueira GS, Barone AA, Dias JC, et al. Possible oral transmission of acute Chagas disease in Brasil. Rev Inst Med Trop Sao Paulo. 1991 Sep-Oct;33(5):351-7. [ Links ]
171. Jörg ME, Freire RS. Lipochagomata genii or lipochagomata of the cheeks, characteristic lesions of acute trypanosomiasis cruzi in children under three years of age. Acta Trop. 1961;18:318-50. [ Links ]
172. Medeiros MB, Guerra JAO, Lacerda MVG. Meningoencephalitis in a patient with acute Chagas disease in the Brazilian Amazon. Rev Soc Bras Med Trop. 2008 Sep-Oct; 41(5):520-1. [ Links ]
173. Freilij H, Altcheh J, Muchinik G. Perinatal human immunodeficiency virus infection and congenital Chagas’ disease. Pediatr Infect Dis J. 1995 Feb;14(2):161-2. [ Links ]
174. Nisida IV, Amato Neto V, Braz LM, Duarte MI, Umezawa ES. A survey of congenital Chagas’ disease, carried out at three health institutions in São Paulo City, Brazil. Rev Inst Med Trop Sao Paulo. 1999 Sep-Oct;41(5):305-11. [ Links ]
175. Sartori AM, Ibrahim KY, Nunes Westphalen EV, Braz LM, Oliveira Junior OC, Gakiya E, et al. Manifestations of Chagas disease (American trypanosomiasis) in patients with HIV/AIDS. Ann Trop Med Parasitol. 2007 Jan;101(1):31-50. [ Links ]
176. França LCM, Lemos S, Fleury RN, Melaragno Filho R, Ramos Júnior HA, Pasternak J. Moléstia de Chagas crônica associada à leucemia linfática: ocorrência de encefalite aguda como alteração do estado imunitário. Arq Neuro-Psiquiatr. 1969 mar;27(1):59-66. [ Links ]
177. Spina-França A, Livramento JA, Machado LR, Yasuda N. Anticorpos a Trypanosoma cruzi no líquido cefalorraqueano: pesquisa pelas reações de fixação do complemento e de imunofluorescência. Arq Neuro-Psiquiatr. 1988 dez;46(4):374-8. [ Links ]
178. Livramento JA, Machado LR, Spina-França A. Anormalidades do líquido cefalorraqueano em 170 casos de AIDS. Arq Neuro-Psiquiatr. 1989 set;47(3):326-31. [ Links ]
179. Del Castilho M, Mendoza G, Oviedo J, Perez Bianco PR, Anselmo AE, Silva M. AIDS and Chagas’ disease with central nervous system tumor-like lesion. Am J Med. 1990 Jun;88(6):693-4. [ Links ]
180. Ferreira MS, Nishioka SA, Rocha A, Silva AM, Ferreira RG, Olivier W, et al. Acute fatal Trypanosoma cruzi meningoencephalitis in a human immunodeficiency virus-positive hemophiliac patient. Am J Trop Med Hyg. 1991 Dec;45(6):723-7. [ Links ]
181. Riarte A, Luna C, Sabatiello R, Sinagra A, Schiavelli R, De Rissio A, et al. Chagas’ disease in patients with kidney transplants: 7 years of experience 1989-1996. Clin Infect Dis. 1999 Sep;29(3):561-7. [ Links ]
182. Campos SV, Strabelli TM, Amato Neto V, Silva CP, Bacal F, Bocchi EA, et al. Risk factors for Chagas’ disease reactivation after heart transplantation. J Heart Lung Transplant. 2008 Jun;27(6):597-602. [ Links ]
183. Ministério da Saúde (BR). Portaria nº 2.600, de 21 de outubro de 2009. Aprova o Regulamento Técnico do Sistema Nacional de Transplantes. Diário Oficial da República Federativa do Brasil, Brasília (DF), 2009 out 21;Seção 1:77. [ Links ]
184. Altclas J, Sinagra A, Dictar M, Luna C, Verón MT, De Rissio AM, et al. Chagas disease in bone marrow transplantation: an approach to preemptive therapy. Bone Marrow Transplant. 2005 Jul;36(2):123-9. [ Links ]
185. Barcán L, Luna C, Clara L, Sinagra A, Valledor A, De Rissio AM, et al. Transmission of T. cruzi infection via liver transplantation to a nonreactive recipient for Chagas’ disease. Liver Transpl. 2005 Sep;11(9):1112-6. [ Links ]
186. Rassi A, Amato Neto V, Siqueira AF, Ferriolli Filho F, Amato VS, Rassi Júnior A. Protective effect of benznidazole against parasite reactivation in patients chronically infected with Trypanosoma cruzi and treated with corticoids for associated diseases. Rev Soc Bras Med Trop. 1999 Sep-Oct;32(5):475-82. [ Links ]
187. Cordova E, Boschi A, Ambrosioni J, Cudos C, Corti M. Reactivation of Chagas disease with central nervous system involvement in HIV-infected patients in Argentina, 1992-2007. Int J Infect Dis. 2008 Nov;12(6):587-92. [ Links ]
188. Validade do conceito de forma indeterminada de doença de Chagas. Rev Soc Bras Med Trop. 1985 jan-mar;18(1):46. [ Links ]
189. Dias JC. The indeterminate form of human chronic Chagas’ disease: a clinical epidemiological review. Rev Soc Bras Med Trop. 1989 Jul-Sep;22(3):147-56. [ Links ]
190. Macêdo VO. Forma indeterminada da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e Terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Editora Fiocruz ; 1997. p.135-51. [ Links ]
191. Macêdo VO. Indeterminate form of Chagas disease. Mem Inst Oswaldo Cruz. 1999 Sep;94 Suppl 1:311-6. [ Links ]
192. Ianni BM, Arteaga E, Frimm CC, Pereira Barretto AC, Mady C. Chagas’ heart disease: evolutive evaluation of electrocardiographic and echocardiographic parameters in patients with the indeterminate form. Arq Bras Cardiol. 2001 Jul;77(1):59-62. [ Links ]
193. Dias JCP, Machado EMM, Borges ÉC, Moreira EF, Gontijo C, Azeredo BVM. Doença de Chagas em Lassance, MG. Reavaliação clínico-epidemiológica 90 anos após a descoberta de Carlos Chagas. Rev Soc Bras Med Trop. 2002 mar-apr;35(2):167-76. [ Links ]
194. Almeida EA, Barbosa Neto RM, Guariento ME, Wanderley JS, Souza ML. Apresentação clínica da doença de Chagas crônica em indivíduos idosos. Rev Soc Bras Med Trop. 2007 mai-jun;40(3):311-5. [ Links ]
195. Villela E. Moléstia de Chagas: descrição clínica, 5ª parte. Folha Médica. 1923; 4:65-6. [ Links ]
196. Dias E, Laranja FS, Miranda A, Nóbrega G. Chagas’ disease: a clinical, epidemiologic and pathologic study. Circulation. 1956 Dec;14(6):1035-60. [ Links ]
197. Prata A, Macedo V. Morbidity of Chagas’ heart disease. Mem Inst Oswaldo Cruz. 1984;79 Suppl:93-6. [ Links ]
198. Organización Mundial de la Salud; Organización Panamericana de la Salud. Aspectos clínicos de la enfermedad de Chagas. Informe de una reunión conjunta OMS/OPAS de investigadores. Bol Oficina Sanit Panam. 1974;76:141-58. [ Links ]
199. Conselho Nacional de Pesquisa. Epidemiologia da doença de Chagas: objetivos e metodologia dos estudos longitudinais. Rio de Janeiro: Conselho Nacional de Pesquisa; 1974. 46 p. Relatório Técnico nº 1. [ Links ]
200. Oliveira Júnior W. Forma indeterminada da doença de Chagas: implicações médico-trabalhistas. Arq Bras Cardiol. 1990 fev;54(2):89-91. [ Links ]
201. Guariento ME, Camilo MVF, Camargo AMA. Working conditions of Chagas’ disease patients in a large Brazilian city. Cad Saude Publica. 1999 Apr-Jun;15(2):381-6. [ Links ]
202. Dias JCP, Siqueira IOC, Dias RB. Doença de Chagas: diagnóstico e manejo na atenção primária à saúde. In: Gusso G, Lopes JMC. Tratado de Medicina de Família e Comunidade: 2 Volumes: Princípios, Formação e Prática. Porto Alegre: Artmed; 2012. p. 2067-80. [ Links ]
203. Castro I, Andrade JP, Paola AAV, Vilas-Boas F, Oliveira GMM, Marin-Neto JA, et al. Sociedade Brasileira de Cardiologia. I Diretriz Latino-Americana para o diagnóstico e tratamento da cardiopatia chagásica. Arq Bras Cardiol. 2011 Aug;97(2 Suppl 3):1-48. [ Links ]
204. Ozaki Y, Guariento ME, Almeida EA. Quality of life and depressive symptoms in Chagas disease patients. Qual Life Res. 2011 Feb;20(1):133-8. [ Links ]
205. Higuchi ML, Benvenuti LA, Reis MR, Metzger M. Pathophysiology of the heart in Chagas’ disease: current status and new developments. Cardiovasc Res. 2003 Oct;60(1):96-107. [ Links ]
206. Higuchi ML. Chagas disease: importance of the parasite in the pathogenesis of the cardiac chronic disease. Arq Bras Cardiol. 1995 Mar;64(3):251-4. [ Links ]
207. Higuchi ML. Chronic chagasic cardiopathy: the product of a turbulent host-parasite relationship. Rev Inst Med Trop Sao Paulo. 1997 Jan-Feb;39(1):53-60. [ Links ]
208. Marin-Neto JA, Cunha-Neto E, Maciel BC, Simões MV. Pathogenesis of chronic Chagas heart disease. Circulation. 2007 Mar;115(9):1109-23. [ Links ]
209. Chagas C, Villela E. Forma cardíaca da Trypanosomíase americana. Mem Inst Oswaldo Cruz. 1922;14(1):5-61. [ Links ]
210. Coura JR, Abreu LL, Pereira JB, Willcox HP. Morbidity in Chagas’ disease. IV. longitudinal study of 10 years in Pains and Iguatama, Minas Gerais, Brazil. Mem Inst Oswaldo Cruz. 1985 Jan-Mar;80(1):73-80. [ Links ]
211. Pereira Barretto AC, Mady C, Arteaga-Fernandez E, Stolf N, Lopes EA, Higuchi ML, et al. Right ventricular endomyocardial biopsy in chronic Chagas’ disease. Am Heart J. 1986 Feb;111(2):307-12. [ Links ]
212. Prata A, Lopes ER, Chapadeiro E. Characteristics of unexpected sudden death in Chagas disease. Rev Soc Bras Med Trop. 1986 Jan-Mar;19(1):9-12. [ Links ]
213. Dias JC, Kloetzel K. The prognostic value of the electrocardiographic features of chronic Chagas’ disease. Rev Inst Med Trop Sao Paulo. 1968 May-Jun;10(3):158-62. [ Links ]
214. Bestetti RB, Muccillo G. Clinical course of Chagas’ heart disease: a comparison with dilated cardiomyopathy. Int J Cardiol. 1997 Jul;60(2):187-93. [ Links ]
215. Pinto AY, Harada GS, Valente VD, Abud JE, Gomes FD, Souza GC, et al. Cardiac attacks in patients with acute Chagas disease in a family micro-outbreak, in Abaetetuba, Brazilian Amazon. Rev Soc Bras Med Trop. 2001 Sep-Oct;34(5):413-9. [ Links ]
216. Souza DSM, Almeida AJB, Costa FA, Costa EG, Figueiredo MTS, Póvoa RMS. O eletrocardiograma na fase aguda da Doença de Chagas por transmissão oral. Rev Bras Cardiol. 2013 mar-abr;26(2):127-30. [ Links ]
217. Nishioka SA, Ferreira MS, Rocha A, Burgarelli MK, Silva AM, Duarte MI, et al. Reactivation of Chagas’ disease successfully treated with benznidazole in a patient with acquired immunodeficiency syndrome. Mem Inst Oswaldo Cruz. 1993 Jul-Sep;88(3):493-6 [ Links ]
218. Almeida EA, Silva EL, Guariento ME, Souza ML, Aoki FH, Pedro RJ. Fatal evolution of Chagas’ disease/Aids co-infection: diagnostic difficulties between myocarditis reactivation and chronic chagasic myocardiopathy. Rev Soc Bras Med Trop. 2009 Mar-Apr;42(2):199-202. [ Links ]
219. Perez-Ramirez L, Barnabé C, Sartori AM, Ferreira MS, Tolezano JE, Nunes EV, et al. Clinical analysis and parasite genetic diversity in human immunodeficiency virus/Chagas’ disease coinfections in Brazil. Am J Trop Med Hyg. 1999 Aug;61(2):198-206. [ Links ]
220. Bestetti RB, Dalbo CM, Freitas OC, Teno LA, Castilho OT, Oliveira JS. Noninvasive predictors of mortality for patients with Chagas’ heart disease: a multivariate stepwise logistic regression study. Cardiology. 1994;84(4-5):261-7. [ Links ]
221. Mady C, Cardoso RH, Barretto AC, Luz PL, Bellotti G, Pileggi F. Survival and predictors of survival in patients with congestive heart failure due to Chagas’ cardiomyopathy. Circulation. 1994 Dec;90(6):3098-102. [ Links ]
222. Rassi Júnior A, Rassi A, Little WC, Xavier SS, Rassi SG, Rassi AG, et al. Development and validation of a risk score for predicting mortality in Chagas’ heart disease. N Engl J Med. 2006 Aug 24;355(8):799-808. [ Links ]
223. Xavier SS, Sousa AS, Hasslocher-Moreno A. Application of the new classification of cardiac insufficiency (ACC/AHA) in chronic Chagas cardiopathy: a critical analysis of the survival curves. Rev SOCERJ. 2005 mai-jun;18(3):227-32. [ Links ]
224. Rodriguez-Salas LA, Klein E, Acquatella H, Catalioti F, Davalos V, Gomez-Mancebo JR, et al. Echocardiographic and clinical predictors of mortality in chronic Chagas’ disease. Echocardiography. 1998 Apr;15(3):271-278. [ Links ]
225. Viotti RJ, Vigliano C, Laucella S, Lococo B, Petti M, Bertocchi G, et al. Value of echocardiography for diagnosis and prognosis of chronic Chagas’ disease cardiomyopathy without heart failure. Heart. 2004 Jun;90(6):655-60. [ Links ]
226. Acquatella H, Schiller NB, Puigbó JJ, Giordano H, Suárez JA, Casal H, et al. M-mode and two-dimensional echocardiography in chronic Chagas’ heart disease: a clinical and pathologic study. Circulation. 1980 Oct;62(4):787-99. [ Links ]
227. Dias JCP. História natural da cardiopatia chagásica. In: Cançado JR, Chuster M. Cardiopatia chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985. p. 99-110. [ Links ]
228. Carrasco HA, Parada H, Guerrero L, Duque M, Durán D, Molina C. Prognostic implications of clinical, electrocardiographic and hemodynamic findings in chronic Chagas’ disease. Int J Cardiol. 1994 Jan;43(1):27-38. [ Links ]
229. Garzon SA, Lorga AM, Nicolau JC. Electrocardiography in Chagas’ heart disease. Sao Paulo Med J. 1995 Mar-Apr;113(2):802-13. [ Links ]
230. Marin-Neto JA, Simões MV, Sarabanda AV. Chagas’ heart disease. Arq Bras Cardiol. 1999;72(3):247-80. [ Links ]
231. Almeida-Filho OC, Maciel BC, Schmidt A, Pazin-Filho A, Marin-Neto JA. Minor segmental dyssynergy reflects extensive myocardial damage and global left ventricle dysfunction in chronic Chagas disease. J Am Soc Echocardiogr. 2002 Jun;15(6):610-6. [ Links ]
232. Pazin-Filho A, Romano MM, Gomes Furtado R, Almeida Filho OC, Schmidt A, Marin-Neto JA, et al. Left ventricular global performance and diastolic function in indeterminate and cardiac forms of Chagas’ disease. J Am Soc Echocardiogr. 2007 Dec;20(12):1338-43. [ Links ]
233. Rassi A Júnior, Rassi A, Rassi SG. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation . 2007 Mar;115(9):1101-8 [ Links ]
234. Xavier SS, Sousa AS, Brasil PEAA, Gabriel FG, Holanda MT, Hasslocher-Moreno A, et al. Incidência e preditores de morte súbita na cardiopatia chagásica crônica com função sistólica preservada. Rev SOCERJ. 2005 set-out;18(5):457-63. [ Links ]
235. Cunha GP. Síndromes clínicas na cardiomiopatia chagásica crônica. Hospital. 1960;57:71-95. [ Links ]
236. Rassi Jr A, Marin-Neto JA. Estado da Arte. Cardiopatia chagásica crônica. Rev Soc Cardiol Est São Paulo. 2000;10(4):6-12. [ Links ]
237. Rassi Júnior A, Rassi AG, Rassi SG, Rassi Júnior L, Rassi A. Arritmias ventriculares na doença de Chagas. Particularidades diagnósticas, prognósticas e terapêuticas. Arq Bras Cardiol. 1995 out;65(4):377-87. [ Links ]
238. Rassi Júnior A, Rassi SG, Rassi A. Morte súbita na Doença de Chagas. Arq Bras Cardiol. 2001 jan;76(1):75-85. [ Links ]
239. Rassi Júnior A, Rassi AG, Rassi SG, Rassi Júnior L, Las Casas AA, Rassi A. Arritmia ventricular na insuficiência cardíaca de etiologia chagásica e não chagásica. Arq Bras Cardiol. 1993;61 supl II:11-9. [ Links ]
240. Scanavacca M, Sosa E. Electrophysiologic study in chronic Chagas’ heart disease. Sao Paulo Med J. 1995 Mar-Apr;113(2):841-50. [ Links ]
241. Chiale PA, Halpern MS, Nau GJ, Tambussi AM, Przybylski J, Lázzari JO, et al. Efficacy of amiodarone during long-term treatment of malignant ventricular arrhythmias in patients with chronic chagasic myocarditis. Am Heart J. 1984 Apr;107(4):656-65. [ Links ]
242. Silva CP, Bacal F, Pires PV, Drager LF, Souza GEC, Fajardo GM, et al. Importance of amiodarone pulmonary toxicity in the differential diagnosis of a patient with dyspnea awaiting a heart transplant. Arq Bras Cardiol. 2006 Sep;86(3):e4-7. [ Links ]
243. Zimerman LI, Fenelon G, Martinelli Filho M, Grupi C, Atié J, Lorga Filho A, et al; Sociedade Brasileira de Cardiologia. Diretrizes brasileiras de fibrilação atrial. Arq Bras Cardiol. 2009;92(6 supl 1):1-39. [ Links ]
244. Martinelli Filho M, Zimerman LI, Lorga AM, Vasconcelos JTM, Rassi Júnior A; Sociedade Brasileira de Cardiologia. Diretrizes brasileiras de dispositivos eletrônicos implantáveis (DCEI). Arq Bras Cardiol. 2007; 89(6):e210-e238. [ Links ]
245. Baroldi G, Oliveira SJ, Silver MD. Sudden and unexpected death in clinically ‘silent’ Chagas’ disease. A hypothesis. Int J Cardiol. 1997 Feb;58(3):263-8. [ Links ]
246. Marin-Neto JA, Simões MV, Maciel BC. Aspectos peculiares da fisiopatologia da insuficiência cardíaca na doença de Chagas. Rev Soc Cardiol Est São Paulo. 1998;8(2):243-52. [ Links ]
247. Simões MV, Almeida Filho OC, Pazin Filho A, Castro RBP, Schmidt A, Maciel BC, et al. Insuficiência cardíaca na doença de Chagas. Rev Soc Cardiol Est São Paulo. 2000 Jan-Fev;10(1):50-64. [ Links ]
248. Bocchi EA, Marcondes-Braga FG, Bacal F, Ferraz AS, Albuquerque D, Rodrigues D, et al; Sociedade Brasileira de Cardiologia. Atualização da Diretriz Brasileira de Insuficiência Cardíaca Crônica: 2012. Arq Bras Cardiol. 2012 jan;98(1 supl 1):1-33. [ Links ]
249. Rocha MOC, Ribeiro AL, Teixeira MM. Clinical management of chronic Chagas cardiomyopathy. Front Biosci. 2003 Jan;8:e44-54. [ Links ]
250. Marin-Neto JA, Rassi A Júnior, Morillo CA, Avezum A, Connolly SJ, Sosa-Estani S, et al; BENEFIT Investigators. BENEFIT Investigators. Rationale and design of a randomized placebo-controlled trial assessing the effects of etiologic treatment in Chagas’ cardiomyopathy: the BENznidazole Evaluation For Interrupting Trypanosomiasis (BENEFIT). Am Heart J. 2008 Jul;156(1):37-43. [ Links ]
251. Morillo CA, Marin-Neto JA, Avezum A, Sosa-Estani S, Rassi Júnior A, Rosas F, et al; BENEFIT Investigators. Randomized Trial of Benznidazole for Chronic Chagas’ Cardiomyopathy. N Engl J Med. 2015 Oct;373(14):1295-306. [ Links ]
252. Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med. 2006 May;144(10):724-34. [ Links ]
253. Viotti R, Vigliano C, Lococo B, Petti M, Bertocchi G, Alvarez MG, et al. Clinical predictors of chronic chagasic myocarditis progression. Rev Esp Cardiol. 2005 Sep;58(9):1037-44. [ Links ]
254. Marin-Neto JA, Rassi Júnior A, Sousa AS, Dias JCP, Rassi A. Doença de Chagas: moléstia negligenciada. In: Andrade JP, Arnett DK, Pinto FJ (editores). Tratado de Prevenção Cardiovascular. Um Desafio Global. São Paulo: Atheneu; 2014. p. 117-27. [ Links ]
255. Montera MW, Pereira SB, Colafranceschi AS, Almeida DR, Tinoco EM, Rocha RM, et al. Sumário de Atualização da II Diretriz Brasileira de Insuficiência Cardíaca Aguda: 2009/2011. Arq Bras Cardiol. 2012;98(5):375-83. [ Links ]
256. Roberti RR, Martinez EE, Andrade JL, Araujo VL, Brito FS, Portugal OP, et al. Chagas cardiomyopathy and captopril. Eur Heart J. 1992 Jul;13(7):966-70. [ Links ]
257. Davila DF, Angel F, Arata de Bellabarba G, Donis JH. Effects of metoprolol in chagasic patients with severe congestive heart failure. Int J Cardiol. 2002 Oct;85(2-3):255-60. [ Links ]
258. Freitas H, Salaltino G, Chizzola P, Costa J, Mansur A, Ramires JF, et al. Betablockers for Chagas’ heart disease. J Am Coll Cardiol. 1999;33 Suppl A:184. [ Links ]
259. Bocchi EA, Bellotti G, Uip D, Kalil J, Lourdes Higuchi M, Fiorelli A, et al. Long-term follow-up after heart transplantation in Chagas’ disease. Transplant Proc. 1993 Feb;25(1 Pt 2):1329-30. [ Links ]
260. Carvalho VB, Sousa EF, Vila JH, Silva JP, Caiado MR, Araujo SR, et al. Heart transplantation in Chagas’ disease. 10 Years after the initial experience. Circulation. 1996 Oct;94(8):1815-7. [ Links ]
261. Ribeiro dos Santos R, Rassi S, Feitosa G, Grecco OT, Rassi Júnior A, Cunha AB, et al; Chagas Arm of the MiHeart Study Investigators. Cell therapy in Chagas cardiomyopathy (Chagas arm of the multicenter randomized trial of cell therapy in cardiopathies study): a multicenter randomized trial. Circulation. 2012 May;125(20):2454-61. [ Links ]
262. Samuel J, Oliveira M, Correa De Araujo RR, Navarro MA, Muccillo G. Cardiac thrombosis and thromboembolism in chronic Chagas’ heart disease. Am J Cardiol. 1983 Jul;52(1):147-51. [ Links ]
263. Lopes ER, Marquez JO, Costa Neto B, Menezes AAC, Chapadeiro E. Associação entre acidentes vasculares encefálicos e doença de Chagas. Rev Soc Bras Med Trop. 1991 Apr-Jun;24(2):101-4. [ Links ]
264. Sousa AS, Xavier SS, Freitas GR, Hasslocher-Moreno A. Prevention strategies of cardioembolic ischemic stroke in Chagas’ disease. Arq Bras Cardiol. 2008 Nov;91(5):306-10. [ Links ]
265. Oliveira Júnior W. O cardiopata chagásico em situações especiais. In: Pinto JC, Rodrigues J (Orgs). Clínica e terapêutica da doença de Chagas. 2 ed. Rio de Janeiro: Fiocruz; 1997. p. 293-322. [ Links ]
266. Bestetti RB. Avaliação do risco cirúrgico em pacientes portadores de cardiopatia chagásica crônica em cirurgias não cardíacas. In: Pinto JC, Rodrigues J (Orgs). Clínica e terapêutica da doença de Chagas. 2 ed. Rio de Janeiro: Fiocruz; 1997. p. 281-91. [ Links ]
267. Ramos G, Ramos Filho J, Rassi Júnior A, Pereira E, Gabriel Neto S, Chaves E. Marcapasso cardíaco artificial: considerações pré e per-operatórias. Rev Bras Anestesiol. 2003 nov-dez;53(6):854-62. [ Links ]
268. Prata A. Implicações epidemiológicas e sócio-econômicas da doença de Chagas. Brasilia Med. 1973;9:69-71. [ Links ]
269. Porto CC, Rassi A, Faria GHDC. Aspectos sócio-econômicos e médico-trabalhistas. In: Cançado JR, Chuster M (editores). Cardiopatia Chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985. p. 362-6. [ Links ]
270. Dias JCP. Aspectos clínicos, sociais e trabalhistas da doença de Chagas em área endêmica sob controle do estado de Minas Gerais, Brasil. Rev Soc Bras Med Trop. 1999 apr-jun;26(2):93-9. [ Links ]
271. Morais BB, Martins P, Maiolini DD, Silva AL, Melo JRC. Concomitant lesions in Chagas’ disease. Eur J Gastroenterol Hepatol. 1991;3(7):523-6. [ Links ]
272. Fonseca FM, Etchebehere RM, Queiroz DM, Rocha AM, Junqueira IS, Fonseca DN, et al. Histological and endoscopic features of the stomachs of patients with Chagas disease in the era of Helicobacter pylori. Rev Soc Bras Med Trop. 2014 Nov-Dec;47(6):739-46. [ Links ]
273. Rezende JM. Classificação radiológica do megaesôfago. Rev Goiana Med. 1982 jul-dez;28(3/4):187-91. [ Links ]
274. Brücher BL, Stein HJ, Bartels H, Feussner H, Siewert JR. Achalasia and esophageal cancer: incidence, prevalence, and prognosis. World J Surg. 2001 Jun;25(6):745-9. [ Links ]
275. Leeuwenburgh I, Scholten P, Alderliesten J, Tilanus HW, Looman CW, Steijerberg EW, et al. Long-term esophageal cancer risk in patients with primary achalasia: a prospective study. Am J Gastroenterol. 2010 Oct;105(10):2144-9. [ Links ]
276. Pérez-Ayala A, Pérez-Molina JA, Norman F, Monge-Maillo B, Faro MV, López-Vélez R. Gastro-intestinal Chagas disease in migrants to Spain: prevalence and methods for early diagnosis. Ann Trop Med Parasitol. 2011 Jan;105(1):25-9. [ Links ]
277. Oliveira RB, Troncon LEA, Dantas RO, Meneghelli UG. Gastrointestinal manifestations of Chagas disease. Am J Gastroenterol. 1998 Jun;93(6):884-9. [ Links ]
278. Meier-Ruge WA, Müller-Lobeck H, Stoss F, Bruder E. The pathogenesis of idiopathic megacolon. Eur J Gastroenterol Hepatol. 2006 Nov;18(11):1209-15. [ Links ]
279. Pasricha PJ, Rai R, Ravich WJ, Hendrix TR, Kalloo AN. Botulinum toxin for achalasia: long-term outcome and predictors of response. Gastroenterology. 1996 May;110(5):1410-5. [ Links ]
280. Ferguson MK. Achalasia: current evaluation and therapy. Ann Thorac Surg. 1991 Aug;52(2):336-42. [ Links ]
281. Heller E. Extramukose Cardiaplastik beim chronischen Cardiospasmus mit Dilatation des Oesophagus. Mitt Grenzgeb Med Chir. 1913;27(1):141-49. [ Links ]
282. Pinotti HW, Habr-Gama A, Cecconello I, Felix VN, Zilbertein B. The surgical treatment of megaesophagus and megacolon. Dig Dis. 1993 Jul-Oct;11(4-5):206-15. [ Links ]
283. Spiess AE, Kahrilas PJ. Treating achalasia: from whalebone to laparoscope. JAMA. 1998 Aug;280(7):638-42. [ Links ]
284. NOSCAR POEM White Paper Committee; Stavropoulos SN, Desilets DJ, Fuchs KH, Gostout CJ, Haber G, Inoue H, et al. Per-oral endoscopic myotomy white paper summary. Gastrointest Endosc. 2014 Jul;80(1):1-15. [ Links ]
285. Inoue H, Tianle KM, Ikeda H, Hosoya T, Onimaru M, Yoshida A, et al. Peroral endoscopic myotomy for esophageal achalasia: technique, indication, and outcomes. Thorac Surg Clin. 2011 Nov;21(4):519-25. [ Links ]
286. Swanstrom LL, Kurian A, Dunst CM, Sharata A, Bhayani N, Rieder E. Long-term outcomes of an endoscopic myotomy for achalasia: the POEM procedure. Ann Surg. 2012 Oct;256(4):659-67. [ Links ]
287. Duhamel B. Une nouvelle opération pour le mégacolon cologénital: l’abaissement rétro-rectal et transanal du côlon et son application possible au traitement de quelques autres malformations. Nouv Presse Med. 1956; 64(95):2249-50. [ Links ]
288. Reis-Neto JA, Pedroso MA, Lupinacci RA, Reis Júnior JA, Ciquini SA, Lupinacci RM, et al. Megacolo adquirido: perspectivas fisiopatológicas para o tratamento laparoscópico. Rev Bras Colo-proctol. 2004 jan-mar;24(1):49-62. [ Links ]
289. Coura JR, Borges-Pereira J. Chronic phase of Chagas disease: why should it be treated? A comprehensive review. Mem Inst Oswaldo Cruz. 2011 Sep;106(6):641-5. [ Links ]
290. Molina I, Gómez i Prat J, Salvador F, Treviño B, Sulleiro E, Serre N, et al. Randomized trial of posaconazole and benznidazole for chronic Chagas’ disease. N Engl J Med. 2014 May;370:1899-908. [ Links ]
291. Cançado JR. Terapêutica específica. In: Dias JCP, Coura JR, editores. Clínica e Terapêutica da Doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz; 1997. p. 323-51. [ Links ]
292. Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel BM, Yampotis C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. Am J Trop Med Hyg. 1988 Oct;59(4):526-9. [ Links ]
293. Andrade AL, Zicker F, Oliveira RM, Silva SA, Luquetti A, Travassos LR, et al. Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet. 1996 Nov;348(9039):1407-13. [ Links ]
294. Yun O, Lima MA, Ellman T, Chambi W, Castillo S, Flevaud L, et al. Feasibility, drug safety, and effectiveness of etiological treatment programs for Chagas disease in Honduras, Guatemala, and Bolivia: 10-year experience of Médecins Sans Frontières. PLoS Negl Trop Dis. 2009 Jul;3(7):e488. [ Links ]
295. Bern C, Montgomery SP, Herwaldt BL, Rassi Júnior A, Marin-Neto JA, Dantas RO, et al. Evaluation and treatment of Chagas disease in the United States: a systematic review. JAMA. 2007 Nov;298(18):2171-81. [ Links ]
296. Coura JR, Abreu LL, Willcox HP, Petana W. Comparative controlled study on the use of benznidazole, nifurtimox and placebo, in the chronic form of Chagas’ disease, in a field area with interrupted transmission. I. Preliminary evaluation. Rev Soc Bras Med Trop. 1997 Mar-Apr;30(2):139-44. [ Links ]
297. Bitto C, Silveira C, Cardoso MA, Marques P, Luquetti A, Macedo V, et al. Parasite persistence in treated chagasic patients revealed by xenodiagnosis and polymerase chain reaction. Mem Inst Oswaldo Cruz. 2001 Aug;96(6):823-6. [ Links ]
298. Gallerano RH, Sosa RR. Resultados de un estúdio a largo plazo con drogas antiparasitárias en infectados chagásicos crónicos. Rev Fed Arg Cardiol. 2001;30:289-96. [ Links ]
299. Fragata Filho AA. Tratamento antiparasitário da doença de Chagas. Rev Soc Cardiol Estado de São Paulo. 2009;19:2-5. [ Links ]
300. Andrade SG, Magalhães JB, Pontes AL. Terapêutica da fase crônica da infecção experimental pelo Trypanosoma cruzi com o benzonidazol e o nifurtimox. Rev Soc Bras Med Trop. 1989 Jul-Sep;22(3):113-8. [ Links ]
301. Garcia S, Ramos CO, Senra JFV, Vilas-Boas F, Rodrigues MM, Campos-de-Carvalho AC, et al. Treatment with benznidazole during the chronic phase of experimental Chagas’ disease decreases cardiac alterations. Antimicrob Agents Chemother. 2005 Apr;49(4):1521-8. [ Links ]
302. Coura JR, Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz. 2002 Jan;97(1):3-24. [ Links ]
303. Maguire JH. Treatment of Chagas’ disease: time is running out. N Engl J Med. 2015 Oct;373(14):1369-70. [ Links ]
304. D’Albuquerque LA, Gonzalez AM, Filho HL, Copstein JL, Larrea FI, Mansero JM, et al. Liver transplantation from deceased donors serologically positive for Chagas disease. Am J Transplant. 2007 Mar;7(3):680-4. [ Links ]
305. Altclas JD, Barcan L, Nagel C, Lattes R, Riarte A. Organ transplantation and Chagas disease. JAMA. 2008 Mar;299(10):1134. [ Links ]
306. Sousa AA, Lobo MC, Barbosa RA, Bello V. Chagas seropositive donors in kidney transplantation. Transplant Proc. 2004 May;36(4):868-9. [ Links ]
307. Bocchi EA, Belloti G, Mocelin AO, Uip D, Bacal F, Higuchi ML, et al. Heart transplantation for chronic Chagas’ disease. Ann Thorac Surg. 1996 Jun;61(6):1727-33. [ Links ]
308. Freitas VL, Silva SC, Sartori AM, Bezerra RC, Westphalen EV, Molina TD, et al. Real-time PCR in HIV/Trypanosoma cruzi coinfection with and without Chagas disease reactivation: association with HIV viral load and CD4 level. PLoS Negl Trop Dis. 2011 Aug;5(8):e1277. [ Links ]
309. Brener Z. Laboratory-acquired Chagas’ disease: an endemic disease among parasitologists? In: Morel M, editor. Genes and antigens of parasites: a laboratory manual. 2 ed. Rio de Janeiro: Editora Fiocruz; 1984. p. 3-9. [ Links ]
310. Brener Z. Laboratory-acquired Chagas disease: comment. Trans R Soc Trop Med Hyg. 1987;81(3):527. [ Links ]
311. Shikanai-Yasuda MA, Umezawa ES, Tolezano JE, Matsubara L. Doença de Chagas aguda após uso profilático de benznidazol (Acidente de laboratório). Rev Soc Bras Med Tropical. 1993;26 supl II:127-8. [ Links ]
312. Bern C. Chagas’ Disease. N Engl J Med. 2015 Nov;373(19):1881-2. [ Links ]
313. Portela-Lindoso AAB, Shikanai-Yasuda MA. Doença de Chagas crônica: do xenodiagnóstico e hemocultura à reação em cadeia da polimerase. Rev Saude Publica. 2003 fev;37(1):107-15. [ Links ]
* Este artículo fue publicado originalmente en portugués (Brasil), bajo licencia de Creative Commons CC BY NC para uso no comercial, según la referencia: Dias JCP, Ramos Jr. AN, Gontijo ED, Luquetti A, Shikanai-Yasuda MA, Coura JR et al. II Consenso Brasileiro em Doença de Chagas, 2015. Epidemiol Serv Saúde 2016; 25 (esp):7-86. Disponible en: http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S1679-49742016000500007&lng=pt. / http://dx.doi.org/10.5123/S1679-49742016000500002
REFERENCIAS
1. World Health Organization. Research priorities for Chagas disease, human African trypanosomiasis and leishmaniasis. WHO: technical report of the TDR Disease Reference Group on Chagas Disease, Human African Trypanosomiasis and Leishmaniasis. Geneva: World Health Organization; 2012. (WHO Technical Report Series, 975). [ Links ]
2. World Health Organization. Sustaining the drive to overcome the global impact of neglected tropical diseases: second WHO report in neglected tropical diseases. Geneva: World Health Organization; 2013. [ Links ]
3. Dias JC, Silveira AC, Schofield CJ. The impact of Chagas disease control in Latin America: a review. Mem Inst Oswaldo Cruz. 2002 Jul;97(5):603-12. [ Links ]
4. Coura JR, Dias JC. Epidemiology, control and surveillance of Chagas disease: 100 years after its discovery. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:31-40. [ Links ]
5. World Health Organization. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Wkly Epidemiol Rec. 2015 Feb;90(6):33-44. [ Links ]
6. Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:17-30. [ Links ]
7. Schmunis GA, Yadon ZE. Chagas disease: a Latin American health problem becoming a world health problem. Acta Trop. 2010 Jul-Aug;115(1-2):14-21. [ Links ]
8. Centers for Disease Control and Prevention. Center for Global Health. Division of Parasitic Diseases and Malaria. Chagas disease in the Americas: 2013. Atlanta: Centers for Disease Control and Prevention; 2013. [ Links ]
9. Hotez PJ, Dumonteil E, Betancourt Cravioto M, Bottazzi ME, Tapia-Conyer R, Meymandi S, et al. An unfolding tragedy of Chagas disease in North America. PLoS Negl Trop Dis. 2013 Oct;7(10):e2300. [ Links ]
10. Dias JCP. Human chagas disease and migration in the context of globalization: some particular aspects. J Trop Med. 2013:789758. [ Links ]
11. Coura JR, Viñas PA, Junqueira AC. Ecoepidemiology, short history and control of Chagas disease in the endemic countries and the new challenge for non-endemic countries. Mem Inst Oswaldo Cruz. 2014 Nov;109(7):856-62. [ Links ]
12. European Centre for Disease Prevention and Control. Assessing the burden of key infectious diseases affecting migrant populations in the EU/EEA: technical report. Stockholm: ECDC; 2014. [ Links ]
13. Requena-Méndez A, Aldasoro E, Lazzari E, Sicuri E, Brown M, Moore DA, et al. Prevalence of Chagas disease in Latin-American migrants living in Europe: a systematic review and meta-analysis. PLoS Negl Trop Dis. 2015 Feb;9(2):e0003540. [ Links ]
14. World Health Organization. Chagas disease (American trypanosomiasis) [Internet]. Geneva: World Health Organization ; 2015 [citado 2015 Nov 13]. Disponível em: Disponível em: http://www.who.int/mediacentre/factsheets/fs340/en/ [ Links ]
15. Ramos Júnior AN, Carvalho DM. Chagas’ disease: past, present and future. Cad Saude Colet. 2009;17(4):787-94. [ Links ]
16. Strasen J, Williams T, Ertl G, Zoller T, Stich A, Ritter O. Epidemiology of Chagas disease in Europe: many calculations, little knowledge. Clin Res Cardiol. 2014 Jan;103(1):1-10. [ Links ]
17. Pan American Health Organization. Estimación cuantitativa de la enfermedad de Chagas en las Americas. Washington: Pan American Health Organization; 2006. [ Links ]
18. Dias JCP. Southern Cone Initiative for the elimination of domestic populations of Triatoma infestans and the interruption of transfusion Chagas disease: historical aspects, present situation, and perspectives. Mem Inst Oswaldo Cruz. 2007 Oct;102 Suppl 1:11-8. [ Links ]
19. Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Dis. 2001 Sep;1(2):92-100. [ Links ]
20. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Consenso Brasileiro em Doença de Chagas. Rev Soc Bras Med Trop. 2005;38 Supl 3:1-29. [ Links ]
21. Organização Pan-americana da Saúde. Guia para vigilância, prevenção, controle e manejo clínico da doença de Chagas aguda transmitida por alimentos. Rio de Janeiro: Organização Pan-Americana da Saúde; 2009. (Série de Manuais Técnicos, 12). [ Links ]
22. Silveira AC, Dias JCP. O controle da transmissão vetorial. Rev Soc Bras Med Trop. 2011;44 supl 2:52-63. [ Links ]
23. Coura JR. The main sceneries of Chagas disease transmission. The vectors, blood and oral transmissions: a comprehensive review. Mem Inst Oswaldo Cruz. 2015 May;110(3):277-82. [ Links ]
24. Victora CG, Wagstaff A, Schellenberg JA, Gwatkin D, Claeson M, Habicht JP. Applying an equity lens to child health and mortality: more of the same is not enough. Lancet. 2003 Jul;362(9379):233-41. [ Links ]
25. Zingales B, Andrade SG, Briones MR, Campbell DA, Chiari E, Fernandes O, et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz. 2009 Nov;104(7):1051-4. [ Links ]
26. Zingales B, Miles MA, Moraes CB, Luquetti A, Guhl F, Schijman AG, et al. Drug discovery for Chagas disease should consider Trypanosoma cruzi strain diversity. Mem Inst Oswaldo Cruz. 2014 Aug;109(6):828-33. [ Links ]
27. Messenger LA, Miles MA, Bern C. Between a bug and a hard place: Trypanosoma cruzi genetic diversity and the clinical outcomes of Chagas disease. Expert Rev Anti Infect Ther. 2015 Aug;13(8):995-1029. [ Links ]
28. Victora CG, Barreto ML, Carmo Leal M, Monteiro CA, Schmidt MI, Paim J, et al. Health conditions and health-policy innovations in Brazil: the way forward. Lancet. 2011 Jun;377(9782):2042-53. [ Links ]
29. Barreto ML, Teixeira MG, Bastos FI, Ximenes RAA, Barata RB, Rodrigues LC. Successes and failures in the control of infectious diseases in Brazil: social and environmental context, policies, interventions, and research needs. Lancet. 2011 May;377(9780):1877-89. [ Links ]
30. Mendes EV. O cuidado das condições crônicas na atenção primária à saúde: o imperativo da consolidação da estratégia da saúde da família. Brasília: Organização Pan-Americana da Saúde; 2012. [ Links ]
31. Nações Unidas. Transformando nosso mundo: a agenda 2030 para o desenvolvimento sustentável [Internet]. [Rio de Janeiro]: Nações Unidas no Brasil; 2015 [citado 2015 out 4]. Disponível em: Disponível em: http://nacoesunidas.org/pos2015/agenda2030/ . [ Links ]
32. Camargo ME, Silva GR, Castilho EA, Silveira AC. Serological survey of the prevalence of Chagas’ infection in Brazil, 1975/1980. Rev Inst Med Trop São Paulo. 1984 Jul-Aug;26(4):192-204. [ Links ]
33. Silveira AC, Silva GR, Prata A. O Inquérito de soroprevalência da infecção chagásica humana (1975-1980). Rev Soc Bras Med Trop. 2011;44 supl 2:33-9. [ Links ]
34. Akhavan D. Análise de custo-efectividade do programa de controle da doença de Chagas no Brasil: relatório final. Brasília: Organização Pan-Americana de Saúde; 1998. [ Links ]
35. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Prevalence of Chagas disease in Brazil: a systematic review and meta-analysis. Acta Trop. 2014 Feb;130:167-74. [ Links ]
36. Hotez PJ, Fujiwara RT. Brazil’s neglected tropical diseases: an overview and a report card. Microbes Infect. 2014 Aug;16(8):601-6. [ Links ]
37. Bern C, Kjos S, Yabsley MJ. Montgomery SP. Trypanosoma cruzi and Chagas disease in the United States. Clin Microbiol Rev. 2011 Oct;24(4):655-81. [ Links ]
38. Dias JC, Coura JR, Yasuda MAS. The present situation, challenges, and perspectives regarding the production and utilization of effective drugs against human Chagas disease. Rev Soc Bras Med Trop. 2014 Jan-Feb;47(1):123-5. [ Links ]
39. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Guia de Vigilância em Saúde. Brasília: Ministério da Saúde; 2014. [ Links ]
40. Instituto Brasileiro de Geografia e Estatística. Projeção da população do Brasil por sexo e idade para o período 2000/2060 e projeção da população das Unidades da Federação por sexo e idade para o período 2000/2030. Brasília: Instituto Brasileiro de Geografia e Estatística; 2013. [ Links ]
41. Bern C, Verastegui M, Gilman RH, Lafuente C, Galdos-Cardenas G, Calderon M, et al. Congenital Trypanosoma cruzi transmission in Santa Cruz, Bolivia. Clin Infect Dis. 2009 Dec 1;49(11):1667-74. [ Links ]
42. Rassi Júnior A, Rassi A, Marin-Neto JA. Chagas disease. Lancet. 2010 Apr;375(9723):1388-402. [ Links ]
43. Ventura-Garcia L, Roura M, Pell C, Posada E, Gascón J, Aldasoro E, et al. Socio-cultural aspects of Chagas disease: a systematic review of qualitative research. PLoS Negl Trop Dis. 2013 Sep 12;7(9):e2410. [ Links ]
44. Bern C, Montgomery SP. An estimate of the burden of Chagas disease in the United States. Clin Infect Dis. 2009 Sep 1;49(5):e52-4. [ Links ]
45. Buekens P, Almendares O, Carlier Y, Dumonteil E, Eberhard M, Gamboa-Leon R, et al. Mother-to-child transmission of Chagas’ disease in North America: why don’t we do more? Matern Child Health J. 2008 May;12(3):283-6. [ Links ]
46. Silveira C, Carneiro Junior N, Ribeiro MC, Barata RC. Living conditions and access to health services by Bolivian immigrants in the city of São Paulo, Brazil. Cad Saude Publica. 2013 Oct;29(10):2017-27. [ Links ]
47. Martes ACB, Faleiros SM. Acesso dos imigrantes bolivianos aos serviços públicos de saúde na cidade de São Paulo. Saude Soc. 2013 abr-jun;22(2):351-64. [ Links ]
48. Almeida EA, Lima JN, Lages-Silva E, Guariento ME, Aoki FH, Torres-Morales AE, et al. Chagas’ disease and HIV co-infection in patients without effective antiretroviral therapy: prevalence, clinical presentation and natural history. Trans R Soc Trop Med Hyg. 2010 Jul;104(7):447-52. [ Links ]
49. Almeida EA, Ramos Júnior AN, Correia D, Shikanai-Yasuda MA. Co-infection Trypanosoma cruzi/HIV: systematic review (1980-2010). Rev Soc Bras Med Trop. 2011 Nov-Dec;44(6):762-70. [ Links ]
50. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Bol Epidemiol. 2014;3(1):1-80 [ Links ]
51. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para manejo da infecção pelo HIV em adultos. Brasília: Ministério da Saúde; 2014. [ Links ]
52. Ministério da Saúde (BR). Recomendações para diagnóstico, tratamento e acompanhamento da co-infecção Trypanosoma cruzi: vírus da imunodeficiência humana. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):392-415. [ Links ]
53. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Mortality related to Chagas disease and HIV/AIDS coinfection in Brazil. J Trop Med. 2012;2012:534649. [ Links ]
54. Ramos Júnior AN. Inclusão da reativação da doença de Chagas como uma condição definidora de AIDS para fins de vigilância epidemiológica no Brasil. Rev Soc Bras Med Trop. 2004 mar-abr;37(2):192-3. [ Links ]
55. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Doença de Chagas aguda no Brasil: série histórica de 2000 a 2013. Bol Epidemiol. 2015;46(21):1-9. [ Links ]
56. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Multiple causes of death related to Chagas’ disease in Brazil, 1999 to 2007. Rev Soc Bras Med Trop. 2012 Sep-Oct;45(5):591-6. [ Links ]
57. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Heukelbach J. Mortality due to Chagas disease in Brazil from 1979 to 2009: trends and regional differences. J Infect Dev Ctries. 2012 Nov;6(11):817-24. [ Links ]
58. Drumond JAG, Marcopito LF. Internal migration and distribution of Chagas disease mortality, Brazil, 1981-1998. Cad Saude Publica. 2006 Oct;22(10):2131-40. [ Links ]
59. Martins-Melo FR, Alencar CH, Ramos Júnior AN, Heukelbach J. Epidemiology of mortality related to Chagas’ disease in Brazil, 1999-2007. PLoS Negl Trop Dis. 2012 Feb;6(2):e1508. [ Links ]
60. Martins-Melo FR, Ramos Júnior AN, Alencar CH, Lange W, Heukelbach J. Mortality of Chagas’ disease in Brazil: spatial patterns and definition of high-risk areas. Trop Med Int Health. 2012 Sep;17(9):1066-75. [ Links ]
61. Santo AH. Tendência da mortalidade relacionada à doença de Chagas, Estado de São Paulo, Brasil, 1985 a 2006: estudo usando causas múltiplas de morte. Rev Panam Salud Publica. 2009 Oct;26(4):299-309. [ Links ]
62. Nóbrega AA, Araújo WN, Vasconcelos AM. Mortality due to Chagas disease in Brazil according to a specific cause. Am J Trop Med Hyg. 2014 Sep;91(3):528-33. [ Links ]
63. Alves RM, Thomaz RP, Almeida EA, Wanderley JS, Guariento ME. Chagas’ disease and ageing: the coexistence of other chronic diseases with Chagas’ disease in elderly patients. Rev Soc Bras Med Trop. 2009 Nov-Dec;42(6):622-8. [ Links ]
64. Lima-Costa MF, Peixoto SV, Ribeiro AL. Chagas disease and mortality in old age as an emerging issue: 10 year follow-up of the Bambuí population-based cohort study (Brazil). Int J Cardiol. 2010 Nov;145(2):362-3. [ Links ]
65. Silveira AC. Os novos desafios e perspectivas futuras do controle. Rev Soc Bras Med Trop. 2011;44 Supl 2:122-4. [ Links ]
66. Passos ADC, Silveira AC. Síntese dos resultados dos inquéritos nacionais. Rev Soc Bras Med Trop. 2011;44 supl 2:47-50. [ Links ]
67. Vinhaes MC, Oliveira SV, Reis PO, Lacerda Sousa AC, Silva RA, Obara MT, et al. Assessing the vulnerability of Brazilian municipalities to the vectorial transmission of Trypanosoma cruzi using multi-criteria decision analysis. Acta Trop. 2014 Sep;137:105-10. [ Links ]
68. Ramos Júnior AN, Carvalho DM. Os diferentes significados da certificação conferida ao Brasil como estando livre da doença de Chagas. Cad Saude Publica. 2001 nov-dez;17(6):1403-12. [ Links ]
69. Abad-Franch F, Diotaiuti L, Gurgel-Gonçalves R, Gürtler RE. Certifying the interruption of Chagas disease transmission by native vectors: cui bono? Mem Inst Oswaldo Cruz. 2013 Apr;108(2):251-4. [ Links ]
70. Valença-Barbosa C, Lima MM, Sarquis O, Bezerra CM, Abad-Franch F. Modeling disease vector occurrence when detection is imperfect II: drivers of site-occupancy by synanthropic Triatoma brasiliensis in the Brazilian northeast. PLoS Negl Trop Dis. 2014 May;8(5):e2861. [ Links ]
71. Abad-Franch F, Valença-Barbosa C, Sarquis O, Lima MM. All that glisters is not gold: sampling-process uncertainty in disease-vector surveys with false-negative and false-positive detections. PLoS Negl Trop Dis. 2014 Sep;8(9):e3187. [ Links ]
72. Salvatella R, Irabedra P, Castellanos LG. Interruption of vector transmission by native vectors and “the art of the possible”. Mem Inst Oswaldo Cruz. 2014 Feb;109(1):122-30. [ Links ]
73. Maegawa FA, Damerau EF, Beltrame-Botelho IT, Lopes A, Emmanuelle-Machado P, Steindel M, et al. Autochthonous Chagas’ disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement. Rev Soc Bras Med Trop. 2003 Sep-Oct;36(5):609-12. [ Links ]
74. Santos CB, Ferreira AL, Leite GR, Ferreira GE, Rodrigues AA, Falqueto A. Peridomiciliary colonies of Triatoma vitticeps (Stal, 1859) (Hemiptera, Reduviidae, Triatominae) infected with Trypanosoma cruzi in rural areas of the state of Espírito Santo, Brazil. Mem Inst Oswaldo Cruz. 2005 Aug;100(5):471-3. [ Links ]
75. Lorosa ES, Santos CM, Jurberg J. Foco de doença de Chagas em São Fidélis, no estado do Rio de Janeiro. Rev Soc Bras Med Trop. 2008 jul-ago;41(4):419-20. [ Links ]
76. Shikanai-Yasuda MA, Carvalho NB. Oral transmission of Chagas disease. Clin Infect Dis. 2012 Mar;54(6):845-52. [ Links ]
77. Sangenis LH, Saraiva RM, Georg I, Castro L, Santos Lima V, Roque AL, et al. Autochthonous transmission of Chagas disease in Rio de Janeiro State, Brazil: a clinical and eco-epidemiological study. BMC Infect Dis. 2015 Jan;15:4. [ Links ]
78. Xavier SC, Roque AL, Lima VS, Monteiro KJ, Otaviano JC, Ferreira da Silva LF, et al. Lower richness of small wild mammal species and Chagas disease risk. PLoS Negl Trop Dis. 2012;6(5):e1647. [ Links ]
79. Xavier SC, Roque AL, Bilac D, Araújo VA, Costa Neto SF, Lorosa ES, et al. Distantiae transmission of Trypanosoma cruzi: a new epidemiological feature of acute Chagas disease in Brazil. PLoS Negl Trop Dis. 2014 May;8(5):e2878. [ Links ]
80. Roque AL, Xavier SC, Gerhardt M, Silva MF, Lima VS, D’Andrea PS, et al. Trypanosoma cruzi among wild and domestic mammals in different areas of the Abaetetuba municipality (Pará State, Brazil), an endemic Chagas disease transmission area. Vet Parasitol. 2013 Mar;193(1-3):71-7. [ Links ]
81. Roque AL, Xavier SC, Rocha MG, Duarte AC, D’Andrea PS, Jansen AM. Trypanosoma cruzi transmission cycle among wild and domestic mammals in three areas of orally transmitted Chagas disease outbreaks. Am J Trop Med Hyg. 2008 Nov;79(5):742-9. [ Links ]
82. Abad-Franch F, Ferraz G, Campos C, Palomeque FS, Grijalva MJ, Aguilar HM, et al. Modeling disease vector occurrence when detection is imperfect: infestation of Amazonian palm trees by triatomine bugs at three spatial scales. PLoS Negl Trop Dis. 2010 Mar;4(3):e620. [ Links ]
83. Abad-Franch F, Santos WS, Schofield CJ. Research needs for Chagas disease prevention. Acta Trop. 2010 Jul-Aug;115(1-2):44-54. [ Links ]
84. Padilla-Torres SD, Ferraz G, Luz SL, Zamora-Perea E, Abad-Franch F. Modeling dengue vector dynamics under imperfect detection: three years of site-occupancy by Aedes aegypti and Aedes albopictus in urban Amazonia. PLoS One. 2013;8(3):e58420. [ Links ]
85. Abad-Franch F, Vega MC, Rolón MS, Santos WS, Rojas de Arias A. Community participation in Chagas disease vector surveillance: systematic review. PLoS Negl Trop Dis. 2011 Jun;5(6):e1207. [ Links ]
86. Roux E, Fátima Venâncio A, Girres JF, Romaña CA. Spatial patterns and eco-epidemiological systems--part II: characterising spatial patterns of the occurrence of the insect vectors of Chagas disease based on remote sensing and field data. Geospat Health. 2011 Nov;6(1):53-64. [ Links ]
87. Roux E, Fátima Venâncio A, Girres JF, Romaña CA. Spatial patterns and eco-epidemiological systems--part I: multi-scale spatial modelling of the occurrence of Chagas disease insect vectors. Geospat Health. 2011 Nov;6(1):41-51. [ Links ]
88. Mougabure-Cueto G, Picollo MI. Insecticide resistance in vector Chagas disease: evolution, mechanisms and management. Acta Trop. 2015 Sep;149:70-85. [ Links ]
89. Pessoa GCA, Pinheiro LC, Ferraz ML, Mello BV, Diotaiuti L. Standardization of laboratory bioassays for the study of Triatoma sordida susceptibility to pyrethroid insecticides. Parasit Vectors. 2015 Feb;8:109. [ Links ]
90. Pessoa GCA, Trevizani NAB, Dias LS, Bezerra CM, Melo BV, Diotaiut L. Toxicological profile of deltamethrin in Triatoma brasiliensis (Hemiptera: Reduviidae) in State of Ceará, Northeastern Brazil. Rev Soc Bras Med Trop. 2015 Jan-Feb;48(1):39-43. [ Links ]
91. Pinto AYN, Valente SA, Valente VC, Ferreira Júnior AG, Coura JR. Fase aguda da doença de Chagas na Amazônia brasileira: estudo de 233 casos do Pará, Amapá e Maranhão observados entre 1988 e 2005. Rev Soc Bras Med Trop. 2008 nov-dec;41(6):602-14. [ Links ]
92. Nóbrega AA, Garcia MH, Tatto E, Obara MT, Costa E, Sobel J, et al. Oral transmission of Chagas disease by consumption of açaí palm fruit, Brazil. Emerg Infect Dis. 2009 Apr;15(4):653-5. [ Links ]
93. Dias JCP, Amato Neto V. Prevenção referente às modalidades alternativas de transmissão do Trypanosoma cruzi no Brasil. Rev Soc Bras Med Trop. 2011;44 supl 2:68-72. [ Links ]
94. Dias JCP. Notas sobre o Trypanosoma cruzi e suas características bio-ecológicas, como agente de enfermidades transmitidas por alimentos. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):370-5. [ Links ]
95. Dias JCP, Schofield CJ. Controle da transmissão transfusional da doença de Chagas na Iniciativa do Cone Sul. Rev Soc Bras Med Trop. 1998 jul-ago;31(4):373-83. [ Links ]
96. Moraes-Souza H, Ferreira-Silva MM. Controle da transmissão transfusional. Rev Soc Bras Med Trop. 2011;44 supl 2:64-7. [ Links ]
97. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Manual técnico para a investigação da transmissão de doenças pelo sangue. Brasília: Ministério da Saúde; 2004. (Série A. Normas e manuais técnicos). [ Links ]
98. Ministério da Saúde (BR). Agência Nacional de Vigilância Sanitária. Manual técnico de hemovigilância. Brasília: Ministério da Saúde; 2004. (Série A. Normas e manuais técnicos). [ Links ]
99. Angheben A, Boix L, Buonfrate D, Gobbi F, Bisoffi Z, Pupella S, et al. Chagas disease and transfusion medicine: a perspective from non-endemic countries. Blood Transfus. 2015 Oct;13(4):540-50. [ Links ]
100. Pinazo MJ, Miranda B, Rodríguez-Villar C, Altclas J, Brunet Serra M, García-Otero EC, et al. Recommendations for management of Chagas disease in organ and hematopoietic tissue transplantation programs in nonendemic areas. Transplant Rev (Orlando). 2011 Jul;25(3):91-101. [ Links ]
101. Ostermayer AL, Passos ADC, Silveira AC, Ferreira AW, Macedo V, Prata AR. O inquérito nacional de soroprevalência de avaliação do controle da doença de Chagas no Brasil (2001-2008). Rev Soc Bras Med Trop. 2011;44 supl 2:108-21. [ Links ]
102. Torrico F, Alonso-Vega C, Suarez E, Rodriguez P, Torrico MC, Dramaix M, et al. Maternal Trypanosoma cruzi infection, pregnancy outcome, morbidity, and mortality of congenitally infected and non-infected newborns in Bolivia. Am J Trop Med Hyg. 2004 Feb;70(2):201-9. [ Links ]
103. Salas NA, Cot M, Schneider D, Mendoza B, Santalla JA, Postigo J, et al. Risk factors and consequences of congenital Chagas disease in Yacuiba, South Bolivia. Trop Med Int Health. 2007 Dec;12(12):1498-505. [ Links ]
104. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al. Congenital Chagas disease: recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis. 2011 Oct;5(10):e1250. [ Links ]
105. Howard EJ, Xiong X, Carlier Y, Sosa-Estani S, Buekens P. Frequency of the congenital transmission of Trypanosoma cruzi: a systematic review and meta-analysis. BJOG. 2014 Jan;121(1):22-33. [ Links ]
106. Martins-Melo FR, Lima MS, Ramos Júnior AN, Alencar CH, Heukelbach J. Prevalence of Chagas disease in pregnant women and congenital transmission of Trypanosoma cruzi in Brazil: a systematic review and meta-analysis. Trop Med Int Health. 2014 Aug;19(8):943-57. [ Links ]
107. Gontijo ED, Andrade GMQ, Santos SE, Galvão LMC, Moreira EF, Pinto FS, et al. Triagem neonatal da infecção pelo Trypanosoma cruzi em Minas Gerais, Brasil: transmissão congênita e mapeamento das áreas endêmicas. Epidemiol Serv Saude. 2009 jul-set;18(3):243-54. [ Links ]
108. Luquetti AO, Tavares SBN, Siriano LR, Oliveira RA, Campos DE, Morais CA, et al. Congenital transmission of Trypanosoma cruzi in central Brazil. A study of 1,211 individuals born to infected mothers. Mem Inst Oswaldo Cruz. 2015 May;110(3):369-76. [ Links ]
109. Sosa-Estani S, Cura E, Velazquez E, Yampotis C, Segura EL. Etiological treatment of young women infected with Trypanosoma cruzi, and prevention of congenital transmission. Rev Soc Bras Med Trop. 2009 Sep-Oct;42(5):484-7. [ Links ]
110. Herwaldt BL. Laboratory-acquired parasitic infections from accidental exposures. Clin Microbiol Rev. 2001 Oct;14(4):659-88. [ Links ]
111. Mahoney RT, Morel CMA. Global Health Innovation System (GHIS). Innovation Strategy Today. 2006;2(1):1-12. [ Links ]
112. Norman FF, López-Vélez R. Chagas disease and breast-feeding. Emerg Infect Dis. 2013 Oct;19(10):1561-6. [ Links ]
113. Gebrekristos HT, Buekens P. Mother-to-Child transmission of Trypanosoma cruzi. J Ped Infect Dis Soc. 2014 Sep;3 Suppl 1:S36-40. [ Links ]
114. De Rissio AM, Riarte AR, Martin García M, Esteva MI, Quaglino M, Ruiz AM. Congenital Trypanosoma cruzi infection. Efficacy of its monitoring in an Urban Reference Health Center in non-endemic area of Argentina. Am J Trop Med Hyg. 2010 May;82(5):838-45. [ Links ]
115. González-Tomé MI, Rivera M, Camaño I, Norman F, Flores-Chávez M, Rodríguez-Gómez L, et al. Recomendaciones para el diagnóstico, seguimiento y tratamiento de la embarazada y del niño con enfermedad de Chagas. Enferm Infecc Microbiol Clin. 2013 Oct;31(8):535-42. [ Links ]
116. Carlier Y, Sosa-Estani S, Luquetti AO, Buekens P. Congenital Chagas disease: an update. Mem Inst Oswaldo Cruz. 2015 May;110(3):363-8. [ Links ]
117. Russomando G, Almirón M, Candia N, Franco L, Sánchez Z, Guillen I. Implementación y evaluación de un sistema localmente sustentable de diagnóstico prenatal que permite detectar casos de transmisión congénita de la enfermedad de Chagas en zonas endêmicas del Paraguay. Rev Soc Bras Med Trop. 2005;38 Supl 2:49-54. [ Links ]
118. Brutus L, Castillo H, Bernal C, Salas NA, Schneider D, Santalla JA, et al. Detectable Trypanosoma cruzi parasitemia during pregnancy and delivery as a risk factor for congenital Chagas disease. Am J Trop Med Hyg. 2010 Nov;83(5):1044-7. [ Links ]
119. Organización Panamericana de la Salud; Organización Mundial de la Salud. Tratamiento etiológico de la enfermidad de Chagas: conclusiones de reunión de especialistas. Rev Patol Trop. 1999;28(2):247-79. [ Links ]
120. Fabbro DL, Streiger ML, Arias ED, Bizai ML, Barco M, Amicone NA. Trypanocide treatment among adults with chronic Chagas disease living in Santa Fe City (Argentina), over a mean follow-up of 21 years: parasitological, serological and clinical evolution. Rev Soc Bras Med Trop. 2007 Jan-Feb;40(1):1-10. [ Links ]
121. Lana M, Lopes LA, Martins HR, Bahia MT, Machado-de-Assis GF, Wendling AP, et al. Clinical and laboratory status of patients with chronic Chagas disease living in a vector-controlled area in Minas Gerais, Brazil, before and nine years after aetiological treatment. Mem Inst Oswaldo Cruz. 2009 Dec;104(8):1139-47. [ Links ]
122. Pérez-Molina JA, Pérez-Ayala A, Moreno S, Fernández-González MC, Zamora J, López-Velez R. Use of benznidazole to treat chronic Chagas’ disease: a systematic review with a meta-analysis. J Antimicrob Chemother. 2009 Dec;64(6):1139-47. [ Links ]
123. CarlierI Y, Torrico F, organizers. Congenital infection with T. cruzi: from mechanisms of transmission to strategies for diagnosis and control. Rev Soc Bras Med Trop . 2003 Nov-Dec;36(6):767-71. [ Links ]
124. Scapellato PG, Bottaro EG, Rodríguez-Brieschke MT. Mother-child transmission of Chagas disease: could infection with human immunodeficiency virus increase the risk? Rev Soc Bras Med Trop . 2009 Mar-Apr;42(2):107-9. [ Links ]
125. Bua J, Volta BJ, Velazquez EB, Ruiz AM, Rissio AM, Cardoni RL. Vertical transmission of Trypanosoma cruzi infection: quantification of parasite burden in mothers and their children by parasite DNA amplification. Trans R Soc Trop Med Hyg. 2012 Oct;106(10):623-8. [ Links ]
126. Mallimaci MC, Sosa-Estani S, Russomando G, Sanchez Z, Sijvarger C, Alvarez IM, et al. Early diagnosis of congenital infection, using shed scute phase antigen, in Ushuaia, Tierra del Fuego, Argentina. Am J Trop Med Hyg. 2010 Jan;82(1):55-9. [ Links ]
127. Chippaux JP, Clavijo AN, Santalla JA, Postigo JR, Schneider D, Brutus L. Antibody drop in newborns congenitally infected by Trypanosoma cruzi treated with benznidazole. Trop Med Int Health. 2010 Jan;15(1):87-93. [ Links ]
128. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Recomendações para profilaxia da transmissão vertical do HIV e terapia antirretroviral em gestantes. Brasília: Ministério da Saúde; 2010. (Série Manuais, 46). [ Links ]
129. Luquetti AO, Rassi A. Diagnóstico laboratorial da infecção pelo Trypanosoma cruzi. In: Brener Z, Andrade Z, Barral-Netto M, editores. Trypanosoma cruzi e doença de Chagas. Rio de Janeiro: Guanabara-Koogan; 2000. p. 344-78. [ Links ]
130. Chiari E. Parasitological diagnosis. In: Wendel S, Brener Z, Camargo ME, Rassi A, editores. Chagas disease (American Trypanosomiasis): its impact on transfusion and clinical medicine. São Paulo: Editora Sociedade Brasileira de Hematologia e Hemoterapia; 1992. p. 153-64. [ Links ]
131. Luquetti AO, Castro AM. Diagnóstico sorológico da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Editora Fiocruz; 1997. p. 99-113. [ Links ]
132. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Programa Nacional de Controle de Chagas. Doença de Chagas aguda: aspectos epidemiológicos, diagnóstico e tratamento: guia de consulta rápida para profissionais de saúde. Rev Patol Trop. 2007 Set-Dez;36(3):1-32 (anexo). [ Links ]
133. Ministério da Saúde (BR). Recomendações sobre o diagnóstico parasitológico, sorológico e molecular para confirmação da doença de Chagas aguda e crônica. Rev Patol Trop. 2013 out-dez;42(4):475-8. [ Links ]
134. Luquetti AO, Schmuñis GA. Diagnosis of Trypanosoma cruzi infection. In: Telleria J, Tibayrenc M, editors. American Trypanosomiasis Chagas disease: one hundred years of research. Amsterdam: Elsevier; 2010. p. 743-92. [ Links ]
135. Camargo ME, Amato Neto V. Anti-Trypanosoma cruzi IgM antibodies as serological evidence of recent infection. Rev Inst Med Trop São Paulo. 1974 Jul-Aug;16(4):200-2. [ Links ]
136. Chiari E, Dias JC, Lana M, Chiari CA. Hemocultures for the parasitological diagnosis of human chronic Chagas disease. Rev Soc Bras Med Trop. 1989 Jan-Mar;22(1):19-23. [ Links ]
137. Chiari E, Galvão LMC. Diagnóstico parasitológico da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz; 1997. p. 85-97. [ Links ]
138. Cerisola JA, Rohwedder R, Segura EL, Del Prado CE, Alvarez M, Martini GJW. El xenodiagnóstico. Buenos Aires: Imp Inst Nac Invest Cardiovasc; 1974. [ Links ]
139. Castro AM, Luquetti AO, Rassi A, Rassi GG, Chiari E, Galvão LMC. Blood culture and polymerase chain reaction for the diagnosis of the chronic phase of human infection with Trypanosoma cruzi. Parasitol Res. 2002 Oct;88(10):894-900. [ Links ]
140. Camargo ME. Serological diagnosis: an appraisal of Chagas disease serodiagnosis. In: Wendel S, Brener Z, Camargo ME, Rassi A, editors. Chagas Disease (American Trypanosomiasis), its impact on Transfusion and Clinical Medicine. São Paulo: Sociedade Brasileira de Hematologia e Hemoterapia; 1992. p. 165-78. [ Links ]
141. Ferreira AW, Ávila SLM. Doença de Chagas. In.: Ferreira AW, Ávila SLM. Diagnóstico laboratorial das principais doenças infecciosas e auto-imunes. 2 ed. Rio de Janeiro: Guanabara Koogan; 2001. p. 241-9. [ Links ]
142. World Health Organization. Control of Chagas disease. Geneva: World Health Organization ; 2002. (Technical Report Series, 905). [ Links ]
143. Hijar G, Padilla C, Balbuena J, Bisio MMC, Bailon H, Vega S, et al. Estandarización y validación del uso clínico de la Reacción en Cadena de la Polimerasa para la detección de infección por Trypanosoma cruzi. In: Anales 9º Congreso Peruano de Enfermedades Infecciosas y Tropicales “Jose Neyra Ramirez”; 2009 nov 18-21; Lima. Lima: Sociedad Peruana de Enfermedades Infecciosas y Tropicales; 2009. [ Links ]
144. Schijman AG, Bisio M, Orellana L, Sued M, Duffy T, Mejia Jaramillo AM, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis. 2011 Jan;5(1):e931. [ Links ]
145. Camargo ME. Fluorescent antibody test for the diagnosis of American trypanosomiasis. Technical modification employing preserved culture forms of Trypanosoma cruzi in a slide test. Rev Inst Med Trop São Paulo. 1966 Sep-Oct;8(5):227-35. [ Links ]
146. Cerisola JA, Chaben MF, Lazari JO. Test de hemaglutinación para el diagnóstico de la enfermedad de Chagas. Prensa Méd Argent. 1962;49:1761-67. [ Links ]
147. Voller A, Draper C, Bidwell DE, Bartlett A. Microplate enzyme-linked immunosorbent assay for Chagas disease. Lancet. 1975 Feb;305(7904):426-8. [ Links ]
148. Castro CN, Alves MT, Macedo VO. Importância da repetição do xenodiagnóstico para avaliação da parasitemia na fase crônica da doença de Chagas. Rev Soc Bras Med Trop. 1983 abr-jun;16(2):98-103. [ Links ]
149. Junqueira AC, Chiari E, Wincker P. Comparison of the polymerase chain reaction with two classical parasitological methods for diagnosis of Chagas disease patients in a north-eastern endemic region of north-eastern Brazil. Trans R Soc Trop Med Hyg. 1996 Mar-Apr;90(2):129-32. [ Links ]
150. Britto CC. Usefulness of PCR-based assays to assess drug efficacy in Chagas disease chemotherapy: value and limitations. Mem Inst Oswaldo Cruz. 2009 Jul;104 Suppl 1:122-35. [ Links ]
151. Silveira JF, Umezawa ES, Luquetti AO. Chagas disease: recombinant Trypanosoma cruzi antigens for serological diagnosis. Trends Parasitol. 2001 Jun;17(6):286-91. [ Links ]
152. Zicker F, Smith PG, Luquetti AO, Oliveira OS. Mass screening for Trypanosoma cruzi infections using the immunofluorescence, ELISA and haemagglutination tests on serum samples and on blood eluates from filter-paper. Bull World Health Organ. 1990;68(4):465-71. [ Links ]
153. Sánchez-Camargo CL, Albajar-Viñas P, Wilkins PP, Nieto J, Leiby DA, Paris L, et al. Comparative evaluation of 11 commercialized rapid diagnostic tests for detecting Trypanosoma cruzi antibodies in serum banks in areas of endemicity and nonendemicity. J Clin Microbiol. 2014 Jul;52(7):2506-12. [ Links ]
154. Pinto AYN, Valente SAS, Valente VC. Emerging acute Chagas disease in Amazonian Brazil: case reports with serious cardiac involvement. Braz J Infect Dis. 2004 Dec;8(6):454-60. [ Links ]
155. Dias JP, Bastos C, Araújo E, Mascarenhas AV, Martins Netto E, Grassi F, et al. Acute Chagas disease outbreak associated with oral transmission. Rev Soc Bras Med Trop. 2008 May-Jun;41(3):296-300. [ Links ]
156. Pinto AY, Valente VC, Coura JR, Valente SAS, Junqueira AC, Santos LC, et al. Clinical follow-up of responses to treatment with benznidazol in Amazon: a cohort study of acute Chagas disease. Plos One. 2013 May;8(5):e64450. [ Links ]
157. Centers for Disease Control and Prevention. Chagas disease after organ transplantation: United States, 2001. MMWR Morb Mortal Wkly Rep. 2002 Mar;51(10):210-2. [ Links ]
158. Centers for Disease Control and Prevention. Chagas disease after organ transplantation: Los Angeles, California, 2006. MMWR Morb Mortal Wkly Rep. 2006 Jul;55(29):798-800. [ Links ]
159. Rocha A, Ramos Júnior AN, Sartori AM, Correia D, Gontijo ED, Tatto E, et al. Recomendações para diagnóstico, tratamento e acompanhamento da co-infecção Trypanosoma cruzi: vírus da imunodeficiência humana. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):392-415. [ Links ]
160. Rassi A, Rassi Júnior A, Rassi GG. Fase aguda. In: Brener Z, Andrade Z, Barral-Netto M (orgs). Trypanosoma cruzi e Doença de Chagas. 2 ed. Rio de Janeiro: Guanabara Koogan; 2000. p.231-45. [ Links ]
161. Romaña C. Acerca de un síntoma inicial de valor para el diagnóstico de la forma aguda de la enfermedad de Chagas: la conjuntivitis schizotripanosómica unilateral: hipótesis sobre la puerta de entrada conjuntival de la enfermedad. Mision de Estudios de Patologia Regional Argentina (MEPRA)1935;22:16-25. [ Links ]
162. Lugones HS. Enfermedad de Chagas. Diagnóstico de su faz aguda. Santiago del Estero (Argentina): Universidad Católica de Santiago del Estero; 2001. [ Links ]
163. Ferreira HO, Pucci H. Estudo evolutivo da doença de Chagas com fase aguda conhecida. Rev Soc Bras Med Trop . 1982 jan-dez;15(1):125-30. [ Links ]
164. Ferreira HO, Miziara JL. Aspectos clínicos da cardiopatia chagásica aguda. In: Cançado JR, Chuster M (editores). Cardiopatia Chagásica. Belo Horizonte: Imprensa Oficial; 1985. [ Links ]
165. Parada H, Carrasco HA, Añez N, Fuenmayor C, Inglessis I. Cardiac involvement is a constant finding in acute Chagas’ disease: a clinical, parasitological and histopathological study. Int J Cardiol. 1997 Jun;60(1):49-54. [ Links ]
166. Wendell S. Doença de Chagas transfusional. In: Dias JCP, Coura JR, editores. Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz ; 1997. p. 411-27. [ Links ]
167. Noya BA, Diaz- Bello Z, Colmenares C, Ruiz-Guevara R, Mauriello L, Zavala-Jaspe R, et al. Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J Infect Dis. 2010 May;201(9):1308-15. [ Links ]
168. Shaw J, Lainson R, Fraiha H. Considerações sobre a epidemiologia dos primeiros casos autóctones de doença de Chagas registrados em Belém, Pará, Brasil. Rev Saude Publica. 1969;3(2):153-7. [ Links ]
169. Pinto AYN, Ferreira Júnior AG, Valente VC, Harada GS, Valente SAS. Urban outbreak of acute Chagas disease in Amazon region of Brazil: four-year follow-up after treatment with benznidazole. Rev Panam Salud Publica. 2009 Jan;25(1):77-83. [ Links ]
170. Shikanai-Yasuda MA, Marcondes CB, Guedes LA, Siqueira GS, Barone AA, Dias JC, et al. Possible oral transmission of acute Chagas disease in Brasil. Rev Inst Med Trop Sao Paulo. 1991 Sep-Oct;33(5):351-7. [ Links ]
171. Jörg ME, Freire RS. Lipochagomata genii or lipochagomata of the cheeks, characteristic lesions of acute trypanosomiasis cruzi in children under three years of age. Acta Trop. 1961;18:318-50. [ Links ]
172. Medeiros MB, Guerra JAO, Lacerda MVG. Meningoencephalitis in a patient with acute Chagas disease in the Brazilian Amazon. Rev Soc Bras Med Trop. 2008 Sep-Oct; 41(5):520-1. [ Links ]
173. Freilij H, Altcheh J, Muchinik G. Perinatal human immunodeficiency virus infection and congenital Chagas’ disease. Pediatr Infect Dis J. 1995 Feb;14(2):161-2. [ Links ]
174. Nisida IV, Amato Neto V, Braz LM, Duarte MI, Umezawa ES. A survey of congenital Chagas’ disease, carried out at three health institutions in São Paulo City, Brazil. Rev Inst Med Trop Sao Paulo. 1999 Sep-Oct;41(5):305-11. [ Links ]
175. Sartori AM, Ibrahim KY, Nunes Westphalen EV, Braz LM, Oliveira Junior OC, Gakiya E, et al. Manifestations of Chagas disease (American trypanosomiasis) in patients with HIV/AIDS. Ann Trop Med Parasitol. 2007 Jan;101(1):31-50. [ Links ]
176. França LCM, Lemos S, Fleury RN, Melaragno Filho R, Ramos Júnior HA, Pasternak J. Moléstia de Chagas crônica associada à leucemia linfática: ocorrência de encefalite aguda como alteração do estado imunitário. Arq Neuro-Psiquiatr. 1969 mar;27(1):59-66. [ Links ]
177. Spina-França A, Livramento JA, Machado LR, Yasuda N. Anticorpos a Trypanosoma cruzi no líquido cefalorraqueano: pesquisa pelas reações de fixação do complemento e de imunofluorescência. Arq Neuro-Psiquiatr. 1988 dez;46(4):374-8. [ Links ]
178. Livramento JA, Machado LR, Spina-França A. Anormalidades do líquido cefalorraqueano em 170 casos de AIDS. Arq Neuro-Psiquiatr. 1989 set;47(3):326-31. [ Links ]
179. Del Castilho M, Mendoza G, Oviedo J, Perez Bianco PR, Anselmo AE, Silva M. AIDS and Chagas’ disease with central nervous system tumor-like lesion. Am J Med. 1990 Jun;88(6):693-4. [ Links ]
180. Ferreira MS, Nishioka SA, Rocha A, Silva AM, Ferreira RG, Olivier W, et al. Acute fatal Trypanosoma cruzi meningoencephalitis in a human immunodeficiency virus-positive hemophiliac patient. Am J Trop Med Hyg. 1991 Dec;45(6):723-7. [ Links ]
181. Riarte A, Luna C, Sabatiello R, Sinagra A, Schiavelli R, De Rissio A, et al. Chagas’ disease in patients with kidney transplants: 7 years of experience 1989-1996. Clin Infect Dis. 1999 Sep;29(3):561-7. [ Links ]
182. Campos SV, Strabelli TM, Amato Neto V, Silva CP, Bacal F, Bocchi EA, et al. Risk factors for Chagas’ disease reactivation after heart transplantation. J Heart Lung Transplant. 2008 Jun;27(6):597-602. [ Links ]
183. Ministério da Saúde (BR). Portaria nº 2.600, de 21 de outubro de 2009. Aprova o Regulamento Técnico do Sistema Nacional de Transplantes. Diário Oficial da República Federativa do Brasil, Brasília (DF), 2009 out 21;Seção 1:77. [ Links ]
184. Altclas J, Sinagra A, Dictar M, Luna C, Verón MT, De Rissio AM, et al. Chagas disease in bone marrow transplantation: an approach to preemptive therapy. Bone Marrow Transplant. 2005 Jul;36(2):123-9. [ Links ]
185. Barcán L, Luna C, Clara L, Sinagra A, Valledor A, De Rissio AM, et al. Transmission of T. cruzi infection via liver transplantation to a nonreactive recipient for Chagas’ disease. Liver Transpl. 2005 Sep;11(9):1112-6. [ Links ]
186. Rassi A, Amato Neto V, Siqueira AF, Ferriolli Filho F, Amato VS, Rassi Júnior A. Protective effect of benznidazole against parasite reactivation in patients chronically infected with Trypanosoma cruzi and treated with corticoids for associated diseases. Rev Soc Bras Med Trop. 1999 Sep-Oct;32(5):475-82. [ Links ]
187. Cordova E, Boschi A, Ambrosioni J, Cudos C, Corti M. Reactivation of Chagas disease with central nervous system involvement in HIV-infected patients in Argentina, 1992-2007. Int J Infect Dis. 2008 Nov;12(6):587-92. [ Links ]
188. Validade do conceito de forma indeterminada de doença de Chagas. Rev Soc Bras Med Trop. 1985 jan-mar;18(1):46. [ Links ]
189. Dias JC. The indeterminate form of human chronic Chagas’ disease: a clinical epidemiological review. Rev Soc Bras Med Trop. 1989 Jul-Sep;22(3):147-56. [ Links ]
190. Macêdo VO. Forma indeterminada da doença de Chagas. In: Dias JCP, Coura JR, editores. Clínica e Terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Editora Fiocruz ; 1997. p.135-51. [ Links ]
191. Macêdo VO. Indeterminate form of Chagas disease. Mem Inst Oswaldo Cruz. 1999 Sep;94 Suppl 1:311-6. [ Links ]
192. Ianni BM, Arteaga E, Frimm CC, Pereira Barretto AC, Mady C. Chagas’ heart disease: evolutive evaluation of electrocardiographic and echocardiographic parameters in patients with the indeterminate form. Arq Bras Cardiol. 2001 Jul;77(1):59-62. [ Links ]
193. Dias JCP, Machado EMM, Borges ÉC, Moreira EF, Gontijo C, Azeredo BVM. Doença de Chagas em Lassance, MG. Reavaliação clínico-epidemiológica 90 anos após a descoberta de Carlos Chagas. Rev Soc Bras Med Trop. 2002 mar-apr;35(2):167-76. [ Links ]
194. Almeida EA, Barbosa Neto RM, Guariento ME, Wanderley JS, Souza ML. Apresentação clínica da doença de Chagas crônica em indivíduos idosos. Rev Soc Bras Med Trop. 2007 mai-jun;40(3):311-5. [ Links ]
195. Villela E. Moléstia de Chagas: descrição clínica, 5ª parte. Folha Médica. 1923; 4:65-6. [ Links ]
196. Dias E, Laranja FS, Miranda A, Nóbrega G. Chagas’ disease: a clinical, epidemiologic and pathologic study. Circulation. 1956 Dec;14(6):1035-60. [ Links ]
197. Prata A, Macedo V. Morbidity of Chagas’ heart disease. Mem Inst Oswaldo Cruz. 1984;79 Suppl:93-6. [ Links ]
198. Organización Mundial de la Salud; Organización Panamericana de la Salud. Aspectos clínicos de la enfermedad de Chagas. Informe de una reunión conjunta OMS/OPAS de investigadores. Bol Oficina Sanit Panam. 1974;76:141-58. [ Links ]
199. Conselho Nacional de Pesquisa. Epidemiologia da doença de Chagas: objetivos e metodologia dos estudos longitudinais. Rio de Janeiro: Conselho Nacional de Pesquisa; 1974. 46 p. Relatório Técnico nº 1. [ Links ]
200. Oliveira Júnior W. Forma indeterminada da doença de Chagas: implicações médico-trabalhistas. Arq Bras Cardiol. 1990 fev;54(2):89-91. [ Links ]
201. Guariento ME, Camilo MVF, Camargo AMA. Working conditions of Chagas’ disease patients in a large Brazilian city. Cad Saude Publica. 1999 Apr-Jun;15(2):381-6. [ Links ]
202. Dias JCP, Siqueira IOC, Dias RB. Doença de Chagas: diagnóstico e manejo na atenção primária à saúde. In: Gusso G, Lopes JMC. Tratado de Medicina de Família e Comunidade: 2 Volumes: Princípios, Formação e Prática. Porto Alegre: Artmed; 2012. p. 2067-80. [ Links ]
203. Castro I, Andrade JP, Paola AAV, Vilas-Boas F, Oliveira GMM, Marin-Neto JA, et al. Sociedade Brasileira de Cardiologia. I Diretriz Latino-Americana para o diagnóstico e tratamento da cardiopatia chagásica. Arq Bras Cardiol. 2011 Aug;97(2 Suppl 3):1-48. [ Links ]
204. Ozaki Y, Guariento ME, Almeida EA. Quality of life and depressive symptoms in Chagas disease patients. Qual Life Res. 2011 Feb;20(1):133-8. [ Links ]
205. Higuchi ML, Benvenuti LA, Reis MR, Metzger M. Pathophysiology of the heart in Chagas’ disease: current status and new developments. Cardiovasc Res. 2003 Oct;60(1):96-107. [ Links ]
206. Higuchi ML. Chagas disease: importance of the parasite in the pathogenesis of the cardiac chronic disease. Arq Bras Cardiol. 1995 Mar;64(3):251-4. [ Links ]
207. Higuchi ML. Chronic chagasic cardiopathy: the product of a turbulent host-parasite relationship. Rev Inst Med Trop Sao Paulo. 1997 Jan-Feb;39(1):53-60. [ Links ]
208. Marin-Neto JA, Cunha-Neto E, Maciel BC, Simões MV. Pathogenesis of chronic Chagas heart disease. Circulation. 2007 Mar;115(9):1109-23. [ Links ]
209. Chagas C, Villela E. Forma cardíaca da Trypanosomíase americana. Mem Inst Oswaldo Cruz. 1922;14(1):5-61. [ Links ]
210. Coura JR, Abreu LL, Pereira JB, Willcox HP. Morbidity in Chagas’ disease. IV. longitudinal study of 10 years in Pains and Iguatama, Minas Gerais, Brazil. Mem Inst Oswaldo Cruz. 1985 Jan-Mar;80(1):73-80. [ Links ]
211. Pereira Barretto AC, Mady C, Arteaga-Fernandez E, Stolf N, Lopes EA, Higuchi ML, et al. Right ventricular endomyocardial biopsy in chronic Chagas’ disease. Am Heart J. 1986 Feb;111(2):307-12. [ Links ]
212. Prata A, Lopes ER, Chapadeiro E. Characteristics of unexpected sudden death in Chagas disease. Rev Soc Bras Med Trop. 1986 Jan-Mar;19(1):9-12. [ Links ]
213. Dias JC, Kloetzel K. The prognostic value of the electrocardiographic features of chronic Chagas’ disease. Rev Inst Med Trop Sao Paulo. 1968 May-Jun;10(3):158-62. [ Links ]
214. Bestetti RB, Muccillo G. Clinical course of Chagas’ heart disease: a comparison with dilated cardiomyopathy. Int J Cardiol. 1997 Jul;60(2):187-93. [ Links ]
215. Pinto AY, Harada GS, Valente VD, Abud JE, Gomes FD, Souza GC, et al. Cardiac attacks in patients with acute Chagas disease in a family micro-outbreak, in Abaetetuba, Brazilian Amazon. Rev Soc Bras Med Trop. 2001 Sep-Oct;34(5):413-9. [ Links ]
216. Souza DSM, Almeida AJB, Costa FA, Costa EG, Figueiredo MTS, Póvoa RMS. O eletrocardiograma na fase aguda da Doença de Chagas por transmissão oral. Rev Bras Cardiol. 2013 mar-abr;26(2):127-30. [ Links ]
217. Nishioka SA, Ferreira MS, Rocha A, Burgarelli MK, Silva AM, Duarte MI, et al. Reactivation of Chagas’ disease successfully treated with benznidazole in a patient with acquired immunodeficiency syndrome. Mem Inst Oswaldo Cruz. 1993 Jul-Sep;88(3):493-6 [ Links ]
218. Almeida EA, Silva EL, Guariento ME, Souza ML, Aoki FH, Pedro RJ. Fatal evolution of Chagas’ disease/Aids co-infection: diagnostic difficulties between myocarditis reactivation and chronic chagasic myocardiopathy. Rev Soc Bras Med Trop. 2009 Mar-Apr;42(2):199-202. [ Links ]
219. Perez-Ramirez L, Barnabé C, Sartori AM, Ferreira MS, Tolezano JE, Nunes EV, et al. Clinical analysis and parasite genetic diversity in human immunodeficiency virus/Chagas’ disease coinfections in Brazil. Am J Trop Med Hyg. 1999 Aug;61(2):198-206. [ Links ]
220. Bestetti RB, Dalbo CM, Freitas OC, Teno LA, Castilho OT, Oliveira JS. Noninvasive predictors of mortality for patients with Chagas’ heart disease: a multivariate stepwise logistic regression study. Cardiology. 1994;84(4-5):261-7. [ Links ]
221. Mady C, Cardoso RH, Barretto AC, Luz PL, Bellotti G, Pileggi F. Survival and predictors of survival in patients with congestive heart failure due to Chagas’ cardiomyopathy. Circulation. 1994 Dec;90(6):3098-102. [ Links ]
222. Rassi Júnior A, Rassi A, Little WC, Xavier SS, Rassi SG, Rassi AG, et al. Development and validation of a risk score for predicting mortality in Chagas’ heart disease. N Engl J Med. 2006 Aug 24;355(8):799-808. [ Links ]
223. Xavier SS, Sousa AS, Hasslocher-Moreno A. Application of the new classification of cardiac insufficiency (ACC/AHA) in chronic Chagas cardiopathy: a critical analysis of the survival curves. Rev SOCERJ. 2005 mai-jun;18(3):227-32. [ Links ]
224. Rodriguez-Salas LA, Klein E, Acquatella H, Catalioti F, Davalos V, Gomez-Mancebo JR, et al. Echocardiographic and clinical predictors of mortality in chronic Chagas’ disease. Echocardiography. 1998 Apr;15(3):271-278. [ Links ]
225. Viotti RJ, Vigliano C, Laucella S, Lococo B, Petti M, Bertocchi G, et al. Value of echocardiography for diagnosis and prognosis of chronic Chagas’ disease cardiomyopathy without heart failure. Heart. 2004 Jun;90(6):655-60. [ Links ]
226. Acquatella H, Schiller NB, Puigbó JJ, Giordano H, Suárez JA, Casal H, et al. M-mode and two-dimensional echocardiography in chronic Chagas’ heart disease: a clinical and pathologic study. Circulation. 1980 Oct;62(4):787-99. [ Links ]
227. Dias JCP. História natural da cardiopatia chagásica. In: Cançado JR, Chuster M. Cardiopatia chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985. p. 99-110. [ Links ]
228. Carrasco HA, Parada H, Guerrero L, Duque M, Durán D, Molina C. Prognostic implications of clinical, electrocardiographic and hemodynamic findings in chronic Chagas’ disease. Int J Cardiol. 1994 Jan;43(1):27-38. [ Links ]
229. Garzon SA, Lorga AM, Nicolau JC. Electrocardiography in Chagas’ heart disease. Sao Paulo Med J. 1995 Mar-Apr;113(2):802-13. [ Links ]
230. Marin-Neto JA, Simões MV, Sarabanda AV. Chagas’ heart disease. Arq Bras Cardiol. 1999;72(3):247-80. [ Links ]
231. Almeida-Filho OC, Maciel BC, Schmidt A, Pazin-Filho A, Marin-Neto JA. Minor segmental dyssynergy reflects extensive myocardial damage and global left ventricle dysfunction in chronic Chagas disease. J Am Soc Echocardiogr. 2002 Jun;15(6):610-6. [ Links ]
232. Pazin-Filho A, Romano MM, Gomes Furtado R, Almeida Filho OC, Schmidt A, Marin-Neto JA, et al. Left ventricular global performance and diastolic function in indeterminate and cardiac forms of Chagas’ disease. J Am Soc Echocardiogr. 2007 Dec;20(12):1338-43. [ Links ]
233. Rassi A Júnior, Rassi A, Rassi SG. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation . 2007 Mar;115(9):1101-8 [ Links ]
234. Xavier SS, Sousa AS, Brasil PEAA, Gabriel FG, Holanda MT, Hasslocher-Moreno A, et al. Incidência e preditores de morte súbita na cardiopatia chagásica crônica com função sistólica preservada. Rev SOCERJ. 2005 set-out;18(5):457-63. [ Links ]
235. Cunha GP. Síndromes clínicas na cardiomiopatia chagásica crônica. Hospital. 1960;57:71-95. [ Links ]
236. Rassi Jr A, Marin-Neto JA. Estado da Arte. Cardiopatia chagásica crônica. Rev Soc Cardiol Est São Paulo. 2000;10(4):6-12. [ Links ]
237. Rassi Júnior A, Rassi AG, Rassi SG, Rassi Júnior L, Rassi A. Arritmias ventriculares na doença de Chagas. Particularidades diagnósticas, prognósticas e terapêuticas. Arq Bras Cardiol. 1995 out;65(4):377-87. [ Links ]
238. Rassi Júnior A, Rassi SG, Rassi A. Morte súbita na Doença de Chagas. Arq Bras Cardiol. 2001 jan;76(1):75-85. [ Links ]
239. Rassi Júnior A, Rassi AG, Rassi SG, Rassi Júnior L, Las Casas AA, Rassi A. Arritmia ventricular na insuficiência cardíaca de etiologia chagásica e não chagásica. Arq Bras Cardiol. 1993;61 supl II:11-9. [ Links ]
240. Scanavacca M, Sosa E. Electrophysiologic study in chronic Chagas’ heart disease. Sao Paulo Med J. 1995 Mar-Apr;113(2):841-50. [ Links ]
241. Chiale PA, Halpern MS, Nau GJ, Tambussi AM, Przybylski J, Lázzari JO, et al. Efficacy of amiodarone during long-term treatment of malignant ventricular arrhythmias in patients with chronic chagasic myocarditis. Am Heart J. 1984 Apr;107(4):656-65. [ Links ]
242. Silva CP, Bacal F, Pires PV, Drager LF, Souza GEC, Fajardo GM, et al. Importance of amiodarone pulmonary toxicity in the differential diagnosis of a patient with dyspnea awaiting a heart transplant. Arq Bras Cardiol. 2006 Sep;86(3):e4-7. [ Links ]
243. Zimerman LI, Fenelon G, Martinelli Filho M, Grupi C, Atié J, Lorga Filho A, et al; Sociedade Brasileira de Cardiologia. Diretrizes brasileiras de fibrilação atrial. Arq Bras Cardiol. 2009;92(6 supl 1):1-39. [ Links ]
244. Martinelli Filho M, Zimerman LI, Lorga AM, Vasconcelos JTM, Rassi Júnior A; Sociedade Brasileira de Cardiologia. Diretrizes brasileiras de dispositivos eletrônicos implantáveis (DCEI). Arq Bras Cardiol. 2007; 89(6):e210-e238. [ Links ]
245. Baroldi G, Oliveira SJ, Silver MD. Sudden and unexpected death in clinically ‘silent’ Chagas’ disease. A hypothesis. Int J Cardiol. 1997 Feb;58(3):263-8. [ Links ]
246. Marin-Neto JA, Simões MV, Maciel BC. Aspectos peculiares da fisiopatologia da insuficiência cardíaca na doença de Chagas. Rev Soc Cardiol Est São Paulo. 1998;8(2):243-52. [ Links ]
247. Simões MV, Almeida Filho OC, Pazin Filho A, Castro RBP, Schmidt A, Maciel BC, et al. Insuficiência cardíaca na doença de Chagas. Rev Soc Cardiol Est São Paulo. 2000 Jan-Fev;10(1):50-64. [ Links ]
248. Bocchi EA, Marcondes-Braga FG, Bacal F, Ferraz AS, Albuquerque D, Rodrigues D, et al; Sociedade Brasileira de Cardiologia. Atualização da Diretriz Brasileira de Insuficiência Cardíaca Crônica: 2012. Arq Bras Cardiol. 2012 jan;98(1 supl 1):1-33. [ Links ]
249. Rocha MOC, Ribeiro AL, Teixeira MM. Clinical management of chronic Chagas cardiomyopathy. Front Biosci. 2003 Jan;8:e44-54. [ Links ]
250. Marin-Neto JA, Rassi A Júnior, Morillo CA, Avezum A, Connolly SJ, Sosa-Estani S, et al; BENEFIT Investigators. BENEFIT Investigators. Rationale and design of a randomized placebo-controlled trial assessing the effects of etiologic treatment in Chagas’ cardiomyopathy: the BENznidazole Evaluation For Interrupting Trypanosomiasis (BENEFIT). Am Heart J. 2008 Jul;156(1):37-43. [ Links ]
251. Morillo CA, Marin-Neto JA, Avezum A, Sosa-Estani S, Rassi Júnior A, Rosas F, et al; BENEFIT Investigators. Randomized Trial of Benznidazole for Chronic Chagas’ Cardiomyopathy. N Engl J Med. 2015 Oct;373(14):1295-306. [ Links ]
252. Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med. 2006 May;144(10):724-34. [ Links ]
253. Viotti R, Vigliano C, Lococo B, Petti M, Bertocchi G, Alvarez MG, et al. Clinical predictors of chronic chagasic myocarditis progression. Rev Esp Cardiol. 2005 Sep;58(9):1037-44. [ Links ]
254. Marin-Neto JA, Rassi Júnior A, Sousa AS, Dias JCP, Rassi A. Doença de Chagas: moléstia negligenciada. In: Andrade JP, Arnett DK, Pinto FJ (editores). Tratado de Prevenção Cardiovascular. Um Desafio Global. São Paulo: Atheneu; 2014. p. 117-27. [ Links ]
255. Montera MW, Pereira SB, Colafranceschi AS, Almeida DR, Tinoco EM, Rocha RM, et al. Sumário de Atualização da II Diretriz Brasileira de Insuficiência Cardíaca Aguda: 2009/2011. Arq Bras Cardiol. 2012;98(5):375-83. [ Links ]
256. Roberti RR, Martinez EE, Andrade JL, Araujo VL, Brito FS, Portugal OP, et al. Chagas cardiomyopathy and captopril. Eur Heart J. 1992 Jul;13(7):966-70. [ Links ]
257. Davila DF, Angel F, Arata de Bellabarba G, Donis JH. Effects of metoprolol in chagasic patients with severe congestive heart failure. Int J Cardiol. 2002 Oct;85(2-3):255-60. [ Links ]
258. Freitas H, Salaltino G, Chizzola P, Costa J, Mansur A, Ramires JF, et al. Betablockers for Chagas’ heart disease. J Am Coll Cardiol. 1999;33 Suppl A:184. [ Links ]
259. Bocchi EA, Bellotti G, Uip D, Kalil J, Lourdes Higuchi M, Fiorelli A, et al. Long-term follow-up after heart transplantation in Chagas’ disease. Transplant Proc. 1993 Feb;25(1 Pt 2):1329-30. [ Links ]
260. Carvalho VB, Sousa EF, Vila JH, Silva JP, Caiado MR, Araujo SR, et al. Heart transplantation in Chagas’ disease. 10 Years after the initial experience. Circulation. 1996 Oct;94(8):1815-7. [ Links ]
261. Ribeiro dos Santos R, Rassi S, Feitosa G, Grecco OT, Rassi Júnior A, Cunha AB, et al; Chagas Arm of the MiHeart Study Investigators. Cell therapy in Chagas cardiomyopathy (Chagas arm of the multicenter randomized trial of cell therapy in cardiopathies study): a multicenter randomized trial. Circulation. 2012 May;125(20):2454-61. [ Links ]
262. Samuel J, Oliveira M, Correa De Araujo RR, Navarro MA, Muccillo G. Cardiac thrombosis and thromboembolism in chronic Chagas’ heart disease. Am J Cardiol. 1983 Jul;52(1):147-51. [ Links ]
263. Lopes ER, Marquez JO, Costa Neto B, Menezes AAC, Chapadeiro E. Associação entre acidentes vasculares encefálicos e doença de Chagas. Rev Soc Bras Med Trop. 1991 Apr-Jun;24(2):101-4. [ Links ]
264. Sousa AS, Xavier SS, Freitas GR, Hasslocher-Moreno A. Prevention strategies of cardioembolic ischemic stroke in Chagas’ disease. Arq Bras Cardiol. 2008 Nov;91(5):306-10. [ Links ]
265. Oliveira Júnior W. O cardiopata chagásico em situações especiais. In: Pinto JC, Rodrigues J (Orgs). Clínica e terapêutica da doença de Chagas. 2 ed. Rio de Janeiro: Fiocruz; 1997. p. 293-322. [ Links ]
266. Bestetti RB. Avaliação do risco cirúrgico em pacientes portadores de cardiopatia chagásica crônica em cirurgias não cardíacas. In: Pinto JC, Rodrigues J (Orgs). Clínica e terapêutica da doença de Chagas. 2 ed. Rio de Janeiro: Fiocruz; 1997. p. 281-91. [ Links ]
267. Ramos G, Ramos Filho J, Rassi Júnior A, Pereira E, Gabriel Neto S, Chaves E. Marcapasso cardíaco artificial: considerações pré e per-operatórias. Rev Bras Anestesiol. 2003 nov-dez;53(6):854-62. [ Links ]
268. Prata A. Implicações epidemiológicas e sócio-econômicas da doença de Chagas. Brasilia Med. 1973;9:69-71. [ Links ]
269. Porto CC, Rassi A, Faria GHDC. Aspectos sócio-econômicos e médico-trabalhistas. In: Cançado JR, Chuster M (editores). Cardiopatia Chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985. p. 362-6. [ Links ]
270. Dias JCP. Aspectos clínicos, sociais e trabalhistas da doença de Chagas em área endêmica sob controle do estado de Minas Gerais, Brasil. Rev Soc Bras Med Trop. 1999 apr-jun;26(2):93-9. [ Links ]
271. Morais BB, Martins P, Maiolini DD, Silva AL, Melo JRC. Concomitant lesions in Chagas’ disease. Eur J Gastroenterol Hepatol. 1991;3(7):523-6. [ Links ]
272. Fonseca FM, Etchebehere RM, Queiroz DM, Rocha AM, Junqueira IS, Fonseca DN, et al. Histological and endoscopic features of the stomachs of patients with Chagas disease in the era of Helicobacter pylori. Rev Soc Bras Med Trop. 2014 Nov-Dec;47(6):739-46. [ Links ]
273. Rezende JM. Classificação radiológica do megaesôfago. Rev Goiana Med. 1982 jul-dez;28(3/4):187-91. [ Links ]
274. Brücher BL, Stein HJ, Bartels H, Feussner H, Siewert JR. Achalasia and esophageal cancer: incidence, prevalence, and prognosis. World J Surg. 2001 Jun;25(6):745-9. [ Links ]
275. Leeuwenburgh I, Scholten P, Alderliesten J, Tilanus HW, Looman CW, Steijerberg EW, et al. Long-term esophageal cancer risk in patients with primary achalasia: a prospective study. Am J Gastroenterol. 2010 Oct;105(10):2144-9. [ Links ]
276. Pérez-Ayala A, Pérez-Molina JA, Norman F, Monge-Maillo B, Faro MV, López-Vélez R. Gastro-intestinal Chagas disease in migrants to Spain: prevalence and methods for early diagnosis. Ann Trop Med Parasitol. 2011 Jan;105(1):25-9. [ Links ]
277. Oliveira RB, Troncon LEA, Dantas RO, Meneghelli UG. Gastrointestinal manifestations of Chagas disease. Am J Gastroenterol. 1998 Jun;93(6):884-9. [ Links ]
278. Meier-Ruge WA, Müller-Lobeck H, Stoss F, Bruder E. The pathogenesis of idiopathic megacolon. Eur J Gastroenterol Hepatol. 2006 Nov;18(11):1209-15. [ Links ]
279. Pasricha PJ, Rai R, Ravich WJ, Hendrix TR, Kalloo AN. Botulinum toxin for achalasia: long-term outcome and predictors of response. Gastroenterology. 1996 May;110(5):1410-5. [ Links ]
280. Ferguson MK. Achalasia: current evaluation and therapy. Ann Thorac Surg. 1991 Aug;52(2):336-42. [ Links ]
281. Heller E. Extramukose Cardiaplastik beim chronischen Cardiospasmus mit Dilatation des Oesophagus. Mitt Grenzgeb Med Chir. 1913;27(1):141-49. [ Links ]
282. Pinotti HW, Habr-Gama A, Cecconello I, Felix VN, Zilbertein B. The surgical treatment of megaesophagus and megacolon. Dig Dis. 1993 Jul-Oct;11(4-5):206-15. [ Links ]
283. Spiess AE, Kahrilas PJ. Treating achalasia: from whalebone to laparoscope. JAMA. 1998 Aug;280(7):638-42. [ Links ]
284. NOSCAR POEM White Paper Committee; Stavropoulos SN, Desilets DJ, Fuchs KH, Gostout CJ, Haber G, Inoue H, et al. Per-oral endoscopic myotomy white paper summary. Gastrointest Endosc. 2014 Jul;80(1):1-15. [ Links ]
285. Inoue H, Tianle KM, Ikeda H, Hosoya T, Onimaru M, Yoshida A, et al. Peroral endoscopic myotomy for esophageal achalasia: technique, indication, and outcomes. Thorac Surg Clin. 2011 Nov;21(4):519-25. [ Links ]
286. Swanstrom LL, Kurian A, Dunst CM, Sharata A, Bhayani N, Rieder E. Long-term outcomes of an endoscopic myotomy for achalasia: the POEM procedure. Ann Surg. 2012 Oct;256(4):659-67. [ Links ]
287. Duhamel B. Une nouvelle opération pour le mégacolon cologénital: l’abaissement rétro-rectal et transanal du côlon et son application possible au traitement de quelques autres malformations. Nouv Presse Med. 1956; 64(95):2249-50. [ Links ]
288. Reis-Neto JA, Pedroso MA, Lupinacci RA, Reis Júnior JA, Ciquini SA, Lupinacci RM, et al. Megacolo adquirido: perspectivas fisiopatológicas para o tratamento laparoscópico. Rev Bras Colo-proctol. 2004 jan-mar;24(1):49-62. [ Links ]
289. Coura JR, Borges-Pereira J. Chronic phase of Chagas disease: why should it be treated? A comprehensive review. Mem Inst Oswaldo Cruz. 2011 Sep;106(6):641-5. [ Links ]
290. Molina I, Gómez i Prat J, Salvador F, Treviño B, Sulleiro E, Serre N, et al. Randomized trial of posaconazole and benznidazole for chronic Chagas’ disease. N Engl J Med. 2014 May;370:1899-908. [ Links ]
291. Cançado JR. Terapêutica específica. In: Dias JCP, Coura JR, editores. Clínica e Terapêutica da Doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: Fiocruz; 1997. p. 323-51. [ Links ]
292. Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel BM, Yampotis C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. Am J Trop Med Hyg. 1988 Oct;59(4):526-9. [ Links ]
293. Andrade AL, Zicker F, Oliveira RM, Silva SA, Luquetti A, Travassos LR, et al. Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet. 1996 Nov;348(9039):1407-13. [ Links ]
294. Yun O, Lima MA, Ellman T, Chambi W, Castillo S, Flevaud L, et al. Feasibility, drug safety, and effectiveness of etiological treatment programs for Chagas disease in Honduras, Guatemala, and Bolivia: 10-year experience of Médecins Sans Frontières. PLoS Negl Trop Dis. 2009 Jul;3(7):e488. [ Links ]
295. Bern C, Montgomery SP, Herwaldt BL, Rassi Júnior A, Marin-Neto JA, Dantas RO, et al. Evaluation and treatment of Chagas disease in the United States: a systematic review. JAMA. 2007 Nov;298(18):2171-81. [ Links ]
296. Coura JR, Abreu LL, Willcox HP, Petana W. Comparative controlled study on the use of benznidazole, nifurtimox and placebo, in the chronic form of Chagas’ disease, in a field area with interrupted transmission. I. Preliminary evaluation. Rev Soc Bras Med Trop. 1997 Mar-Apr;30(2):139-44. [ Links ]
297. Bitto C, Silveira C, Cardoso MA, Marques P, Luquetti A, Macedo V, et al. Parasite persistence in treated chagasic patients revealed by xenodiagnosis and polymerase chain reaction. Mem Inst Oswaldo Cruz. 2001 Aug;96(6):823-6. [ Links ]
298. Gallerano RH, Sosa RR. Resultados de un estúdio a largo plazo con drogas antiparasitárias en infectados chagásicos crónicos. Rev Fed Arg Cardiol. 2001;30:289-96. [ Links ]
299. Fragata Filho AA. Tratamento antiparasitário da doença de Chagas. Rev Soc Cardiol Estado de São Paulo. 2009;19:2-5. [ Links ]
300. Andrade SG, Magalhães JB, Pontes AL. Terapêutica da fase crônica da infecção experimental pelo Trypanosoma cruzi com o benzonidazol e o nifurtimox. Rev Soc Bras Med Trop. 1989 Jul-Sep;22(3):113-8. [ Links ]
301. Garcia S, Ramos CO, Senra JFV, Vilas-Boas F, Rodrigues MM, Campos-de-Carvalho AC, et al. Treatment with benznidazole during the chronic phase of experimental Chagas’ disease decreases cardiac alterations. Antimicrob Agents Chemother. 2005 Apr;49(4):1521-8. [ Links ]
302. Coura JR, Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz. 2002 Jan;97(1):3-24. [ Links ]
303. Maguire JH. Treatment of Chagas’ disease: time is running out. N Engl J Med. 2015 Oct;373(14):1369-70. [ Links ]
304. D’Albuquerque LA, Gonzalez AM, Filho HL, Copstein JL, Larrea FI, Mansero JM, et al. Liver transplantation from deceased donors serologically positive for Chagas disease. Am J Transplant. 2007 Mar;7(3):680-4. [ Links ]
305. Altclas JD, Barcan L, Nagel C, Lattes R, Riarte A. Organ transplantation and Chagas disease. JAMA. 2008 Mar;299(10):1134. [ Links ]
306. Sousa AA, Lobo MC, Barbosa RA, Bello V. Chagas seropositive donors in kidney transplantation. Transplant Proc. 2004 May;36(4):868-9. [ Links ]
307. Bocchi EA, Belloti G, Mocelin AO, Uip D, Bacal F, Higuchi ML, et al. Heart transplantation for chronic Chagas’ disease. Ann Thorac Surg. 1996 Jun;61(6):1727-33. [ Links ]
308. Freitas VL, Silva SC, Sartori AM, Bezerra RC, Westphalen EV, Molina TD, et al. Real-time PCR in HIV/Trypanosoma cruzi coinfection with and without Chagas disease reactivation: association with HIV viral load and CD4 level. PLoS Negl Trop Dis. 2011 Aug;5(8):e1277. [ Links ]
309. Brener Z. Laboratory-acquired Chagas’ disease: an endemic disease among parasitologists? In: Morel M, editor. Genes and antigens of parasites: a laboratory manual. 2 ed. Rio de Janeiro: Editora Fiocruz; 1984. p. 3-9. [ Links ]
310. Brener Z. Laboratory-acquired Chagas disease: comment. Trans R Soc Trop Med Hyg. 1987;81(3):527. [ Links ]
311. Shikanai-Yasuda MA, Umezawa ES, Tolezano JE, Matsubara L. Doença de Chagas aguda após uso profilático de benznidazol (Acidente de laboratório). Rev Soc Bras Med Tropical. 1993;26 supl II:127-8. [ Links ]
312. Bern C. Chagas’ Disease. N Engl J Med. 2015 Nov;373(19):1881-2. [ Links ]
313. Portela-Lindoso AAB, Shikanai-Yasuda MA. Doença de Chagas crônica: do xenodiagnóstico e hemocultura à reação em cadeia da polimerase. Rev Saude Publica. 2003 fev;37(1):107-15. [ Links ]
*Proyecto financiado por la Unidad Técnica de Vigilancia de las Enfermedades de Transmisión Vectorial, Secretaría de Vigilancia en Salud, Ministerio de la Salud de Brasil, Brasilia-DF.
ADJUNTO
Definiciones relativas a los grados o clases de recomendaciones y niveles de evidencias1
Clases de recomendaciones
Clase I - condiciones para las cuales hay evidencias conclusivas, o, en su ausencia, consenso general de que el procedimiento o tratamiento es útil y/o efectivo.
Clase II - condiciones para las cuales hay evidencias conflictivas y/o divergencias de opiniones sobre utilidad/efectividad y seguridad del procedimiento o tratamiento:
Clase IIa - evidencias u opiniones que favorecen la indicación del procedimiento o tratamiento; la mayoría de los profesionales involucrados en el manejo específico lo aprueba;
Clase IIb - utilidad/efectividad y seguridad menos bien establecidas por medio de evidencias, con división de opiniones; procedimiento o tratamiento es considerado opcional.
Clase III - condiciones para las cuales hay evidencias conclusivas y/o consenso general de que el procedimiento/ tratamiento no es útil y/o efectivo, pudiendo ser perjudicial en algunas circunstancias.
Niveles de evidencia
Nivel A - datos obtenidos a partir de varios estudios randomizados consistentes y de buena calidad o de metaanálisis robustas de estudios clínicos randomizados.
Nivel B - datos obtenidos a partir de un único ensayo clínico randomizado o de varios estudios clínicos no randomizados, observacionales (metaanálisis menos robustas).
Nivel C - datos obtenidos a partir de opiniones consensuales de expertos en el tema.
1Basadas en publicaciones internacionales y particularmente avaladas por la I Directriz Latinoaméricana para el Diagnóstico y Tratamiento de la Cardiopatía de Chagas.203
Niveles de evidencia clasificados como B o C no pueden ser interpretados como recomendaciones débiles. Existen muchas recomendaciones consensuales, por lo tanto, con clase de recomendación I, con nivel de evidencia C (opiniones de expertos). Por otro lado, algunas indicaciones consideradas controvertidas (grado de recomendación II) pueden estar basadas en ensayos clínicos randomizados (nivel de evidencia A).










 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI