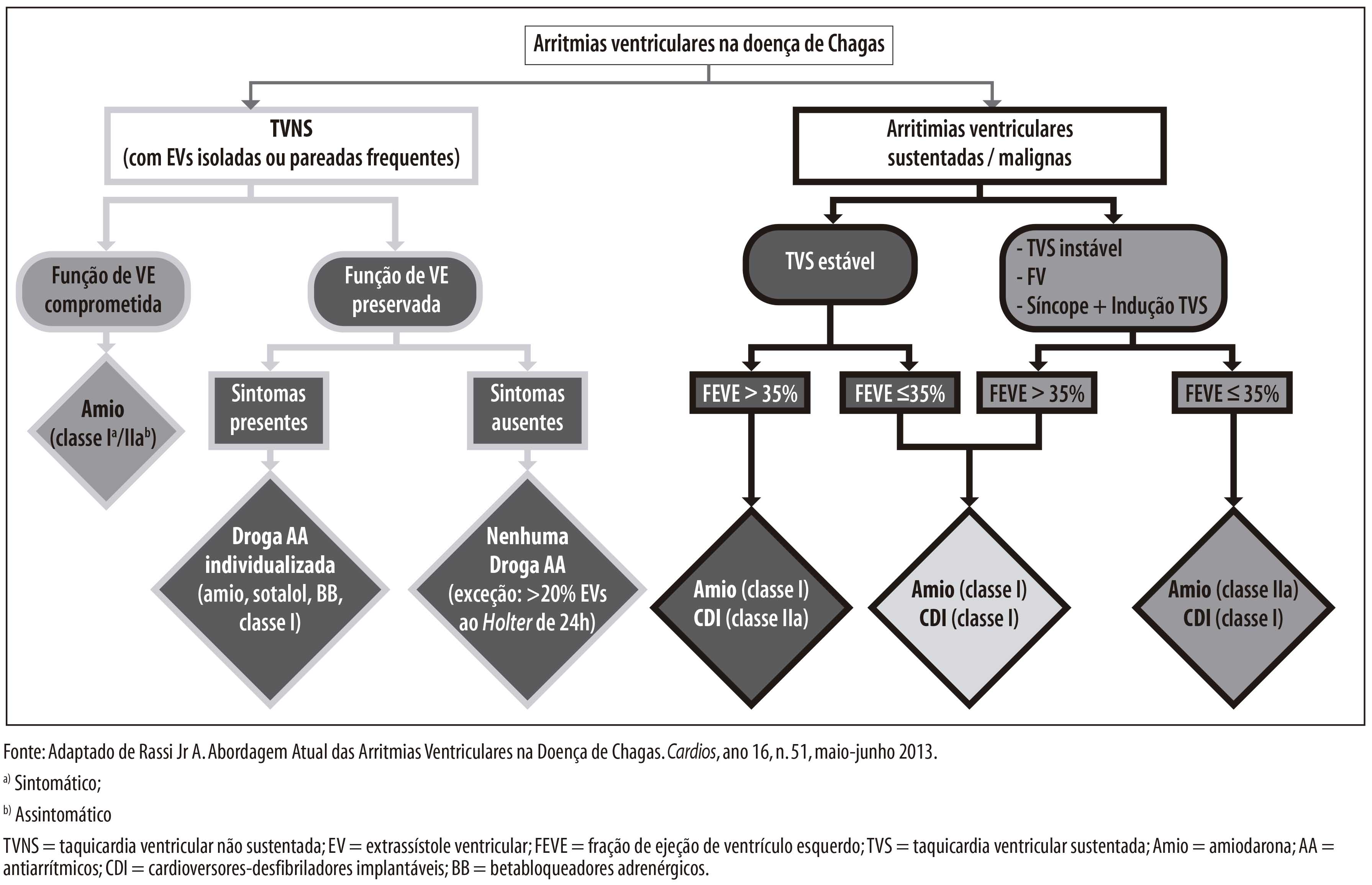
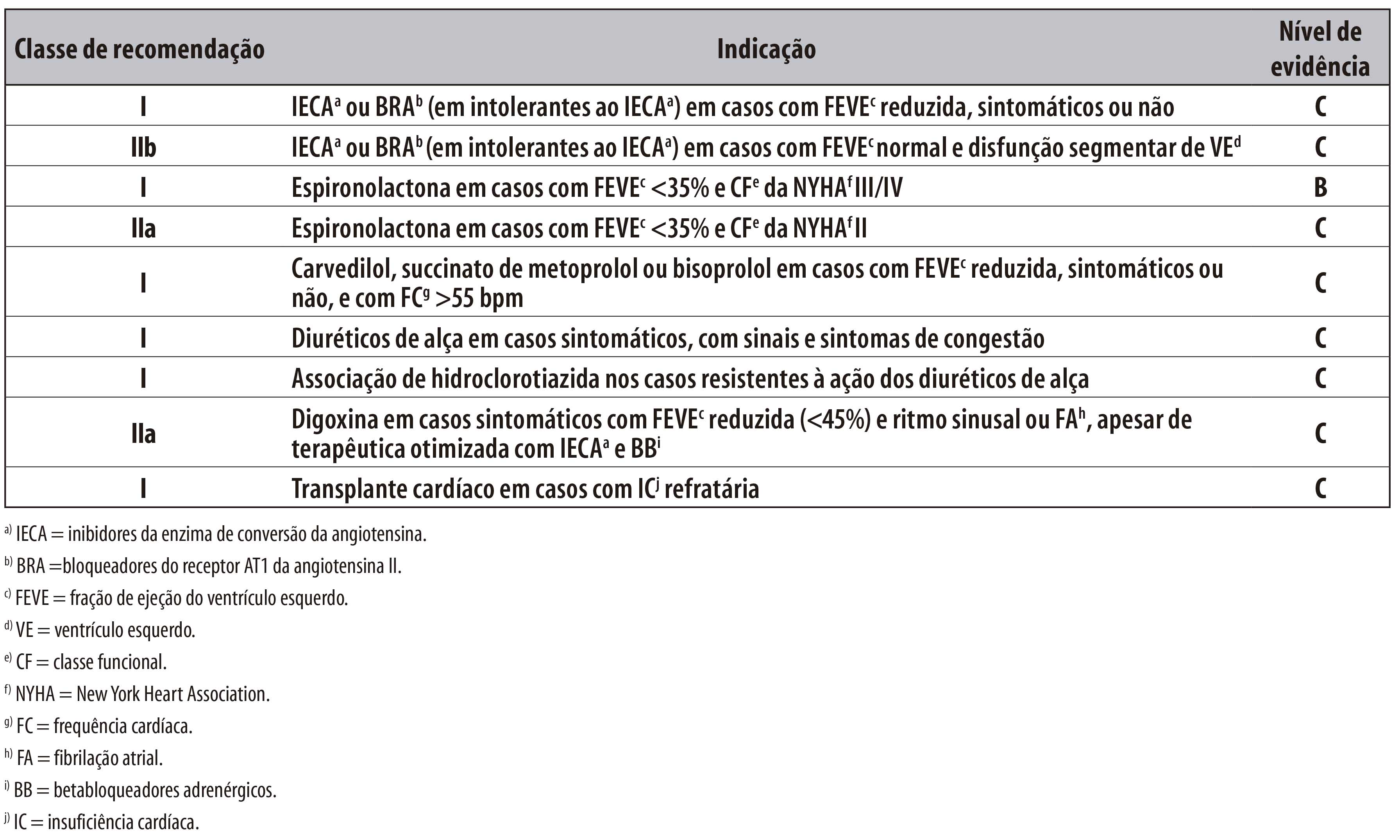
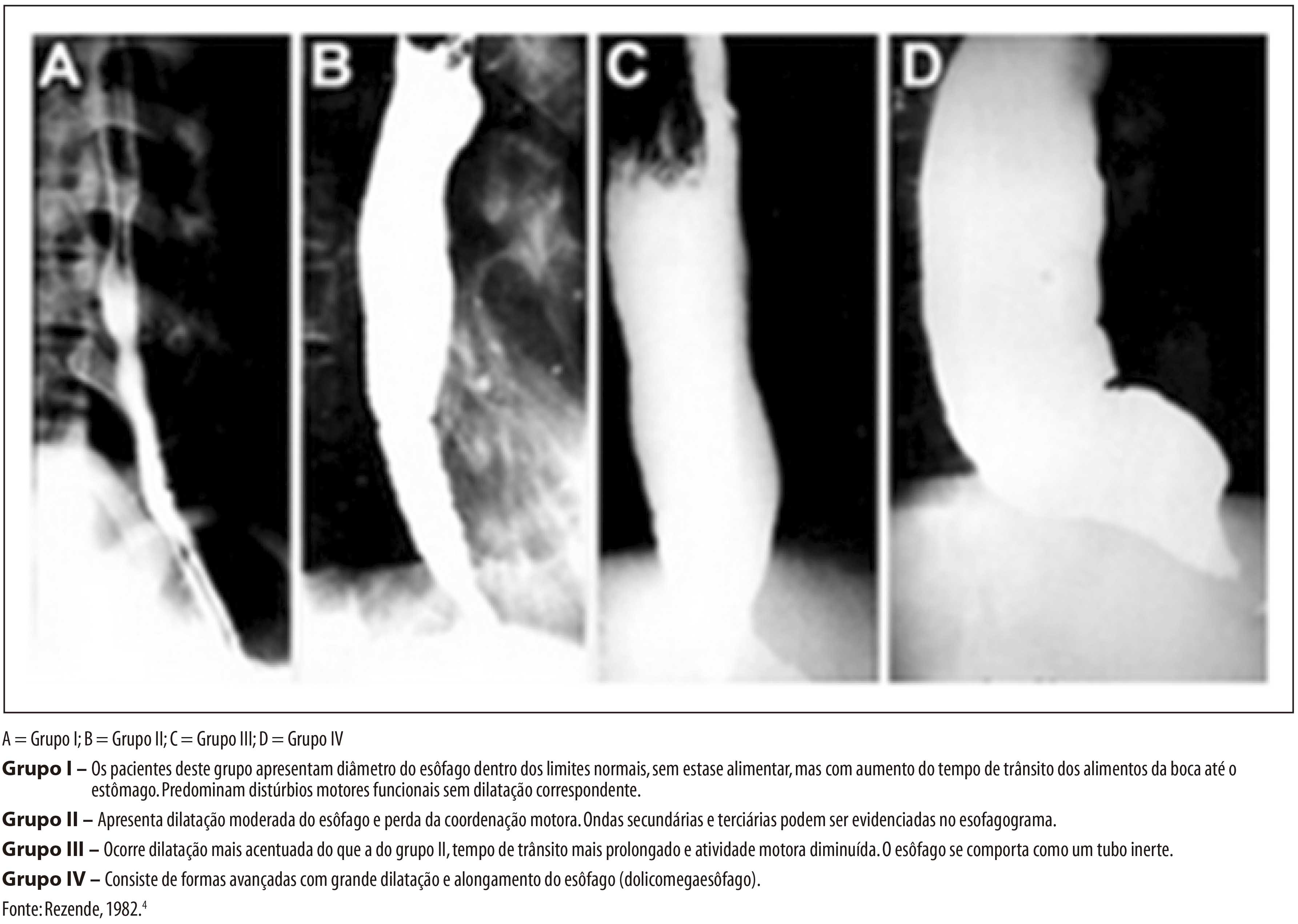
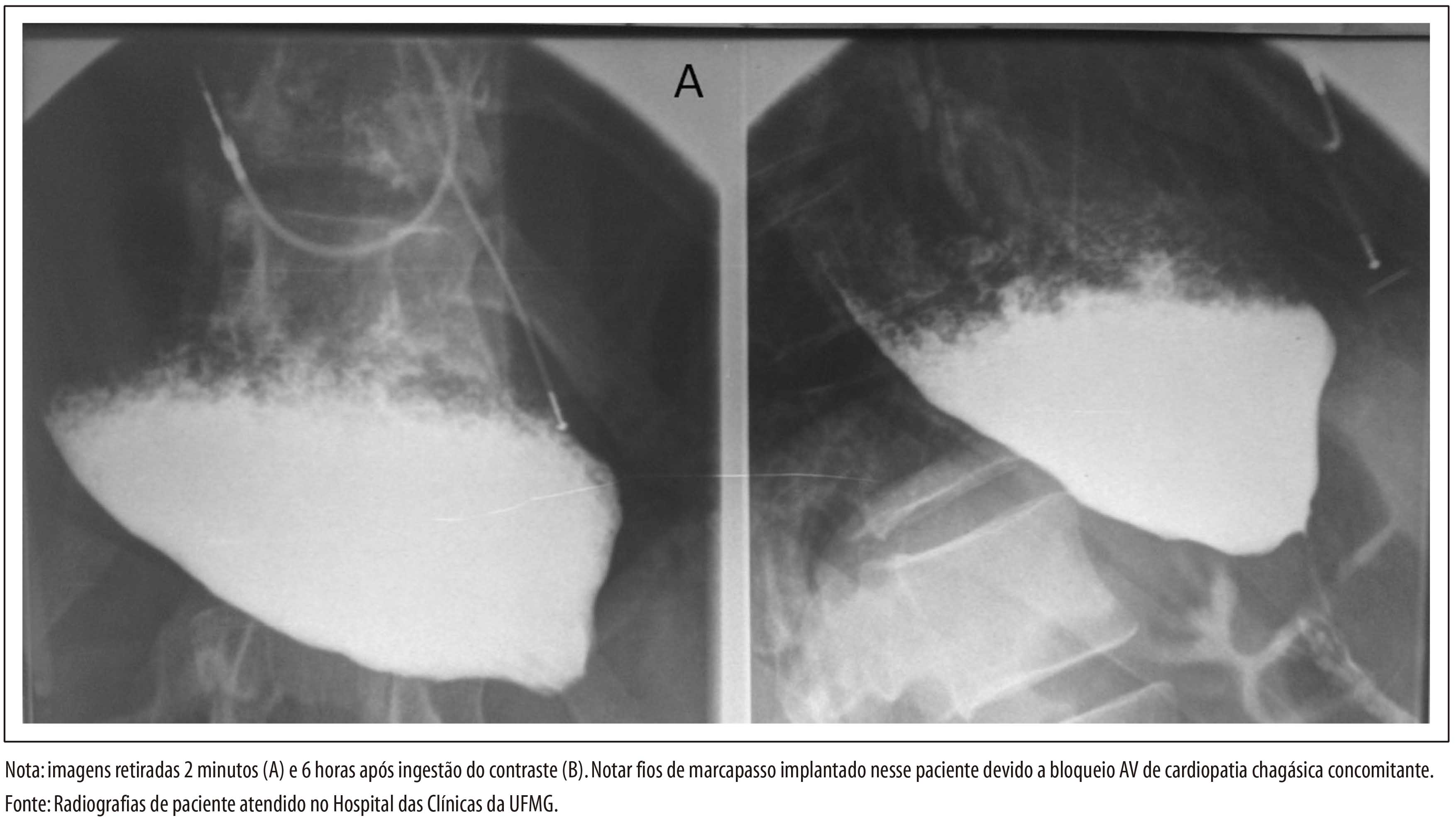
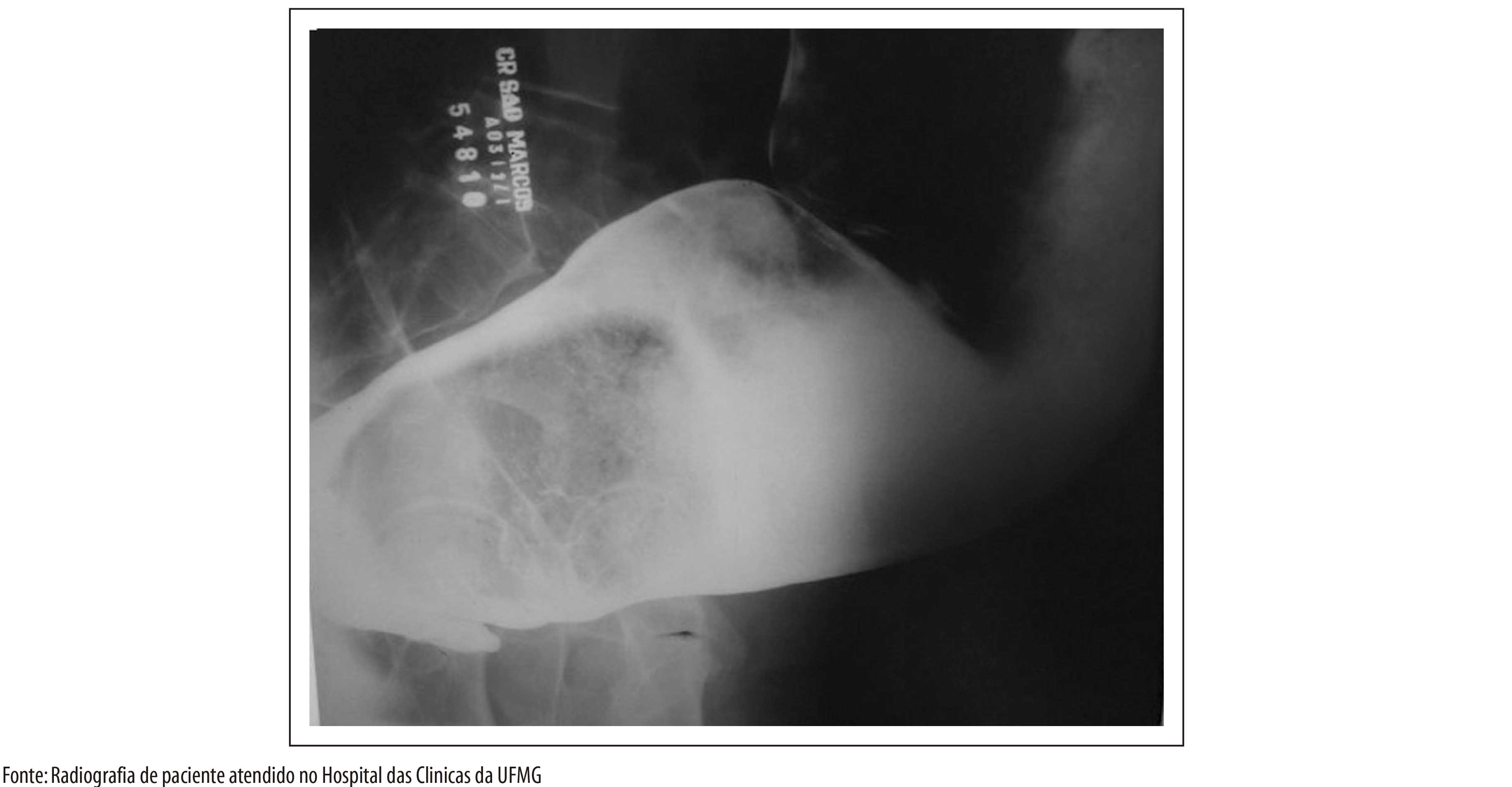
ASPECTOS GERAIS DA EPIDEMIOLOGIA DA DOENÇA DE CHAGAS, COM ESPECIAL ATENÇÃO AO BRASIL
Introdução
A doença de Chagas representa uma condição infecciosa (com fase aguda ou crônica) classificada como enfermidade negligenciada pela Organização Mundial da Saúde (OMS).1,2 É resultante da pobreza humana, ao mesmo tempo que a reproduz, e apresenta elevada carga de morbimortalidade em países endêmicos, incluindo o Brasil, com expressão focal em diferentes contextos epidemiológicos.1-4 A distribuição espacial da doença é limitada primariamente ao continente americano em virtude da distribuição de mais de 140 espécies do inseto vetor (Triatominae, Hemiptera, Reduviidae), daí ser também denominada “tripanossomíase americana”.5 Progressivamente, no entanto, a doença tem alcançado países não endêmicos, mediante o deslocamento de pessoas infectadas e por meio de outros mecanismos de transmissão, como resultado do intenso processo de migração internacional.6-13
A OMS estima em aproximadamente 6 a 7 milhões o número de pessoas infectadas em todo o mundo, a maioria na América Latina.14 Estimativas recentes para 21 países latino-americanos, com base em dados de 2010, indicavam 5.742.167 pessoas infectadas por Trypanosoma cruzi, das quais 3.581.423 (62,4%) eram residentes em nações da Iniciativa dos Países do Cone Sul, destacando-se a Argentina (1.505.235), o Brasil (1.156.821) e o México (876.458), seguidos da Bolívia (607.186).5 Todavia, estes dados divergem de outras estimativas realizadas por diferentes grupos de pesquisa e métodos para definição de infecção por T. cruzi em vários países, o que dificulta o estabelecimento exato da prevalência da doença de Chagas nas Américas. No entanto, os autores concordam que o número de infectados é ainda muito expressivo no contexto sanitário e social do Continente, requerendo prioridade e atenção por parte dos países.15,16
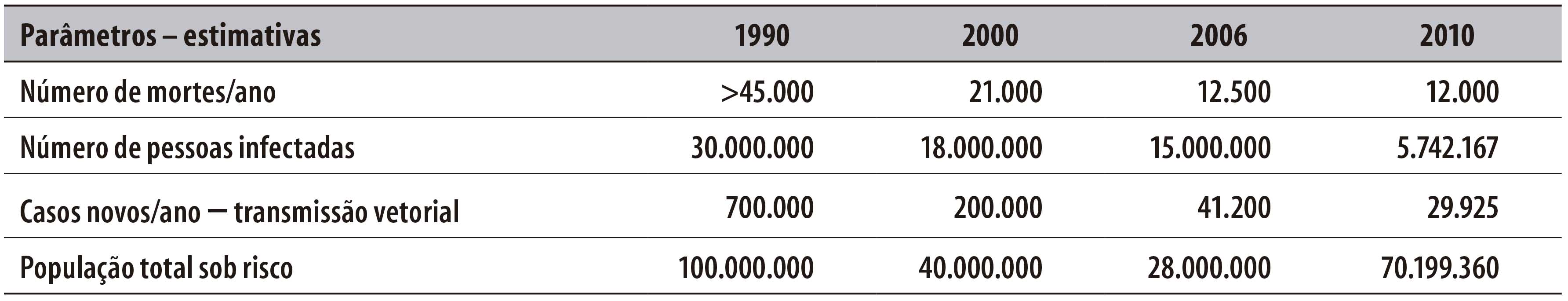
A Tabela 1 apresenta as mudanças em parâmetros epidemiológicos específicos para a América Latina em anos recentes.5,17
Tabela 1 - Mudanças na mortalidade, prevalência e incidência por transmissão vetorial da doença de Chagas em 21 países endêmicos da América Latina, nos anos de 1990, 2000, 2006 e 2010
Fonte: Adaptado de Pan American Health Organization, 200617 (TDR/WHO, PAHO, WHO); de World Health Organization, 2015.5
Assim, a despeito dos avanços no controle do vetor e na garantia de qualidade das transfusões de sangue em vários desses países, especialmente a partir de iniciativas intergovernamentais deflagradas na década de 1990,3,4,10,11,18 é ainda inequívoca a relevância da doença de Chagas como problema de saúde pública na América Latina, sob diferentes padrões regionais de expressão epidemiológica. Os desafios ampliam-se quando se têm estimativas em 2015 de mais de 80% das pessoas atingidas pela doença de Chagas no mundo sem acesso a diagnóstico e tratamento sistemáticos, o que sustenta o elevado impacto de morbimortalidade e o custo social da enfermidade.
Migrações humanas não controladas, degradação ambiental, alterações climáticas, maior concentração da população em áreas urbanas e precariedade de condições socioeconômicas (habitação, educação, saneamento, renda, entre outras) inserem-se como determinantes e condicionantes sociais para a transmissão de T. cruzi ao homem.1,10,11,19-23 Negligenciadas em diferentes graus e perspectivas, as populações infectadas apresentam maior vulnerabilidade, que se expressa pela sobreposição e maior exposição a outras doenças, condições e agravos, menor cobertura com intervenções preventivas, maior probabilidade de adoecimento, menor acesso à rede de serviços de saúde, pior qualidade da atenção recebida em serviços de atenção primária, menor probabilidade de receber tratamentos essenciais, menor acesso a serviços de nível secundário e terciário, maior probabilidade de desenvolvimento de formas graves da doença e maior risco de evolução para óbito.24
Nesta perspectiva, torna-se essencial o maior conhecimento relativo a cenários epidemiológicos da doença de Chagas e sua dinâmica de transmissão, envolvendo pessoas infectadas e sob risco de infecção, diferentes populações do parasito, espécies do vetor e reservatórios de T. cruzi. Este conhecimento integrado representa fator central para a busca de ações consistentes e sustentáveis de gestão, vigilância, controle e atenção à saúde e social, coerentes, eficazes, efetivas e eficientes.1,10,11,25-27
Apesar desta clara necessidade por maiores evidências, após mais de 105 anos desde a descoberta da doença por Carlos Ribeiro Justiniano Chagas (1909), ainda persistem importantes lacunas nos campos técnico, científico e político que devem ser superadas para o efetivo enfrentamento desta condição extensamente negligenciada.
O Brasil, com suas dimensões continentais, está passando por grandes e rápidas transformações demográficas, sociais e ambientais, mas com persistência de graves desigualdades socioeconômicas e regionais. Aqui, doenças associadas a contextos de vulnerabilidade social e negligência ainda afligem parte considerável da população.28
Aos poucos, entretanto, tem-se observado melhoria consistente na situação geral da saúde e na expectativa de vida da população brasileira, o que pode ser atribuído a transformações nos determinantes sociais da saúde, ao avanço no controle de doenças infecciosas e à implementação de um sistema nacional de saúde mais abrangente, com relevante participação social.28,29
A despeito dos avanços ocorridos no campo social brasileiro, reconhece-se a persistência de grandes desigualdades sociais que resultam em situações de vulnerabilidade individual, programática e social potencial que envolvem a doença de Chagas. Novos problemas de saúde emergem, todavia, como resultado do intenso processo de urbanização e das mudanças no campo social e ambiental, enquanto outros tendem a persistir e coexistir,28 demandando novas respostas da rede de atenção à saúde.30
Demandam, portanto, ações específicas, ajustadas a novas realidades, voltadas para a abordagem integrada dos diferentes componentes envolvidos na história natural da doença: seres humanos, vetores, reservatórios e T. cruzi.3,6,15 A grande extensão e diversidade territorial, com especificidades nas dinâmicas ecológica, demográfica, social e econômica das regiões, implica múltiplos cenários clínicos, epidemiológicos e operacionais.3,4,15
Os próximos anos trazem, para além dos desafios, oportunidades de uma ação ainda mais concreta e compartida no enfrentamento da doença de Chagas. O ano de 2015 foi o ano de lançamento dos novos dezessete Objetivos de Desenvolvimento Sustentável (ODS), que se baseiam nos oito Objetivos de Desenvolvimento do Milênio (ODM). A agenda que foi pactuada e consolidada no documento referencial “Transformando Nosso Mundo: A Agenda 2030 para o Desenvolvimento Sustentável” representa uma oportunidade histórica e sem precedentes para os países buscarem novos caminhos globais.31 De uma forma mais ampla, essas decisões determinarão o curso global de ação para o enfrentamento e eliminação da pobreza, com o objetivo de promover a prosperidade e o bem-estar para todos, proteger o ambiente e enfrentar as mudanças climáticas.31
A doença de Chagas insere-se no terceiro objetivo deste documento, que visa “assegurar uma vida saudável e promover o bem-estar para todos, em todas as idades”, na meta de, até 2030, acabar com as epidemias de aids, tuberculose, malária e doenças tropicais negligenciadas, e combater a hepatite, doenças transmitidas pela água, e outras doenças transmissíveis.31 Ressalta-se o avanço na composição de indicador específico para monitorar as doenças tropicais negligenciadas no mundo, a partir do reconhecimento do número de pessoas que requerem intervenções contra este grupo de doenças. Adicionalmente, visualizam-se também a doença de Chagas e outras doenças tropicais negligenciadas em interfaces com o segundo (fome zero e agricultura sustentável), quinto (igualdade de gênero) e sexto (água potável e saneamento) objetivos.31
MORBIMORTALIDADE
Infecção por T. cruzi
No Brasil, o número reduzido de estudos sistemáticos, de base populacional, dificulta a avaliação por estimativas da magnitude da doença de Chagas ao longo da história.
Em um período que vai até aproximadamente os anos 1950, a doença de Chagas era reconhecida como endemia eminentemente rural, em áreas de elevada vulnerabilidade social, predominando a transmissão vetorial. Com o processo de industrialização do país, a doença foi sendo modelada a um novo contexto epidemiológico urbano, potencializado pela migração interna no país de áreas rurais para áreas urbanas e pelo crescimento das cidades.4
Entre 1975 e 1980, um inquérito sorológico nacional na população rural do Brasil (exceto em São Paulo), estimou a prevalência global no país em 4,2%, correspondendo a 6,5 milhões de pessoas infectadas por T. cruzi.20,32,33
Em 1996 foi estimada para o Brasil a prevalência de infecção por T. cruzi em 3,1% para 1978 e em 1,3% para 1995, chegando-se a um número estimado de 1,96 milhão de pessoas infectadas.34 Posteriormente, a Organização Pan-americana da Saúde (OPAS) estimou o número de pessoas expostas ao risco em áreas endêmicas no Brasil em 21,8 milhões, sendo de 1,9 milhão (1,019% da população) o número de pessoas infectadas.17
Em 2014 foi publicado o primeiro estudo com revisão sistemática e metanálise para estimativa da prevalência da doença de Chagas no Brasil. Incluindo publicações no período de 1980 a 2012, estimou-se a prevalência agrupada da doença de Chagas em 4,2% (Intervalo de Confiança [IC] 95%: 3,1-5,7), variando de 4,4% (IC95%: 2,3-8,3) na década de 1980 a 2,4% (IC95%: 1,5-3,8) após 2000.35 Neste estudo, as maiores prevalências foram verificadas em: mulheres (4,2%; IC95%: 2,6-6,8), maiores de 60 anos (17,7%; IC95%: 11,4-26,5), residentes nas regiões Nordeste (5,0%; IC95%: 3,1-8,1) e Sudeste (5,0%; IC95%: 2,4-9,9) e em áreas mistas, urbana/rural (6,4%; IC95%: 4,2-9,4), estimando-se que 4,6 milhões (IC95%: 2,9-7,2 milhões) de pessoas estariam infectadas por T. cruzi no Brasil. Ressaltando a limitação dos achados na literatura, os autores encareceram a necessidade de novos estudos, com vistas a estimativas cada vez mais próximas do contexto real.35
A partir deste e de outros estudos, as estimativas mais recentes no Brasil relativas ao número de pessoas infectadas por T. cruzi variam de 1,9 milhão a 4,6 milhões de pessoas,35-37 provavelmente mais próximo atualmente à variação de 1,0 a 2,4% da população.
Este cenário epidemiológico traz o desafio para o país nas próximas décadas de sustentar as ações de controle e estabelecer um plano consistente no Sistema Único de Saúde (SUS) para diagnóstico, tratamento e atenção integral a milhões de cidadãos,38 aliados a ações de vigilância epidemiológica mais ajustadas a esta realidade.15,22 Partindo-se do pressuposto de que até 30% das pessoas cronicamente infectadas poderão vir a apresentar alterações cardíacas e que até 10% poderão apresentar alterações digestivas, neurológicas ou mistas, amplia-se a necessidade para estruturação de uma rede de atenção à saúde oportuna, resolutiva e integral à doença de Chagas no país.39
Com o objetivo de se estabelecerem estimativas para o Brasil quanto ao número de pessoas infectadas por T. cruzi, tomou-se como referência de base populacional a publicação Projeção da População do Brasil por Sexo e Idade para o Período 2000/2060 e Projeção da População das Unidades da Federação por Sexo e Idade para o período 2000/2030, do Instituto Brasileiro de Geografia e Estatística (IBGE). De acordo com o IBGE a população brasileira continuará crescendo até o ano 2042, quando deverá chegar a 228,4 milhões de pessoas, a maioria concentrada em centros urbanos. A partir daí, haverá diminuição gradual e estará em torno de 218,2 milhões em 2060.40
A Tabela 2 apresenta a projeção relativa às estimativas do número de pessoas infectadas por T. cruzi e do número de casos com doença de Chagas na fase crônica com a forma cardíaca e com a forma digestiva no Brasil, no período de 2015 a 2055, segundo quinquênios.Em 2015, por exemplo, tomando-se como base a estimativa de população de 204.450.649, estimava-se que entre 1.426.994 e 3.357.633 brasileiros estivessem infectados por T. cruzi, de 142.699 a 335.763 potencialmente com a forma digestiva, e de 428.098 a 1.007.290 com a forma cardíaca. A população estimada com infecção por T. cruzi na forma indeterminada variava de 856.197 a 2.014.580 pessoas.
Tabela 2 - Projeções das estimativas de prevalência de infecção por T. cruzi e da doença de Chagas na fase crônica com a forma cardíaca e com a forma digestiva no Brasil, no período de 2000 a 2055
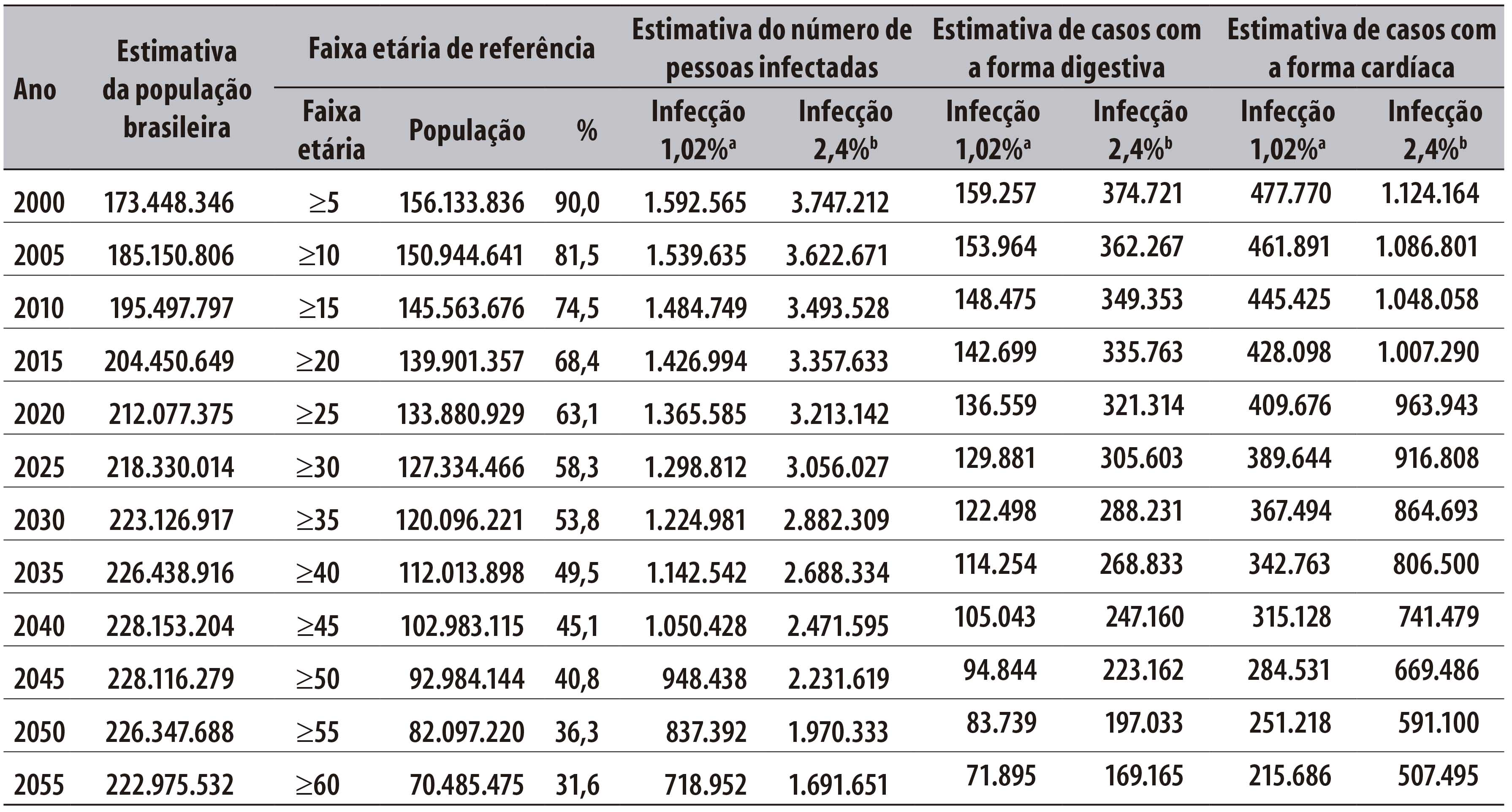
Fonte: IBGE - Estimativas populacionais globais e por faixa etária. Coordenação de População e Indicadores Sociais. Gerência de Estudos e Análises da Dinâmica Demográfica.40
a) Parâmetros para estimativas (mínima e máxima) da prevalência de infecção por T. cruzi -PAHO, 2006;17 Martins-Melo e colaboradores, 2014.35
b) Parâmetros para estimativas máximas da prevalência de doença de Chagas na fase crônica com a forma cardíaca (x 30%) e com a forma digestiva (x 10%).
Além dos processos internos de migração no Brasil, com urbanização da doença de Chagas, sua ocorrência em migrantes oriundos de áreas endêmicas em países tradicionalmente não endêmicos tem trazido uma discussão ampliada sobre contextos de riscos e vulnerabilidade, com desafio para o desenvolvimento de ações de controle para estes países.3,6,7,10-13,16,18,36,37,41,42 Múltiplos fatores bioecológicos, socioculturais e políticos têm sido implicados neste processo,10 demandando a ampliação do número de pesquisas da área de ciências sociais e humanas relativas à doença.43
Em 2005, estimou-se um total de 501.036 brasileiros nos Estados Unidos, com uma prevalência de infecção por T. cruzi de 1,02%,17 ou 5.106 casos.44 De uma forma mais ampla, estima-se que um total que varia de 300 mil a pouco mais 1,0 milhão de pessoas estejam infectadas por T. cruzi naquele país,8,9 com diferentes impactos para o sistema de saúde. Lembremos que se trata de área não endêmica.9,45
Estima-se que aproximadamente 72 mil pessoas infectadas por T. cruzi estejam vivendo na Europa.12 A partir da análise de dados agregados de revisão sistemática e metanálise investigando a prevalência de doença de Chagas em pessoas latino-americanas vivendo na Europa (Espanha, França, Suíça, Itália e Alemanha), estimou-se a prevalência desta infecção em brasileiros em 0,6% (0,16-1,12%) ou 4/954.13 Os migrantes oriundos da Bolívia apresentaram a maior prevalência da doença de Chagas (18,1%), seguidos pelos migrantes do Paraguai (5,5%). A prevalência entre migrantes da Argentina foi de 2,2%; não houve casos de doença de Chagas detectados entre migrantes do Uruguai, Venezuela, Panamá, Guatemala e México.13
Reconhece-se a ocorrência de outras ondas de migração internacional importantes dentro da América Latina, como, por exemplo, da Bolívia e do Paraguai para Argentina e Brasil, ou da Colômbia para a Venezuela.10 Por outro lado, notadamente a partir da segunda metade do século XX, ressalta-se a intensificação do movimento de milhares de cidadãos da América Latina para países na América do Norte (principalmente os Estados Unidos, mas também o Canadá), Europa (em especial Espanha, além de outras nações), Ásia (Japão) e Oceania (Austrália), ampliando o número de pessoas com doença de Chagas vivendo em países não endêmicos.2,7,10,12,42 Em geral este processo migratório associa-se à busca de melhores condições de vida por pessoas em grave situação de vulnerabilidade social, oriundas de países endêmicos.10
Além da presença de brasileiros potencialmente infectados por T. cruzi no exterior, o país tem recebido consideráveis fluxos migratórios de outros países endêmicos, como a Bolívia, de onde são estimados de 80 mil a 200 mil migrantes aproximadamente no Estado de São Paulo.46 Este fato tem suscitado a discussão, no país, sobre políticas públicas de saúde consistentes para maior atenção a esta população de migrantes, com vistas inclusive ao enfretamento das precárias condições de vida e trabalho às quais são submetidos.46,47
Além do contexto de migração, há um claro deslocamento da prevalência de infecção por T. cruzi para faixas etárias mais avançadas no país, o que traz novos desafios para o SUS. Com o predomínio de casos de doença de Chagas na fase crônica decorrentes, em grande parte, de infecção por via vetorial no passado, ampliou-se a probabilidade de ocorrência de comorbidades, infecciosas ou não, a maioria de caráter crônico-degenerativo, em especial, diabetes mellitus, hipertensão arterial sistêmica e outras cardiopatias. Entre estas condições, insere-se e emerge a coinfecção HIV com T. cruzi, ou a associação com outras condições imunossupressoras, adquiridas ou induzidas.2,48-51 A maior sobrevida, aliada aos processos migratórios e de urbanização nas últimas cinco décadas, entre outros fatores, amplificaram este risco.49
Como em outras doenças infecciosas, T. cruzi pode se comportar como micro-organismo oportunista em indivíduos com imunossupressão.2,49-52 Apesar de o primeiro caso de coinfecção T. cruzi e HIV ter sido relatado ainda na década de 1980, a frequência com que esta associação ocorre, assim como aquela específica da reativação, qual o perfil clínico e laboratorial da pessoa com a coinfecção, os tratamentos específicos para a infecção por T. cruzi e HIV mais adequados, o dimensionamento da sobrevida e de óbitos nestes indivíduos persistem como lacunas em nível global.49,52,53
No Brasil, estimou-se a prevalência da coinfecção em 1,3%.48,49,52 Considerando-se haver aproximadamente 734 mil pessoas vivendo com HIV (sem aids) no Brasil no ano de 2014, correspondendo a uma prevalência na população geral de 0,4%,51 haveria um total estimado de 9.542 casos de coinfecção T. cruzi/HIV. Por outro lado, desde o início da epidemia de aids no Brasil até junho de 2014, foram registrados no Sistema Nacional de Agravos de Notificação (Sinan) um total de 757.042 casos de aids,50 a partir dos quais, seriam estimados mais 9.842 casos de coinfecção. Estima-se, portanto, um total de 19.384 casos com coinfecção T. cruzi/HIV-aids no Brasil com base nos dados até junho de 2014, salientando-se que muitos destes casos provavelmente morreram ou estão sem diagnóstico, sem reconhecimento, portanto, do quadro de coinfecção.
No Brasil, recomenda-se para todo caso com infecção por HIV ou aids a solicitação de teste anti-T. cruzi, tendo em vista potenciais contextos epidemiológicos de risco.51 Ressalta-se ainda que, para fins de vigilância epidemiológica, desde 2004, a reativação da doença de Chagas foi inserida na lista de doenças indicativas de aids, na vigência de infecção por HIV, e tem sido um marcador importante, a partir do diagnóstico definitivo de meningoencefalite e miocardite chagásica.39,49,52,54 De modo geral, como a coinfecção por HIV geralmente acontece em indivíduos previamente infectados por T. cruzi, por transmissão sexual, a tendência esperada no Brasil é de um progressivo decréscimo dos casos da coinfecção, desde que a doença de Chagas está cada vez mais se restringindo aos grupos etários mais elevados.
Para além do quadro de coinfecção, de uma forma geral, a despeito da elevada carga de morbimortalidade da doença de Chagas no Brasil, os dados relativos à vigilância epidemiológica específica de casos humanos dessa doença não permitem estimar sua magnitude, uma vez que apenas casos na fase aguda são notificados compulsoriamente por meio do Sinan. Ademais, estima-se que somente 10-20% dos casos de doença de Chagas aguda sejam de fato notificados.
No período de 2000 a 2013 (dados atualizados em maio/2014) foram notificados 1.570 casos de doença de Chagas aguda (média de 112 casos por ano), oriundos de registros da maioria dos estados brasileiros, com a exceção do Mato Grosso do Sul e Distrito Federal na região Centro-Oeste e do Paraná, na região Sul. A maioria destes casos (1.430, 91,1%) concentrava-se na região Norte, seguida pelas regiões Nordeste (73, 4,7%), Sul (28, 0,2%), Centro-Oeste (27, 1,8%) e Sudeste (12, 0,8%). Ressalta-se que o Estado do Pará foi responsável por 75% de todos os casos no país e por 82% dos casos da região Norte.55
Em relação ao município de residência, 163 registraram casos de doença de Chagas aguda, dos quais, 97 (60%) pertencem à região Norte, 37 (23%) à região Nordeste, 14 (9%) à região Centro-Oeste e, em menores proporções, 9 (6%) e 6 (4%) aos municípios das regiões Sudeste e Sul, respectivamente.55 Este padrão de notificação é bastante distinto daquele verificado nos anos 1990,4,18,19 mas ainda demarcando contextos operacionais de “silêncio epidemiológico” em algumas áreas.
Mortalidade
A carga da mortalidade relacionada à doença de Chagas no Brasil persiste em níveis elevados, a despeito das ações de controle empreendidas.3,29,35,56,57
Estudo conduzido com o objetivo de quantificar o padrão de mortalidade por doença de Chagas no período de 1981 a 1998 identificou que, dos 68.936 óbitos em brasileiros com naturalidade conhecida, 32.369 (32%) ocorreram em pessoas naturais de outras Unidades da Federação que não a de residência do falecido, variando de 0,3% no Rio Grande do Sul a 100% em Roraima e Amapá. A maioria (67%) desses óbitos em migrantes ocorreu em pessoas naturais de Minas Gerais (51%) e Bahia (16%). Os coeficientes de mortalidade no período em residentes mostraram declínio sustentado nas regiões Sudeste, Sul e Centro-Oeste, mas não nas regiões Nordeste e Norte, onde as medianas de idade quando da morte foram comparativamente mais baixas.58
Posteriormente, de 1999 a 2007, a doença de Chagas foi identificada em 53.924 (0,6%) das declarações de óbito do período (aproximadamente 9,0 milhões): 44.537 (82,6%) como causa básica e 9.387 (17,4%) como causa associada.59 A doença de Chagas aguda esteve registrada na declaração em 2,8% dos óbitos. A média de óbitos por ano foi de 5.992, com um coeficiente médio de mortalidade padronizado de 3,36/100 mil habitantes/ano, verificando-se uma redução gradual do coeficiente de mortalidade específico no país de 226,4%. Ressaltou-se a tendência decrescente do coeficiente de mortalidade padronizado (237,9%), em especial na região Centro-Oeste. A mortalidade proporcional (por causas múltiplas) foi de 0,60%, maior na região Centro-Oeste (2,17%), onde se verificou redução de 219,5%, com expressiva tendência decrescente. Entretanto, neste estudo, verificou-se considerável aumento de 38,5% na região Nordeste, com tendência crescente. Como fatores de risco identificados na análise bivariada inserem-se grupos etários mais idosos e residir na região Centro-Oeste. Já na análise multivariada, idade superior a 30 anos e residência nos estados de Minas Gerais e Goiás, bem como no Distrito Federal.59 Saliente-se que o país foi responsável por mais de 40% do total de mortes esperadas associadas à doença de Chagas na América Latina.56,59
Outro estudo com a mesma base populacional do trabalho anterior, no Brasil, analisou 53.930 óbitos registrados entre 1999 e 2007, em que a doença de Chagas foi mencionada como uma das causas de morte; quando analisada como causa básica, esta doença foi a quarta principal causa de morte (10,8%) entre todas as doenças infecciosas e parasitárias.56 Daquele total, 37.800 (84,9%) foram óbitos relativos a formas cardíacas e 4.208 (9,4%) a formas digestivas. Em 1.097 (2,5%) óbitos houve menção a envolvimento cardíaco agudo; em 1.157 (2,6%), envolvimento de outros órgãos; e, por fim, em 281 (0,6%), de outras apresentações clínicas da doença (envolvimento do sistema nervoso central e fase aguda sem envolvimento cardíaco). Em relação às causas associadas de morte tendo a doença de Chagas como causa básica, houve predominância de doenças dos sistemas digestório, circulatório e respiratório. Complicações diretas da doença cardíaca, em especial distúrbios de condução/arritmias e insuficiência cardíaca, foram definidas em mais de 35% dos óbitos, seguidas por choque (15%). Entre as causas básicas de morte em que a doença de Chagas foi mencionada como causa associada, as mais comuns foram as doenças dos sistemas circulatório e respiratório, com 59% das mortes, seguidas por neoplasias e doenças do sistema digestório, com 11,6% e 10,6% das mortes, respectivamente. Ressalta-se que as doenças cerebrovasculares, as doenças isquêmicas do coração e as doenças hipertensivas foram as principais causas básicas de morte quando a doença de Chagas foi identificada como causa associada. Doenças pulmonares crônicas e doença pulmonar obstrutiva crônica particularmente também representaram importantes causas de morte.56
Estudo adicional a partir desta mesma base de dados, com utilização de diferentes abordagens analíticas espaciais, identificou-se um cluster (aglomerado) de alto risco de mortalidade por doença de Chagas, envolvendo nove estados da região Central do Brasil - a quase totalidade dos municípios dos estados de Goiás e de Minas Gerais, o Distrito Federal e alguns municípios dos estados de São Paulo, Mato Grosso, Mato Grosso do Sul, Tocantins, Piauí e Bahia. Esta área foi indicada pelos autores como prioritária para planejamento integrado das ações de fortalecimento da rede de atenção voltada para a doença de Chagas.60
Estudo que analisou padrões e tendências regionais no Brasil, em série temporal mais extensa (1979-2009), verificou que, dos 27.560.043 óbitos analisados, 172.066 mortes tiveram a doença de Chagas como causa básica.57 A mortalidade proporcional da doença de Chagas foi de 0,62%, com um coeficiente de mortalidade específico bruto de 3,61 óbitos/100 mil hab./ano e um coeficiente de mortalidade específico ajustado para idade de 5,19 óbitos/100 mil hab./ano. Para o país, houve apreciável redução no período, mas com importantes diferenças inter-regionais. Houve grande redução nas regiões Sudeste, Sul e Centro-Oeste, mas relevante crescimento nas regiões Nordeste e Norte.57
Outra série histórica, no período de 1980 a 2008, verificou que a proporção de mortes atribuíveis à doença de Chagas como causa básica permaneceu estável no período.29
No Estado de São Paulo, no período de 1985 a 2006, foram identificados 40.002 óbitos relacionados à doença de Chagas, dos quais 34.917 (87,3%) como causa básica e 5.085 (12,7%) como causa associada. O coeficiente de mortalidade segundo a causa básica teve um declínio de 56,1%, mas verificou-se estabilidade segundo a causa associada. O número de óbitos foi 44,5% maior entre os homens em comparação com as mulheres, e 83,5% dos óbitos ocorreram em pessoas com mais de 45 anos de idade. Verificou-se que as principais causas associadas que tiveram a doença de Chagas como causa básica de morte foram: complicações diretas do comprometimento cardíaco (transtornos da condução, arritmias e insuficiência cardíaca). Para a doença de Chagas como causa associada, as causas básicas mais importantes foram as doenças isquêmicas do coração, as doenças cerebrovasculares e as neoplasias.61
Por outro lado, a partir de base de dados nacional sobre mortalidade relativa à doença de Chagas como causa básica, no período de 2000 a 2010, verificou-se que a maioria das mortes (85,9%) ocorreu em pessoas do sexo masculino com idade superior a 60 anos. Estas mortes foram causadas principalmente por envolvimento cardíaco, sendo que o coeficiente de mortalidade desta forma clínica da doença diminuiu em todas as regiões, exceto na região Norte, onde houve um aumento de 1,6%. A região Nordeste teve a menor redução, enquanto a Centro-Oeste, a maior. Ressalta-se que o coeficiente de mortalidade relacionado à forma digestiva aumentou em todas as regiões.62
Verificou-se que o padrão de envelhecimento da população atingida pela doença de Chagas e de ampliação das idades em faixas etárias mais elevadas tem sido verificado não apenas pelos estudos anteriores de mortalidade, mas também por outros estudos de base populacional baseados em coortes de casos em seguimento por longos períodos de tempo.63,64
Dados do Ministério da Saúde relativos a óbitos por doença de Chagas aguda indicam que, no período de 2005 a 2013, o coeficiente de letalidade médio anual do país ao longo dos 14 anos foi de 2,7% (37,9/14). A elevada letalidade (20,0%) no ano de 2005 coincidiu com o surto de Chagas aguda por transmissão oral em Santa Catarina, momento em que pouco se conhecia sobre a etiologia e manejo da doença por essa forma de transmissão. Em 2006, a letalidade continuou elevada (5,9%), com posterior redução, que se manteve relativamente constante nos anos subsequentes (média de 1,7% de 2007 a 2013), variando de 0,5% em 2009 a 4,7% em 2011. Ressalta-se que a falta de oportunidade de suspeição da doença e a demora no diagnóstico podem agravar o quadro clínico e a evolução da enfermidade, podendo interferir no prognóstico dos casos, a exemplo de óbitos que ocorreram por falta de uma intervenção mais oportuna,55, em especial para as formas cardiovasculares.
Em termos da mortalidade associada à coinfecção T. cruzi/HIV, estudo de aproximadamente 9 milhões de óbitos, no período de 1999 a 2007, identificou 74 óbitos relacionados à coinfecção T. cruzi/HIV - 57 (77,0%) cuja causa básica foi a aids, e 13 óbitos (17,6%) que tiveram como causa básica a doença de Chagas.53 Houve associação com sexo masculino (51,4%), cor da pele branca (50%), idades entre 40 e 49 anos (29,7%), e residência na região Sudeste (75,7%). A média de idade no momento do óbito foi consideravelmente menor entre coinfectados (47,1 anos) do que entre aqueles sem coinfecção (64,1 anos).53 Esses dados provavelmente indicam subdimensionamento do impacto dessa coinfecção na mortalidade.
Perfil epidemiológico segundo modos de transmissão
Para anos mais recentes (Sinan, 2000 a 2013), com a limitação operacional já indicada previamente, verificou-se que a forma de transmissão oral foi a mais frequente em todos os anos (1.081, 68,9%), seguida pela transmissão vetorial em 100 casos (6,4%).55 Apesar da ocorrência em menor proporção, provavelmente devido à menor visibilidade destes casos, observa-se a persistência desta última forma desde 2006, ano em que o Brasil obteve a certificação de interrupção de transmissão por T. infestans. De forma comparativa, estimativas da OMS com base em dados de 2010 indicavam um total de 46 casos de doença de Chagas por ano no Brasil originários de transmissão vetorial.5 Estes dados em conjunto reforçam a provável subestimativa dos casos relativos a esta forma de transmissão, tanto nacional quanto internacionalmente. Em 372 (23,7%) casos notificados não foi identificada a forma de transmissão, sendo 93,0% (306 casos) destes somente do Estado do Pará. Foram notificados ainda 11 (0,7%) casos por outras formas de transmissão (transfusional ou acidental), e 6 (0,4%) casos por transmissão vertical.55 Neste último modo de transmissão, a subnotificação também é clara.
Esta mudança nos padrões epidemiológicos de transmissão da doença de Chagas no país também tem sido gerada como resultado das ações de controle empreendidas há quatro décadas, acompanhadas por importantes mudanças ambientais, demográficas, econômicas e sociais, além da maior concentração da população em áreas urbanas.4,15,33,65 Dessa forma, mecanismos relacionados diretamente ao ciclo enzoótico da infecção, como a transmissão vetorial extradomiciliar ou por visitação de vetores silvestres aos domicílios, além da transmissão oral (mediada também por vetores, na maioria dos casos), passaram a ter relevância como modos principais de transmissão de T. cruzi às populações humanas.22,27,65
Transmissão vetorial
Durante os anos de 1950 e 1951 foi desenvolvida a primeira Campanha de Profilaxia da Doença de Chagas no Brasil, conduzida pelo então Serviço Nacional de Malária, alcançando com ações de controle vetorial químico 74 municípios na divisa dos estados de Minas Gerais e São Paulo. Até o ano de 1975, as atividades de controle foram conduzidas de forma intermitente, com maior ou menor alcance territorial. A área com risco de transmissão vetorial para doença de Chagas no Brasil conhecida no final dos anos 1970 incluía 18 estados, com mais de 2.200 municípios, nos quais se comprovou a presença de triatomíneos domiciliados. Ressalta-se que a Região Amazônica estava excluída desta área de risco.4,19,20,22,66
Desde então, com a intensificação das ações de controle, a transmissão vetorial de T. cruzi no Brasil tem apresentado redução vultosa e sistemática. Alcançou-se tal resultado a partir do desenvolvimento de ações sistematizadas de controle químico de populações domiciliadas do vetor, instituídas a partir de 1975, com alcance da cobertura da área endêmica no ano de 1983.20,22,66 Essas ações foram sustentadas em caráter regular desde então, ainda que o seu alcance nas últimas duas décadas tenha sido progressivamente menor em virtude de mudanças de priorização técnico-política, bem como devido ao reordenamento político-institucional no país.20,22
Este processo, de forma integrada, culminou com a Certificação da Interrupção da Transmissão da Doença de Chagas pelo principal vetor domiciliado, Triatoma infestans, concedida em 2006 pela OPAS/OMS, dentro da Iniciativa dos Países do Cone Sul.18,22,39
O controle da transmissão vetorial teve impacto considerável em relação às transmissões transfusional e congênita.4,18,29,10,23 A despeito dos avanços, o risco de transmissão vetorial da doença de Chagas persiste e tem sido avaliado sob diferentes perspectivas,22em função: da existência de espécies de triatomíneos autóctones com elevado potencial de colonização; da presença de reservatórios de T. cruzi e da aproximação cada vez mais frequente das populações humanas a esses ambientes; e da persistência de focos residuais de T. infestans, ainda existentes em alguns municípios dos estados da Bahia e do Rio Grande do Sul.22,23,39,67 Os impactos, já ao longo do processo de certificação obtida pelo Brasil no ano de 2006, em relação a T. infestans, geraram preocupação quanto à desmobilização da sociedade em geral frente ao modo impreciso como a informação foi apropriada e divulgada para a sociedade.68
Ademais, outros estudos e análises têm buscado aprofundar a avaliação sobre processos operacionais envolvidos dentro das diferentes estratégias de controle/eliminação da transmissão por vetores autóctones, incluindo o modelo de certificação e potenciais alternativas.69-72
Dados do Ministério da Saúde relativos à vigilância entomológica (passiva ou ativa) específica do período de 2007 a 2011 (Boletim Epidemiológico de Doença de Chagas 2015) indicam o registro da captura de mais de 770 mil triatomíneos nos contextos locais de domicílios e peridomicílios no país. Da mesma forma que para os casos humanos, considerando-se a baixa cobertura das ações de vigilância entomológica, este registro provavelmente engloba menos de 10% dos triatomíneos dentro ou ao redor das residências. Ainda segundo estes dados do Ministério da Saúde, entre as 62 espécies distribuídas nos espaços do intradomicílio e peridomicílio no Brasil, destacam-se como espécies de relevância epidemiológica: Panstrongylus geniculatus, Panstrongylus lutzi, Panstrongylus megistus, Rhodnius nasutus, Rhodnius neglectus, Rhodnius robustus, Rhodnius pictipes, Triatoma infestans, Triatoma brasiliensis, Triatoma maculata, Triatoma pseudomaculata, Triatoma rubrovaria, Triatoma rubrofasciata, Triatoma sordida e Triatoma vitticeps.
Do total de triatomíneos capturados, segundo os dados do Boletim Epidemiológico do Ministério da Saúde sobre doença de Chagas, foram examinados quanto à identificação da infecção por T. cruzi 591.360 (76,8%) dos triatomíneos capturados, resultando em uma taxa de infecção natural total de 2,7% (15.967 triatomíneos). As espécies T. vitticeps (52,0%), R. robustus(33,3%) e P. lutzi (29,4%) foram as que apresentaram as maiores taxas de infecção natural. T. vitticeps se apresenta com maior frequência nos estados da região Sudeste (Minas Gerais e Espírito Santo), R. robustus tem sua área de maior registro segundo os dados do Ministério da Saúde na região Norte (Tocantins, Amazonas, Acre e Rondônia), e P. lutzi na região Nordeste (Piauí, Bahia, Sergipe, Alagoas, Paraíba, Rio Grande do Norte, Ceará e Pernambuco).55 Em 2012, a investigação de dois casos de doença de Chagas aguda registrados por transmissão vetorial evidenciou o envolvimento de espécies silvestres com elevadas taxas de infecção natural em municípios que eram considerados não endêmicos para doença de Chagas. Um dos casos ocorreu no município de Ibitirama (Espírito Santo), onde frequentemente exemplares de T. vitticeps adultos infectados são encontrados por moradores, e outro caso em Mangaratiba (Rio de Janeiro), envolvendo T. tibiamaculata encontrado infectado por T. cruzi. Esses episódios refletem uma realidade estendida para todo o país - a existência de ciclos de transmissão do parasito em ambientes silvestres próximos às habitações humanas -, o que favorece a transmissão.55
Para esse período de 2007 a 2011, identificou-se ainda a persistência de focos de T. infestans em quatro municípios do Estado da Bahia (Itaguaçu da Bahia, Ibipeba, Novo Horizonte e Tremedal) e em 12 municípios do Rio Grande do Sul (Ajuricaba, Alegria, Coronel Barros, Doutor Maurício Cardoso, Giruá, Humaitá, Ijuí, Independência, Porto Mauá, Salvador das Missões, Santo Cristo e São José do Inhacorá).55 Ações integradas de controle vetorial mobilizando governos Federal, Estaduais e Municipais têm avançado na direção do controle deste triatomíneo.
Atualmente o risco relacionado à transmissão de T. cruzi no Brasil depende principalmente: (i) da persistência de focos residuais de T. infestans, com achado episódico em alguns estados, como Bahia e Rio Grande do Sul; (ii) da existência de grande número de espécies comprovadamente autóctones ou potencialmente vetoras no país, mesmo que em alguns casos populações domiciliadas tenham sido bastante reduzidas; (iii) da emergência de “novas” espécies com risco de domiciliação (T. rubrovaria, P. lutzi); (iv) da existência de transmissão em caráter endêmico na Região Amazônica, com mecanismos ainda mal caracterizados de transmissão como vetorial domiciliar sem colonização, vetorial extradomiciliar e oral; e (v) da ocorrência de surtos ou microepidemias de transmissão oral de T. cruzi.20,33,65,67
A importante alteração no quadro epidemiológico da doença no país tem gerado a necessidade de revisão dinâmica das estratégias de controle adotadas.4,20,23,33,65,67 Nesta perspectiva, a identificação de áreas com maior vulnerabilidade para ocorrência de triatomíneos sinantrópicos tem sido uma ferramenta importante para reorientar ações de prevenção, controle e vigilância epidemiológica,39,67 inclusive pela necessidade de se otimizar o uso dos recursos disponíveis dos programas.20
Por outro lado, a estratificação do risco associado à transmissão vetorial tem sido proposta como estratégia importante para orientação e sustentação das ações de controle no país e tem sido incorporada, em diferentes perspectivas, pelos programas de controle de estados e municípios.4,20,22,39,65
Esta estratificação está baseada em três diferentes cenários ou espaços ecoepidemiológicos da transmissão vetorial de T. cruzi:22
uma área a princípio considerada endêmica, com transmissão vetorial domiciliar registrada, e que foi submetida por um extenso período de intensas operações de controle químico, o que resultou na quase completa eliminação do principal vetor existente no país (T. infestans), sendo o risco limitado atualmente à transmissão mais ou menos focal, principalmente por espécies nativas, abrangendo os estados de Alagoas, Bahia, Ceará, Goiás, Mato Grosso do Sul, Minas Gerais, Paraíba, Pernambuco, Paraná, Piauí, Rio Grande do Norte, Rio Grande do Sul, São Paulo e Sergipe, bem como o Distrito Federal;
a região que abrange os estados do Acre, Amazonas, Amapá, Rondônia, Roraima e Pará, antes considerada “indene” para a doença de Chagas humana, e que se sabe hoje com transmissão, por meio de mecanismos antes considerados extraordinários ou improváveis, ainda mal caracterizados mas capazes de manter transmissão endêmica de intensidade relativamente baixa para sustentar a transmissão endêmica (oral, extradomiciliar e domiciliar sem colonização vetorial);
uma área de transição entre os dois cenários anteriores, na qual coexistem ambos, que engloba os estados do Maranhão, Mato Grosso e Tocantins.
Como discutido previamente, os estados de Santa Catarina, Rio de Janeiro e Espírito Santo, apesar de não estarem enquadrados na proposta de estratificação anterior de risco, tendo em vista os padrões históricos observados a partir da vigilância entomológica de estados, têm registrado casos autóctones de doença de Chagas.39,55,73-77
A avaliação e o monitoramento sistemáticos deste processo devem incorporar a possibilidade de colonização na Amazônia e em outras frentes agropecuárias (criação de gado extensivo, plantação de soja, entre outros) em curso no país por vetores domiciliados e com importância epidemiológica nas áreas de emigração humana.22,65
A grande diversidade de situações de transmissão vetorial de T. cruzi inerentes aos cenários ou espaços ecoepidemiológicos acima englobam:22,65 (i) o risco remoto de seu restabelecimento por espécie alóctone, como T. infestans; (ii) a transmissão focalizada por espécies nativas sabidamente vetoras, como P. megistus, T. brasiliensis e, menos provavelmente, por T. pseudomaculata e T. sordida; (iii) a domiciliação de algumas espécies tidas classicamente como exclusivamente silvestres, e o risco de que passem a atuar como vetoras em algumas áreas, como é o caso de T. rubrovaria no Estado do Rio Grande do Sul e de P. lutzi em estados da região Nordeste; e (iv) a possibilidade de ocorrência de transmissão extradomiciliar ou por visitação (forma básica de geração de surtos por transmissão oral, pelo menos em áreas rurais) de triatomíneos às casas, como já observado com Rhodnius brethesi, na região do Alto Rio Negro, no Estado do Amazonas, e com R. pictipes no Estado do Tocantins.
Frente aos cenários de coexistência de áreas com diferentes graus de risco, as ações de vigilância e controle vetorial devem estar ajustadas tendo como base o risco estabelecido.22,65 Além de se considerar a capacidade operacional de municípios, a estratificação da extensa área tradicionalmente endêmica está baseada em um conjunto de variáveis que potencialmente influenciam o processo de infestação e/ou de reinfestação e, desta maneira, de transmissão ou de reinstalação da transmissão vetorial da doença de Chagas no ambiente domiciliar.22
A análise de impacto ambiental e do risco potencial de intensificação da transmissão de T. cruzi deve incluir necessariamente o estudo de reservatórios.15,39,78,79 Reconhece-se que o processo de simplificação de fauna é resultado da ocupação não planejada do ambiente e tem como consequências potenciais: (i) menor diversidade de oferta de fonte alimentar para triatomíneos nos diferentes habitat; (ii) maior tendência de deslocamento de triatomíneos em busca de alimento (hematofagia) de seus habitat originais, para se alimentar sobre espécies mais ecléticas de mamíferos que permaneceram e se expandiram numericamente; (iii) as populações do parasita também serão expandidas a partir destas espécies de mamíferos com este ecletismo ambiental, em geral excelentes reservatórios de T. cruzi.21,80 Como estes animais (como marsupiais e alguns roedores) têm um elevado grau de sinantropização, o risco epidemiológico torna-se claro.78,80
T. cruzi é um parasito flagelado multi-hospedeiro capaz de infectar dezenas de espécies de mamíferos silvestres e domésticos distribuídos em todas as regiões fitogeográficas do Brasil; é encontrado nos mais diversos nichos ecológicos, contribuindo, em cada tipo de ecótopo, para formar modalidades singulares de focos naturais de transmissão.21,23,27,39,78,80
A integração dos reservatórios no processo de vigilância de rotina deve ser considerada tendo em vista que animais domésticos não confinados também podem atuar como elo entre os circuitos de transmissão silvestre e domiciliar.80,81 Analogamente ao que acontece com os mamíferos silvestres, a importância dos animais domésticos (por exemplo, cães e gatos) como reservatórios de T. cruzi varia nos diferentes locais, e eles podem ser utilizados como população sentinela da transmissão de T. cruzi em uma determinada área.21,81 Em geral, estão sempre expostos e sua infecção normalmente precede a do homem.78 Portanto, a presença de animais domésticos infectados por T. cruzi em uma determinada área sinaliza que a transmissão está ocorrendo nas áreas onde esses animais circulam, o que reforça a necessidade de ampliar as ações de controle.21
O processo de investigação entomológica e de reservatórios deve estar associado a ações sustentadas de vigilância ambiental.39 Para tanto, a compreensão dos processos de seleção de habitat por triatomíneos é fundamental para a construção de evidências epidemiológicas, com vistas ao planejamento e ao desenvolvimento de sistemas locais de vigilância epidemiológica e controle, reforçando, portanto, o papel da vigilância.22,39,82 Entretanto, falhas operacionais evidenciadas na detecção de vetores podem gerar erros críticos de classificação e, portanto, impedir o alcance das ações, dificultando a composição de cenários e dinâmicas destes insetos em seus habitat.70,71,82
Partindo do princípio de que nenhuma técnica de amostragem é “perfeita”, alguns estudos têm inserido no Brasil a aplicação de métodos que incorporam explicitamente as falhas na detecção de focos de infestação na investigação da ecologia e na vigilância dos vetores da doença de Chagas em diferentes ambientes, incluindo a Amazônia e a região Nordeste.70,71,82 Esta abordagem tem possibilitado e possibilitará cada vez mais, no futuro, a melhora das estimativas de indicadores ecoepidemiológicos e poderá reforçar significativamente as estratégias de vigilância e controle integrados de vetores.70,71,83,84 As falhas foram verificadas em áreas com infestação triatomínica bem estabelecida, onde as buscas ativas por agentes treinados e motivados geralmente detectam aproximadamente de 40 a 60% dos focos de infestação intradomiciliares e extradomiciliares, enquanto os focos não detectados não são eliminados.70 Além disto, apartir da análise do processo de vigilância por meio da busca ativa conduzida por agentes de controle, estimou-se a sua sensibilidade em aproximadamente 20% para localidades com infestação de baixa intensidade (poucos focos, com poucos triatomíneos) e em aproximadamente 40% para localidades com infestação mais intensa.71
Adicionalmente a esta abordagem, a utilização integrada de técnicas de análise espacial para ampliar a capacidade analítica, com inserção das dimensões espaciais e temporais da transmissão da doença de Chagas, tem demonstrado grande potencialidade, em especial pelo expressivo desenvolvimento de equipamentos eletrônicos portáteis e softwares de processamento e análise de dados.70,85-87
Nas últimas duas décadas, foram publicados estudos com descrição de diferentes graus de resistência das populações de triatomíneos a inseticidas.88 Entretanto, desconhecem-se os reais fatores por trás da emergência destes fenótipos e o impacto que esta situação trará no desenvolvimento das estratégias padronizadas para controle de vetores.89,90 Este novo contexto demandará dos países endêmicos a composição de redes de cooperação entre laboratórios para a realização de análises de resistência em populações de triatomíneos de forma padronizada, integrando-se esta atividade no processo de vigilância epidemiológica dos países endêmicos.88
Transmissão oral
Com o controle da transmissão vetorial da doença de Chagas no Brasil por seu principal vetor, T. infestans, a transmissão oral de T. cruzi vem ampliando a sua relevância epidemiológica, em especial nos contextos da Região Amazônica.11,23,39,76,91,92
A transmissão por via oral é considerada como mecanismo primário, em especial no ciclo silvestre,93 e seguirá ocorrendo independentemente das ações de controle empreendidas.21,39 Apresenta caráter habitual no ciclo enzoótico primitivo deste parasita, por meio da ingestão - por mamíferos susceptíveis - de vetores e reservatórios infectados.21 No caso do homem, esta transmissão ocorre de maneira esporádica e circunstancial, por meio de alimentos contaminados com o parasita, principalmente a partir de triatomíneos ou de suas dejeções, com registros desde a década de 1960.93 Portanto, a análise deste contexto epidemiológico remete indiretamente aos vetores.
No Brasil, em relação ao contexto epidemiológico dos eventos de doença de Chagas aguda por transmissão oral, a maior parte dos casos foi relatada na Amazônia em surtos de contextos familiares ou multifamiliares.11,23,91,92 Na região Extra-amazônica poucos eventos foram bem investigados, em geral relacionados à cana-de-açúcar, o provável alimento veiculador na transmissão destes casos.76,93
Revisão recente sobre o tema identificou registros de surtos ou microepidemias no Brasil, nos Estados do Rio Grande do Sul, Pará, Paraíba, Santa Catarina, Bahia e Ceará. Outros países com registros incluíam Venezuela e Colômbia.76
O Ministério da Saúde do Brasil contabilizou 112 surtos no território nacional entre 2005 e 2013, envolvendo em sua totalidade 35 municípios da Região Amazônica. A fonte provável de infecção foi a ingestão de alimentos contaminados com T. cruzi, entre eles: açaí, bacaba, jaci (coquinho), caldo de cana e palmito de babaçu. A maioria dos surtos ocorreu nos estados do Pará, 75,9% (85 surtos) e Amapá, 12,5% (14 surtos) e, em menor proporção, nos estados do Amazonas, 4,5% (5 surtos), Tocantins, 1,8% (2 surtos) e Bahia, 1,8% (2 surtos).55
O processo de vigilância da doença de Chagas aguda por transmissão oral passou a ser potencializado principalmente, com aumento da sensibilidade do sistema de vigilância, a partir do primeiro surto oficialmente investigado de doença de Chagas aguda no Brasil por transmissão oral, ocorrido em Santa Catarina em 2005, provavelmente vinculado à ingestão de caldo de cana contaminado com T. cruzi.55 Entre os casos de transmissão oral de 2007 a 2013, ressalta-se que mais de 50% apresentaram início de sintomas entre os meses de agosto e novembro, período que coincide com os meses de safra do açaí no Pará.55
As evidências experimentais disponíveis sugerem que a transmissão oral pode ocorrer a partir de formas tripomastigotas, epimastigotas de T. cruzi e, provavelmente, de amastigotas e massas celulares, originárias de mamíferos ou vetores contaminados, assim como, acidentalmente, por meio de cultivos artificiais do parasita.21,23,94 A depender do domínio de grande grupo ou linhagem de T. cruzi transmitida, bem como do inóculo em questão, verifica-se diversidade de patogenicidade, histiotropismo e morbimortalidade.21
Em relação ao mecanismo de transmissão oral de T. cruzi, foram identificadas como situações possíveis para exposição:21,39,93,94
ingestão das fezes ou urina de triatomíneos ou ainda de triatomíneos infectados, na hipótese de que sejam processados ou beneficiados junto com alimentos, como verificado em episódios investigados em que se atribuiu a infecção ao consumo de açaí, fruto típico da Região Amazônica brasileira;92
ingestão de alimentos ou bebidas contaminados com formas tripomastigotas metacíclicas presentes na secreção da glândula anal ou na urina de marsupiais do gênero Didelphis infectados;
ingestão de suspensão de T. cruzi em pipetas em contextos de laboratórios de pesquisa ou diagnósticos;
ingestão de leite materno de mãe com diagnóstico de doença de Chagas aguda ou de coinfecção T. cruzi-HIV em fase avançada da aids ou com reativação documentada da doença de Chagas, ou em situações de sangramento por fissuras.
E como situações em especulação de possibilidade para exposição:21,39,93,94
ingestão de carne crua ou mal cozida ou ainda de sangue de mamíferos infectados, especialmente silvestres;
consumo de sangue de animais infectados, que teria uma função terapêutica, segundo alguns grupos indígenas na Amazônia. Este fato foi reportado na Colômbia, onde se observa, em algumas regiões, a ingestão de sangue de tatus e gambás;
contaminação de utensílios utilizados na manipulação de carcaças de mamíferos infectados;
ingestão de triatomíneos por hábitos primitivos ou exóticos.
Ressalta-se que as fezes de triatomíneos infectados podem permanecer durante algumas horas com potencial infectante em ambientes com elevada umidade. Desta forma, podem contaminar potencialmente tanto alimentos como patas e aparelho bucal de carreadores secundários, como moscas e baratas. Em alimentos como leite ou caldo de cana, à temperatura ambiente, o parasita manteve-se viável por 24 horas ou mais em estudos experimentais. Apesar de o suco gástrico ter a capacidade de destruir parte considerável dos parasitas, parte é capaz de evadir-se desta ação, mediante mecanismos químicos de proteção externa, o que possibilita sua penetração através da mucosa intestinal.21,92
A transmissão oral geralmente está associada a surtos, mas também pode ocorrer em casos isolados.21,39 De fato, podem-se identificar dois perfis principais de surtos, de acordo com o local de ocorrência: urbanos e rurais. No caso dos surtos urbanos, decorre do consumo de açaí semi-industrializado e comercializado, refletindo uma questão de vigilância sanitária, associada à segurança alimentar e a boas práticas de manipulação de alimentos, com alcance mais amplo. Já nos surtos rurais, verifica-se a participação de vários tipos de alimentos elaborados artesanalmente, com acometimento local, em geral familiar ou de pessoas da rede social/comunitária de uma determinada família.
Dentro do processo de investigação, recomenda-se: realizar um recordatório alimentar para identificar a possibilidade de ingestão de alimentos suspeitos, identificar procedência, local de preparação e de consumo do alimento suspeito e listar todas as pessoas que possam ter ingerido o alimento suspeito.21,39,92 O foco das ações de vigilância e controle deve incluir, portanto, a cadeia produtiva, com base nas boas práticas de manipulação dos alimentos.21,39
Transmissão por transfusão de sangue e transplante de tecidos/órgãos
A transmissão de T. cruzi em transfusões de sangue teve amplificação pelo processo de urbanização da doença de Chagas no Brasil e em outros países endêmicos na América Latina.3,4,10,95,96 O risco de transmissão via transfusional está na dependência de diferentes fatores: (i) presença do parasita no sangue ou componente transfundido; (ii) tipo e número de produto sanguíneo infectado transfundido; (iii) estado imunológico do receptor; (iv) qualidade na triagem clínico-epidemiológica; (v) nível de cobertura da triagem sorológica dos doadores; e (vi) sensibilidade dos testes sorológicos empregados no processo de triagem dos candidatos à doação.4,23,95,96
Dado que a maioria dos candidatos à doação de sangue encontra-se, geralmente, concentrada na faixa etária de 18 a 35 anos - o menor número de candidatos potencialmente infectados com T. cruzi -, e que se estabeleceu, nos últimos anos, a obrigatoriedade da triagem clínico-epidemiológica e sorológica na maioria dos países endêmicos, registrou-se uma grande redução do risco da transmissão transfusional da doença de Chagas em toda a América Latina.4,23,95,96 No Brasil, ainda nos anos 1950, a prevalência média estimada de sorologia reagente para T. cruzi entre candidatos à doação de sangue era de 8,3%, nos anos 1960 e 1970 reduziu-se para 6,9% e, no final dos anos 1980 e início de 1990, alcançou 3,2%.96 A prevalência estimada de doença de Chagas por transfusão de sangue em candidatos à doação de sangue da hemorrede pública das diferentes regiões geográficas do país, a partir de um relatório do Ministério da Saúde de janeiro a junho de 1994, foi estimada em 0,75%.95 Em 2006, para o Brasil esta estimativa ficou em 0,21%, uma redução de mais de 95% em relação aos dados prévios.17 Dados mais recentes da OMS, com base no ano de 2010, estimaram em 0,18% esta prevalência no país.5
O Brasil tem avançado não apenas na busca da segurança transfusional, mas também no processo de hemovigilância, com a instituição de um sistema nacional integrando hemocentros, vigilância epidemiológica e vigilância sanitária.97,98 Com isto, qualifica-se a investigação dos raros, mas possíveis casos de doença de Chagas transmitidos pelo sangue, associados ao risco residual transfusional e de eventuais falhas dentro do processo. Da mesma forma, para situações associadas à triagem de candidatos à doação de tecidos ou órgãos. Para tanto, deflagra-se inspeção sanitária em serviços de hemoterapia e de transplante (hospitais ou hemocentros), comunicação e ação integrada com a hemovigilância,97,98 lembrando que a transmissão transfusional somente poderá ser definida caso a pessoa tenha recebido sangue ou algum outro hemocomponente dentro de 120 dias antes do início dos sintomas.97
Esta tendência de redução do risco de transmissão a partir de transfusões de sangue tem diminuído também em outros países endêmicos, em maior ou menor grau. Para os países não endêmicos, na última década, várias estratégias têm sido adotadas para prevenção e controle da transmissão transfusional da doença de Chagas. Nações como Estados Unidos, Canadá, Espanha, França, Reino Unido, Suíça e Austrália, por exemplo, já introduziram estratégias de triagem sorológica (universal ou seletiva) no processo de triagem de candidatos à doação de sangue.99
No caso de transplante de órgãos, devem ser considerados os padrões de endemicidade das áreas de origem e residência, tanto de doadores quanto de receptores, no sentido de se delinear a melhor conduta possível para cada caso em termos da triagem e do manejo de eventual infecção por T. cruzi.100
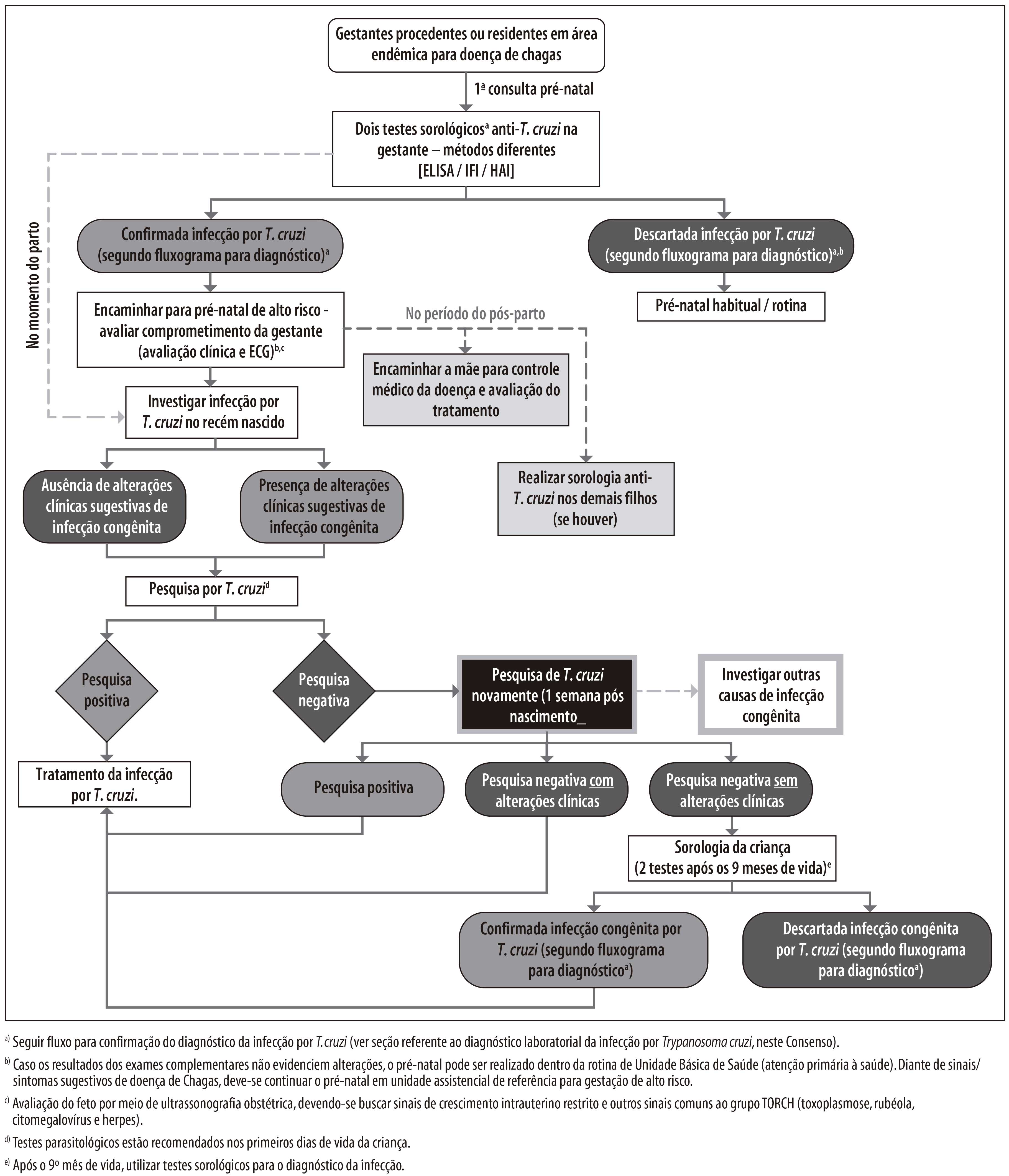
Transmissão Vertical (Congênita)
A transmissão vertical da doença de Chagas apresenta ainda relativa importância no Brasil, a despeito da ausência de ações sistemáticas de prevenção desta modalidade no país. Para avaliar o seu impacto e também as ações do controle vetorial, no período de 2001 a 2008 foi conduzido novo inquérito sorológico nacional, agora tendo como população de referência envolvendo 105 mil crianças de 0 a 5 anos.101 A prevalência estimada foi de 0,03% (32 casos) crianças infectadas por T. cruzi. Deste total, 20 (0,02%) apresentavam positividade materna concomitante, sugerindo a transmissão congênita (oriundas dos estados do Rio Grande do Sul [12], Minas Gerais [3], Paraná [1], Pernambuco [1], Alagoas [1], Bahia [1] e Acre [1]), e 11 (0,01%) registraram positividade apenas na criança, indicando provável transmissão vetorial (oriundas dos estados de Piauí [2], Ceará [2], Rio Grande do Norte [1], Paraíba [2] e Alagoas [2], Amazonas [1] e Paraná [1]). Este estudo representa o primeiro a identificar diferenças regionais na transmissão congênita da doença de Chagas no Brasil, possivelmente relacionada à existência de T. cruzi TcV e TcVI.101 Ademais, aponta para a inexistência de transmissão de doença de Chagas por via vetorial domiciliar sustentada no país.39,101
Os dados oficiais do Ministério da Saúde relativos à vigilância epidemiológica por meio da notificação de casos de doença de Chagas aguda indicam consistência com os achados do inquérito acima: 50% das notificações desta forma de transmissão foram identificados no Estado do Rio Grande do Sul.55
A estimativa global da prevalência da infecção por T. cruzi em gestantes tem variado de 1 a 40%,102-104 sendo que aproximadamente 1,8 milhão de mulheres em idade fértil estavam infectadas na América Latina.17 Dados mais atuais da OMS estimam este número em 1.124.930 mulheres entre 15 e 44 anos com infecção por T. cruzi.5 Metanálise recente estimou o risco global de infecção congênita por T. cruzi em crianças nascidas de mães infectadas como sendo de 5%, variando de 0 a 28,6%.105 Na América Latina foram estimados mais de 15 mil casos de doença de Chagas congênita por ano,17 com análises mais recentes indicando estimativa de 8.668 crianças infectadas por transmissão vertical.5
Por outro lado, em áreas não endêmicas, é ainda mais limitada a disponibilidade de evidências sobre estimativas de incidência.5,17,104 Na América do Norte, por exemplo, a estimativa é de 2 mil casos de doença de Chagas congênita por ano.45
Revisão sistemática com metanálise de estudos conduzidos no Brasil estimou a prevalência de infecção em gestantes como sendo de 1,1%, com taxa de transmissão vertical de 1,7%.106 Considerando-se que no Brasil, segundo dados do Sistema de Informações sobre Nascidos Vivos (Sinasc), foram registrados 2.861.868 nascidos vivos em 2010, estimou-se a partir destes dados que haveria neste ano 34.629 gestantes infectadas por T. cruzi e que o número de crianças com infecção congênita variava de 312 a 1.073 (média: 589 casos).106 Estes dados foram consistentes com o inquérito epidemiológico realizado no estado de Minas Gerais em 1998, extrapolado para a população brasileira,107 bem como com a estimativa global da OMS de 571 crianças brasileiras infectadas por transmissão vertical em 2010.5 As estimativas da OPAS para o país, em 2006, indicavam 5 mil crianças brasileiras infectadas.17 Considerando a redução progressiva da taxa de fecundidade no Brasil, estima-se que, ao longo das próximas décadas, a transmissão vertical apresente tendência de redução ainda mais substancial, com possível eliminação como problema de saúde pública no país nos próximos 10 a 20 anos.
Estudo retrospectivo recente, a partir de hospital de referência da Universidade Federal de Goiás (UFG), ao analisar 1.211 indivíduos nascidos de mães sabidamente infectadas por T. cruzi, identificou taxa de transmissão vertical de 2%, consistente com as estimativas anteriores, e sugere que a presença de TcII na área estudada pode estar associada a menor transmissão, quando comparado a TcV, que predomina em regiões do Sul do Brasil e em outras nações do Cone Sul, onde as taxas de transmissão vertical são reconhecidamente maiores.108 A despeito das evidências científicas existentes, lacunas importantes persistem em termos do papel da diversidade genética de T. cruzi em relação à evolução da fase crônica da doença, ao risco de transmissão congênita ou de reativação, bem como à ocorrência de surtos de transmissão por via oral.27
No Brasil, a doença de Chagas congênita é considerada aguda e, portanto, de notificação compulsória.20,39 Entretanto, não se estabeleceu no país a vigilância da doença de Chagas específica em gestantes ou crianças expostas/infectadas.
Por outro lado, reconhece-se que o tratamento anti-T. cruzi em mulheres infectadas em idade fértil, que não estão grávidas, pode representar uma estratégia efetiva para reduzir a transmissão vertical a futuras gestações.41,109 Ressalta-se que a transmissão vertical pode ser repetida a cada gravidez, durante todo o período fértil da vida de uma mulher.104
Transmissão Acidental
Há registros de acidentes em diferentes contextos: laboratórios de triatomíneos, ações de captura do vetor em áreas endêmicas, trabalhos experimentais com mamíferos infectados e culturas, aerossóis de materiais infectados, infecção cirúrgica e coleta de sangue a partir de pessoas com infecção aguda - nesses casos, deficiências de segurança no transporte de materiais contaminados -, entre outros.93 Os fatores de risco passam por desconhecimento, desatenção, falta ou mau uso de equipamentos de proteção individual, instalações e equipamentos inadequados, iluminação deficiente, falta de capacitação, não observância de medidas de precaução padrão, não adoção de protocolos técnicos na rotina, entre outros.93,110
O processo de vigilância e controle deve incluir necessariamente o desenvolvimento de ações de educação permanente em saúde e supervisão, com verificação da utilização apropriada de equipamentos de proteção individual e, caso esteja aplicada, a comunicação de acidente de trabalho dentro dos processos demarcados de vigilância à saúde do trabalhador.39,93,110
Vigilância Epidemiológica
A vigilância epidemiológica representa um conjunto de ações estratégicas que proporcionam o conhecimento, a detecção ou prevenção de qualquer mudança nos fatores determinantes e condicionantes de saúde individual ou coletiva, com a finalidade de recomendar e adotar as medidas de prevenção e controle das doenças e agravos.39 No caso da doença de Chagas, engloba ações necessariamente integradas que envolvem a abordagem de casos humanos, de vetores e reservatórios, com interface estreita com a rede de atenção à saúde, com destaque à atenção básica ou de atenção primária à saúde.4,15
A seguir estão sistematizados os principais elementos no Brasil para o desenvolvimento do processo de vigilância de casos em humanos e de vigilância entomológica, ressaltando-se que várias questões próprias deste processo já foram apresentadas e discutidas previamente.
Vigilância de Casos de Doença de Chagas
As ações de vigilância epidemiológica da doença de Chagas no Brasil têm os seguintes objetivos principais:20,39
detectar precocemente casos de doença de Chagas aguda, com vistas ao tratamento oportuno dos casos diagnosticados bem como à aplicação de medidas de prevenção de ocorrência de novos casos;
proceder à investigação epidemiológica de todos os casos agudos, visando identificar a forma de transmissão e, consequentemente, adotar medidas adequadas de controle;
monitorar a infecção por T. cruzi na população humana, por meio de inquéritos sorológicos periódicos em populações estratégicas, bem como por meio da análise nacional do processo de triagem de candidatos à doação de sangue em hemocentros;
monitorar o perfil de morbimortalidade da doença de Chagas no país, delineando cenários para fortalecimento da rede de atenção à saúde às pessoas infectadas;
manter eliminada a transmissão vetorial por T. infestans e sob monitoramento/controle as outras espécies importantes na transmissão humana da doença; e
incorporar ações de vigilância sanitária, ambiental, de vetores e reservatórios de forma integrada com as ações de vigilância epidemiológica.
A mudança dos padrões epidemiológicos da doença no país demandou a necessidade de estruturação da Vigilância Epidemiológica de Chagas na região Norte em virtude da transmissão oral, e interface estreita com a Vigilância Sanitária, visando a melhorias nas ações de prevenção e controle, além da definição de fluxos de referência para o diagnóstico, tratamento e acompanhamento de complicações da doença. O elevado percentual de casos com forma de transmissão ignorada na base de dados do Ministério de Saúde sugere fragilidade do processo de vigilância e indica a necessidade de melhorias na oportunidade das ações de vigilância no tocante à detecção e investigação de casos suspeitos.55 Reforça a necessidade de qualificação das ações de vigilância em saúde no SUS, potencializadas por meio de ações de educação permanente, monitoramento e avaliação junto às equipes de saúde.
A ocorrência de casos suspeitos de doença de Chagas aguda no Brasil requer imediata notificação (até 24 horas após a suspeição), em instrumento específico: a Ficha de Investigação de Doença de Chagas Aguda padronizada em todo o território nacional. Para fins de vigilância epidemiológica, são estabelecidas as definições de caso a seguir especificadas.39
1- Caso suspeito de doença de Chagas aguda
• Pessoa com febre persistente (por mais de 7 dias) com uma ou mais das seguintes manifestações clínicas: edema de face ou de membros, exantema, adenomegalia, hepatomegalia, esplenomegalia, cardiopatia aguda (taquicardia, sinais de insuficiência cardíaca), manifestações hemorrágicas, icterícia, sinal de Romaña, chagoma de inoculação, ou que:
- tenha tido contato direto com triatomíneo ou suas excretas; ou
- tenha recebido sangue/hemocomponentes ou transplante de células/tecidos/órgãos contaminados por T. cruzi; ou
- tenha ingerido alimento suspeito contaminado por T. cruzi; ou
- seja recém-nascido, de mãe infectada.
2- Caso confirmado de doença de Chagas aguda
Critério laboratorial
Parasitológico - T. cruzi circulante no sangue periférico identificado por meio de exame parasitológico direto.
Sorológico - caso suspeito com sorologia reagente com anticorpos da classe IgM anti-T. cruzi por IFI; ou sorologia reagente com anticorpos da classe IgG anti-T. cruzi por IFI, com alteração na concentração de IgG de pelo menos 2 títulos em um intervalo mínimo de 21 dias em amostras preferencialmente pareadas; ou soroconversão por qualquer um dos métodos (ELISA, HAI ou IFI).
Critério clínico-epidemiológico
Os casos de doença de Chagas aguda devem ser confirmados sempre por meio de diagnóstico laboratorial. Apenas em situações eventuais, pode-se adotar critério clínico-epidemiológico para casos suspeitos com os exames parasitológicos negativos e sorológicos inicialmente não reagentes, e que possuam vínculo epidemiológico com casos confirmados de doença de Chagas aguda por critério laboratorial, durante surto de doença na fase aguda por transmissão oral.
3- Caso descartado de doença de Chagas aguda
Caso suspeito, com resultado dos exames laboratoriais negativos ou não reagentes, ou que tiver outra doença com diagnóstico. Em função da pouca expressão clínica apresentada em muitos casos na fase aguda e do longo e silencioso curso da enfermidade, o caso notificado pode ser descartado como caso crônico ou por reativação da doença.
4- Definição de caso segundo prováveis formas de transmissão no Brasil
Reservam-se para confirmação de casos de doença de Chagas aguda particularidades segundo a provável forma de transmissão.
Caso confirmado de doença de Chagas por transmissão oral
Caso em que se excluíram outras vias de transmissão, e com evidência epidemiológica de um alimento como fonte comum de transmissão, e habitualmente a ocorrência simultânea de mais de um caso com vinculação epidemiológica (procedência, hábitos e elementos culturais).
Caso confirmado de doença de Chagas por transmissão vetorial
Caso em que se excluíram outras vias de transmissão, e com evidência clínica (sinal de Romaña ou chagoma de inoculação) e/ou epidemiológica da ocorrência de triatomíneos no local de infecção. Normalmente observa-se a ocorrência de caso isolado.
Caso confirmado de doença de Chagas por acidente laboratorial
Caso que teve contato com culturas de T. cruzi, exposição às fezes de triatomíneos contaminadas ou sangue (de casos humanos ou de animais) contendo formas infectantes do parasito. Normalmente ocorre entre laboratoristas, profissionais de saúde ou pesquisadores.
Caso confirmado de doença de Chagas por transmissão vertical
Recém-nascido de mãe com exame parasitológico positivo ou sorológico reagente para T. cruzi e que apresente:
exame parasitológico positivo a partir do nascimento; ou
exame sorológico reagente a partir do 9º mês de nascimento (antes disso, os anticorpos maternos ainda podem estar presentes na criança) e sem evidência de infecção por outras formas de exposição a T. cruzi.
Além da vigilância dos focos vigentes para vigilância específica da doença de Chagas no Brasil, com a revisão da definição de caso para a vigilância epidemiológica de aids no país, a partir de janeiro de 2004, em todo o território nacional, inseriu-se a reativação da doença de Chagas (miocardite e/ou meningoencefalite) como doença indicativa de aids para o SUS.49,54
Embora não sejam objeto da vigilância epidemiológica no Brasil até o momento,15 os indivíduos portadores da forma crônica da doença de Chagas devem ser confirmados, considerando-se a avaliação de pessoas sem quadro indicativo de doença febril nos últimos 60 dias e a presença de um dos seguintes exames:39
sorologia anti-T. cruzi (IgG) reagente por dois métodos baseados em princípios distintos (ELISA, HAI ou IFI);
xenodiagnóstico (artificial ou indireto) positivo para T. cruzi; e
hemocultura positiva para T. cruzi em amostras de sangue ou líquor; ou ainda, diagnóstico post mortem.
Ressalta-se que o contexto epidemiológico atual no Brasil traz para debate a ampliação do foco e abordagens da vigilância epidemiológica na população humana para a doença de Chagas em sua fase crônica, considerando, entre outros fatores, a possibilidade de maior sensibilidade das ações de investigação epidemiológica de outros casos em familiares, rede social e comunidades (nas fases aguda ou crônica), bem como de delineamento de contextos espaciais de transmissão (passado ou recente, ativo ou não) de forma integrada a vetores e reservatórios. Paralelamente, deve-se considerar a ampliação dos critérios para tratamento específico da doença de Chagas, considerando-se que milhões de cidadãos brasileiros infectados teriam benefícios claros com o tratamento específico.15,59 Estas questões trazem, portanto, a necessidade de superação de problemas operacionais da rede de atenção à saúde, que deve estar preparada para manejo longitudinal, qualificado e oportuno desta condição crônica. Inclui-se também como necessidade a garantia e sustentabilidade da produção de medicamentos frente à potencial ampliação da demanda para tratamento específico e aos acordos internacionais.38
Está em curso no país, portanto, ampla discussão para a avaliação da inserção da vigilância por meio de notificação compulsória de casos humanos na fase crônica com vistas a qualificar as ações tanto de epidemiologia e controle quanto de atenção à saúde.
Vigilância Entomológica
A vigilância entomológica para doença de Chagas deve estar implantada em todo o país, respaldada principalmente em dois pilares: vigilância passiva, com participação da população na notificação de triatomíneos; e vigilância ativa, realizada por equipes de entomologia dos municípios em parceria com regionais de saúde dos estados, sem necessariamente estar baseada na prévia notificação pelo morador.39
A vigilância entomológica tem sido potencializada com sustentação em bases comunitárias, responsáveis pela rede de Postos de Informação de Triatomíneos (PITs), que está sendo consolidada lentamente no país.22 A pesquisa domiciliar por equipe técnica institucional tem sido recomendada de forma mais sistemática e abrangente, a depender do risco existente. Entretanto, poucos municípios brasileiros têm adotado esta abordagem, e aqueles que a desenvolvem, em geral, apresentam baixa sensibilidade na busca ativa, com pelo menos metade dos focos de infestação não sendo detectada. Revisão sistemática abordando impactos da participação comunitária no processo de vigilância entomológica verificou que o desenvolvimento de estratégias para garantir essa participação deve ser incorporado como um componente do processo de vigilância entomológica, ressaltando-se que somente o controle químico padronizado parece ser consistentemente eficaz em eliminar focos de infestação.85 Reforçou-se, portanto, a necessária participação das pessoas, famílias e comunidades de áreas endêmicas em todas as etapas deste processo, desde o planejamento até a avaliação das ações, considerando-se as dimensões sociais em que se inserem18,43,85 e reconhecendo-se o necessário empoderamento e participação destas populações.
As estratégias adotadas devem ser adequadas à realidade de cada local, sendo que a vigilância passiva com participação da população é prioritária no Brasil e está indicada para a grande maioria dos cenários, salvaguardando-se a necessária e pronta resposta pelos serviços às demandas da população.85 Por outro lado, a vigilância ativa deve ser realizada obrigatoriamente nos municípios com focos residuais de T. infestans.23,39
A ampliação do registro de transmissão de T. cruzi em áreas anteriormente consideradas “indenes” ou sem risco para transmissão da doença de Chagas, como a Região Amazônica, tem gerado a necessidade de maior atenção às equipes de vigilância epidemiológica.76,91,92 Em várias regiões brasileiras, têm-se observado alterações ambientais que favorecem a adaptação de vetores aos ambientes artificiais, estabelecendo novos espaços para o aparecimento da doença.22,23,39,65,66 Dessa forma, também se tem observado a domiciliação de espécies secundárias, mesmo que em escala muito inferior ao observado anteriormente ao controle de T. infestans.22,23,39,66
A emergência ou a reemergência da doença de Chagas no Brasil caracteriza um novo perfil epidemiológico que independe da transmissão intradomiciliar por T. infestans. Dessa forma, o controle da transmissão de T. cruzi, no atual cenário, deve ser analisado sob uma nova perspectiva. A atenção da vigilância é de extrema importância, mantendo principalmente o funcionamento da vigilância entomológica sensível nos municípios, além das ações de educação em saúde e ambiental.
Desafios para o Brasil
No Brasil, o SUS está fundamentado em valores centrais e princípios fundamentais dentro da sociedade, como universalidade, equidade, integralidade, participação e controle social, que devem ser o alicerce para políticas e programas de interesse público. O país representa uma das principais áreas endêmicas da doença de Chagas no mundo, em contextos diversos de grande complexidade para prevenção e controle. Pela elevada carga de morbimortalidade associada à doença de Chagas e sua relativa “invisibilidade” na sociedade, cabe ao governo garantir sua priorização para a saúde pública e mobilizar recursos e capacidades necessários junto a outros atores governamentais ou não governamentais para seu enfrentamento, reforçando o papel singular que a atenção básica tem para o sistema nacional de saúde.
As estimativas nacionais de milhões de pessoas infectadas por T. cruzi indicam a grande responsabilidade do país nos campos técnico-científico e político, não apenas para a prevenção de novos casos, mas, sobretudo, na implementação de melhores decisões e benefícios para os portadores da doença, tanto na fase aguda quanto crônica. O Brasil e os demais países da América Latina têm um papel fundamental na condução desse processo e na execução dos compromissos de ação pactuados internacionalmente, sob as chancelas da OPAS e da OMS. O movimento social emergente deve ser valorizado e estimulado, a fim de se buscar a sustentabilidade das ações para enfrentamento.
As ações de vigilância à saúde para a doença de Chagas, com base na atenção primária à saúde, devem ter como princípios: territorialização, intersetorialidade, foco nas pessoas e não na doença, constituição de equipes multiprofissionais, foco nas necessidades e expectativas da população e, por fim, busca da qualidade. A abordagem qualificada e ética das famílias atingidas pela doença de Chagas deve ser integrada às ações de promoção e prevenção, atenção à saúde para diagnóstico e tratamento oportunos, mas também para reabilitação física, psicológica e social. Da mesma forma, para as ações de vigilância epidemiológica transversais nestes territórios. Para tanto, novas pactuações e agendas devem ser construídas, inserindo-se a doença de Chagas como tema relevante, visando à garantia do acesso aos insumos necessários para diagnóstico e tratamento da doença no SUS.
Portanto, para além dos elementos apresentados previamente, o país deve rever continuamente os objetivos e focos vigentes da vigilância epidemiológica da doença de Chagas, considerando-se o acúmulo de evidências científicas e as experiências exitosas. O desenvolvimento social e humano deve estar fortemente atrelado ao fomento de pesquisas estratégicas com foco na superação de falhas próprias da ciência, do mercado e do sistema de saúde pública,111 com ampla participação popular e do emergente movimento social em doença de Chagas. A constituição da Federação Internacional de Pessoas Afetadas pela Doença de Chagas (Findechagas), com a participação importante de várias representações do Brasil e de outros países, fortalece a possibilidade de levantar e catalisar debates e decisões do ponto de vista técnico-político baseadas em evidências, para o alcance do verdadeiro controle e da prevenção.
O Ministério da Saúde, em parceria com estados e municípios, tem tido um papel indutor fundamental, devendo ser garantido o fortalecimento e a sustentabilidade do Programa Nacional de Controle da doença de Chagas, para se possibilitar que as evidências científicas, muitas das quais sintetizadas neste Consenso, de fato sejam aplicadas nas diferentes realidades do SUS. Reitera-se o seu papel estratégico de se garantir a sustentabilidade do financiamento de pesquisas para controle e prevenção da doença de Chagas no Brasil, mais ajustadas às diferentes realidades e contextos no país.83
A ampliação das ações de vigilância epidemiológica, para além dos casos agudos de doença de Chagas, integrando os casos da doença na fase crônica, deve ser incorporada estrategicamente nesta perspectiva, ampliando o acesso à rede de atenção à saúde para diagnóstico e tratamento oportunos da infecção e das potenciais complicações da doença. O tratamento antiparasitário deve ser garantido a todos os casos que tiverem indicação para seu uso, e novas opções terapêuticas seguras e eficazes devem ser continuamente buscadas.
Os espaços prioritários para o desenvolvimento das ações de vigilância devem ser pensados tanto para cenários epidemiológicos atuais quanto futuros, englobando a redefinição de instrumentos e ferramentas com caráter inovador para o desenvolvimento dos processos de vigilância, integrando aspectos ambientais, reservatórios, vetores, parasito e população humana. A perspectiva macroecológica e ecogeográfica deve ser integrada ao planejamento das ações no país, de forma articulada com as demais nações da Iniciativa dos Países do Cone Sul.
Considerando-se os contextos de risco delineados para o Brasil, deve-se definir o papel de outras modalidades de vigilância e como estas estarão integradas aos processos vigentes de vigilância, incluindo-se: hemovigilância, tecnovigilância, farmacovigilância, transmissão vertical, acidentes com materiais biológicos, transplantes, infecção por HIV/aids, outras condições de imunossupressão, eventos agudos inusitados, como surtos e microepidemias, entre outros.
Saliente-se, ademais, que é necessária a integração do programa de controle de doença de Chagas a outros programas de controle de doenças transmissíveis (vetoriais ou não) e de doenças crônicas não transmissíveis no país (todos vinculados principalmente à Secretaria de Vigilância em Saúde - SVS), bem como com outras áreas do Ministério da Saúde (Secretaria de Ciência, Tecnologia e Insumos Estratégicos - SCTIE, Secretaria de Atenção à Saúde - SAS, Secretaria de Gestão Estratégica e Participativa - SGEP, Secretaria de Gestão do Trabalho e Educação em Saúde - SGTES e Secretaria Especial de Saúde Indígena - SESAI), com vistas ao fortalecimento de ações intersetoriais para o controle efetivo da doença de Chagas.
Diante de tais perspectivas, justifica-se a construção do presente Consenso, que, além de focalizar a realidade brasileira, pode vir a ser um instrumento de referência, estímulo e mobilização de todos os atores envolvidos no enfrentamento global da doença de Chagas.
TRANSMISSÃO VERTICAL DE Trypanosoma cruzi
A transmissão vertical (de mãe para filho) de T. cruzi mantém-se como realidade, mesmo com o impacto favorável das ações de controle de vetores e da qualificação do processo transfusional em vários países,104,105,112,113 inclusive no Brasil.20,106,107 A existência de mulheres em idade fértil infectadas, em países endêmicos ou não, sustenta este risco, que tende a reduzir-se ao longo das duas próximas décadas.
No Brasil, em 2011, segundo dados do Sinasc, foram registrados cerca de 3 milhões de nascidos vivos. Com base em prevalência estimada de 1% de infecção por T. cruzi em mulheres entre 25 e 44 anos de idade17 e em um risco de transmissão vertical estimado máximo de 1% para o Estado de Minas Gerais, estima-se que até 300 crianças tenham nascido infectadas naquele ano.107 A detecção da transmissão vertical se complica na prática, pois a imensa maioria dos casos congênitos é totalmente assintomática.4,10,102,104,113-116
Trata-se de tema complexo, considerando-se a existência de poucas evidências científicas de base populacional. No Brasil, como a doença de Chagas congênita é considerada aguda, sua notificação é compulsória dentro das ações de vigilância epidemiológica.
Diagnóstico e manejo da infecção por T. cruzi durante a gestação
Recomenda-se a realização de avaliação (triagem) sorológica para infecção por T. cruzi em todas as gestantes que vivem em áreas endêmicas ou são delas procedentes, preferencialmente na primeira consulta do pré-natal.20,117 O grupo técnico da OMS sobre prevenção e controle da transmissão congênita da doença de Chagas recomenda também esta triagem para aquelas mulheres que têm histórico de ter recebido sangue por transfusões realizadas em áreas endêmicas ou que tenham nascido nestas áreas.104 Embora a transmissão dependa fundamentalmente da parasitemia materna, não há evidências claras sobre quais mulheres poderão transmitir de fato a infecção, o que acentua a importância da triagem pré-natal.112,116,117
A transmissão pode ocorrer em qualquer momento da gravidez, sendo possivelmente maior no terceiro trimestre, com o aumento da parasitemia.116,118 Por outro lado, o diagnóstico oportuno da infecção durante a gravidez possibilita atenção mais qualificada à gestante infectada, que deve ser acompanhada durante toda a gestação.
Relatos de exposição acidental ao benznidazol em gestantes não indicam efeitos adversos no recém-nascido. Entretanto, em virtude da evidência de teratogenicidade demonstrada em animais, o tratamento antiparasitário específico da infecção por T. cruzi está contraindicado durante a gestação e desaconselhado durante a amamentação,20,115 devendo ser indicado apenas após estes períodos.112 A exposição acidental ao antiparasitário durante a gravidez não representa um critério para interrupção da gestação.115
Estudos apontam para o possível benefício do tratamento antiparasitário, com melhor evolução da doença de Chagas116,119-122 e redução do risco de transmissão vertical em futuras gestações.109,116 Elevada parasitemia materna associa-se a maior risco de transmissão vertical e de aborto.103,115 Gestantes que se encontram na fase aguda da doença de Chagas devem ser avaliadas caso a caso, preferencialmente com a participação de especialistas, para definição do risco-benefício de se indicar o tratamento antiparasitário. As gestantes portadoras de cardiopatia chagásica crônica devem ser acompanhadas em centros de referência para gestação de alto risco, uma vez que poderão apresentar necessidade de atendimento de alta complexidade.
A evidência de infecção por T. cruzi não justifica a indicação de parto abdominal (cesárea),115 sendo que a infecção congênita por T. cruzi pode resultar em crescimento uterino retardado, detectado em ultrassonografia, e parto prematuro.102,115,116,123
Ressalta-se a importância de proceder a todas as avaliações recomendadas durante o pré-natal, incluindo a testagem anti-HIV. A coinfecção T. Cruzi e HIV em gestantes representa risco aumentado de transmissão congênita de T. cruzi, pela elevada parasitemia, também implicando maior morbidade e mortalidade perinatal.20,116,120,123,124
Após o parto, a mulher deverá ser avaliada quanto à condução da doença de Chagas, a partir da clínica da doença presente, com vistas a oportuno tratamento específico.
Diagnóstico e manejo em crianças expostas
O risco de transmissão vertical de T. cruzi depende do nível de parasitemia, do estado imunológico materno, da cepa infectante e de fatores placentários, podendo ocorrer em qualquer fase da doença.41,104,113,115,116
Embora a maior parte dos casos sejam assintomáticos, em alguns pode ocorrer febre prolongada, hepatoesplenomegalia, insuficiência respiratória, prematuridade, baixo peso ao nascer e natimorto. Sinais de meningoencefalite e miocardite foram observados na coinfecção com HIV.102,104,113-115,123 Portanto, têm sido recomendados como avaliações de rotina nas crianças com indícios clínicos de doença de Chagas congênita: hemograma completo, bioquímica sérica, exame de urina, radiografia de tórax, eletrocardiograma (ECG), ecocardiograma, além de ultrassonografia cerebral e abdominal.115
A estratégia empregada para o diagnóstico da infecção por T. cruzi dependerá essencialmente da idade da criança. Crianças expostas a T. cruzi, por transmissão vertical, apresentam anticorpos maternos da classe IgG circulantes que podem ser detectados por testes sorológicos de rotina até 9 meses de idade, sendo que sua detecção, neste período, não caracteriza necessariamente uma infecção congênita. Por sua vez, a persistência de títulos inalterados de anticorpos anti-T. cruzi, em crianças a partir de 9 meses de idade, é indicativa de infecção congênita, e a ausência desses anticorpos afasta a possibilidade de infecção na criança.104,123
O diagnóstico em casos suspeitos de doença de Chagas por transmissão vertical (excluídas outras formas de transmissão), por se tratar de infecção aguda, deve ser confirmado por meio da utilização de métodos parasitológicos diretos (exame a fresco, micro-hematócrito, creme leucocitário e/ou método de Strout) no sangue do cordão ou do recém-nascido nos primeiros 30 dias de idade (preferencialmente na primeira semana de vida), com avaliação de duas ou três amostras na ausência de sinais e sintomas para ampliação da sensibilidade.20,104,123
Para crianças sintomáticas ou recém-nascidos de mãe com infecção aguda por T. cruzi ou com reativação na vigência de coinfecção por HIV/T. cruzi, estes exames parasitológicos devem ser realizados repetidamente e, caso sejam negativos, métodos parasitológicos de enriquecimento e/ou moleculares (em laboratórios de pesquisa) têm sido utilizados, embora não estejam accessíveis e padronizados para uso na rotina dos serviços de saúde.115,125
Em caso de exames parasitológicos/moleculares negativos nos primeiros meses ou na impossibilidade do uso de métodos parasitológicos, recomenda-se realizar a pesquisa de anticorpos IgG anti-T. cruzi após o nono mês em dois testes.20,104,123,125 A sorologia convencional reagente em crianças neste período é fortemente indicativa de transmissão congênita, principalmente quando excluídas as possibilidades de transmissão vetorial e transfusional.20
No Brasil, a inclusão do teste sorológico com pesquisa de IgG para T. cruzi no Programa Nacional de Triagem Neonatal (“teste do pezinho”) é recomendável, especialmente em regiões endêmicas para infecção por T. cruzi, representando estratégia útil e de baixo custo.20,107
A pesquisa de anticorpos anti-T. cruzi da classe IgM apresenta baixa sensibilidade, havendo ainda dificuldades para a padronização das técnicas e para a obtenção de controles. A utilização de métodos sorológicos que empregam antígenos recombinantes, como o shed acute phase antigen (SAPA), pode ser indicada caso disponível. Há relatos de que anticorpos maternos anti-SAPA desaparecem mais precocemente do que anticorpos convencionais - em aproximadamente três meses.126
Estabelecido o diagnóstico da infecção por T. cruzi, a criança deve ser tratada com benznidazol, sendo um esquema bem tolerado até 10-15mg/kg/dia em duas ou três doses por 60 dias.20,104,115 Há uma clara necessidade para o desenvolvimento de formulações em suspensão mais adequadas para este tratamento, a despeito do avanço recente na disponibilização de comprimidos pediátricos (12,5 mg) para estas situações clínicas.
O tratamento é obrigatório em todos os casos de infecção congênita, pois sua adoção apresenta alta eficácia e segurança para a grande maioria das crianças tratadas. Além disso, estudos evidenciam alta taxa de cura (≥95%) quando o tratamento é iniciado antes de 1 ano de idade, já nas primeiras semanas de vida.104,112,115,127
Deve-se proceder à avaliação clínica e laboratorial (exame hematológico) no início do tratamento e no 30º, 60º e 90º dias após o uso de benznidazol. Nas crianças com síndrome clínica de doença de Chagas, devem ser realizadas outras avaliações complementares, de acordo com o quadro apresentado. O controle de cura deve ser realizado com exame sorológico a cada seis meses, com titulação, até que a criança apresente dois exames sorológicos consecutivos não reagentes. A persistência de sorologia reagente ou a evidência de exames parasitológicos positivos pode indicar falha terapêutica e a criança deve ser acompanhada e avaliada em relação a possíveis complicações da doença. Em casos refratários, pode ser repetida a terapêutica com benznidazol ou a substituição por nifurtimox (até 15mg/kg/dia, em duas ou três doses, por 60 dias).
Em recém-nascidos de mães infectadas, assintomáticos, sempre que possível, deve ser realizada a pesquisa de T. cruzi. Aqueles com exame parasitológico inicial negativo ou não realizado devem ser submetidos, aos nove meses após o nascimento, a testes sorológicos para pesquisa de anticorpos anti-T. cruzi da classe IgG ou à sorologia convencional para infecção por T. cruzi.107,117,127 Exames sorológicos reagentes após esta idade implicam necessariamente o início de tratamento antiparasitário. Por outro lado, a sorologia não reagente permite excluir a existência de infecção.
Não se recomenda a suspensão da amamentação em puérperas com doença de Chagas na fase crônica - exceto nos casos em que se verifica sangramento por fissura mamária, quando seria conveniente a interrupção da amamentação na mama comprometida -, ou em situações de elevada parasitemia, como na reativação da doença de Chagas ou em mulheres na fase aguda da doença.112,115 Em caso de exposição ao leite materno de mãe com infecção aguda ou infecção crônica com presença de fissuras do mamilo, o monitoramento de aquisição da infecção por T. cruzi pelo lactente deve ser realizado durante o período de exposição, utilizando-se os mesmos critérios parasitológicos e/ou sorológicos descritos anteriormente. Em alguns destes casos, o tratamento térmico do leite materno antes da administração aos lactentes pode ser considerado.112
Na coinfecção T. cruzi/HIV, recomenda-se que toda mãe infectada seja orientada a não amamentar, considerando-se que a amamentação, independentemente da associação com a doença de Chagas, está associada a um risco adicional de 7 a 22% de transmissão do HIV. Por sua vez, em casos de infecção materna aguda por HIV, o aleitamento natural aumenta a probabilidade de transmissão vertical do HIV para 29%. No Brasil, a mãe terá direito a receber fórmula láctea infantil, pelo menos até que seu filho complete 6 meses de idade.128
A Figura 1 apresenta o fluxograma geral para abordagem da infecção por T. cruzi no binômio mãe/filho.
DIAGNÓSTICO LABORATORIAL DA INFECÇÃO POR
Trypanosoma cruzi
O diagnóstico etiológico da doença de Chagas no Brasil deve ser realizado em todos os casos suspeitos, tanto na fase aguda quanto na fase crônica.20,39,129 Para tanto, é fundamental integrar evidências epidemiológicas, clínicas e laboratoriais, a fim de se aumentar o grau de predição e a acurácia do diagnóstico.
O diagnóstico complementar da infecção por T. cruzi por meio de diferentes técnicas laboratoriais deve seguir critérios definidos, a depender da fase da doença. As recomendações a seguir incluem as normas vigentes no Brasil para este diagnóstico.
Critérios Laboratoriais para Definição do Diagnóstico da Doença de Chagas
Fase aguda
Critério parasitológico
O exame parasitológico é o mais indicado nesta fase. Este critério é definido pela presença de formas tripomastigotas de T. cruzi, identificadas por meio do exame direto do sangue periférico (com ou sem centrifugação prévia) com o uso de microscopia (com ou sem coloração).39,129-132
Recomenda-se a realização simultânea de diferentes modalidades de exames parasitológicos diretos - pesquisa a fresco de tripanossomatídeos, métodos de concentração ou lâmina corada de gota espessa ou de esfregaço. Quando os resultados do exame a fresco e de concentração forem negativos na primeira coleta, devem ser realizadas novas coletas até a confirmação do caso e/ou desaparecimento dos sintomas da fase aguda, ou ainda confirmação de outra hipótese diagnóstica.20,39,133
Critério sorológico
O critério sorológico baseia-se em métodos indiretos para diagnóstico que podem ser realizados quando os exames parasitológicos forem negativos e a suspeita clínica persistir. Tais métodos têm utilidade complementar, e devem sempre ser realizados em casos suspeitos ou confirmados de doença de Chagas aguda.39,134
Nos casos em que não se identifica o parasito na pesquisa direta, a verificação da presença de anticorpos anti-T. cruzi da classe IgM no sangue periférico é considerada sugestiva da fase aguda, particularmente quando associada a contexto epidemiológico e manifestações clínicas.129,135 Representa uma técnica de maior complexidade de realização, mais adequada na fase aguda tardia, quando as repetições dos exames de pesquisa direta tiverem resultados negativos.129,133,134
A soroconversão para infecção por T. cruzi é definida pela presença de uma primeira amostra de soro não reagente para anticorpos anti-T. cruzi, associada a uma segunda amostra reagente (coletada 2 a 4 semanas após), com base em um ensaio que inclua ambas as amostras simultaneamente.133,134
Por outro lado, o aumento de pelo menos dois títulos entre duas amostras reagentes com intervalos de 2 a 4 semanas, em um contexto clínico e epidemiológico favorável para doença de Chagas aguda, pode ser considerado sugestivo também de doença de Chagas aguda.39,132-134
Nas situações relacionadas à possibilidade de transmissão vertical, a estratégia empregada para o diagnóstico da infecção por T. cruzi dependerá essencialmente da idade da criança, e é discutida em parte específica deste documento. Ressalta-se que todo caso de transmissão congênita significa um caso agudo de doença de Chagas, devendo ser notificado e manejado como tal.104
Fase Crônica
Critério parasitológico
Devido à parasitemia subpatente na fase crônica da doença de Chagas, os métodos parasitológicos de enriquecimento/multiplicação, hemocultura136,137 e xenodiagnóstico138 apresentam comprovadamente baixa sensibilidade, o que implica a ausência de valor diagnóstico quando o resultado for negativo.20,133,139 Quando apresentam resultados positivos, possuem utilidade principalmente no controle do tratamento específico ou nos casos não usuais, quando a sorologia apresenta resultados inconclusivos.129,134
Critério sorológico
Nessa fase, o diagnóstico é essencialmente sorológico, e deve ser realizado utilizando-se um teste com elevada sensibilidade em conjunto com outro de alta especificidade.20,39,132-134
Considera-se indivíduo infectado na fase crônica aquele que apresenta anticorpos anti-T. cruzi da classe IgG detectados por meio de dois testes sorológicos com princípios/métodos distintos ou que possuam diferentes preparações antigênicas. O diagnóstico diferencial com outras doenças (por exemplo, leishmaniose visceral, hanseníase na forma clínica virchowiana, doenças autoimunes, entre outras) deve ser considerado.140-142
Princípios e diretrizes do diagnóstico laboratorial da infecção por T. cruzi
Diagnóstico parasitológico na fase aguda
O diagnóstico parasitológico da doença de Chagas nesta fase baseia-se essencialmente na identificação do parasito, e a sua sensibilidade depende do nível de parasitemia. Na fase aguda, o número de parasitos no sangue periférico é elevado. Recomenda-se que, diante de um caso suspeito de doença de Chagas na fase aguda, sejam utilizados diferentes métodos de exames parasitológicos diretos, para leitura imediata e repetida, com a finalidade de esclarecimento diagnóstico.20,39,104,132-134
A pesquisa a fresco de tripanossomatídeos é de execução rápida e simples, sendo mais sensível que o esfregaço corado. A situação ideal é a realização da coleta com paciente febril e dentro de 30 dias do início de sintomas.134
O exame pode ser realizado diretamente ao microscópio em uma gota de sangue entre lâmina e lamínula, e a coleta deve ser realizada simultaneamente para métodos de concentração do sangue.
Os métodos de concentração são de rápida execução e baixo custo (método de Strout, micro-hematócrito e creme leucocitário), e são recomendados como primeira escolha de diagnóstico para casos sintomáticos com mais de 30 dias de evolução, devido ao declínio da parasitemia com o decorrer do tempo. As amostras de sangue devem ser examinadas dentro de 24 horas, devido à possível lise dos parasitos.129,134
As avaliações por exame direto de lâmina corada de gota espessa ou de esfregaço sanguíneo podem ser utilizadas, mas apresentam menor sensibilidade do que os métodos anteriormente descritos. Entretanto, na região Norte do Brasil, pertencente à Amazônia Legal, são largamente utilizadas, em virtude da praticidade e da disponibilidade ao serem integradas às ações de diagnóstico da malária.20,39 Representam métodos importantes para a comprovação e caracterização morfológica, especialmente em áreas geográficas onde a infecção por Trypanosoma rangeli pode coexistir com T. cruzi.
Ressalta-se que os casos de elevada parasitemia - como na fase aguda da doença, mas também na transmissão transfusional e em imunossuprimidos -, pode ser um achado casual no exame de esfregaço sanguíneo para contagem diferencial de leucócitos.20,39,49,52,100
Diante de forte suspeita clínica e epidemiológica de fase aguda da infecção por T. cruzi associada a exames parasitológicos diretos negativos, o diagnóstico molecular por meio da reação em cadeia da polimerase (PCR) com hibridização tem apresentado resultados promissores, apesar de serem testes in house, e realizados apenas por alguns centros de pesquisa/referência. Os métodos, os protocolos e os procedimentos operacionais devem seguir as recomendações da recente padronização para o uso da PCR.143,144 No Brasil, devido à ausência de protocolos definidos e de procedimentos operacionais padronizados, assim como de kits comerciais para uso na rotina da vigilância em saúde, a PCR não pode ser considerada um método de diagnóstico isolado para confirmação ou descarte de caso de doença de Chagas aguda ou crônica.39
Diagnóstico sorológico na fase aguda
Atualmente, existem dificuldades no Brasil para a realização de testes sorológicos em pacientes na fase aguda, devido à falta de kits comerciais registrados aprovados pela Agência Nacional de Vigilância Sanitária (Anvisa) e à dificuldade de obtenção de controles positivos para IgM.20,39,133 Dessa forma, tradicionalmente tem-se recomendado que sejam implantadas metodologias de imunofluorescência indireta (IFI)145 com pesquisa de IgM em laboratórios de referência, além das técnicas convencionais já utilizadas, como IFI com pesquisa de IgG, hemaglutinação indireta (HAI)146 e ensaio imunoenzimático (ELISA).147
Diagnóstico parasitológico - fase crônica
Os métodos convencionais indiretos para o isolamento e a identificação de T. cruzi (xenodiagnóstico e hemocultura) apresentam baixa sensibilidade, que pode ser aumentada por meio da sua repetição.20,129,133,148,149 Um exame negativo não afasta a possibilidade da infecção, mas um exame positivo tem valor diagnóstico absoluto. A PCR nesta fase, apesar de sua limitação pela ausência de protocolos padronizados, tem indicação quando os testes sorológicos apresentarem resultado indeterminado ou para o controle de cura após o tratamento antiparasitário. Assim, deve ser realizada por laboratórios de competência reconhecida, com execução por especialistas na área.150
Diagnóstico sorológico - fase crônica
O diagnóstico na fase crônica é essencialmente sorológico, e deve ser realizado utilizando-se um teste com elevada sensibilidade (ELISA com antígeno total ou IFI) em conjunto com outro método com elevada especificidade (HAI).129,133,134 Os testes ditos convencionais (HAI, IFI e ELISA)131 podem determinar o diagnóstico em quase 100% dos casos. Os testes não convencionais (com antígenos recombinantes, por exemplo) podem ser utilizados preferencialmente em paralelo com outro teste convencional clássico.151
A realização de reações em eluatos de sangue coletado em papel de filtro é desaconselhada para o diagnóstico de infecção, porém estas são habitualmente utilizadas em etapas de triagem em inquéritos epidemiológicos.152 A reação de Guerreiro e Machado (ou fixação de complemento) para doença de Chagas não atende aos padrões exigidos atualmente, além de não estar disponível no mercado, não sendo, portanto, indicada.20,129
A prova de quimioluminescência também permite a identificação de anticorpos da classe IgG. Embora existam alguns kits disponíveis no mercado, a técnica ainda não é recomendada pelo Ministério da Saúde do Brasil.133
Avaliação recente de 11 kits para teste rápido para diagnóstico sorológico da doença de Chagas indicam a potencialidade destes métodos. Entretanto, novos estudos devem ser conduzidos em laboratório e no campo para confirmação destes dados, em especial para se avaliar a reprodutibilidade em contextos de recursos limitados ou de uso de sangue total nos contextos reais de áreas endêmicas e não endêmicas.153
O fluxograma a seguir (Figura 2) sumariza as etapas do diagnóstico laboratorial da infecção por T. cruzi na fase crônica da doença.
FASE AGUDA DA DOENÇA DE CHAGAS
A doença de Chagas aguda vem se tornando um evento menos frequente nos países endêmicos, inclusive no Brasil, onde o controle da transmissão vetorial (especialmente por T. infestans) e sanguínea foi decisivo neste novo cenário epidemiológico.20,39
Por outro lado, a ocorrência de casos e surtos por transmissão oral, vetorial domiciliar sem colonização e vetorial extradomiciliar, principalmente na Amazônia Legal, vem ganhando importância epidemiológica.20,21,39,76,154-156
Processos de urbanização e globalização da doença de Chagas decorrentes de grandes migrações, tanto nos países endêmicos quanto não endêmicos, contribuíram para tornar ainda mais complexos os cenários epidemiológicos. Adicionalmente, eventos de reativação da doença de Chagas associados a imunodeficiências têm se tornado desafios emergentes para os sistemas de saúde.20,39,49,157-159
Nesse sentido, a investigação epidemiológica do modo de transmissão dos casos de doença de Chagas reveste-se de especial importância, não apenas com vistas às ações de controle a serem implementadas, mas também porque as diferentes vias levam potencialmente a especificidades na expressão clínica da doença aguda.20,39,76,132
Aspectos clínicos e de exames complementares
Fase aguda da doença de Chagas por transmissão vetorial
O quadro clínico se caracteriza pelo aparecimento de um conjunto de manifestações de intensidade variável, após um período de incubação que varia na razão inversa entre a carga do inóculo e a via de inoculação, podendo ocorrer ou não um sinal de porta de entrada da infecção.20,21,39,76,91,155,160
O quadro clínico da doença aguda nos casos de transmissão vetorial é polimórfico, indo desde a descrição clássica - sinal de porta de entrada da infecção, febre, edema subcutâneo, aumento do volume de linfonodos, hepatomegalia, esplenomegalia, além de evidências de miocardite e de meningoencefalite - até situações oligossintomáticas e inaparentes.20,76,91,160 O período de incubação pode variar de 4 a 15 dias.
A infecção tem como porta de entrada, em 50% dos casos, a conjuntiva ocular (sinal de Romaña), e em 25%, a pele (chagoma), mas não é reconhecida nos 25% restantes.160 É de se supor, entretanto, que a via ocular seja a mais frequentemente diagnosticada, em virtude do seu fácil reconhecimento, tanto pelo indivíduo acometido, quanto pela equipe de saúde.
O sinal de Romaña caracteriza-se, essencialmente, por edema elástico das pálpebras em um dos olhos, indolor, com reação de linfonodo satélite (principalmente pré-auricular). Frequentemente o edema se propaga à hemiface correspondente; é de proporção variável, podendo ser tão acentuado a ponto de ocasionar oclusão total da fenda palpebral. A divulgação do sinal de Romaña tornou-o excelente marcador para o diagnóstico de fase aguda, permitindo o reconhecimento de maior número de casos.20,160,161
O chagoma de inoculação se apresenta como uma formação cutânea pouco saliente, endurecida, avermelhada, pouco dolorosa e circundada por edema elástico. É acompanhado também de reação de linfonodo satélite e às vezes se exulcera; localiza-se em qualquer região do corpo, principalmente nas partes descobertas.20,160
Juntamente com os sinais de porta de entrada, aparecem sintomas gerais, como febre, mal-estar, cefaleia, astenia e hiporexia. A febre é sintoma inicial praticamente constante, em geral não ultrapassando 39,0ºC; às vezes é mais elevada, especialmente em crianças. A curva térmica não é característica, podendo-se registrar os tipos contínuo, remitente e intermitente, com elevações apreciáveis no período vespertino.160,162
Por volta da segunda semana de evolução da doença, pode aparecer edema generalizado ou localizado (no rosto ou nos membros inferiores), independentemente da relação com a porta de entrada da infecção ou com a insuficiência cardíaca.160 Sua consistência pode ser elástica ou mole; a elástica é observada apenas em crianças de baixa idade. De patogenia ainda obscura, várias hipóteses têm sido aventadas para explicar essa manifestação.
Os linfonodos comumente apresentam-se ligeira a moderadamente aumentados de volume, isolados, móveis, lisos, indolores, e têm consistência algo aumentada. Entre as plêiades acessíveis à palpação, as que mais comumente se mostram alteradas são as das regiões cervicais, axilares e inguinais; essa manifestação é de aparecimento precoce.160
A hepatomegalia e a esplenomegalia, isoladas ou em associação, são frequentemente observadas; em geral, o aumento de volume do fígado e do baço é pequeno ou moderado, a consistência não se mostra alterada, a borda e a superfície são lisas e, às vezes, há dor à palpação do fígado; integram precocemente o quadro clínico.160,163
Ainda que menos comuns, outras alterações (nervosas e cutâneas), podem estar presentes. As manifestações nervosas são as de uma meningoencefalite (vômitos, agitação, convulsões, opistótono, rigidez da nuca etc.), observada principalmente em crianças de tenra idade. A meningoencefalite pode se apresentar com alteração do líquido cefalorraquidiano, cujas características são líquor claro, aumento da celularidade com discreta linfocitose (menos de 100 células/ml), hipoglicorraquia e aumento discreto das proteínas; é possível a visualização de formas tripomastigotas de T. cruzi após centrifugação do líquor e coloração específica.20,160
As manifestações cutâneas (raras no Brasil e relativamente frequentes na Argentina), são exantemas (morbiliforme, urticariforme e macular), denominadas esquizotripanides, e chagomas hematógenos (formações geralmente planas), que acometem pele e tecido celular subcutâneo sem alterar-lhes a cor, não aderentes a planos profundos, comumente indolores, de tamanho variável ao de uma moeda a grandes placas160 e, segundo Lugones (2001), mais palpáveis que visíveis.162
O coração apresenta alterações de maior ou menor intensidade; com relativa frequência, porém, a exteriorização clínica, radiológica ou eletrocardiográfica desse acometimento é pouco expressiva, não guardando paralelismo com os achados histológicos; podem, inclusive, faltar. Por outro lado, deve-se ter em mente a necessidade de seriar os exames radiológico e eletrocardiográfico, a prazo curto, na busca de sinais de comprometimento cardíaco, dada a transitoriedade de algumas manifestações.20,21,160,164
A sintomatologia da miocardite chagásica aguda praticamente se superpõe à das miocardites agudas de outras etiologias, às vezes sendo mascarada pelas demais manifestações clínicas. A taquicardia é frequentemente assinalada e, regra geral, não depende do grau de elevação térmica; na maioria dos casos é observada precocemente. Um sopro sistólico com características de sopro funcional pode ser percebido no foco mitral. As arritmias de excitabilidade apenas ocasionalmente são encontradas. A insuficiência cardíaca, quando presente, é global, e seu cortejo sintomatológico em nada difere das demais. Às vezes ocorre certo grau de hipotensão arterial.160,164
Já nas primeiras semanas de infecção, podem ser notadas alterações radiológicas e/ou eletrocardiográficas, de maior ou menor significado. Nem sempre ambos os exames se mostram simultaneamente alterados, podendo apenas um deles apresentar-se anormal; praticamente têm o mesmo valor diagnóstico, pois ambos, isoladamente, revelam distúrbios com a mesma frequência. Praticados conjuntamente e de maneira seriada, porém, permitem demonstrar maior número de vezes o comprometimento do coração.160,164 Portanto, o estudo da área e função cardíaca por meio do ecocardiograma está indicado nos casos com evidências de sinais e sintomas de miocardite.
Radiologicamente, a área cardíaca pode apresentar-se normal ou com leve, moderado ou acentuado aumento, globalmente ou em decorrência da dilatação dos ventrículos, predominando, em alguns casos, a dilatação do ventrículo esquerdo. Contribui para o aumento da sombra cardíaca a presença de exsudato na cavidade pericárdica.160,164
As alterações eletrocardiográficas mais frequentemente encontradas são taquicardia sinusal, diminuição da voltagem do complexo QRS, bloqueio atrioventricular (BAV) de primeiro grau, alteração primária da repolarização ventricular e aumento da sístole elétrica. As arritmias, excetuado o BAV de primeiro grau, apenas ocasionalmente são observadas.160,164
O assincronismo cronológico entre o aparecimento da ecocardiografia e a ocorrência de fase aguda foi motivo da não realização generalizada desse exame. Em estudo conduzido na Venezuela que acompanhou 58 pacientes na fase aguda, o ecocardiograma mostrou-se anormal em 27 (52%); o mais relevante achado foi o derrame pericárdio, presente em 42% dos casos, de leve a moderada intensidade em 17 pacientes e acentuado em 5; em 11 pacientes (21%), foi demonstrada discinesia anterior e/ou apical e, em 3 (6%) deles, dilatação de ventrículo esquerdo.165 Trabalho abordando 158 pacientes com doença de Chagas aguda na Amazônia, na maioria dos casos decorrente de transmissão oral, evidenciou a presença de 108 alterações, sendo que mais de uma alteração esteve presente no mesmo indivíduo;91 as principais foram derrame pericárdico de pequeno a grande volume, regurgitação valvar mitral ou tricúspide e hipertrofia simétrica de ventrículo esquerdo. Ocasionalmente, observa-se acentuação da taquicardia sinusal, em contraste com a redução da intensidade ou o desaparecimento das manifestações da fase aguda, inclusive da febre, fato já relatado por Chagas.76,91,160
As principais alterações laboratoriais inespecíficas encontradas são, em ordem de frequência, anemia, leucopenia, linfocitose relativa e aumento, de leve a moderado, de aminotransferases. Também são descritas plaquetopenia e, mais raramente, trombocitose e linfocitose atípica.21,76
O hemograma revela leucocitometria global geralmente aumentada, porém, às vezes, normal ou ligeiramente diminuída, com linfocitose intensa, plasmocitose e neutropenia relativa; assinala-se o aparecimento de elevado percentual de linfócitos atípicos e leucocitoides após a segunda semana de doença; com a evolução do processo para a cronicidade, essas alterações desaparecem, surgindo então a eosinofilia.20,21,39,160
Fase aguda da doença de Chagas por transmissão sanguínea
Na fase aguda da doença de Chagas por transmissão transfusional, a síndrome clínica é praticamente idêntica ao verificado na transmissão por triatomíneos, exceto pela não existência de chagoma de inoculação. Da mesma forma, a avaliação por exames complementares. O período de incubação pode variar de 30 a 112 dias, sendo um pouco mais prolongado do que o verificado na transmissão vetorial, embora períodos bem mais curtos, como 8 dias, ou mais longos, como 120 dias, possam ser verificados.160,166 A doença de Chagas deve ser sempre aventada em casos de febre de origem indeterminada, em particular se o paciente sob investigação tiver sido transfundido em regiões remotas ou hiperendêmicas.166
A febre é o sintoma mais frequente, acometendo de 80 a 100% dos casos e, muitas vezes, é a única sintomatologia encontrada. Por sua vez, a linfadenopatia e a esplenomegalia são observadas também com frequência, enquanto anemia/palidez cutânea, edema periorbital e perimaleolar, exantemas ou hepatomegalia aparecem em menos de 50% dos casos.166
Fase aguda da doença de Chagas por transmissão oral
A doença de Chagas transmitida por via oral tem sido registrada na Região Amazônica e Extra-amazônica,76,91,94,167 com características clínicas peculiares em relação à transmitida por via vetorial, e por vezes com diferenças conforme a região.21
A principal diferença clínica entre as descrições de área endêmica do passado e a Região Amazônica (transmissão predominante por via oral) é a apresentação clínica de elevada morbidade, ressaltando a característica epidemiológica regional no que se refere à ocorrência da transmissão muito mais eficaz que a via vetorial.76,94 A avaliação por exames complementares inespecíficos é, em geral, semelhante ao verificado previamente.
Sinais sugestivos de porta de entrada discutidos anteriormente - sinal de Romaña e chagoma de inoculação - próprios da doença por transmissão vetorial têm sido raramente descritos na transmissão por via oral, enfatizando, assim, o diagnóstico diferencial clínico entre as duas formas de transmissão e a baixa frequência do contato de pessoas com vetores não domiciliados nesta região.91,94,160
O período de incubação varia de 3 a 22 dias. Os principais sinais e sintomas registrados na doença de Chagas aguda são, em ordem de frequência: febre prolongada, cefaleia, palidez, mialgias, exantema e edemas de face e membros inferiores.21,39 Os sinais e sintomas característicos de comprometimento cardíaco incluem taquicardia sem febre, palpitações, dispneia e dor torácica.76
A febre é a manifestação predominante na quase totalidade dos casos. Em geral, cursa com temperatura elevada de início contínuo e, posteriormente, de caráter vespertino, diário, de duração média total de 18 dias, com intervalos mínimos e máximos entre 3 e 25 dias. Naqueles que cursam com febre prolongada, esta se apresenta de início elevada (38,7ºC a 39,0oC), acompanhada de calafrios e dores generalizadas. Após cerca de 12 a 15 dias, começa a decair em lise, permanecendo temperaturas variáveis entre 37,0oC e 37,8oC, de caráter vespertino, diário, até desaparecer totalmente.76,91
A palidez (anemia) se revela desde o início da síndrome febril, em especial de 3 a 5 dias, podendo perdurar por até 20 a 25 dias. Por sua vez, a mialgia pode ser intensa, frequentemente descrita pelos casos como dor aguda em pontada, ou semelhante aos quadros de dengue (generalizada, confundindo-se com poliartralgia).91,168
Na doença de Chagas por transmissão oral, o exantema se afigura como um sinal importante e justificado por parasitemias abundantes, as quais ocorrem com maior frequência do que na transmissão vetorial. Em geral, se apresenta sob a forma de exantema macular, não pruriginoso e não doloroso. Surge em torno do 4º ao 8º dia da doença, em geral no tórax, dorso, membros inferiores e pescoço, poupando face e regiões palmoplantares. Tem relativa fugacidade e, na maioria das vezes, passa despercebido pelo próprio paciente, sendo um achado ao exame físico.91,169,170
O edema de membros inferiores, em geral, aparece em torno do 12º ao 20º dia de doença, coincidindo com o desaparecimento da febre. Invariavelmente tem características de edema inflamatório, inelástico e pouco doloroso, podendo acometer apenas a região maleolar ou os membros inferiores por completo. O edema de face pode surgir no mesmo período e não tem características específicas.76,91
Na maioria dos casos, a miocardite aguda pode ter início pouco antes do desaparecimento da febre, em período médio de 15 a 20 dias de doença. Os principais sinais e sintomas são dispneia, palpitações, taquicardia (sem febre) e, eventualmente, dores precordiais, simulando infarto do miocárdio. A miocardite é uma das complicações mais frequentes entre doentes em fase aguda. Os exames eletrocardiográfico e ecocardiográfico devem ser realizados imediatamente após o diagnóstico.76,160,164
Entre pacientes avaliados na Amazônia, 52,3% apresentaram ECG com alterações, predominando as alterações difusas de repolarização ventricular (ADRV), baixa voltagem dos complexos QRS, desvio do eixo elétrico para a esquerda e taquicardia sinusal, demonstrando algum envolvimento do sistema de condução cardíaco mais leve e, mais frequentemente, sinais de inflamação difusa. Os distúrbios de condução elétrica cardíaca são mais evidentes em adultos e as miopericardites, evidenciadas pela presença de ADRV e derrame pericárdico (observados ao ECG e ao ecocardiograma, respectivamente), sendo importantes tanto em adultos quanto em crianças.154,160,164 Em surtos fora da Região Amazônica, observou-se também elevada frequência de derrame pericárdico,155 enfatizando-se a necessidade de diagnóstico precoce em vista da grave evolução, se não for prontamente diagnosticado e tratado.
Derrame pericárdico e/ou pleural podem ocorrer em mais da metade dos casos por transmissão oral, sugerindo que a pericardite possa ser mais importante que o acometimento do sistema de condução elétrica cardíaco durante a fase aguda.154,160,164
Nodulações dolorosas de membros inferiores podem estar associadas ao edema, e têm sido registradas invariavelmente nos membros inferiores em pessoas do sexo feminino. A expressão de eritema nodoso tem sido mais frequentemente observada na transmissão oral. Descrições similares em crianças foram também registradas em casuísticas argentinas, nas quais algumas lesões de pele e subcutâneas foram rotuladas como chagomas hematogênicos ou metastáticos.169,171
Outras manifestações associadas a esta forma de transmissão podem estar presentes, como dor abdominal (epigastralgia), icterícia de pele e mucosas, hepatomegalia e enfartamento de linfonodos. Estas são frequentes em crianças, acometendo especialmente cadeias de linfonodos cervicais, não sendo difusas. Esplenomegalia e diarreia são eventos raros.91,94
Casos graves têm sido registrados em 13,3% dos casos, quase sempre relacionados à miocardite aguda e a manifestações hemorrágicas digestivas graves. A presença de hemorragia digestiva pode ser a expressão da porta de entrada,94 com presença de infiltrado inflamatório contendo amastigotas. Há raros relatos de meningoencefalite aguda.172 A hemorragia representou um quadro exuberante na epidemia ocorrida no município de Navegantes, no Estado de Santa Catarina (região Sul do Brasil), propiciando diagnóstico diferencial com doenças graves que cursavam com quadro íctero-hemorrágico, como leptospirose, dengue e hantavirose.76 O coeficiente de letalidade foi mais expressivo entre adultos com idades acima de 50 anos - em geral, de 5,6%.
Em pouco mais da metade (54,1%) dos casos na Amazônia, o diagnóstico foi realizado pelo exame parasitológico direto positivo.154,156,169 Dessa forma, entre os casos com testes parasitológicos negativos, mas com forte suspeita clínica, recomenda-se a realização dos testes sorológicos concomitantes, particularmente considerando-se a sua maior sensibilidade após o primeiro mês de história clínica.
Tratamento específico
Os casos em fase aguda têm indicação de tratamento específico imediato e seguimento em longo prazo, para fins de identificação de cura sorológica.76,156,169 Para mais detalhes, consultar parte de tratamento específico deste Consenso.
Considerando casuística de 179 pacientes tratados com benznidazol em fase aguda da doença de Chagas por transmissão oral, e que tiveram um acompanhamento sob protocolo de pesquisa por um período médio de 5,6 anos, ocorreu cura sorológica em 26,3%, mais evidente durante o quarto ano após tratamento. Outros 2,7% evoluíram com cardiopatia crônica leve a moderada, e 73,7% persistiram com sorologias reagentes, porém com expressivo decréscimo dos níveis de anticorpos.156
Reativação da doença de Chagas
O manejo de casos com reativação da doença de Chagas, na vigência de contextos de imunossupressão, constitui-se em importante e emergente problema de saúde pública em todos os países que albergam pessoas portadoras da doença de Chagas crônica.
Em particular, destaca-se a elevada taxa de transmissão congênita em gestantes coinfectadas (HIV/T. cruzi), superior a 50% nos registros da literatura, aconselhando-se seguimento cuidadoso, com avaliação clínica e pesquisa direta periódica do parasito nessas mulheres.20,173-175
A reativação da doença de Chagas crônica em casos previamente infectados é definida pela positividade dos seguintes exames, independentemente de presença de outros sinais e sintomas:159
Presença do parasito por exame microscópico direto no sangue ou secreções biológicas: líquor, pleura, pericárdio, líquido ascítico, entre outros. Em termos de sensibilidade, indica-se a pesquisa do parasito em creme leucocitário ou por micro-hematócrito no sangue ou sedimento de outros materiais, ou exames mais sensíveis do que a pesquisa direta em material biológico a fresco ou mesmo em esfregaço. A gota espessa é de mais difícil realização e interpretação, só podendo ser realizada por técnico capacitado.
Exame histopatológico de lesões teciduais (paniculite, miocardite, encefalite, enterite, colpite, entre outras), com encontro de ninhos do parasito em meio a infiltrado inflamatório agudo.
A reativação da doença de Chagas foi registrada inicialmente em pacientes imunodeprimidos por neoplasias hematológicas;176 no final da década de 1980, e a partir de 1990, começaram a ser relatados casos de reativação da doença de Chagas em pessoas infectadas por HIV.159,175,177,178-180
No maior estudo prospectivo em coinfecção, a taxa observada em 53 pacientes foi de 20,8%;175 considerando-se apenas os pacientes em seguimento com coinfecção (excluídos os internados com diagnóstico de reativação), este valor foi de aproximadamente 10%.175
Em transplantes de rim, são registradas taxas de transmissão por doador infectado de 18,7%, e de reativação em pacientes crônicos submetidos a transplante taxas de 21,7%.181 Em contextos de transplante de coração, verificou-se proporção de 26,4 a 40% de reativação182 e, embora seja proibida a utilização de coração de doador infectado em transplante de coração, registros têm sido descritos na ausência de triagem de doadores em países não endêmicos.157,158
No Brasil, além da proibição da utilização de transplantes de coração e de intestino de doador com infecção, recomenda-se não utilizar transplante de outros órgãos de doadores com infecção; situações excepcionais devem ser discutidas caso a caso por equipes especializadas.183
A taxa de reativação em transplantes alogênicos de células-tronco hematopoiética é de 27,3%,184 e de 18,7% em fígado.185 A associação de uso de corticosteroides com aumento de parasitemia e um possível efeito com medicamentos imunossupressores no tratamento de mesenquimopatias têm sido registrados, sem relação causal bem definida.186
Diagnóstico da reativação da doença de Chagas
Clinicamente, as manifestações mais comuns de reativação são febre, paniculite (nódulos subcutâneos), miocardite, meningoencefalite, acidente vascular cerebral e sintomas como anorexia, mialgia, mal-estar ou diarreia. Trabalhos de séries de caso sugerem que a reativação associada à infecção por HIV é seguida de maior morbimortalidade do que em algumas outras situações de imunossupressão, como em transplantes, em que o monitoramento dos receptores de órgãos é sugerido, com elevada taxa de sucesso para alguns grupos.181,184
Na reativação associada à infecção por HIV, há registro de meningoencefalite (74% dos casos), miocardite (17,1%), e concomitância de ambas (7,9%).48,49,159,175,187 Formas oligossintomáticas foram diagnosticadas em mãe que deu à luz uma criança com doença de Chagas grave e em paciente com quadro febril em seguimento há longo prazo, com boa resposta terapêutica ao benznidazol. Outras manifestações mais raras de reativação em pacientes imunodeprimidos foram observadas, como eritema nodoso, mielite, peritonite e colpite.49,159
Exames complementares, tais como tomografia computadorizada e/ou ressonância nuclear magnética de crânio, são fundamentais para localizar as lesões e diferenciar de outras possibilidades diagnósticas, tais como neurotoxoplasmose e linfoma primário do sistema nervoso central, e se verificar se é possível indicar o exame de líquor para confirmação do diagnóstico por meio do reconhecimento da presença do parasito (e posterior cultivo), pois este exame é mais sensível do que a pesquisa em sangue periférico. O líquor revela pleocitose discreta (à custa de linfócitos e monócitos), glicorraquia normal ou um pouco diminuída e hiperproteinorraquia leve ou moderada.48,49,159
A miocardite se manifesta na reativação por insuficiência cardíaca por arritmia, choque cardiogênico e baixa resposta aos medicamentos sintomáticos para insuficiência cardíaca congestiva. O ecocardiograma e outros exames complementares para avaliação da função cardíaca são indicados.49,159,175 O diagnóstico é facilitado quando concomitantemente há um aumento da parasitemia no sangue periférico, mas a reativação pode ocorrer no tecido sem repercussão sistêmica.49,159
A forma reativada da doença de Chagas, em suas manifestações de meningoencefalite e/ou miocardite, é considerada oficialmente no Brasil como doença indicativa de imunodeficiência grave em indivíduos maiores de 13 anos de idade, para a definição de caso de aids, desde janeiro de 2004.54
Para fins de vigilância epidemiológica, somente são considerados casos de reativação da doença de Chagas aqueles que apresentarem diagnóstico definitivo de infecção por T. cruzi por diagnóstico parasitológico, por meio de pesquisa direta no sangue ou em fluidos corporais (líquor, líquidos pericárdico ou peritoneal), associado a:
meningoencefalite - imagem de lesão cerebral com efeito de massa (ressonância nuclear magnética ou tomografia computadorizada, com ou sem injeção de meio de contraste - captação anelar); e/ou
miocardite aguda - arritmias e/ou insuficiência cardíaca diagnosticadas por meio de eletrocardiografia e ecocardiografia.
Fatores associados à reativação da doença de Chagas
Observa-se nível de linfócitos T CD4+ abaixo de 200 células/mm3 em mais de 80% dos casos de reativação,49,159,175 embora raramente possa ser maior que 350 células por mm3.48,49
Os dados disponíveis não sugerem a importância da carga viral do HIV como fator prognóstico para a reativação ou como fator relacionado à gravidade dos casos. Por outro lado, tem-se registrado o aumento da carga viral do HIV no contexto da reativação.49,159
Em relação ao papel do protozoário, estudos prospectivos têm demonstrado a importância da parasitemia elevada (observada por métodos quantitativos) como fator preditivo da reativação (50% dos casos). Adicionalmente, discute-se a participação de diferentes subpopulações de T. cruzi na gênese de manifestações clínicas da reativação, sendo tal dado ainda controverso na literatura.48,49,159
Em situações de transplante de coração, foram identificados como fatores associados: número de episódios de rejeição, presença de neoplasias e, de maneira tangencial, o uso de micofenolato mofetil.182
Evolução e prognóstico da reativação da doença de Chagas
Caso não recebam tratamento precocemente, grande parte dos pacientes com aids e reativação da doença de Chagas morrem antes ou logo após o diagnóstico.159,175 Dos pacientes que completam ao menos 30 dias de tratamento, cerca de 80% sobrevivem.159
O prognóstico nos casos com infecção por HIV e reativação da doença de Chagas era reservado, antes do advento da terapia antirretroviral altamente ativa (HAART), com sobrevida média estimada em 10 dias.20 No paciente imunodeprimido, a gravidade depende do grau de imunossupressão, da carga parasitária e da sensibilidade do isolado ao medicamento antiparasitário, sendo os registros de desfechos favoráveis em transplante de rim decorrentes de monitoramento, diagnóstico e tratamento precoces. O quadro clínico é bastante grave em recém-nascidos com infecção congênita de mãe coinfectada, havendo elevada morbimortalidade.173-175
FORMA CRÔNICA INDETERMINADA DA DOENÇA DE CHAGAS
A forma crônica indeterminada (FCI) tem particular relevância, por ser a forma clínica de maior prevalência na doença de Chagas, além do evidente caráter benigno e do baixo potencial evolutivo em curto e médio prazos.19,20,39,188-191
Com a redução da incidência de doença de Chagas aguda e com a melhora do manejo clínico, os casos de doença de Chagas crônica estão tendo sua sobrevida ampliada, com avanço na idade, refletindo a tendência à redução proporcional da FCI em idades avançadas.19,189,192-194
Por outro lado, desde o último Consenso Brasileiro, em 2005,20 não surgiu efetivamente nenhuma estratégia aplicável de propedêutica clínica ou complementar pertinente ao conceito clássico de FCI.
Critérios diagnósticos
São considerados portadores da FCI da doença de Chagas os indivíduos em fase crônica com sorologia reagente e/ou exame parasitológico positivo para T. cruzi188,189 que não apresentam síndrome clínica específica da doença, e com resultados de ECG convencional, estudo radiológico de tórax, esôfago e cólon normais.188 Ressalta-se que não há a necessidade de utilização de outros exames complementares, além daqueles já indicados previamente, para a definição da FCI.
A expressão forma crônica indeterminada foi empregada pela primeira vez por Carlos Chagas e consagrou-se pelo seu uso,195-198 tendo sido consolidada por investigadores brasileiros em 1984, principalmente para uso em pesquisas científicas.20,142,188,199
Em estudos de campo e na assistência, para casos assintomáticos e com exame físico, ECG convencional e radiografias de tórax e de esôfago normais, tem sido utilizado o termo FCI sem a realização de propedêutica radiológica do cólon.19,189-191 Justifica-se tal conduta, considerando-se a baixa disponibilidade e exequibilidade destes exames complementares no real contexto dos sistemas nacionais de saúde.
Tratamento e seguimento clínico
O tratamento antiparasitário específico está indicado para todos os casos com FCI (ver a seção específica sobre tratamento antiparasitário deste Consenso).20,39
Enquanto o ECG estiver normal, o prognóstico dos casos com doença de Chagas na FCI é semelhante ao da população geral, sendo que a realização desse exame de maneira seriada pode detectar a evolução para a forma cardíaca.20,189,192,197 Com base nessa noção essencial, não se recomenda realizar outros exames complementares de rotina enquanto o ECG for normal.19,20,189-191
Os casos com a FCI devem ser orientados para não se candidatarem à doação de sangue, e, em princípio, à doação de tecidos e órgãos.20,39 Em virtude dessa benignidade, não se justifica a prática, ainda comum, de solicitação de exames sorológicos específicos para doença de Chagas na avaliação pré-admissional para fins trabalhistas e nos exames periódicos realizados por instituições e/ou empresas de natureza pública ou privada.192,200-202 Quanto aos demais exames complementares, poderão ser solicitados segundo as especificidades da atividade laboral que o indivíduo irá exercer. Da mesma forma, nestes casos, não se recomenda o afastamento temporário ou definitivo das atividades laborais.192,200-203
A prática de atividades físicas regulares habituais não está contraindicada para portadores da FCI. Para as atividades profissionais que envolvem risco individual e coletivo que podem requerer grande demanda de esforço físico e/ou estresse psicológico, recomenda-se a adoção da avaliação específica cardiológica complementar. Não existe restrição à atividade sexual para os portadores da FCI.192,200-202
Os portadores da FCI deverão ser atendidos, preferencialmente, nos serviços de atenção básica (atenção primária à saúde), recomendando-se a realização de avaliação médica e ECG convencional uma vez por ano.20,202 Caso seja constatada evolução da doença, estes casos deverão ser encaminhados para serviços de saúde de maior complexidade, com vistas à orientação mais precisa (com vistas à definição da sequência de condutas) para manejo integrado com as equipes de atenção básica (referência e contrarreferência).
A FCI não interfere no manejo de doenças associadas e não justifica que sejam negligenciados o seguimento e o tratamento de comorbidades que, eventualmente, possam estar presentes nessa condição.49,197,203,204 Se houver a ocorrência de imunodeficiência (adquirida ou induzida) em casos com a FCI, atenção especial deve ser dada à possível reativação da doença (ver parte específica sobre reativação da doença de Chagas).20,49,159 O risco cirúrgico do portador de FCI não difere do verificado na população em geral não infectada.20,194,200,202,203
Em relação às gestantes infectadas por T. cruzi com essa classificação, recomenda-se atenção quanto à possibilidade de transmissão vertical, oportunizando-se avaliação adequada do recém-nascido (ver parte específica sobre transmissão vertical).20,202,39 Mulheres portadoras da FCI não devem restringir a amamentação, exceto na vigência de fissura e/ou sangramento mamilar.20,202
Ressalta-se que os profissionais de saúde devem evitar a adoção de qualquer prática que possa induzir estigma ou preconceito. Os serviços de saúde devem oferecer espaços e recursos para aconselhamento, esclarecimento e orientação da população quanto às particularidades dessa forma da doença, recomendando-se fortemente que esta abordagem seja conduzida por equipe multiprofissional.20,189-191,193,202
FORMA CARDÍACA DA DOENÇA DE CHAGAS
A cardiopatia chagásica crônica (CCC) é a forma clínica sintomática mais prevalente da doença de Chagas, responsável pela elevada carga de morbimortalidade, com grande impacto social e médico-trabalhista.4,19,20 Recentemente, tem sido consolidada a noção de que a patogenia da agressão miocárdica na fase crônica da doença de Chagas depende principalmente da persistência parasitária e da resposta do sistema imunológico desfavorável a esse estímulo infeccioso incessante.205-208
Entre as características mais peculiares da CCC, destacam-se seu caráter inflamatório e intensamente fibrosante, presença de arritmias ventriculares complexas em associação com distúrbios da formação e condução do estímulo elétrico atrioventricular e intraventricular, elevada incidência de morte súbita e de fenômenos tromboembólicos, além de disfunção ventricular direita e aneurismas ventriculares.209-214
Antes restrita à transmissão vetorial da doença de Chagas, hoje rara no Brasil, a doença de Chagas aguda e, consequentemente, a cardite chagásica aguda, ampliou sua importância epidemiológica tanto no Brasil quanto em outros países, endêmicos e não endêmicos, devido à reativação da doença em indivíduos imunocomprometidos, favorecida pela disseminação e cronificação da infecção por HIV/aids, bem como pelo maior acesso a técnicas de transplante. Acrescenta-se a este cenário o desafio representado pela endemia na Amazônia, atribuída à transmissão oral. Como consequência da mudança de perfil epidemiológico de transmissão da doença, recrudesceram os casos de cardiopatia chagásica aguda que, na atualidade, apresentam aspectos clínicos e epidemiológicos peculiares.76,91,92,169,170
Ressalta-se a importância da composição de uma rede de atenção à saúde resolutiva para as pessoas com doença de Chagas, em especial o papel da atenção básica no primeiro contato e na prevenção secundária da doença. A partir do reconhecimento do contexto dos casos clínicos, esta rede de atenção primária deve se integrar à rede de matriciamentos/referência para situações de maior complexidade.
Cardiopatia Chagásica Aguda
1 - Miocardite chagásica aguda por transmissão oral
Na Amazônia Legal, principalmente, tem sido observado registro sistemático de casos da forma aguda, isolados ou em surtos, em microepidemias familiares, cuja principal forma de transmissão ocorre por via oral, envolvendo alimentos contaminados com fezes de triatomíneos.21,76 A apresentação clínica difere da cardite chagásica aguda clássica (vetorial) principalmente pela ausência de evidência de porta de entrada (chagoma de inoculação) e pelo acometimento de grupos comunitários ou familiares em surtos, não sendo identificada uma faixa etária de infecção ou gravidade preferenciais.91,169
As manifestações clínicas da doença aguda por transmissão oral são variáveis, observando-se desde quadros assintomáticos até casos que evoluem com insuficiência cardíaca grave, choque cardiogênico e mesmo óbitos. Pode apresentar-se, também, como síndrome infecciosa inespecífica, com febre prolongada, em geral por mais de três semanas.
As manifestações da cardite aguda estão descritas na Figura 3.215
Exames laboratoriais
A telerradiografia de tórax pode ser normal ou pode evidenciar cardiomegalia em graus variáveis e derrame pleural.
O ECG mostra-se alterado na maioria dos casos agudamente infectados. Os principais sinais eletrocardiográficos são representados por alterações inespecíficas da repolarização ventricular, seguidas de intervalo QTc prolongado, sobrecarga de átrio esquerdo, baixa voltagem dos complexos QRS, bloqueios atrioventriculares, bloqueios de ramo, taquicardia sinusal e fibrilação atrial.216
O ecocardiograma pode detectar derrame pericárdico, regurgitação valvar atrioventricular, aumento das dimensões das câmaras cardíacas, presença de trombos intracavitários e alterações da função sistólica ventricular esquerda.
Tratamento
O manejo farmacológico da cardiopatia chagásica aguda é o mesmo preconizado para o tratamento da insuficiência cardíaca (IC) em miocardites agudas de outras etiologias, sendo baseado na utilização rotineira da combinação de três tipos de fármacos: diuréticos, inibidores da enzima de conversão da angiotensina (IECA) ou bloqueadores do receptor AT1 da angiotensina II (BRA) e betabloqueadores, sempre associados ao tratamento específico da infecção por T. cruzi com benznidazol ou nifurtimox.203
A história natural da fase aguda da cardite chagásica por transmissão oral da doença de Chagas ainda não é totalmente conhecida. Os casos mais graves, com disfunção ventricular, derrame pericárdico e fibrilação atrial, tendem a ter pior evolução na fase aguda, necessitando de tratamento em ambiente de terapia intensiva.
2 - Miocardite chagásica aguda em imunocomprometidos
Indivíduos infectados por T. cruzi, quando também expostos a agentes imunossupressores ou apresentam outra doença concomitante, como neoplasias e outras infecções, especialmente a infecção por HIV, podem apresentar reativação da doença de Chagas. A frequência desta reativação não é totalmente conhecida, porém, em estudo prospectivo no qual foram avaliados casos no período pré e pós-terapia antirretroviral, verificou-se ocorrência de reativação em 20% dos casos.48
O coração parece estar envolvido em aproximadamente 30 a 40% dos casos de reativação da doença de Chagas em indivíduos coinfectados com HIV. No entanto, a ocorrência de miocardite, isoladamente, parece não ser comum. O comprometimento cardíaco é habitualmente caracterizado por quadro de miocardite aguda, com acometimento difuso ou focal do órgão. Clinicamente, caracteriza-se por sinais ou sintomas de insuficiência cardíaca (taquicardia, edema, hepatomegalia) ou arritmias graves. Em alguns casos são observadas apenas alterações eletrocardiográficas e, em outros, a existência de miocardite é confirmada unicamente por exame histopatológico em material de biopsia endomiocárdica. O exame anatomopatológico revela miocardite aguda com infiltrado inflamatório intenso, agressão às fibras cardíacas com necroses focais e grande número de formas amastigotas do parasita.217 Nos casos em que há, previamente, comprometimento cardíaco (por CCC), pode haver sobreposição de reativação da doença de Chagas com descompensação da cardiopatia chagásica preexistente, sendo complexo definir se o quadro se deve unicamente à reativação da doença de Chagas, à miocardite pelo próprio HIV ou à sobreposição das duas condições.218 A miocardite aguda por reativação da infecção por T. cruzi pode ser confundida, também, com progressão e agravamento naturais da CCC. O diagnóstico diferencial entre essas duas condições é importante para a tomada de decisão de se efetuar o tratamento específico da infecção por T. cruzi ou não, visto que muitos casos não toleram a medicação. Níveis altos de parasitemia são indicativos de reativação, mas há registro de casos que evoluíram com baixa parasitemia.219
Diagnóstico
A confirmação da reativação da doença de Chagas na imunossupressão é realizada por visualização do parasito no sangue periférico, nos fluidos orgânicos (líquor, derrames cavitários etc.), por métodos diretos de observação ou nos locais das lesões orgânicas (coração, tegumento etc.) em indivíduos com a coinfecção.48
Tratamento
Não há medidas específicas para este grupo de casos, devendo-se seguir as recomendações baseadas em evidências desenvolvidas para tratamento da insuficiência cardíaca de modo geral.
A insuficiência cardíaca aguda descompensada, resultante da falência ventricular e de suas repercussões hemodinâmicas, associa-se à ativação neuro-humoral e a sintomas de congestão e/ou baixo débito cardíaco. O reconhecimento precoce dessa condição e a aplicação de medidas terapêuticas adequadas para a IC, associada ao tratamento específico da infecção por T. cruzi, podem reduzir o elevado coeficiente de letalidade observado nos casos de miocardite por reativação em contextos de imunocomprometimento.
Cardiopatia Chagásica Crônica (CCC)
Definição
Define-se CCC como a presença de alterações eletrocardiográficas sugestivas de comprometimento cardíaco, próprias da doença de Chagas, em indivíduo sintomático ou não. Por se tratar de método de fácil acesso e com elevada sensibilidade e especificidade (próximo de 90%), o ECG convencional alterado é utilizado, a priori, como elemento sugestivo do diagnóstico de CCC em pessoas cronicamente infectadas por T. cruzi.20
O acometimento cardíaco na fase crônica da doença de Chagas inclui amplo espectro de manifestações, variando desde a presença de anormalidades clinicamente inaparentes, até formas graves, como insuficiência cardíaca terminal, complicações tromboembólicas, arritmias ventriculares refratárias e morte súbita.
Tendo como referência apenas o ECG convencional de 12 derivações, é possível estabelecer, de maneira simplificada, o grau de comprometimento cardíaco e a rotina de avaliação do portador de cardiopatia chagásica, conforme demonstrado no fluxograma a seguir20 (Figura 4). Casos com alterações eletrocardiográficas inespecíficas não seriam diagnosticados com CCC, mas devem ser reavaliados segundo a concomitância de sintomas e eventuais alterações de outros exames adicionais.
Estadiamento da CCC
Presença de insuficiência cardíaca grave (classe funcional III e IV da New York Heart Association - NYHA) e disfunção sistólica global do ventrículo esquerdo são os fatores prognósticos mais importantes na CCC.220-223
O ecocardiograma permite avaliar tanto a função miocárdica global quanto a segmentar, além de identificar marcadores importantes para estadiamento da cardiopatia, como dimensões das câmaras, alterações de mobilidade segmentar e presença de aneurismas e tromboses murais. Por esses motivos e por constituir exame não invasivo e de baixo custo, apresenta grande valor para o estadiamento inicial da CCC, em associação à classificação funcional da NYHA. Sob o ponto de vista prognóstico e terapêutico, é possível identificar cinco subgrupos distintos de casos com CCC, conforme apresentado na Figura 5.223-226
Além do comprometimento da função miocárdica, distúrbios de ritmo e anormalidades da condução do impulso elétrico constituem relevantes alterações na CCC; em alguns casos, inclusive, as arritmias ocorrem isoladamente, sem disfunção ventricular global, ou somente com pequenas discinesias regionais.227-232
Havendo disponibilidade de realização do exame, e obrigatoriamente em todos os casos com suspeita de arritmias, a análise de um registro eletrocardiográfico de 24 horas (Holter) estaria indicada. De modo menos frequente, pode-se recorrer a um teste ergométrico como sucedâneo ao Holter, para evidenciação de arritmias ventriculares durante o esforço físico padronizado. Quando possível, os dois métodos devem ser realizados, pois são complementares na avaliação desses casos.
Há ainda um grupo de casos na fase crônica da doença de Chagas (não incluído na classificação acima), que apresenta ECG normal, mas tem alterações, geralmente discretas e não associadas a maior risco de óbito, em outros testes cardiológicos, como ecocardiograma, cintilografia miocárdica e ressonância nuclear magnética. Entretanto, como o risco de evolução nesses casos para a forma cardíaca, classicamente definida, parece ser maior em comparação a casos com doença de Chagas sem essas alterações, os mesmos devem ser acompanhados do ponto de vista clínico de modo mais frequente.231,232
Prognóstico da CCC
Em revisão sistemática dos estudos que utilizaram análise multivariada para avaliação do prognóstico na CCC,233 quatro variáveis prognósticas independentes foram identificadas: classe funcional III/IV da NYHA, cardiomegalia à telerradiografia de tórax, disfunção sistólica do ventrículo esquerdo e taquicardia ventricular não sustentada (TVNS) ao Holter. Utilizando-se essas quatro variáveis, de forma integrada, é possível elaborar um algoritmo capaz de estratificar o prognóstico de casos com CCC (Figura 6).
É importante ressaltar que a presença de classe funcional III ou IV da NYHA, per se, identifica casos de alto risco, uma vez que praticamente todos estes casos apresentam disfunção ventricular sistólica ao ecocardiograma e TVNS ao Holter. Já a combinação de disfunção ventricular com TVNS (independentemente da classe funcional) identifica grupo com risco aproximadamente 15 vezes maior quando comparado a casos sem essas duas variáveis.222,233,234
I - Síndrome arrítmica
Arritmias ventriculares
As arritmias ventriculares são frequentes na doença de Chagas e são dos mais variados tipos, compreendendo as extrassístoles ventriculares (EVs) isoladas e em pares, a TVNS, a taquicardia ventricular sustentada (TVS) e a fibrilação ventricular (FV).237 Comumente apresentam-se em associação, podendo expressar-se, clinicamente, por palpitações, lipotimias, síncope e morte súbita.237,238 Síncope e demais sintomas de baixo débito em casos com CCC devem ser rapidamente investigados, pelo risco de arritmias ventriculares complexas e morte súbita.
Extrassístole ventricular representa a arritmia mais comum. De início pouco frequente, monomorfa e isolada, torna-se polimorfa e repetitiva com a evolução da doença. O Holter e o teste ergométrico são métodos de escolha para a detecção das arritmias ventriculares e, quando possível, devem ser realizados em todos os casos com CCC, independentemente da presença de sintomas.42 A taquicardia ventricular pode apresentar-se de forma sustentada (duração igual ou superior a 30 segundos ou inferior a este período quando interrompida, elétrica ou farmacologicamente) e não sustentada (3 batimentos cardíacos ou mais e duração inferior a 30 segundos).
A TVNS relaciona-se com o grau de disfunção ventricular, ocorrendo em cerca de 40% dos casos com CCC associada a alterações regionais da contratilidade ventricular, e em 90% dos casos com disfunção sistólica global de ventrículo esquerdo associada a insuficiência cardíaca.222,237 Eventualmente pode ocorrer em casos com função ventricular normal.234 Há evidências de que a densidade (frequência) da arritmia ventricular seja maior na insuficiência cardíaca de etiologia chagásica do que nas de outras etiologias.239 A TVS, de pior prognóstico, pode ocorrer espontaneamente ou ser reproduzida ao estudo eletrofisiológico, exame indicado em casos cuja história implique esta hipótese diagnóstica e ainda não se tenha conseguido sua comprovação pelos métodos não invasivos.240 A FV constitui a principal causa de morte súbita na CCC, sendo mais frequente quando há episódios prévios de taquicardia ventricular, mas pode ser a primeira manifestação da doença ou seu evento terminal, principalmente nos casos com grave disfunção ventricular e ICC.238
Tratamento das arritmias ventriculares
O tratamento antiarrítmico tem dois objetivos principais: controlar sintomas e prevenir a morte súbita.237 As arritmias ventriculares simples (EV isoladas e monomorfas), como não estão associadas a risco aumentado de óbito, devem ser tratadas apenas se causarem sintomas limitantes às pessoas acometidas, sendo que o tratamento é indicado para se utilizarem doses habituais de amiodarona, sotalol ou betabloqueadores.
Em casos com arritmias potencialmente letais (TVNS, TVS e FV), o antiarrítmico mais eficaz e de uso mais seguro é a amiodarona.241 Deve-se estar atento aos efeitos colaterais deste fármaco, que se relacionam geralmente à dose total acumulada, que pode desencadear bradiarritmias graves, devendo-se, nesses casos, avaliar a necessidade de implante de marca-passo definitivo. Toxicidade extracardíaca, disfunção tireoidiana e anormalidades dermatológicas não são incomuns, enquanto a toxicidade pulmonar grave é rara.242 Recomenda-se, no mínimo, avaliação periódica da função tireoidiana em casos sob tratamento com amiodarona.
Por sua vez, os casos com TVS (condição relativamente frequente) e aqueles recuperados de parada cardiorrespiratória em ambiente extra-hospitalar (condição muito mais rara) apresentam risco elevado de óbito e merecem avaliação rigorosa. Para estes casos, dispõe-se não apenas de fármacos antiarrítmicos, mas também de técnicas de ablação do foco arrítmico por cateter (ou, raramente, por cirurgia) e, principalmente, de cardioversor-desfibrilador implantável (CDI).237
O tratamento das arritmias ventriculares na CCC é descrito resumidamente na Figura 7. O tratamento farmacológico e as recomendações de CDI estão descritos nas Figuras 8 e 9, respectivamente.

Figura 8 Recomendações e níveis de evidências para o uso de fármacos antiarrítmicos no tratamento das arritmias ventriculares na CCC
Arritmias supraventriculares
A fibrilação atrial é a arritmia supraventricular sustentada mais frequente na CCC, sendo encontrada em 4 a 12% dos casos.229 Tende a se apresentar mais tardiamente, frequentemente associada à cardiomegalia pronunciada. O tratamento consiste no controle da frequência ventricular, que pode ser obtido por meio do uso de fármacos que prolongam o período refratário do nó atrioventricular (AV). Se houver insuficiência cardíaca associada, dá-se preferência aos digitálicos e aos betabloqueadores (succinato de metoprolol, carvedilol ou bisoprolol). Se a função ventricular estiver normal, recomenda-se o uso de betabloqueadores convencionais (propranolol e atenolol) ou de bloqueadores do canal de cálcio (verapamil e diltiazem) para controle inicial da frequência cardíaca, com avaliação posterior da possibilidade de cardioversão elétrica ou farmacológica. A anticoagulação está indicada sempre que a fibrilação atrial estiver associada à cardiomegalia e à insuficiência cardíaca, CHA2DS2VASc≥2, ou quando houver evidências de trombose intracavitária ou de episódios embólicos prévios. O fármaco de escolha é a warfarina, em dose suficiente para manter o fator de normatização internacional (RNI) entre 2 e 3.243
Bradiarritmias
O tratamento das bradiarritmias na CCC não difere daquele recomendado para as cardiomiopatias de outra natureza. Consiste no implante de marca-passo cardíaco definitivo em casos sintomáticos ou de bloqueios de alto risco. Essas recomendações encontram-se bem definidas nas Diretrizes Brasileiras de Dispositivos Cardíacos Eletrônicos Implantáveis, publicadas em 2007.244
É comum na CCC a associação entre distúrbios do sistema de condução do coração e arritmias ventriculares frequentes e complexas. Nesses casos, a terapia farmacológica antiarrítmica eficaz pode requerer o implante de marca-passo permanente, com o objetivo de prevenir eventual bloqueio atrioventricular ou bradiarritmia de alto risco induzida pelo antiarrítmico. A escolha do modo de estimulação é, até o presente momento, objeto de controvérsia na literatura.
II - Síndrome de insuficiência cardíaca (IC)
Na fase aguda da doença de Chagas, pode ocorrer insuficiência cardíaca, decorrente da intensa miocardite. Embora o desfecho possa ser o óbito, na maioria dos casos, ela é reversível, com evolução para a forma indeterminada da doença. Aproximadamente 30 a 40% dos casos com a forma indeterminada desenvolverão a forma cardíaca, geralmente após décadas de evolução.42,236
A forma cardíaca crônica, caracterizada pelo aparecimento gradual de alterações eletrocardiográficas, é causada, pela lenta - mas persistente - destruição das fibras miocárdicas, causada por processo inflamatório crônico incessante, com intensa fibrose reparativa e remodelamento ventricular progressivo.208
Na fase inicial da cardiopatia crônica, não é incomum que apenas o ECG se mostre alterado, permanecendo os indivíduos assintomáticos, capazes de exercer atividade física irrestrita, por vezes extrema. Enquadram- se, portanto, na classe I da NYHA.227,230,239
Raramente, nesse grupo de casos, a primeira e única manifestação da CCC é a morte súbita.245 No mais das vezes, instala-se progressiva redução da capacidade física, acompanhando a deterioração da função contrátil do ventrículo esquerdo, inicialmente na forma de discinergias regionais e disfunção diastólica, e, posteriormente, com queda da função sistólica global da câmara, mercê de fatores diversos que se associam, como a progressiva destruição de cardiomiócitos, as alterações microvasculares, a desestruturação do arcabouço muscular e a fibrose.208,236,247 Não é comum que casos com doença de Chagas na fase crônica apresentem edema pulmonar agudo. Também há muitos casos com CCC nos quais as manifestações iniciais de insuficiência cardíaca são a fadiga e o edema, sem grande percepção de dispneia.246,247 Nesses casos há acometimento precoce, às vezes intenso, da função sistólica do ventrículo direito. Nas fases mais avançadas da doença, quando a insuficiência cardíaca se manifesta em plenitude, podem surgir sintomas e sinais predominantes de congestão sistêmica, mas com congestão pulmonar pouco expressiva. A telerradiografia de tórax mostra acentuada cardiomegalia, com pouco reforço da trama vascular pulmonar. É importante a identificação de sinais precoces de insuficiência sistólica ventricular esquerda, pois o tratamento, nessa fase inicial, poderia, em tese, retardar a deterioração da função cardíaca contrátil.42,227 Além disso, é a disfunção sistólica do ventrículo esquerdo o mais importante indicador de risco na fase crônica da cardiopatia da doença de Chagas.222,224,225
Tratamento da insuficiência cardíaca no caso com CCC
O tratamento da insuficiência cardíaca visa reduzir os sintomas, retardar a evolução da disfunção ventricular e prolongar a sobrevida.20
O tratamento da insuficiência cardíaca de etiologia chagásica, assim como de outras etiologias, deve ser abrangente, começando por medidas gerais, remoção dos fatores que contribuem para o agravamento da insuficiência cardíaca e tratamento da síndrome propriamente dita.248,249
Medidas gerais
Dieta: deve-se corrigir a obesidade e manter o peso ideal, evitar ingestão inadequada de cloreto de sódio e, em casos específicos, aliviar os sintomas de disfagia e constipação intestinal.
Controle da retenção hídrica: ingestão balanceada de sal - até 3 a 4g/dia de cloreto de sódio (doença leve e moderada) e até 2g/dia (casos mais graves). Um modo simples e confiável de avaliar a retenção hídrica é a realização do controle diário do peso corpóreo. Variações superiores a 1kg por dia são indicativas de retenção de líquido. Um ganho de peso rápido e constante (1kg/dia) constitui indício de que a insuficiência cardíaca está se agravando. As pessoas acometidas devem ser estimuladas a controlar o peso diariamente pela manhã (após urinar e em jejum). Na insuficiência cardíaca grave, com hipervolemia e/ou hiponatremia, a restrição da ingestão de líquidos poderá ser necessária.
Controle dos fatores agravantes: convém evitar a ingestão abusiva de álcool e o uso de anti-inflamatórios; controlar hipertensão arterial, arritmias cardíacas, anemia ou distúrbios da função tireoidiana. Outras comorbidades podem contribuir para o agravamento da insuficiência cardíaca, como a doença arterial coronariana e o diabetes mellitus.
Individualização das recomendações de repouso ou de atividade física, de acordo com o grau da insuficiência cardíaca e a idade da pessoa.
Vacinação contra influenza (anualmente) e antipneumocócica 23-valente (um reforço após cinco anos para aqueles casos com sistema imunológico comprometido, ou adultos com idade acima de 60 anos que tenham recebido a primeira dose antes dos 65 anos de idade).
Tratamento medicamentoso da IC causada pela doença de Chagas
No momento de finalização deste Consenso, foram publicados os resultados do estudo BENEFIT, um ensaio clínico, duplo-cego, multicêntrico, que testou a hipótese de que o tratamento tripanosomicida com benznidazol, comparativamente a placebo, poderia modificar o prognóstico de pacientes com cardiopatia chagásica crônica.250,251 Foram avaliados 2.854 pacientes, designados aleatoriamente para receber benznidazol ou placebo por até 80 dias, com um tempo médio de seguimento de 5,4 anos, sendo observada redução da carga parasitária, sem reflexo no agravamento dos problemas cardíacos (estimado por complicações ocorridas durante seguimento clínico, como morte, arritmias ventriculares, implante de dispositivos, eventos tromboembólicos, insuficiência cardíaca ou transplante cardíaco) (27,5% no grupo com benznidazol e 29,1% no grupo com placebo, Hazard Ratio (HR) = 0,93; IC 95%, 0,81-1,07; p = 0,31),251 diferindo dos resultados de estudos observacionais prévios.252,253 Estes resultados deslocam o foco de atenção ao tratamento do paciente com CCC para o tratamento clássico da disfunção sistólica e da IC derivada de outras cardiopatias.254
O tratamento de longo curso da IC baseia-se habitualmente na combinação das seguintes classes de medicamentos: diuréticos; IECA ou BRA; betabloqueadores adrenérgicos (BB); e antagonistas da aldosterona.248
Fármacos inotrópicos positivos (como catecolaminas ou milrinona) têm sua aplicabilidade restrita a condições de tratamento intensivo e pouco prolongado da descompensação cardíaca, à exceção do digital, que pode ser administrado cronicamente em indivíduos sem bradiarritmias para aliviar sintomas, evitando descompensações cardíacas e internações hospitalares, especialmente se ocorrer fibrilação atrial com resposta ventricular rápida.255
Os diuréticos de alça e os tiazídicos podem ser utilizados separadamente ou em combinação para aliviar os sintomas e sinais de congestão venosa pulmonar e sistêmica. Quando for imperativo o uso de doses elevadas de diuréticos de alça, como a furosemida, deve-se estar atento à maior probabilidade de ocorrência de hipocalemia e/ou hiponatremia que, por sua vez, podem agravar ou desencadear arritmias.248
Na CCC com IC ou disfunção sistólica assintomática (FE <45%), há indicação de administração crônica de IECA para reduzir a morbimortalidade ou de BRA, quando houver intolerância a IECA.256 Com o mesmo objetivo, recomenda-se o uso de espironolactona em casos com IC, em classes funcionais II a IV - NYHA.248 Além disso, considera-se que os antagonistas da aldosterona possam trazer benefício adicional, quando utilizados na CCC, por suas propriedades antifibrosantes, demonstradas em estudos experimentais. A combinação de hidralazina e nitrato é alternativa recomendável para tratar casos em classe funcional II-III que apresentem contraindicação ao uso de IECA ou BRA (por exemplo, insuficiência renal progressiva ou hipercalemia).248
É recomendável o uso de betabloqueadores adrenérgicos em adição ao bloqueio do sistema renina-angiotensina-aldosterona (com IECA ou BRA) para reduzir a morbimortalidade associada à doença. Supõe-se que esses fármacos possam contribuir para evitar o agravamento do remodelamento ventricular e a instalação de arritmias malignas e morte súbita.257,258 Entretanto, o uso em dose otimizada dos bloqueadores adrenérgicos pode ser dificultado na CCC, em virtude das bradiarritmias e da necessidade frequente de administração de amiodarona para o tratamento das taquiarritmias. Até o momento, não há um consenso entre especialistas no manejo da doença de Chagas sobre qual dos fármacos, betabloqueadores ou amiodarona, deva ser priorizado.
Formas complementares de tratamento da IC causada pela doença de Chagas
O transplante cardíaco é o tratamento de escolha na fase terminal da IC, a despeito das inúmeras limitações de cunho médico e social que embargam seu uso mais ampliado em casos com a doença de Chagas. Os resultados obtidos em séries selecionadas de casos, comparativamente aos observados em casos com IC de outras etiologias, mostram evolução até mais favorável nos casos com doença de Chagas transplantados. Entre outros possíveis fatores, isso possivelmente se deve ao fato de que, nessas séries, os casos com doença de Chagas eram mais jovens e apresentavam número menor de comorbidades.259,260 Não há indicação definitiva de profilaxia, porém recomenda-se ativo controle de possível reativação da doença, principalmente no primeiro ano pós-transplante, quando a imunossupressão é mais intensa, devendo ser prontamente iniciado o benznidazol na dose de 5mg/kg/dia, mantido por 60 dias, obtendo-se, desta forma, boa evolução clínica.100
Não há evidências que embasem indicação rotineira da terapêutica de ressincronização cardíaca (TRC). Além de não existirem estudos controlados explorando de forma cientificamente válida essa possibilidade terapêutica, na CCC o bloqueio completo do ramo direito é frequente e, em presença desta condição, as evidências sobre os benefícios da TRC, mesmo em outras etiologias de IC, são ainda mais escassas e menos convincentes.203,244
Terapias à base de implantes celulares foram recentemente exploradas em um único estudo, devidamente controlado. Seus resultados não evidenciaram qualquer benefício, mesmo sobre desfechos substitutos como a fração de ejeção ventricular esquerda.261
As classes de recomendações e os níveis de evidências para o tratamento da insuficiência cardíaca na CCC estão sumarizados na Figura 10.
III - Síndrome tromboembólica
Eventos tromboembólicos sistêmicos e pulmonares são comuns na CCC, sendo os pulmonares certamente subdiagnosticados quando considerados os resultados de estudos necroscópicos.262 Os eventos embólicos são favorecidos por combinação de vários fatores, sendo os mais relevantes a estase venosa, a redução do débito cardíaco e a trombose mural intracardíaca, favorecida pelas discinergias ventriculares localizadas (por exemplo, aneurisma apical), dilatação das câmaras cardíacas e fibrilação atrial em estádios mais avançados da cardiopatia.
Prevenção de complicações tromboembólicas na CCC
Os acidentes embólicos no sistema nervoso central constituem a forma mais grave de tromboembolismo na CCC e contribuem para a elevada morbimortalidade da doença.263
O embasamento científico para tratamento antitrombótico na CCC ancora-se no estudo de coorte prospectiva de 1.043 casos, que avaliou o risco e definiu as estratégias de prevenção do acidente vascular encefálico (AVE) cardioembólico.264 Nesse estudo, a incidência de AVE foi de 3,0% ou 0,56% ao ano, e a análise estatística multivariada permitiu a composição de um escore de risco para ocorrência de AVE: presença de disfunção sistólica do VE contribuiu com 2 pontos; presença de aneurisma apical, alteração primária da repolarização ventricular no ECG e idade superior a 48 anos contribuíram com 1 ponto cada. A warfarina estaria indicada para casos com 4-5 pontos (neste subgrupo, há incidência de AVE de 4,4% versus 2,0% de sangramento grave ao ano). No subgrupo com escore de 3 pontos, as taxas de embolia e sangramento com anticoagulante oral se equivalem, podendo ser indicado AAS ou warfarina. Nos casos com 2 pontos, com baixa incidência de AVE (1,22% ao ano), foi recomendado AAS ou nenhuma profilaxia. Os casos com 0-1 ponto, com incidência do evento próximo a zero, não necessitariam de profilaxia. Obviamente que em casos com trombo intracavitário, fibrilação atrial associada a CHA2DS2VASc≥2 e acidente embólico prévio, o emprego de anticoagulante oral é sempre aconselhável, mantendo-se o RNI entre 2 e 3.264 As recomendações para anticoagulação oral na CCC estão descritas na Figura 11.
Abordagem da gravidez na CCC
A CCC ocupa o segundo lugar entre as cardiopatias presentes no ciclo gravídico-puerperal, mostrando-se inferior apenas à cardiopatia reumática. A maioria das gestantes com doença de Chagas são assintomáticas ou oligossintomáticas, sendo portadoras das formas indeterminada ou cardíaca inicial.
Os riscos da gestação na mulher com cardiopatia chagásica dependem do estado funcional cardíaco, bem como da presença e da gravidade das arritmias. Casos com IC e/ou arritmias devem ser desaconselhados a engravidar. As gestantes nessas condições requerem acompanhamento e cuidados especiais, pela possibilidade de agravamento durante a gestação. Na consulta inicial da gestante cardiopata com doença de Chagas devem ser solicitados, além dos exames de rotina, ECG e ecocardiograma, para avaliação das dimensões cardíacas e função ventricular e Holter de 24 horas, com vistas à identificação de distúrbios de condução e arritmias.265 Devem ser sempre observadas as contraindicações relativas e absolutas para uso de fármacos com ação sobre o sistema cardiovascular ou com potencial teratogênico.
As gestantes portadoras de CCC devem ser acompanhadas em centros de referência para gestação de alto risco, uma vez que poderão apresentar necessidade de atendimento de alta complexidade. Ressalta-se a importância de proceder a todas as avaliações recomendadas durante o pré-natal, incluindo necessariamente a testagem anti-HIV.20
Risco cirúrgico em portadores de cardiopatia chagásica crônica
A avaliação do risco cirúrgico na cardiopatia chagásica tem se ancorado nas informações disponíveis para outras cardiopatias. Entretanto, as características peculiares da CCC, principalmente aquelas relacionadas com a presença de disfunção autonômica, arritmias complexas e distúrbios da condução intraventricular do estímulo, podem provocar respostas diferentes ao trauma cirúrgico.266
Casos com comprometimento miocárdico mais grave (CF IV-NYHA ou FE <30%; disfunção sistólica moderada, porém com arritmia complexa; fibrilação atrial; dilatação importante de ventrículo esquerdo; BAV total e disfunção do nó sinusal) têm maior probabilidade de apresentar complicações peroperatórias.
Portadores de bradicardia sinusal assintomática que serão submetidos a cirurgia sob anestesia geral devem ser monitorizados sob o ponto de vista eletrocardiográfico durante o procedimento, que deve ser realizado em locais onde haja possibilidade de implante de marca-passo em caráter emergencial. Se a bradicardia for sintomática, deve ser avaliado o implante preventivo de marca-passo.
Quando houver fibrilação atrial com frequência ventricular alta, acima de 90 batimentos por minuto, independentemente do tipo de anestesia, os casos devem ser operados sob monitorização eletrocardiográfica contínua e sob digitalização prévia. Em casos com fibrilação atrial com frequência ventricular menor que 60 batimentos por minuto, deve-se considerar a possibilidade de ocorrer acentuada queda da frequência cardíaca por ação anestésica. Recomenda-se, nesses casos, que o procedimento cirúrgico seja realizado sob monitorização eletrocardiográfica contínua e em locais onde haja possibilidade de implante de MP em caráter emergencial. Os mesmos cuidados devem ser tomados em relação aos casos que apresentem BAV associado a bloqueios de ramo, pela possibilidade de desenvolverem BAV total durante o ato cirúrgico por ação de agentes anestésicos.266
Casos com arritmias ventriculares complexas devem ser avaliados ao Holter e operados após instituição de terapêutica antiarrítmica adequada. O procedimento cirúrgico deve ser realizado sob monitorização eletrocardiográfica contínua e em locais onde haja desfibrilador.
A avaliação pré-operatória de casos portadores de MP cardíaco envolve o conhecimento da arritmia que motivou o seu implante, bem como as características do gerador. Além da história clínica, dados importantes podem ser obtidos no cartão que os portadores de MP recebem e que identifica as principais características do dispositivo, como data do implante, frequência cardíaca programada, modalidade de funcionamento e fabricante.
Os principais riscos associados à presença de marca-passo durante procedimentos cirúrgicos ou diagnósticos consistem em alteração do limiar de funcionamento do aparelho (por ação de fármacos, alteração dos níveis de potássio sérico e mudanças da impedância torácica por ventilação pulmonar), fibrilação ventricular (condução da corrente elétrica do eletrocautério pelo eletrodo intracardíaco do marca-passo) e, finalmente, dano, inibição ou reprogramação do sistema pelo eletrocautério, por cardioversão ou por ressonância nuclear magnética. Sempre que possível, devem ser utilizados eletrocautérios bifásicos (bipolares), porque neles a corrente elétrica permanece circunscrita entre a região da cirurgia e o eletrocautério, reduzindo o risco de escape e de interferência com o dispositivo.244,267
Em todo caso, o bisturi elétrico deve ser utilizado o mínimo possível, em intervalos curtos e irregulares, mantendo-se a monitorização não apenas do ECG, mas também do pulso, através da pletismografia ou oxímetro de pulso. Caso ocorra bradicardia ou taquicardia acentuadas durante o uso do bisturi elétrico, pode-se utilizar um ímã sobre o marca-passo, o que o faz funcionar em sua resposta magnética programada. Convém atentar para o fato de que a colocação do ímã deve ser restrita aos curtos períodos de utilização do bisturi elétrico. O paciente deve ser orientado no pós-operatório a retornar à clínica de seguimento do marca-passo para avaliação do seu funcionamento e eventual reprogramação do seu gerador.267
Nos casos com CDI, deve ser recomendada a presença do técnico ou especialista na sala de cirurgia, devendo ser desligada a função antitaquicardia, com a equipe preparada para o tratamento de todas as eventuais arritmias, inclusive com cardioversão elétrica.244,267
Em caso de necessidade de cardioversão elétrica nos indivíduos com marca-passo, o ideal seria utilizar placas adesivas em posição anteroposterior do tórax, afastadas ao máximo do gerador, utilizando-se o mínimo de energia possível para resolução da arritmia. Da mesma forma, os limiares e o funcionamento do marca-passo devem ser idealmente avaliados após o procedimento.244
Avaliação médico-trabalhista
A CCC constitui importante causa de incapacidade laborativa em áreas endêmicas, onde deve ser objeto de ações de vigilância em saúde do trabalhador, incluindo a atenção básica. O exame clínico minucioso, com especial atenção ao aparelho cardiovascular, é componente básico das avaliações funcional e médico-trabalhista na CCC.268
Nessas avaliações, devem ser levados em consideração: o grau de disfunção ventricular; a presença, magnitude e complexidade dos transtornos de condução e de ritmo; e o relato de tromboembolismo. Importa também considerar as características da atividade laborativa exercida pelo trabalhador, especialmente a necessidade de esforço físico intenso ou continuado na atividade, assim como o grau de sua qualificação profissional e a possibilidade de inscrevê-lo em programa de reabilitação profissional.
A idade do trabalhador também deve ser considerada, visto que a possibilidade de evolução da cardiopatia é tanto maior quanto mais novo for o trabalhador e vice-versa. De modo geral, quanto pior a fração de ejeção e maior o diâmetro ventricular, pior o prognóstico e maior o grau de incapacidade laborativa.269
A presença de cardiomegalia e de disfunção ventricular significativa implica incapacidade laborativa para atividades que requeiram esforço físico e em invalidez, quando não for possível a reabilitação profissional. Em toda avaliação funcional, prognóstica e da capacidade laborativa de um indivíduo com doença de Chagas, deve-se levar em conta a grande variabilidade clínica desses casos, mesmo quando enquadrados em um mesmo estágio de qualquer classificação do comprometimento cardíaco. Frequentemente, mas nem sempre, transtornos avançados da condução do estímulo associam-se à gravidade do comprometimento miocárdico, levando à necessidade de avaliação complementar do grau de disfunção miocárdica, especialmente nos casos em que o trabalhador exerce atividade física intensa e de risco pessoal ou social (como, por exemplo, pilotos de aviação).270
FORMA DIGESTIVA DA DOENÇA DE CHAGAS
A forma digestiva da doença de Chagas, conquanto possa acometer todos os órgãos do trato gastrointestinal, manifesta-se, do ponto de vista prático, pelo acometimento do esôfago e do intestino grosso, levando ao aparecimento de megaesôfago e megacólon, respectivamente.20 A associação de megaesôfago e megacólon em casos com indicação de cirurgia é de aproximadamente 92% e de megaesôfago, megacólon e cardiopatia, de 65%.271
Casos com síndrome clínica digestiva compatível com as descritas a seguir, em contextos de risco e/ou vulnerabilidade para doença de Chagas, se ainda não houverem realizado, deverão ser aconselhados e orientados para a realização de investigação específica da infecção por T. cruzi.20
Diagnóstico
Manifestações digestivas na fase aguda da doença de Chagas
As manifestações clínicas são, na maioria das vezes, incaracterísticas e discretas, sendo os sintomas relacionados ao trato gastrointestinal, praticamente, imperceptíveis. No entanto, há relatos da ocorrência de hemorragia digestiva nos casos de transmissão oral e de disfagia em raros casos de transmissão vetorial.20
Manifestações digestivas na fase crônica da doença de Chagas
As manifestações digestivas da doença de Chagas concentram-se no esôfago e no cólon e são, basicamente, disfagia e constipação, decorrentes de alterações crônicas dos órgãos que podem levar a megaesôfago e/ou megacólon.20 Porém, como a doença causa lesões do sistema nervoso autônomo ao longo de todo o trato gastrointestinal, podem ocorrer alterações anátomo-funcionais das glândulas salivares, do estômago, das vias biliares extra-hepáticas, do duodeno, intestino delgado, intestino grosso e, até mesmo, de órgão não pertencente ao trato gastrointestinal (TGI), como o ureter. A prevalência de infecção por Helicobacter pylori e de alterações características histológicas e endoscópicas gástricas foi semelhante em pacientes com ou sem doença de Chagas. Além disso, estudos têm demonstrado que H. pylori representa a principal causa de gastrite nos pacientes com doença de Chagas.272
Os sintomas e sinais mais comuns do sistema digestivo, na fase crônica da doença de Chagas, estão descritos a seguir.
Diagnóstico clínico
Disfagia é o principal sintoma de pacientes com acometimento grave do esôfago. Outras queixas, associadas à disfagia, ocorrem nos casos de megaesôfago: ptialismo, soluços, odinofagia, regurgitação, sensação de sufocação noturna, pneumonia aspirativa e desnutrição.20 Nos estágios iniciais da doença, o paciente refere uma sensação de obstrução, no xifoide, após a ingestão de sólidos e, tardiamente, após a ingestão de líquidos, especialmente se ingeridos frios. A disfagia progride lentamente e é bem tolerada por muitos anos. Por isso, pacientes com acalasia frequentemente não procuram atendimento em serviços de saúde até que a disfagia progressiva interfira no seu estilo de vida. Observa-se que os próprios pacientes modificam espontaneamente seus hábitos alimentares para atenuar a disfagia.
Pacientes com acalasia se alimentam vagarosamente, ingerem grandes volumes de água para levar os alimentos até o estômago, costumam fletir o dorso, elevar o mento, estender o pescoço, ou andar para auxiliar o esvaziamento esofágico. A regurgitação do alimento não digerido é comum enquanto a doença progride, com risco de aspiração, podendo levar a pneumonia, abscesso pulmonar, bronquiectasia, hemoptise e broncoespasmo. Grandes distensões do esôfago dilatado podem produzir dispneia, por compressão do brônquio fonte ou do hilo pulmonar.
O acometimento esofágico ocorre em vários graus, com grande variação dos aspectos morfológicos e diferenças do comportamento motor do esôfago, variando desde alterações mínimas do trânsito esofágico até formas avançadas de dolicomegaesôfago, com tempo de trânsito esofagogástrico dos alimentos extremamente prolongado.20 Tendo em vista os aspectos práticos e terapêuticos, os pacientes com megaesôfago podem ser classificados em grupos, dependendo do grau de dilatação do órgão, conforme se verifica na Figura 12.273
A maior parte dos casos de megaesôfago encontra-se nos grupos II e III. O grau do megaesôfago não reflete, necessariamente, a duração da doença. Há casos que evoluem rapidamente para as formas avançadas, enquanto outros permanecem estabilizados nos estágios iniciais. A disfunção do esfíncter inferior do esôfago é maior nos casos em que a alteração motora do corpo do esôfago é mais evidente. Embora exista correlação entre o grau de megaesôfago e o sintoma disfagia, não é raro encontrar pacientes com volumosos megaesôfagos com queixa ou mesmo sem queixade disfagia.273
A incidência de câncer de esôfago em pacientes com acalasia idiopática é de 3,3%, correspondendo a aumento de mais de 15 vezes em relação à população geral, sem acalasia.274,275
Exames Complementares
- Radiografia simples de tórax em PA ou perfil: nos casos de megaesôfago grau III ou IV, a grande dilatação do esôfago ocupando o mediastino posterior pode ser identificada (Figura 13: A e B).
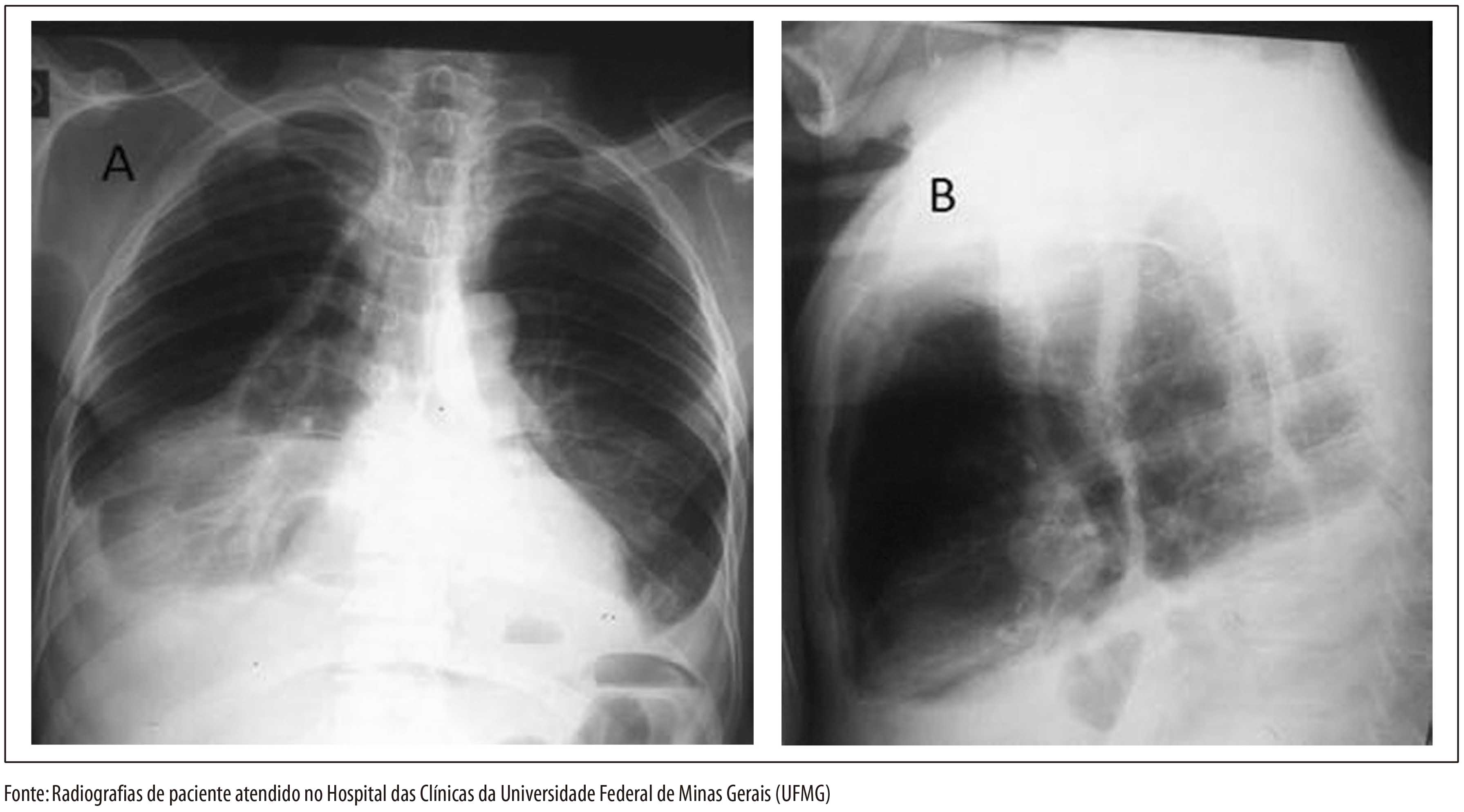
Figura 13 Radiografia simples de tórax em PA e perfil, em que se evidencia grande dilatação do esôfago alargando o mediastino posterior
- Radiografia contrastada do esôfago: demonstra não apenas o grau de dilatação do esôfago, permitindo classificar o megaesôfago, mas também as alterações funcionais, tais como ondas peristálticas anormais ou ausentes e o tempo de esvaziamento do conteúdo esofágico para o estômago. São características radiológicas do megaesôfago por doença de Chagas: aumento do diâmetro e do tempo de esvaziamento (Figura 14); terço distal afilado; retenção de restos alimentares; alongamento do esôfago/mediastino; diminuição da câmara de ar gástrica.
- Eletromanometria do esôfago: método útil no diagnóstico diferencial de outras afecções que evoluem com disfunção motora, expressa por disfagia. Nos pacientes sem dilatação, ou com dilatação discreta do esôfago (grupos I e II), podem ocorrer ondas de pressão não coordenadas no corpo do esôfago e relaxamento incompleto ou atípico do esfíncter inferior do esôfago (EIE), apesar de o estudo radiológico ainda não ter demonstrado anormalidade.276
- Endoscopia: embora não seja fundamental para a confirmação diagnóstica de megaesôfago, deve ser realizada para avaliar o grau de inflamação da mucosa e para afastar a presença de lesões neoplásicas em pacientes com disfagia, varizes e ulcerações. É exame útil nos casos de haver necessidade de dilatação forçada da cárdia com balão e nos casos de injeção de toxina botulínica.
Cólon
Diagnóstico Clínico
Os principais sinais e sintomas do megacólon são constipação, diarreia paradoxal (constipação intercalada por períodos de diarreia), disquesia, distensão abdominal e fecaloma.20 A manometria anorretal é útil para o diagnóstico da acalasia do esfíncter interno do ânus. A dilatação colônica localizada no reto e sigmoide é mais bem observada por estudo de radiografia contrastada, podendo ser detectada em até 80% dos casos, mas pode ocorrer também apenas no reto, apenas no sigmoide ou em todo o cólon.277 Deve-se ressaltar que casos de constipação grave em pacientes com megacólon idiopático não infectados por T. cruzi são indistinguíveis, sob o ponto de vista clínico, do megacólon por doença de Chagas.278
Exames Complementares
- Radiografia simples de abdome: megacólons volumosos podem ser detectados em radiografia simples de abdome, especialmente na presença de fecaloma. É útil, ainda, nos casos suspeitos de vôlvulo, pois pode demonstrar a rotação do sigmoide e a dilatação de alças de delgado causada pela obstrução (Figura 15).
Figura 15 Radiografia simples de abdome em caso de vólvulo do sigmoide. Notar posição anômala do sigmoide causada pela dilatação e a imagem característica de alças de delgado secundária à obstrução em decorrência do vólvulo
- Radiografia contrastada do cólon (enema opaco): é o exame padrão ouro para o diagnóstico de megacólon. Evidencia dilatação e/ou alongamento do cólon, presença de fecaloma e anormalidades na situação anatômica do sigmoide (Figura 16).
- Tomografia computadorizada e ressonância nuclear magnética: esses exames de imagem, mais modernos, vêm ocupando lugar de destaque na avaliação dos pacientes portadores de doença de Chagas e, aos poucos, substituindo os métodos convencionais de imagem. Ambos os métodos apresentam maior sensibilidade para avaliação de tecidos pericolônicos e/ou periesofágicos, podendo detectar infiltrações e massas não visíveis na radiografia convencional e fecalomas com mais acuidade do que o enema opaco (Figura 17: A, B e C).

Figura 17 Tomografia computadorizada de abdome, demonstrando grande megaesôfago com nível hidroaéreo do contraste ingerido (A); megacólon com grande dilatação do cólon cheio de ar, com fecaloma no reto (B); e megacólon com imagem predominante de fecaloma no sigmoide dilatado (C)
- Endoscopia digestiva: é útil no megacólon, para avaliar o grau de inflamação da mucosa, detectar ulcerações, necrose da parede, perfuração ou sangramento, e para afastar presença de lesões associadas, especialmente as neoplásicas.
É particularmente importante nos casos suspeitos de vôlvulo do sigmoide, podendo ser procedimento terapêutico, porque pode evitar laparotomia. Se a redução do vôlvulo do sigmoide não for possível pelo exame endoscópico, o tratamento cirúrgico de urgência é de indicação absoluta.
Tratamento
Megaesôfago
Considerando-se não ser possível restaurar a fisiologia normal do órgão devido às alterações irreversíveis da desnervação, o objetivo do tratamento é o de atuar sobre o esfíncter inferior do esôfago acalásico, removendo o obstáculo funcional à passagem de alimentos para o estômago. O tratamento, exceto o específico, não cura a doença - visa tão somente melhorar a disfagia.20
Tratamento Clínico
Indicado em pacientes com idade avançada, sem história prévia de complicações, oligossintomáticos, com alto risco para tratamento cirúrgico, que se recusam a se submeter a tratamentos invasivos, ou aqueles atendidos em hospital sem infraestrutura adequada para cirurgia desse porte.20 As bases para o tratamento são especificadas a seguir.
Aconselhamento e educação em saúde, com vistas a dar maior segurança ao paciente sobre sua condição clínica.
Adequação dos hábitos alimentares.
Recomenda-se ao paciente mastigar bem os alimentos, ingerir pequenos volumes por vez e usar proporção de alimentos líquidos, pastosos e sólidos adequada à intensidade da disfagia que apresenta. Alimentos irritantes, muito condimentados, quentes ou gelados agravam a disfagia e devem ser evitados. Pelo risco de regurgitação e aspiração, deve ser evitada ingestão de alimentos, pelo paciente, antes de se deitar.
Em casos de megaesôfago dos grupos III e IV, em pacientes desnutridos, candidatos a tratamento cirúrgico, está indicada nutrição enteral balanceada. Nos casos em que a passagem de cateter nasoentérico não for possível, pode-se fazer nutrição parenteral, por cateter venoso central. Nas duas situações, a intervenção possui caráter temporário.
Medicamentos que relaxam as fibras musculares lisas do esfíncter inferior do esôfago podem aliviar os sintomas de disfagia. Entre estes medicamentos, incluem-se:
Dinitrato de isossorbida, na dose de 2,5mg a 5mg, por via sublingual, 15 minutos antes de cada refeição.
Nifedipina, na dose de 10mg, por via sublingual, 30 minutos antes de cada refeição. O uso de nifedipina deve ser realizado com precaução, considerando-se que a população em foco tem considerável associação de cardiopatia chagásica crônica, com riscos de hipotensão e choque pelo medicamento.
4. Toxina botulínica - a toxina botulínica do tipo A, aplicada localmente, bloqueia a liberação de acetilcolina das terminações nervosas pré-sinápticas e produz desnervação química. O tratamento é eficaz em 70% dos pacientes, e a duração média da remissão dos sintomas é de 16 meses. Pacientes com mais de 50 anos de idade respondem melhor ao tratamento. 280 O resultado do tratamento do megaesôfago com toxina botulínica é pior quando comparado ao realizado por meio de dilatação ou cirurgia (nível IIB). Embora seus efeitos sejam temporários, a injeção de toxina botulínica pode ser indicada em casos selecionados, apresentando a vantagem de poder ser repetida por várias vezes.
A dose de toxina botulínica é de 20 unidades, injetada em cada um dos quadrantes do esfíncter inferior do esôfago. Uma limitação desse tratamento é que o procedimento deve ser guiado por endoscopia.
5. Dilatação por balão - a dilatação pneumática está indicada aos pacientes do grupo I, podendo ser feita, também, em pacientes dos grupos II e III que apresentem contraindicação para cirurgia. Pode também ser utilizada no pré-operatório de pacientes dos grupos II e III, candidatos a tratamento cirúrgico do megaesôfago, visando melhora da condição nutricional pré-operatória. Nos pacientes do grupo IV, pelo risco de perfuração do esôfago redundante, a dilatação não é recomendada.
O procedimento é realizado por meio de balão acoplado a manômetro, introduzido por via endoscópica, o que torna o método mais seguro. O resultado do tratamento do megaesôfago por dilatação com balão traz alívio da disfagia em 71% dos pacientes,280 porém, o efeito é transitório, piorando com as dilatações sucessivas no decorrer do tempo.
Tratamento cirúrgico
Não trata a causa básica da doença, mas restaura a deglutição do paciente. Os conhecimentos adquiridos sobre a patogênese e a fisiopatologia do megaesôfago permitem dizer que a cardiomiotomia conhecida como cirurgia de Heller,281 associada a algum tipo de fundoplicatura parcial,282 é o procedimento cirúrgico mais indicado para os casos de megaesôfago de graus I a III. O índice de resposta é de cerca de 90%,280 sendo o resultado mais duradouro e mais eficaz do que o da dilatação pneumática. Para os dolicomegaesôfagos, ainda não há um consenso entre os cirurgiões, o que faz com que diferentes técnicas cirúrgicas ainda sejam indicadas.
Esta técnica foi introduzida no Brasil a partir do início dos anos 1990, concomitantemente com a disponibilidade de modernos instrumentos cirúrgicos, tais como bisturis eletrônicos e grampeadores. A experiência dos cirurgiões com a inovação tecnológica e sua utilização no tratamento dos casos de acalasia por megaesôfago relacionado à doença de Chagas resultou em redução da morbimortalidade observada na cirurgia convencional do megaesôfago por doença de Chagas (nível IA). A cardiomiotomia por videolaparoscopia, associada a algum tipo de válvula antirrefluxo, principalmente as feitas por fundoplicatura parcial, tornou-se a cirurgia padrão e praticamente uniformizou as condutas cirúrgicas para os pacientes com essa afecção.283
A cirurgia robótica constitui alternativa provavelmente vantajosa, em relação aos demais procedimentos. Entretanto, a complexidade de sua execução e os elevados custos associados dificultam a sua aplicação rotineira na prática dos serviços de saúde.20
O tratamento do megaesôfago por miotomia associada à cirurgia antirrefluxo apresenta risco de perfuração do esôfago durante sua realização, constituindo complicação que pode ser grave. A cirurgia robótica por efetuar movimentos programados e precisos e diminuirá, certamente, o índice dessa complicação.
O avanço tecnológico e a especialização dos profissionais permitiram que a miotomia fosse realizada por meio de procedimento totalmente endoscópico.
Essa cirurgia é hoje conhecida pela sigla POEM (per-oral endoscopic myotomy) e constitui a técnica de Heller feita por cirurgia endoscópica transluminal por orifícios naturais (Natural orifice translumenal endoscopic surgery - NOTES). A proposta desse procedimento foi feita por profissionais do setor de endoscopia da Mayo Clinic e, após teste em animais, teve ampla divulgação para aplicação em seres humanos em 2012. A técnica POEM parece ser método seguro, e constitui, atualmente, alternativa eficaz para o tratamento da acalasia. O procedimento é realizado com a pessoa em decúbito dorsal sob anestesia geral, e consiste em abordagem da luz esofágica com gastroscópio de alta definição com visão frontal. Injeção de solução salina corada com índigo carmim é aplicada, para criar um espaço de segurança entre a mucosa e a submucosa do esôfago. Em seguida, procede-se à incisão longitudinal de 2cm de extensão, na posição de duas horas, que é feita na mucosa, 10 a 15cm proximal à junção gastresofágica, para exposição da camada submucosa. É feito túnel na submucosa, desde o ponto de secção da mucosa até 2 a 3cm além da junção esofagogástrica (JEG).284
A miotomia do esfíncter inferior do esôfago é geralmente realizada iniciando-se 2cm distal à abertura da mucosa até abaixo da JEG. Via de regra, a miotomia deve ter extensão mínima de 6cm (em média, 8 a 10cm), sendo 2cm no esôfago, 2 a 3cm no esfíncter inferior do esôfago e 2cm na cárdia. A dissecção do túnel submucoso é feita em plano anterior ao da muscular da mucosa, e a secção muscular do esôfago é realizada apenas na camada circular da muscular própria, não havendo necessidade de secção da camada muscular longitudinal.
Dados de 14 publicações em língua inglesa demonstram que, dos 804 pacientes submetidos ao procedimento POEM, houve sucesso terapêutico documentado em mais de 80% (nível A1).285
A técnica é menos invasiva e os pacientes não apresentam refluxo gastresofágico, como verificado naqueles casos submetidos à miotomia pela técnica cirúrgica convencional laparotômica ou videolaparoscópica. A familiarização do endoscopista com o método permite o fechamento seguro de perfurações menores e a hemostasia adequada do sangramento (nível B1).286 Ocorrendo eventual perfuração mais extensa do esôfago, ou sangramento mais intenso, a atuação do cirurgião pode ser necessária.
Tratamento clínico
Aconselhamento e educação em saúde, com vistas a se proporcionar ao paciente maior segurança sobre sua condição clínica.
Adequação dos hábitos alimentares - convém focalizar no maior grau de autocuidado. Pacientes que evacuam duas a três vezes por semana sem relato de fecaloma devem ser orientados a ingerir maior quantidade de líquidos, frutas e vegetais. O uso de dieta rica em fibras nesses pacientes é controverso, porque existe o receio de que o excesso de fibras possa favorecer a formação de fecaloma e o agravamento dos sintomas. A dieta pode ser a habitual, com restrição de alimentos obstipantes. Recomenda-se a ingestão hídrica abundante, em volume de pelo menos 2 litros/dia, bem como de alimentos que favoreçam o funcionamento intestinal.
Deve-se atender sistematicamente ao desejo de evacuar e criar o hábito de evacuar em horas determinadas.
Laxativos - estão indicados para pacientes que não respondem adequadamente às medidas dietéticas. Os laxativos osmóticos (manitol a 20% ou polietilenoglicol) são os mais indicados. Óleo mineral é, também, eficaz.
Medicamentos potencialmente obstipantes - opioides, diuréticos, antidepressivos, anti-histamínicos, anticonvulsivantes, antiparkinsonianos, entre outros - só devem ser prescritos sob monitoramento médico.
Remoção do fecaloma - os fecalomas, localizados no reto, podem ser retirados manualmente com uso de anestesia, se não responderem às medidas dietéticas e medicamentosas.
Lavagem intestinal - pacientes que não respondem satisfatoriamente ao tratamento medicamentoso e dietético, ou aqueles com fecalomas mais altos, devem ser tratados com clister glicerinado ou de soro fisiológico. Para os pacientes resistentes ao tratamento clínico, indica-se a lavagem intestinal com 500 a 1.000ml, duas vezes por semana. Nos que apresentam fecalomas, o procedimento pode ser repetido duas a três vezes ao dia, tomando-se o cuidado de não utilizar mais do que 3,5 litros de solução por dia. A experiência com esses tratamentos demonstra que, com a remoção do fecaloma e a normalização das evacuações, o diâmetro do cólon tende a voltar ao normal.
Tratamento cirúrgico
1. Cirurgia eletiva
O tratamento cirúrgico do megacólon está indicado aos pacientes que apresentem grande dilatação do sigmoide, episódios repetidos de vôlvulo, retenção prolongada de fezes, recorrência de fecalomas e dificuldades para fazer aplicação de enemas em ambiente domiciliar.
À semelhança do que acontece com o tratamento cirúrgico do megaesôfago, o objetivo do tratamento do megacólon é melhorar ou normalizar o ritmo intestinal, porquanto o sintoma predominante é a constipação.
Excetuados os casos de emergência por vôlvulo, sangramento, obstrução ou perfuração, nos quais procedimentos de urgência devem ser adotados (colonoscopia ou cirurgia), a cirurgia do megacólon é eletiva e deve ser bem planejada.
As técnicas cirúrgicas convencionais mais comumente utilizadas são a retossigmoidectomia anterior e a cirurgia proposta originalmente por DuHamel para tratamento da doença de Hirschsprung.287 Com o advento e a difusão da cirurgia videolaparoscópica, a realização da cirurgia de DuHamel, por este método, tornou-se o padrão ouro para o tratamento desses casos.288
2. Cirurgia de urgência
As indicações cirúrgicas de urgência para tratamento do megacólon são:
vôlvulo do sigmoide que não se resolveu por endoscopia; e
ulceração, necrose e/ou perfuração, em decorrência do próprio volvo ou da endoscopia.
A cirurgia a ser realizada vai depender do estado do paciente e da situação anatomopatológica, variando de simples colostomia a fixação do sigmoide ou ressecção da parte acometida com anastomose primária ou retardada.
TRATAMENTO ANTIPARASITÁRIO DA DOENÇA DE CHAGAS
Embora haja divergências quanto aos percentuais de cura no tratamento antiparasitário da doença de Chagas, existem evidências consistentes sobre a sua utilidade em ambas as fases (aguda e crônica) da doença e em todas as formas clínicas da infecção crônica, uma vez que as lesões orgânicas dependem exclusivamente (fase aguda) ou pelo menos em parte (fase crônica) da presença do parasito. Além disso, há supressão evidente da parasitemia com a terapêutica antiparasitária vigente.289,290
Por sua vez, o percentual de cura e sua comprovação dependem de alguns fatores, como a fase e o tempo de duração da doença, a idade do paciente, os exames utilizados para a avaliação de eficácia terapêutica e o tempo de seguimento pós-tratamento, as condições associadas e a susceptibilidade da cepa de T. cruzi aos medicamentos antiparasitários.
Tratamento na fase aguda
Na fase aguda, o tratamento deve ser realizado em todos os casos e o mais rápido possível, independentemente da via de transmissão do parasito (classe I, nível de evidência B). Estudos de séries de casos seguidos por mais de 20 anos comprovaram percentuais de cura acima de 50% nesta fase da doença.291
Tratamento da doença de Chagas congênita
Os casos diagnosticados como doença de Chagas congênita devem receber tratamento antiparasitário (mais detalhes na parte específica de transmissão vertical),20 independentemente de o diagnóstico ter sido realizado por métodos parasitológicos nas primeiras semanas ou por meio de testes sorológicos convencionais nove meses após o nascimento (classe I, nível de evidência B).
Tratamento da fase crônica
Devem ser tratadas todas as crianças com idade igual ou inferior a 12 anos portadoras da doença de Chagas em sua fase crônica (classe I, nível de evidência A). Estudos prospectivos, randomizados, duplo-cegos e controlados com placebo, realizados em crianças assintomáticas em idade escolar, demonstraram cura da infecção por T. cruzi em 58% a 62% dos casos.292,293 Em estudo não controlado que envolveu países da América Latina,294 mostrou-se grande diversidade regional na resposta ao tratamento, medida por taxa de soroconversão de 92,7% em Honduras, para crianças de 9 meses a 12 anos e de 58,8% em um quarto dos casos estudados menores de 15 anos; houve variações na Bolívia - de 0% em Sucre a 5,4% em Entre Rios, sendo que na última região esta taxa foi maior em crianças menores de 5 anos (24,4%) do que em crianças entre 5 e 9 anos de idade (4,6%).294
Para adolescentes com idade entre 13 e 18 anos e adultos com infecção crônica, quando se consegue estabelecer que a fase aguda ocorreu até 12 anos antes (considerados como infecção recente), é usualmente recomendado o tratamento antiparasitário,20,294 embora faltem evidências consistentes a partir de estudos randomizados justificando tal conduta295 (classe IIa, nível de evidência C).
Para os indivíduos com doença de Chagas na faixa etária de 19 a 50 anos, sem infecção recente documentada, o tratamento antiparasitário deve ser considerado de forma individualizada, seja na FCI120,252 (classe IIa, nível de evidência B), seja na forma crônica determinada sem cardiopatia avançada42,120,122,252 (classe IIb, nível de evidência C). De forma específica, o tratamento de mulheres cronicamente infectadas em idade fértil, realizado antes de gravidez, tem o efeito de reduzir a transmissão congênita.104,109
Alguns estudos observacionais têm demonstrado que, neste grupo etário, o tratamento antiparasitário é capaz de impedir o aparecimento ou retardar a progressão da doença em proporção expressiva dos casos.42,120,252,295,298 Este resultado levaria à redução das complicações da doença, em especial aquelas relacionadas à cardiopatia. Estudos experimentais clássicos em camundongos já documentaram a regressão total ou parcial de lesões miocárdicas iniciais e a prevenção do desenvolvimento de cardiopatia com o tratamento antiparasitário.299-300 Entretanto, a regressão de lesões inflamatórias e fibróticas, observada nos estudos experimentais, ainda não foi verificada no contexto clínico.20
Estudos provenientes da observação de séries de casos comprovaram um percentual de cura de pelo menos 20% dos casos tratados na fase crônica tardia,301 devendo-se assinalar que a demonstração de cura dependeu, em vários trabalhos, do tempo de seguimento dos casos tratados, que deverá ser de mais de duas décadas para a fase tardia. Verificou-se também aumento da soroconversão para casos apresentando doença não aguda e sem falência cardíaca.290
Para indivíduos com idade superior a 50 anos, sem cardiopatia avançada, não há estudos justificando o tratamento antiparasitário. Estudo observacional em indivíduos idosos com infecção por T. cruzi demonstrou que a doença se encontra presente e ativa, com redução do percentual de pacientes na FCI e aumento daqueles na forma cardíaca,195 não estando estes indivíduos completamente fora do plano terapêutico etiológico da doença de Chagas, o qual pode ser individualizado (classe IIb, nível de evidência C).
O tratamento antiparasitário não deve ser realizado em indivíduos na fase crônica da doença de Chagas com a forma cardíaca grave, uma vez que não há evidências de benefícios clínicos na evolução destes pacientes251,289,291,295,296,302,303 (classe III, nível de evidência C).
Recentemente foi publicado251 o conjunto de resultados do BENEFIT, um estudo prospectivo, multicêntrico, randomizado, duplo-cego, controlado com placebo (placebo versus benznidazol). Representa o primeiro estudo a avaliar o efeito do tratamento específico por até 80 dias em relação a desfechos cardíacos e à infecção por T. cruzi.
Foram avaliados os efeitos do benznidazol na redução de morbimortalidade em 2.854 pacientes com cardiopatia chagásica crônica estabelecida.250,251 Após 5,4 anos de seguimento, os resultados não evidenciaram diferença estatística significativa entre os dois grupos em relação ao desfecho primário composto, incluindo morte, taquicardia ventricular sustentada, insuficiência cardíaca recente, implantação de um cardioversor-desfibrilador ou marca-passo, transplante cardíaco, parada cardíaca com ressuscitação, acidente vascular cerebral ou outro evento tromboembólico.251 Estes achados, a princípio, parecem indicar divergência das taxas consideravelmente mais baixas de detecção do parasita por meio da PCR no sangue neste mesmo estudo após o tratamento com benznidazol.303
O tratamento com benznidazol dentro do protocolo utilizado no estudo BENEFIT provavelmente não tem efeito preventivo relevante sobre a progressão de doença cardíaca em pacientes com doença de Chagas avançada251 (classe III, nível de evidência B). Entretanto, ressalta-se a gravidade da doença de Chagas a partir deste estudo e a consequente necessidade de diagnóstico e tratamento oportunos, fundamentados em manejo qualificado, em especial da doença cardíaca: 503 pacientes evoluíram para óbito dentro de 5 anos (246 no grupo com benznidazol e 257 no grupo placebo), enquanto 63% dos pacientes (em ambos os grupos de tratamento) que tiveram fração de ejeção do ventrículo esquerdo inferior a 40% evoluíram com um dos desfechos primários do estudo.251
Evidencia-se, portanto, a necessidade premente de se estruturar uma rede de atenção à saúde qualificada para pessoas com doença de Chagas, na perspectiva da integralidade do cuidado, sem perdas de oportunidades de diagnóstico e tratamento. Cite-se não apenas o manejo clínico longitudinal em si em termos das formas clínicas da doença, em especial formas avançadas de cardiopatia com protocolos ajustados às realidades locais, mas também a possibilidade de oportunizar tratamento específico para as pessoas com indicações terapêuticas já baseadas em evidências mais consistentes.303
Além disto, chama a atenção nesse estudo a menor frequência de efeitos adversos graves ao benznidazol comparativamente a estudos anteriores,251,303 o que reforça a real possibilidade de se inserir, de forma mais ampliada, o tratamento específico da doença de Chagas na rede de atenção básica (primária) à saúde não somente no Brasil, mas também em outros países endêmicos.
A forma digestiva não contraindica o tratamento antiparasitário da doença de Chagas, devendo-se realizar a correção do megaesôfago, com a finalidade de possibilitar o pleno trânsito do medicamento e, consequentemente, sua absorção20,302 (classe IIa, nível de evidência C).
Tratamento de casos com imunossupressão
Casos com imunodeficiência, como os usuários de medicamentos imunossupressores para o tratamento de neoplasias, em transplantes e outras doenças, e casos com imunodeficiência, como aqueles com coinfecção T. cruzi/HIV, podem desenvolver quadro de reativação da doença de Chagas.181,184,304 As condutas indicadas nestes casos são tematizadas a seguir.
Transplantes
Em transplantes em geral, é necessário saber se o doador ou o receptor apresentam doença de Chagas, considerando-se o risco de transmissão ou de reativação da doença. Assim, são três os cenários possíveis:
doador com doença de Chagas e receptor sem doença de Chagas;
doador sem doença de Chagas e receptor com doença de Chagas;
doador e receptor com doença de Chagas.
Doador com doença de Chagas e receptor sem doença de Chagas
O candidato à doação de órgãos com sorologia reagente para T. cruzi deve receber tratamento antiparasitário por 60 dias antes do procedimento. Em situações especiais que exijam o transplante antes de se completar o tratamento, o transplante poderá ser realizado, se possível, não antes de 14 dias de tratamento (classe I, nível de evidência C).
Considerar o tratamento etiológico logo após o transplante, mantendo-o por 60 dias mediante intensa imunossupressão (classe IIa, nível de evidência C).184
Não tratar e proceder à monitorização sequencial com avaliações clínica, parasitológica (pesquisa direta de T. cruzi no sangue periférico semanalmente, até 60 dias), métodos parasitológicos indiretos (hemocultura e/ou xenodiagnóstico) - seguimento do receptor enquanto durar a imunossupressão - e sorologia (exames aos 30 e 60 dias pós-transplante).181,184,305 Nos casos em que a monitorização não for possível, recomenda-se tratamento etiológico.
A seguir, exames clínicos e sorológicos aos 3 meses e aos 6, 9 e 12 meses de seguimento, e exames parasitológicos diretos/indiretos (hemocultura e/ou xenodiagnóstico artificial aos 3, 6 e 12 meses) ou PCR devem ser realizados. Posteriormente, a avaliação é repetida a cada 6 meses, enquanto persistir a imunossupressão (Classe IIa, nível de evidência B)181,184,305. Ressalta-se que, em alguns centros de referência, é realizada a PCR e não os exames parasitológicos indiretos.
Em qualquer momento, caso seja detectada infecção aguda por meio de exames parasitológicos ou sorológicos, o tratamento etiológico convencional deverá ser instituído. Fora dos controles habituais, qualquer sinal clínico suspeito de quadro infeccioso deverá ser investigado por meio de exames parasitológicos, e os casos positivos devem receber o tratamento convencional para a fase aguda. Desde 2009, a possibilidade de pacientes com a doença de Chagas serem aceitos como doadores de órgãos no Brasil ficou restrita pela legislação vigente em transplantes de órgãos.183
No Brasil, a Portaria no 2.600 de 2009, que aprovou o Regulamento Técnico do Sistema Nacional de Transplantes, estabelece que é obrigatória a realização de sorologia para infecção por T. cruzi nas seguintes situações:183 (i) em todas as doações, seguindo-se os mesmos algoritmos utilizados para triagem de doadores de sangue; (ii) para fins de inscrição dos potenciais receptores de órgãos no Cadastro Técnico Único; (iii) em todos os potenciais doadores falecidos de órgãos, tecidos, células ou partes do corpo antes da alocação dos enxertos. Estabelece ainda critérios de classificação de doadores vivos e falecidos e dos potenciais receptores para distribuição de órgãos, tecidos, células e partes captadas. Há indicação de que “a equipe informará se aceita ou não” para os módulos relativos a rim, rim/pâncreas, pâncreas, fígado e pulmão. Na referida portaria, a não aceitação diz respeito apenas ao módulo de coração. Para os módulos tecidos oculares, células-tronco hematopoiéticas, tecidos musculoesqueléticos, pele e tecidos cardiovasculares, não há menção a questões relativas à infecção por T. cruzi.183
3. Orientações quanto ao receptor sem doença de Chagas - nos casos em que o doador com doença de Chagas não tenha sido tratado ou tenha recebido tratamento incompleto, três condutas poderão ser adotadas em relação ao receptor:
Iniciar o tratamento antiparasitário logo após o transplante, mantendo-o por 60 dias (Classe IIa, nível de evidência C). Conduta recomendada caso a monitorização sequencial indicada no Item C abaixo não for possível.
Iniciar o tratamento imediatamente após a cirurgia, mantendo-o inicialmente por 14 dias. A partir de então, proceder à monitorização sequencial com avaliação clínica, parasitológica e sorológica (Classe IIa, nível de evidência C ou sem evidência). Em caso de soroconversão, introduzir o tratamento antiparasitário indicado para a fase aguda.
Não tratar e proceder a monitorização sequencial com avaliações clínica, parasitológica - Classe IIa nível de evidência B181,184,305 (pesquisa direta de T. cruzi no sangue periférico semanalmente, até 60 dias), e exames parasitológicos indiretos e sorológicos (no 30º e 60º dias após o transplante). A seguir, exames clínicos e sorológicos e parasitológicos (diretos/indiretos/PCR) devem ser realizados a cada dois meses até um ano de seguimento; posteriormente, a cada seis meses, enquanto persistir a imunossupressão (tempo dependente da modalidade e do tipo de transplante). Ressalta-se que em alguns centros é realizada a PCR, e não os exames parasitológicos indiretos.
Em qualquer momento, caso seja detectada infecção aguda por exames parasitológicos ou sorológicos (IgM ou soroconversão), o tratamento antiparasitário convencional deverá ser instituído.
Fora dos controles habituais, qualquer sinal clínico suspeito de quadro infeccioso deverá ser investigado por meio de exames parasitológicos, e os casos positivos devem receber o tratamento convencional para a fase aguda.20,302
Relatos de pequeno número de casos em transplante de rim com profilaxia antiparasitária por 14 dias em receptores de transplante de rim sem doença de Chagas a partir de doadores com doença de Chagas308 e outro trabalho também realizou profilaxia por 60 dias em receptores (sem doença de Chagas) de fígado de doadores com doença Chagas306 como estratégia habitual, não se observando soroconversão nos receptores que sobreviveram que, como se sabe, pode estar ausente em cerca de 20% ou mais dos pacientes no período pós-transplante. Considera-se profilaxia a utilização de medicamento antiparasitário em pacientes sem infecção documentada por identificação do parasito ou evidência de soroconversão. Neste texto, mesmo quando administrado durante o mesmo período de tratamento (60 dias), o termo profilaxia foi usado se o medicamento foi indicado na ausência de infecção documentada no receptor. Os trabalhos citados não são controlados e, além de terem sido realizados em pequeno número de casos em transplante de rim e fígado, não utilizaram o monitoramento sistemático de parasitemia, sendo resultados finais embasados na ausência de soroconversão nos pacientes que não faleceram.
Todavia, desde 2009, a possibilidade de pacientes com a doença de Chagas serem aceitos como doadores de órgãos no Brasil é restrita pela regulamentação de transplantes,184 com a triagem sorológica sistemática limitando este este tipo de doação nos indivíduos com infecção por T. cruzi. Entretanto, estes mesmos órgãos poderão funcionar como “órgãos marginais” em algumas situações específicas.184,305,307
Doador sem doença de Chagas e receptor com doença de Chagas
Nestes casos, a complicação esperada é a reativação da doença de Chagas no receptor, em consequência da utilização de medicamentos imunossupressores para evitar ou tratar rejeições. Havendo tempo hábil, o tratamento antiparasitário convencional pré-transplante poderá ser instituído. Caso contrário, não deverá impedir a realização do transplante, e as condutas a seguir poderão ser adotadas (Classe IIa, nível de evidência C).
Profilaxia dos episódios de reativação. Em transplantes de coração, o tratamento antiparasitário pode falhar. 100,307
Monitorização clínica e parasitológica do receptor pós-transplante, como realizada no caso com doador com doença de Chagas e receptor sem doença de Chagas, e tratamento convencional precoce dos episódios de reativação.181,184,305 O monitoramento durante o período pós-transplante no transplante cardíaco é obrigatório, tanto no sangue como nos tecidos, pela maior sensibilidade dos métodos no local de reativação (miocárdio).
Doador e receptor com doença de Chagas
Ambos devem ser considerados como portadores da forma crônica da doença de Chagas e avaliados para tratamento antiparasitário, conforme descrito para casos com a forma crônica. Após o transplante, o receptor deverá ser monitorado do ponto de vista clínico e parasitológico para o diagnóstico de eventuais episódios de reativação, como no caso de doador com doença de Chagas e receptor sem doença de Chagas. Caso ocorra reativação, introduzir o tratamento convencional para a fase aguda (Classe IIa, nível de evidência C). Os episódios de reativação podem ocorrer mais de uma vez, devendo ser tratados quando documentados, razão pela qual se recomenda o monitoramento parasitológico sistemático enquanto persistir a imunossupressão.
Coinfecção T. cruzi/HIV
Estudos observacionais têm demonstrado que, na vigência de coinfecção T. cruzi e HIV, sem ocorrência de aids, ocorre a evolução natural de ambas as doenças, devendo-se seguir as orientações para tratamento antiparasitário da doença de Chagas em suas fases aguda e crônica ou monitoramento da parasitemia, se possível quantitativamente49,159,175 (Classe IIa, nível de evidência C) (ver parte específica neste Consenso). Na coinfecção e na vigência de aids, pode ocorrer reativação da doença de Chagas, e as seguintes condutas são recomendadas: na reativação com síndrome clínica com miocardite, meningoencefalite ou outras, e exame parasitológico positivo por microscopia direta no sangue, líquor ou lesão característica em tecidos, o tratamento antiparasitário específico está indicado20,49,159 (Classe I, nível de evidência C). Esta conduta terapêutica também deve ser adotada nos casos sem evidência de reativação com síndrome clínica associada, mas com alta parasitemia, definida por Sartori e colaboradores como presença de mais de 20% das ninfas positivas em um mesmo exame de xenodiagnóstico (exame parasitológico indireto, PCR quantitativo) ou parasitemia persistente49,159,175,308 (Classe IIa, nível de evidência C).
Coinfecção e profilaxia
Por analogia com outras doenças oportunistas na aids, a profilaxia secundária pode ser realizada em pacientes com reativação da doença de Chagas que foram tratados e alcançaram remissão clínica e parasitológica, quando os níveis de linfócitos T CD4+ forem menores que 200 células/mm3 (Classe IIa, nível de evidência C).20,49,159,175 Entretanto, esta recomendação precisa ser validada em estudos prospectivos, considerando-se a baixa frequência de recidivas observadas em doentes sob HAART.
Imunossupressão em outras doenças associadas à doença de Chagas
Situações clínicas como neoplasias, doenças do colágeno, entre outras, em portadores da doença de Chagas, podem estar associadas à reativação. As recomendações são as mesmas para a reativação em transplante de órgãos e na coinfecção doença de Chagas e HIV.20,49,159,175
Transmissão acidental
Em acidentes caracterizados como de risco elevado para transmissão da doença, como pérfuro-cortantes, e contato com mucosas durante a manipulação de material biológico com parasitos vivos (amostras para cultura de T. cruzi, líquidos de pacientes com elevada parasitemia e material de necropsia, vetores e animais de laboratório infectados), deve-se fazer a profilaxia primária, iniciando-se o medicamento imediatamente após o acidente e mantendo-o por 10 dias309-311 (Classe IIa, nível de evidência C).
Devem ser realizados exames sorológicos antes de se iniciar o tratamento, e no 20º, 40º e 60º dias pós-tratamento para monitoramento de soroconversão. No caso de os exames sorológicos serem reagentes, o tratamento antiparasitário convencional deverá ser realizado como descrito previamente para a fase aguda. Em situações de risco mínimo, como contato com sangue de paciente com a doença de Chagas em fase crônica, a profilaxia medicamentosa não está indicada, recomendando-se a realização de exames sorológicos imediatamente após o acidente, e no 20º, 40º e 60º dias após a infecção. Havendo soroconversão, o tratamento convencional para a fase aguda da doença de Chagas deverá ser instituído, e o monitoramento pós-terapêutico deve ser realizado como na fase aguda. Se a sorologia permanecer positiva após o tratamento, deve-se procurar documentar a falha terapêutica para um novo tratamento com o mesmo medicamento ou com medicamento alternativo.20
Opções terapêuticas, posologia e modo de administração
O caráter de negligência da doença de Chagas é evidenciado pela limitação de opções terapêuticas, com a existência de apenas dois fármacos antiparasitários disponíveis com eficácia estabelecida para o tratamento específico: benznidazol (agente derivado nitroimidazólico) e nifurtimox (composto nitrofurânico).14,19,20,38,42,293,294,296
O medicamento de primeira escolha para o tratamento antiparasitário da doença de Chagas em todas as situações abordadas anteriormente é o benznidazol.20,38,100,294 Atualmente este medicamento é produzido por laboratório farmacêutico brasileiro, distribuído por meio de solicitação junto ao Ministério da Saúde do Brasil, não havendo distribuição ao mercado farmacêutico geral.20,39
O benznidazol é um medicamento bem tolerado.20,38,251 As crianças em geral têm menos efeitos adversos do que os adultos e toleram doses mais elevadas.104 Em abril de 2013, o 19o Comitê de Especialistas para Seleção e Uso de Medicamentos Essenciais da OMS debateu e aprovou a adição de duas novas apresentações do benznidazol na lista de medicamentos essenciais para crianças.38
O benznidazol está sendo cada vez mais prescrito para o tratamento antiparasitário da doença de Chagas, não apenas pela ampliação de indicações com base em evidências, mas também como decorrência do aumento da demanda em países endêmicos e não endêmicos, com a melhor estruturação de seus sistemas nacionais de vigilância e atenção à saúde.38,294,295
Benznidazol (Classe 1, nível de evidência b): comprimidos de 100mg e 50mg (adultos) e de 12,5mg e 50mg (crianças).20,42,104,109,122,291,296,299,302,312,313 No Brasil, somente as apresentações de 100mg e 12,5mg estão disponíveis na rede do SUS.
Adultos: 5mg/kg/dia, por via oral, em duas ou três tomadas diárias, durante 60 dias. A dose máxima recomendada é de 300mg/dia.
O benznidazol, em comprimidos de 100mg e de 50mg, é distribuído na América Latina por meio do Laboratório Endocrínico Argentino (ELEA, Maprimed) e do Fundo Rotativo da OPAS; na Espanha, por meio da Agência Espanhola de Medicamentos e Produtos Sanitários; e para os demais países do mundo, por meio do ELEA e da OMS.38
No Brasil, é adquirido pelo Ministério da Saúde, e distribuído às Secretarias Estaduais de Saúde (SES) mediante solicitação no Sistema de Informação de Insumos Estratégicos (SIES). O fluxo de distribuição do benznidazol (100mg) para regionais e/ou munícipios deve ser estabelecido por cada SES, articulando-se Assistência Farmacêutica, Vigilância Epidemiológica e Atenção Básica. Já a distribuição do benznidazol na dose de 12,5mg é centralizada, considerando a pequena ocorrência de casos da doença na faixa etária recomendada para uso do medicamento. Portanto, para requerer a formulação pediátrica, deve-se entrar em contato com o Grupo Técnico de Doença de Chagas, Coordenação de Doenças Transmissíveis da Secretaria de Vigilância em Saúde, Ministério da Saúde.49
Em todos os casos, não se deve ultrapassar a dose de 300mg/dia. Quando a dose diária ultrapassar os 300mg, recomenda-se estender o tempo de tratamento até se alcançar a dose total calculada para 60 dias.
A principal vantagem do comprimido de 12,5mg é que ele pode ser utilizado para tratar de recém-nascidos até crianças de 2 anos de idade, o que facilita a dosagem adequada sem a necessidade de se fragmentar e manipular partes de comprimidos de maiores dimensões. Além disso, a principal vantagem do comprimido de 50mg é que ele pode ser usado para tratar o restante da população pediátrica, incluindo adolescentes e adultos jovens.38
Além do tratamento específico da infecção por T. cruzi, estes antiparasitários podem ser utilizados para profilaxia em situações específicas.
Deve-se considerar a profilaxia secundária após o tratamento convencional da reativação na coinfecção HIV/aids (2,5 a 5mg/kg/dia, via oral, três vezes por semana), pois ainda não há evidências consistentes que validem o uso do benznidazol profilaticamente nesta situação.49,159,175
Por seu turno, a profilaxia primária está indicada em situações em que se define como via de transmissão a exposição acidental a T. cruzi. Recomenda-se o uso de 5mg/kg/dia (adulto) e 10mg/kg/dia (criança), por via oral, em duas tomadas diárias, durante 10 dias, não se ultrapassando 300mg/dia. Em caso de alta carga parasitária do inóculo (igual ou maior que 107 tripomastigotas/ml), deve-se efetuar tratamento convencional para a fase aguda da doença de Chagas por, no mínimo, 60 dias310(Classe IIa, nível de evidência C). Em casos em crianças, deve-se utilizar a apresentação pediátrica do benznidazol, já disponível.
Os efeitos adversos e a toxicidade do benznidazol, juntamente com as respectivas condutas, podem ser observados na Figura 19. Assim, cuidados devem ser tomados antes e durante o tratamento na monitorização desses eventos. Antes de se iniciar o tratamento, devem ser realizados exame clínico, hemograma completo, avaliação de enzimas hepáticas e testes de função renal. Esta conduta deve ser repetida no 30º e 60º dias do início do tratamento.20
Em casos de intolerância ao benznidazol, tem-se como opção terapêutica o nifurtimox20,42,119,291,292,296,312 (classe 1, nível de evidência B): comprimidos de 120mg (adultos) e 30mg (crianças).
Adultos: 10mg/kg/dia, por via oral, em três tomadas diárias, durante 60 dias.
Crianças: 15mg/kg/dia, por via oral, em três tomadas diárias, durante 60 dias.
Os efeitos adversos e a toxicidade do nifurtimox são semelhantes aos verificados com o benznidazol, exceto pela menor tolerância digestiva, refletida na anorexia com perda de peso e distúrbios psíquicos.20 Em caso de falha terapêutica com o benznidazol, o nifurtimox pode ser utilizado, embora tenha sido observada resistência cruzada entre os dois medicamentos.
É necessário lembrar que o nifurtimox não é disponibilizado no mercado farmacêutico de nenhum país até o momento. Em situações em que o uso do nifurtimox é imprescindível, o medicamento deverá ser solicitado via escritórios da OPAS e da OMS. O Ministério da Saúde do Brasil, por intermédio do Grupo Técnico de Doença de Chagas da SVS, tem disponibilidade do nifurtimox para dispensação nas condições anteriormente descritas de intolerância ao benznidazol. O nifurtimox é adquirido pelo Ministério da Saúde via doação da OPAS e é dispensado diretamente pelo Grupo Técnico de Doença de Chagas da SVS.39 O medicamento pode ser solicitado por meio de protocolo padronizado direcionado a este grupo técnico do Ministério da Saúde.
Outros medicamentos, tais como o alopurinol e os antifúngicos azólicos (cetoconazol, itraconazol, fluconazol, posaconazol), são reconhecidos como supressores da parasitemia por T. cruzi e podem ser úteis em algumas situações específicas, como nas reativações em imunodeprimidos, quando houver impossibilidade do uso do benznidazol ou do nifurtimox49,159,175 (Classe IIa, nível de evidência C). No entanto, não há evidências clínicas indiscutíveis de comprovada eficácia terapêutica.
O tratamento antiparasitário com o benznidazol não deve ser instituído em gestantes ou em mulheres em idade fértil que não estejam em uso regular de método contraceptivo reconhecidamente efetivo.20 Conforme discutido na parte específica sobre transmissão vertical de T. cruzi neste Consenso, há evidências indicando benefício do tratamento antiparasitário, com melhor evolução da doença de Chagas,116,119-122 redução do risco de transmissão vertical em futuras gestações109,116 e menor risco de transmissão vertical e de evolução para aborto, pela redução da parasitemia.103,115
No caso de gestante com indicação de tratamento antiparasitário, a relação de risco-benefício deve ser considerada, caso a caso, assim como as opções terapêuticas disponíveis (em especial, fase aguda e coinfecção). A indicação em pacientes com outras afecções graves, tais como insuficiência hepática e renal, deve ser avaliada criteriosamente, caso a caso, de acordo com a gravidade, assim como eventos adversos prévios aos componentes do medicamento, constituindo contraindicações relativas.20,38,104
Avaliação de cura da doença de Chagas, após tratamento antiparasitário
A sorologia, tornando-se negativa, é considerada o único método tradutor de cura após o tratamento antiparasitário da doença de Chagas. O tempo necessário para que isto ocorra é variável e depende da fase e do tempo da doença, sendo de um ano para a infecção congênita, 3-5 anos para a fase aguda, 5-10 anos para a fase crônica recente e acima de 10 anos (usualmente, 20-25 anos) para a fase crônica de longa duração. A redução dos títulos dos exames sorológicos se faz gradativamente. O declínio persistente e progressivo acima de três diluições dos títulos dos exames sorológicos é sugestivo de que estes irão negativar. Os exames parasitológicos não são obrigatórios como controles de cura do tratamento antiparasitário da doença de Chagas, porém, em qualquer momento da evolução do paciente, a positividade destes indica fracasso terapêutico. Neste sentido, a PCR é uma opção alternativa aos métodos indiretos (xenodiagnóstico e hemocultura) na avaliação parasitológica como critério de falha terapêutica após o tratamento antiparasitário da doença de Chagas.104,313 Entretanto, persistem limitações quanto à disponibilidade e à padronização das técnicas na rede de saúde dos países endêmicos.313
Quem e onde tratar
Considerando-se as especificidades operacionais dos sistemas nacionais de saúde, o tratamento antiparasitário para a doença de Chagas é factível, seguro20,251,294,303,312 e operacionalmente viável para utilização em unidades de atenção primária à saúde,294 por médicos que conheçam as particularidades dos medicamentos e da doença de Chagas.20,303 Dependendo da gravidade das condições clínicas de cada caso, principalmente os casos com a forma aguda ou reativada e formas crônicas descompensadas, pode haver necessidade de encaminhamento para unidades mais especializadas ou de referência, com maior densidade tecnológica em saúde, ou até mesmo internação hospitalar.
A Figura 18 apresenta uma síntese de situações potenciais para tratamento específico, tomando-se como referência a classe de recomendação e o nível de evidência existente. A Figura 19 apresenta os efeitos adversos ao benznidazol bem como as condutas recomendadas para cada situação indicada.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI