Introdução
O monitoramento da segurança, qualidade e efetividade dos imunobiológicos utilizados no Brasil é feito pela Farmacovigilância do Sistema Nacional de Vigilância Sanitária do Ministério da Saúde (SNVS/MS).1 Este sistema foi criado para possibilitar a detecção, compreensão e avaliação de eventos adversos (EA) ou qualquer outro problema relacionado ao uso de medicamento, com vistas à prevenção de reações adversas bem como à redução de riscos relacionados com seu uso.
Desde 2009, o pelo Instituto Butantan de São Paulo-SP, Brasil conta com uma área de Farmacovigilância integrada ao SNVS/MS, e com um Serviço de Atendimento ao Consumidor (SAC) que recebe notificações espontâneas de qualquer EA relacionado ao uso de seus produtos, encaminhadas tanto por profissionais de saúde como usuários dos serviços de saúde.
Até o momento da conclusão desta nota, foram encontrados poucos trabalhos na literatura que apresentem dados sobre a segurança dos soros heterólogos.2-8 Por isso, este estudo propôs-se a descrever o perfil de segurança dos soros produzidos pelo Instituto Butantan (IB), no período de 2012 a 2015.
Métodos
Estudo observacional descritivo, sobre a ocorrência de EA temporalmente associados ao uso de soros fabricados pelo Instituto Butantan e notificados entre janeiro de 2012 e dezembro de 2015, ocorridos em indivíduos de ambos os sexos e todas as idades, provenientes de todo o território brasileiro.
Uma parte dos EA foi notificada à Farmacovigilância do Instituto Butantan espontaneamente, por profissionais de saúde ou usuários dos serviços de saúde. Os demais casos foram recebidos de forma ativa, diretamente da Unidade Técnica de Doenças Respiratórias e Imunopreveníveis da - Coordenação Geral de Doenças Transmissíveis Departamento de Vigilância das Doenças Transmissíveis do Ministério da Saúde, de acordo com o recomendado no Plano de Gerenciamento de Risco para o soro antidiftérico de potência reduzida estabelecido com o Ministério da Saúde.9
Para cada notificação, foi preenchido um formulário específico com dados do notificador (Unidade da Federação de residência e profissão), ano de notificação, dados sociodemográficos (sexo e idade) e clínicos (EA registrado, soro recebido, gravidade e evolução clínica do EA) do usuário. Todos os EA foram codificados segundo o Dicionário Médico para Atividades Regulatórias (MedDRA), empregando-se o termo preferido (PT) como termo médico de escolha, e a classificação por sistema/órgão (SOC).
Os dados coletados foram inseridos no sistema eletrônico OpenClinica®, adaptado para compor o banco de dados de segurança da Farmacovigilância do Instituto Butantan. Em seguida, esses dados foram exportados para a plataforma Excel e, posteriormente, analisados com o auxílio do programa estatístico STATA versão 13.0 (StataCorp LP, College Station, Texas, USA).
Os resultados obtidos são apresentados em tabelas de frequências; para a variável ‘idade’, calculou-se, também, a média e seu respectivo desvio-padrão.
Os dados utilizados neste estudo foram gerados durante a realização de atividades de rotina de Farmacovigilância, obrigatórias para todos os detentores de registro de medicamentos, conforme estabelecido pela Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa): RDC nº 4, de 10 de fevereiro de 2009.1 Por esse motivo, o projeto do estudo foi dispensado de aprovação por Comitê de Ética em Pesquisa. A privacidade dos indivíduos que apresentaram EA foi preservada em todas as etapas do estudo.
Resultados
No período de janeiro de 2012 a dezembro de 2015, 52 usuários relataram pelo menos uma ocorrência de EA após aplicação de soro produzido pelo Instituto Butantan. A maior parte desses usuários era do sexo masculino (n=28) e metade contava 30 anos ou mais de idade (n=26) (Tabela 1). A maioria dos relatos de EA foi notificada por um profissional da saúde (36/52) e classificada como ‘não grave’ (33/52); além disso, verificou-se que 22/52 dos relatos procediam do estado de São Paulo.
Tabela 1 - Distribuição dos indivíduos que apresentaram evento adverso após exposição a soro heterólogo, notificado à Farmacovigilância do Instituto Butantan (n=52) segundo características sociodemográficas, dados da notificação e tipo de soro, 2012-2015
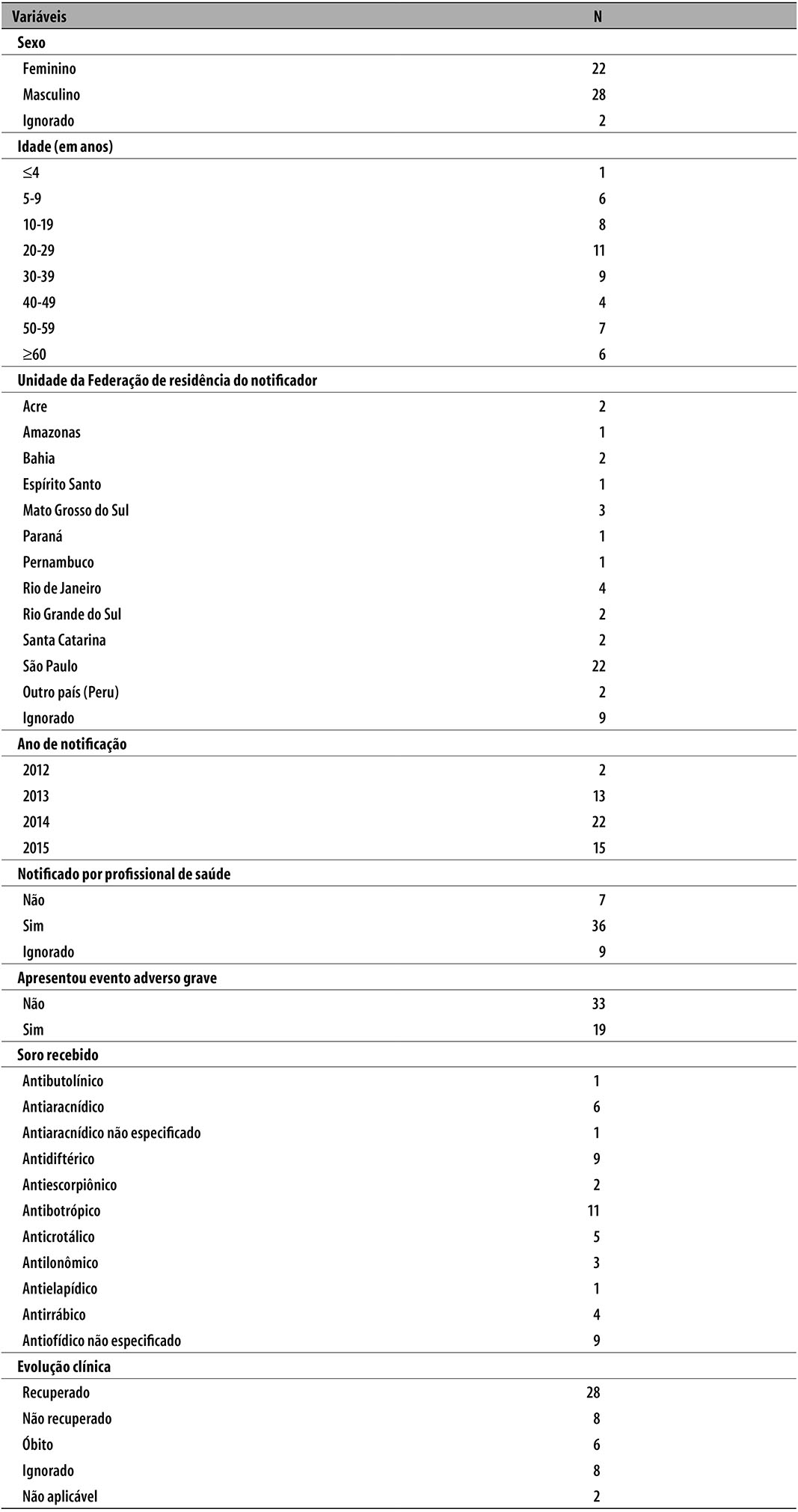
Os EA notificados referiam-se, mais frequentemente, aos soros antibotrópico (n=11), antidiftérico (n=9), antiofídico não especificado (n=9), antiaracnídico (n=6) e anticrotálico (n=5). Ressalta-se que em 2012, foram identificados apenas dois relatos de indivíduos com EA pós-exposição a algum soro do Instituto Butantan.
No período estudado, foram relatados 173 EA, dos quais 63,0% eram esperados por serem eventos descritos em bula. Observaram-se, em média, 3,2 EA por indivíduo (desvio-padrão=2,4). As classificações por sistema/órgão mais frequentes foram: afecções dos tecidos cutâneos e subcutâneos (30,6%); perturbações gerais e alterações no local de aplicação (22,0%); e doenças respiratórias, torácicas e do mediastino (9,2%) (Tabela 2). Os EA mais notificados foram: ‘prurido’ (n=11), seguido por ‘eritema’, ‘erupção cutânea’, ‘erupção medicamentosa’, ‘erupção papulosa’ e ‘tumefação periférica’ (6 casos de cada). Quarenta e um EA (23,7%) ocorreram após exposição ao soro antibotrópico. Segundo a evolução clínica, 28 indivíduos (53,8%) apresentaram recuperação do quadro clínico (Tabela 1).
Tabela 2 - Manifestações clínicas dos eventos adversos ocorridos após exposição a soro heterólogo, notificados à Farmacovigilância do Instituto Butantan (N=52), 2012-2015
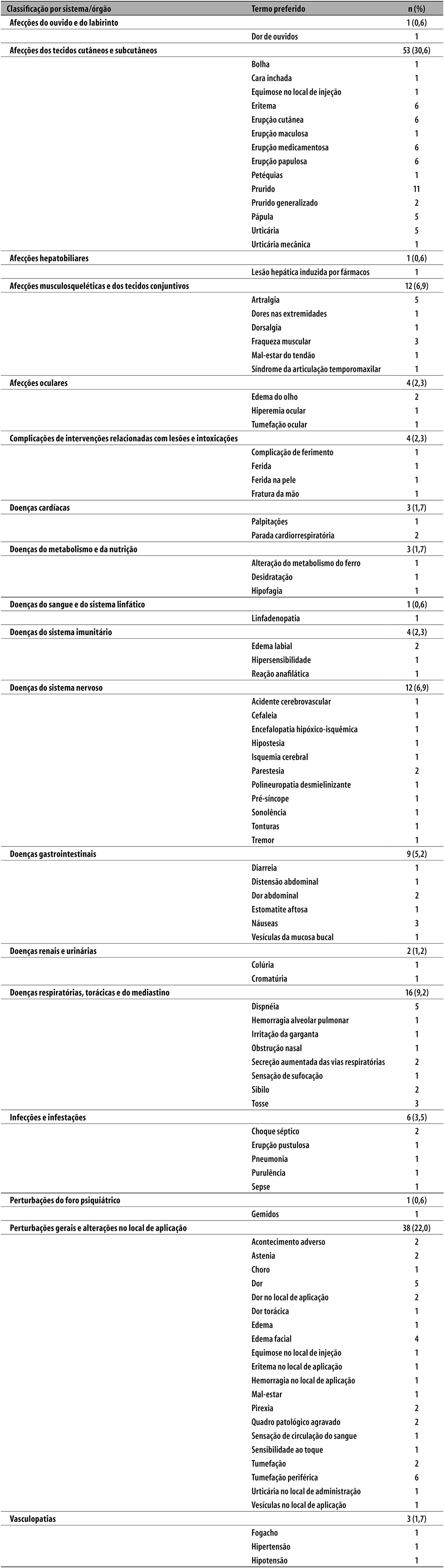
Houve registro de seis óbitos temporalmente relacionados ao uso de soros: cinco com uso do soro antidiftérico e um com uso do soro antibotulínico. Porém, nenhum dos óbitos teve a utilização do soro como causa para esse desfecho. Dos indivíduos que foram a óbito e utilizaram o soro antidiftérico, três tiveram diagnóstico de difteria descartado com óbito relacionado à doença de base; os outros dois tiveram a instituição tardia do tratamento, resultando na difteria como causa do óbito. Já o óbito com uso de soro antibotulínico teve registradas, como causas de morte: encefalopatia hipóxica isquêmica, acidente vascular cerebral isquêmico e parada cardiorrespiratória.
Discussão
Neste estudo, observou-se a importância das atividades da área de Farmacovigilância para conhecer o perfil de segurança dos produtos fabricados pelo Instituto Butantan. Os resultados reforçam a segurança dos soros produzidos pelo Instituto, uma vez que a maioria dos EA notificados foi classificada como esperada e não grave, acompanhando o que já é clinicamente previsível e descrito em bula.
Com base nas referências encontradas em literatura, não foi possível realizar análises comparativas porque os estudos encontrados têm como escopo o relato do acidente e sua evolução de acordo com o soro recebido,3-8 ou não foram realizados com soros fabricados pelo Instituto Butantan.2 Tais estudos não se dedicaram a avaliar a ocorrência de EA temporalmente relacionados ao uso de soros.3-8
No Brasil, o marco regulatório que dispõe sobre as “normas de Farmacovigilância para detentores de registro de medicamentos para uso humano” foi estabelecido em 2009, pela Agência Nacional de Vigilância Sanitária (Anvisa) com a publicação da Resolução RDC nº 4, de 10/2/2009.1 Esta RDC, que constitui o pilar para a detecção de sinais de segurança por meio da identificação de casos de EA após o uso de um fármaco, permitiu que essa área de conhecimento apresentasse muitos avanços. Entre eles, o mais contundente é a ampliação da base nacional de dados de EA relacionados ao uso de medicamentos, especialmente dos imunobiológicos.
A partir da implementação dessa regulamentação, houve um fortalecimento das atividades de Farmacovigilância em todas as instâncias do SNVS e com isso, um incremento na detecção de eventos adversos. Essa melhoria pode ser verificada nos resultados deste estudo, pelo aumento no número de usuários de soros imunes (heterólogos) que apresentaram pelo menos um EA no período de 2012 para 2015.
A vigilância ativa é proposta pela Anvisa e tem por objetivo determinar, precisamente, o número de suspeitas de reações adversas, mediante um processo contínuo e pré-organizado. Para a realização da vigilância ativa do soro antidiftérico de potência reduzida, foi elaborado um Plano de Gerenciamento de Risco que estabelecia a todos os pacientes tratados com esse produto a realização de vigilância ativa pelos serviços de saúde e seu acompanhamento pela Farmacovigilância do Instituto Butantan.
No entanto, ainda é perceptível a existência de algumas lacunas relacionadas à Farmacovigilância. Ressalta-se a baixa qualidade dos dados registrados: muitos não dispõem de informações completas que permite análises mais esclarecedoras. Entre essas faltas, destaca-se a ausência do número do lote do produto, uma informação extremamente importante para o fabricante porque possibilita a realização de investigação de qualidade para identificação de possíveis desvios durante o processo produtivo. De acordo com a presente análise, 24,0% dos relatos não possuíam esse dado, ou seja, não foi possível verificar se as ocorrências de EA estão relacionadas a um lote específico de um determinado produto.
Também é possível que tenha ocorrido subnotificação de casos de EA. Isto pode acontecer - em parte - devido à falta de aderência dos profissionais de saúde, ao não reconhecerem a Farmacovigilância como uma ação prioritária de sua rotina de trabalho. Outra possibilidade é o fato de a subnotificação estar relacionada à percepção dos profissionais de saúde de que a ocorrência do EA é menos grave quando comparada à de um acidente causado por animal peçonhento, ou mesmo à suspeita de uma doença infecciosa - como difteria, ou tétano. O fato de os soros estarem em uso há muito tempo pode ser outra barreira para a notificação de EA relacionados a seu uso, uma vez que os profissionais passam a não ser tão encorajados a realizar essa atividade, ao contrário do que acontece com a entrada de um novo produto no mercado.10
Hazell e Shakir identificaram, em revisão sistemática da literatura, elevada ocorrência de subregistro de reações adversas a medicamentos em sistemas de vigilância passiva. Uma estratégia recomendada para melhorar a cobertura e a qualidade da notificação é a educação continuada dos profissionais envolvidos. Os dois autores citados sugerem a implantação e avaliação de iniciativas estratégicas para melhorar a notificação de EA, tais como notificação on-line, participação de todos os profissionais de saúde, maior retorno aos notificadores e vínculo com a educação e formação continuada.11 Todo esse processo pode beneficiar a geração de dados de melhor qualidade e, consequentemente, uma avaliação mais apurada do perfil de segurança dos soros heterólogos (e outros medicamentos), intensificando o domínio do conhecimento a respeito da terapêutica e suas implicações.
O presente estudo descreveu o perfil de segurança dos soros heterólogos produzidos pelo Instituto Butantan e evidenciou lacunas nas atividades da Farmacovigilância. Para o aprimoramento da vigilância dos EA, recomenda-se a capacitação contínua dos profissionais, de modo a obter avanços na identificação de sinais de segurança e dos problemas de qualidade dos medicamentos. Tais medidas poderão, igualmente, repercutir em melhores resultados na comunicação das ocorrências de eventos adversos, na avaliação de risco e na manutenção de sistemas de informações sobre prescrição e uso seguro de medicamentos, contribuindo para a promoção da saúde e o bem-estar da população.