Introdução
A síndrome congênita associada à infecção pelo vírus Zika (SCZ) compreende um conjunto de sinais e sintomas apresentados por crianças nascidas de mães infectadas por esse vírus durante a gestação.1 A microcefalia, definida como ‘perímetro cefálico (PC) abaixo de -2 desvios-padrão para idade e sexo de acordo com curvas de referência’ é a manifestação mais marcante dessa síndrome. A SCZ também pode incluir alterações oculares, desproporção craniofacial e algumas deformidades articulares e de membros, mesmo que na ausência de microcefalia.2 Ainda não se conhecem completamente o espectro e as consequências da SCZ para a saúde e a esperança de vida das crianças acometidas, embora seja notável a gravidade dos casos, com evidência de prejuízos ao crescimento e desenvolvimento infantil.3-5
A literatura científica desconhecia o potencial teratogênico do vírus Zika até a ocorrência da epidemia no Brasil.6 Em 22 de outubro de 2015, a Secretaria Estadual de Saúde de Pernambuco notificou e solicitou apoio à Secretaria de Vigilância em Saúde (SVS) do Ministério da Saúde para realizar as investigações iniciais de 26 casos de crianças com microcefalia. Inicialmente, a microcefalia era definida como PC inferior a 33cm para ambos os sexos. Por se tratar de evento raro, ao ser comparado com o perfil clínico e epidemiológico da microcefalia no estado, concluiu-se que se tratava de evento de importância para a Saúde Pública estadual.
Em 11 de novembro de 2015, o Ministério da Saúde declarou Emergência em Saúde Pública de Importância Nacional (ESPIN) por alteração do padrão de ocorrência de microcefalias no Brasil (Portaria nº 1.813/2015) e notificou o fato à Organização Pan-Americana da Saúde (OPAS)/Organização Mundial da Saúde (OMS).7,8
Em 1º de fevereiro de 2016, a OMS declarou que o cluster de casos de microcefalia e outros distúrbios neurológicos relatados no Brasil, após uma situação semelhante observada na Polinésia Francesa em 2014, constituía uma Emergência de Saúde Pública de Importância Internacional (ESPII), sob o marco do Regulamento Sanitário Internacional (RSI).9
O ineditismo e a gravidade da situação epidemiológica em tela, aliados à declaração da ESPIN e ESPII, motivaram a articulação de uma resposta rápida, nos cenários nacional e internacional. Como resultado, evidências produzidas no âmbito da vigilância epidemiológica nacional, agregadas a resultados de estudos epidemiológicos, clínicos e laboratoriais, possibilitaram, em curto período de tempo, comprovar que a infecção pelo vírus Zika em gestantes causava microcefalia e outras malformações congênitas.10-12
O consenso sobre a implicação do vírus Zika na causalidade da SCZ foi extremamente relevante. Porém, este achado não excluiu a necessidade de novas investigações, tampouco o contínuo trabalho da vigilância e da atenção à saúde na detecção e acompanhamento dos casos. Não obstante as ações realizadas pelo Ministério da Saúde, Secretarias de Estado e Municipais de Saúde, e por outros setores do governo e da sociedade, a epidemia do vírus Zika espalhou-se por todas as grandes regiões brasileiras.13
O presente estudo objetivou descrever a distribuição temporal e espacial dos casos notificados e confirmados de SCZ em nascidos vivos no Brasil, no período 2015-2016.
Métodos
Realizou-se estudo descritivo com dados do Registro de Eventos em Saúde Pública - Microcefalia (RESP-Microcefalia) -, instituído pelo Ministério da Saúde em 19 de novembro de 2015, no âmbito da ESPIN.14 Trata-se de um formulário eletrônico elaborado para notificação de todos os casos e óbitos suspeitos de alterações no crescimento e desenvolvimento relacionadas à infecção pelo vírus Zika e outras etiologias infecciosas. Além das notificações de nascidos vivos, são registrados no RESP-Microcefalia casos suspeitos envolvendo fetos, abortos e natimortos. Apesar de disponibilizado em novembro de 2015, o RESP permitiu o registro de casos nascidos anteriormente, a partir de 1o de janeiro de 2015, e que se enquadrassem nas definições vigentes à época.
Neste estudo, foram incluídos apenas os nascidos vivos nos anos de 2015 e 2016, notificados no RESP-Microcefalia entre as semanas epidemiológicas 45/2015 e 2/2017 (8/11/2015 a 14/01/2017). Os dados foram extraídos no dia 18 de janeiro de 2017, às 10h (horário de Brasília).
Entre 2015 e 2016, diferentes definições de caso para notificação foram adotadas ao longo da epidemia:15
17 de novembro de 2015 a 12 de dezembro de 2015: recém-nascido pré-termo com PC menor ou igual ao percentil 3 na curva de Fenton16 segundo idade gestacional ao nascer e sexo; recém-nascido a termo ou pós-termo com PC menor ou igual a 33cm para ambos os sexos.
13 de dezembro de 2015 a 12 de março de 2016: recém-nascido pré-termo com PC menor ou igual ao percentil 3 na curva de Fenton16 segundo idade gestacional ao nascer e sexo; recém-nascido a termo ou pós-termo com PC menor ou igual a 32cm para ambos os sexos.
13 de março de 2016 a 31 de dezembro de 2016:17 recém-nascido pré-termo com PC inferior a -2 desvios-padrão para idade gestacional ao nascer e sexo de acordo com a referência do Intergrowth;18 recém-nascido a termo ou pós-termo com PC inferior a -2 desvios-padrão para idade gestacional ao nascer e sexo, de acordo com a referência da OMS.19
Para confirmação dos casos, foram realizadas investigações epidemiológicas sob responsabilidade das equipes de vigilância das Secretarias de Estado e Municipais de Saúde, a partir da revisão de prontuários, entrevistas com os responsáveis pela criança, avaliação clínica, realização de exames de imagem e laboratoriais, em atendimento às orientações do Ministério da Saúde.17 Na classificação final, foram considerados os resultados de exames de imagem e laboratoriais específicos para o vírus Zika, assim como para sífilis, toxoplasmose, rubéola, citomegalovírus e herpes vírus (STORCH), descritos na literatura como infecções que, comumente, causam anomalias congênitas.20 As definições adotadas para confirmação dos casos foram:17
- Caso confirmado por critério laboratorial para Zika: caso notificado que apresente diagnóstico laboratorial específico e conclusivo para vírus Zika, identificado em amostras do recém-nascido e/ou da mãe.
- Caso confirmado por critério laboratorial para STORCH: caso notificado que apresente diagnóstico laboratorial específico e conclusivo para sífilis, toxoplasmose, rubéola, citomegalovírus ou vírus da herpes simples, identificado em amostras do recém-nascido e/ou da mãe.
- Caso confirmado por exame de imagem: caso notificado que apresente alterações sugestivas de infecção congênita por qualquer método de imagem (ultrassonografia, tomografia computadorizada ou ressonância magnética), conforme protocolo estabelecido pelo Ministério da Saúde,1 sem resultados laboratoriais.
Neste estudo, foram considerados como casos confirmados de SCZ apenas aqueles com evidência laboratorial para Zika e/ou exames de imagem sugestivos de infecção congênita por esse vírus, excluídos os casos com confirmação laboratorial para ao menos uma das STORCH. Também foram excluídos pelo estudo os casos sem informação válida sobre a data de nascimento.
As séries temporais mensais de casos notificados e confirmados no período 2015-2016 foram descritas para o Brasil e suas grandes regiões nacionais. Foram calculados os coeficientes de prevalência (por 10 mil nascidos vivos) de casos notificados e confirmados no país, grandes regiões e Unidades da Federação (UF). Considerou-se como numerador o número anual de casos notificados/confirmados registrados no RESP-Microcefalia, e como denominador a média de nascimentos por região ou UF no período 2010-2014, de acordo com o Sistema de Informações sobre Nascidos Vivos (Sinasc).21 Optou-se por utilizar a média de nascimentos no denominador, considerando-se que os dados do Sinasc para o ano de 2016 ainda não estavam disponíveis.
As análises foram realizadas utilizando-se o software Stata versão 13.0 (StataCorp. 2013). Os coeficientes de prevalência de casos notificados e confirmados foram mapeados separadamente, por UF, para 2015 e 2016, utilizando-se o software Quantum GIS.
Para realização deste estudo, foi extraído do RESP-Microcefalia um banco de dados anonimizado, ou seja, sem apresentação de variáveis que permitissem a identificação dos indivíduos e suas famílias. Apenas o primeiro autor teve acesso ao banco de dados, sendo responsável pelas análises. Os demais autores consultaram tão somente os resultados consolidados. O estudo foi realizado no âmbito das ações de vigilância epidemiológica desenvolvidas por profissionais do Ministério da Saúde, no contexto da ESPIN; portanto, o projeto não foi passível de registro e avaliação pelo sistema de Comitês de Ética em Pesquisa, da Comissão Nacional de Ética em Pesquisa (CEP/CONEP), conforme define a Resolução do Conselho Nacional de Saúde (CNS) no 510, de 7 de abril de 2016.
Resultados
Foram notificados no RESP--Microcefalia 10.200 casos suspeitos de SCZ entre nascidos vivos no período 2015-2016; desses casos, 138 (1,4% do total) foram confirmados laboratorialmente para ao menos uma STORCH. Estes casos foram excluídos desta análise, assim como aqueles que não apresentavam informação válida para a data de nascimento (n=109; 1,1%) (Figura 1).
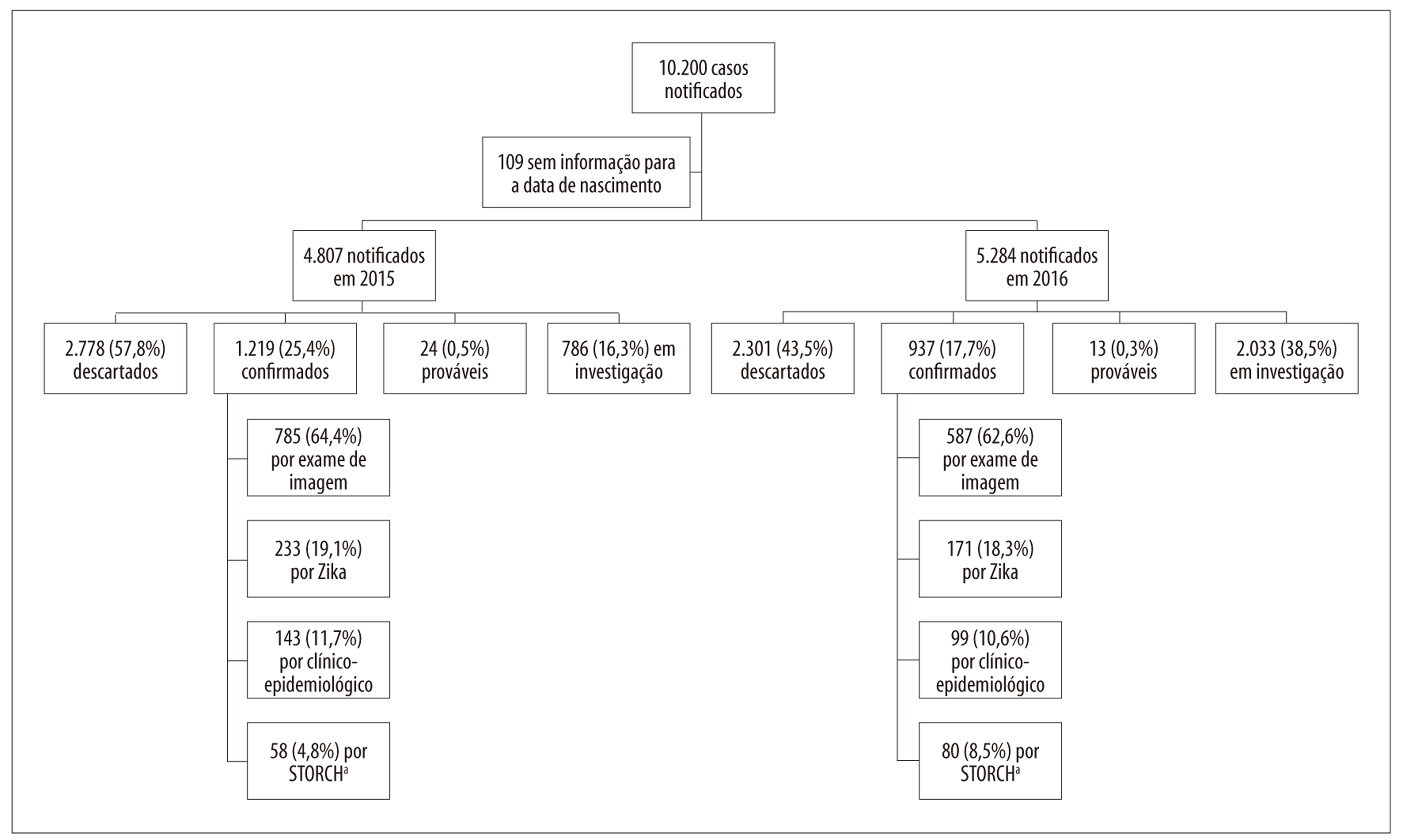
a) STORCH: sífilis, taxoplasmose, rubéola, citomegalovírus e herpes vírus.
Figura 1 - Distribuição dos casos notificados de síndrome congênita associada à infecção pelo vírus Zika em nascidos vivos, segundo ano de nascimento, classificação final e critério de confirmação, Brasil, 2015-2016
Do total de notificações incluídas no estudo (n=9.953), 2.819 (28,3%) permaneciam em investigação na semana 2/2017, a maioria delas referentes a nascidos em 2016 (72,1%; dados não apresentados em tabela). Entre os 2.018 casos confirmados de SCZ nascidos em 2015-2016, 404 (20,0%) apresentavam evidência laboratorial para o vírus Zika. Dos 4.749 casos notificados nascidos em 2015, 1.161 (24,4%) foram confirmados laboratorialmente para o vírus Zika ou apresentaram exame de imagem com alterações sugestivas de infecção congênita, enquanto a mesma proporção para as notificações de 2016 foi de 16,5% (857/5.204).
O coeficiente de prevalência de SCZ, considerando-se apenas os casos confirmados, foi de 3,8 por 10 mil nascidos vivos em 2015 e de 3,1 por 10 mil nascidos vivos em 2016, sendo maior na região Nordeste em ambos os anos (12,6 em 2015 e 7,1 em 2016). Observa-se um aumento nos coeficientes de prevalência em 2016 para as regiões Centro-Oeste (de 1,1 para 3,7) e Norte (de 0,4 para 1,4), quando comparados aos mesmos coeficientes para o ano de 2015 (Tabela 1).
Tabela 1 - Distribuição dos casos notificados e confirmados de síndrome congênita associada à infecção pelo vírus Zika em nascidos vivos, segundo ano de nascimento, região e Unidade da Federação de residência da mãe, Brasil, 2015-2016
| Região/ unidade da federação | 2015 | 2016 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Casos notificados | Casos confirmados | Casos notificados | Casos confirmados | |||||||
| n | n | % | Coeficiente de prevalênciaa | % por laboratório | n | n | % do total notificado | Coeficiente de prevalênciaa | % por laboratório | |
| Centro-Oeste | 251 | 28 | 11,2 | 1,1 | 17,9 | 386 | 81 | 21,0 | 3,7 | 43,2 |
| Distrito Federal | 12 | 2 | 16,7 | 0,3 | 50,0 | 55 | 8 | 14,5 | 1,6 | 25,0 |
| Goiás | 65 | 5 | 7,7 | 0,6 | 40,0 | 139 | 22 | 15,8 | 3,0 | 86,4 |
| Mato Grosso | 166 | 19 | 11,4 | 3,4 | 5,3 | 149 | 30 | 20,1 | 5,9 | 23,3 |
| Mato Grosso do Sul | 8 | 2 | 25,0 | 0,5 | 50,0 | 43 | 21 | 48,8 | 5,0 | 33,3 |
| Nordeste | 3.969 | 1.071 | 27,0 | 12,6 | 21,0 | 2.651 | 555 | 20,9 | 7,1 | 14,8 |
| Alagoas | 162 | 25 | 15,4 | 4,8 | 0,0 | 195 | 58 | 29,7 | 12,5 | 0,0 |
| Bahia | 704 | 232 | 33,0 | 11,4 | 6,5 | 734 | 163 | 22,2 | 8,4 | 6,1 |
| Ceará | 263 | 43 | 16,3 | 3,2 | 25,6 | 288 | 61 | 21,2 | 4,9 | 24,6 |
| Maranhão | 168 | 81 | 48,2 | 7,0 | 2,5 | 128 | 59 | 46,1 | 5,6 | 22,0 |
| Paraíba | 719 | 94 | 13,1 | 16,0 | 17,0 | 192 | 80 | 41,7 | 14,6 | 28,8 |
| Pernambuco | 1.345 | 332 | 24,7 | 22,7 | 48,5 | 828 | 64 | 7,7 | 4,9 | 28,1 |
| Piauí | 118 | 65 | 55,1 | 12,6 | 3,1 | 71 | 28 | 39,4 | 5,7 | - |
| Rio Grande do Norte | 313 | 99 | 31,6 | 20,0 | 3,0 | 128 | 15 | 11,7 | 3,6 | - |
| Sergipe | 177 | 100 | 56,5 | 27,6 | 15,0 | 87 | 27 | 31,0 | 8,3 | 11,1 |
| Norte | 120 | 12 | 10,0 | 0,4 | 16,7 | 379 | 58 | 15,3 | 1,9 | 24,1 |
| Acre | 9 | - | - | - | - | 42 | 1 | 2,4 | 0,6 | 100,0 |
| Amapá | 4 | 2 | 50,0 | 1,2 | - | 8 | 3 | 37,5 | 1,8 | - |
| Amazonas | 3 | - | - | - | - | 54 | 24 | 44,4 | 3,2 | 20,8 |
| Pará | 13 | 2 | 15,4 | 0,1 | 100,0 | 99 | 6 | 6,1 | 0,5 | 100,0 |
| Rondônia | 10 | 5 | 50,0 | 1,8 | - | 35 | 7 | 20,0 | 2,7 | 14,3 |
| Roraima | 1 | 1 | 100,0 | 0,9 | - | 29 | 11 | 37,9 | 10,1 | 9,1 |
| Tocantins | 80 | 2 | 2,5 | 0,8 | - | 112 | 6 | 5,4 | 2,6 | - |
| Sudeste | 379 | 48 | 12,7 | 0,4 | 2,1 | 1.621 | 161 | 9,9 | 1,4 | 24,2 |
| Espírito Santo | 54 | 2 | 3,7 | 0,4 | - | 156 | 16 | 10,3 | 3,2 | 50,0 |
| Minas Gerais | 33 | - | - | - | - | 217 | 15 | 6,9 | 0,6 | 6,7 |
| Rio de Janeiro | 150 | 42 | 28,0 | 1,8 | 2,4 | 616 | 103 | 16,7 | 4,8 | 14,6 |
| São Paulo | 142 | 4 | 2,8 | 0,1 | - | 632 | 27 | 4,3 | 0,5 | 55,6 |
| Sul | 30 | 2 | 6,7 | 0,0 | - | 167 | 2 | 1,2 | 0,1 | 50,0 |
| Paraná | 16 | - | - | - | - | 30 | 1 | 3,3 | 0,1 | 100,0 |
| Rio Grande do Sul | 13 | 2 | 15,4 | 0,1 | - | 131 | 0,0 | 0,0 | - | |
| Santa Catarina | 1 | - | - | - | - | 6 | 1 | 16,7 | 0,1 | - |
| Brasil | 4.749 | 1.161 | 24,4 | 3,8 | 20,1 | 5.204 | 857 | 16,5 | 3,1 | 20,0 |
a) Coeficiente de prevalência: número de casos por 10 mil nascidos vivos.
A Figura 2 apresenta a distribuição das notificações de nascidos vivos para os anos de 2015 e 2016, bem como os casos confirmados para o período, por mês de nascimento. Observou-se um pico de notificações no mês de novembro de 2015, com posterior redução até abril de 2016. Então, observou-se uma estabilização no número mensal de notificações até o mês de agosto, quando voltaram a cair. O número de casos confirmados acompanhou a curva de notificações, com pico nos meses de novembro e dezembro de 2015. Analisando-se a distribuição acumulada, encontra-se um aumento das notificações a partir de outubro de 2015, com um incremento acelerado até março de 2016, quando se nota uma diminuição do incremento mensal.

Figura 2 - Distribuição mensal e acumulada dos casos notificados e confirmados de síndrome congênita associada à infecção pelo vírus Zika em nascidos vivos, segundo mês de nascimento, região e Unidade da Federação de residência da mãe, Brasil, 2015-2016
Um terço dos municípios brasileiros (33,2%) apresentou pelo menos um caso suspeito notificado; menos da metade desses municípios apresentaram casos confirmados (40,8%). A região Nordeste concentrou maior número de municípios com casos e óbitos, notificados e confirmados, afetando 1.049 (58,5%) dos 1.794 municípios da região. A maioria dos casos notificados concentrou-se na região Nordeste do país (65,7%), seguida das regiões Sudeste (20,6%) e Centro-Oeste (6,5%). Os cinco estados com maior número de casos notificados foram Pernambuco (21,3%), Bahia (14,3%), Paraíba (9,0%), São Paulo (8,1%) e Rio de Janeiro (7,8%) (dados não apresentados em tabela).
A distribuição dos casos notificados e confirmados de SCZ em nascidos vivos, por mês de nascimento e região de residência da mãe, é apresentada na Figura 3. O Nordeste foi a região com maior número de notificações mensais de casos suspeitos nascidos entre os meses de agosto de 2015 e maio de 2016, assim como de casos confirmados no mesmo período. A maioria das demais regiões mantiveram um número similar de notificações mensais, ao longo desse período; a exceção coube à região Sudeste, onde se verificou aumento no número de notificações a partir de dezembro de 2015, embora sem incremento no número de casos confirmados.
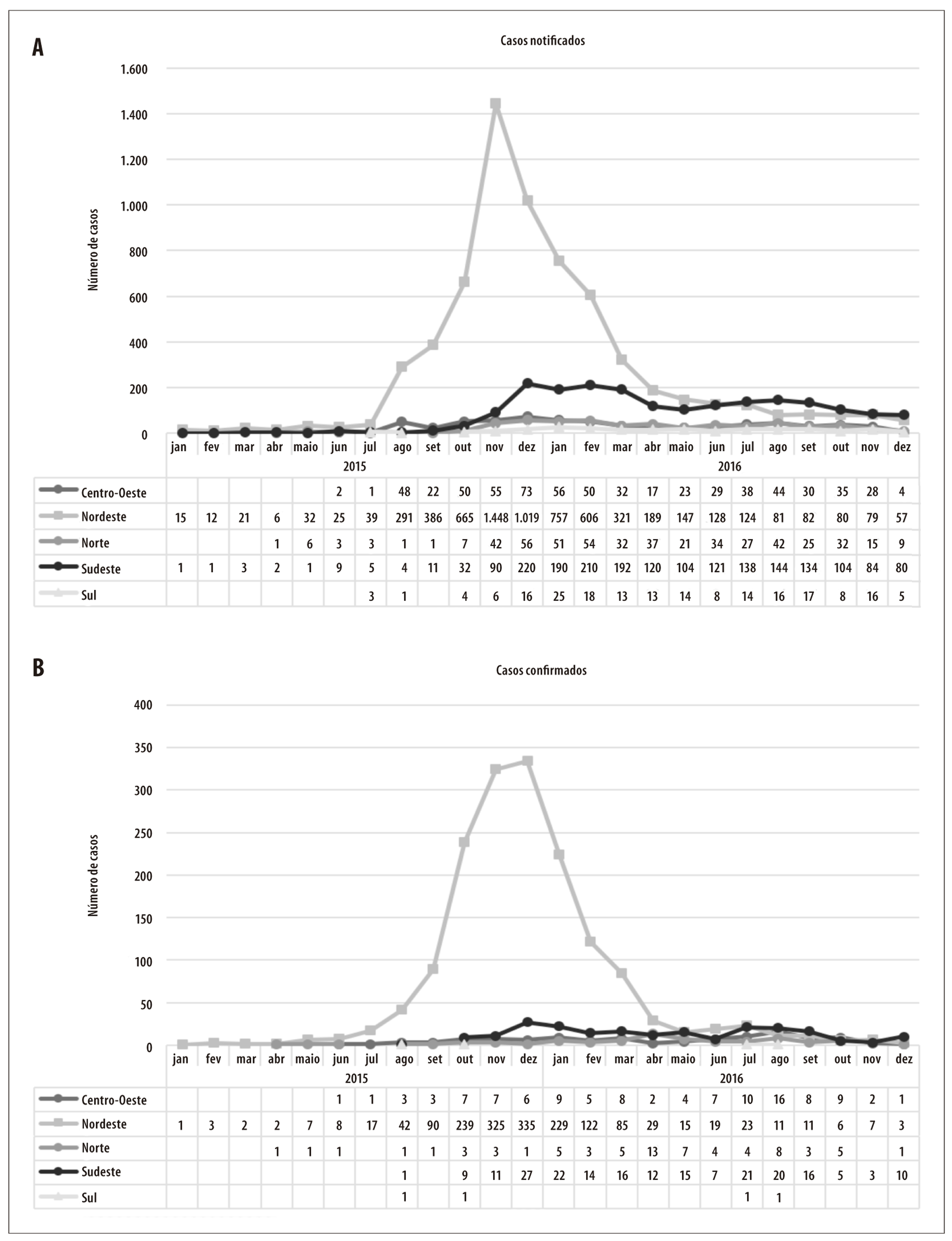
Figura 3 - Distribuição mensal dos casos notificados (A) e confirmados (B) de síndrome congênita associada à infecção pelo vírus Zika em nascidos vivos, segundo mês de nascimento e região de residência da mãe, Brasil, 2015-2016
Em 2015, observou-se coeficiente de prevalência de notificações igual ou superior a 20 casos por 10 mil nascidos vivos na maioria dos estados da região Nordeste, bem como nos estados de Mato Grosso e Tocantins (Figura 4). Para o mesmo ano, os estados do Rio Grande do Norte, Pernambuco e Sergipe apresentaram 20 ou mais casos confirmados por 10 mil nascidos vivos, enquanto os estados do Piauí, Paraíba e Bahia referiram coeficientes de prevalência de casos confirmados na faixa de 10 a 19 casos por 10 mil nascidos vivos.
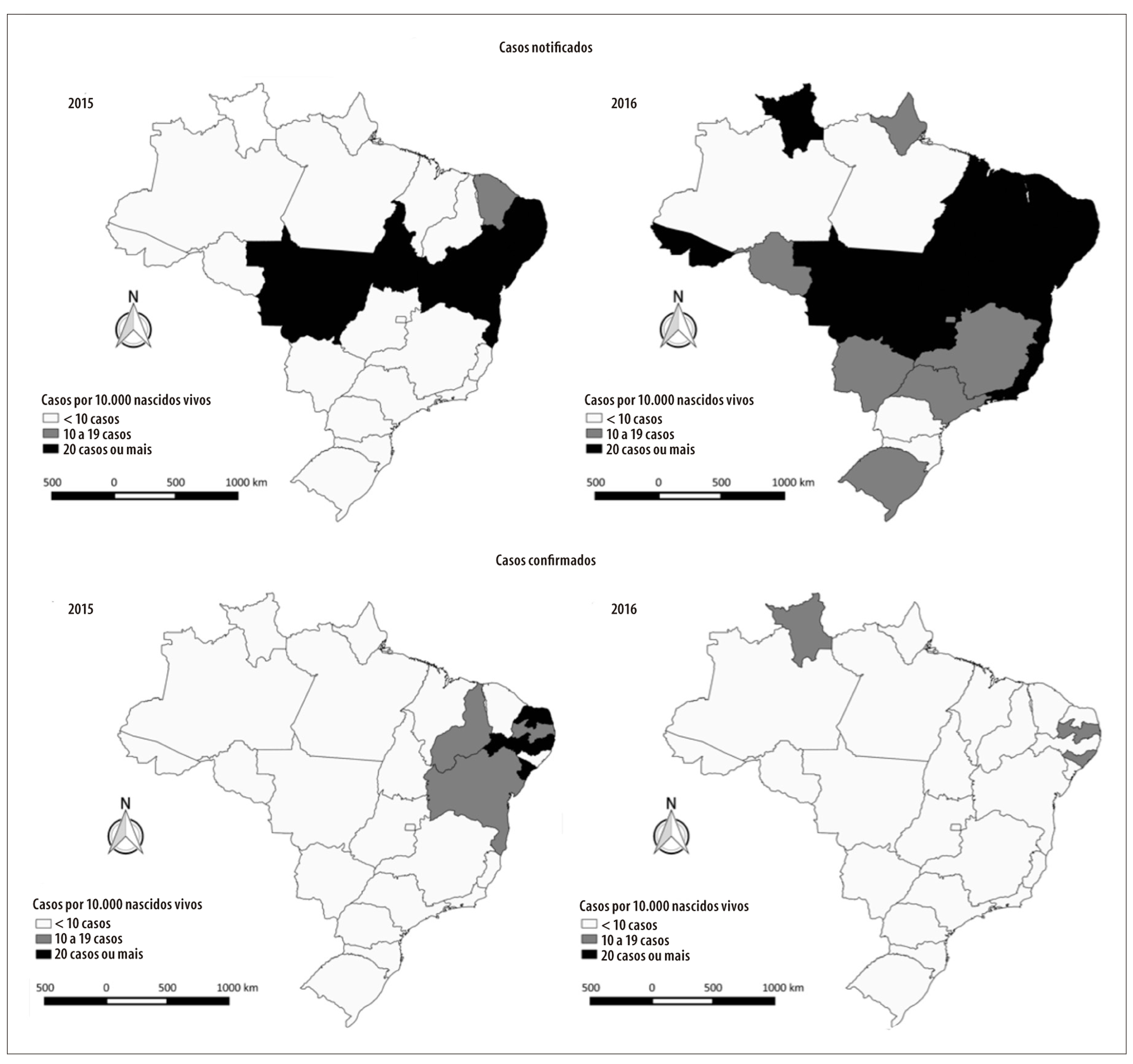
Figura 4 - Distribuição espacial dos coeficientes de prevalência (por 10 mil nascidos vivos) de casos notificados e confirmados de síndrome congênita associada à infecção pelo vírus Zika em nascidos vivos, segundo ano de nascimento e Unidade da Federação de residência da mãe, Brasil, 2015-2016
Em 2016, todos os estados do Nordeste apresentaram coeficientes de prevalência de casos notificados ≥20 casos por 10 mil nascidos vivos, assim como os estados do Acre, Roraima, Tocantins, Goiás, Mato Grosso, Espírito Santo e Rio de Janeiro. Para o mesmo ano, os casos confirmados apresentaram os coeficientes mais elevados (na faixa de 10 a 19 casos por 10 mil nascidos vivos) nos estados da Paraíba e Alagoas, na região Nordeste, e Roraima na região Norte (Figura 4).
Discussão
O presente estudo apresentou a distribuição dos casos notificados e confirmados de SCZ em território nacional desde a emergência da epidemia, em agosto de 2015, atravessando o pico epidêmico no último bimestre do mesmo ano e cobrindo seu declínio até o final do ano seguinte. A região Nordeste acusou a maior prevalência de casos, seguida pelas regiões Centro-Oeste e Norte.
Evidenciou-se o curto período entre a emergência e o declínio da epidemia, com posterior manutenção de um baixo número de casos novos de SCZ ao longo de 2016. Esse comportamento da SCZ é consistente com a característica “explosiva” da epidemia da doença pelo vírus Zika, previamente observada no Sudeste Asiático.22 Estima-se que, aproximadamente, três quartos dos pouco menos de 7.500 habitantes da ilha Yap, na Micronésia, foram infectados pelo vírus Zika durante o surto ocorrido em 2007, surto esse que desapareceu em três meses, sem registro de internações ou óbitos relacionados à doença. No surto ocorrido na Polinésia Francesa em 2013-2014, mais de 32 mil habitantes (12% da população do país) buscaram os serviços de saúde ao apresentarem sintomas clínicos sugestivos da infeção.23
No Brasil, a região Nordeste concentrou o maior número de casos de SCZ, indicando ser, provavelmente, o local de entrada do vírus no país.24 Cabe lembrar, também, que o Brasil, desde a década de 1940, tem sido palco de epidemias provocadas por dengue. No entanto, foi na década de 1980 que se observou a mais intensa circulação dos quatro sorotipos daquele vírus. Historicamente, estados das regiões Nordeste, Centro-Oeste e Sudeste têm sido responsáveis pelas maiores incidências de casos de dengue. Em 2014, 15,3% (n=90.192) dos casos prováveis de dengue registrados no país foram de residentes na região Nordeste.25
A presença do vetor Aedes aegypti, aliada a condições ambientais favoráveis a sua proliferação, possibilitaram a transmissão dos vírus da dengue, chikungunya, e logo do vírus Zika. Nesse contexto, estudo sobre dados do Sinasc revelou maiores coeficientes de prevalência de microcefalia entre nascidos vivos de mães com baixa escolaridade, cor da pele/raça negra e solteiras, características marcadoras de condições socioeconômicas mais baixas.26
As ações de prevenção e controle da febre pelo vírus Zika realizadas no Brasil, principalmente focadas no combate ao A. aegypti, podem ter contribuído para a diminuição do número de nascidos vivos com SCZ observado ao longo do ano de 2016, e em 2017.27 Concomitantemente à declaração da situação de ESPIN em novembro de 2015, foi acionado o Grupo Estratégico Interministerial de Emergência em Saúde Pública de Importância Nacional e Internacional. No mês seguinte, foi instituída a Sala Nacional de Coordenação e Controle para o enfrentamento das doenças transmitidas pelo A. aegypti. Também foram implantadas salas estaduais em todas as UF, com participação de representantes do Ministério da Saúde e das Secretarias de Saúde, além de outros setores, como Educação, Defesa Civil, Forças Armadas e Assistência Social.28
Entre as ações realizadas pelo Ministério da Saúde com o objetivo de imprimir mais celeridade às investigações e conclusão dos casos, destaca-se a implementação da Estratégia de Ação Rápida para o Fortalecimento da Atenção à Saúde e da Proteção Social de Crianças com Microcefalia, por meio da Portaria Interministerial no 405, de 15 de março de 2016, no âmbito do Sistema Único de Saúde (SUS) e do Sistema Único de Assistência Social (SUAS). Nos meses de março a outubro de 2016, foram realizados mutirões em diferentes serviços de referência para diagnóstico, possibilitando o encerramento das investigações epidemiológicas sobre um número substancial de casos e melhor encaminhamento para continuidade do cuidado nos pontos de atenção à saúde.28
Algumas limitações do presente estudo precisam ser consideradas, para adequada interpretação de seus achados. Primeiramente, a maioria dos casos confirmados foram concluídos com base em sinais observados mediante exames de imagem indicativos de alterações relacionadas a infecções congênitas, embora não específicas para o vírus Zika. As alterações mais descritas eram as calcificações e ventriculomegalia, utilizadas para confirmação sem identificação etiológica porque não são alterações patognomônicas para a SCZ.15 Em dezembro de 2016, com a publicação do documento de ‘Orientações Integradas de Vigilância e Atenção à Saúde no âmbito da Emergência de Saúde Pública’,1 disponibilizou-se um compilado de sinais e sintomas relacionados à SCZ, constantes de um consenso de especialistas construído em reunião realizada na cidade do Recife, Pernambuco, pela OPAS/OMS. Essa publicação permitiu uma melhor caracterização dos achados morfofisiológicos e neurológicos considerados para notificação dos casos suspeitos. Contudo, lacunas importantes no conhecimento a respeito das consequências da infecção congênita pelo vírus Zika permanecem, impossibilitando, até agora, uma caracterização definitiva da SCZ.
As limitações laboratoriais para confirmação dos casos foram e continuam sendo desafios importantes para uma investigação mais eficiente dos casos. Inicialmente, a confirmação laboratorial dos casos somente era possível por meio de reverse transcriptase-polymerase chain reaction (RT-PCR), com a detecção e diferenciação do RNA viral. A maior dificuldade, entretanto, encontrava-se na restrição de tempo para a coleta de material biológico necessário à realização do teste, dado o curto período de viremia. Desta forma, a obtenção de um resultado negativo não descartava a ocorrência da infecção, dado que o material para exame poderia não ter sido coletado no intervalo de tempo oportuno. Durante a emergência, houve a introdução do teste rápido para Zika como parte do rastreamento mas, por conta desses testes deverem ser confirmados por meio de sorologia, não poderiam ser utilizados para confirmação diagnóstica da SCZ. Desafios persistem quanto à validade dos testes existentes, especialmente do teste rápido e dos kits comerciais para realização de testes sorológicos.
Ao longo da ESPIN, foram adotadas diferentes definições de caso para notificação e classificação final dos casos, previamente apresentadas aqui. Essas mudanças, por si sós, dificultam o entendimento da real curva epidêmica, uma vez que o maior número de casos suspeitos notificados no final de 2015 pode ser - ainda que parcialmente - explicado pela maior sensibilidade dos critérios de notificação, ao incluírem recém-nascidos que não se enquadrariam na definição internacional de microcefalia. Contudo, a adoção de definições mais sensíveis, inicialmente, permitiu a identificação de recém-nascidos que não apresentavam microcefalia, de acordo com a definição internacional, mas que tinham alterações do sistema nervoso central em decorrência da infecção pelo vírus Zika. Além disso, tais mudanças refletem o caráter dinâmico da emergência e a participação ativa dos especialistas na construção e atualização dos protocolos de vigilância, especialmente por pesquisadores brasileiros, à medida que se apresentavam novas evidências científicas.
Entre os pontos positivos da resposta à ESPIN, destaca-se a rápida implementação do RESP-Microcefalia, possibilitando o registro da notificação, investigação e conclusão dos casos em todo o território nacional. Essa medida foi fundamental para a adesão dos estados, responsáveis pela gestão dos dados. Ademais, a integração de ações da vigilância e atenção à saúde ao longo da ESPIN possibilitou a produção de respostas mais eficientes, tanto para o diagnóstico situacional como para uma resposta institucional diante da emergência. As informações produzidas foram imprescindíveis para a melhor compreensão das manifestações da infecção pelo vírus Zika e suas potenciais consequências.29
Ressalta-se que este estudo apresenta a maior série de casos já publicada, oferecendo informações complementares àquelas disponibilizadas pelo Ministério da Saúde regularmente, em seus boletins epidemiológicos. Outrossim, a exclusão dos casos confirmados para outras STORCH da análise permitiu alcançar uma maior especificidade no que se refere à SCZ, na comparação com estudos prévios.
Os achados deste trabalho reforçam a importância da síndrome congênita pelo vírus Zika como grave problema de Saúde Pública, que ainda impõe desafios à investigação de quase um terço dos casos notificados em 2015-2016. Diante do desconhecimento sobre o vírus Zika e suas consequências, os resultados apresentados reforçam a necessidade de uma vigilância ativa e constante, especialmente da síndrome congênita a ele associada.











 texto en
texto en 


