Etiologia
A paracoccidioidomicose (PCM) é causada por fungos termodimórficos de duas principais espécies: Paracoccidoides brasiliensis (P. brasiliensis) e Paracoccidioides lutzii (P. lutzii).1P. brasiliensis é composto por um complexo de pelo menos cinco agrupamentos geneticamente isolados, classificados como espécies filogenéticas: S1a, S1b, PS2, PS3 e PS4.2,3,4 As espécies filogenéticas S1a e S1b são predominantemente encontradas na América do Sul, especialmente no Sudeste e Sul do Brasil, na Argentina e no Paraguai (Figura 1). A espécie PS2 tem uma distribuição irregular, menos frequentemente identificada e, até agora, os casos humanos foram identificados na Venezuela e no Sudeste do Brasil. As espécies de PS3 e PS4 são exclusivamente endêmicas da Colômbia e da Venezuela, respectivamente. Por sua vez, P. lutzii abriga uma única espécie, predominantemente distribuída no Centro-Oeste e na Amazônia (Brasil e Equador).1,5,6,7,8 A incidência real de cada espécie filogenética e sua implicação na prática clínica é difícil de se estabelecer, devido à falta de estudos comparando as formas PCM e as manifestações clínicas com o perfil genético dessas entidades.8 A imunodifusão radial contra os exoantígenos comumente usados, contendo uma glicoproteína de 43-kDa (gp43), sugere que esses fungos apresentam uma grande variabilidade antigênica.9 De acordo com estudos filogenéticos, diferentes isolados de Paracoccidioides sp são distribuídos em diferentes genótipos, encontrados em várias áreas endêmicas de PCM na América Latina. Em particular, os da região central do Brasil (Mato Grosso e Rondônia) apresentam menor taxa de similaridade genética. Os isolados de P. lutzii apresentam alta variabilidade antigênica específica de espécies,9 já avaliada em estudos proteômicos.

Fonte: Adaptado de Muñoz JF, Farrer RA, Desjardins CA, Gallo JE, Sykes S, Sakthikumar S, et al. (2016). Diversity, Recombination and Virulence across the Major Lineages of Paracoccidioides. mSphere. 2016; 1(5): e00213-16.
Pl = Paracoccidoidodes lutzii; PS2, PS3, PS4, S1a, S1b = espécies filogenéticas de P. brasiliensis.
Figura 1 - Distribuição geográfica de Paracoccidioides lutzii e das espécies crípticas de Paracoccidioides brasiliensis
Ecoepidemiologia
Na natureza, P. brasiliensis e P. lutzii se desenvolvem como estruturas filamentosas e produzem os propágulos infectantes chamados conídios10,11 (Figura 2). Uma vez inalados, os propágulos dão origem a formas leveduriformes do fungo, que constituirão sua forma parasitária nos tecidos do hospedeiro. Além dos humanos, outros animais (domésticos e silvestres) também se infectam pelo fungo, embora a doença ativa tenha sido constatada em poucos animais, como cães.10,12 O tatu-galinha é reconhecidamente um reservatório de P. brasiliensis, uma vez que o fungo pode ser facilmente cultivado a partir de seus órgãos internos (baço, fígado e linfonodos), indicando assim um processo sistêmico. P. lutzii ainda não foi isolado de tatus (Figura 2).

Fonte: Mendes RP e Bagagli E.
Figura 2 - Propagação de Paracoccidioides brasiliensis (Pb) e Paracoccidioides lutzii (Pl)
Surtos epidêmicos de PCM nunca foram observados, e a recuperação fúngica (cultivo) diretamente da sua forma saprofítica ambiental mostrou ser particularmente difícil de se obter sem reprodutibilidade. Em função desta dificuldade, considera-se “reservaria” a região onde se adquire a doença. Métodos sensíveis de biologia molecular, no entanto, indicam a presença frequente do fungo em solos e aerossóis, particularmente quando provenientes de tocas de animais ou de locais com teores de umidade média a alta, protegidos por coberturas vegetais.13
Mudanças nas características demográficas e na distribuição geográfica têm sido observadas nas últimas décadas. Possivelmente, a urbanização, a aplicação de métodos diagnósticos e a presença de comorbidades e imunossupressão expliquem parte dessas alterações. Além disso, fatores ambientais, com abertura de novas fronteiras, derrubada de florestas e produção de café, contribuíram para o panorama atual, com elevados níveis de incidência em algumas regiões de Rondônia.14
Influências da umidade do solo decorrente da estação chuvosa e temperatura entre 18-28 oC, possivelmente favorecendo a esporulação e dispersão aérea, bem como alterações climáticas decorrentes do fenômeno El Niño ocorrido em 1982/1983 foram associados a um surto de casos agudos, descrito um a dois anos após, na região Sudeste do Brasil.15
Como é adquirida a infecção por P. brasiliensis?
O grande fator de risco para aquisição da infecção são as profissões ou atividades relacionadas ao manejo do solo contaminado com o fungo, como atividades agrícolas, terraplenagem, preparo de solo, práticas de jardinagens, transporte de produtos vegetais, entre outros (Figura 2). Em todas as casuísticas, observa-se que a grande maioria dos pacientes exerceu atividade agrícola nas duas primeiras décadas de vida, tendo nessa época provavelmente adquirido a infecção, embora as manifestações clínicas tenham surgido muitos anos depois.11 A maioria destes pacientes, quando procuram atenção médica, já saíram da área endêmica, residindo em centros urbanos, onde exercem outras atividades, não ligadas ao trato do solo. Tabagismo (>20cigarros/dia por >20 anos) e alcoolismo (>50g/dia)16 estão frequentemente associados à micose. Ao contrário de outras micoses, como a criptococose, a histoplasmose disseminada e a candidíase, a PCM não é usualmente relacionada a doenças imunodepressoras. Entretanto, há casos desta micose associados à infecção pelo HIV, a neoplasias e, mais raramente, a transplantes de órgãos e ao uso de imunobiológicos.17,18,19,20
Incidência, prevalência e mortalidade
Uma vez que a PCM não se constitui em doença de notificação compulsória, não temos dados precisos sobre sua incidência no Brasil. Os cálculos de prevalência, incidência e morbidade da micose baseiam-se em relatos de inquéritos epidemiológicos, séries de casos e dados de hospitalização e mortalidade.21 Com base na experiência de serviços de referência no atendimento de pacientes com PCM, acredita-se que sua incidência em zonas endêmicas varie de 3 a 4 novos casos/milhão até 1 a 3 novos casos por 100 mil habitantes ao ano. Cerca de 80% dos casos são registrados, no Brasil, particularmente nos estados de São Paulo, Paraná, Rio Grande do Sul, Goiás e Rondônia (Figura 3).2 Na América Latina, casos são mais frequentemente registrados na Argentina, na Colômbia, na Venezuela, no Equador e no Paraguai. Estimativas de incidência anual no Brasil variam de 0,71 caso a 3,70 casos por 100 mil hab.,21 com registros recentes de incidência de 9,4 casos por 100 mil hab. em Rondônia - sendo que, em dois municípios, há incidências próximas de 40 casos por 100 mil hab.14 Informações registradas no Ministério da Saúde atestam que 3.181 casos de óbito por PCM foram registrados no Brasil entre 1980 e 1995, resultando em taxa de mortalidade por PCM de 1,45 caso por milhão de habitantes (2,59 para a região Sul; 2,35 para o Centro Oeste; 1,81 para o Sudeste; 1,08 para o Norte; e 0,20 para o Nordeste).22 Nesse estudo, os autores apontaram a PCM como a oitava causa de mortalidade por doença infecciosa predominantemente crônica entre as doenças infecciosas e parasitárias - taxa inclusive maior que a da mortalidade por leishmanioses, e a mais alta entre as micoses sistêmicas. Dados recentes de 13.683 pacientes hospitalizados, de janeiro de 1998 a dezembro de 2006, com micoses sistêmicas,23 apontam a PCM como a responsável pelo maior número de internações (49%) entre essas micoses, destacando-se as taxas de hospitalização nas regiões Norte e Centro-Oeste, sem grande diferença na mortalidade pela micose em pacientes hospitalizados (Figura 3).
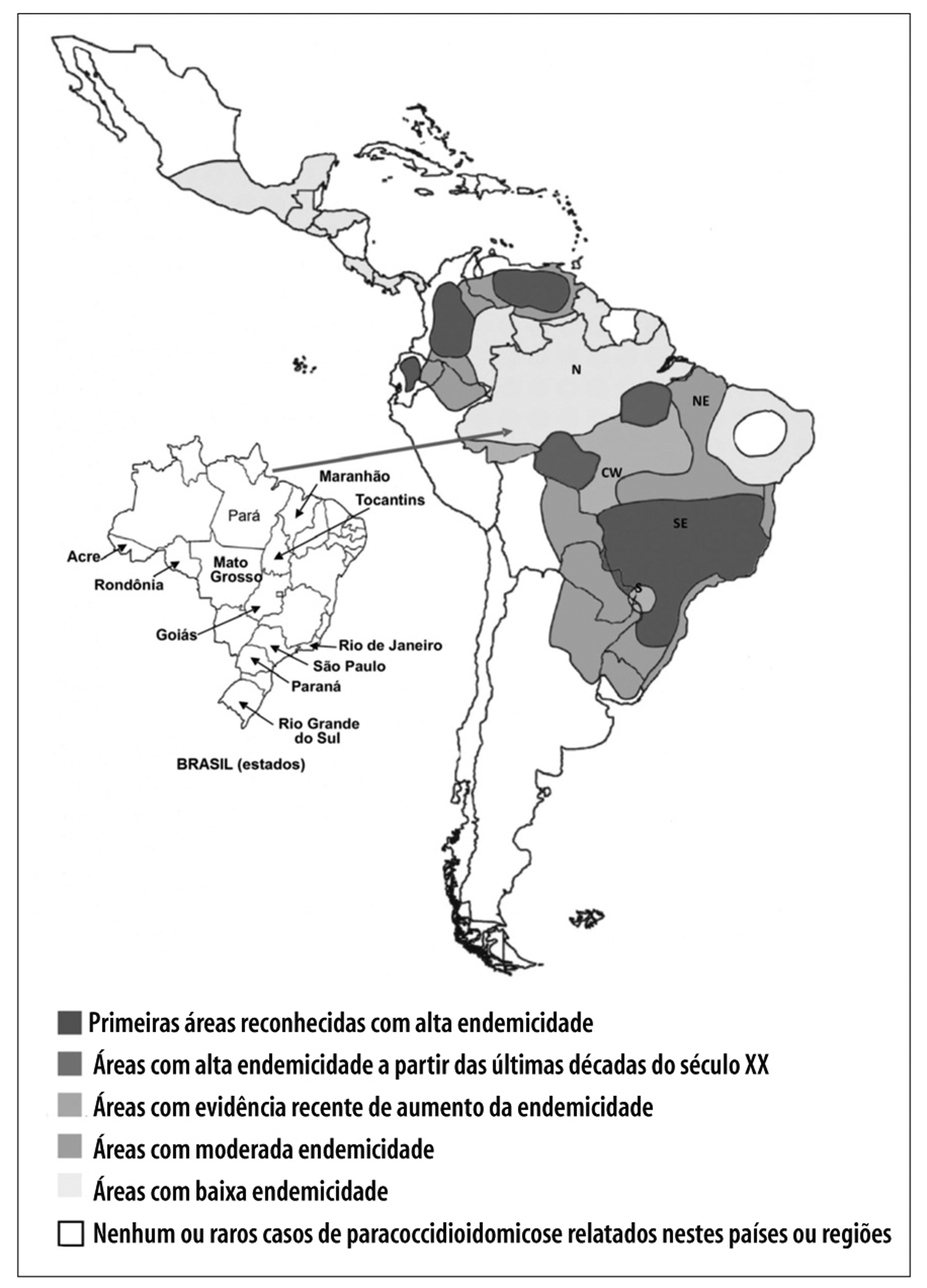
Fonte: Martinez R, 2017.21
Figura 3 - Áreas geográficas da endemicidade da paracoccidioidomicose na América Latina
Faixa etária e distribuição entre gêneros
A infecção é prioritariamente adquirida nas duas primeiras décadas de vida, com um pico de incidência entre 10 e 20 anos de idade. A apresentação de manifestações clínicas ou a evolução para doença é incomum neste grupo, ocorrendo mais frequentemente em adultos entre 30 e 50 anos, como reativação de foco endógeno latente.10 Embora haja grandes variações entre as regiões, na média estima-se que cerca de 10% dos casos da doença ocorram até os 20 anos de idade e os demais ocorram em idade mais avançada. A razão de acometimento da PCM em adultos varia entre 10 a 15 homens para uma mulher, o que não ocorre na infância, em que a infecção e a doença se distribuem uniformemente entre ambos os sexos, com ligeiro predomínio do masculino em adultos jovens.
Imunopatogenia
O controle da infecção depende de resposta imune celular efetiva, tendo os linfócitos T um papel central. Na PCM, padrões específicos de regulação da imunidade mediada por linfócitos T têm sido associados às diferentes apresentações clínicas do espectro da doença.24 A maioria dos indivíduos de área endêmica infectados por Paracoccidioides spp não desenvolve a doença, exibindo um padrão tipo T-helper [Th] tipo 1 da resposta imune, caracterizado pela síntese de citocinas que ativam macrófagos e linfócitos TCD4+ e TCD8+, resultando na formação de granulomas compactos e controle da replicação do fungo;25,26 eventualmente, formas quiescentes podem persistir no interior de granulomas. Indivíduos infectados que evoluem para doença apresentam resposta Th-1 deficiente, cuja magnitude se correlaciona com a gravidade da moléstia.25,26
Doentes que apresentam as formas mais graves - como a forma aguda/subaguda (FA) ou a forma crônica (FC) disseminada grave - evoluem com predomínio de resposta tipo Th-2 e Th-9, promovendo ativação de linfócitos B, secreção de altos títulos de anticorpos específicos (inclusive IgE), hipergamaglobulinemia e eosinofilia, em detrimento da formação de granulomas compactos.27 Doentes com a FC crônica unifocal ou multifocal, em que a doença é menos grave/disseminada e a carga fúngica menor, também exibem depressão da resposta Th-1, mas em menor grau que nos doentes com a FA ou FC disseminada grave; estes doentes conseguem formar granulomas que restringem, ainda que parcialmente, a replicação do fungo.25,26 Nestes pacientes, a perda da função Th-1 seria parcialmente compensada pelas respostas tipo Th-17 e Th-22, que promovem resposta inflamatória de mucosas com intensa participação de neutrófilos.27 De fato, a FC caracteriza-se por comprometimento de mucosas, especialmente do trato respiratório.
Células T reguladoras também participam da regulação da resposta anti- Paracoccidioides, atuando como supressoras da resposta imune celular, contribuindo para a anergia anti-Paracoccidioides observada principalmente nas formas mais graves da doença.28,29
Não se conhecem os fatores determinantes dos diferentes desfechos no espectro da PCM. Estudos preliminares sugerem a eventual participação do background imunogenético.30 Entretanto, o conhecimento das alterações da resposta imune que resultam da infecção é de relevância clínica para se compreender a necessidade de tratamento prolongado, até o estabelecimento de resposta imune celular eficiente. Células leveduriformes quiescentes podem persistir no interior de granulomas, por razões ainda não completamente estabelecidas, levando a recidivas da doença. De fato, com o tratamento, as alterações da resposta imune tendem a regredir e passa a predominar a resposta (protetora) do tipo Th-1. Experimentos in vitro modulando e restaurando resposta Th-1 em doentes corroboram esta observação.31 Entretanto, evidências sugerem que esta restauração não alcança a magnitude da resposta Th-1 dos indivíduos infectados que não desenvolvem a doença.32 Finalmente, não se demonstrou o papel protetor em relação aos altos níveis séricos de anticorpos específicos em pacientes com formas mais disseminadas.
Classificação das formas clínicas e avaliação de gravidade
A PCM pode comprometer qualquer órgão, aparelho ou sistema, como revela a Tabela 1,33,34 que apresenta achados clínicos e de autópsia, cuja diversificação tende a dificultar sua classificação.
Tabela 1 - Órgãos envolvidos em pacientes com paracoccidioidomicose
| Órgãos | Aspectos clínicos | Necropsias | ||||
|---|---|---|---|---|---|---|
| Belissimo-Rodrigues et al. 33* | Franco et al. 34** | Franco et al. 34** | ||||
| N | % | N | % | N | % | |
| Pulmão | 778 | 63,8 | 128 | 74,0 | 24 | 96,0 |
| Brônquio/traqueia | 5 | 0,4 | - | - | - | - |
| LInfonodomegalia | 618 | |||||
| Generalizada | 342 | 28,1 | ||||
| Localizada | 276 | 22,6 | ||||
| Boca, faringe, laringe | 83 | 48,0 | 15 | 60,0 | ||
| Mucosa oral | 610 | 50,0 | ||||
| Laringe | 196 | 16,1 | ||||
| Mucosa nasal | 19 | 1,6 | - | - | - | - |
| Glândulas adrenais | 26 | 2,1 | 6 | 3,5 | 11 | 44,0 |
| Sistema nervoso central | 42 | 3,4 | 1 | 0,6 | 9 | 36,0 |
| Fígado | - | - | 0 | 0,0 | 8 | 32,0 |
| Baço | 57 | 4,7 | 0 | 0,0 | 7 | 28,0 |
| Pele | 361 | 29,6 | 22 | 12,7 | 6 | 24,0 |
| Rins | - | - | 0 | 0,0 | 4 | 16,0 |
| Medula óssea | - | - | 0 | 0,0 | 3 | 12,0 |
| Coração | - | - | 0 | 0,0 | 3 | 12,0 |
| Trato digestivo | 92 | 7,5 | 6 | 6,5 | 2 | 8,0 |
| Testículos | 9 | 0,7 | 1 | 0,6 | 2 | 8,0 |
| Próstata | - | - | 1 | 0,6 | 2 | 8,0 |
| Olhos | - | - | 2 | 1,2 | 0 | 0,0 |
| Mamas | - | - | 1 | 0,6 | 0 | 0,0 |
| Osteoarticular | 27 | 2,2 | - | - | - | - |
Fonte: Elaboração própria a partir dos dados de Belissimo-Rodrigues et al.;33 Franco et al.34
Notas: *1.219 pacientes da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (USP).
**173 pacientes e 25 necropsias da Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (Unesp).
Diversas classificações de formas clínicas da PCM já foram publicadas, baseando-se em diferentes critérios, tais como topografia das lesões, história natural da doença, gravidade do quadro clínico e resultados de reações sorológicas, entre outros. Este consenso adotou a classificação apresentada no International Colloquium on Paracoccidioidomycosis, realizado em fevereiro de 1986 em Medellín, Colômbia, exposta a seguir.35
I) Infecção paracoccidioidica
II) Paracoccidioidomicose (doença)
A) Forma aguda/subaguda (juvenil)
- Moderada
- Grave
B) Forma crônica (do adulto)
- Leve
- Moderada
- Grave
III) Forma residual ou sequelas
A infecção paracoccidioidica caracteriza-se pela presença de contato de indivíduos saudáveis com fungos do genêro Paracoccidioides spp, identificado pela presença de reação intradérmica positiva a antígeno específico e achados de fungos latentes em necropsia.36
Formas clínicas da PCM
Forma aguda/subaguda (forma juvenil)
A forma aguda/subaguda da PCM é responsável por 5-25% dos casos, podendo ser mais frequente em algumas regiões endêmicas e quase nunca observada em outras. No Brasil, é mais comumente observada nos seguintes estados: Maranhão, Minas Gerais, Pará, Goiás e São Paulo.
Sua incidência parece estar diminuindo em algumas áreas endêmicas.37 Predomina em crianças e adolescentes e adultos jovens, podendo eventualmente acometer adultos com mais de 30 (até os 40) anos de idade. A distribuição por gênero é praticamente igual, particularmente entre crianças.33,37,38,39
Esta forma clínica mostra uma evolução rápida, com ampla disseminação do fungo a múltiplos órgãos e sistemas. Em geral, os pacientes são diagnosticados poucas semanas após o início dos sintomas. A maioria deles demonstra envolvimento do sistema fagocítico-mononuclear, destacando-se a presença de linfadenomegalia localizada ou generalizada, que pode, na evolução, apresentar supuração, fistulização e hepatoesplenomegalia, além de manifestações digestivas, lesões cutâneas (ou de mucosas), envolvimento osteoarticular e, raramente, comprometimento pulmonar. Febre, perda de peso, anorexia e emagrecimento acompanham com frequência o quadro clínico. Linfadenomegalias intra-abdominais podem coalescer, produzindo massas tumorais que exercem compressão em vários órgãos, tais como colédoco e alças intestinais38(Figura 4 e Figura 5). Um destaque entre as alterações laboratoriais nessa forma é a eosinofilia periférica, que pode ocorrer em 30 a 50% dos casos.38,39,40 A eosinofilia mais raramente pode chegar a níveis elevados, de até 70%.
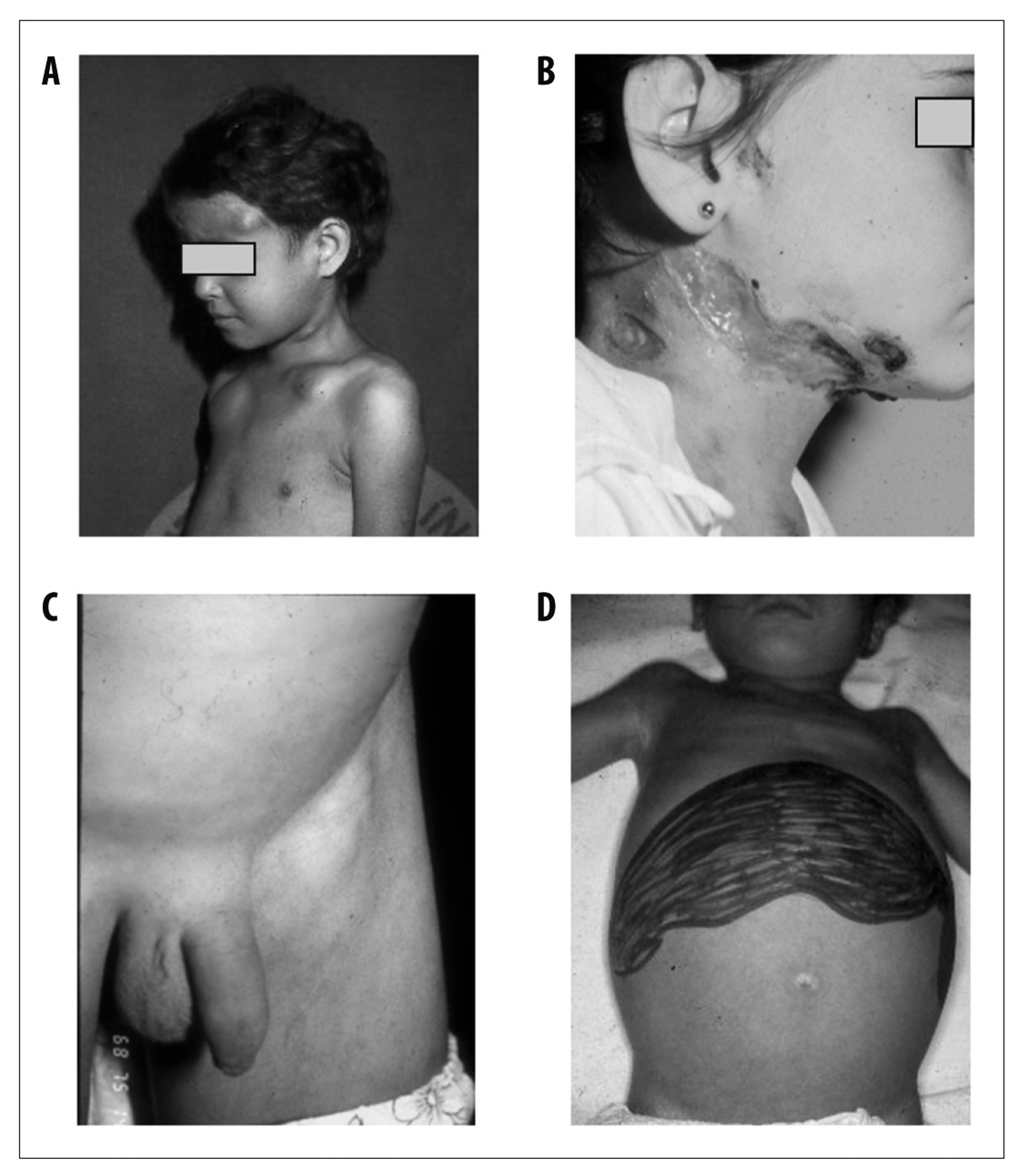
Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.39
Obs.: A = abscessos em regiões frontal e clavicular, resultantes do acometimento osteoarticular; B = criança do sexo feminino apresentando importante acometimento linfático abscedado; C = linfoadenomegalia inguinal; D = acometimento linfático-abdominal com ascite e hepatoesplenomegalia.
Figura 4 - Forma aguda da paracoccidioidomicose em crianças
Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.39
Obs: A = massas ganglionares em região supraclavicular, cervical e submandibular; B = linfoadenomegalia da PCM, que deve ser diferenciada de doenças hematológicas, como linfoma; C = lesões ulceradas de aspecto verruciforme em face e pavilhão, resultante de disseminação hematogênica; D = lesões de aspecto papulonodular e ulceradas, resultantes de disseminação hematogênica.
Figura 5 - Pacientes com a forma aguda/subaguda (tipo juvenil) da Paracoccidioidomicose(PCM)
Forma crônica (do adulto)
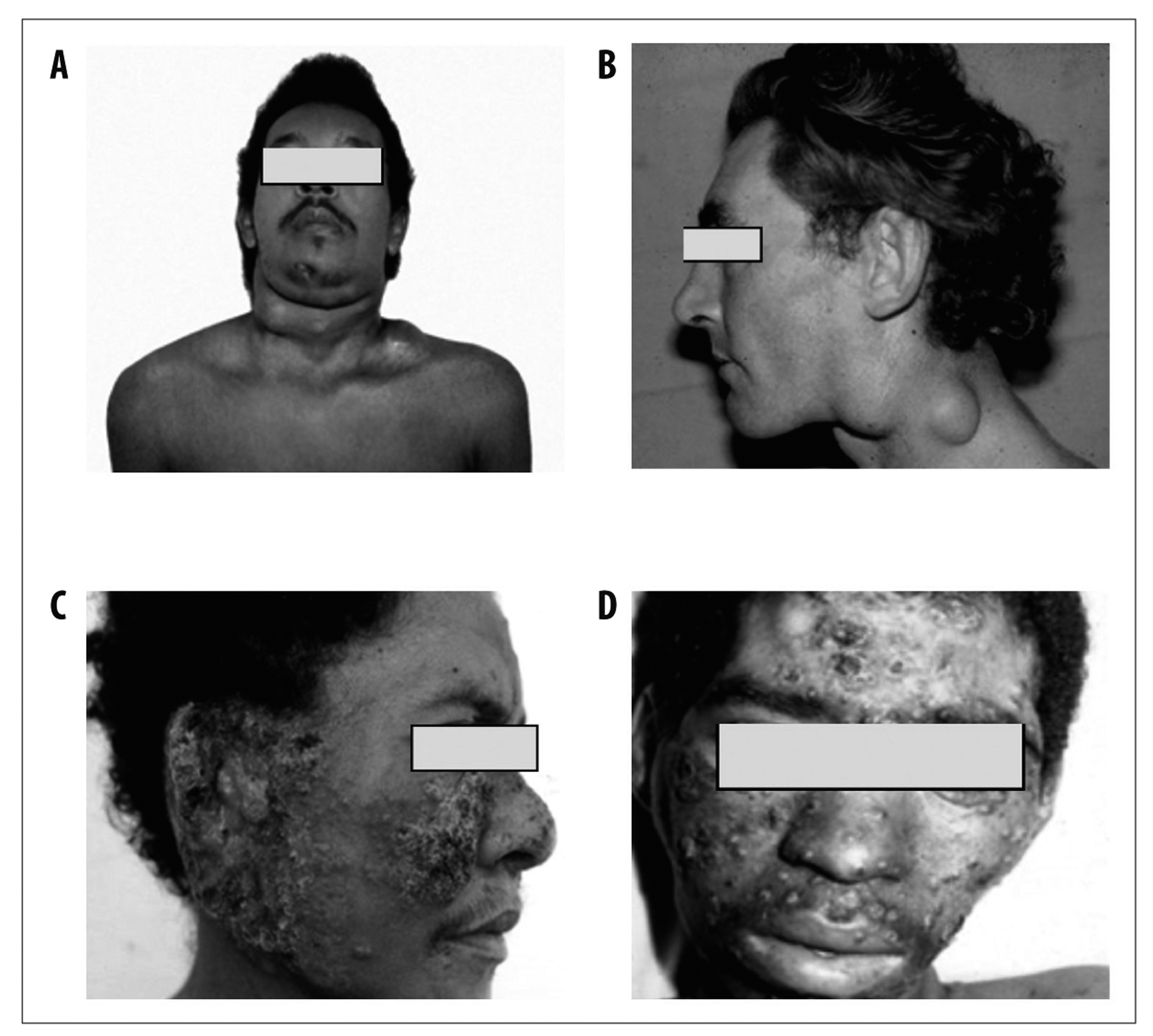
Esta forma clínica é responsável pela maioria dos casos de PCM, com prevalência de 74 a 96%. Apresenta-se em geral em adultos com 30 a 60 anos de idade e predomina no sexo masculino - razão de masculinidade igual a 22:1. A doença instala-se de forma mais lenta, com duração da sintomatologia acima de quatro a seis meses e, por vezes, acima de um ano. Em alguns casos, a instalação é silenciosa e a doença é flagrada por exame solicitado para fins trabalhistas ou check-up. O comprometimento pulmonar está presente em 90% dos pacientes.41,42 Além dos pulmões, mucosa das vias aerodigestivas superiores e pele são os sítios mais acometidos pela PCM (Figura 6 e Figura 7).
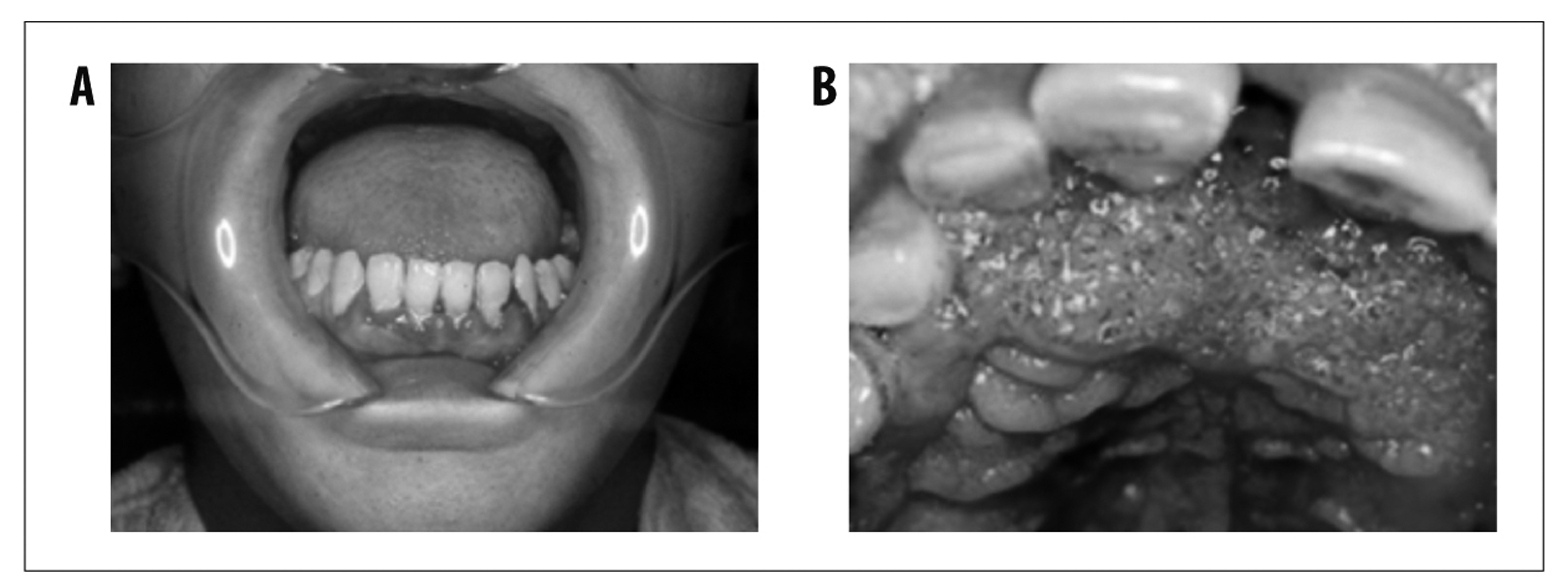
Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.
Obs.: A = gengivoestomatite; B = estomatite moriforme de Aguiar Pupo.
Nota: As lesões podem se apresentar como úlceras rasas, extensas, ou lesões ulcerovegetantes, com pontilhado hemorrágico característico (lesão moriforme). Embora isso seja pouco frequente, podem se estender para o vestíbulo nasal, causando perfuração de palato e de septo nasal, com sequelas inestésicas e funcionais. Na forma aguda, o comprometimento da mucosa oral é pouco frequente.
Figura 6 - Acometimento oral na forma crônica da paracoccidioidomicose

Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.
Obs.: A = lesões cutâneas papulosas e ulcerocrostosas em face; B = acometimento perioral e mentoniano; C = linfonodos cervicais e submandibulares fistulizados; D = lesão vegetante, com bordas irregulares em região perianal.
Nota: As lesões cutâneas ocorrem por contiguidade, a partir de mucosas comprometidas, linfonodos fistulizados ou acometimento ósseo, por disseminação hematogênica e, excepcionalmente, por implantação traumática do fungo.47 Caracterizam-se pelo polimorfismo - ulcerocrostosas, moluscoides, papulosas ou acneiformes -, e se localizam de preferência no polo cefálico e áreas periorificiais.48 Deve-se registrar que pacientes com a síndrome de Addison apresentam hiperpigmentação cutânea e mucosa.
Figura 7 - Aspectos clínicos da forma crônica da paracoccidioidomicose
Quanto à gravidade, a forma crônica pode ser classificada em leve, moderada e grave.35 Os casos graves são definidos pelo encontro de três ou mais dos seguintes critérios: i) perda ponderal maior que 10% do peso habitual; ii) intenso comprometimento pulmonar; iii) acometimento de outros órgãos, tais como glândulas adrenais, sistema nervoso central e ossos; iv) presença de linfonodos acometidos em múltiplas cadeias, superficiais ou profundas, do tipo tumoral (>2,0cm de diâmetro, sem supuração) ou do tipo supurativo; v) títulos de anticorpos elevados.
Casos graves são representados por pacientes com instabilidade clínica, devido a insuficiência respiratória, disfunção adrenal, síndrome neurológica ou abdome agudo.
Casos leves são aqueles com perda ponderal abaixo de 5% do peso habitual e envolvimento de um único órgão ou comprometimento restrito de órgãos ou tecidos sem disfunção.
Os critérios de gravidade, acima descritos, auxiliam no planejamento da terapêutica do paciente.
Há pacientes que apresentam manifestações clínicas compatíveis com a forma aguda/subaguda associada a outras, em geral observadas na forma crônica, dificultando a classificação. Em geral, esses pacientes revelam doença muito generalizada, com intensa supressão da imunidade celular. Essa forma clínica foi denominada PCM forma mista.43
Formas residuais (sequelas)
As formas residuais, também chamadas sequelas, caracterizam-se pelas manifestações clínicas decorrentes de alterações anatômicas e funcionais causadas pelas cicatrizes que se seguem ao tratamento da PCM. As sequelas são observadas em vários órgãos, com maior incidência em pulmões, pele, laringe, traqueia, glândulas adrenais, mucosa das vias aerodigestivas superiores, sistema nervoso central e sistema linfático, o que explica a diversidade do quadro clínico.44,45,46
Atendimento inicial, abordagem diagnóstica e rotina de seguimento ambulatorial de pacientes com PCM
Sendo a PCM uma micose sistêmica, qualquer sítio orgânico pode ser acometido. A atenção do observador deve ser inicialmente dirigida ao estado geral do paciente e, então, aos órgãos e sistemas que são mais frequentemente comprometidos, segundo as formas de apresentação da doença: PCM aguda/subaguda e PCM crônica. Conforme rotina habitual de atendimento médico, todos os pacientes devem ter exame físico geral detalhado, lembrando-se de relatar avaliação de peso e altura, para permitir a caracterização do estado nutricional.
Avaliação geral de paciente com forma aguda/subaguda
Nessa forma clínica, cabe destacar o papel fundamental da anamnese e do exame físico que, se bem realizados, podem mostrar o grau de envolvimento multissistêmico da doença; a presença de linfadenomegalia em várias cadeias linfáticas, de lesões cutâneas, da hepatoesplenomegalia ou de massas abdominais pode ser confirmada durante o exame físico do paciente. Além disso, o exame clínico pode ainda detectar a presença de icterícia, de ascite e de edema periférico. Estes últimos justificam a investigação de hipoalbuminemia. Sinais de envolvimento suprarrenal, assim como o envolvimento neurológico, são raros nessa forma clínica. Queixas digestivas, tais como dor abdominal, diarreia crônica disabsortiva e vômitos, também são bastante frequentes. Febre e perda de peso completam o quadro clínico.40 A presença de tumoração ou de dor em região óssea requer a identificação de lesões ósseas.
Exames laboratoriais e de imagem - forma aguda/subaguda
Hemograma completo e VHS
Bioquímica hepática (alanina aminotransferase, fosfatase alcalina)
Proteínas totais e frações
Avaliação da função renal e metabólica (creatinina sérica) e eletrólitos (sódio - Na e potássio - K)
Raio X do tórax (póstero-anterior e perfil)
Os exames de imagem - tais como ultrassonografia, tomografias computadorizadas, ressonância magnética e mapeamento cintilográfico - só devem ser realizados quando houver suspeita clínica ou alterações laboratoriais que indiquem envolvimento de órgãos ou sistemas que não possam ser avaliados apenas com o exame físico.
Avaliação geral de paciente com forma crônica
Na forma crônica, a anamnese e o exame físico devem obrigatoriamente incluir a pesquisa de sinais e sintomas relacionados ao envolvimento pulmonar, tegumentar e laríngeo41,46 (tosse, dispneia, expectoração mucopurulenta, lesões ulceradas de pele e de mucosa da naso-orofaringe, odinofagia, disfagia e disfonia); linfático (adenomegalia); adrenal49,50 (astenia, emagrecimento, hipotensão, escurecimento de pele, dores abdominais); do sistema nervoso central51,52 (cefaleia, déficit motor, síndrome convulsiva, alteração de comportamento e/ou nível de consciência); e comprometimento digestivo (diarreia e síndrome de má absorção)53,54 (Figura 8).
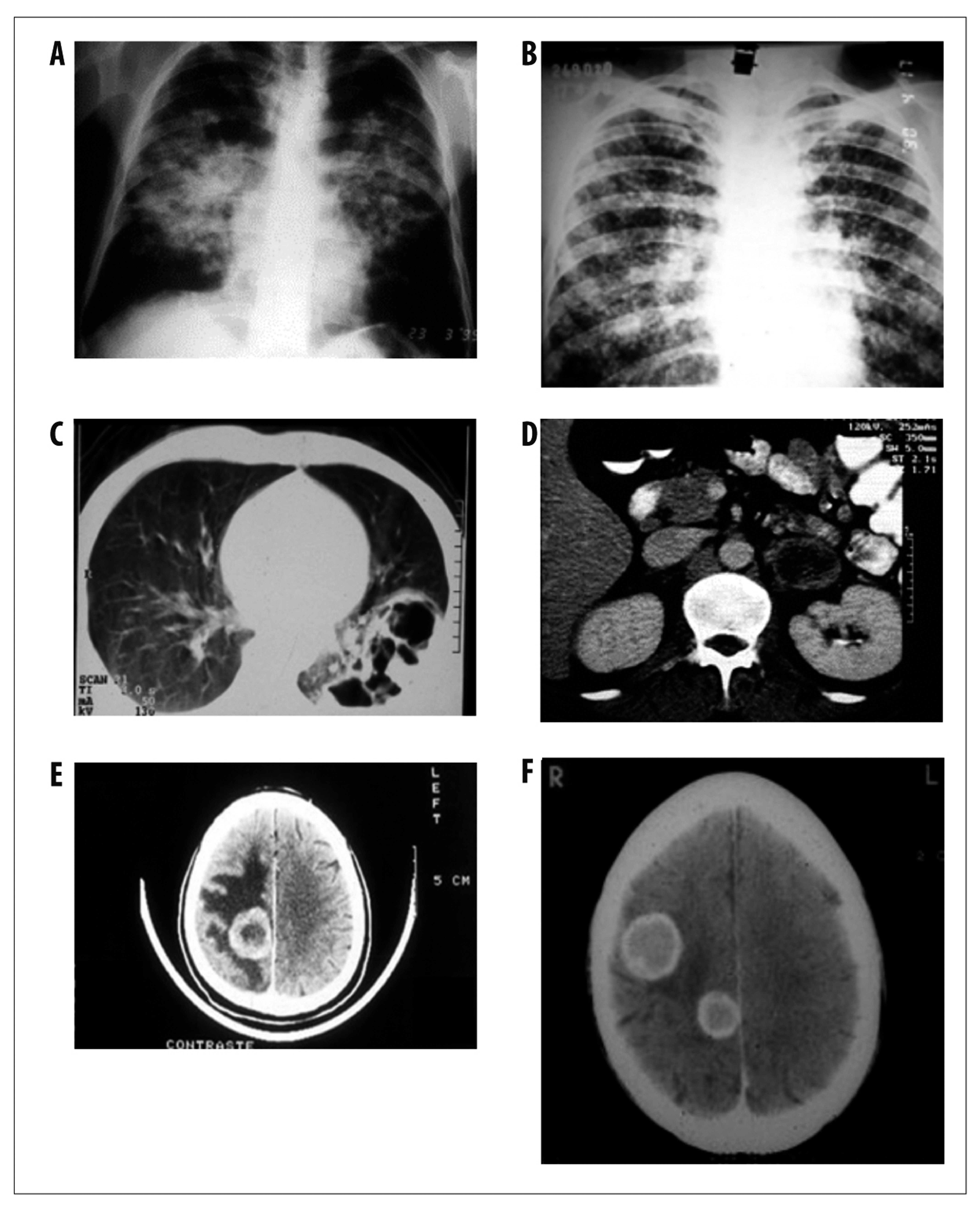
Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.39
A = radiologia convencional, imagem em “asa de borboleta”. Envolvimento pulmonar bilateral, para-hilar e simétrico, predomínio de lesões alveolares, poupando ápices e terços inferiores; muito sugestivas de PCM, mas menos frequentes; B = opacidades nodulares e micronodulares difusas e simétricas; C = TC de pulmões com múltiplas cavitações subpleurais. As lesões pulmonares também podem ser intersticiais do tipo reticular fino ou grosseiro, reticulonodulares e, em menor frequência, do tipo tumoral; D = aumento bilateral de glândulas adrenais; E e F = sistema nervoso central: imagens de aspecto hipodenso e com realce de contraste em forma de anel, com pequeno efeito de massa.
Figura 8 - Imagens na paracoccidioidomicose
Exames laboratoriais e de imagem - forma crônica
Raio X simples do tórax (posterior, anterior e perfil)
Hemograma completo e velocidade de hemossedimentação (VHS)
Provas bioquímicas hepáticas (alanina aminotransferase, fosfatase alcalina)
Avaliação da função renal e metabólica (creatinina sérica, Na e K)
A realização de exames mais complexos está condicionada à suspeita clínica ou a alterações dos exames laboratoriais que indiquem envolvimento de sistema nervoso central, acometimento gastrointestinal, formas abdominais, insuficiência respiratória crônica ou lesões osteoarticulares. Nestes pacientes, a investigação com exames de imagem e provas funcionais deverá ser conduzida com o apoio de especialistas, se necessário, em ambiente hospitalar. Pela alta frequência do acometimento adrenal e seu impacto clínico, recomenda-se a avaliação da reserva funcional, sempre que este exame estiver disponível.
Diagnóstico diferencial
Constituem os principais diagnósticos diferenciais na forma aguda: linfoma, leucemia, histoplasmose, tuberculose, toxoplasmose, leishmaniose visceral e mononucleose infecciosa. Na forma crônica cutâneo-mucosa: leishmaniose cutânea ou mucosa, tuberculose, cromoblastomicose, hanseníase, sarcoidose, lues e neoplasias. Na forma crônica pulmonar: tuberculose (Figura 9), coccidioidomicose, histoplasmose, sarcoidose, pneumoconiose e pneumonite intersticial. Nas formas digestivas: tuberculose e doença de Chron. No sistema nervoso central: tuberculose, criptococose, cisticercose e neoplasias.
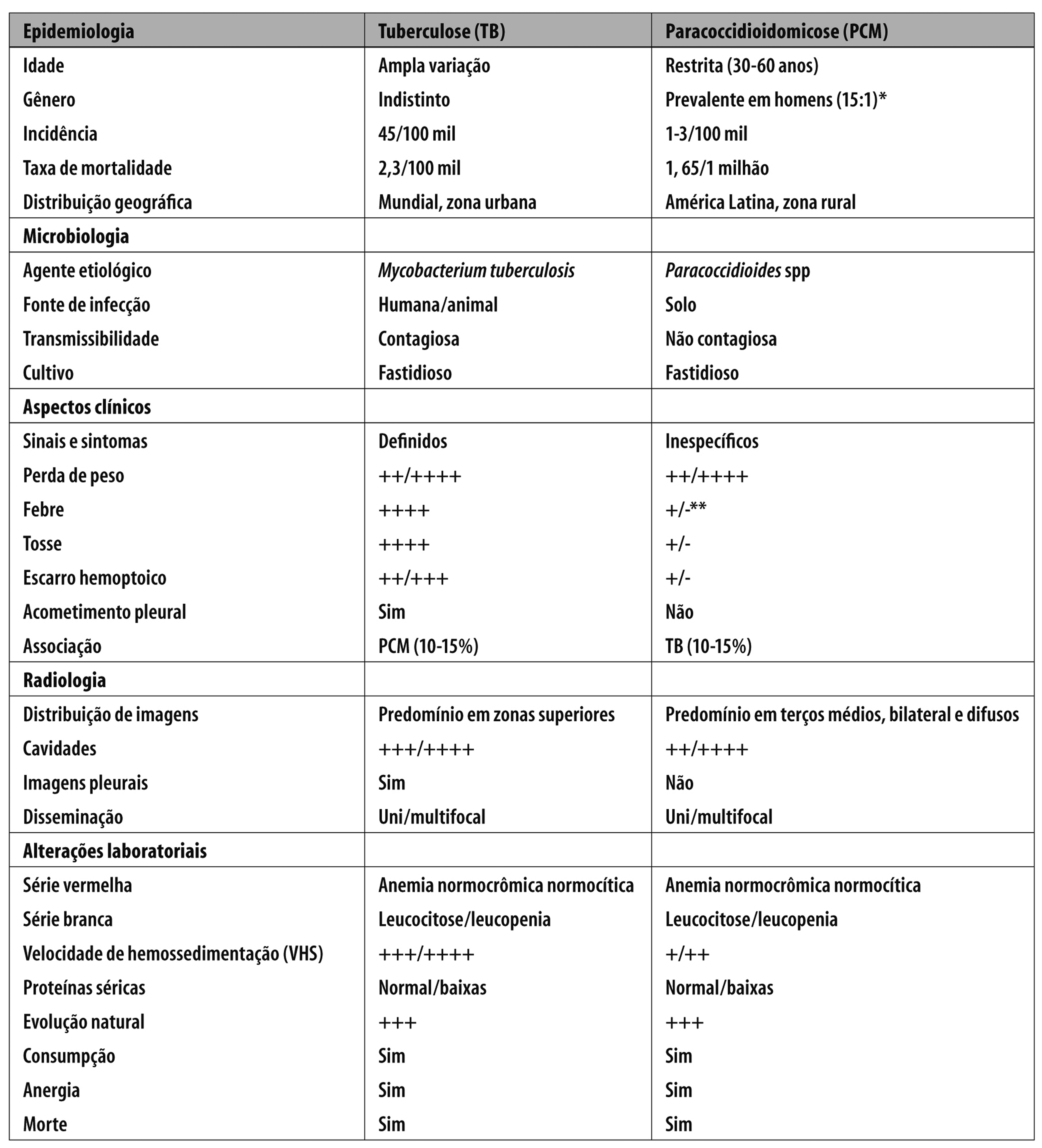
Fonte: Adaptada de Queiroz-Telles F, Escuissato D, 2011.55
Notas: *Excepcionalmente, pneumonia pode ocorrer na forma aguda/subaguda, em que ambos os sexos podem ser acometidos.
**Febre pode ocorrer em pacientes com infecções associadas.
Figura 9 - Diferenças e semelhanças entre a paracoccidioidomicose e a tuberculose pulmonares
Exames laboratoriais para diagnóstico específico
O padrão ouro para o diagnóstico de PCM é o encontro de elementos fúngicos sugestivos de Paracoccidioides spp em exame a fresco de escarro ou outro espécime clínico (raspado de lesão, aspirado de linfonodos) e/ou fragmento de biópsia de órgãos supostamente acometidos. Aspectos do diagnóstico laboratorial da doença podem ser observados na Figura 10.

Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.39
A = cultivo de P. brasiliensis em fase micelial; B = cultivo de P. brasiliensis em fase leveduriforme; C = Exame a fresco em KOH (hidróxido de potássio); D = corado pelo lactofenol mostrando células leveduriformes com múltiplos brotamentos; E = corte histológico corado pelo método de Grocott; F = corte histológico corado pelo PAS (periodic acid-schiff).
Figura 10 - Diagnóstico laboratorial da paracoccidioidomicose
Para fins de possível notificação padronizada de casos, sugerem-se as definições a seguir.
1) Caso suspeito: paciente com uma ou mais das seguintes manifestações, durante pelo menos quatro semanas, excluída a tuberculose e outras doenças que cursam com quadro semelhante:
a) tosse com ou sem expectoração e dispneia;
b) sialorreia, odinofagia, rouquidão;
c) lesão (ulcerada) na mucosa nasal ou oral;
d) lesões cutâneas (úlceras, vegetações, nódulos, placas etc.);
e) adenomegalia cervical ou generalizada, com ou sem supuração e fistulização; e
f) criança ou adulto jovem com hepatoesplenomegalia e/ou tumoração abdominal.
2) Caso provável: paciente com manifestações clínicas compatíveis com PCM e títulos de anticorpos séricos anti-P. brasiliensis/P.lutzii, detectados preferencialmente por teste de imunodifusão dupla quantitativa ou contraimunoeletroforese.
3) Caso confirmado: paciente com manifestações clínicas compatíveis com PCM em cuja secreção, fluido corporal ou material de lesão for observada a presença de elementos fúngicos sugestivos de P. brasiliensis/P. lutzii em exame micológico direto ou exame histopatológico, assim como seu isolamento em cultivo de qualquer material biológico (Figura 10). Vale salientar que a micromorfologia das formas parasitárias de P. brasiliensis/P. lutzii em material biológico de pacientes infectados não permite diferenciá-los entre si. Sendo assim, a definição da espécie envolvida requer o isolamento em cultivo e a utilização de técnicas moleculares.56,57
Avaliação crítica de exames sorológicos: diagnóstico e seguimento sorológico
As provas sorológicas específicas têm importância não apenas no auxílio diagnóstico mas também, particularmente, por permitirem avaliação da resposta do hospedeiro ao tratamento específico. Atualmente, são disponíveis em diferentes serviços de referência os métodos de imunodifusão dupla (IDD), contraimunoeletroforese (CIE), ensaio imunoenzimático (ELISA) e imunoblot (IB).58,59,60
Utilizando-se técnicas padronizadas e antígenos adequados,61 estes testes apresentam sensibilidade entre 80 e 95%. O título de anticorpos específicos anti-P. brasiliensis tem correlação com a gravidade das formas clínicas,58,59,60 sendo mais elevado na forma aguda/subaguda e nas formas disseminadas. Para a infecção por P. lutzii, tais informações não são conhecidas, estimulando-se estudos multicêntricos em áreas endêmicas. Casos de PCM com resultados falso-negativos, observados com quaisquer dos testes, na maioria das vezes se associam a lesões muito localizadas e em hospedeiros com aids ou imunodeprimidos. Vale lembrar que preparações de antígenos ricas em gp43KDA62 preparadas a partir de isolados de P. brasiliensis apresentam excelente acurácia para o diagnóstico de infecções por P. brasiliensis,58,59,60 mas têm baixa sensibilidade na investigação de infecções por P. lutzii.63,64 A especificidade dos testes sorológicos varia de 85 a 100%, sendo a imunodifusão considerada a mais específica. Reações falso-positivas podem ocorrer com soros de pacientes com histoplasmose e, eventualmente, na aspergilose e na leishmaniose, sendo a reação de imunodifusão em gel mais específica.
Tendo em vista a maior simplicidade do teste, a não necessidade de equipamentos de maior custo, a sensibilidade >80% e a especificidade >90%, bem como pela experiência acumulada nas últimas décadas, a reação de imunodifusão dupla em gel ágar situa-se atualmente como principal método de diagnóstico sorológico da PCM. Recomenda-se para IDD ou qualquer outro teste utilizado no diagnóstico de PCM que os soros sejam titulados, para melhor interpretação da resposta terapêutica, uma vez que os títulos de anticorpos diminuem progressivamente com o controle clínico da doença. É desejável que ocorra negativação ou estabilização em diluição de 1:2 ou menos para se considerar preenchido o critério de cura sorológica. Alguns pacientes podem apresentar, já no diagnóstico, títulos abaixo de 1:4. Nestes casos, o critério sorológico pela IDD tem valor limitado no seguimento do tratamento.
Recursos adicionais para o diagnóstico foram desenvolvidos, mas não estão disponíveis para a rotina de atendimento de PCM. Entre esses exames, podem-se citar a técnica de imunoblot, o teste de ELISA para triagem, a pesquisa de antígeno específico e técnicas de PCR.65,66
Até o momento, não se dispõe de técnica sorológica validada para o diagnóstico acurado de infecção por P. lutzii. Infelizmente, não há nenhum sistema comercial disponível para o diagnóstico de paracoccidioidomicose, sendo todos os testes disponíveis baseados em sistemas desenvolvidos in house.58,59,60,63,64 Estudo recente demonstrou haver grande variabilidade nos resultados gerados por testes sorológicos realizados em diferentes laboratórios de referência para o diagnóstico desta micose.67 Nesse contexto, é importante observar que o acompanhamento da curva de resposta sorológica ao tratamento antifúngico dos pacientes assistidos por diferentes serviços deve ser sempre realizado pela mesma técnica e pelo mesmo laboratório.
Frequência de retornos ambulatoriais e realização de exames
Recomenda-se a realização de consultas médicas mensais nos três primeiros meses, para se otimizar a adesão do paciente ao regime terapêutico instituído, avaliar a tolerabilidade ao medicamento e certificar-se de que houve boa resposta clínica (Figura 11). Havendo resposta clínica satisfatória, as consultas serão trimestrais até o final do primeiro ano. Após 90 dias de seguimento, em caso de resposta clínica satisfatória, os pacientes realizarão hemograma e provas bioquímicas a cada três meses durante o primeiro ano de seguimento. Exames radiológicos e sorológicos deverão ser solicitados a cada seis meses, ou em período menor, se não houver resposta clínica satisfatória ou aparecerem alterações laboratoriais indicativas de atividade. A redução dos títulos de anticorpos específicos deverá ocorrer em torno de seis meses após o tratamento, devendo negativar ou estabilizar em títulos baixos, após cerca de dez a 24 meses de tratamento, na dependência da forma clínica, do antifúngico utilizado e da gravidade, sendo mais rápida com itraconazol do que com cotrimoxazol, e na forma aguda do que na crônica. No segundo ano de seguimento, os retornos serão semestrais. Após a interrupção do tratamento, uma vez observados os critérios de cura, os pacientes devem ser acompanhados ambulatorialmente, em consultas semestrais, até se completarem dois anos de seguimento pós-terapêutico. Após este período, permanecendo o paciente com critérios de cura, deverá ter alta e ser orientado para retornar, se necessário.

Elaboração própria.
Notas: * Após um ano de interrupção do tratamento, o paciente pode receber alta, se estiver estável e preencher os critérios de cura da doença.
**Raio X do tórax, de acordo com a presença de alterações.
a) ALT = alanina aminotransferase.
b) N = sódio.
c) K = potássio.
Figura 11 - Orientação para o seguimento clínico-laboratorial de pacientes com paracoccidioidomicose sob terapêutica*
De acordo com a forma de apresentação clínica da PCM, deverão ser solicitados exames de acompanhamento específicos, tais como ultrassom - por exemplo, para se avaliar a evolução de massas ganglionares ou imagens nodulares em órgãos abdominais -, e tomografia computadorizada ou ressonância magnética, para avaliação das lesões encefálicas.
Suporte clínico-ambulatorial de especialidades
Os pacientes com envolvimento de laringe (disfonia) e traqueia deverão ser encaminhados ao otorrinolaringologista, para avaliação e realização de exames especializados, como a nasofibroscopia, para diagnóstico e tratamento precoces de complicações.
Pacientes que evoluam com dispneia persistente, apesar do tratamento adequado e da resposta terapêutica satisfatória, caracterizada pela cicatrização de lesões cutâneas e mucosas e recuperação do peso corpóreo, deverão ser encaminhados ao pneumologista, para confirmação e tratamento de doença pulmonar cicatricial ou de moléstias respiratórias associadas.
Da mesma forma, pacientes com síndrome de Addison, decorrente do comprometimento adrenal por PCM em atividade ou residual, devem ser acompanhados por endocrinologista, em especial os casos não responsivos ao tratamento habitual. Seguindo essa mesma linha de raciocínio e conduta, os casos de neuroPCM, de comprometimento intestinal e do sistema linfático abdominal, acompanhados de síndrome de má absorção, de lesões de órgãos do aparelho reprodutor, entre outras situações clínicas, também devem contar com seguimento especializado, pois o manejo destes pacientes sempre envolve dificuldades adicionais e exige assistência por especialista.
Indicações de internação
Deverão ser internados os seguintes tipos de pacientes:
Pacientes com formas disseminadas que apresentem uma das seguintes complicações: alterações neurológicas, insuficiência respiratória, importante comprometimento do estado nutricional, envolvimento gastrointestinal, icterícia, ascite, alterações hemodinâmicas.
Pacientes apresentando comorbidades tais como aids, tuberculose e/ou neoplasia, se houver necessidade de melhor investigação diagnóstica ou mediante deterioração clínica.
Pacientes com sequelas e instabilidade clínica, tais como DPOC descompensada, cor pulmonale, doença de Addison, estenose de laringe ou traqueia. (Figura 12).
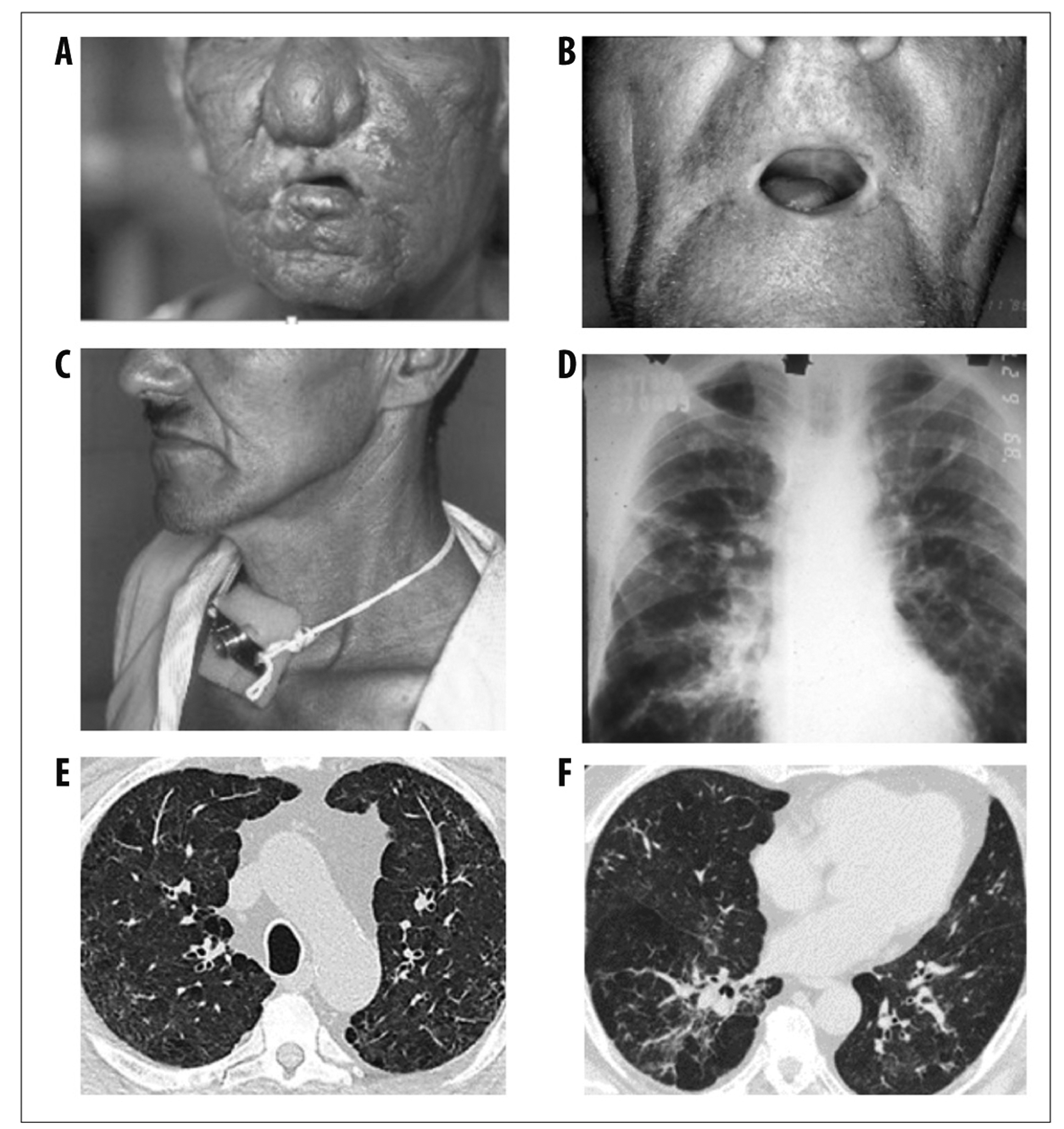
Fonte: Adaptado de Shikanai-Yasuda MA, Telles Filho F de Q, Mendes RP, Colombo AL, Moretti ML, 2006.39
A e B = microstomia resultante de lesões periorais; C = traqueostomia decorrente de estenose de traqueia; D = radiografia do tórax, mostrando infiltrado reticular bilateral residual; E e F = tomografias computadorizadas mostrando espessamento septal, reticulado periférico e espessamento peribroncovascular após o tratamento.
Figura 12 - Sequelas da paracoccidioidomicose no sistema respiratório
Pesquisa de comorbidades e imunossupressão
Muitos pacientes com a forma crônica para PCM são tabagistas e apresentam distúrbio pulmonar obstrutivo crônico (DPOC) previamente ao diagnóstico da micose. Outras doenças são relativamente comuns em pacientes com PCM, principalmente algumas infectoparasitárias de curso crônico e as neoplasias. É presumível que fatores predisponentes da PCM também favoreçam a ocorrência no paciente destas doenças, incluindo tuberculose, leishmaniose, doença de Chagas, hanseníase e estrongiloidíase.33 Por outro lado, Paracoccidioides spp pode ser oportunista em pacientes com redução da imunidade celular, quer por doença subjacente, quer por tratamentos imunossupressores.
Tuberculose
A tuberculose tem sido relatada em cerca de 2 a 20% dos casos de PCM. É diagnosticada antes, depois ou concomitantemente à PCM. Quando as duas infecções são simultâneas, pode haver dificuldades no diagnóstico, necessidade de terapia antifúngica alternativa e confusão quanto à resposta terapêutica, se uma delas não for reconhecida.68 Em pacientes com lesão pulmonar por Paracoccidioides spp, é recomendável solicitar baciloscopia da expectoração, para se avaliar a concomitância de tuberculose, principalmente quando houver infiltrado pulmonar acometendo os lobos superiores.
Câncer
Em revisão de diferentes casuísticas, foi verificado que 0,16 a 14,1% dos pacientes com PCM também apresentaram neoplasia em algum momento de suas vidas.19 Carcinomas foram observados mais frequentemente em localizações como pulmões, orofaringe e laringe. Pacientes com lesão de vias respiratórias por Paracoccidioides spp podem apresentar carcinoma juntamente com a micose ou nos anos seguintes, em geral no mesmo sítio ou próximo da lesão fúngica.19 É controverso se a PCM representa fator de risco para neoplasias ou se ambas as doenças estão relacionadas a fatores predisponentes comuns. Em pacientes com PCM, é maior a frequência de câncer em fumantes do que em não fumantes.69 A suspeita diagnóstica é fundamental para o estabelecimento precoce do diagnóstico e da terapêutica, pois as manifestações clínicas do câncer em pacientes com PCM podem ser mascaradas por sintomas decorrentes de sequelas da lesão fúngica no pulmão, laringe ou faringe, principalmente em tabagistas e etilistas. Com menor frequência, a doença por Paracoccidioides spp manifesta-se depois de (ou simultaneamente a) neoplasias, como linfoma, leucemia e carcinoma pulmonar, inclusive como recidiva da micose.19,70 Esta PCM provavelmente é oportunista e apresenta-se com lesões localizadas, particularmente no pulmão ou disseminadas. Em geral, a doença é controlada com terapia antifúngica, e os óbitos são atribuídos à neoplasia. Em áreas endêmicas de PCM, esta micose deve ser incluída entre as possíveis causas de piora clínica do paciente com câncer.
Transplante de órgãos e imunossupressão medicamentosa
PCM oportunista tem sido observada durante redução da imunidade relacionada a transplante renal ou hepático e uso de imunossupressores, como corticosteroides, drogas citotóxicas e imunobiológicos para tratamento de diversas doenças, além de raros casos de imunodeficiência primária. Isto é exemplificado por relato de caso de artrite reumatoide e sarcoma ósseo em que o paciente foi medicado com adalimumab, metotrexate e leflunomide, com ocorrência de doença pulmonar e óssea por Paracoccidioides spp.20 Um pequeno número de casos, que ocorreu desde poucos dias a 14 anos após o transplante de rim, possibilitou verificar, nesta condição, alterações significativas das características clínico-laboratoriais da PCM. Na radiografia do tórax, os pacientes apresentaram nódulos bilaterais,18 cavitação pulmonar71,72 ou infiltrado broncopneumônico.73 É incomum o predomínio de comprometimento linfático.74 Deve ser priorizado o diagnóstico microbiológico, pois os testes sorológicos em geral mostram títulos baixos de anticorpos anti-Paracoccidioides spp.73,75 Como em outros pacientes imunossuprimidos, as expressões clínica e sorológica não usuais podem confundir e retardar o diagnóstico da PCM. Adicionalmente, a resposta à terapêutica em pacientes com transplante renal pode ser lenta, particularmente com os antifúngicos usados por via oral,72,73,74 tendo-se observado evolução para óbito em metade dos casos relatados. Recomenda-se, portanto, o uso de antifúngicos eficazes e por via endovenosa, além de monitoramento rigoroso de pacientes imunossuprimidos em geral, que tenham tido exposição em áreas endêmicas de PCM.
Infecção por HIV e aids
PCM oportunista tem sido observada em pacientes infectados pelo HIV, podendo atingir até cerca de 1,5% dos casos de aids do Brasil.17,76 Nestes pacientes coinfectados, a PCM evolui mais rapidamente e as lesões são mais disseminadas, comumente abrangendo linfadenomegalia, lesões cutâneas por vezes umbilicadas, hepatoesplenomegalia, infiltrado pulmonar e, eventualmente, lesão do sistema nervoso central e de outros tecidos. A maioria dos casos apresenta manifestações clínicas mistas, com lesões predominantes da forma aguda/subaguda, porém com frequentes lesões pulmonares, que podem ser atípicas.43 Muitos pacientes têm baixa contagem de linfócitos CD4+ e podem apresentar a PCM como primeira manifestação da aids. Embora cerca de 30% dos casos não apresentem anticorpos anti-Paracoccidioides spp, o fungo é facilmente reconhecido ou isolado em exames micológico ou histopatológico. A coinfecção HIV/Paracoccidioides spp pode levar os pacientes à morte, mas a maioria alcança a cura com o tratamento antifúngico intensivo combinado com antirretrovirais e profilaxia secundária.17
Recomendações para pacientes com suspeita de comorbidades e imunossupressão
1) Solicitar pesquisa de bacilos álcool-ácido resistentes em três amostras de expectoração de pacientes com PCM pulmonar, particularmente naqueles com febre, sudorese noturna e infiltrado e/ou cavitação nos lobos superiores dos pulmões.
2) Fazer acompanhamento otorrinolaringológico de pacientes com lesão laríngea e que persistam com disfonia, para diagnóstico diferencial com tuberculose ou neoplasia.
3) Em pacientes com envolvimento pulmonar e piora da função respiratória, apesar do tratamento adequado, deve-se considerar a possibilidade de infecção bacteriana, doença pulmonar relacionada ao tabagismo (doença pulmonar obstrutiva crônica - DPOC) ou neoplasia associada ou de sequela com repercussão funcional.
4) Investigar a possível infecção por HIV em pacientes com epidemiologia sugestiva e também em casos de pacientes com forma aguda/subaguda com forma mista.
5) Em pacientes imunodeprimidos, a ausência de anticorpos, mesmo na doença disseminada, não afasta o diagnóstico de PCM, que deve ser investigada com testes microbiológicos e, se possível, com biópsia tecidual e exame histopatológico.
Sequelas
A PCM é uma doença sistêmica, cuja resposta do hospedeiro ao agente infectante consiste de processo inflamatório granulomatoso crônico, que se associa a um processo fibrosante sobrejacente. Desse modo, além da formação do granuloma, há um aumento na produção de citocinas - entre elas TNF-a e TGF-b - capazes de induzir o acúmulo de colágeno e reticulina no tecido infectado. Essa resposta fibrosante pode, então, levar a alterações anatômicas e funcionais dos órgãos acometidos durante a infecção, particularmente os pulmões.
Pulmonar
Na sua forma crônica, a PCM tratada pode persistir com sintomas de tosse, expectoração hialina e dispneia de diferentes graus, até mesmo em repouso, em casos mais graves.41,42 Associam-se a esses sintomas alterações na espirometria, com padrão obstrutivo na maioria dos casos, que se justifica pela associação das sequelas fibróticas predominantemente peribrônquicas ao antecedente de tabagismo presente da maioria dos pacientes.42 A prova de função pulmonar completa pode ainda mostrar aprisionamento aéreo e redução da difusão, que em casos mais graves leva a hipoxemia crônica.42 A maioria dos pacientes, mesmo após completar o tratamento, revela alterações cicatriciais aos exames de imagem, em especial à tomografia computadorizada44 (Figura 12), que revela distorção arquitetural (90%), espessamento septal e reticulado (88%), enfisema centrolobular ou parasseptal (82%), espessamento brônquico (82%), bandas parenquimatosas (74%), áreas de enfisema cicatricial (66%) e nódulos <3cm (62%), e cistos pulmonares (10%).42 Na gasometria, aumento do gradiente alveoloarterial de O2, hipoxemia e hipercapnia podem estar presentes, esta última sinalizando maior gravidade. A hipertensão pulmonar é rara, e secundária às alterações parenquimatosas.
Glândulas adrenais
O comprometimento adrenal é observado em média em 56% dos casos autopsiados, variando de 48,2 a 80,0%.34,36 No entanto, 15 a 50% dos doentes submetidos à avaliação adrenal apresentam reserva comprometida, apesar da ausência de manifestações clínicas, e 3,5% dos pacientes apresentam doença de Addison, que exige frequente reposição hormonal, por toda a vida.49,50
Laringe
As sequelas laríngeas caracterizam-se por disfonia, às custas de rouquidão e alteração do fluxo aéreo decorrentes do mau fechamento de cordas vocais fibróticas. A isso se soma um maior risco de infecções pulmonares por aspiração e ainda uma dificuldade de socialização, pois, muitas vezes, a voz se encontra extremamente alterada.77 As sequelas de traqueia podem levar à obstrução à passagem de ar e consequente insuficiência respiratória, exigindo traqueostomia inicial e, por vezes, necessitando de correção cirúrgica da estenose traqueal.
Sistema nervoso central
Os pacientes frequentemente evoluem com déficit motor, síndrome convulsiva (epilepsia) e/ou hidrocefalia. O envolvimento cerebelar ocorre em cerca de 20 a 30% dos casos de neuro-PCM, sendo comum a evolução rápida para hipertensão intracraniana, que requer derivação ventricular.51,52 O potencial de sequelas das formas neurológicas desta micose é substancial.
Pele
As sequelas cutâneas podem levar a alterações estéticas e da mucosa oral, e mesmo à microstomia, que exige cuidados especiais para alimentação do paciente e correção cirúrgica, após tratamento antifúngico.
Linfático
As sequelas do sistema linfático abdominal podem levar à icterícia obstrutiva, pelo comprometimento de linfonodos do hilo hepático,78 e à síndrome de má absorção de proteínas e gorduras.54,79
O custo social e econômico dessas complicações não tem sido adequadamente avaliado pela comunidade científica e pelas autoridades de saúde.
Avaliação e seguimento das sequelas pulmonares
Pacientes com comprometimento pulmonar por PCM, mesmo tratados de forma adequada, podem apresentar sintomas respiratórios persistentes. Dessa forma, a presença de sequelas respiratórias, patologias associadas ou de recidiva da PCM no pulmão devem ser ativamente investigadas em pacientes sintomáticos.80 A espirometria deve ser realizada e, na vigência de um distúrbio obstrutivo, sugere-se introdução de medicação broncodilatadora, seguindo orientações do tratamento da DPOC.81 A radiografia e a tomografia computadorizada do tórax auxiliam não só na investigação de doenças associadas, como neoplasia de pulmão, mas também no diagnóstico de recidiva da doença (aparecimento ou recrudescência de lesões com sinais radiológicos de atividade, como nódulos e massas com cavidades e vidro fosco). Coinfecções, em especial a tuberculose (Figura 9 e Figura 13), devem ser investigadas por meio de exames microbiológicos de escarro e, se necessário, lavado broncoalveolar. A gasometria arterial pode indicar a necessidade de oxigênio suplementar em casos de hipoxemia grave, e deve ser solicitada em pacientes com hipoxemia aferida na oximetria de pulso.31

Elaboração própria.
Nota: *Consolidação, lesões vidro fosco, cavidades de paredes espessas, espessamento de septos alveolares, nódulos e massas confluentes.
PCM = Paracoccidioidomicos; + = positivo; - = negativo; Baar = bacilos álcool-ácido resistentes.
Figura 13 - Abordagem diagnóstica a queixas respiratórias em pacientes tratados
Em casos mais avançados do ponto de vista clínico, espirométrico ou laboratorial, é conveniente a avaliação com pneumologista para caracterização da gravidade e orientação da terapêutica.
Tratamento
P. brasiliensis e P. lutzii diferem de outros fungos patogênicos por serem organismos sensíveis à maioria dos antifúngicos sistêmicos, sendo que mesmo os derivados sulfamídicos podem inibir seu crescimento. Não há evidências sólidas que comprovem a resistência primária ou secundária às drogas utilizadas no tratamento da PCM, portanto, vários antifúngicos mostraram-se eficazes no tratamento de diferentes formas clínicas da doença, incluindo derivados azólicos (cetoconazol, fluconazol, itraconazol, voriconazol, posaconazol e isavuconazol),82,83,84,85,86,87 derivados sulfamídicos (cotrimoxazol, sulfadiazina etc.),88 a anfotericina B (formulações em deoxicolato, complexo lipídico e lipossomal), para formas graves,89,90,91 e mesmo a terbinafina.92
Apesar de o vasto arsenal terapêutico estar disponível para manejo da doença, na prática clínica são mais empregados o itraconazol, o cotrimoxazol (associação sulfametoxazol/trimetoprim) e a anfotericina B. Na atualidade, não há evidências in vitro ou in vivo demonstrando que a PCM por P. brasiliensis e P. lutzii responda diferentemente aos antifúngicos utilizados na terapêutica da doença. Portanto, as recomendações terapêuticas são válidas para todos os pacientes com PCM.
Mesmo com altas taxas de incidência e morbimortalidade na América Latina, somente dois ensaios clínicos randomizados envolvendo pacientes com PCM foram publicados. Entretanto, nenhum deles teve poder estatístico para definições cruciais, como eficácia, segurança e duração do tratamento.83,86 Assim, as orientações sugeridas para tratamento da PCM são embasadas em apenas dois estudos prospectivos abertos e randomizados, e, na maioria das vezes, em estudos abertos retrospectivos ou prospectivos, comparativos ou não.82.86,90,93,94 Embora testados em um número pequeno de pacientes, voriconazol, posaconazol e isavuconazol possuem ação inibitória in vitro contra isolados de Paracoccidioides spp, portanto, são potencialmente úteis no tratamento da PCM. Devem, no entanto, ser consideradas as interações medicamentosas e os efeitos adversos de uma terapia mais prolongada.
Tratamento de pacientes com formas leves e moderadas
O itraconazol, na dose de 200mg diários, tem sido largamente utilizado no tratamento de formas leves e moderadas de PCM, com altas taxas de eficácia e segurança. Portanto, na atualidade, esse triazólico é o tratamento de escolha para pacientes com formas leves a moderadas de PCM. A duração do tratamento pode variar de nove a 18 meses, com uma média de 12 meses, sendo que o paciente deve sempre ser avaliado por critérios de cura clínicos, imunológicos e radiológicos (Figura 14). Em geral, as lesões tegumentares cicatrizam 30 dias após o início do tratamento, e as linfadenopatias regridem entre 45 e 90 dias. A estabilização das imagens radiológicas normalmente é observada após seis meses de uso do itraconazol.

Nota:
* Não usar concomitantemente com astemizol, antiácidos e bloqueadores de receptor H2, barbitúricos, cisapride, ciclosporina, didanosina, digoxina, fentanil, fenitoína, rifampicina, cisaprida e terfenadina.
** Maior experiência em crianças - com sulfametoxazol/trimetoprim.
*** Prolongar a duração do tratamento quando há envolvimento de sistema nervoso central.
**** Requer tratamento de manutenção com itraconazol ou cotrimoxazol.
Figura 14 - Medicamentos mais utilizados em pacientes com paracoccidioidomicose
Como ocorre com muitos triazólicos, a absorção de itraconazol pode ser prejudicada por uma série de fatores, como interações medicamentosas, acloridria, gastrectomia prévia, ingestão com alimentos alcalinos ou estado de jejum (Figuras 14, 16 e 17). Para incremento dos níveis séricos, recomenda-se que, em pacientes adultos, as cápsulas de itraconazol sejam ingeridas em única tomada, após o almoço ou o jantar. Bebidas ácidas, como sucos cítricos, podem incrementar a absorção de itraconazol, enquanto alimentos alcalinos a reduzem. Não se recomenda o fracionamento de doses de itraconazol, pois sua absorção no trato gastrointestinal só ocorre quando o medicamento está acondicionado em cápsulas íntegras. Estudos retrospectivos, comparativos, demonstraram que o tratamento da PCM com itraconazol é mais vantajoso que a utilização da associação sulfametoxazol/trimetoprim (cotrimoxazol), em termos de eficácia clínica (principalmente na forma crônica), duração e aderência ao tratamento, e farmacoeconomia.93,94

Fonte: Adaptado de Medscape English, 201795 e Epocrates.Athenahealth Inc USA, 2017.96
Nota: * Intervalo QT no eletrocardiograma.
Figura 16 - Principais interações medicamentosas para antifúngicos azólicos

Fonte: Adaptado de Medscape English, 201795 e Epocrates.Athenahealth Inc USA, 2017.96
Figura 17 - Interação medicamentosa entre os principais antirretrovirais e antifúngicos azólicos
Novos derivados azólicos
Apesar de um reduzido número de pacientes ter sido tratado com outros triazólicos de espectro expandido - voriconazol, posaconazol (com previsão futura de uso de cápsulas de liberação prolongada) e isavuconazol -, essas drogas podem ser consideradas como potenciais substituintes de itraconazol, à medida que seu custo seja acessível e que novas evidências sejam publicadas,86,87 devendo, no entanto, ser consideradas as interações medicamentosas95,96 (Figuras 15, 16 e 17).
Cotrimoxazol (sulfametoxazol/trimetoprim)
Embora tenha ação fungistática e exija um tempo de tratamento maior que o do itraconazol, o cotrimoxazol é a segunda opção terapêutica para pacientes com formas leves a moderadas e graves de PCM. Suas vantagens incluem a maior disponibilidade pelo sistema público de saúde no Brasil e apresentação em comprimidos, suspensão oral e venosa, além de boa absorção pela via oral, com níveis séricos previsíveis. A suspensão oral pode ser utilizada em crianças que não toleram comprimidos e também por adultos que não deglutem comprimidos, pela presença de lesões estenóticas de laringe ou esôfago. A solução venosa de cotrimoxazol pode ser utilizada em pacientes com acometimento do aparelho digestivo e/ou que não absorvam bem a medicação oral. Também tem sua utilização recomendada em contraindicações de uso de itraconazol, ou em casos de suspeita de falha terapêutica, e ainda em casos de tratamento concomitante de tuberculose. Segundo poucas casuísticas publicadas, o cotrimoxazol é o tratamento de escolha para a maioria dos pacientes com neuroparacoccidioidomicose.52,97
Tratamento de pacientes com formas graves e disseminadas
Para formas graves e disseminadas, está indicada a anfotericina B em desoxicolato ou em formulação lipídica (lipossomal ou em complexo lipídico). A dose indução recomendada de anfotericina B convencional é de 0,5-0,7mg/kg/dia, máximo de 50mg/dia. As formulações lipídicas devem ser prescritas nas doses de 3 a 5mg/kg/dia. A duração do tratamento visa à estabilidade clínica do paciente, devendo ser realizada pelo menor tempo possível (em média, de duas a quatro semanas). A transição para medicação oral, durante a fase de consolidação, deve ocorrer após a estabilização clínica, confirmadas as condições de absorção oral do medicamento.
Na impossibilidade de uso das formulações lipídicas de anfotericina B, recomenda-se a utilização da formulação venosa de cotrimoxazol, na dose de 800mg/160mg a cada 8 horas. Apesar de pouca experiência clínica, o fluconazol endovenoso (600 a 800mg/dia) pode ser também uma opção terapêutica.
Os principais desafios terapêuticos nessa doença são o longo período de uso contínuo de antifúngicos sistêmicos, a possibilidade de recaídas e o aparecimento de sequelas, principalmente no aparelho respiratório. O manejo terapêutico da PCM deve obrigatoriamente compreender, além da utilização de drogas antifúngicas, o emprego de medidas que melhorem as condições gerais do paciente, o tratamento de comorbidades infecciosas ou não, a aplicação de critérios de cura e o acompanhamento pós-terapêutico.
Corticosteroides
Embora escassas, há evidências na literatura de que alguns pacientes com PCM podem se beneficiar com o uso de corticosteroides concomitante à terapêutica antifúngica.98 Alguns exemplos de benefício podem ser observados em pacientes com inflamação intensa, seja em gânglios ou no sistema nervoso central, lesões graves de laringe ou traqueia, e lesões pulmonares com insuficiência respiratória. O uso de prednisona por uma a duas semanas pode reduzir a inflamação durante a terapêutica com antifúngicos. Em pacientes com PCM e aids que venham a apresentar piora do quadro clínico após uso de antirretrovirais depois de responderem ao medicamento antifúngico, pode-se considerar a hipótese de síndrome de reconstituição imune, com base em outras infecções associadas ao HIV/aids.
Medidas gerais
Todos os pacientes devem ser tratados por tempo suficiente para redução dos sinais e sintomas, estabilização do peso corpóreo, das imagens radiológicas do tórax e dos títulos de anticorpos séricos. Além da terapêutica antifúngica específica, o paciente com PCM necessita de medidas gerais que melhorem seu estado nutricional e a imunodepressão celular das formas mais graves da doença. Também contribuem para o melhor restabelecimento do paciente o controle do tabagismo, do etilismo, da insuficiência adrenal e de outras infecções associadas. Desse modo, os fatores seguintes são importantes para a obtenção dos critérios de cura: o repouso, a dieta hiperproteica e hipercalórica associada aos suplementos vitamínicos, a restrição de álcool e tabaco, bem como a terapêutica da doença de Addison e de infecções associadas, a exemplo de enteroparasitoses e coinfecções bacterianas respiratórias. Todas as medidas preconizadas serão inúteis se não se garantir o acesso do paciente à medicação antifúngica, uma vez que a maioria dos indivíduos com PCM não possui condições socioeconômicas que permitam custear o tratamento. Portanto, espera-se que os medicamentos de uso ambulatorial (itraconazol e cotrimoxazol) sejam fornecidos sem ônus para os pacientes.
Terapêutica em populações especiais
Gravidez
Gestantes podem ter PCM, quer como manifestação inicial, quer como reativação de doença fúngica previamente controlada. Presume-se que isto decorra de redução da resposta imunológica na gravidez, que também predispõe a outras micoses sistêmicas. Em um dos casos descritos, houve disseminação de Paracoccidioides spp para a placenta, mas não existem relatos de comprometimento fetal.99 A PCM em gestantes é controlável com antifúngicos usuais, prioritariamente a anfotericina B (categoria B). Porém, pelo possível efeito teratogênico, deve ser evitado o uso de drogas azólicas (categoria C) e de sulfametoxazol/trimetoprim (categoria D).100 Anfotericina B (categoria B) e sulfadiazina (categoria C) são alternativas para uso em qualquer período gestacional, mas recomenda-se interromper a sulfa 15 dias antes da data prevista para o parto, evitando complicações no recém-nascido. O sulfametoxazol/trimetoprim pode ser utilizado durante a amamentação.100 A terapia antifúngica deve ser mantida durante todo o período da gestação, para evitar recidiva, e sua suspensão posteriormente ao parto deverá ser avaliada pelos critérios de cura usuais. Após o nascimento, recomenda-se substituir a terapia antifúngica alternativa pela convencional, até a paciente alcançar os critérios de cura da PCM.
Aids
Pacientes com aids geralmente apresentam formas graves e disseminadas da doença, portanto devem ser tratados inicialmente com anfotericina B, ou, se o caso permitir, com doses elevadas de itraconazol, 600 mg/dia (atentando para as interações deste com os antirretrovirais) ou sulfametoxazol+trimetoprim endovenoso (duas ampolas a cada 8 horas). Apesar de pouca experiência clínica, o fluconazol endovenoso (600 mg/dia a 800 mg/dia) pode ser uma opção terapêutica. Para evitar possíveis interações medicamentosas, recomenda-se que a PCM seja tratada, inicialmente, com antifúngicos por três a cinco semanas, antes do início da terapêutica antirretroviral. Após a cura da PCM, recomenda-se, em pacientes imunodeprimidos, a profilaxia secundária com sulfametoxazol (1.600 mg/dia)+trimetoprim (320mg/dia) ou itraconazol (200mg/dia). A profilaxia deve continuar até que a terapia antirretroviral eleve a contagem de linfócitos CD4+ para um mínimo de 100 células/µL (concomitantemente à carga viral indetectável) a 200 células/µL (independentemente da carga viral), durante pelo menos três meses, em função da experiência em outras micoses sistêmicas. O uso de sulfametoxazol+trimetoprim (800/160mg a cada 12horas) tem a vantagem de também ser efetivo como profilaxia primária e secundária para pneumocistose e como profilaxia primária para neurotoxoplasmose. Em pacientes imunossuprimidos, a ausência de anticorpos, mesmo na doença disseminada, não afasta o diagnóstico de PCM, a qual deve ser investigada com testes microbiológicos e, se possível, com biópsia tecidual e exame histopatológico.
Insuficiência hepática ou renal
As drogas utilizadas no tratamento da PCM devem ter suas doses ajustadas em pacientes com deficiência hepática ou renal.101,102,103,104,105
Insuficiência renal
• Anfotericina B
Deve ser evitada, devido a seu alto potencial de nefrotoxicidade, que se acumula com o uso de séries consecutivas. Os níveis séricos da anfotericina B não são afetados de forma significativa pela hemodiálise, não necessitando de ajuste nestes casos. Deve-se optar por outras drogas ou pela formulação lipídica da anfotericina B.
• Azólicos
Como vários azóis apresentam excreção renal, devem ter sua dose ajustada,101,102,103 como segue.
o Fluconazol - tem 80% de eliminação renal; reduzir para 50% da dose quando o clearance de creatinina for menor que 50ml/min e o intervalo aumentado para 48 horas. No caso de clearance abaixo de 20ml/min, a dose deve ser reduzida para um terço da dose normal, e o intervalo entre as doses aumentado para 72 horas. No caso de hemodiálise, utilizar dose plena após o processo dialítico, e 50% da dose em diálise peritoneal.
o Itraconazol - usar 50% da dose apenas com clearance <10 ml/min. Para hemodiálise ou peritoneal, usar solução oral 100mg cada 12-24 horas.
o Voriconazol - usar dose de ataque de 6mg/kg cada 12 horas, duas vezes, seguida de 4mg/kg/dia cada 12 horas para clearance de creatinina >50 ml/min. Não usar solução endovenosa quando o clearance for <50ml/min. Para terapêutica renal substitutiva, hemodiálise ou diálise peritoneal, usar 4mg/kg/dia a cada 12 horas.
o Terbinafina - na vigência de clearance >50 ml/min, usar apenas a cada 24 horas, e evitar com clearance <50 ml/min.
• Derivados sulfamídicos
Os derivados sulfamídicos apresentam excreção renal e seus metabólitos podem causar toxicidade, por serem pouco solúveis em pH ácido (urina), propiciando a formação de cristais que se depositam nos túbulos renais, podendo levar a obstrução e consequente dano renal. Casos de nefrite intersticial também já foram relatados. Esses derivados são removidos por diálise. Como decorrência, devem ser evitados em pacientes com insuficiência renal.
Alterações hepáticas funcionais
Alterações hepáticas podem ser decorrentes da PCM, por lesão hepatocítica ou compressão extrínseca com processo colestático.105
Nesses casos, o tratamento segue os padrões propostos e o paciente tem evolução satisfatória.
Por outro lado, pode ocorrer hepatotoxicidade induzida por antifúngicos.
• Anfotericina B
Tem característica organodepositária, permanecendo depositada no fígado, levando raramente ao aumento das transaminases.
A anfotericina B desoxicolato é pouco hepatotóxica, diferentemente de seus derivados lipídicos, que têm a desvantagem de apresentar maior agressão hepática.
A insuficiência hepática não causa retenção importante da droga, que mantém seu nível sérico estável e pode ser utilizada.
• Azólicos
As alterações bioquímicas observadas com o itraconazol persistem com a manutenção do tratamento. No tratamento por cotrimoxazol e itraconazol, as alterações bioquímicas comumente registradas não ultrapassam cinco vezes o limite superior da normalidade, o que permite a manutenção do tratamento. No entanto, há relatos de caso em que o itraconazol teve que ser descontinuado. O fluconazol é o menos hepatotóxico.
Metabolizados no fígado com contraindicação relativa em hepatopatias graves
O voriconazol e o cetoconazol são os mais hepatotóxicos, seguidos pelo itraconazol.104 Devem ser evitados nas insuficiências hepáticas graves. O fluconazol pode ser usado com muita cautela, se o paciente não puder receber anfotericina.
Metabolizados no fígado, com necessidade de ajuste de dose em hepatopatias
Voriconazol: administrar 6mg/kg a cada 12 horas, duas doses, e seguir com 2mg/kg/dia a cada 12 horas.
Derivados sulfamídicos
Raramente causam efeitos hepatotóxicos graves, podendo ser utilizados.
A toxicidade hepática induzida pelo cotrimoxazol evolui com normalização das dosagens de enzimas hepáticas, apesar da manutenção do tratamento.
Em pacientes com insuficiência hepática por outras causas, tais como a cirrose ou a hepatopatia alcoólica, está indicada a anfotericina B desoxicolato, por ser menos tóxica para o fígado que as outras preparações, e, como alternativa, o fluconazol.
Paracoccidioidomicose em crianças
O medicamento mais usado em crianças, fornecido pela rede pública de saúde, é a combinação de sulfametoxazol+trimetoprim, pela eficácia conhecida, boa tolerabilidade e apresentação na forma de xarope, que facilita a administração e adequação da dose.39,40,106 A dose recomendada é de 8 a 10mg/kg/dia de trimetoprim, em duas tomadas diárias, não sendo necessária a administração em jejum. A formulação intravenosa é uma alternativa quando a via oral está contraindicada, como nos casos de suboclusão intestinal, devendo ser usada na mesma dosagem, dividida em duas vezes ao dia. Entre os efeitos colaterais descritos, a leucopenia é frequente, mas pode ser controlada com uso concomitante de ácido folínico, sem outras complicações associadas.106,107
O itraconazol pode ser usado como segunda opção, na dosagem de 5 a 10 mg/kg/dia, uma vez ao dia. Anfotericina B desoxicolato, assim como outras formulações de anfotericina B, são reservadas para casos graves.108 Alguns pacientes podem apresentar reação paradoxal durante o tratamento, que se caracteriza por uma piora clínica - surgimento de novos gânglios, inclusive com fistulização, febre e perda de peso - sendo indicada a introdução de corticosteroide.108
Paracoccidioidomicose em situações de recursos limitados
Em Rondônia, ocorre o registro sistemático de casos desde 1997, tendo-se observado períodos em que a incidência alcançou mais de 15 casos por 100 mil hab., e, na análise estratificada por município, quase 40 casos por 100 mil hab., na região sul do estado.14
O diagnóstico tardio da PCM pode contribuir para o agravamento da doença, com evolução para sequelas, acometendo principalmente os trabalhadores rurais com baixos níveis de escolaridade, precárias condições socioeconômicas e dificuldades de acesso aos serviços de saúde. Em Rondônia, cerca de um terço dos pacientes teve o diagnóstico baseado em critérios clínico-epidemiológicos,14 não estando disponível no estado exame sorológico no período de janeiro de 2013 a dezembro de 2016. Dados relativos a mais de uma centena de casos de PCM atendidos no Centro de Medicina Tropical de Rondônia, nos últimos quatro anos, demonstraram predominância de forma crônica, com frequente acometimento de mucosas, início do tratamento após cerca de sete meses de doença e resposta terapêutica tanto ao cotrimoxazol quanto ao itraconazol. As seguintes medidas podem contribuir para uma melhor abordagem da doença: a expansão da rede de diagnóstico; a padronização e disponibilização de antígenos das diferentes espécies descritas para realização de exames sorológicos; a capacitação de profissionais de saúde, muitas vezes oriundos de outros estados e ainda não conscientes da importância regional da PCM; e a disponibilização, pelo poder público, de medicamentos de fácil administração.
Critérios de cura
Após sua confirmação diagnóstica, o tratamento de pacientes com PCM sempre envolve esquemas de longa duração, e o seu acompanhamento periódico geralmente ocorre em regime ambulatorial. A duração da terapia deve ser fundamentada em critérios de cura embasados em parâmetros clínicos, micológicos, radiológicos e imunológicos.
Critérios clínicos
Os critérios clínicos de cura da PCM incluem ausência ou regressão dos sinais e sintomas da doença, tais como a cicatrização das lesões tegumentares, a involução das adenomegalias e a estabilização do peso corporal. Inicialmente, após duas semanas de tratamento, há melhora subjetiva das lesões orais, e em um mês há cicatrização dessas lesões. Do mesmo modo, as lesões cutâneas regridem também em um mês, e as linfadenomegalias, entre dois e três meses. É comum se observar a persistência de sintomas residuais ou sequelas decorrentes da cicatrização e fibrose das lesões de PCM. As sequelas mais comumente observadas ocorrem nos pulmões, no sistema linfático, nas glândulas adrenais e no sistema nervoso central. Sinais e sintomas decorrentes de sequelas devem ser diferenciados do quadro clínico decorrente de doença em atividade.
Critérios micológicos
A negativação do exame micológico direto nas amostras clínicas ocorre precocemente se o tratamento é eficaz. Este parâmetro é mais facilmente verificado quando se examina a secreção respiratória. Já em outros materiais, como biópsias ou secreção de linfonodos, a pesquisa de fungos é desnecessária, pois as lesões regridem ou desaparecem com o tratamento.
Critérios radiológicos
As opacidades pulmonares, inicialmente de padrão nodular, micronodular ou reticular, e as lesões cavitárias, tendem a se transformar em imagens lineares, indicando a cicatrização e a fibrose das lesões pulmonares. A estabilização do padrão das imagens radiológicas pulmonares deve ser analisada em radiografias de tórax semestrais (Figura 11).
Critérios imunológicos
O método sorológico para detecção de anticorpos mais empregado é a reação de IDD. Espera-se que, com o tratamento, ocorra a negativação do título de anticorpos ou a sua estabilização em valores baixos (soro não diluído ou na diluição 1:2). Alternativamente, quando se usa a contraimunoeletroforese (CIE), a estabilização ocorre em soro não diluído até a diluição 1:4. As avaliações sorológicas devem ser realizadas a cada seis meses, quando disponíveis.
Acompanhamento pós-terapêutico
A expressão "cura definitiva" talvez nunca possa ser aplicada a pacientes com PCM, pela impossibilidade de erradicação de P. brasiliensis do organismo. O objetivo do tratamento é reduzir a carga fúngica no organismo do paciente, permitindo a recuperação da imunidade celular e o restabelecimento do equilíbrio entre parasito e hospedeiro. Após o tratamento e a observação dos critérios de cura, os pacientes devem receber acompanhamento ambulatorial, com avaliação clínica e sorológica. A positivação ou aumento do valor do título de IDD é preditor de recaída clínica. Exame clínico periódico, com controle do peso e verificação do surgimento de lesões orais ou de linfoadenopatias, deve ser realizado por um período de até um ano após a obtenção dos critérios de cura pelo paciente.
Controle, prevenção, desafios e recomendações Controle e prevenção
Não existe vacina disponível para prevenir a infecção humana por Paracoccidioides spp, embora resultados promissores tenham sido obtidos em animais de laboratório.109 Recomendações para a prevenção da PCM podem ser propostas a partir do conhecimento das situações mais evidentes de infecção após exposição aérea a conídios em áreas endêmicas, assim como dos fatores predisponentes da doença.
Recomenda-se, tanto no ambiente rural como no periurbano, evitar a exposição à poeira originada de escavação do solo, de terraplanagem e de manipulação de vegetais. Para os trabalhadores rurais e motoristas de trator constantemente expostos à poeira mais densa, particularmente os que fazem a coleta manual, limpeza (abano) e varrição do café, é presumível que evitar a exposição, com máquinas de cabine bem vedadas ou máscaras protetoras tipo N95 (nem sempre disponíveis), possa proteger contra a infecção por Paracoccidioides spp. Na prática, o uso de forno, substituindo processos manuais de varrição do café, ou mudanças para outras culturas, podem ter contribuído para a diminuição de incidência da micose em antigas regiões cafeeiras. Aconselha-se evitar a exposição de crianças e indivíduos imunodeprimidos a situações de risco em zona rural. Em laboratórios, a manipulação de isolados do fungo, sempre que possível, deve ser feita em capela de segurança, principalmente de cultivos na forma de micélio. Para laboratoristas que manipulam habitualmente Paracoccidioides spp, recomenda-se exame sorológico pré-exposição e anualmente, para monitoramento de possível infecção pelo fungo. Acidentes em laboratório de pesquisa que implicam inoculação transdérmica de Paracoccidioides spp devem ser manejados com monitorização da presença de anticorpos antifúngicos na pessoa acidentada, inicial e após três e seis meses, e profilaxia com itraconazol - 200 mg/dia, via oral, por 30 dias.
Como estão descritas a associação da forma crônica da paracoccidioidomicose tanto ao tabagismo quanto ao consumo médio de álcool,16 aconselha-se evitar o cigarro e o consumo excessivo de bebidas alcoólicas (e a desnutrição consequente), antes e após exposição. Pacientes imunossuprimidos por medicamentos e/ou submetidos a transplantes20,110 têm risco aumentado de desenvolver paracoccidioidomicose. Tendo sido também descrita a doação de rim de doador com paracoccidoidomicose silenciosa de suprrarenal,111 recomenda-se a avaliação prévia dos doadores de órgãos com antecedentes epidemiológicos suspeitos, com monitoramento dos receptores respectivos, assim como de receptores com antecedentes epidemiológicos suspeitos nos períodos pré e durante o período de imunossupressão, com uma radiografia do tórax e a pesquisa de anticorpos anti-Paracoccidioides spp.
Desafios
Além do aprimoramento dos dados de prevalência e incidência da doença, registro de casos por notificação compulsória e mediante acesso a medicamentos, uniformização de métodos sorológicos, avaliação crítica da terapêutica antifúngica e do uso de corticosteroides, busca de novas abordagens terapêuticas para as sequelas, a descrição de nova espécie de Paracoccidioides, P. lutzii e do complexo P. brasiliensis traz novos desafios.
Para o clínico, é importante avaliar o impacto epidemiológico, clínico, diagnóstico e terapêutico atual das diferentes espécies na doença humana. As regiões Norte e Centro-Oeste têm sido relacionadas a infecções causadas por P. lutzii, em função da identificação por métodos moleculares de alguns isolados dessas regiões1,5,9 e, principalmente, pela fraca reatividade dos soros de pacientes com doença comprovada a antígenos de P. brasiliensis e maior reatividade a antígenos de P. lutzii.63,64
Embora os dados clínicos e a resposta à terapêutica sejam aparentemente similares para ambas as espécies (dados do Mato Grosso do Sul), pouco se conhece com base em dados de isolamento e identificação molecular em pacientes,8 uma vez que os exames micológico e histopatológico não são capazes de distinguir essas espécies, e as provas moleculares não estão disponíveis em laboratórios de rotina.66
Permanecem como questões a serem respondidas: o conhecimento do perfil epidemiológico-molecular de isolados de Paracoccidioides no país, visando fundamentar o diagnóstico clínico-epidemiológico; a caracterização do perfil antigênico dos isolados e sua correlação com os dados clínico-laboratoriais das doenças causadas por ambas as espécies,1,7 incluindo sequelas; e a resposta aos diferentes medicamentos, bem como a análise da susceptibilidade às drogas.112,113
Da maior importância para a saúde pública é a implantação de métodos simples, como o exame micológico, como método de primeira escolha no diagnóstico em regiões carentes, particularmente quando o diagnóstico de tuberculose for excluído. Nesse sentido, é necessário e urgente o esforço conjunto dos órgãos públicos e da comunidade acadêmica para que o diagnóstico sorológico esteja universalmente disponível para infecções por P. lutzii e P. brasiliensis, com frações antigênicas estáveis e provas reprodutíveis de fácil exequibilidade. A comunidade acadêmica internacional, reunindo os países endêmicos da América Latina (Rede Latino-Americana de Paracoccidioidomicose), por intermédio do Working Group on Paracoccidioidomycosis,114 participa do esforço para alcançar esses alvos. Paralelamente, a disseminação de conhecimentos é também uma etapa fundamental para que o diagnóstico e tratamento precoces, assim como a atenção integral ao paciente, com base em dados clínico-epidemiológicos, micológico e sorológico, sejam instituídos em todas as regiões endêmicas.
Recomendações
Seguem-se recomendações gerais para o aprimoramento da atenção ao paciente com PCM.
Instituir a notificação compulsória de casos com paracoccidioidomicose provável e provada.
Dispor de um registro nacional de casos, por meio da notificação, mediante acesso aos medicamentos ou internação.
Acesso universal ao itraconazol e ao cotrimoxazol para formas leves a moderadas.
Acesso a formulações lipídicas de anfotericina em situações especiais e em imunossupressão e à anfotericina B desoxicolato, liberada para comercialização após aprovação de requisitos farmacológicos mínimos.
Estruturação de uma rede de atenção básica com base em diagnóstico clínico-epidemiológico, micológico (direto e cultura) e sorológico.
Na ausência de diagnóstico micológico, acesso ao diagnóstico histopatológico.
Disponibilização de antígenos estáveis e reprodutíveis de P. brasiliensis e P. lutzii na rede pública.
Padronização de uma técnica sorológica para diagnóstico e seguimento em nível nacional.
Estímulo à avaliação do papel de corticosteroides no tratamento de pacientes com lesões inflamatórias intensas e/ou extensas.
Estímulo à avaliação da terapêutica de manutenção de antifúngicos em pacientes imunodeprimidos, segundo o grau de imunodepressão.
Análises em pacientes com aids quanto ao momento adequado para se introduzir a terapêutica antirretroviral, considerando-se a presença de interações medicamentosas e de síndrome de reconstituição imune, estabelecendo-se os parâmetros para tais avaliações.
Criação de um banco de dados da distribuição das diferentes espécies de Paracoccidoides no país, para embasar o diagnóstico epidemiológico, estimulando-se projetos multicêntricos, com provas sorológicas e tipagem de isolados, a partir do apoio a grupos consolidados e trabalhos em rede.











 Curriculum ScienTI
Curriculum ScienTI