Introdução
No Brasil, a Política Nacional de Gestão de Tecnologias em Saúde1 e a Política Nacional para a Prevenção e Controle do Câncer2 determinam que a incorporação, a alteração e a desincorporação de tecnologias voltadas à prevenção e controle do câncer no âmbito do Sistema Único de Saúde (SUS) sejam resultado das recomendações formuladas por órgãos governamentais, a partir de um processo de avaliação de tecnologias em saúde (ATS).
Segundo a Lei no 12.401, de 28 de abril de 2011, a utilização das evidências científicas para nortear os tomadores de decisão quanto à gestão de tecnologias no SUS deve considerar os atributos de segurança, eficácia, efetividade e eficiência, e os impactos econômicos, éticos, sociais e ambientais da tecnologia em questão.3 As análises de custo-efetividade e de impacto orçamentário são as etapas do processo de ATS que estimam a eficiência e as consequências financeiras da adoção de determinada tecnologia.4
A incorporação acrítica de tecnologias ameaça a sustentabilidade dos sistemas de saúde. A decisão por determinada alocação de recursos implica sua indisponibilidade para outros fins. A análise de impacto orçamentário é imprescindível ao planejamento de gastos no SUS, posto que o Brasil é o único país com mais de 200 milhões de habitantes que adotou um sistema de saúde público, universal e gratuito.
O melanoma corresponde a menos de 5% das neoplasias malignas cutâneas. No Brasil, segundo dados do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA), estima-se que em 2018 ocorreram 6.260 casos novos.5 Entretanto, se a incidência é relativamente baixa, a carga da doença é expressiva, decorrente do elevado potencial de metastização e da alta letalidade que provoca. O melanoma é considerado o câncer de pele mais agressivo e com pior prognóstico. Em 2016, ocorreram 1.773 óbitos pela doença no país, resultando em uma taxa de mortalidade ajustada pela população mundial de 0,66 por 100 mil habitantes.6
A dacarbazina, quimioterapia-padrão para o tratamento do melanoma avançado não cirúrgico e metastático até 2010, não modifica a sobrevida dos pacientes quando comparada aos cuidados paliativos.7 A introdução da terapia-alvo, tratamento sistêmico que promove a inibição seletiva da mutação do gene B-raf proto-oncogene (BRAF), presente em aproximadamente 50% dos pacientes, possibilita o bloqueio da via de sinalização da proteína quinase ativada e, consequentemente, inibe o crescimento tumoral.7 Os ensaios clínicos randomizados que compararam as terapias-alvo isoladas à quimioterapia convencional com dacarbazina mostraram redução - estatisticamente significativa - de 30% no risco de morte em 24 meses, com o uso de vemurafenibe, e redução do risco de progressão de 70%, sem redução na mortalidade, para o uso de dabrafenibe.8,9 Foram observadas maiores sobrevidas global e livre de progressão dos tratamentos combinados, quando comparados aos isolados.10,11
As Diretrizes Diagnósticas e Terapêuticas do Melanoma Maligno Cutâneo do Ministério da Saúde, embasadas por revisão da literatura realizada em outubro de 2012, não recomendam a terapia-alvo para o melanoma avançado não cirúrgico e metastático, sendo a dacarbazina o quimioterápico mais amplamente utilizado.12 Segundo as mesmas diretrizes, no advento de novas evidências científicas, sua abordagem deve ser avaliada pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec).
O presente estudo objetivou estimar o impacto orçamentário incremental da terapia-alvo para tratamento de primeira linha do melanoma avançado não cirúrgico e metastático, em comparação à dacarbazina.
Métodos
Realizou-se análise de impacto orçamentário conforme as recomendações das Diretrizes metodológicas: análise de impacto orçamentário: manual para o Sistema de Saúde do Brasil e da International Society for Pharmacoeconomics and Outcomes Research (ISPOR).13,14
O problema de saúde para o qual se destina a intervenção avaliada nesta análise de impacto orçamentário é o melanoma cutâneo avançado não cirúrgico e metastático (estágio III irressecável; ou estágio IV), com mutação da valina para ácido glutâmico na posição 600 da proteína (V600) no gene BRAF, sem tratamento prévio.
A tecnologia avaliada foi a terapia-alvo. Atualmente, duas modalidades de terapias-alvo isoladas para inibição BRAF são aprovadas no Brasil pela Agência Nacional de Vigilância Sanitária (Anvisa): vemurafenibe e dabrafenibe. Quanto à terapia-alvo combinada, dois esquemas terapêuticos podem ser administrados: vemurafenibe + cobimetinibe; e dabrafenibe + trametinibe.
O estudo foi realizado sob a perspectiva do SUS enquanto órgão financiador dos serviços públicos de saúde. Dado o contexto dinâmico e de alta difusão de tecnologias em oncologia, considerou-se suficiente a adoção de um horizonte temporal de três anos (2018-2020) para esta análise.
O cenário de referência corresponde ao tratamento-padrão da população-alvo no SUS: quimioterapia com dacarbazina na dose de 1.000mg/m² por via intravenosa a cada 21 dias, até progressão da doença ou intolerância incontrolável ao tratamento.
Os cenários alternativos incluíram as diversas modalidades de terapia-alvo, utilizadas até que o paciente apresente progressão da doença ou intolerância incontrolável ao tratamento:
Cenário alternativo 1
Vemurafenibe, na dose de 960mg (4 comprimidos de 240mg) por via oral, de 12 em 12 horas.
Cenário alternativo 2
Dabrafenibe, na dose de 150mg (2 cápsulas de 75mg; ou 3 cápsulas de 50mg) por via oral, de 12 em 12 horas.
Cenário alternativo 3
Vemurafenibe (mesma dose prescrita para o cenário alternativo 1) + cobimetinibe, na dose de 60mg (3 comprimidos de 20mg) por via oral, uma vez por dia, por 21 dias ao mês.
Cenário alternativo 4
Dabrafenibe (mesma dose prescrita para o cenário alternativo 2) + trametinibe, na dose de 2mg (1 comprimido de 2,0mg; ou 4 comprimidos de 0,5mg) uma vez por dia.
O delineamento dos cenários de referência e alternativos foi modelado com três estados de saúde relacionados ao melanoma avançado não cirúrgico e metastático: sem progressão; com progressão; e óbito (Figura 1).
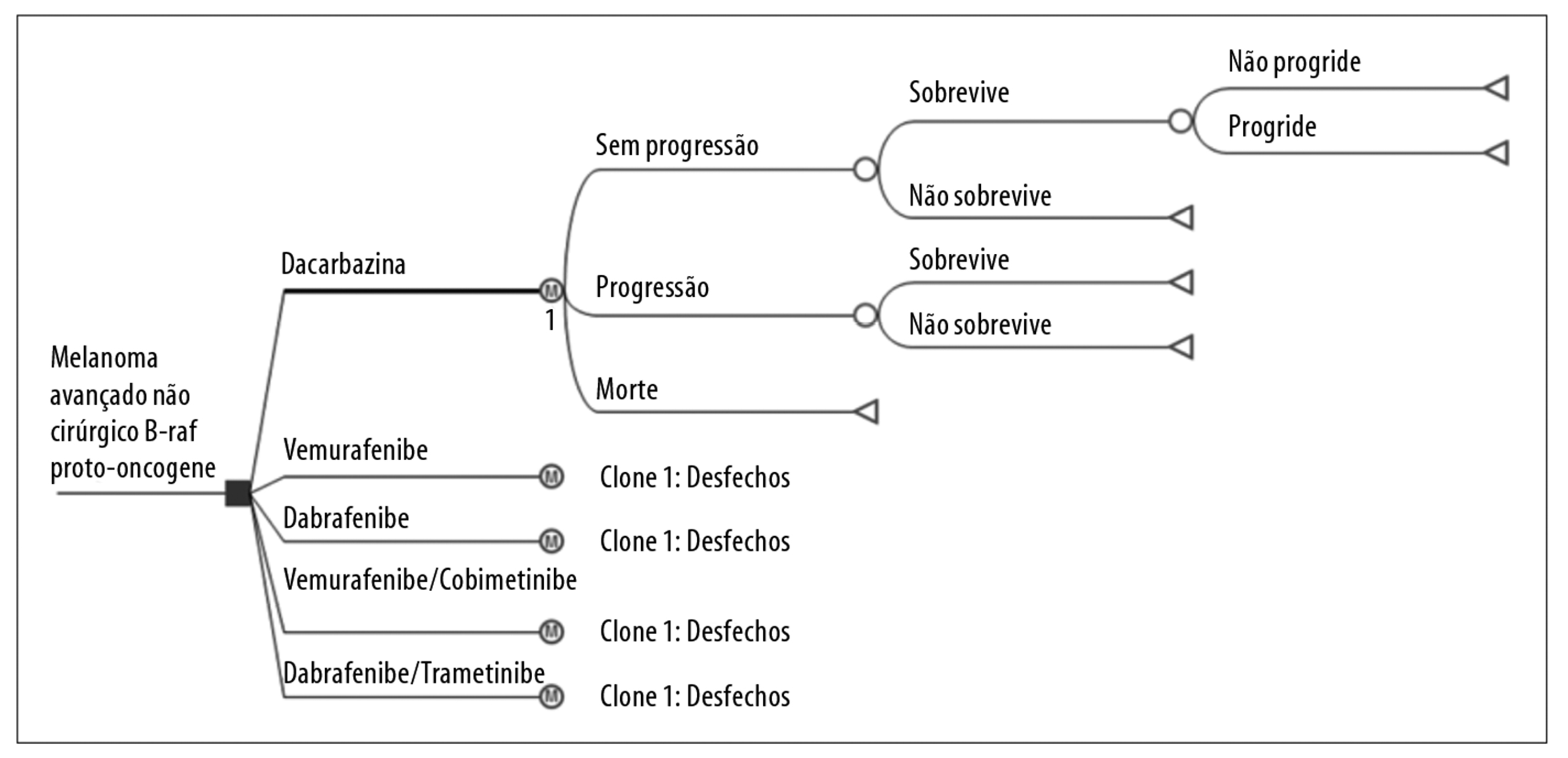
Figura 1 - Modelo analítico da dacarbazina como cenário alternativo de terapia-alvo para tratamento de primeira linha do melanoma avançado não cirúrgico e metastático
A taxa de difusão da nova tecnologia no SUS e a taxa de market-share em relação à terapia-padrão e entre as diferentes modalidades de terapias-alvo, ao longo do horizonte temporal do estudo, não foram consideradas, dada a incerteza inerente a esses pressupostos: há lacunas na evidência científica sobre a metodologia mais apropriada para determinar essas taxas.15 Inovações farmacêuticas de maior eficácia frente a outros medicamentos já disponíveis costumam ser rapidamente difundidas no SUS.15 Ademais, segundo os oncologistas clínicos do INCA, consultados em entrevista semiestruturada, a terapia-alvo, uma vez incorporada, poderia ser substitutiva já no primeiro ano.
A população de interesse do estudo consistiu de pacientes com melanoma avançado não cirúrgico e metastático (estágio III irressecável; ou estágio IV), com mutação no gene BRAF V600, sem tratamento prévio.
A incidência anual de casos de melanoma nos estágios IIIc e IV com mutação BRAF atendidos no SUS, válida para o primeiro ano do horizonte temporal estipulado, tanto no cenário de referência como nos cenários alternativos, foi definida a partir de dados populacionais e epidemiológicos robustos e estratificados, obtidos de informações disponibilizadas pela Fundação Instituto Brasileiro de Geografia e Estatística (IBGE), e dos Registros de Câncer de Base Populacional.16,17 Foi utilizada a projeção da população do Brasil por sexo e idade (18 anos ou mais) para os anos de 2018 a 2020.16 Em 2013, a taxa mediana de incidência de melanoma no país, ajustada pela população mundial, foi de 4,84 por 100 mil em homens e de 3,22 por 100 mil em mulheres; 26,2% dos casos foram diagnosticados nos estágios IIIc e IV, e desses, 74,7% dos pacientes foram atendidos no SUS.17 A prevalência de mutação BRAF V600 em pacientes com melanoma avançado não cirúrgico e metastático foi estimada em 48%, com base em dados da literatura científica.18
Adicionalmente, para o cálculo do tamanho da população no segundo e no terceiro ano analisados, foi necessário considerar a dinâmica de sobrevida, ou seja, o percentual de pacientes sobreviventes sem progressão da doença nos anos anteriores e que, consequentemente, continuariam a receber o tratamento. Esses dados foram obtidos do levantamento da literatura científica.19,20 Para o cenário de referência com a dacarbazina, a sobrevida livre de progressão no 1º ano foi de 10,7%, e no 2º ano, de 5,2%; no 3º ano, todos os pacientes progrediram ou morreram, segundo ensaio clínico randomizado, duplo-cego, multicêntrico, de fase III, que utilizou a dacarbazina como comparador.19 Para os cenários alternativos com as terapias-alvo, foram utilizadas as hazard ratios (HR) de progressão em relação à dacarbazina, reportadas em uma metanálise em rede: 0,38 para o vemurafenibe; 0,37 para o dabrafenibe; 0,22 para vemurafenibe + cobimetinibe; e 0,21 para dabrafenibe + trametinibe.20
Assim sendo, no cenário de referência, onde só a dacarbazina estaria disponível: (i) no primeiro ano, a população foi composta apenas pelos pacientes incidentes; (ii) para os incidentes do segundo ano, foi preciso somar os sobreviventes que não progrediram no primeiro ano; e (iii) para os incidentes do terceiro ano, foi preciso somar os sobreviventes que não progrediram no primeiro e no segundo ano. A mesma lógica foi aplicada aos cenários alternativos; entretanto, os pacientes incidentes foram estratificados como ‘sem mutação’ e ‘com mutação’, gerando um quantitativo de sobreviventes sem progressão desigual nos dois grupos, haja vista a diferença de eficácia dos tratamentos.
Foram considerados no modelo apenas os custos diretos médicos. A identificação e a mensuração dos recursos em saúde foram realizadas a partir da revisão da literatura científica,20 leitura das recomendações dos fabricantes da dacarbazina e das terapias-alvo, recomendações das Diretrizes Diagnósticas e Terapêuticas do Melanoma Maligno Cutâneo do Ministério da Saúde,12 consulta a oncologistas clínicos do INCA por meio de entrevista semiestruturada, e dados do Sistema de Informações Ambulatoriais do Sistema Único de Saúde (SIA/SUS) disponibilizados pelo Departamento de Informática do SUS (Datasus). Os recursos incluíram o teste cobas® 4800 BRAF V600, imprescindível na identificação de pacientes com mutações BRAF V600, terapias oncológicas, consultas, exames laboratoriais, exames de imagem e exames para monitoramento de eventos adversos, necessários para o acompanhamento dos pacientes.
A valoração dos recursos em saúde foi conduzida pelo método de macrocusteio, que permite a generalização dos resultados para outras instituições de assistência oncológica no país.21 Foi utilizado o SIA/SUS e pesquisados os valores de reembolso e custeio do Sistema de Gerenciamento da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais (SIGTAP), assim como os preços disponíveis no Banco de Preços em Saúde, ambos do Sistema Único de Saúde.22,23 Também foi consultada a tabela de preços da Câmara de Regulação do Mercado de Medicamentos (CMED) da Anvisa, para estimação do custo das terapias-alvo não disponibilizadas no SUS.24 O preço sugerido para o teste cobas® 4800 BRAF V600, também indisponível no SUS, foi obtido de cotação junto a um laboratório privado de análises clínicas, realizada por contato telefônico. Assim foram estimados os custos anuais por paciente. Não foram encontrados dados nacionais referentes ao custeio do manejo de eventos adversos, atendimentos em serviços de emergência e internações hospitalares. Os custos foram estimados em reais (R$), considerando-se o ano de 2017. Coerentemente com as diretrizes metodológicas, não foi aplicada taxa de desconto ou correção pela inflação.13
A análise de impacto orçamentário foi realizada por calculadora de custos, desenvolvida em planilha eletrônica determinística elaborada no software Microsoft Excel® 2016. Utilizou-se um modelo estático, que consistiu da multiplicação do custo individual de cada tecnologia por paciente pelo número de indivíduos com indicação de uso.
O impacto orçamentário incremental foi calculado pela diferença de custos entre os cenários alternativos de tratamento e o cenário de referência, considerando-se a população-alvo do cenário em cada ano do horizonte temporal. Também foi estimado o percentual dos gastos totais com medicamentos ambulatoriais no SUS eventualmente direcionado à terapia-alvo, pois esse segmento abrange o componente especializado do Bloco de Financiamento da Assistência Farmacêutica, que inclui medicamentos em geral, para doenças raras e crônicas, de alto custo, em nível ambulatorial. Segundo análise do Instituto de Pesquisa Econômica Aplicada (Ipea)/Ministério da Economia, o gasto do SUS com medicamentos ambulatoriais foi de R$18,6 bilhões em 2016. A pesquisa foi baseada na execução orçamentária do Ministério da Saúde e das secretarias de saúde dos 26 estados, do Distrito Federal e dos municípios, utilizando-se dados de sistemas de informações de acesso público: Siga Brasil; e Sistema de Informações sobre Orçamentos Públicos em Saúde (SIOPS).25
A validade aparente foi estabelecida por revisão da estrutura do modelo, dos pressupostos e dos valores dos parâmetros, realizada com especialistas, mediante entrevistas semiestruturadas individuais.
A validação interna do modelo consistiu de revisão da transcrição dos dados e da sintaxe da programação do software utilizado.
O impacto das incertezas nas estimativas e premissas adotadas sobre os resultados da análise de impacto orçamentário foi avaliado por cenários. O tamanho da população de interesse e os custos dos cenários foram selecionados para variação, por serem questões centrais na análise de impacto orçamentário. Segundo recomendação das diretrizes brasileiras, as variáveis foram modificadas arbitrariamente, em 20% para mais (pior cenário) e para menos (melhor cenário).13
O estudo baseou-se no levantamento de informações de acesso e domínio públicos, em bancos de dados cujas informações são agregadas, sem possibilidade de identificação individual, e na revisão de textos científicos. Portanto, considerando a Resolução do Conselho Nacional de Saúde (CNS) no 510, de 7 de abril de 2016, o projeto da pesquisa foi dispensado de apreciação por Comitê de Ética em Pesquisa (CEP) institucional ou pelo Comitê Nacional de Ética em Pesquisa (CONEP).
Resultados
A partir dos dados epidemiológicos, foram estimadas as coortes iniciais de pacientes com melanoma nos estágios IIIc e IV atendidos pelo SUS em 2018, totalizando 1.204 casos, tanto no cenário de referência como nos cenários alternativos; nos cenários com as terapias-alvo, a população foi estratificada ‘sem mutação’ (626) e ‘com mutação’ (578) (Figura 2). Considerando-se a estimativa de incidência e a dinâmica de sobrevida em 2019 e 2020, foram incluídos no cenário de referência, respectivamente, 1.350 e 1.429 pacientes. Em 2019 e 2020, nos cenários alternativos, a população foi constituída por, respectivamente, 693 e 725 indivíduos sem mutação, e por 678 a 688 e 725 a 742 indivíduos com mutação.

Figura 2 - Estimativa de casos de melanoma cutâneo avançado não cirúrgico e metastático (estágios IIIc e IV) atendidos no Sistema Único de Saúde do Brasil no primeiro ano dos cenários de referência e alternativos, Brasil, 2018
O custo do teste foi de R$ 1.053,00 por paciente (Tabela 1). O custo anual dos tratamentos foi de R$ 13.212,60 para a dacarbazina, R$ 257.673,60 para o vemufarenibe, R$ 238.528,80 para o dabrafenibe, R$ 393.291,81 para vemurafenibe + cobimetinibe e R$ 375.631,20 para dabrafenibe + trametinibe. O acompanhamento dos sobreviventes sem progressão variou de R$ 2.861,76 a R$ 3.408,48.
Tabela 1 - Estimativa de custos anuais por paciente de melanoma cutâneo avançado não cirúrgico e metastático (estágios IIIc e IV), Brasil, 2018-2020
| Componente | Valor (R$) | Fontes |
|---|---|---|
| Exame de triagem | ||
| Teste de mutação V600/B-raf proto-oncogene | 1.053,00 | Cotação junto a um laboratório privado |
| Tratamento | ||
| Dacarbazina | 13.212,60 | SIA/SUSa em 2014 |
| Vemurafenibe | 257.673,60 | CMEDb / Bula |
| Dabrafenibe | 238.528,80 | CMEDb / Bula |
| Vemurafenibe + cobimetinibe | 393.291,81 | CMEDb / Bula |
| Dabrafenibe + trametinibe | 375.631,20 | CMEDb / Bula |
| Acompanhamento de sobreviventes sem progressão | ||
| Dacarbazina | 2.861,76 | SIGTAPc / Bula / Diretrizd / Especialista |
| Vemurafenibe | 3.043,80 | SIGTAPc / Bula / Diretrizd / Especialista |
| Dabrafenibe | 2.999,40 | SIGTAPc / Bula / Diretrizd / Especialista |
| Vemurafenibe + cobimetinibe | 3.408,48 | SIGTAPc / Bula / Diretrizd / Especialista |
| Dabrafenibe + trametinibe | 3.364,08 | SIGTAPc / Bula / Diretrizd / Especialista |
a) SIA/SUS: Sistema de Informações Ambulatoriais do Sistema Único de Saúde.
b) CMED: Câmara de Regulação do Mercado de Medicamentos.
c) SIGTAP: Sistema de Gerenciamento da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais.
d) Diretrizes Diagnósticas e Terapêuticas do Melanoma Maligno Cutâneo.18
Na composição dos custos totais do tratamento da população de interesse no horizonte de três anos, os esquemas terapêuticos representaram 82% dos custos no cenário de referência, e 97 a 98% dos custos nos cenários alternativos. O acompanhamento de sobreviventes sem progressão variou de 1,5-2,3% dos custos nos cenários alternativos a 18% dos custos no cenário de referência. O teste para mutações BRAF V600 representou entre 0,46 e 0,74% dos custos totais nos cenários alternativos.
A Figura 3a ilustra o impacto orçamentário anual e total da terapia-padrão e das terapias-alvo. O impacto orçamentário incremental nos cenários alternativos com as terapias-alvo é apresentado a seguir:
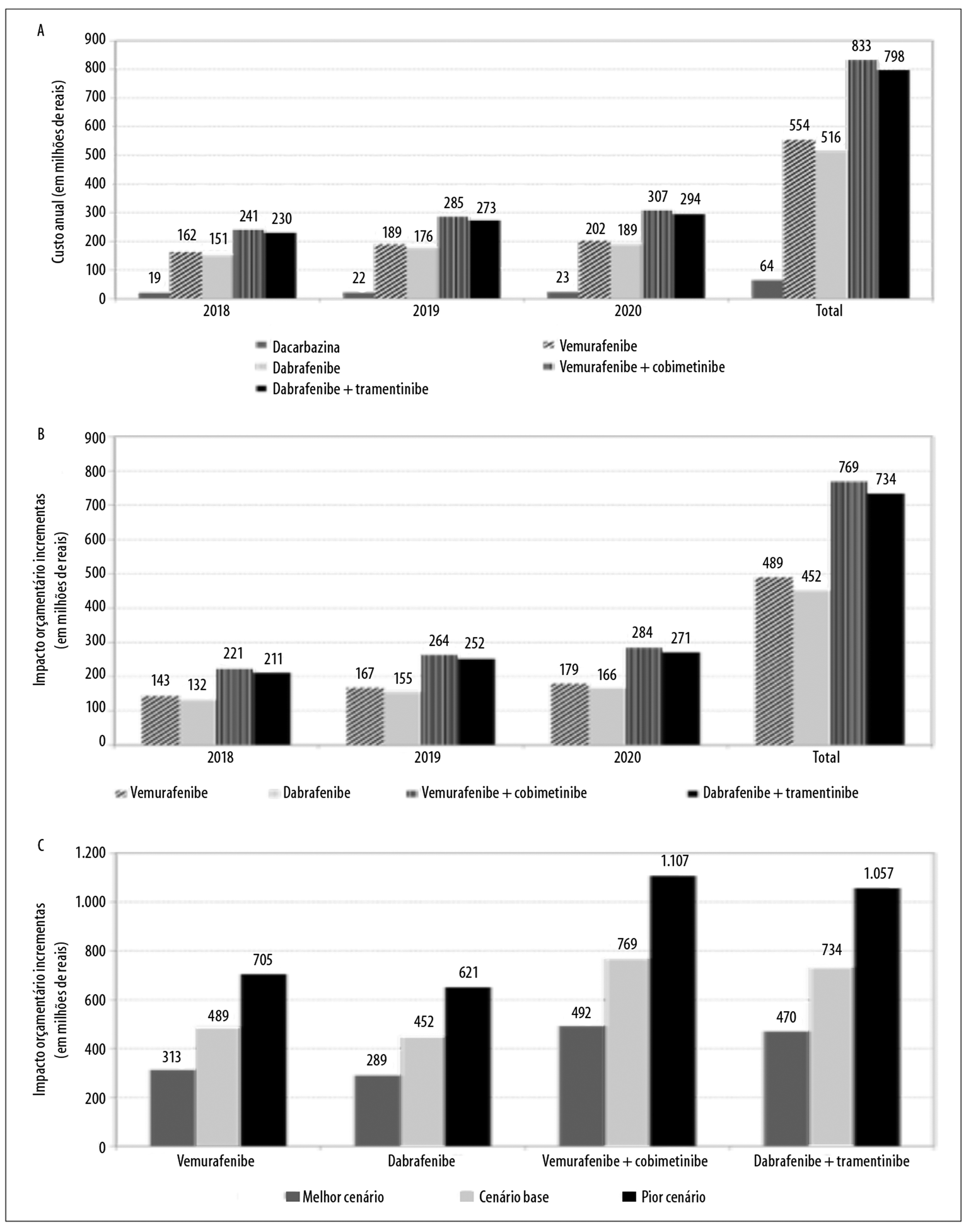
Figura 3 - Estimativas de (a) impacto orçamentário anual e total da terapia-padrão e das terapias-alvo, do (b) impacto orçamentário incremental anual e total das terapias-alvo, e análise de sensibilidade (melhor e pior cenário) e do (c) impacto orçamentário incremental, no tratamento de melanoma cutâneo avançado não cirúrgico e metastático (estágios IIIc e IV), Brasil, 2018-2020
1o ano
R$ 142.621.428,00 (vemurafenibe)
R$ 131.533.975,00 (dabrafenibe)
R$ 221.191.862,00 (vemurafenibe + cobimetinibe)
R$ 210.961.970,00 (dabrafenibe + trametinibe)
2o ano
R$ 167.461.943,00 (vemurafenibe)
R$ 154.620.120,00 (dabrafenibe)
R$ 263.594.092,00 (vemurafenibe + cobimetinibe)
R$ 251.650.125,00 (dabrafenibe + trametinibe)
3o ano
R$ 179.399.382,00 (vemurafenibe)
R$ 165.713.785,00 (dabrafenibe)
R$ 284.075.014,00 (vemurafenibe + cobimetinibe)
R$ 271.298.039,00 (dabrafenibe + trametinibe)
Total
R$ 489.482.753,00 (vemurafenibe)
R$ 451.867.881,00 (dabrafenibe)
R$ 768.860.968,00 (vemurafenibe + cobimetinibe)
R$ 733.910.134,00 (dabrafenibe + trametinibe) (Figura 3b).
O impacto orçamentário incremental anual para os cenários alternativos com as terapias-alvo representou 0,70 a 1,19% no primeiro ano, 0,83 a 1,41% no segundo ano e 0,89 a 1,53% dos gastos anuais totais com medicamentos ambulatoriais eventualmente oferecidos no SUS.
A modificação dos parâmetros, no melhor e no pior cenário, provocou variação nos resultados do cálculo do impacto orçamentário incremental: de R$ 313.268.962,00 a R$ 704.855.164,00 para o vemurafenibe; de R$ 289.160.835,00 a R$ 650.611.880,00 para o dabrafenibe; de R$ 492.036.411,00 a R$ 1.107.081.926,00 para vemurafenibe + cobimetinibe; e de R$ 469.667.877,00 a R$ 1.056.752.724,00 para dabrafenibe + trametinibe (Figura 3c).
Discussão
Os valores obtidos nesta análise de impacto orçamentário para eventual incorporação da terapia-alvo no tratamento do melanoma avançado não cirúrgico e metastático pelo SUS ultrapassam R$ 700 milhões, no horizonte temporal de três anos. Embora não existam limiares definidos de impacto orçamentário, eles podem ser considerados altos (acima de R$ 85 milhões) para o sistema, de acordo com a distribuição de valores resultante de análise histórica dos relatórios de recomendação de medicamentos avaliados pela Conitec.26 O alto impacto orçamentário incremental pode ser explicado pelo aumento exponencial dos custos das novas tecnologias oncológicas. De fato, no presente estudo, os esquemas terapêuticos representaram o maior percentual dos custos no cenário de referência e nos cenários alternativos, sendo o custo anual das terapias-alvo 18 a 30 vezes maior quando comparado ao custo da dacarbazina.
A população de interesse foi estimada com base em dados populacionais e epidemiológicos, pois não foram encontrados dados robustos de demanda aferida, talvez mais próximos da realidade. As taxas de incidência de melanoma no país utilizadas incluíram todas as faixas etárias; contudo menos de 1% dos pacientes eram menores de 18 anos. Adicionalmente, as probabilidades de sobrevida livre de progressão empregadas no cálculo do tamanho da população no horizonte temporal da análise foram baseadas em resultados de eficácia, apresentados em ensaios clínicos randomizados não conduzidos no Brasil e, talvez por isso, não generalizáveis para o país e provavelmente superestimados. A prevalência de mutação BRAF V600 não foi estimada com base em dados nacionais. Pesquisas brasileiras não relataram resultados desagregados por estadiamento, apresentando variações de 39 a 70% na positividade.27 Também não foi considerado o market-share em relação à terapia-padrão, entre as diferentes modalidades de terapias-alvo, como também em relação à imunoterapia, passível de - eventualmente - ser avaliada visando incorporação. Dessa forma, o tamanho da população pode não ser fidedigno. Entretanto, a variação desses pressupostos e estimativas na análise de melhor cenário, com população 20% menor, revelou que o impacto orçamentário incremental ainda seria marcante e ocasionaria aumento excessivo de gastos.
Foram considerados todos os custos relevantes para o sistema, apesar de os custos com internações hospitalares por complicações da doença ou decorrentes do tratamento não terem sido estimados, haja vista a terapia-alvo representar até 98% dos custos totais observados nos cenários alternativos. De qualquer forma, na metanálise em rede que utilizou evidências diretas e indiretas, relativas às terapias-alvo isoladas ou combinadas, tendo a dacarbazina como comparador comum, não foram encontradas diferenças estatisticamente significativas na ocorrência de eventos adversos graves.20 Não foi possível conduzir uma análise de sensibilidade probabilística, dada a ausência de resultados das medidas de precisão e variabilidade dos parâmetros relacionados aos custos.
As estimativas obtidas são consistentes com os resultados de avaliações econômicas com análise de impacto orçamentário elaboradas em outros países. Na Noruega, em 2015, uma ATS concluiu que o impacto orçamentário para o sistema público com a incorporação da terapia-alvo poderia ser substancial; entretanto, havia a possibilidade, mediante negociação de preços, da redução desse impacto na proporção de 63 a 84%, a depender do esquema terapêutico adotado.20 Na Itália, uma análise de impacto orçamentário mais recente, realizada em 2017, relatou que a incorporação da terapia-alvo pelo sistema público de saúde demandaria quase 200% de recursos adicionais para o tratamento de pacientes com melanomas metastáticos com mutação BRAF nos três anos considerados.28 No Reino Unido, desde 2015, o National Institute for Heath and Care Excellence (Nice) recomenda o tratamento do melanoma irressecável ou metastático positivo para mutação BRAF V600 com vemurafenibe ou dabrafenibe tão somente sob a condição de o fabricante fornecer o medicamento com o desconto acordado junto ao projeto Patient Access Schemes, o qual visa garantir aos pacientes o acesso a medicamentos de alto custo, não considerados custo-efetivos pelos contribuintes do sistema público.29 Nos Estados Unidos, ainda que na perspectiva dos planos de saúde privados, também foram apontadas importantes consequências financeiras da introdução da terapia-alvo na prática clínica, principalmente em virtude do custo dos medicamentos.30
No Brasil, a terapia-alvo, quando comparada à administração da dacarbazina em pacientes com melanoma avançado não cirúrgico e metastático, implica aumento expressivo de gastos, desfavorecendo eventual incorporação.











 texto em
texto em 


