Introdução
O câncer de tireoide é a neoplasia maligna mais comum do sistema endócrino e sua incidência tem aumentado a partir da década de 1990, sem repercussões consideráveis na mortalidade e na sobrevida das populações estudadas em todo o mundo.1 A diferença entre as magnitudes de incidência e a mortalidade pode estar associada à ocorrência de um diagnóstico mais oportuno e do prognóstico favorável dos tipos histológicos mais comumente detectados, os carcinomas diferenciados.2
Segundo projeção norte-americana,8 o câncer de tireoide ocupará a quarta posição entre as neoplasias malignas mais frequentes em 2030, e possivelmente esse padrão também será verificado em outros países. Apontado como possível hipótese para o aumento da incidência, o sobrediagnóstico – atribuído à introdução de novas tecnologias diagnósticas3 – implica a detecção e o tratamento de tumores de baixo risco, além de gerar uma morbidade permanente, associada à tireoidectomia e à reposição hormonal.4, Essas questões conferem relevância à situação do câncer de tireoide para a Saúde Pública, ainda que, no Brasil, os estudos acerca do perfil de casos atendidos no âmbito do Sistema Único de Saúde (SUS) sejam escassos. Os registros hospitalares de câncer (RHCs) fornecem informações que possibilitam conhecer a situação dos casos tratados nos hospitais habilitados no SUS e avaliar as questões relacionadas à assistência pública oncológica no país. O presente estudo teve como objetivo descrever o perfil clínico-epidemiológico dos casos hospitalares de câncer primário de tireoide no Brasil.
Métodos
Estudo descritivo com dados dos casos de câncer de tireoide informados pelos RHCs do Brasil.
As informações dos casos foram extraídas do Integrador RHC (IRHC), um sistema web desenvolvido pelo Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA), responsável pela consolidação das bases de dados enviadas pelos estabelecimentos de saúde habilitados na atenção especializada em oncologia no âmbito do SUS, e de instituições que fornecem informações da assistência oncológica de forma espontânea. O estudo utilizou a base de dados atualizada no IRHC em setembro de 2019.
Cabe ressaltar que o envio de bases de dados para o IRHC é considerado um processo dinâmico, visto que as habilitações e desabilitações ocorrem ao longo do tempo. Além disso, embora os RHCs coletem as informações de maneira prospectiva, também podem enviar bases com casos registrados retrospectivamente. Por esse motivo, a quantidade de RHCs informantes variou no decorrer do período de estudo.
Foram selecionadas as seguintes variáveis:
sexo (feminino; masculino);
idade (registrada em anos completos, categorizada em faixas etárias: ≤19; 20-29; 30-39; 40-49; 50-59; 60-69; ≥70);
escolaridade (nenhuma; ensino fundamental; ensino médio; ensino superior);
Unidade da Federação (UF) de residência do caso;
tipo histológico (diferenciado; medular; anaplásico);
classificação de tumores malignos (TNM);
estadiamento clínico do tumor (I; II; III; IV; IVA; IVB; IVC);
diagnóstico e tratamento anterior (refere-se ao status de chegada do caso na instituição do RHC informante, sendo possíveis as categorias: sem diagnóstico e sem tratamento; com diagnóstico e sem tratamento; com diagnóstico e com tratamento; outros);
protocolo terapêutico (estratificado segundo os tratamentos mais relevantes, entre os quais foram considerados: cirurgia [somente]; cirurgia + radioiodoterapia; cirurgia + radioterapia; radioiodoterapia [somente]; radioterapia [somente]; protocolos terapêuticos múltiplos; nenhum tratamento);
data de primeira consulta (considerada como aquela de atendimento pelo serviço responsável pelo diagnóstico/tratamento, desconsiderando-se as consultas de triagem ou de orientação e as entrevistas sociais);
data do diagnóstico;
data de início do tratamento; e
Cadastro Nacional de Estabelecimentos de Saúde (CNES) dos RHCs (utilizado para consultar a UF do RHC informante).12
O tipo histológico refere-se aos códigos morfológicos do tumor segundo a Classificação Internacional de Doenças para a Oncologia, 3ª edição (CID-O3),13 sendo considerados aqueles relacionados aos carcinomas diferenciados (8050; 8260; 8340-8344; 8350; 8450-8460; 8290; 8330-8335), medulares (8345; 8510-8513) e anaplásicos (8020-8035).
As variáveis ‘estadiamento clínico do tumor’ e ‘TNM’, normalmente disponíveis no banco de dados, representam o estádio do caso no momento de chegada à instituição do RHC informante. Para os casos cuja informação sobre estadiamento estava ausente e a informação sobre o TNM estava presente, optou-se por fazer a correspondência entre estadiamento e TNM, respeitando-se a edição vigente no ano de primeira consulta do caso (5ª edição14 para os casos de 2000 a 2004; 6ª edição15 para os casos de 2005 a 2012; e 7ª edição16 para os casos de 2013 a 2016), tal como se realizasse pelo RHC. Uma particularidade a ser mencionada é a de que, na 5ª edição da TNM, o estádio IV não apresentava subdivisões como nas edições 6ª e 7ª (IVA, IVB e IVC).
O intervalo de tempo mediano entre a primeira consulta e o diagnóstico foi mensurado para os casos que chegaram à instituição do RHC sem diagnóstico e sem tratamento. Também foi calculado o intervalo de tempo mediano entre o diagnóstico e o início do tratamento para (i) os casos que chegaram sem diagnóstico e sem tratamento e para (ii) os que chegaram com diagnóstico e sem tratamento, excluindo-se aqueles que tiveram a informação do tratamento ignorada e os que não receberam nenhum tratamento. O tempo entre o diagnóstico e o tratamento, mensurado em valor absoluto, foi estratificado em ≤60 dias e >60 dias, considerando-se o preconizado pela Lei no 12.732, de 2012.17
Foi realizada uma análise descritiva dos dados por meio da distribuição das variáveis na população de estudo. Foram calculadas medidas de tendência central e de dispersão para as variáveis contínuas. Com o intuito de não sofrer influência de outliers, optou-se por utilizar a mediana e o respectivo intervalo interquartil (IIQ). Para as variáveis categóricas, foram calculadas proporções, sendo a comparação entre os grupos realizada pelos testes do qui-quadrado de Pearson, considerando-se o nível de significância de 5%. Uma matriz com o número absoluto de casos segundo UF de residência versus UF do RHC informante foi construída, sendo calculada a proporção de casos atendidos na própria UF de residência. A razão entre os sexos feminino e masculino (F/M) foi calculada, igualmente analisada segundo tipos histológicos e faixas etárias. Todas as análises foram realizadas com uso do software R, versão 3.6.1.
O projeto do estudo foi aprovado pelo Comitê de Ética em Pesquisa da Escola Nacional de Saúde Pública Sergio Arouca/Fundação Oswaldo Cruz (Cep/ENSP/Fiocruz): Certificado de Apresentação para Apreciação Ética (CAAE) no 62062116.8.0000.5240, em 31 de janeiro de 2017.
Resultados
Entre os 83.151 casos primários de câncer de tireoide informados pelos RHCs do Brasil, 80.463 tiveram a primeira consulta para tratamento do tumor no período de 2000 a 2016, e 56.394 foram acompanhados na instituição do RHC informante. Destes, 51.291 eram carcinomas diferenciados, 1.042 eram medulares e 579 anaplásicos, totalizando 52.912 casos selecionados para o estudo.
A distribuição proporcional de casos informados pelos RHCs aumentou ao longo dos anos, de 1,1% em 2000 para 11,0% em 2014. Houve declínio na proporção de casos em 2015 (8,5%) e 2016 (7,3%), embora também se observasse redução no número de RHCs informantes após 2014 (Figura 1).
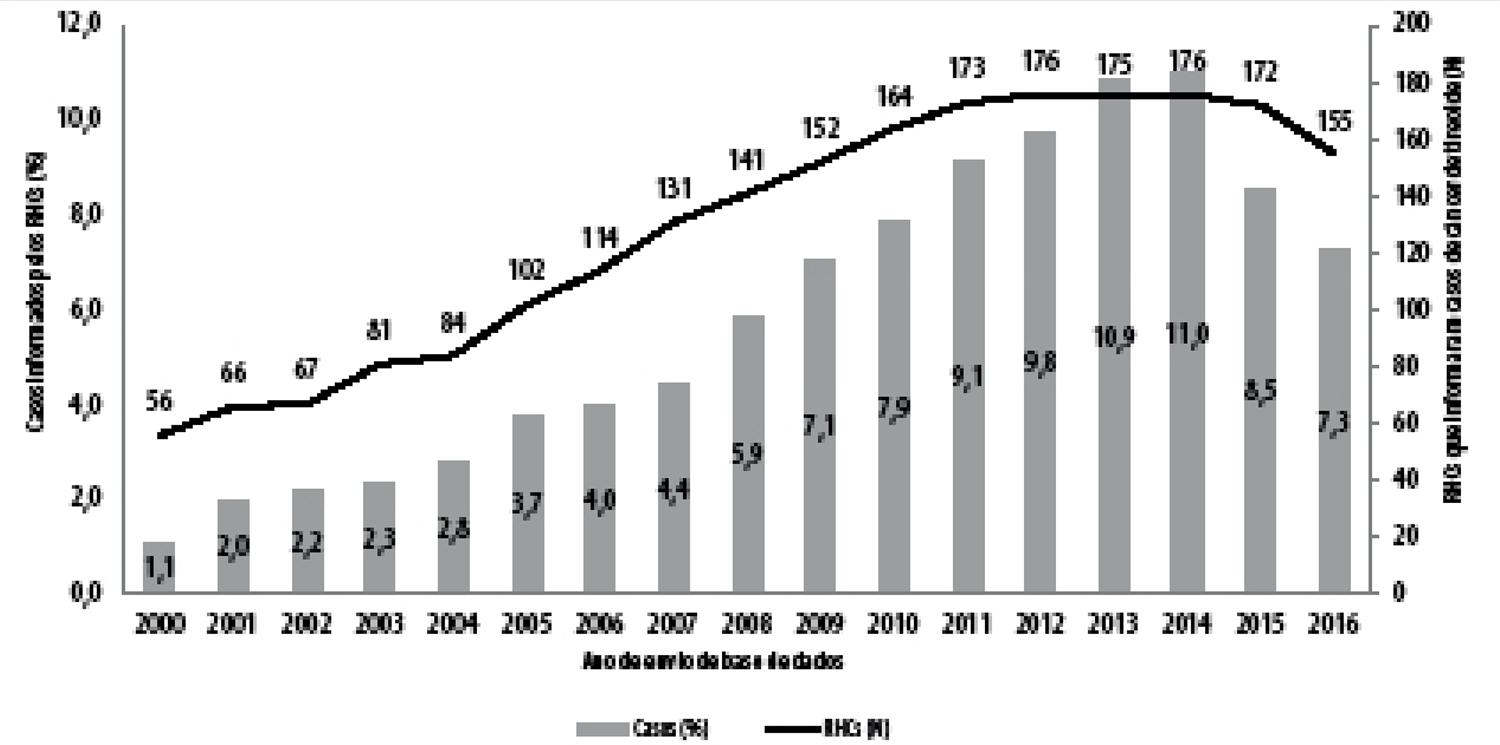
Figura 1 – Proporção de casos de câncer de tireoide e número de registros hospitalares de câncer (RHC) informados por ano, Brasil, 2000-2016
Dos 52.912 casos, 83,4% era do sexo feminino: a razão entre os sexos (F/M) foi de 5:1, com mediana de idade de 46 anos (IIQ = 35-56). Segundo o tipo histológico, a razão F/M foi de 5,3 para o carcinoma diferenciado, 1,5 para o medular e 2,2 para o anaplásico. Para o carcinoma diferenciado, a razão F/M segundo faixas etárias foi de: 3,7 para ≤19 anos; 5,7 para 20-29 anos; 5,5 para 30-39 anos; 6,1 para 40-49 anos; 5,3 para 50-59 anos; 4,4 para 60-69 anos; e 3,7 para ≥70 anos.
Em relação aos tipos histológicos, 96,9% dos casos tinham o diagnóstico de carcinoma diferenciado (inclui os carcinomas papilífero e folicular), 2,0% medular e 1,1% anaplásico, cujas idades medianas foram, respectivamente, 45 (IIQ = 35-56), 49 (IIQ = 36-60) e 66 (IIQ = 56-76) anos.
Para o carcinoma diferenciado, observou-se aumento na proporção de casos até a faixa etária de 40-49 anos, e para o medular, até 50-59 anos. O crescimento foi progressivo ao longo dos grupos etários para o carcinoma anaplásico (Tabela 1).
Tabela 1 – Características sociodemográficas e do tumor segundo tipo histológico dos casos de câncer de tireoide informados pelos registros hospitalares de câncer (RHCs), Brasil, 2000-2016
| Variáveisa | Diferenciadosb | Medular | Anaplásico | Total | p-valorc | |||
|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | |||
| Sexo | ||||||||
| Feminino | 43.081 | 84,0 | 623 | 59,8 | 400 | 69,1 | 44.104 | < 0,001 |
| Masculino | 8.205 | 16,0 | 419 | 40,2 | 179 | 30,9 | 8.803 | |
| Total | 51.286 | 100,0 | 1.042 | 100,0 | 579 | 100,0 | 52.907 | |
| Faixa etária (em anos) | ||||||||
| ≤19 | 1.377 | 2,7 | 61 | 5,9 | 6 | 1,0 | 1.444 | < 0,001 |
| 20-29 | 5.837 | 11,4 | 93 | 8,9 | 10 | 1,7 | 5.940 | |
| 30-39 | 11.014 | 21,5 | 161 | 15,5 | 19 | 3,3 | 11.194 | |
| 40-49 | 12.728 | 24,8 | 212 | 20,3 | 45 | 7,8 | 12.985 | |
| 50-59 | 11.040 | 21,5 | 235 | 22,6 | 102 | 17,6 | 11.377 | |
| 60-69 | 6.272 | 12,2 | 183 | 17,6 | 155 | 26,8 | 6.610 | |
| ≥70 | 3.019 | 5,9 | 97 | 9,3 | 242 | 41,8 | 3.358 | |
| Total | 51.287 | 100,0 | 1.042 | 100,0 | 579 | 100,0 | 52.908 | |
| Escolaridade | ||||||||
| Nenhuma | 1.819 | 5,0 | 57 | 7,2 | 71 | 18,6 | 1.947 | < 0,001 |
| Ensino fundamental | 16.277 | 44,4 | 464 | 58,8 | 230 | 60,4 | 16.971 | |
| Ensino médio | 10.930 | 29,8 | 171 | 21,7 | 51 | 13,4 | 11.152 | |
| Ensino superior | 7.645 | 20,8 | 97 | 12,3 | 29 | 7,6 | 7.771 | |
| Total | 36.671 | 100,0 | 789 | 100,0 | 381 | 100,0 | 37.841 | |
| Região de residência dos casos | ||||||||
| Norte | 1.762 | 3,4 | 29 | 2,8 | 12 | 2,1 | 1.803 | < 0,001 |
| Nordeste | 21.027 | 41,1 | 247 | 23,8 | 152 | 26,3 | 21.426 | |
| Centro-Oeste | 1.184 | 2,3 | 40 | 3,9 | 16 | 2,8 | 1.240 | |
| Sudeste | 20.249 | 39,6 | 536 | 51,7 | 267 | 46,2 | 21.052 | |
| Sul | 6.892 | 13,5 | 185 | 17,8 | 131 | 22,7 | 7.208 | |
| Total | 51.114 | 100,0 | 1.037 | 100,0 | 578 | 100,0 | 52.729 | |
| Diagnóstico e tratamento anteriores | ||||||||
| Sem diagnóstico e sem tratamento | 31.979 | 62,9 | 674 | 65,9 | 366 | 64,1 | 33.019 | < 0,001 |
| Com diagnóstico e sem tratamento | 14.277 | 28,1 | 275 | 26,9 | 167 | 29,2 | 14.719 | |
| Com diagnóstico e com tratamento | 3.996 | 7,9 | 68 | 6,6 | 35 | 6,1 | 4.099 | |
| Outros | 584 | 1,1 | 6 | 0,6 | 3 | 0,5 | 593 | |
| Total | 50.836 | 100,0 | 1.023 | 100,0 | 571 | 100,0 | 52.430 | |
| Estadiamento | ||||||||
| I | 23.521 | 73,6 | 159 | 25,0 | – | – | 23.680 | < 0,001 |
| II | 2.729 | 8,5 | 120 | 18,8 | – | – | 2.849 | |
| III | 3.969 | 12,4 | 141 | 22,1 | – | – | 4.110 | |
| IV | 130 | 0,4 | 19 | 3,0 | 70 | 21,7 | 219 | |
| IVA | 1.025 | 3,2 | 107 | 16,8 | 134 | 41,6 | 1.266 | |
| IVB | 160 | 0,5 | 17 | 2,7 | 55 | 17,1 | 232 | |
| IVC | 418 | 1,3 | 74 | 11,6 | 63 | 19,6 | 555 | |
| Total | 31.952 | 100,0 | 637 | 100,0 | 322 | 100,0 | 32.911 | |
| Protocolo terapêutico | ||||||||
| Cirurgia (somente) | 27.424 | 53,5 | 654 | 62,9 | 177 | 30,6 | 28.255 | < 0,001 |
| Cirurgia + radioiodoterapia | 5.879 | 11,5 | 31 | 3,0 | 9 | 1,6 | 5.919 | |
| Cirurgia + radioterapia | 6.068 | 11,8 | 79 | 7,6 | 47 | 8,1 | 6.194 | |
| Radioiodoterapia (somente) | 3.688 | 7,2 | 11 | 1,1 | 12 | 2,1 | 3.711 | |
| Radioterapia (somente) | 1.216 | 2,4 | 31 | 3,0 | 89 | 15,4 | 1.336 | |
| Protocolos terapêuticos múltiplos | 5.906 | 11,5 | 187 | 18,0 | 177 | 30,6 | 6.270 | |
| Nenhum tratamento | 1.037 | 2,0 | 46 | 4,4 | 67 | 11,6 | 1.150 | |
| Total | 51.218 | 100,0 | 1.039 | 100,0 | 578 | 100,0 | 52.835 | |
a) Missings: sexo (N=5; 0,01); faixa etária (N=4; 0,01%); escolaridade (N=15.071; 28,5%); região de residência dos casos (N=183; 0,4%); estadiamento (N=20.001; 37,8%); diagnóstico e tratamento anterior (N=482; 0,9%); protocolo terapêutico (N=63; 0,2%).
b) Inclui os carcinomas papilífero e folicular.
c) Teste do qui-quadrado de Pearson.
A maioria dos casos cursou até o ensino fundamental, independentemente do tipo histológico. Entretanto, 18,6% dos carcinomas anaplásicos não possuíam nenhuma escolaridade, seguidos por 7,2% dos medulares e 5,0% dos diferenciados. Entre os carcinomas diferenciados, 50,6% cursaram o ensino médio e/ou superior. Contudo, a ausência de informação nessa variável foi de 28,5% (Tabela 1).
A grande maioria dos casos era residente nas regiões Sudeste, Nordeste e Sul. O Sudeste era a região de residência de 51,7% dos carcinomas medulares e 46,2% dos anaplásicos. As regiões Nordeste e Sudeste, juntas, concentram aproximadamente 80,0% dos carcinomas diferenciados (Tabela 1).
Mais de 60,0% dos casos chegaram às instituições sem diagnóstico e sem tratamento, e um percentual acima de 20,0% foi encontrado na categoria com diagnóstico e sem tratamento, para quaisquer tipos histológicos (Tabela 1).
Para o carcinoma diferenciado, 73,6% dos casos foram classificados como estádio I. O medular apresentou 25,0% dos casos no estádio I e 22,1% no estádio III. E nos anaplásicos, foram observados 41,6% do estadiamento IVA e 19,6% do estadiamento IVC. Os casos anaplásicos cuja primeira consulta foi realizada entre os anos 2000 e 2004 foram registrados como estádio IV (21,7%), sem subdivisões. No entanto, essa variável apresentou 37,8% de informações ausentes (Tabela 1).
Em relação ao tratamento, somente cirurgia foi o protocolo terapêutico recebido na maioria dos casos, sendo realizada em 62,9% dos carcinomas medulares e 53,5% dos diferenciados. Entre os anaplásicos, 30,6% dos casos foram submetidos somente a cirurgia e 15,4% somente a radioterapia, representando esta última uma maior proporção quando comparada às dos demais tipos histológicos: 2,4% dos diferenciados e 3,0% dos medulares. O mesmo comportamento foi observado para nenhum tratamento, encontrado em 11,6% dos carcinomas anaplásicos frente a 2,0% dos diferenciados e 4,4% dos medulares (Tabela 1).
A análise dos intervalos de tempo por tipos histológicos (Tabela 2) apontou, entre os casos que chegaram sem diagnóstico e sem tratamento, os carcinomas anaplásicos com menor tempo mediano entre a primeira consulta e o diagnóstico (11 dias). Da mesma maneira, os casos anaplásicos que chegaram com diagnóstico e sem tratamento apresentaram tempo mediano menor (38 dias) entre o diagnóstico e o primeiro tratamento. Portanto, 74,7% dos carcinomas anaplásicos foram tratados em até 60 dias após o diagnóstico, frente a 34,5% dos diferenciados e 32,1% dos medulares.
Tabela 2 – Tempo (em dias) entre a primeira consulta e o diagnóstico e entre o diagnóstico e o início do tratamento segundo status de chegada do caso à instituição do registro hospitalar de câncer (RHC) e tipos histológicos, Brasil, 2000-2016
| Intervalo de tempo (dias) | Tipos histológicos | Sem diagnóstico e sem tratamento | Com diagnóstico e sem tratamento | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N | Mediana (IIQª) | ≤60 dias (%) | >60 dias (%) | N | Mediana (IIQª) | ≤60 dias (%) | >60 dias (%) | ||
| Entre a primeira consulta e o diagnóstico | Diferenciados | 31.751 | 28 (6 - 84) | − | − | − | − | − | − |
| Medular | 671 | 35 (9 - 88) | − | − | − | − | − | − | |
| Anaplásico | 363 | 11 (3 - 33) | − | − | − | − | − | − | |
| Todos | 32.785 | 28 (6 - 84) | − | − | − | − | − | − | |
| Entre o diagnóstico e o tratamento | Diferenciados | 26.020 | 0 (0 - 1) | 27.535 (88,8) | 3.467 (11,2) | 12.707 | 91 (48 - 165) | 4.442 (34,5) | 8.447 (65,5) |
| Medular | 580 | 0 (0 - 14) | 563 (86,7) | 86 (13,3) | 539 | 92 (47 - 182) | 77 (32,1) | 163 (67,9) | |
| Anaplásico | 287 | 0 (0 - 16) | 290 (92,4) | 24 (7,6) | 146 | 38 (20 - 62) | 109 (74,7) | 37 (25,3) | |
| Todos | 26.887 | 0 (0 - 2) | 28.388 (88,8) | 3.577 (11,2) | 13.092 | 90 (47 - 164) | 4.628 (34,9) | 8.647 (65,1) | |
a) Intervalo interquartil.
A distribuição dos intervalos de tempo por regiões brasileiras (Tabela 3) evidenciou que os casos que chegaram sem diagnóstico e sem tratamento apresentaram um tempo mediano de 28 dias entre a primeira consulta e o diagnóstico. Esse tempo mediano variou entre as regiões brasileiras, sendo o menor intervalo encontrado no Sul (5 dias) e o maior no Norte (73 dias). O tempo mediano entre diagnóstico e tratamento foi zero para todas as regiões, exceto a região Norte (1 dia), significando que diagnóstico e tratamento foram concomitantes. Já para os casos que chegaram com diagnóstico e sem tratamento, o tempo mediano foi de 90 dias entre o diagnóstico e o tratamento, encontrando-se o menor intervalo na região Sul (72 dias) e o maior na região Norte (142 dias). Nesse sentido, observou-se uma maior proporção de casos cujo tratamento foi empregado em tempo superior a 60 dias, variando de 55,2% na região Sul a 73,3% no Nordeste. Observou-se que o estado de São Paulo prestou atendimento a 66,9% dos casos residentes em Goiás, 33,0% dos residentes no Distrito Federal e 18,5% dos residentes no Acre (Tabela 4).
Tabela 3 – Tempo (em dias) entre a primeira consulta e o diagnóstico e entre o diagnóstico e o início do tratamento segundo status de chegada do caso à instituição do registro hospitalar de câncer (RHC) e a região de residência, Brasil, 2000-2016
| Intervalo de tempo (dias) | Regiões | Sem diagnóstico e sem tratamento | Com diagnóstico e sem tratamento | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N | Mediana (IIQa) | ≤60 dias (%) | >60 dias (%) | N | Mediana (IIQa) | ≤60 dias (%) | >60 dias (%) | ||
| Entre a primeira consulta e o diagnóstico | Norte | 570 | 73 (18 - 164) | − | − | − | − | − | − |
| Nordeste | 12.495 | 36 (10 - 100) | − | − | − | − | − | − | |
| Centro-Oeste | 552 | 22 (5 - 80) | − | − | − | − | − | − | |
| Sudeste | 14.505 | 28 (4 - 76) | − | − | − | − | − | − | |
| Sul | 4.663 | 5 (0 - 55) | − | − | − | − | − | − | |
| Brasil | 32.785 | 28 (6 - 84) | − | − | − | − | − | − | |
| Entre o diagnóstico e o tratamento | Norte | 341 | 1 (0 - 74) | 471 (83,5) | 93 (16,5) | 579 | 142 (70 - 270) | 124 (38,6) | 457 (61,4) |
| Nordeste | 8.803 | 0 (0 - 7) | 10.616 (88,7) | 1.350 (11,3) | 4.389 | 115 (61 - 205) | 1.206 (26,7) | 3.309 (73,3) | |
| Centro-Oeste | 520 | 0 (0 - 0) | 486 (86,7) | 72 (13,3) | 251 | 95 (37 - 194) | 97 (38,6) | 154 (61,4) | |
| Sudeste | 13.022 | 0 (0 - 9) | 12.478 (87,4) | 1.794 (12,6) | 6.490 | 77 (42 - 141) | 2.564 (39,4) | 3.941 (60,6) | |
| Sul | 4.201 | 0 (0 - 0) | 4.355 (94,2) | 268 (5,8) | 1.383 | 72 (30 - 125) | 637 (44,8) | 786 (55,2) | |
| Brasil | 26.887 | 0 (0 - 2) | 28.388 (88,8) | 3.577 (11,2) | 13.092 | 90 (47 - 164) | 4.628 (34,9) | 8.647 (65,1) | |
a) Intervalo interquartil.
Tabela 4 – Matriz do número absoluto de casos de câncer de tireoide por Unidade da Federação (UF) de residência e UF do registro hospitalar de câncer (RHC) informante e proporção de casos atendidos na respectiva UF de residência, Brasil, 2000-2016
| UF de residência dos casosa | UF do RHC informante | % de casos atendidos na UF de residência | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | Total | ||
| AC | 42 | − | − | − | − | − | − | − | − | − | 1 | − | − | − | − | − | − | − | − | 1 | 22 | − | − | − | − | 15 | − | 81 | 51,9 |
| AL | − | 650 | − | − | 6 | − | − | − | − | − | − | − | − | − | 1 | 9 | − | 1 | − | − | − | − | − | − | 5 | 9 | − | 681 | 95,4 |
| AM | − | − | 440 | − | 1 | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | 2 | − | 1 | − | − | 50 | − | 494 | 89,1 |
| AP | − | − | − | 26 | − | 1 | − | − | − | − | − | − | − | 26 | − | − | − | − | − | − | 3 | − | − | − | − | 4 | − | 60 | 43,3 |
| BA | − | 1 | − | − | 7.727 | 1 | 8 | 9 | − | − | 6 | 1 | 1 | 0 | − | 7 | − | 1 | 2 | − | − | − | 1 | 1 | 25 | 44 | − | 7.835 | 98,6 |
| CE | − | − | − | − | 8 | 2.578 | − | − | − | 1 | − | − | − | − | − | − | 1 | − | 3 | 1 | − | − | − | 1 | 1 | 6 | − | 2.600 | 99,2 |
| DF | − | − | − | − | 3 | − | 164 | − | − | 1 | 3 | − | − | − | − | − | − | − | 1 | 1 | − | − | − | − | − | 85 | − | 258 | 63,6 |
| ES | − | − | − | − | 1 | − | − | 573 | − | − | 3 | − | 1 | − | − | − | − | − | 10 | − | − | − | − | − | − | 13 | − | 601 | 95,3 |
| GO | − | − | − | − | − | 2 | 22 | − | 15 | − | 3 | − | − | − | − | − | 1 | − | − | − | − | − | 1 | − | − | 89 | − | 133 | 11,3 |
| MA | − | − | − | − | 1 | − | − | 1 | − | 1.594 | 2 | − | − | 2 | 1 | 2 | 128 | − | 1 | − | − | − | − | 3 | − | 13 | 4 | 1.752 | 91,0 |
| MG | − | − | − | − | 7 | 1 | 5 | 2 | − | − | 3.487 | 1 | 1 | − | − | − | − | 6 | 8 | − | − | − | − | 1 | 2 | 383 | − | 3.904 | 89,3 |
| MS | − | − | − | − | − | − | − | − | − | − | 1 | 363 | 1 | − | − | − | 1 | 8 | 1 | − | − | − | − | − | − | 137 | − | 512 | 70,9 |
| MT | − | − | − | − | 1 | − | − | − | − | − | 1 | − | 273 | − | − | − | − | − | − | − | − | − | − | − | − | 60 | 2 | 337 | 81,0 |
| PA | − | − | 30 | − | − | 1 | − | − | − | 2 | − | − | 2 | 704 | − | − | 16 | − | 1 | − | − | − | − | − | − | 29 | 6 | 791 | 89,0 |
| PB | − | − | − | − | 8 | 2 | − | − | − | − | − | 1 | − | 3 | 1.084 | 19 | 2 | 1 | 2 | 10 | − | − | 2 | 2 | 1 | 4 | − | 1.141 | 95,0 |
| PE | − | 1 | − | − | 15 | 22 | − | − | − | − | 2 | − | − | − | 7 | 2.672 | − | 2 | 2 | 1 | − | − | 1 | − | 1 | 27 | − | 2.753 | 97,1 |
| PI | − | − | − | − | 1 | 2 | − | − | − | − | 1 | − | − | − | − | 1 | 714 | − | − | − | − | − | − | − | − | 10 | − | 729 | 97,9 |
| PR | − | − | − | − | 2 | 1 | − | − | − | − | 1 | 2 | 1 | − | − | − | − | 2.059 | − | − | − | − | 2 | 17 | − | 33 | − | 2.118 | 97,2 |
| RJ | − | − | 1 | − | 2 | − | − | − | − | − | 19 | − | − | − | − | − | − | − | 1.769 | − | − | − | 1 | 1 | 3 | 23 | − | 1.819 | 97,3 |
| RN | − | − | − | − | 4 | 6 | − | − | − | − | − | − | − | − | 1 | − | − | 1 | − | 3.480 | − | − | − | − | − | − | − | 3.492 | 99,7 |
| RO | − | − | − | − | 1 | − | − | − | − | − | − | − | 4 | − | − | − | 1 | 2 | − | − | 164 | − | − | 1 | − | 34 | − | 207 | 79,2 |
| RR | − | − | 8 | − | − | − | − | − | − | − | 1 | − | − | − | − | − | 1 | − | 1 | − | 1 | 10 | − | − | − | 2 | − | 24 | 41,7 |
| RS | − | − | − | − | − | − | − | − | − | − | 1 | − | 1 | − | − | − | − | 3 | − | − | − | − | 2.099 | 3 | 1 | 3 | − | 2.111 | 99,4 |
| SC | − | − | − | − | − | − | 1 | − | − | − | − | − | − | − | 1 | − | − | 34 | − | − | − | − | 27 | 2.894 | − | 22 | − | 2.979 | 97,1 |
| SE | − | − | − | − | 27 | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | 406 | 10 | − | 443 | 91,6 |
| SP | − | − | − | − | 12 | − | 1 | − | − | − | 20 | 1 | − | − | − | − | − | 7 | 2 | − | − | − | 2 | 2 | 1 | 14.680 | − | 14.728 | 99,7 |
| TO | − | − | − | − | − | − | 1 | − | − | − | 1 | − | − | − | − | − | 1 | 1 | − | − | − | − | − | − | − | 12 | 130 | 146 | 89,0 |
| Total | 42 | 652 | 479 | 26 | 7.827 | 2.617 | 202 | 585 | 15 | 1.598 | 3.553 | 369 | 285 | 735 | 1.095 | 2.710 | 866 | 2.126 | 1.803 | 3.494 | 192 | 10 | 2.137 | 2.926 | 446 | 15.797 | 142 | 52.729 | − |
| Missing: UF de residência (N=183; 0,4%). | |||||||||||||||||||||||||||||
Discussão
Os resultados deste estudo mostraram um aumento do número de casos de câncer de tireoide informados pelos RHCs do país, ao longo dos anos. Enquanto o número de RHCs informantes aumentou mais de 3 vezes, entre os anos 2000 e 2014, o número de casos informados nesse período cresceu aproximadamente 10 vezes. A redução no número de casos observada nos anos subsequentes pode estar relacionada ao atraso no envio de bases de dados pelas instituições.18
Apesar de o presente estudo não tratar da morbidade populacional, vale ressaltar que um aumento substancial da incidência do câncer de tireoide vem sendo descrito a partir da década de 1990, em diversos países, inclusive no Brasil.2 Alguns autores sugerem que o padrão de crescimento da incidência seja real, considerando-se que: esse aumento ocorre em quaisquer tamanhos de tumores e estádios, embora seja mais notável em nódulos pequenos; afeta quase exclusivamente o tipo histológico papilífero; ele é maior para o sexo feminino que para o masculino; e exibe um efeito de coorte de nascimento, possivelmente reflexo de mudanças nos fatores de risco relacionados às exposições ambientais.4 Entretanto, outros autores defendem a hipótese de esse aumento refletir o sobrediagnostico, devido à melhora na capacidade de detectar malignidade em nódulos tireoidianos milimétricos, proporcionada pela maior disponibilidade de exames de ultrassonografia e viabilidade da citologia com material obtido por punção aspirativa com agulha fina.3
Por se tratar de um estudo de base hospitalar, a razão observada entre os sexos feminino e masculino, de 5:1, é maior que a descrita nos estudos populacionais, de cerca de 3:1, principalmente para os carcinomas diferenciados.11 No entanto, a razão encontrada no estudo em tela é bastante consistente com o fato de o câncer de tireoide ser um dos poucos cânceres de dominância feminina.24 Além disso, quando analisada por grupos etários e tipos histológicos, especificamente para o carcinoma diferenciado, essa razão entre os sexos apresentou crescimento durante os anos reprodutivos e declínio após a menopausa,11 achado sugestivo da possibilidade de os hormônios sexuais femininos desempenharem um importante papel na patogênese da doença, qual seja: o potencial dos hormônios endógenos e dos disruptores endócrinos, como os hidrocarbonetos aromáticos polihalogenados, particularmente os éteres difenila polibromados, no desenvolvimento do câncer de tireoide.26
A análise da idade segundo os tipos histológicos apresenta-se em consonância com a literatura, que descreve a média de idade ao diagnóstico entre 45-55 anos para o carcinoma diferenciado, de 50 anos para o medular e, de 60 anos ou mais para o anaplásico.25
O preenchimento inadequado do prontuário por parte dos profissionais de saúde dificulta o registro fidedigno dos dados pelos RHCs, impactando diretamente na qualidade da informação. Neste estudo em particular, a ausência de informações foi pontual para as variáveis ‘escolaridade’ e ‘estadiamento clínico do tumor’. O nível de escolaridade não é um fator de risco consolidado na literatura,2 embora alguns estudos descrevam maior incidência da doença entre pessoas com ensino médio ou superior,30 sugerindo um viés de detecção ocasionado pela maior vigilância médica e acesso às tecnologias diagnósticas.25Já o estadiamento clínico do tumor é imprescindível, e a existência de tantos casos com ausência dessa informação impossibilitou levantamento de suposições e análises mais aprofundadas sobre essa variável.
O primeiro tratamento recebido nas instituições possui estrita relação com o estadiamento, motivo pelo qual tumores diagnosticados em estádios iniciais tendem a ser submetidos à cirurgia. Com exceção do carcinoma anaplásico, mais de 70,0% dos demais tipos histológicos receberam tratamento cirúrgico como parte do protocolo terapêutico. Nos carcinomas diferenciados, a principal abordagem terapêutica consiste em tireoidectomia, seguida de ablação do tecido tireoidiano com iodo radioativo (I131), esta com excelente prognóstico, mesmo quando a ablação não é bem-sucedida.25Assim, as implicações de se tratar um número considerável de neoplasias malignas que não afetariam a saúde, tampouco a sobrevida dos indivíduos, devem ser levadas em consideração: além de conferir pouco benefício, esses tratamentos geram morbidade permanente relacionada à tireoidectomia e à reposição do hormônio tireoidiano. Entretanto, diante da incerteza da evolução do câncer de tireoide, independentemente do perfil clínico-epidemiológico, o tratamento de escolha tem sido a cirurgia imediata, em detrimento da observação vigilante.4
Os intervalos de tempo decorridos entre a primeira consulta, o diagnóstico e o início do tratamento consistem em um aspecto relevante, que aponta prováveis dificuldades de acesso à assistência oncológica. Cabe ressaltar que a Lei nº 12.732, de 22 de novembro de 2012, determina o direito da pessoa de receber o primeiro tratamento pelo SUS em até 60 dias contados a partir do diagnóstico.17 Nesse sentido, para os casos de câncer de tireoide que chegaram à instituição do RHC sem diagnóstico e sem tratamento, foram identificadas divergências no tempo mediano entre a primeira consulta e a confirmação diagnóstica, tanto entre os tipos histológicos como entre as regiões brasileiras. Os carcinomas anaplásicos apresentaram tempo mediano mais baixo, o que também foi observado no Sul do Brasil, ao ser comparado às demais regiões.
Considerando-se ainda os casos que chegaram sem diagnóstico e sem tratamento à instituição do RHC, o tempo entre o diagnóstico e o início do tratamento foi pequeno, sendo bastante similar entre os tipos histológicos e regiões do país. Destaca-se que a maior proporção dos casos recebeu o primeiro tratamento em até 60 dias, a partir do diagnóstico. Em contrapartida, para os casos que chegaram à instituição do RHC com diagnóstico e sem tratamento, o tempo mediano para início do tratamento é mais elevado, superior a 60 dias na maioria dos casos, possivelmente reflexo das dificuldades de acesso daqueles que receberam o diagnóstico em unidades não habilitadas a realizar o tratamento oncológico. Além disso, o fato de os casos anaplásicos receberem o diagnóstico e o tratamento em menor tempo pode estar associado à característica mais letal do tumor.
A distribuição dos casos de acordo com as UFs de residência e do RHC informante evidenciou um fluxo migratório, provavelmente não previsto pelos planos de atenção oncológica dos respectivos estados; é o caso de residentes dos estados do Acre e Goiás, e no Distrito Federal, que foram buscar assistência oncológica em São Paulo. Possivelmente, problemas de acesso aos serviços de saúde ou falhas na rede de atenção oncológica podem contribuir para a migração em busca de atendimento, dificultando o início do tratamento em até 60 dias após o diagnóstico.
Algumas limitações relacionadas às informações dos RHCs podem ser apontadas, entre as quais a ausência de informação para algumas variáveis e um possível sub-registro de casos. Erros na codificação morfológica dos tumores malignos da tireoide poderiam, igualmente, responder pela não inclusão de alguns casos na população de estudo. A carência de publicações com base nas informações dos RHCs dificulta a comparação dos resultados. Não obstante essas limitações, os achados desta investigação são consistentes com a epidemiologia do câncer de tireoide descrita na literatura.25
A análise da situação de morbidade hospitalar do câncer pode viabilizar um planejamento de saúde que facilite o fluxo de atendimento na rede, propiciando o diagnóstico e o tratamento em tempo oportuno, além de reduzir o deslocamento em busca de assistência oncológica. Espera-se que este estudo contribua para a Saúde Pública, no sentido de sensibilizar os gestores de saúde a se aprimorarem das informações geradas a partir dos Registos Hospitalares de Câncer, para subsidiar o processo de construção e avaliação do plano de atenção oncológica, identificar os possíveis obstáculos na rede assistencial e avaliar a qualidade da informação dos prontuários, bem como da assistência prestada no âmbito do SUS.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI

