Introdução
Devido à magnitude de sua morbidade e mortalidade, a leishmaniose visceral (LV) é considerada pela Organização Mundial da Saúde (OMS) umas das cinco doenças negligenciadas prioritárias para eliminação.1 Com incidência anual estimada em 50 mil a 90 mil novos casos, a LV é endêmica em cerca de 83 países ou territórios. Entretanto, no ano de 2018, mais de 95% dos casos novos relatados à OMS ocorreram em apenas dez países: Brasil, China, Etiópia, Índia, Iraque, Quênia, Nepal, Somália, Sudão do Sul e Sudão.1
Nas Américas, a LV continua sendo um desafio para os programas nacionais e regionais de vigilância e controle, dadas sua elevada incidência e ampla distribuição geográfica. Em 2017, foi aprovado o Plano de Ação de Leishmanioses nas Américas, cujo objetivo é reduzir sua morbimortalidade mediante fortalecimento do diagnóstico, tratamento, reabilitação, prevenção, vigilância e controle da infecção até o ano de 2022.2
A doença pode evoluir para formas graves e apresentar elevada letalidade quando não tratada adequadamente. No Brasil, todo caso suspeito e/ou confirmado de LV é notificado às autoridades de saúde, obrigatoriamente: a ficha específica para LV do Sistema de Informação de Agravos de Notificação (Sinan) deve ser completamente preenchida, e a investigação epidemiológica realizada em até 48 horas após a notificação do caso.3
O país reporta 96% dos casos ocorridos nas Américas.2 Entre os anos de 2007 e 2017, a taxa de incidência de LV variou de 1,7 a 2,0 casos por 100 mil hab., e a letalidade passou de 5,9% para 8,8%. Os maiores percentuais de letalidade corresponderam aos anos de 2015 e 2016 (9,0%).4
A LV possui distribuição territorial dos casos autóctones em 25% dos 5.570 municípios brasileiros e está presente em 21 das 27 Unidades da Federação (77,8%).6 Em 2018, os estados do Maranhão (N=653), Pará (N=503), Minas Gerais (N=324) e Ceará (N=308) registraram os maiores números de casos confirmados no país.4
Até a década de 1990, a região Nordeste foi responsável por 90% dos casos notificados no Brasil. No Ceará, a doença é descrita desde os anos 1930, mas apenas em 1986 passou a ser notificada de forma contínua. De janeiro de 2008 a agosto de 2018, foram confirmados 6.347 casos no estado, com média de 578 casos anuais e taxa de incidência média de 6,7 casos por 100 mil hab.; em todo o ano de 2018, foram notificados 12 óbitos pela doença, correspondendo a uma letalidade de 6,4%.5
A LV vem se expandindo em áreas urbanas de médio e grande porte no Brasil, entre elas Fortaleza, desafiando a capital do Ceará a priorizar suas atividades de controle e vigilância da doença.3 A análise da distribuição geográfica tem sido utilizada em estudos epidemiológicos, identificando-se padrões espaciais de morbidade e/ou mortalidade e fatores socioeconômicos e ambientais associados, cujas informações contribuem para a prevenção e o controle da doença.6
O estudo teve como objetivo analisar a tendência temporal e descrever a distribuição espacial das taxas de incidência, mortalidade e letalidade da leishmaniose visceral no município de Fortaleza, estado do Ceará, no período de 2007 a 2017.
Métodos
Realizou-se um estudo transversal descritivo e um estudo ecológico com abordagem exploratória de tendência temporal e espacial dos casos novos confirmados e autóctones de LV no município de Fortaleza, no período de 2007 a 2017.
Fortaleza, capital do estado do Ceará, estende-se sobre uma área total de 314,930km2, conta com 2.452.185 hab. e ocupa o quinto lugar entre as cidades mais populosas do Brasil.7 O município apresenta apenas zona urbana, e sua administração divide-se em seis Secretarias Executivas Regionais, as quais somam 119 bairros.7
Foram utilizados dados secundários, provenientes do Sinan. Para a análise descritiva (distribuição de frequências e mapas temáticos), esses dados foram agrupados em três períodos: 2007-2010, 2011-2013 e 2014-2017. Os dados populacionais foram extraídos do Sistema de Monitoramento Diário de Agravos (SIMDA) da prefeitura local.
As variáveis sociodemográficas estudadas foram: sexo (masculino; feminino); faixa etária (em anos: 0-4; 5-9; 10-19; 20-39; 40-59; 60 ou mais); raça/cor da pele (branca; preta; amarela; parda; indígena); e escolaridade (analfabeto; ensino fundamental I; ensino fundamental II; ensino médio; ensino superior).
Foram estudadas manifestações clínicas da LV registradas nos casos, como febre, fraqueza, emagrecimento, tosse e/ou diarreia, esplenomegalia e hepatomegalia; e presença de coinfecção pelo vírus da imunodeficiência humana, LV-HIV. Também verificou-se a evolução da doença: cura; abandono; óbito por LV; óbito por outras causas; transferência.
As taxas de incidência foram calculadas dividindo-se o número de casos novos pela população sob risco, vezes 100 mil hab. As taxas de mortalidade foram calculadas dividindo-se o número de óbitos pela população sob risco, vezes 100 mil hab. Já o cálculo da letalidade consistiu da divisão do número de óbitos pelo número de casos novos, vezes 100.
A distribuição espacial foi descrita pelo mapeamento temático das taxas de incidência (casos por 100 mil hab., categorizados em intervalos: 0,0; 0,1 a 5,0; 5,1 a 10,0; 10,1 a 15,0; acima de 15) e de mortalidade (casos por 100 mil hab.: 0,0; 0,1 a 1,0; 1,1 a 2,0; 2,1 a 4,0; acima de 4,0) e da letalidade (em percentuais: 0,0; 0,1 a 10,0; 10,1 a 20,0; 20,1 a 50,0; acima de 50,0).
Os indicadores foram calculados de forma estratificada, por bairros, e para a cidade como um todo. Todas as taxas foram padronizadas por faixa etária.
A tendência temporal dos indicadores calculados foi analisada pelo Joinpoint Regression Program (US National Cancer Institute, Bethesda, MD, EUA). Este programa estima a variação percentual anual (annual percent change [APC]) de uma regressão linear segmentada e identifica pontos de inflexão. O APC representa a variação percentual média positiva, se ocorrer um aumento, ou negativa, se ocorrer um decréscimo do indicador ao longo de um determinado período. Foi instituído nível de significância de 95% (p<0,05), distribuição de Poisson8 e número de joinpoints máximo de três. Escolheu-se o modelo de regressão linear segmentada com dois pontos de inflexão, por ser o que melhor explicou o comportamento dos indicadores ao longo do tempo.
As análises foram realizadas com auxílio do programa Stata versão 11.2 (Stata Corp LP, College Station, TX, EUA). Para a construção dos mapas, foi utilizado o programa ArcGIS 9.2.
Resultados
Foram confirmados 1.660 casos novos e 97 óbitos por LV no município de Fortaleza, no período de 2007 a 2017. Observou-se predominância da doença em pessoas do sexo masculino (69,4%), de raça/cor da pele parda (82,1% em 2007-2010, 86,2% em 2011-2013 e 91,8% em 2014-2017), com nível de escolaridade até o ensino fundamental I no primeiro período - 14,7% em 2007-2010 -, e até o ensino fundamental II nos demais períodos - 7,7% em 2011-2013 e 8,7% em 2014-2017. A faixa etária de 0 a 4 anos concentrou a maior proporção de casos novos da doença, 30,8% no período 2007-2010; a partir do ano seguinte, 2011, a frequência foi maior nas idades de 20 a 39 anos - 32,9% em 2011-2013 e 33,2% em 2014-2017 (Tabela 1).
Tabela 1 Características sociodemográficas, clínicas e evolução dos casos de leishmaniose visceral (N=1.660) em Fortaleza, Ceará, 2007-2017
| Características | 2007 a 2010 (N=828) | 2011 a 2013 (N=465) | 2014 a 2017 (N=367) | |||
|---|---|---|---|---|---|---|
| N | (%) | N | (%) | N | (%) | |
| Sexoa | ||||||
| Feminino | 284 | 34,3 | 133 | 28,6 | 90 | 24,5 |
| Masculino | 543 | 65,6 | 332 | 71,4 | 277 | 75,5 |
| Faixa etária (em anos)a | ||||||
| 0-4 | 255 | 30,8 | 87 | 18,7 | 48 | 13,1 |
| 5-9 | 41 | 4,9 | 24 | 5,2 | 14 | 3,8 |
| 10-19 | 85 | 10,3 | 41 | 8,8 | 27 | 7,4 |
| 20-39 | 212 | 25,6 | 153 | 32,9 | 122 | 33,2 |
| 40-59 | 181 | 21,9 | 115 | 24,7 | 119 | 32,4 |
| ≥60 | 53 | 6,4 | 45 | 9,7 | 36 | 9,8 |
| Raça/cor da pele | ||||||
| Branca | 50 | 6,0 | 13 | 2,8 | 12 | 3,3 |
| Preta | 5 | 0,6 | 4 | 0,9 | 2 | 0,5 |
| Amarela | 3 | 0,4 | 4 | 0,9 | 0 | 0,0 |
| Parda | 680 | 82,1 | 401 | 86,2 | 337 | 91,8 |
| Indígena | 2 | 0,2 | 0 | |||
| Ignorada | 88 | 10,6 | 43 | 9,2 | 16 | 4,4 |
| Escolaridadea | ||||||
| Analfabeto | 6 | 0,7 | 4 | 0,9 | 5 | 1,4 |
| Ensino fundamental I | 122 | 14,7 | 28 | 6,0 | 17 | 4,6 |
| Ensino fundamental II | 70 | 8,5 | 36 | 7,7 | 32 | 8,7 |
| Ensino médio | 112 | 13,5 | 28 | 6,0 | 30 | 8,2 |
| Superior | 15 | 1,8 | 7 | 1,5 | 2 | 0,5 |
| Manifestação clínica | ||||||
| Febre | 796 | 96,1 | 434 | 93,3 | 340 | 92,6 |
| Fraqueza | 603 | 72,8 | 324 | 69,7 | 222 | 60,5 |
| Emagrecimento | 602 | 72,7 | 333 | 71,6 | 249 | 67,9 |
| Tosse e/ou diarreia | 404 | 48,8 | 225 | 48,4 | 161 | 43,9 |
| Esplenomegalia | 658 | 79,5 | 338 | 72,7 | 226 | 61,6 |
| Hepatomegalia | 610 | 73,7 | 305 | 65,6 | 203 | 55,3 |
| Coinfecção LV-HIVb | ||||||
| Sim | 70 | 8,5 | 61 | 13,1 | 83 | 22,6 |
| Não | 622 | 75,1 | 304 | 65,4 | 225 | 61,3 |
| Ignorado | 136 | 16,4 | 100 | 21,5 | 59 | 16,1 |
| Evolução | ||||||
| Cura | 683 | 82,5 | 366 | 78,7 | 287 | 78,2 |
| Abandono | 8 | 1,0 | 6 | 1,3 | 3 | 0,8 |
| Óbito por leishmaniose visceral | 33 | 4,0 | 26 | 5,6 | 38 | 10,3 |
| Óbito por outras causas | 19 | 2,3 | 25 | 5,4 | 8 | 2,2 |
| Transferência | 12 | 1,4 | 11 | 2,3 | 16 | 4,4 |
| Ignorada/em branco | 73 | 8,8 | 31 | 6,7 | 15 | 4,1 |
aA diferença de número de observações deve-se aos registros ignorados e em branco excluídos.
bCoinfecção LV-HIV: coinfecção por leishmaniose visceral e pelo vírus da imunodeficiência humana (human immunodeficiency virus [HIV]).
A manifestação clínica mais observada foi febre, com 96,1% em 2007-2010, 93,3% em 2011-2013 e 92,6% em 2014-2017, seguida de esplenomegalia, com 79,5% em 2007-2010, 72,7% em 2011-2013 e 61,6% em 2014-2017; a exceção coube ao terceiro período, quando teve maior destaque o emagrecimento: 67,9%. A coinfecção LV-HIV foi proporcionalmente mais ausente, do que presente: não foi encontrada em 75,1% dos casos no período 2007-2010, 65,4% em 2011-2013 e 61,3% em 2014-2017. A evolução dos casos com alta por cura foi a mais frequente em todos os períodos: 82,5% em 2007-2010, 78,7% em 2011-2013 e 78,2% em 2014-2017. Entretanto, a letalidade cresceu ao longo dos três períodos, de 4,0% em 2007-2010 a 5,6% em 2011-2013 e, finalmente, 10,3% no período 2014-2017 (Tabela 1).
No primeiro período, de 2007 a 2010, 17 bairros apresentaram incidência acima de 15 casos por 100 mil hab., localizados principalmente na região oeste de Fortaleza. Destacou-se, também, um grupo de bairros localizados no sudeste da cidade, com incidência entre 10,1 e 15 casos por 100 mil hab.; nesta segunda região, ao todo, 17 bairros encontraram-se nessa faixa de incidência. No mesmo período, a taxa de mortalidade mostrou-se dispersa em toda Fortaleza; à exceção de sua região nordeste, fato semelhante ao que ocorreu com a letalidade, cujo destaque coube a um bairro no sudeste do município, com 100% de letalidade (1 óbito) (Figura 1).
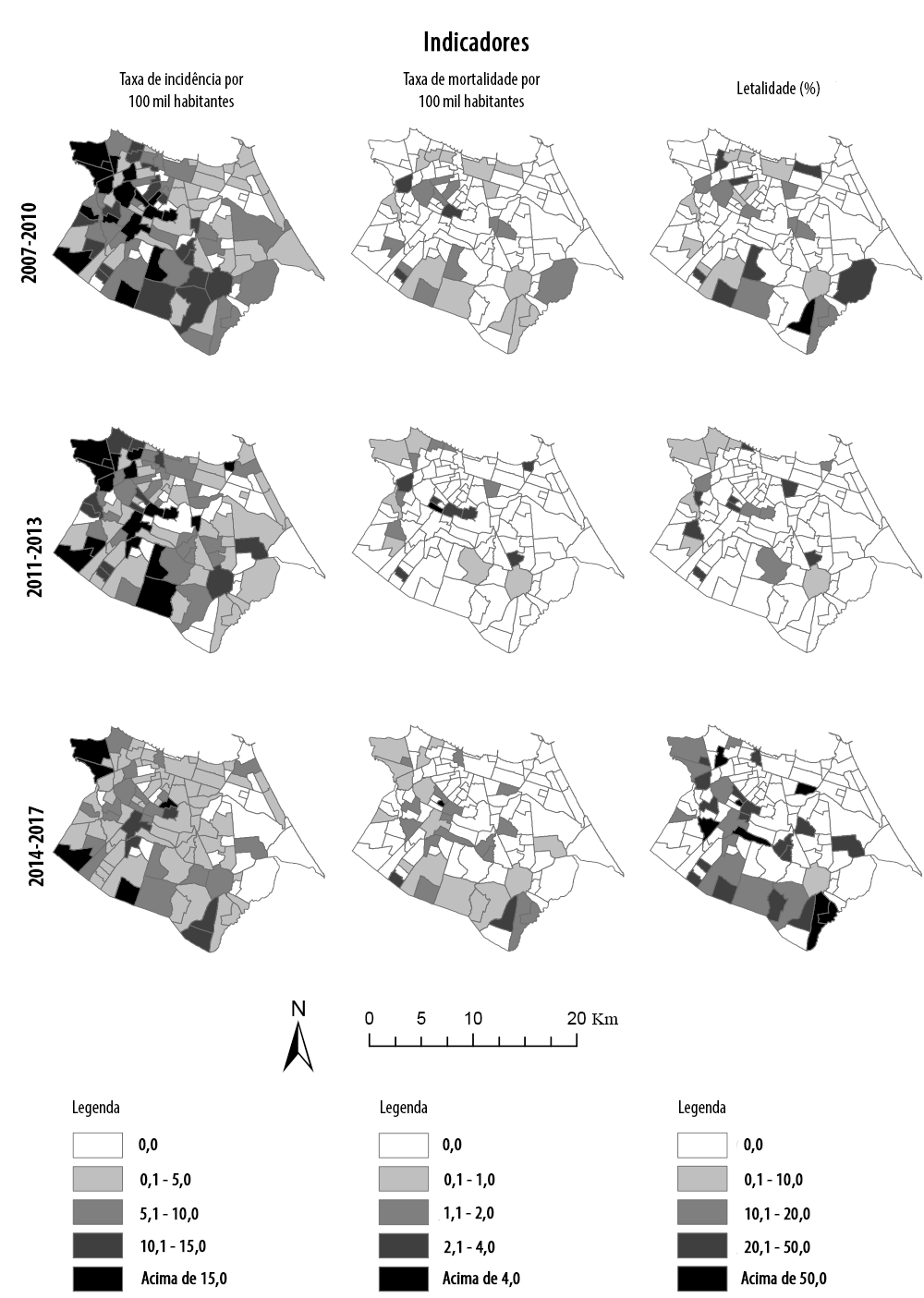
Figura 1 Taxas de incidência, mortalidade e letalidade por leishmaniose visceral nos bairros de Fortaleza, Ceará, 2007-2010, 2011-2013 e 2014-2017
No período de 2011 a 2013, 17 bairros apresentaram incidência acima de 15 casos por 100 mil hab., localizados principalmente na região oeste de Fortaleza; 10 desses bairros já apresentavam incidência alta no período 2007-2010. As taxas de mortalidade e a letalidade apresentaram-se dispersas em toda Fortaleza, entre 2011 e 2013, embora se tenha observado um grupo de bairros com taxas mais elevadas na área central da cidade, destacando-se um deles com mortalidade acima de 5 óbitos por 100 mil hab.
Entre os anos de 2014 e 2017, apenas cinco bairros, localizados principalmente no sudoeste da cidade, apresentaram incidência acima de 15 casos por 100 mil hab. É importante enfatizar que dois desses bairros não apresentaram casos nos dois períodos anteriores. Um grupo de bairros localizados nas regiões norte e centro-sul de Fortaleza apresentaram incidência variando de 0,1 a 5,0 casos por 100 mil hab. No mesmo período, as taxas de mortalidade e letalidade se concentraram nas regiões oeste e sul da cidade, com destaque para dois bairros com letalidade de 100% (1 óbito em cada bairro) (Figura 1).
A análise de tendência temporal segmentada encontrou dois pontos de inflexão nos indicadores avaliados. O primeiro, no ano de 2010, e o segundo, no ano de 2015, sendo identificados três segmentos ao longo de 2007-2017: o primeiro, entre os anos de 2007 e 2010; o segundo, entre 2010 e 2015; e o terceiro segmento, entre 2015 e 2017.
De 2007 a 2010, a taxa de incidência de LV apresentou um aumento de 3,5 para 4,8 casos por 100 mil hab. De 2011 até 2013, houve um declínio acentuado, de 4,4 para 2,2 casos por 100 mil hab., seguido de uma diminuição mais suave dessa taxa, entre 2014 e 2017, de 2,3 para 1,1 caso por 100 mil hab. A análise por pontos de inflexão, no período de 2007 a 2010, encontrou um comportamento crescente, porém sem significância estatística (APC=8,7 - IC95% -3,3;34,1). A partir de 2010, esse indicador apresentou uma tendência decrescente até o ano de 2015 (APC=-15,8 - IC95% -25,1;-4,0). Esta variação anual decresceu ainda mais nos três últimos anos, de 2015 a 2017, quando foi observada redução estatisticamente significativa na incidência de LV (APC=-24,6 - IC95% -36,2;-10,3) (Tabela 2).
Tabela 2 Análise de tendência temporala das taxas de leishmaniose visceral (padronizadas por 100 mil hab.) (N=1.660) em Fortaleza, Ceará, 2007-2017
| Variáveis | 2007 a 2010 | 2010 a 2015 | 2015 a 2017 | |||
|---|---|---|---|---|---|---|
| APCb | IC95%c | APCb | IC95%c | APCb | IC95%c | |
| Taxa de incidência (por 100 mil hab.) | 8,7 | -3,3;34,1 | -15,8 | -25,1;-4,0 | -24,6 | -36,2;-10,3 |
| Taxa de mortalidade (por 100 mil hab.) | -25,9 | -48,5;-10,6 | 18,7 | 9,4;50,6 | -44,6 | -58,8;-17,6 |
| Letalidade (%) | -33,0 | -53,7;-17,6 | 40,1 | 22,5;72,0 | -13,5 | -38,7;3,8 |
aRegressão linear segmentada.
bAPC: variação percentual média (Average Percentual Change).
cIC95%: intervalo de confiança de 95%.
De 2007 a 2010, a taxa de mortalidade por LV teve um declínio de 0,2 para 0,1 óbito por 100 mil hab. A partir de 2011 até 2013, observou-se oscilação. Em 2014 e 2015, a taxa voltou a subir para 0,2 e 0,3 óbito por 100 mil hab., respectivamente. Em 2016, observou-se uma diminuição brusca da taxa, para 0,1 óbito por 100 mil hab., e sua manutenção, com o mesmo valor, em 2017. As taxas de mortalidade declinaram no primeiro período, de 2007 a 2010 (-25,9% - IC95% -48,5;-10,6), e no terceiro período, de 2015 a 2017 (-44,6% - IC95% -58,8;-17,6). Entretanto, no período de 2010 a 2015, observou-se aumento na mortalidade por LV (APC=18,7% - IC95% 9,4;50,6) (Tabela 2).
De 2007 a 2010, a letalidade por LV apresentou um declínio de 6,3% para 1,8%. A partir de 2011, até 2015, observou-se aumento acentuado, de 4,2% para 8,5%, seguida de um aumento entre 2016 e 2017, de 4,9% para 6,7%. A tendência temporal da letalidade apresentou significância estatística somente no primeiro e no segundo períodos. De 2007 a 2010, houve decréscimo de -33,0% (IC95% -53,7;-17,6); em seguida, no intervalo de 2010 a 2015, esse indicador mostrou tendência ascendente de 40,1% (IC95% 22,5;72,0). A partir de 2015, a letalidade por LV mostrou estabilidade (APC=-13,5 - IC95%: -38,7;3,8) (Tabela 2).
Discussão
Os indicadores da LV permaneceram elevados, apesar da redução nas taxas de incidência e de mortalidade, e na letalidade, com comportamento cíclico. Além disso, a doença se espalhou para um maior número de bairros de Fortaleza. Pessoas na faixa etária dos 20 aos 59 anos passaram a ser as mais acometidas, o que implica impacto negativo para a economia do município.
As taxas de incidência mais elevadas se concentraram na região oeste de Fortaleza e as menores se limitaram aos bairros da região leste da cidade, permanecendo um quadro semelhante ao encontrado no período de 2001 a 2007, possivelmente justificado pela infraestrutura dos bairros. Fortaleza é dividida socioeconomicamente: os bairros de sua área oeste, caracterizados como “periféricos”, encontram-se em piores condições estruturais, tanto de moradia como de saneamento, condições estas que estão relacionadas à ocorrência de LV, enquanto os bairros da área leste, estes mais desenvolvidos economicamente, apresentam as melhores condições de moradia e infraestrutura urbana.3 9
Um padrão cíclico e com certa estabilidade das taxas de incidência da LV também foi observado em estudo realizado entre 1999 e 2015, na cidade de Araçatuba, SP, onde seus autores sugerem que a redução dos casos ocorreu, possivelmente, como resultado das ações de controle implementadas.10 Em outros estudos, realizados na cidade de Aracaju, SE, entre 1999 e 2008, e no estado do Piauí, entre 2007 e 2011, encontrou-se o mesmo padrão cíclico: aproximadamente a cada cinco anos, um pico no número de casos e na taxa de incidência de LV, que pode ser explicado pelo longo curso característico da doença, com o aparecimento dos sinais da infecção mais tardiamente.11-13
Apesar de se identificarem taxas de incidência variáveis nos três períodos estudados, a maioria dos bairros de Fortaleza apresentaram valores abaixo de 5 casos por 100 mil hab.; houve, outrossim, uma redução do número de bairros com taxas de incidência acima de 15 casos por 100 mil hab. Este comportamento decrescente foi observado no estado de Alagoas, em 2013, quando a incidência de LV em humanos neste ano foi a menor dentro do período de estudo de 2007 a 201314.
Achados semelhantes foram encontrados por estudo realizado em Sergipe, nos anos de 2010 a 2015, quando se identificou uma dispersão difusa dos casos de LV. Apesar de ter havido uma redução da incidência em 2012, possível consequência das ações de vigilância do estado, alguns municípios sergipanos permaneceram notificando casos novos, o que configura áreas de persistência e de transmissão ativa da doença.15
A expansão da leishmaniose em Fortaleza pode estar diretamente relacionada com a urbanização da doença e do vetor, mudanças socioambientais e migração de populações humanas e caninas, oriundas de áreas endêmicas, introduzindo o parasito em novos ambientes.12 16
Verificou-se que quase 70% dos casos de LV foram de pessoas do sexo masculino. Este fato também foi verificado em outros estudos, com percentuais entre 60 e 75%, apontando para uma maior susceptibilidade deste sexo à doença.13 17-20 Fatores hormonais e ligados à exposição ao vetor têm sido responsabilizados pelo aumento do risco dessa infecção no sexo masculino.11
A raça/cor da pele parda foi a mais acometida, diferentemente do que apresenta o relato de um estudo sobre o município de Bauru, SP, onde 49,3% dos casos de LV notificados foram da raça/cor da pele branca.21 Essa diferença ocorreu, provavelmente, pelas características raciais distintas entre as populações dos dois municípios.
Em Fortaleza a doença afetou, mais frequentemente, indivíduos de baixa escolaridade. Situação semelhante foi detectada em Pernambuco, entre 2003 e 2015, quando 12,9% dos casos do estado tinham nível de educação fundamental incompleto.22 A escolaridade é uma variável proxy na medida em que pode sugerir que baixas condições socioeconômicas e vulnerabilidades são mais frequentes nos indivíduos acometidos pela enfermidade. Não obstante, o baixo preenchimento dessa variável na ficha de investigação dificulta sua interpretação.
O acometimento mais expressivo em pessoas na faixa etária de 0 a 4 anos também foi observado em estudo realizado no período 2002-2009, no hospital de referência em doenças infecciosas do Ceará: em 196 prontuários de crianças de 0 a 12 anos, 33,2% dos casos corresponderam a menores de 2 anos, e 29,0% à idade de 2 a 4 anos.23 A maior suscetibilidade das crianças pode ser explicada pela baixa imunidade, maior exposição ao vetor no peridomicílio e estado nutricional deficiente, eventos comuns em regiões endêmicas.22
Se para o primeiro período avaliado, 2007-2010, a condição infantil apresentou maior vulnerabilidade e número de casos, nos períodos seguintes, 2011-2013 e 2014-2017, a faixa etária de 20 a 39 anos passou a ser a mais acometida pela doença, provavelmente devido ao aumento do número de casos de coinfecção LV-HIV na idade adulta, quando o indivíduo é mais susceptível à depressão de seu sistema imunológico. Esta característica foi relatada em mais um estudo epidemiológico realizado no Ceará, entre 2007 e 2011. Até 2006, a população de crianças doentes no estado foi maior que a de adultos; desde esse ano, entretanto, houve uma equiparação na ocorrência de LV entre ambos os contingentes de idade e, a partir de 2008, um aumento dos casos em adultos.24
As manifestações clínicas mais frequentes nos casos confirmados de LV em Fortaleza foram febre e esplenomegalia, sintomatologia também observada em Aracaju, SE, de 1999 a 2008.11 Esse padrão também foi observado no estudo das características clínico-epidemiológicas dos casos de LV realizado na cidade de Campo Grande, MS,18 e no estado de Pernambuco.25 Em zona endêmica, todo quadro clínico que se apresente com hepatoesplenomegalia febril deve ser investigado como quadro suspeito da doença. Achados com linfadenomegalia, comuns na Índia e no Sudão, não foram descritos nos casos estudados aqui, assim como em outras pesquisas no Brasil.2
A coinfecção LV-HIV foi baixa em Fortaleza, levando a considerar a possibilidade de a leishmaniose ter se comportado como uma doença oportunista do estado de imunodepressão desses pacientes.26 Essa coinfecção, considerada um grave problema de Saúde Pública, requer caracterização, identificação e resolução das dificuldades envolvidas na contenção da progressão de ambas as doenças.27
O aumento proporcional da presença de coinfecção LV-HIV observado ao longo dos três períodos também foi relatado em 2017, por Reis et al.: ao compararem as incidências de coinfecção entre 2001-2006 e 2007-2014, seus autores observaram maior ocorrência de óbitos entre os homens, provavelmente porque eles apresentam maior proporção de abandono do tratamento.28
As taxas de mortalidade e a letalidade também se mostraram dispersas, mesmo quando mais de 70% dos bairros não registraram óbitos. É importante destacar que a letalidade entre 20,1 e 50,0 por 100 hab. cresceu de 5,0% (2007-2010) para 12,6% dos bairros de Fortaleza (2014-2017).
No Brasil, de 2000 a 2011, tanto as taxas de mortalidade como a de letalidade por LV apresentaram tendências crescentes e estatisticamente significativas, ainda que tivessem apresentado declínio em algumas regiões. Destacaram-se as regiões Norte e Sudeste do Brasil, onde se registrou elevação da mortalidade, e a região Nordeste, cujo aumento dos casos fatais foi significativo ao longo de todo o período.27
Achado semelhante ao do presente trabalho foi identificado na cidade de Belo Horizonte, MG, no período de 1994 a 2007: a taxa de mortalidade local apresentou tendência anual crescente, embora a de letalidade se mostrasse estacionária, enquanto Fortaleza, conforme observado, apresentou uma tendência crescente na taxa de letalidade.29
Entre os principais fatores que contribuem para o aumento da letalidade estão o diagnóstico tardio e a expansão da epidemia, acometendo grupos de indivíduos com comorbidades. As complicações infecciosas e as hemorragias são reconhecidas como os principais fatores de risco para a mortalidade por LV11. Ademais, são escassas as pesquisas sobre a eficácia das drogas de escolha utilizadas atualmente, no tratamento da doença, e maiores esforços são necessários para melhorar o atendimento a pacientes de sua forma crítica e, assim, evitar óbitos.2
O presente estudo apresenta limitações relacionadas ao uso de dados secundários provenientes do Sinan, como alguns campos com preenchimento inadequado, além de informações ausentes ou incompletas. Contudo, essas faltas não comprometeram as informações, dado o grande volume de notificações em Fortaleza.
Conclui-se que houve redução da incidência da leishmaniose visceral no decorrer dos três períodos estudados, apesar de a doença manter comportamento endêmico e disperso em toda Fortaleza. As maiores incidências foram verificadas em bairros da região oeste da cidade. Sobre as taxas de mortalidade e a letalidade, mostraram-se crescentes, com distribuição dispersa nas diversas regiões urbanas. Os dados denotam o caráter endêmico da leishmaniose visceral no município, apontando para a necessidade de ações que permitam a redução da ocorrência da doença na população, principalmente naquela residente em áreas de maior risco.











 texto en
texto en 


