Introdução
Vacinas estão entre as medidas de Saúde Pública mais efetivas para prevenção, eliminação e controle de doenças transmissíveis.1 Os programas organizados de imunização são, reconhecidamente, um dos investimentos de maior custo-efetividade em saúde.2 No Brasil, o Programa Nacional de Imunizações (PNI), criado em 1973, de acesso universal e contínuo, oferece amplo leque de vacinas, disponibilizadas nos serviços públicos de saúde de todo o território nacional, sem ônus para os usuários. Ademais, a cada ano, o PNI promove várias campanhas de vacinação em massa.3 A oferta universal de vacinas na rede pública e seu acesso facilitado à população, dada a extensa rede nacional de serviços básicos de saúde, juntamente com outras ações de vigilância, têm sido fundamentais para a eliminação e controle de doenças como varíola, difteria, poliomielite e sarampo, historicamente responsáveis por um grande número de vítimas no Brasil.4
Atualmente, o PNI oferece 44 tipos de imunobiológicos, incluindo vacinas, soros e imunoglobulinas.3,4 No entanto, o aumento na complexidade de itens do calendário vacinal, nas últimas décadas, e a introdução de diversas vacinas em um curto período, trouxeram novos desafios para programa, entre eles o de atingir e manter altas coberturas vacinais na população.5 Apenas para o primeiro ano de vida, por exemplo, o calendário atual de vacinação prevê a realização de oito contatos entre a família e os serviços de saúde, para que a criança receba um total de 18 doses de vacinas. Não obstante, pesquisas realizadas em locais específicos do país sinalizaram uma possível redução na cobertura vacinal, no período de 1993 a 2015.6
O objetivo deste estudo foi avaliar a cobertura vacinal, conforme o calendário do PNI, entre crianças beneficiárias do Programa Bolsa Família, de acordo com o nível socioeconômico da família e características maternas.
Métodos
Trata-se da primeira e segunda etapas do estudo longitudinal ‘Avaliação de Impacto do Programa Criança Feliz (PCF)’, oferecido pelo Ministério da Cidadania (MCid) a menores de 3 anos de idade7, com o objetivo de promover o desenvolvimento infantil por meio do fortalecimento dos vínculos familiares, prevenção de situações de negligência e violência contra a criança e redução da desnutrição.
A população-alvo do PCF constitui-se de crianças beneficiárias do Bolsa Família,8 cuja participação no programa é condicionada ao cumprimento, pela família, de algumas exigências: matricular e manter as crianças e adolescentes de 6 a 17 anos na escola; e levar os menores de 7 anos a unidades de saúde, para imunização e monitoração do crescimento e desenvolvimento, conforme calendário recomendado pelas equipes de saúde.
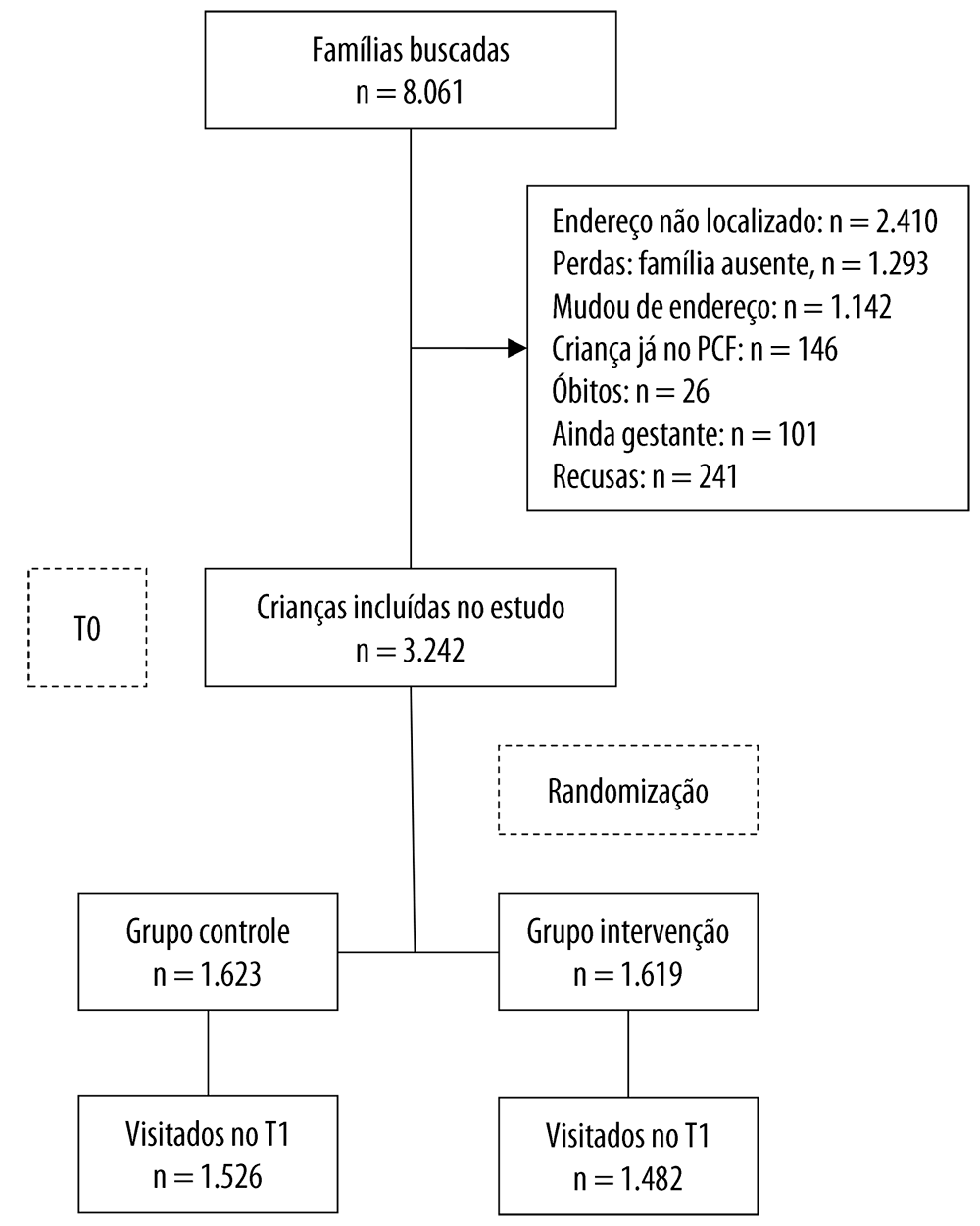
Desde 2018, está sendo realizado o trabalho ‘Avaliação de Impacto do Programa Criança Feliz’, um estudo randomizado, cujo objetivo é estimar o efeito do programa na estimulação intelectual do ambiente doméstico e no neurodesenvolvimento das crianças atendidas pelo Bolsa Família, antes de completarem o primeiro ano de vida.9 Para compor o estudo, foram escolhidas seis Unidades da Federação (UFs), com grande clientela do Bolsa Família. Em cada UF, foram selecionados três a seis municípios com sobredemanda (no mínimo 4:1) de menores de 1 ano de idade elegíveis para o PCF; e que contassem com uma capacidade instalada para incluir e visitar semanalmente ≥80 crianças. Ao todo, foram selecionados 30 municípios dos estados da Bahia, Ceará, Goiás, Pará, Pernambuco e São Paulo (média de 109 crianças por município). Mais informações sobre a metodologia adotada no estudo estão disponíveis em: https://aplicacoes.mds.gov.br/sagirmps/ferramentas/docs/Caderno%20de%20Estudos-35-online.pdf; e http://www.epidemio-ufpel.org.br/uploads/downloads/avaliacao-do-impacto-do-programa-crianca-feliz.pdf.
O MCid fornecia à equipe estadual uma lista de crianças e gestantes elegíveis para o PCF. Chegando a cada município, a equipe de avaliação reunia-se com o responsável pelo PCF no Centro de Referência de Assistência Social (CRAS), para delimitar os bairros onde o programa de avaliação seria disponibilizado. Na maioria dos municípios, o PCF não é oferecido em áreas rurais, áreas urbanas remotas ou onde há problemas de segurança. De posse da lista fornecida pelo MCid à equipe estadual do PCF, os pesquisadores visitavam cada domicílio para determinar se a família aceitaria participar do programa e da pesquisa. A inclusão de gestantes deveu-se à possibilidade de essas mulheres haverem dado à luz após a última atualização da listagem, que, normalmente, correspondia a alguns meses antes do trabalho de coleta de dados (Material Suplementar 4).
No atual estudo, foram analisadas as 3.242 crianças avaliadas no primeiro acompanhamento (linha de base - T0), ocorrido entre agosto de 2018 e julho de 2019, quando estavam com menos de 12 meses de vida; e as 3.008 crianças (93% do grupo original) localizadas e avaliadas no segundo acompanhamento (T1), ocorrido 9-13 meses após o início do T0 (mediana=12 meses), conforme a UF.
Os questionários utilizados na coleta de dados, em ambas as etapas, foram testados previamente, em estudo-piloto realizado na cidade de Pelotas, RS, e estão disponíveis no sítio eletrônico do Programa de Pós-Graduação em Epidemiologia da Universidade Federal de Pelotas.10
Nas duas avaliações - T0 e T1 -, o questionário geral, aplicado por entrevistadores treinados, continha perguntas já testadas e padronizadas, extraídas do Multiple Indicator Cluster Survey (MICS),11 dos instrumentos utilizados nas Coortes de Nascimento de Pelotas de 2004 e 201512,13 e dos manuais de treinamento do PCF.14 Os entrevistadores foram selecionados após participar de curso de treinamento, com duração de 40 horas, realizado em Brasília, DF. As respostas às perguntas eram registradas em tablets, sobre plataforma REDCap.15
Em ambas as visitas, era solicitado à mãe que mostrasse a Caderneta de Saúde da Criança ou qualquer outro registro de vacinação. Também com o auxílio do tablet, o entrevistador fotografava e gravava a imagem da Caderneta; em seguida, registrava as doses de vacinas já recebidas pela criança. Para cada vacina, havia cinco opções de preenchimento da resposta, de múltipla escolha: ‘1ª dose’; ‘2ª dose’; ‘3ª dose’; ‘não fez’; e ‘reforços’. Caso a criança tivesse recebido a primeira e a segunda doses de uma vacina, eram marcadas as opções ‘1ª dose’ e ‘2ª dose’.
Para as análises, o desfecho ‘vacinação adequada’ foi operacionalizado conforme o calendário vacinal recomendado pelo PNI16 e esquematizado na Figura 1. As crianças que tivessem recebido todas as vacinas recomendadas para sua idade (observada uma tolerância de até 15 dias de atraso para cada imunobiológico) eram consideradas com vacinação ‘adequada’. Por exemplo, uma criança com 6 meses e 7 dias de vida era classificada como ‘em dia’ com o calendário se tivesse recebido todas as vacinas previstas para os 5 meses de vida, mesmo que alguma dose anterior tivesse sido administrada com algum atraso. Vacinas que não compõem o esquema básico de vacinação do PNI16 (como a da influenza), bem como aquelas não oferecidas na rotina dos serviços em todas as UFs (e.g., febre amarela),17 não entraram na construção da variável de desfecho.
Figura 1 Esquema vacinal adotado para a construção da variável ‘vacinação adequada’ conforme calendário vacinal, extraído e adaptado do Calendário de Vacinação da Caderneta de Saúde da Criança
| Grupo de idade | Idade recomendada (meses) | Vacinas recomendadas |
|---|---|---|
| 1 | 0 ≤ idade < 2 | BCGa |
| Hepatite B (pelo menos 1 dose) | ||
| 2 | 2 ≤ idade < 3 | Vacinas do grupo de idade 1 |
| Pentavalente | ||
| VIPb | ||
| Pneumocócica 10-valente | ||
| Rotavírus humano | ||
| 3 | 3 ≤ idade <4 | Vacinas do grupo de idade 1 |
| Vacinas do grupo de idade 2 | ||
| Meningocócica C (pelo menos 1 dose) | ||
| 4 | 4 ≤ idade < 5 | Vacinas do grupo de idade 1 |
| Pentavalente (pelo menos 2 doses) | ||
| VIPb (pelo menos 2 doses) | ||
| Pneumocócica 10-valente (pelo menos 2 doses) | ||
| Rotavírus humano (pelo menos 2 doses) | ||
| Meningocócica C (pelo menos 1 dose) | ||
| 5 | 5 ≤ idade < 6 | Vacinas do grupo de idade 1 |
| Pentavalente (pelo menos 2 doses) | ||
| VIPb (pelo menos 2 doses) | ||
| Pneumocócica 10-valente (pelo menos 2 doses) | ||
| Rotavírus humano (pelo menos 2 doses) | ||
| Meningocócica C (pelo menos 2 doses) | ||
| 6 | 6 ≤ idade < 9 | Vacinas do grupo de idade 1 |
| Pentavalente (pelo menos 3 doses) | ||
| VIPb (pelo menos 3 doses) | ||
| Pneumocócica 10-valente (pelo menos 2 doses) | ||
| Rotavírus humano (pelo menos 2 doses) | ||
| Meningocócica C (pelo menos 2 doses) | ||
| 7 | 9 ≤ idade < 12 | Vacinas do grupo de idade 1 |
| Vacinas do grupo de idade 6 | ||
| 8 | 12 ≤ idade < 15 | Vacinas do grupo de idade 1 |
| Pentavalente (pelo menos 3 doses) | ||
| VIPb (pelo menos 3 doses) | ||
| Pneumocócica 10-valente (pelo menos 3 doses) | ||
| Rotavírus humano (pelo menos 2 doses) | ||
| Meningocócica C (pelo menos 3 doses) | ||
| Tríplice viral (pelo menos 1 dose) | ||
| 9 | 15 ≤ idade < 48 | Vacinas do grupo de idade 1 |
| Vacinas do grupo de idade 8 | ||
| DTPc reforço (pelo menos 1 dose) | ||
| VOPd reforço (pelo menos 1 dose) | ||
| Hepatite A | ||
| Tetraviral |
a) BCG: bacilo de Calmette-Guérin; b) VIP: poliomielite 1,2,3; c) DTP: vacina adsorvida difteria, tétano e pertussis; d) VOP: poliomielite 1 e 3.
As variáveis independentes utilizadas foram coletadas na entrevista do T0:
Nível socioeconômico da família (dividido em quintis, e construído a partir da informação sobre características do domicílio e bens de consumo, mediante análise de componentes principais);
Idade materna (anos: <20; 20-29; 30-39; ≥40);
Escolaridade materna (anos de estudo: 0-4; 5-8; ≥9);
Raça/cor da pele autodeclarada da mãe (branca; parda [reuniu as categorias morena/parda, amarela/asiática e indígena]; e preta);
Vive com marido/companheiro (sim; não).
Como a cobertura vacinal no T1 foi diferente no grupo PCF e no grupo de controle (p=0,032), utilizou-se o status ‘intervenção’ ou o status ‘controle’ das crianças como potencial confundidor da associação entre as exposições e os desfechos.
A alocação aleatória dos participantes para o grupo de controle ou para o grupo de intervenção e a semelhança entre os grupos no T0 e em relação às perdas podem ter prevenido viés de seleção. O viés de informação foi minimizado com a padronização da coleta de dados: as equipes das seis UFs foram treinadas na mesma ocasião, e a informação sobre as vacinas, obtida diretamente da Carteira de Saúde da Criança.
O tamanho da amostra necessário para este estudo de avaliação do impacto do PCF foi calculado com base nos seguintes parâmetros: erro alfa bicaudal de 5%; erro beta de 10%; adesão ao programa de 60% (continuidade de participação no PCF durante três anos); e um acréscimo de 20% para perdas de acompanhamento. Dessa forma, seria necessário consultar os dados de 2.880 crianças do país.
As análises estatísticas foram realizadas com uso do programa Stata versão 16.0 (StataCorp LLC, College Station, TX, Estados Unidos). A proporção de crianças com Caderneta de Saúde ou outro registro de vacinação foi a primeira variável a ser calculada. Posteriormente, estimou-se a proporção de crianças com vacinação adequada no T0 e T1, para toda a amostra, com os respectivos intervalos de confiança de 95% (IC95%). Logo, foram calculadas as proporções de crianças com vacinação adequada, conforme as características da família e maternas. Em seguida, foram calculadas as proporções por UF e município. Nos dois acompanhamentos (T0 e T1), foram utilizados modelos multiníveis (nível 3, UF; nível 2, município; nível 1, crianças). As associações foram avaliadas pelo teste de Wald, sendo os valores p<0,05 considerados estatisticamente significantes.
O projeto do estudo foi submetido ao Comitê de Ética em Pesquisa da Faculdade de Medicina da Universidade Federal de Pelotas (CEP/FAMED/UFPel), afiliado à Comissão Nacional de Ética em Pesquisa (Conep)/Conselho Nacional de Saúde (CNS), e aprovado no Parecer CNS nº 2.148.689, emitido em 13 de maio de 2017. O projeto está disponível para consulta no sítio eletrônico do Registro Brasileiro de Ensaios Clínicos (ReBEC), sob o identificador RBR-4x7dny. O Termo de Consentimento Livre e Esclarecido foi assinado pelas mães ou responsáveis, como condição para participar do estudo.
Resultados
As listagens fornecidas pelo MCid para os 30 municípios apresentavam 8.601 famílias com gestantes ou crianças potencialmente elegíveis para inclusão no PCF. Das 8.601 famílias listadas, mais da metade não foi incluída no estudo porque o endereço não foi localizado pelos pesquisadores (28%), a família havia se mudado definitivamente (15%) ou estava temporariamente ausente do domicílio (13,3%) (Material Suplementar 4). Ao todo, 3.242 (37,7%) das famílias listadas pelo MCid foram efetivamente contempladas na pesquisa.
Entre as 3.242 crianças avaliadas no T0, a mediana de idade foi de 7,6 meses; para as 3.008 reavaliadas no T1, a mediana de idade foi de 18,9 meses. Na Tabela 1, observa-se a distribuição da amostra de acordo com as características na linha de base (T0). A maior proporção de mães encontrava-se entre 20-29 anos de idade (51,5%), tinham ≥9 anos de escolaridade (60,0%), 75,4% autodeclararam-se de raça/cor da pele parda e mais de 60% informaram viver com marido ou companheiro.
Tabela 1 Características familiares e maternas na linha de base (T0) do estudo Avaliação do Impacto do Programa Criança Feliz (n=3.242 crianças <12 meses de vida), Brasil, agosto/2018-abril/2019
| Características familiares e maternas | N | % |
|---|---|---|
| Nível socioeconômico da família (quintis) (n=3.239) | ||
| 1º (mais pobre) | 648 | 20,0 |
| 2º | 648 | 20,0 |
| 3º | 648 | 20,0 |
| 4º | 650 | 20,1 |
| 5º (mais rico) | 645 | 19,9 |
| Idade materna (anos) (n=3.199) | ||
| <20 | 464 | 14,5 |
| 20-29 | 1.649 | 51,5 |
| 30-39 | 975 | 30,5 |
| ≥40 | 111 | 3,5 |
| Escolaridade materna (anos) (n=3.004) | ||
| 0-4 | 278 | 9,3 |
| 5-8 | 924 | 30,7 |
| ≥9 | 1.802 | 60,0 |
| Raça/cor da pele da mãe (n=3.186) | ||
| Branca | 463 | 14,5 |
| Parda | 2.402 | 75,4 |
| Preta | 321 | 10,1 |
| Mãe vive com marido ou companheiro (n=3.241) | ||
| Não | 1.198 | 37,0 |
| Sim | 2.043 | 63,0 |
| Total | 3.242 | 100 |
No T1, houve perda de 234 crianças (de 7,2% em relação ao T0). Entre as crianças não acompanhadas no T1, a maior proporção pertencia ao quintil mais pobre (23,5%), as mães tinham entre 20 e 29 anos de idade (55,2%), menos de nove anos de estudo (52,1%), autodeclararam-se de raça/cor da pele parda (73,2%) e viviam com marido/companheiro (66,4%).
Um total de 3.133 (96,7%) famílias no T0 e 2.779 (92,4%) no T1 apresentaram a Caderneta de Saúde da Criança ou outro registro de vacinas aplicadas, no momento da entrevista. No T0, não houve diferença entre as crianças cujas mães apresentaram a caderneta ou outro registro de vacinação, de acordo com qualquer das variáveis independentes analisadas (Tabela 2). No T1, entretanto, foi maior a proporção de crianças com caderneta ou registro de vacinação filhas de mães que viviam com marido ou companheiro, em comparação a suas contrapartes (Tabela 2).
Tabela 2 Distribuição de crianças com Caderneta de Saúde da Criança ou outro registro de vacinação, na linha de base (T0) e no primeiro acompanhamento (T1) do estudo Avaliação do Impacto do Programa Criança Feliz, Brasil (T0, agosto/2018-abril/2019; T1, setembro/2019-janeiro/2020)
| Variável | n (%) com caderneta ou outro registro de vacinaa (T0) | n (%) com caderneta ou outro registro de vacinaa (T1) |
|---|---|---|
| (n=3.239) | (n=3.008) | |
| Nível socioeconômico da família (quintis) | p= 0,420b | p=0,152b |
| 1º (mais pobre) | 631 (97,5) | 554 (91,7) |
| 2º | 627 (96,8) | 564 (91,6) |
| 3º | 629 (97,1) | 553 (91,3) |
| 4º | 618 (95,4) | 568 (94,2) |
| 5º (mais rico) | 625 (96,9) | 537 (90,3) |
| Idade materna (anos) | p=0,257b | p=0,103b |
| <20 | 445 (95,9) | 389 (90,6) |
| 20-29 | 1.596 (96,6) | 1.396 (91,1) |
| 30-39 | 946 (97,1) | 854 (93,4) |
| ≥40 | 110 (99,1) | 103 (95,1) |
| Escolaridade materna (anos) | p=0,199b | p=0,131b |
| 0-4 | 273 (98,2) | 249 (94,8) |
| 5-8 | 901 (97,5) | 772 (92,6) |
| ≥9 | 1.737 (96,5) | 1.557 (91,3) |
| Raça/cor da pele da mãe | p=0,493b | p=0,322b |
| Branca | 447 (96,5) | 387 (90,5) |
| Parda | 2.326 (97,0) | 2.068 (93,7) |
| Preta | 311 (96,9) | 275 (91,8) |
| Mãe vive com marido ou companheiro | p=0,094b | p=0,012b |
| Não | 1.149 (96,0) | 1.016 (90,1) |
| Sim | 1.983 (97,2) | 1.762 (92,8) |
| Total | 3.133 (96,7) | 2.779 (92,4) |
a) Proporções calculadas considerando-se os níveis hierárquicos do modelo multinível (nível 3, estado; nível 2, município; nível 1, crianças); b) Teste de Wald.
A proporção de crianças com vacinação adequada foi 2,5 vezes maior no T0 (61,0% - IC95% 59,3;62,6), em relação ao T1 (24,8% - IC95% 22,8;25,9) (p<0,001). Na Tabela 3, são apresentadas as proporções de crianças com vacinação adequada, de acordo com características da família e maternas. No T0, a maior proporção de vacinação adequada ocorreu entre as pertencentes ao quintil mais rico (67,9%) e entre filhos de mães com ≥9 anos de escolaridade (63,3%) (Tabela 3). No T1, não foram observadas diferenças entre as proporções de vacinação adequada, conforme as variáveis independentes.
Tabela 3 Proporção de crianças com vacinação adequada conforme calendário vacinal com 15 dias de tolerância (T0 e T1), de acordo com características familiares e maternas na linha de base do estudo Avaliação do Impacto do Programa Criança Feliz, Brasil (T0, agosto/2018-abril/2019; T1, setembro/2019-janeiro/2020)
| Características familiares e maternas | T0 | T1 |
|---|---|---|
| Vacinação adequada conforme calendário vacinal com 15 dias de tolerânciaa | Vacinação adequada conforme calendário vacinal com 15 dias de tolerânciaa | |
| (n=3.205) | (n=3.008) | |
| n (%) | n (%) | |
| Nível socioeconômico da família (quintis) | p<0,001b | p=0,557b |
| 1º (mais pobre) | 315 (55,1) | 164 (26,6) |
| 2º | 396 (57,6) | 145 (22,7) |
| 3º | 374 (58,4) | 149 (24,5) |
| 4º | 420 (63,1) | 144 (24,3) |
| 5º (mais rico) | 447 (67,9) | 143 (26,0) |
| Idade materna (anos) | p=0,341b | p=0,474b |
| <20 | 273 (61,6) | 107 (25,2) |
| 20-29 | 959 (59,3) | 362 (23,6) |
| 30-39 | 633 (62,4) | 238 (26,3) |
| ≥40 | 71 (63,2) | 28 (26,6) |
| Escolaridade materna (anos) | p=0,001b | p=0,780b |
| 0-4 | 157 (56,3) | 65 (24,1) |
| 5-8 | 521 (57,2) | 202 (24,0) |
| ≥9 | 1.125 (63,3) | 419 (25,2) |
| Raça/cor da pele da mãe | p=0,573b | p=0,797b |
| Branca | 293 (60,2) | 95 (23,6) |
| Parda | 1.438 (60,4) | 571 (24,1) |
| Preta | 196 (63,3) | 65 (25,0) |
| Mãe vive com marido ou companheiro | p=0,899b | p=0,092b |
| Não | 716 (60,4) | 258 (23,1) |
| Sim | 1.238 (60,6) | 488 (25,8) |
| Total | 1.954 (61,0) | 746 (24,8) |
a) Proporções calculadas considerando-se os níveis hierárquicos do modelo multinível (nível 3, estado; nível 2, município; nível 1, crianças); b) Teste de Wald.
Na Tabela 4 são apresentados os percentuais de vacinação adequada, conforme o calendário vacinal e a idade das crianças em meses. Não se evidenciou um padrão de aumento ou redução da cobertura conforme a idade. No primeiro acompanhamento (T0), a faixa de idade com menor percentual de vacinas adequadas correspondeu ao estrato de 5,5 a 6,5 meses (53,5%); e o maior percentual, ao estrato de 0,5 a 2,5 meses (93,5%). No segundo acompanhamento (T1), o maior percentual de vacinas adequadas correspondeu à faixa de idade de 12,5 a 15,5 (34,4%) meses, e o menor, à faixa dos 6,5 aos 9,5 (12,5%) meses.
Tabela 4 Percentuais de vacinação adequada conforme calendário vacinal com 15 dias de tolerância, de acordo com a idade da criança em meses, na linha de base (T0) e no primeiro acompanhamento (T1) do estudo Avaliação do Impacto do Programa Criança Feliz, Brasil (T0, agosto/2018-abril/2019; T1, setembro/2019-janeiro/2020)
| Idade em meses | Percentual de vacinas adequadas no T0 | Percentual de vacinas adequadas no T1 |
|---|---|---|
| n (%) | n (%) | |
| 0,5-2,5 | 188/201 (93,5) | - |
| 2,5-3,5 | 87/123 (70,7) | - |
| 3,5-4,5 | 128/194 (66,0) | - |
| 4,5-5,5 | 146/272 (53,7) | - |
| 5,5-6,5 | 192/359 (53,5) | - |
| 6,5-9,5 | 667/1217 (54,8) | 1/8 (12,5) |
| 9,5-12,5 | 546/832 (65,6) | 36/122 (29,5) |
| 12,5-15,5 | 0/7 (0,0) | 177/514 (34,4) |
| 15,5-26,5 | - | 532/2.364 (22,5) |
Os Materiais Suplementares 1 e 2 apresentam os percentuais de vacinação adequada, respectivamente para cada UF e município estudado. A maior proporção de vacinação adequada no T0 foi observada no Ceará (78,4%), e a menor, no Pará (36,1%) (Material Suplementar 1). Segundo observado no T1, não foram observadas diferenças significativas entre as UFs. Das 30 cidades estudadas, Morada Nova (CE) teve a maior cobertura vacinal no T0 (89,3%), e São Miguel do Guamá (PA), a maior cobertura vacinal no T1 (45,7%) (Material Suplementar 2). A menor cobertura vacinal no T0 foi verificada em Tailândia (PA), com 10,6%; e no T1, em Paulo Afonso (BA), com 7,2%.
Segundo cada UF, entre os municípios estudados, os maiores percentuais de vacinação no T0 foram encontrados em Irecê (BA), Morada Nova (CE), Novo Gama (GO), São Miguel do Guamá (PA), Serra Talhada (PE) e Piracicaba (SP); e os menores percentuais, nos municípios de Serrinha (BA), Caucaia (CE), Águas Lindas de Goiás (GO), Tailândia (PA), Abreu e Lima (PE) e Francisco Morato (SP). No T1, os municípios com maiores percentuais de vacinação adequada foram: Irecê e Vitória da Conquista (BA), Sobral (CE), Águas Lindas de Goiás (GO), São Miguel do Guamá (PA), Caruaru (PE) e Piracicaba (SP); e os municípios com menores percentuais, Paulo Afonso (BA), Caucaia (CE), Novo Gama (GO), Bragança (PA), São Lourenço da Mata (PE) e Limeira (SP) (Material Suplementar 2).
A proporção de crianças que receberam cada uma das doses de vacina no T0 e no T1, de acordo com o calendário vacinal para a idade, é apresentada no Material Suplementar 3. No T0, a dose vacinal com menor cobertura foi o reforço da vacina meningocócica C (14,3%). No T1, a menor proporção correspondeu à dose do primeiro reforço da DTP (6,1%).
Discussão
Os resultados deste estudo revelaram baixo percentual de crianças com vacinação adequada, tanto no primeiro quanto no segundo ano de vida, mesmo respeitando-se os 15 dias de tolerância em relação à faixa etária recomendada para a aplicação da vacina. Os percentuais de vacinação adequada no primeiro ano de vida foram maiores entre crianças pertencentes a famílias do quintil mais rico e cujas mães tinham ≥9 de escolaridade. Essas diferenças socioeconômicas devem ser interpretadas levando-se em conta a constituição da amostra do estudo: famílias de menor nível socioeconômico, beneficiárias do Bolsa Família. No segundo acompanhamento (T1), não se encontrou relação entre cobertura vacinal e nível socioeconômico ou escolaridade materna, o que, possivelmente, é reflexo da diminuição da oferta de vacinas no ano de 2019.18
Estudo realizado no município de Volta Redonda, RJ, com crianças de 2 meses a 5 anos de idade atendidas em unidades básicas de saúde (UBS), encontrou cobertura vacinal completa de apenas 11% no ano de 2012.19 Já outro estudo, realizado no âmbito do programa das Coortes de Nascimentos de Pelotas, RS, revelou que, aos 12 meses de vida, a cobertura vacinal foi de 80,9% (IC95% 79,8;82,0), 97,2% (IC95% 96,1;98,0), 87,8% (IC95% 86,7;88,8) e 77,2% (IC95% 75,8;78,4), respectivamente, para nascidos no município gaúcho em 1982, 1993, 2004 e 2015.6
Resultados de inquéritos populacionais, a exemplo estudos mencionados em epígrafe e desta pesquisa, tendem a mostrar coberturas vacinais inferiores àquelas obtidas da rotina dos sistemas de informações de saúde. Estes sistemas são alimentados por relatórios de doses aplicadas, compilados nas unidades sanitárias. Os cálculos de cobertura utilizam-se de estimativas populacionais como denominadores - o que, às vezes, resulta em coberturas superiores a 100%. Por exemplo, segundo dados da série Saúde Brasil,20 em 2015, a cobertura da vacina do bacilo de Calmette-Guérin (BCG) foi de 105%.20 No ano de 2016, as doses da vacina da hepatite B (<1 ano), rotavírus humano (<1 ano), meningocócica C (12 meses), vacina absorvida difteria, tétano e pertussis (DTP) (15 meses), pneumocócica 10 (12 meses), poliomielite (15 meses) e tríplice viral (12 meses) aplicadas estiveram, todas, abaixo da meta de cobertura vacinal.21 A despeito dos diferentes métodos de cálculo empregados, os dados oficiais confirmam queda nas coberturas em nível nacional.
O atual estudo demonstrou que pertencer ao quintil mais rico - no âmbito de uma amostra predominantemente pobre - foi um fator associado a maiores proporções de vacinação adequada no T0. Dois estudos avaliativos, sobre países de renda média e baixa, verificaram desigualdades na cobertura vacinal conforme o nível socioeconômico: cobertura menor para o quintil mais pobre, quando comparada à cobertura do quintil mais rico.22,23
Dois estudos brasileiros, realizados em Salvador, BA,24 entre 2007 e 2008, e em São Luís, MA,25 entre 2006 e 2007, apontaram que crianças dos estratos sociais mais pobres tiveram menor cobertura vacinal, comparadas àquelas dos estratos mais ricos. De sua parte, os estudos sobre as coortes de nascimentos de Pelotas observaram que, aos 12 meses de idade, houve maior cobertura vacinal entre as criança nascidas dos estratos mais ricos nascidas em 1982, enquanto, para as nascidas em 2015, tal padrão socioeconômico havia-se invertido, fato que seus autores atribuíram à possível existência de uma hesitação das famílias mais ricas em vacinar seus filhos.6 Ainda segundo os autores da série histórica, outro motivo importante para a queda da cobertura vacinal diz respeito à complexidade crescente do esquema vacinal brasileiro, que passou de quatro tipos de vacinas em 1982, administradas em cinco contatos com os serviços durante o primeiro ano de vida, para 18 tipos de vacinas em oito contatos. Se, por um lado, a expansão na oferta de vacinas é importante para o controle de doenças imunopreveníveis, por outro lado, a complexidade dos esquemas contribui para a redução da cobertura prevista no calendário vacinal.
A menor escolaridade materna associou-se a menores coberturas no T0. O estudo realizado em UBS de Volta Redonda, RJ, encontrou maiores prevalências de crianças com vacinação em atraso entre filhos de mães com menos de oito anos de estudo.19 Outro estudo, conduzido no Maranhão entre 2006 e 2007, com crianças de 12 a 59 meses de vida, revelou maiores prevalências de esquema vacinal incompleto entre famílias cujo chefe de família tinha menos de cinco anos de escolaridade.25
De modo geral, destacam-se como pontos fortes do presente estudo (i) o tamanho e a abrangência da amostra, envolvendo mais de 3 mil crianças de seis Unidades da Federação brasileira e 30 municípios de quatro das cinco macrorregiões do país, e (ii) a estratégia adotada para coleta da informação sobre o desfecho, incluindo a fotografia das Cadernetas de Saúde da Criança e a extração direta do registro vacinal. Muitos estudos utilizam apenas a informação relatada pelas mães ou guardiões sobre as vacinas recebidas pela criança. A análise dos dados retirados de dois acompanhamentos - T0 e T1 - permitiu comparar a cobertura vacinal na mesma população, no período de um ano.
Entretanto, a pesquisa apresenta uma limitação: o fato de utilizar dados de uma população predominantemente pobre, originária de um estudo planejado para responder uma outra questão de pesquisa, limita a generalização de seus resultados. Informações sobre uso de serviços de saúde pelas crianças e disponibilidade de vacinas para elas nas unidades básicas do Sistema Único de Saúde não puderam ser avaliados.
As diferenças nas prevalências de cobertura vacinal entre o primeiro e o segundo acompanhamentos permitem considerar a seguinte hipótese: parte da diminuição na cobertura no período seria reflexo da falta de vacinas, principalmente da pentavalente em 2019.18 Também chamam a atenção as amplas diferenças nas coberturas vacinais entre UFs e municípios. Essas diferenças resultam, de um lado, das características locais da implementação do PNI (oferta de vacinas, acesso aos serviços de saúde e regularidade do registro na Caderneta de Saúde da Criança), e de outro lado, dependem da adesão das famílias à vacinação de suas crianças. Como a vacinação constitui uma das condicionalidades para o recebimento dos benefícios do Bolsa Família, resta mais forte a hipótese de essas diferenças atribuírem-se a características locais de implementação do programa. Diferenças semelhantes foram identificadas em 2017, quando o percentual de crianças até 2 anos vacinadas foi de 24,7% na Bahia, 25,7% no Ceará, 23,4% em Goiás, 42,1% no Pará, 33% em Pernambuco e 15,8% em São Paulo.26
Destaca-se, outrossim, a baixa cobertura vacinal, ainda que se respeite uma tolerância de 15 dias de atraso para cada vacina. Assim, torna-se preocupante o fato de todas as crianças avaliadas pertencerem a famílias dependentes dos benefícios do Bolsa Família, cujo acesso está condicionado à vacinação de todos os menores de 7 anos na família.27 Os achados do estudo sugerem a necessidade de uma avaliação detalhada da adesão das famílias à condicionalidade de manter o esquema de vacinação de suas crianças em dia.
Programas de visitas domiciliares podem aumentar a cobertura vacinal em crianças.28 No presente estudo, no T1, a cobertura vacinal no grupo PCF foi maior do que no controle, mesmo após ajuste para o status ‘intervenção’ ou ‘controle’, indicando que o Programa Criança Feliz pode contribuir para a melhoria das taxas de vacinação.
O Ministério da Saúde, enquanto instituição responsável, tem demonstrado preocupação com o declínio das coberturas vacinais no país. A Organização Mundial da Saúde recomenda coberturas de 90% para BCG e rotavírus humano, e de 95% para os demais imunizantes. As medidas a serem tomadas para promover a vacinação incluem (i) ampliar o horário dos locais de vacinação, (ii) evitar barreiras de acesso, (iii) aproveitar oportunidades para a vacinação (consultas ou outros procedimentos nas unidades de saúde), (iv) identificar crianças em atraso no calendário vacinal, mediante busca ativa e estratégias comunitárias, (v) promover ações coletivas de educação em saúde, junto com a comunidade, para a prevenção de doenças por meio da vacinação, e (vi) combater qualquer informação falsa sobre vacinação, sempre exaltando a segurança e benefícios das vacinas.29
Cumpre salientar que, tão logo se concluiu a pesquisa em tela, a pandemia da COVID-19 chegou ao país e, muito provavelmente, relatos mais recentes, informando que ações preventivas na rede básica foram severamente afetadas pela pandemia, sinalizam para uma cobertura vacinal - até o final de 2020 - todavia menor do que a evidenciada na presente análise.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI