Introdução
No início da pandemia de COVID-19, causada pelo vírus SARS-CoV-2, foi consenso que crianças apresentavam sintomas leves e que boa parte delas seriam assintomáticas, não estando entre as condições e fatores de risco para complicações pela doença.1 Os primeiros estudos sobre a COVID-19 também registraram baixa incidência e baixa letalidade entre crianças e adolescentes.1
Em abril de 2020, durante o pico da pandemia na Europa, foi identificado aumento na internação de crianças/adolescentes com quadros de inflamação multissistêmica grave, semelhante à síndrome de Kawasaki, possivelmente associados à infecção pregressa pelo SARS-CoV-2.3 Após alerta emitido por pesquisadores do Reino Unido, diferentes países registraram aumento de casos semelhantes,2 posteriormente denominados como multisystem inflammatory syndrome in children (MIS-C)6 – adaptada para o português como síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19 (SIM-P).
Ainda que rara, a síndrome tem chamado a atenção em todo o mundo. Trata-se de um quadro caracterizado por febre alta e persistente, com espectro de sinais e sintomas acometendo vários sistemas (manifestações gastrointestinais, dermatocutâneas e circulatórias, entre outras).2 Os sintomas respiratórios nem sempre estão presentes, porém há importante elevação dos marcadores inflamatórios e o quadro clínico pode evoluir para choque e coagulopatia.2
No Brasil, o monitoramento sistemático da SIM-P foi implantado em 24 de julho de 2020 pela Secretaria de Vigilância em Saúde do Ministério da Saúde, em todo o território nacional, permitindo a notificação retroativa de casos identificados anteriormente a sua implementação.7 O presente estudo teve como objetivos caracterizar o perfil clínico-epidemiológico dos casos de SIM-P e identificar fatores associados aos óbitos causados por SIM-P no Brasil, em 2020.
Métodos
Foi realizado estudo seccional, a partir das notificações de casos suspeitos de SIM-P no Brasil, com data de início dos sintomas compreendida no período entre 26 de fevereiro de 2020 (data da confirmação do primeiro caso de COVID-19 no país) e 31 de dezembro de 2020.
Foram excluídas as notificações em duplicidade, pelo método determinístico, comparando-se nome e data de nascimento, nome da mãe e Unidade da federação (UF) de residência. Logo, os registros foram classificados conforme a definição adotada pelo Ministério da Saúde,7 considerando-se como ‘caso confirmado’ o indivíduo com menos de 20 anos de idade, hospitalizado, com presença de:
a) Febre elevada (mínimo: 38ºC) e persistente (por 3 ou mais dias).
b) Evidência de COVID-19 (biologia molecular, teste antigênico ou sorológico positivo) ou história de contato com pessoas com COVID-19.
c) Marcadores de inflamação elevados, como resultados laboratoriais alterados para velocidade de hemossedimentação (VHS), proteína C-reativa ou procalcitonina, entre outros.
d) Pelo menos dois dos seguintes sinais/sintomas:
– Conjuntivite não purulenta ou erupção cutânea bilateral ou sinais de inflamação mucocutânea (oral, nas mãos ou pés);
– Hipotensão arterial ou choque;
– Manifestações de disfunção miocárdica, pericardite, valvulite ou anormalidades coronárias, incluindo achados do ecocardiograma ou elevação de troponina ou N-terminal do peptídeo natriurético tipo B (NT-proBNP);
– Evidência de coagulopatia por tempo de protrombina (TP), tempo de tromboplastina parcial ativada (TTPa) ou dímero-D elevados;
– Manifestações gastrointestinais agudas (diarreia, vômito ou dor abdominal).
e) Afastadas quaisquer outras causas de origem infecciosa óbvia de inflamação, incluindo sepse bacteriana, síndrome de choque estafilocócica ou estreptocócica.
A curva epidêmica dos casos de SIM-P foi comparada à curva da COVID-19 para menores de 20 anos no Brasil, considerando-se a média móvel das últimas três semanas epidemiológicas (SEs) de início dos sintomas. Foram contabilizados os casos de síndrome respiratória aguda grave (SRAG) e de síndrome gripal (SG) confirmados para COVID-19 por critério laboratorial, clínico, clínico-epidemiológico ou clínico-imagem.
Os casos e a incidência bruta de SIM-P foram apresentados segundo UF de residência. A incidência foi calculada dividindo-se o número de casos confirmados pelo número de pessoas menores de 20 anos, multiplicado por 100 mil. Também foi calculada a letalidade da SIM-P no Brasil, dividindo-se o número de casos com evolução para óbito registrada, pelo número de casos totais, multiplicado por 100.
Os dados de SIM-P provieram da base de dados nacional do monitoramento [notificação online na plataforma REDCap®, hospedada e sob domínio do Departamento de Informática do Sistema Único de Saúde (Datasus)]. Para aos casos de COVID-19, consultaram-se dados do Sistema de Informação da Vigilância Epidemiológica da Gripe (SIVEP-Gripe), para SRAG, e do sistema e-SUS Notifica, para síndrome gripal (SG), ambos disponíveis na plataforma Open-DataSUS.9 Para o cálculo da incidência, foram utilizadas projeções populacionais do Instituto Brasileiro de Geografia e Estatística (IBGE) para o ano de 2020.10 Todos os dados utilizados foram extraídos em 4 de fevereiro de 2021, e foram consideradas as notificações até 14 de janeiro de 2021.
A caracterização dos casos de SIM-P contemplou frequências simples, relativas, e medidas de tendência central das seguintes variáveis independentes:
a) Sociodemográficas: idade (em anos: menos de 1; 1 a 9; menos de 20); sexo (feminino; masculino); raça/cor da pele (branca; preta; parda; indígena; amarela).
b) Presença de comorbidades pregressas (sim; não)
c) Sinais/sintomas apresentados em grandes grupos e detalhados (sim; não):
– Gastrointestinais – dor abdominal, náusea ou vômito, diarreia;
– Dermatocutâneos – conjuntivite, manchas vermelhas pelo corpo (como rash e exantemas);
– Respiratórios – dispneia, saturação de O2<95%, tosse, coriza, dor de garganta;
– Neurológicos – cefaleia, letargia, irritabilidade, confusão mental;
– Circulatórios e hemodinâmicos – taquicardia, hipotensão/choque, alterações na cor da pele (como palidez e cianose);
– Edema – edema de mãos ou pés, linfadenopatia;
– Mialgia;
– Oligúria.
d) Resultados alterados para marcadores de inflamação, coagulopatia ou disfunção orgânica (sim; não) – proteína C-reativa, dímero-D, velocidade de hemossedimentação (VHS), ferritina, desidrogenase láctica, albumina, transaminase glutâmico-oxalacética (TGO), transaminase glutâmico-pirúvica (TGP), tempo de tromboplastina, troponina, tempo de tromboplastina parcial ativada, ureia, creatinina, sódio, potássio.
e) Uso no tratamento (sim; não) – imunoglobulina, corticoide, anticoagulante, antiviral.
f) Critério de confirmação para COVID-19 – evidência laboratorial de infecção por SARS-CoV-2 (sorológico; molecular) ou critério clínico-epidemiológico (temporalmente associado a um caso de COVID-19 confirmado laboratorialmente nos últimos 30 dias).
g) Ocorrência de complicações (sim; não).
h) Internação em unidade de terapia intensiva (UTI) (sim; não).
i) Tempo (em dias: do início dos sintomas à hospitalização; duração da internação; permanência em UTI).
j) Evolução do caso (óbito; alta hospitalar).
Para análise dos fatores associados aos óbitos, a variável dependente analisada foi a evolução do caso: casos de SIM-P com desfecho ‘óbito’ foram comparados àqueles com desfecho ‘alta hospitalar’; os registros sem preenchimento da evolução foram desconsiderados.
Para tratamento das variáveis independentes, construiu-se um modelo teórico hierarquizado11 contemplando os cinco primeiros blocos de variáveis descritos acima. Primeiramente foram empregados modelos de regressão logística simples, para estudo das relações entre as variáveis independentes e o desfecho óbito, com participação das variáveis que apresentaram ao menos 90% de completude em ambos os grupos de comparação (óbito e alta hospitalar).
Em seguida, adotou-se a abordagem hierarquizada de modelagem dos dados,11 empregando-se modelo de regressão logística múltipla com participação das variáveis que apresentaram nível de significância até 10% (p-valor<0,10) na regressão simples. O bloco distal foi composto pelas variáveis sociodemográficas e pela presença de comorbidades pregressas (Modelo 1); os níveis intermediários, pela presença de sinais e sintomas (Modelo 2) e de resultados alterados para marcadores de atividade inflamatória, coagulopatia ou disfunção orgânica (Modelo 3); e o nível proximal, pelo tratamento (Modelo 4).
A inclusão das variáveis independentes no modelo de regressão múltipla hierarquizado foi realizada de forma ordenada e sequencial, seguindo a direção distal-proximal (Modelos 1 a 4). A cada nível, permaneceram no modelo aquelas variáveis que apresentaram nível de significância até 5% (p-valor<0,05), de maneira que todos os níveis eram ajustados pelas variáveis do próprio nível e níveis anteriores. A associação entre o óbito e as variáveis independentes estudadas foi expressa em valores de odds ratios bruta (ORb) e ajustada (ORa) e seus respectivos intervalos de 95% de confiança (IC95%).
Optou-se por incluir as variáveis de sinais/sintomas específicos nos modelos de regressão, em vez de organizadas em grandes grupos, uma vez que foi encontrada elevada ou absoluta frequência dos grandes grupos entre casos de SIM-P que evoluíram a óbito, não permitindo estabelecer grupo de comparação. Também foi realizado diagnóstico de multicolinearidade entre as variáveis de sinais/sintomas específicos identificadas na regressão simples, através de matriz de correlação; para regressão múltipla, foi selecionada uma das variáveis de sinais/sintomas específicos a cada par de variáveis que demonstrou coeficiente de correlação ≥0,4 (correlação modera a alta).
Foram consideradas perdas para o modelo de regressão múltipla os registros dos casos de SIM-P que demonstraram ausência de dados em qualquer variável independente selecionada. Considerando-se a amostra de casos que participaram do modelo, razão de chances igual a 2,0 e diferença de 10% na distribuição do desfecho entre grupos com ou sem a variável de interesse, o poder mínimo foi estimado em 64,2%.
O software R 4.0.0 foi utilizado para limpeza de duplicidades, tratamento e análise de dados, enquanto os softwares Microsoft/Excel e QGIS3.12 foram empregados para visualização dos dados.
O projeto do estudo foi submetido à apreciação da Comissão Nacional de Ética em Pesquisa/Conselho Nacional de Saúde (CONEP/CNS) e aprovado em 14 de janeiro de 2021 [Certificado de Apresentação para Apreciação Ética (CAAE) no 40867220.5.0000.0008].
Resultados
O Brasil registrou 1.082 notificações de casos suspeitos de SIM-P em 2020, 43 (4,0%) delas eram registros em duplicidade e 387 (35,8%) não atenderam aos critérios de definição de caso, restando 652 (60,2%) casos classificados como confirmados de SIM-P. Destes, 525 (80,6%) receberam alta hospitalar e 42 (6,4%) evoluíram para óbito. Houve 85 (13,0%) registros sem evolução preenchida na notificação ( Figura 1 ).
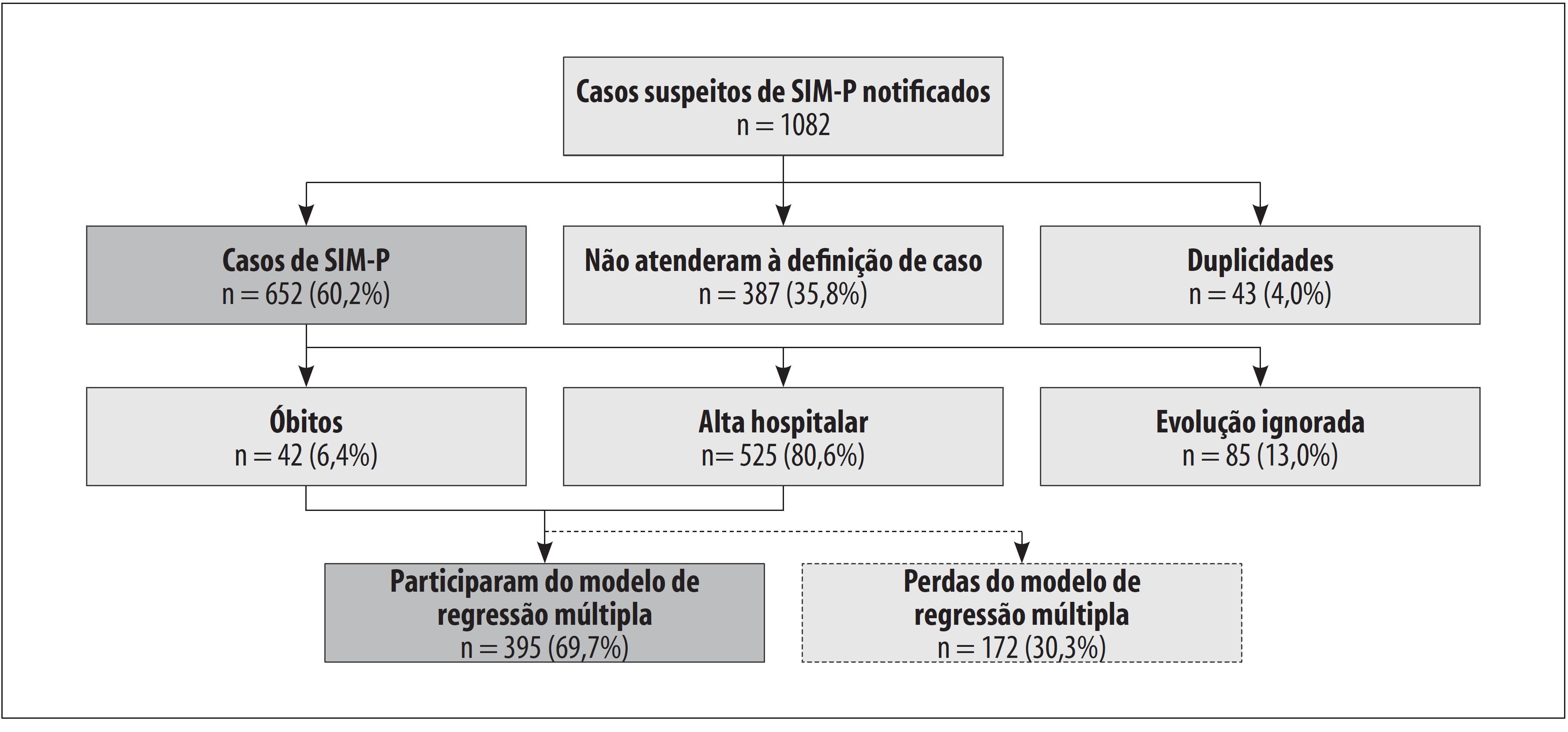
Figura 1 – Fluxograma dos casos suspeitos notificados de síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19 (SIM-P), seleção dos casos confirmados e definição dos grupos com desfecho ‘óbito’ ou ‘alta hospitalar’ participantes do estudo de associação ao óbito, Brasil, 2020Nota: a) As perdas ocorreram devido a dados faltantes nas variáveis estudadas.
O comportamento da curva epidêmica de SIM-P no Brasil foi semelhante ao da curva de COVID-19 em menores de 20 anos; contudo, as curvas guardaram diferenças em suas distribuições temporais. O pico de ocorrência dos casos de SIM-P na média móvel ocorreu cinco semanas após o pico de COVID-19 na faixa etária pediátrica (SE 30). O maior número de óbitos dos casos de SIM-P (n=5) foi registrado na SE 42 ( Figura 2 ).
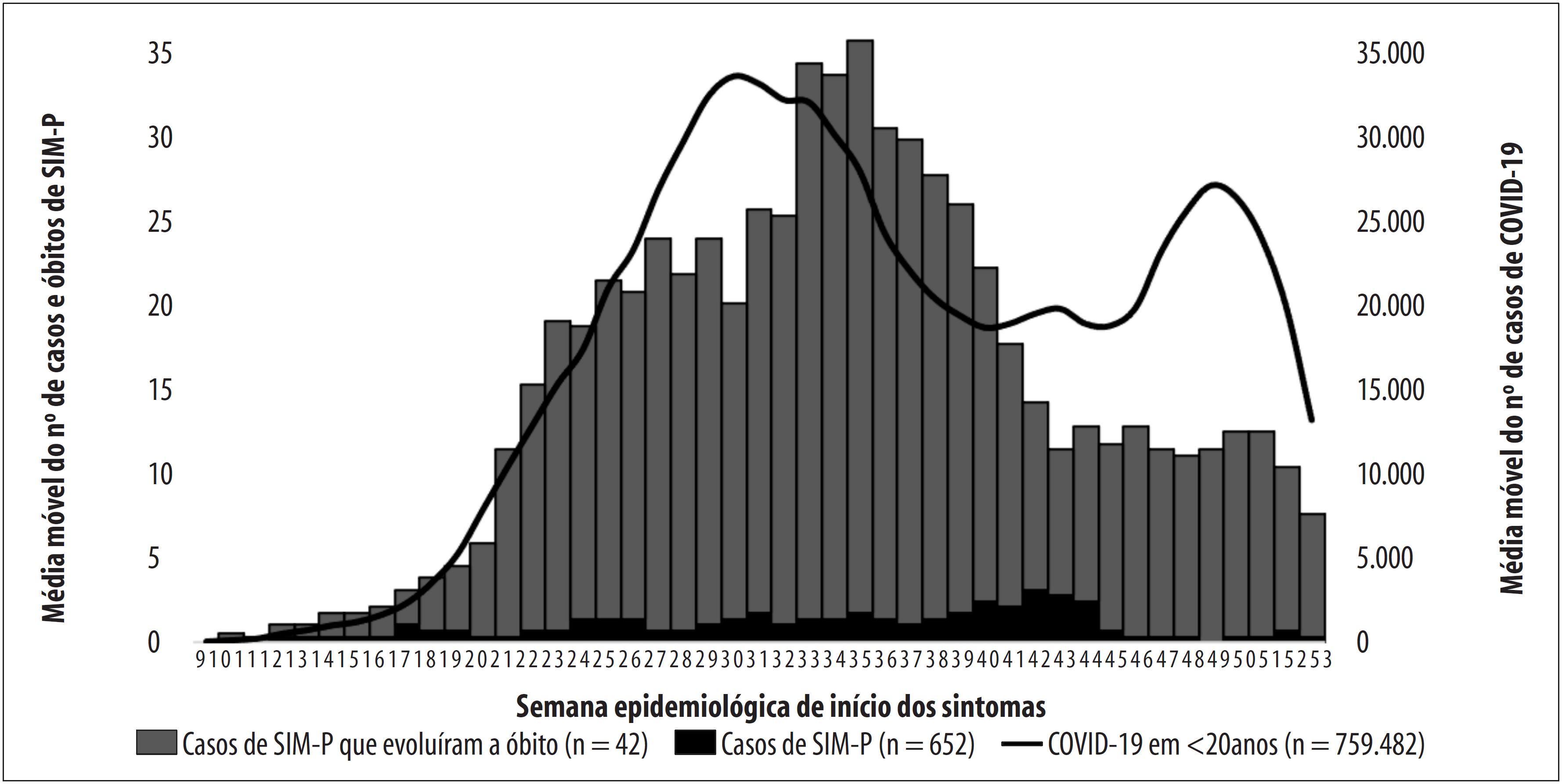
Figura 2 – Média móvel do número de casos e óbitos de síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19 (SIM-P) e de COVID-19 em menores de 20 anos de idade, segundo semana epidemiológica de início dos sintomas, Brasil, 2020
As UFs São Paulo (n=142; 21,8%), Distrito Federal (n=58; 8,9%), Minas Gerais (n=57; 8,7%), Bahia (n=50; 7,7%) e Pará (n=50; 7,7%) responderam por mais de 50% dos casos de SIM-P no país (Material suplementar 1). A incidência da SIM-P no Brasil foi de 1,1 caso a cada 100 mil habitantes com menos de 20 anos. As UFs Alagoas (2,2), Rio Grande do Norte (1,6), Pará (1,6), Ceará (1,2), São Paulo (1,2), Santa Catarina (1,2) e o Distrito Federal (6,7) apresentaram incidências superiores à média nacional (Material suplementar 1).
A Tabela 1 apresenta o perfil dos casos de SIM-P: 64,3% das crianças/adolescentes tinham entre 1 e 9 anos (mediana: 5 anos), 57,1% eram do sexo masculino, 52,0% de raça/cor da pele parda e aproximadamente 80% não apresentavam comorbidades previamente à SIM-P. A presença de algum sinal/sintoma do grupo gastrointestinal foi registrada em 87,6% dos casos de SIM-P, seguindo-se os sinais/sintomas dermatocutâneos em 72,4% e dos respiratórios em 66,0%. Como critério obrigatório da definição de caso, a febre alta e persistente esteve presente em todos os casos.
Tabela 1 – Casos de síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19 (SIM-P) (n=652) segundo características pessoais, clínicas e da internação, Brasil, 2020
| Características | n | % |
|---|---|---|
| Faixa etária (em anos) | ||
| <1 | 70 | 10,7 |
| 1-9 | 419 | 64,3 |
| <20 | 163 | 25,0 |
| Sexo | ||
| Masculino | 372 | 57,1 |
| Feminino | 280 | 42,9 |
| Raça/cor da pele (n=517) | ||
| Parda | 269 | 52,0 |
| Branca | 215 | 41,6 |
| Preta | 31 | 6,0 |
| Indígena | 2 | 0,4 |
| Presença de alguma comorbidade pregressa | ||
| Sim | 131 | 20,1 |
| Sinais e sintomas apresentados | ||
| Gastrointestinais | 571 | 87,6 |
| Dermatocutâneos | 472 | 72,4 |
| Respiratórios | 430 | 66,0 |
| Circulatórios e hemodinâmicos | 402 | 61,7 |
| Neurológicos | 366 | 56,1 |
| Edema | 295 | 45,1 |
| Mialgia | 152 | 22,3 |
| Oligúria | 129 | 19,8 |
| Marcadores alterados de inflamação, coagulopatia ou disfunção orgânica | ||
| Proteína C-reativa (n=622) | 590 | 94,9 |
| Dímero-D (n=526) | 493 | 93,7 |
| VHSa (n=427) | 379 | 88,8 |
| Ferritina (n=404) | 303 | 75,0 |
| DHLb (n=424) | 258 | 60,8 |
| Albumina (n=454) | 269 | 59,3 |
| TGOc (n=588) | 301 | 51,2 |
| TGPd (n=590) | 273 | 46,3 |
| TPe (n=529) | 226 | 42,7 |
| Troponina (n=454) | 190 | 41,9 |
| TTPaf (n=523) | 203 | 38,8 |
| Ureia (n=588) | 151 | 25,7 |
| Creatinina (n=592) | 150 | 25,3 |
| Sódio (n=559) | 142 | 25,4 |
| Potássio (n=556) | 117 | 21,0 |
| Tratamento | ||
| Imunoglobulinas (n=616) | 418 | 67,9 |
| Corticoides (n=603) | 376 | 62,3 |
| Anticoagulantes (n=601) | 335 | 55,7 |
| Antivirais (n=600) | 96 | 16,0 |
| Critério de confirmação para COVID-19 | ||
| Clínico-epidemiológico | 141 | 21,6 |
| Laboratorial | 511 | 78,4 |
| Sorológico | 399 | 61,2 |
| Molecular | 145 | 22,2 |
| Complicações | ||
| Hipotensão (necessidade de drogas vasoativas) | 181 | 27,8 |
| Necessidade de ventilação invasiva | 128 | 19,6 |
| Pneumonia | 126 | 19,3 |
| Necessidade de ventilação não invasiva | 72 | 11,0 |
| Insuficiência renal | 62 | 9,5 |
| Convulsões | 34 | 5,2 |
| Internação em UTIg (n=563) | ||
| Sim | 290 | 44,5 |
| Evolução | ||
| Alta hospitalar | 525 | 80,5 |
| Óbito | 42 | 6,4 |
| Ignorada | 85 | 13,1 |
a) VHS: velocidade de hemossedimentação; b) DHL: desidrogenase láctica; c) TGO: transaminase glutâmico-oxalacética; d) TGP: transaminase glutâmico-pirúvica; e) TP: tempo de tromboplastina; f) TTPa: tempo de tromboplastina parcial ativado; g) UTI: unidade de terapia intensiva.
Foi encontrada elevada frequência de resultados alterados para marcadores de inflamação, coagulopatia e disfunção orgânica entre os casos de SIM-P, com destaque para proteína C-reativa, dímero-D e VHS alterados em mais de 80% dos casos (excluídos os não realizados/ignorados). O uso de imunoglobulinas e anticoagulantes foi registrado em 67,9% e 55,7% dos casos de SIM-P, respectivamente. Na maioria das crianças/adolescentes o diagnóstico de COVID-19 foi confirmado por critério laboratorial (78,4%), sendo que 61,2% tiveram diagnóstico confirmado por teste sorológico ( Tabela 1 ).
A mediana de tempo decorrido entre o início dos sinais/sintomas e a internação foi de 4 dias, e a mediana do tempo de internação de internação, de 9 dias. A internação em UTI ocorreu em 44,5% dos casos, com permanência mediana de 6 dias (excluídos os ignorados). Os 42 casos de SIM-P que evoluíram a óbito estiveram distribuídos em 15 UFs, entre as quais o Pará e São Paulo registraram o maior número absoluto: 7 casos cada.
A Tabela 2 apresenta as características dos casos de SIM-P associados ao óbito na análise de regressão bruta. As faixas etárias de <1 e 20 anos e a presença de alguma comorbidade pregressa à SIM-P revelaram-se significativamente associadas ao óbito. Em relação às características clínicas dos óbitos, observou-se maior frequência de dispneia, saturação de O2<95%, taquicardia, hipotensão/choque, alterações na cor da pele (como palidez e cianose) e oligúria, além de menor frequência de conjuntivite, manchas vermelhas pelo corpo (como rash e exantemas), edema de mãos ou pés e linfadenopatia, em relação aos que tiveram alta hospitalar.
Tabela 2 – Distribuição de frequência das características demográficas, clínicas e laboratoriais, de acordo com evolução durante a internação (óbito ou alta hospitalar), em casos de síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19, Brasil, 2020.
| Características | Óbitos (n=42) | Alta hospitalar (n=525) | p-valora |
|---|---|---|---|
| n (%) | n (%) | ||
| Faixa etária (em anos) | |||
| <1 | 10 (23,8) | 44 (8,4) | 0,001 |
| 1-9 | 17 (40,5) | 352 (67,0) | |
| <20 | 15 (35,7) | 129 (24,6) | |
| Sexo | |||
| Masculino | 19 | 307 (58,5) | 0,101 |
| Feminino | 23 | 218 (41,5) | |
| Presença de alguma comorbidade pregressa | |||
| Sim | 16 | 105 (20,0) | 0,007 |
| Sinais e sintomas apresentados | |||
| Dor abdominal | 19 | 316 (60,2) | 0,056 |
| Náusea ou vômito | 22 | 290 (55,2) | 0,697 |
| Diarreia | 18 | 255 (48,6) | 0,467 |
| Conjuntivite | 7 | 352 (67,0) | <0,001 |
| Manchas vermelhas pelo corpob | 10 | 313 (59,6) | <0,001 |
| Dispneia | 31 | 178 (33,9) | <0,001 |
| Saturação de O2<95% | 29 | 152 (29,0) | <0,001 |
| Tosse | 14 | 116 (22,1) | 0,105 |
| Coriza | 7 | 79 (15,0) | 0,769 |
| Dor de garganta | 4 | 76 (14,5) | 0,359 |
| Cefaleia | 11 | 132 (25,1) | 0,886 |
| Letargia | 14 | 121 (23,0) | 0,140 |
| Irritabilidade | 9 | 106 (20,2) | 0,881 |
| Confusão mental | 7 | 41 (7,8) | 0,071 |
| Taquicardia | 25 | 184 (35,0) | <0,001 |
| Hipotensão/choque | 35 | 173 (33,0) | 0,002 |
| Alterações na cor da pelec | 20 | 154 (29,3) | 0,017 |
| Edema de mãos ou pés | 6 | 167 (31,8) | 0,010 |
| Linfadenopatia | 2 | 113 (21,5) | 0,003 |
| Mialgia | 12 | 121 (23,0) | 0,448 |
| Oligúria | 14 | 93 (17,7) | 0,023 |
| Marcadores alterados de inflamação, coagulopatia ou disfunção orgânica | |||
| Proteína C reativa | 39/40 | 478/502 (95,2) | 0,477 |
| TGOd | 31/39 | 235/477 (49,3) | <0,001 |
| TGPe | 22/38 | 216/477 (45,3) | 0,132 |
| Ureia | 25/38 | 107/481 (22,2) | <0,001 |
| Creatinina | 21/40 | 110/480 (22,9) | <0,001 |
| Tratamento | |||
| Imunoglobulinas | 15/38 | 357/501 (71,3) | <0,001 |
| Corticoides | 30/39 | 300/493 (60,9) | 0,043 |
| Anticoagulantes | 14/38 | 281/487 (57,7) | 0,013 |
| Antivirais | 11/38 | 74/487 (15,2) | 0,039 |
a) p-valor do teste de likelihood ratio ; b) Como rash e exantema; c) Como palidez e cianose; d) TGO: transaminase glutâmico-oxalacética; e) TGP: transaminase glutâmico-pirúvica.
Também se observou maior frequência de resultados alterados para TGO, ureia e creatinina entre os casos de SIM-P que evoluíram a óbito, quando comparados aos que tiveram alta hospitalar. O uso de imunoglobulinas e de anticoagulantes estiveram negativamente associados ao óbito, enquanto o uso de corticoides e antivirais, ao maior risco de morte. O Material suplementar 2 apresenta as análises dos casos de SIM-P, segundo características adicionais.
Na Tabela 3 , são apresentados os resultados da regressão múltipla em modelagem hierarquizada, da qual participaram 28 casos de SIM-P com evolução para óbito e 368 casos de alta hospitalar (70% dos 567 casos com evolução conhecida). As perdas ocorreram devido a dados faltantes nas variáveis estudadas.
Tabela 3 – Fatores associados aos óbitos nos casos de síndrome inflamatória multissistêmica pediátrica temporalmente associada à COVID-19 (SIM-P) (n=397), segundo análise em modelos de regressão logística múltipla hierarquizada, com inclusão de variáveis em blocos proximais ao desfecho ‘óbito’, Brasil, 2020
| Modelo/variáveis | ORba (IC95%)b | ORac (IC95%)b | p-valord |
|---|---|---|---|
| Modelo 1: Sociodemográficas e comorbidades (AIC: 204) | |||
| Faixa etária (referência: 1 a 9 anos) | 0,159 | ||
| <1 | 2,56 (0,79;8,32) | 2,57 (0,79;8,39) | |
| <20 | 2,01 (0,87;4,75) | 1,97 (0,84;4,62) | |
| Presença de comorbidade | 0,092 | ||
| Sim | 2,09 (0,93;4,72) | 2,07 (0,91;4,71) | |
| Modelo 2: Sinais e sintomas apresentados (AIC: 182) | |||
| Presença de sinais e sintomas (referência: Não) | |||
| Manchas vermelhas pelo corpoe | 0,19 (0,08;0,48) | 0,23 (0,09;0,62) | 0,001 |
| Alterações na cor da pelef | 2,29 (1,05;4,95) | 1,31 (0,53;3,22) | 0,557 |
| Saturação de O2<95% | 5,10 (2,19;11,92) | 4,35 (1,69;11,20) | 0,002 |
| Confusão mental | 2,07 (0,74;5,78) | 1,59 (0,51;4,92) | 0,437 |
| Edema de mãos ou pés | 0,34 (0,12;1,01) | 0,52 (0,16;1,68) | 0,254 |
| Linfadenopatia | 0,26 (0,06;1,10) | 0,35 (0,08;1,60) | 0,127 |
| Oligúria | 1,88 (0,82;4,33) | 1,41 (0,55;3,57) | 0,476 |
| Modelo 3: Resultados de exames alterados (AIC: 163) | |||
| Presença de sinais e sintomas (referência: Não) | |||
| Manchas vermelhas pelo corpoe | 0,19 (0,08;0,48) | 0,18 (0,07;0,49) | < 0,001 |
| Saturação de O2<95% | 5,10 (2,19;11,92) | 3,6 (1,44;8,98) | 0,004 |
| Marcadores alterados de inflamação, coagulopatia ou disfunção orgânica (referência: Não) | |||
| TGOg | 4,07 (1,61;10,26) | 2,11 (0,77;5,82) | 0,135 |
| Ureia | 7,85 (3,42;18,03) | 5,18 (1,91;14,04) | < 0,001 |
| Creatinina | 3,84 (1,76;8,40) | 1,12 (0,43;2,95) | 0,817 |
| Modelo 4: Tratamento (AIC: 191) | |||
| Presença de sinais e sintomas (referência: Não) | |||
| Manchas vermelhas pelo corpoe | 0,19 (0,08;0,48) | 0,19 (0,07;0,54) | < 0,001 |
| Saturação de O2<95% | 5,10 (2,19;11,92) | 4,64 (1,75;12,28) | 0,001 |
| Marcadores alterados de inflamação, coagulopatia ou disfunção orgânica (referência: Não) | |||
| Ureia | 7,85 (3,42;18,03) | 4,7 (1,88;11,73) | < 0,001 |
| Tratamento (referência: Não) | |||
| Antivirais | 1,67 (0,68;4,11) | 2,28 (0,79;6,53) | 0,137 |
| Corticoides | 2,39 (0,95;6,05) | 2,48 (0,83;7,44) | 0,091 |
| Imunoglobulina | 0,25 (0,11;0,56) | 0,38 (0,15;1,01) | 0,050 |
| Anticoagulante | 0,33 (0,14;0,74) | 0,32 (0,12;0,89) | 0,025 |
a) ORb: odds ratio (razão de chances) bruta; b) IC95%: intervalo de 95% de confiança; c) ORa: odds ratio (razão de chances) ajustada; d) P-valor do teste de likelihood ratio ; e) Como rash e exantema; f) Como palidez e cianose; g) TGO: transaminase glutâmico-oxalacética.
Não foi encontrada associação estatisticamente significativa entre as variáveis ajustadas no Modelo 1 e o desfecho ‘óbito’. No Modelo 2, observou-se que a chance de saturação de O2<95% foi significativamente maior (ORa=4,35 – IC95% 1,69;11,20), e a presença de manchas vermelhas pelo corpo (ORa=0,23 – IC95% 0,09;0,62), significativamente menor entre os óbitos, quando comparados aos que evoluíram para alta hospitalar. As variáveis ‘conjuntivite’, ‘dispneia’, ‘taquicardia’ e ‘hipotensão/choque’ não participaram do modelo hierarquizado devido à identificação de correlação moderada com as variáveis ‘manchas vermelhas pelo corpo’ (para conjuntivite) e ‘saturação de O2<95%’ (para as demais) (Material suplementar 3).
No Modelo 3, controlado pelas variáveis associadas anteriormente, apenas a alteração em exame de ureia demonstrou associação estatisticamente significativa com o óbito (ORa=5,18 – IC95% 1,91;14,04). No Modelo 4, após inclusão das variáveis relacionadas aos tratamentos, o uso de anticoagulantes associou-se significativamente a menor chance de óbito (ORa=0,32 – IC95% 0,12;0,89), enquanto o uso de imunoglobulina apresentou associação negativa com o óbito com nível de significância de p foi limítrofe (ORa=0,38 – IC95% 0,15;1,01).
Discussão
Os casos de SIM-P no Brasil, em 2020, tiveram idade mediana de 5 anos e a maioria ocorreu em crianças/adolescentes de raça/cor da pele parda e sexo masculino, após o pico de COVID-19 na faixa etária pediátrica. As manifestações clínicas foram diversas e cursaram, majoritariamente, com elevados níveis de marcadores de inflamação, coagulopatia ou disfunção orgânica. A letalidade da SIM-P no Brasil foi de 6,4% em 2020, tendo como fatores associados aos óbitos a presença de saturação de O2<95% e resultado alterado de ureia. A letalidade foi menor entre os casos com ausência de manchas vermelhas pelo corpo e os que usaram anticoagulantes e imunoglobulinas.
A ocorrência de SIM-P após pico de COVID-19 na faixa etária pediátrica já foi observada em outros países, cuja maioria relatou diferença de 3 a 5 semanas entre as curvas.2 Também foram consistentes com a literatura os resultados da frequência de positividade em teste sorológico para SARS-CoV-2 e da presença de marcadores inflamatórios/coagulopatia (também descrita em casos graves de COVID-19).4 Tais aspectos corroboram a hipótese de a SIM-P constituir uma resposta imunológica tardia à infecção pelo SARS-CoV-2 em crianças/adolescentes.15
A mediana de idade dos casos de SIM-P no Brasil foi inferior à encontrada na maioria dos estudos,2 aproximando-se da síndrome de Kawasaki (SK) ou da COVID-19 aguda pediátrica.18 Esse resultado pode indicar que os serviços de saúde no Brasil foram mais sensíveis à suspeição da SIM-P em crianças/adolescentes mais jovens, ou que o estudo incluiu casos de outras manifestações inflamatórias semelhantes à SIM-P. A sobreposição com outras síndromes multissistêmicas já foi descrita em diversos trabalhos.2 A elevada frequência de crianças com menos de 1 ano também chamou a atenção, especialmente entre os que evoluíram para óbito, justamente um grupo etário que apresenta desafio ainda maior para diagnóstico.16
A maior frequência de casos de SIM-P em pessoas da raça/cor da pele parda e do sexo masculino foram consistentes com a literatura;2 porém, a contribuição dos fatores genéticos permanece pouco elucidada e acredita-se que os resultados podem estar relacionados a fatores ambientais, como iniquidades sociais e raciais.16 Destaca-se que a raça/cor da pele não foi registrada em mais de 20% dos casos de SIM-P, ainda que o preenchimento seja obrigatório nos sistemas de informações em saúde no Brasil.22
O estudo encontrou diversidade clínica e acometimento de múltiplos órgãos entre os casos de SIM-P, com diferenças importantes entre os que evoluíram para óbito e aqueles com alta hospitalar, corroborando a compreensão atual da comunidade científica sobre a existência de diferentes fenótipos e níveis de gravidade da síndrome.2 A elevada letalidade entre casos de SIM-P na presença de sinais/sintomas respiratórios e ausência de manifestações dermatocutâneas, por exemplo, já foi descrita previamente.4 As crianças/adolescentes com lesões mucocutâneas, contudo, podem apresentar maior risco de anormalidades coronarianas, especialmente entre os que manifestam características da SK típica ou atípica.23
A alteração em exames de ureia e creatinina e a presença elevada de oligúria entre os casos de SIM-P que evoluíram a óbito indicam que a falência renal parece ter papel importante no curso clínico dos casos graves. O diagnóstico de SIM-P já foi previamente associado a crianças/adolescentes internados por COVID-19 que apresentaram lesão renal aguda.16 A alteração de ureia também é preditora de gravidade para pneumonia, sobretudo na presença de sepse, e pode decorrer da administração de medicamentos como corticoides, assim como do acometimento de múltiplos órgãos, resultante do quadro inflamatório multissistêmico.25
Os comprometimentos respiratório e renal encontrados neste estudo podem estar relacionados à combinação de choque hipovolêmico e hiperinflamatório. Ainda que a fisiopatogenia da SIM-P não esteja completamente elucidada, acredita-se que a falência de múltiplos órgãos ocorra devido à resposta imune tardia exacerbada, e não necessariamente à ação direta do vírus sobre os tecidos.5
As complicações do sistema circulatório/hemodinâmico têm-se mostrado mais frequentes na SIM-P do que na SK e, embora haja risco de sequelas, vem sendo observado um bom prognóstico.18 Tais complicações também foram observadas em desfechos graves e fatais da COVID-19 em adultos, e podem estar associadas ao comprometimento do miocárdio em decorrência do fenômeno conhecido como ‘tempestade de citocinas’, assim como a progressão da insuficiência respiratória aguda.18 Alterações em biomarcadores de função cardíaca e reação hiperinflamatória têm sido relatados como preditores de gravidade para SIM-P, porém não foram incluídos no estudo de associação aos óbitos devido à ausência de dados.18
No Brasil, a terapêutica utilizada nos casos de SIM-P foi variada, o que pode estar relacionado a manifestações fisiopatológicas inespecíficas, ausência de prognóstico claro e possibilidade de risco de vida.15 Todavia, não existe tratamento para SIM-P padronizado na literatura;5 protocolos terapêuticos foram propostos, baseados em guias de manejo clínico para outras síndromes inflamatórias com espectro clínico semelhante.5 O uso de imunoglobulina costuma ser o tratamento de primeira escolha,17 combinado ou não com o uso de corticoides nos casos moderados e graves; o uso de anticoagulantes é indicado em casos de eventos tromboembólicos, desempenhando importante papel na prevenção do choque.5 Os resultados encontrados sugerem que imunoglobulinas e anticoagulantes podem ter desempenhado fator protetor para o desfecho fatal; os resultados, contudo, não devem ser vistos como medidas de eficácia, dada a natureza observacional do estudo.
A letalidade da SIM-P no Brasil foi alta, quando comparada a séries de casos publicadas por outros países (aproximadamente, 1 a 2%),4 o que pode ser reflexo de diferenças na dinâmica de transmissão, na situação epidemiológica, na disponibilidade de recursos diagnósticos, na assistência prestada pelos serviços de saúde locais, bem como da subnotificação de casos mais leves.
O estudo apresenta outras limitações relacionadas à qualidade dos registros, como incompletude e não padronização. Tais limitações podem ter implicação na classificação dos casos confirmados, realizada a partir das variáveis preenchidas na notificação. Quanto a esse aspecto, destaca-se que todas as condições da definição de caso de SIM-P foram obrigatoriamente registradas entre os casos classificados confirmados; porém, nem sempre foi possível obter dados detalhados em variáveis subsequentes, como a realização de diagnósticos etiológicos diferenciais. O perfil clínico-epidemiológico apresentado e a seleção das variáveis para a análise da associação com o óbito também podem ter sofrido influência do sub-registro ou da ausência de variáveis na base, como raça/cor da pele, marcadores inflamatórios e de função cardíaca, e outras classes de medicamentos.
Destaca-se, ainda, que as perdas no modelo de regressão hierarquizado ocorreram por sub-registro de resultados laboratoriais e tratamento, o que pode ser consequência de acesso diferenciado a recursos diagnósticos e terapêuticos. Ademais, os resultados quantitativos dos marcadores laboratoriais não estão disponíveis nos registros de notificação, não sendo possível saber em qual estágio da síndrome obteve-se o resultado qualitativo alterado. A temporalidade das características clínicas e da administração dos medicamentos também não está estabelecida. Pelos motivos expostos, a interpretação e comparação dos achados de fatores associados aos óbitos deve ser encarada de forma exploratória, considerando-se, também, a possibilidade de confundimento residual.
Em contrapartida, o estudo apresenta a maior série de casos de SIM-P descrita no Brasil e foi o primeiro realizado com a base de dados do monitoramento nacional. Estudos futuros, sobre representatividade e qualidade dos dados, podem qualificar a interpretação dos resultados apresentados. Investigações adicionais, que estabeleçam a relação temporal entre manifestações clínicas, detalhamento de resultados laboratoriais e tratamento instituído, também se fazem necessárias, para melhor definição clínico-epidemiológica e de fatores associados aos óbitos.
O estudo também contribui para a compreensão dos sinais de gravidade da SIM-P, diante dos quais se recomenda assistência especializada, com participação conjunta de equipes multiprofissionais, terapêutica instituída oportunamente, acompanhamento da função renal e seguimento das crianças/adolescentes para detecção de possíveis sequelas, principalmente em relação ao acometimento cardíaco, sempre que possível.24 Também se destaca a importância de os profissionais da Assistência e da Vigilância Epidemiológica do SUS estarem sensibilizados e aptos a reconhecer, notificar e investigar diferentes espectros de manifestações clínicas da SIM-P, de forma a se aprimorar o entendimento da síndrome e a se favorecer o tratamento oportuno e o melhor prognóstico para as crianças e adolescentes acometidos pela COVID-19.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI

