Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde vol.30 no.esp1 Brasília 2021 Epub 28-Fev-2021
http://dx.doi.org/10.1590/s1679-4974202100009.esp1
Consenso
Protocolo Brasileño para Infecciones de Transmisión Sexual 2020: infecciones que causan secreción uretral
1Ministério da Saúde, Secretaria de Vigilância em Saúde, Brasília, DF, Brasil
2Secretaria de Estado da Saúde de São Paulo, Programa Estadual de DST/Aids, São Paulo, SP, Brasil
3Universidade Federal do Estado do Rio de Janeiro, Campus Macaé, RJ, Brasil
4Secretaria de Estado da Saúde de Santa Catarina, Gerência Estadual de IST/Aids/HV, Florianópolis, SC, Brasil
El artículo trata de las infecciones que causan secreción uretral, tema que hace parte del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a Personas con Infecciones de Transmisión Sexual, publicado por el Ministerio de Salud de Brasil en 2020. Dicho documento se elaboró con base en evidencias científicas y se validó en discusiones con expertos. Las uretritis, cuando no tratadas correctamente o cuando el microorganismo desarrolla resistencia al tratamiento, puede ocasionar daños graves a la salud. Los niveles de resistencia antimicrobiana que estos agentes desarrollan son considerados una emergencia de salud pública. En este artículo, se presentan aspectos epidemiológicos y clínicos, recomendaciones para el diagnóstico y tratamiento y estrategias para acciones de monitoreo epidemiológico, prevención y control de las infecciones que causan secreción uretral, a fin de contribuir con gestores y personal de salud para la cualificación de la asistencia.
Palabras clave: Uretritis; Neisseria gonorrhoeae; Chlamydia trachomatis; Protocolos Clínicos; Salud Pública
Presentación
El artículo enfoca las infecciones que causan secreción uretral, tema que consta del Protocolo Clínico y Directrices Terapéuticas (PCDT) para Atención Integral a las Personas con Infecciones de Transmisión Sexual (ITS), publicado por la Secretaría de Vigilancia en Salud, del Ministerio de Salud de Brasil. Para la elaboración del PCDT, se realizaron la selección y el análisis de las evidencias disponibles en la literatura y un debate en un panel de especialistas. El referido PCDT fue aprobado por la Comisión Nacional de Incorporación de Tecnologías en el Sistema Único de Salud (Conitec)1 y actualizado por el grupo de especialistas en ITS en 2020.
Aspectos epidemiológicos
La uretritis se define como una inflamación de la uretra, que puede ser infecciosa o no. Varios agentes pueden causar uretritis infecciosa en el contexto de prácticas sexuales sin preservativos. Las uretritis se clasifican, según el agente etiológico, en gonocócicas, causada por Neisseria gonorrhoeae, y no gonocócica, causada principalmente por Chlamydia trachomatis y Mycoplasma genitalium. Otros agentes, como Trichomonas vaginalis, enterobacterias (en el coito anal insertivo), el virus del herpes simple (HSV), adenovirus y Candida sp. son menos frecuentes.2 3
Los factores asociados con la uretritis son: edad joven, nivel socioeconómico bajo, parejas múltiples o nuevas parejas sexuales, antecedentes de ITS y uso irregular de condones, así como la falta de acceso a un diagnóstico y tratamiento adecuados. 2 3
La Organización Mundial de la Salud (OMS), mediante un estudio de revisión sistemática, estimó para 2016, la aparición de 370,4 millones de nuevas infecciones urogenitales curables por clamidia, gonorrea y tricomoniasis en mujeres y hombres entre 15 y 49 años.4 La tasa de incidencia general de clamidia en 2016 fue de 34 casos por 1000 mujeres y 33 casos por 1000 hombres; gonorrea, 20 casos por 1000 mujeres y 26 casos por 1000 hombres; y, de tricomoniasis, 40 casos por 1000 mujeres y 42 casos por 1000 hombres.4 Una revisión sistemática y un estudio de metanálisis sobre la prevalencia de M. genitalium, que incluyó tres estudios con un total de 3.809 personas, estimó una prevalencia de 1,3% de este agente en países desarrollados y 3,9% en países en desarrollo. La prevalencia fue similar en hombres y mujeres.5 El análisis del sistema europeo de vigilancia de enfermedades transmisibles encontró que, en 2018, de los 17 países que recopilaron datos sobre el modo de transmisión de la gonorrea, el 48% de todos los casos confirmados y notificados ocurrieron en hombres que tienen sexo con hombres.6
En Brasil, el escenario epidemiológico de infecciones que causan secreción uretral acompaña las altas tasas mundiales. Se estima que la prevalencia de gonorrea en la población de 15 a 49 años es aproximadamente del 1,4% y que la incidencia en la población general ronda los 500.000 casos nuevos por año.7
En cuanto al riesgo de transmisión de agentes infecciosos, se verifica que N. gonorrhoeae se transmite del hombre infectado a la mujer, con una probabilidad que puede variar del 50% al 73%, independientemente del número de exposiciones. La probabilidad de que un hombre se infecte con una mujer infectada varía del 20% al 35% en una sola exposición.8 El sexo oral sin protección resulta en infección alrededor del 25% de las veces, ya que la faringe es uno de los mayores reservorios asintomáticos del patógeno.9
En el caso de C. trachomatis, la probabilidad de que un hombre contraiga la infección de una mujer es del 32% y de que la mujer contraiga la infección del hombre, del 40%; esta proporción de transmisión se refiere al contacto con una pareja infectada a través de relaciones sexuales sin protección.10 Aunque está bien establecido que M. genitalium se transmite sexualmente, no se sabe cuántas veces esto ocurre debido a un episodio de relaciones sexuales sin protección.11 Los estudios sugieren que la transmisión de M. genitalium es probablemente menor que la de C. trachomatis, lo que sería consistente con la carga infecciosa de estos agentes. Es probable que los hombres con uretritis no gonocócica sintomática y, presumiblemente, mayores cargas de M. genitalium sean más infecciosos que los hombres con infección asintomática.12 13
El riesgo de que los hombres se infecten con parejas infectadas con T. vaginalis varía del 22% al 72%. Teniendo en cuenta que existe contaminación hasta en un 5% de las personas que informan haber tenido sexo anal receptivo reciente, es necesario aclarar si el recto puede ser un reservorio de la infección por T. vaginalis.14 Según el Centro de Control y Prevención de Enfermedades de los Estados Unidos (Centers for Disease Control and Prevention, CDC), las pruebas rectales y orales para T. vaginalis no se recomiendan debido a la falta de evidencia de estas infecciones en estos lugares.
En la Figura 1 se presenta un resumen de los riesgos que ofrece cada agente infeccioso que causa secreción uretral.
Figura 1 Riesgo de transmisión de los agentes infecciosos causadores de secreciones uretrales en prácticas sexuales desprotegidas
| Agente infeccioso | Práctica sexual | Transmisión del hombre hacia la mujer | Transmisión de la mujer hacia el hombre | Referencia |
|---|---|---|---|---|
| Neisseria gonorrhoeae | Relación sexual | 50% a 73% | 20% a 35% | [8] |
| Sexo oral | 25% | 25% | [9] | |
| Chlamydia trachomatis | Relación sexual | 40% | 32% | [10] |
| Trichomonas vaginalis | Relación sexual | No hay información | 22% a 72% | [14] |
Aspectos clínicos
La secreción uretral es un síndrome clínico, con la identificación de un grupo de síntomas y signos comunes a determinadas infecciones, caracterizado por una secreción que varía de mucoide a purulenta, con volumen variable, y puede estar asociada a dolor uretral (independientemente de la micción), disuria, estranguria (micción lenta y dolorosa), prurito uretral y eritema del meato uretral. El aspecto de la secreción uretral purulenta corresponde al 75% de las uretritis por N. gonorrhoeae y del 11 al 33% de las uretritis no gonocócicas; a su vez, el aspecto mucoide aparece en alrededor del 25% de los casos de uretritis gonocócica y en el 50% de los casos de uretritis no gonocócica.
La uretritis gonocócica es un proceso infeccioso e inflamatorio de la mucosa uretral. Después del período de incubación, que dura un promedio de dos a cinco días, variando de uno a diez días, la infección progresa sintomáticamente. Se entiende por disuria la sensación de hormigueo y picazón intrauretral seguida de dolor al orinar. La secreción, inicialmente mucoide, se vuelve purulenta en uno o dos días, con gran volumen y acompañada de edema del meato uretral. Algunos hombres pueden experimentar fiebre, así como manifestaciones de una infección sistémica aguda. Aproximadamente el 95% de los casos se vuelven asintomáticos en tres meses y una proporción de los casos no tratados puede progresar a la curación espontánea en algunas semanas.15
Las complicaciones clínicas por falta de tratamiento inmediato ocurren hasta en el 50% de los casos, debido a la progresión de la infección a la uretra posterior. La epididimitis aguda constituye la complicación más frecuente, que puede evolucionar con obstrucción del conducto epididimario, determinando oligospermia, azoospermia y esterilidad. Otras consecuencias de la uretritis gonocócica son: prostatitis, orquitis, edema de pene (en particular del prepucio), balanopostitis, y también lesiones de las glándulas sebáceas y acinosas de la región genital, tysonitis (glándulas de Tyson), cauperitis (glándulas de Cowper) y littritis (glándulas de Littré).15
La uretritis no gonocócica es una uretritis sintomática cuya bacterioscopia por tinción de Gram, cultivo y detección de material genético por biología molecular son negativas para gonococos. La infección por clamidia en los hombres es responsable de aproximadamente el 50% de los casos de uretritis no gonocócica. El período de incubación en humanos es de 14 a 21 días. Se estima que dos tercios de las parejas estables de hombres con uretritis no gonocócica albergan C. trachomatis en el endocérvix, pudiendo así reinfectar a sus parejas sexuales y desarrollar la enfermedad pélvica inflamatoria si no se realiza ningún tratamiento.16-18
En los hombres, la uretritis no gonocócica suele caracterizarse por la presencia de secreción mucoide discreta, con disuria leve e intermitente. La uretritis subaguda es la forma de presentación en aproximadamente el 50% de los hombres con uretritis causada por C. trachomatis.19 Sin embargo, en algunos casos, la secreción de la uretritis no gonocócica puede simular, clínicamente, la de la gonorrea. La uretritis causada por C. trachomatis puede progresar a prostatitis, epididimitis, balanitis, conjuntivitis (por autoinoculación) y síndrome conjuntivo uretro sinovial o síndrome de Reiter.
Las mujeres con uretritis tienen disuria leve, que puede estar asociada con flujo vaginal o sangrado. La exploración física puede revelar la presencia de cervicitis mucopurulenta o incluso lesiones vulvovaginales herpéticas.20
En los casos de uretritis persistente, la evaluación debe realizarse principalmente a través de la historia clínica, considerando la posibilidad de reinfección o tratamiento inadecuado para clamidia y gonorrea. Desechadas tales situaciones, deben investigarse los agentes no susceptibles a un tratamiento previo (por ejemplo, M. genitalium y T. vaginalis), así como la ocurrencia de resistencia a los antimicrobianos.2
Otras causas no infecciosas de uretritis, como trauma (ordeño continuado), instrumentalización, inserción de cuerpos extraños intrauretrales o parauretrales (piercings) e irritación química (uso de productos lubricantes y espermicidas) deben ser consideradas en el diagnóstico diferencial de uretritis persistentes.2
Diagnóstico
El manejo de la secreción uretral se puede realizar a través del abordaje sindrómico para situaciones en las que no hay soporte de laboratorio2 21 22 (Figura 2). Para los casos de secreción uretral masculina, se estima que el abordaje sindrómico tiene una sensibilidad que va del 84% al 95%.23

Fuente: adaptado del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a las Personas con Infecciones de Transmisión Sexual, 2020.2
Notas: a) Existen kits de biología molecular que detectan más patógenos simultáneamente, además de clamidia y gonococo, y que también son útiles para el diagnóstico etiológico de uretritis, como M. genitalium; b) Esquema terapéutico también contempla tratamiento para M. genitalium.
Figura 2 Recomendaciones para atención a las personas con queja de secreción uretral
El uso de pruebas diagnósticas está indicado para el rastreo de casos asintomáticos de uretritis y para la investigación de casos sintomáticos.2 El buen desempeño de las pruebas depende del estricto cumplimiento de todos los pasos recomendados por los fabricantes, incluida la recolección, transporte y almacenamiento de las muestras. 24
El cribado de los casos asintomáticos de uretritis debe realizarse mediante técnicas de biología molecular, que incluyen métodos con alta sensibilidad y especificidad, como la reacción en cadena de la polimerasa y la amplificación mediada por transcripción. Estas pruebas, que se basan en la prueba de amplificación de ácidos nucleicos (nucleic acid amplification test, NAAT), permiten el uso de muestras de secreción uretral masculina u orina, o ambos tipos de muestra, y la identificación de uno o más patógenos simultáneamente en una muestra única, según el fabricante. Los resultados se emiten discriminando los patógenos detectados.24-27
Para el diagnóstico de la uretritis sintomática, se pueden realizar varias pruebas para ayudar en la identificación del agente causador.2 Los métodos de bacterioscopia, cultivo y biología molecular, están incorporados al Sistema Único de Salud (SUS) brasileño, disponibles de forma heterogénea en los distintos niveles de atención de los servicios de salud.
En la uretritis gonocócica es posible visualizar, mediante bacterioscopia, diplococos gram negativos intracelulares en leucocitos polimorfonucleares. El método tiene alta sensibilidad y especificidad en muestras de secreción uretral masculina.2 24 27 El cultivo de muestras en medios selectivos (por ejemplo, Thayer-Martin o similar) es una técnica con buena sensibilidad y alta especificidad para el diagnóstico de N. gonorrhoeae, siempre que se utilice con rigor metodológico.27
En definitiva, se cultivan las muestras biológicas en medios de cultivo que favorezcan el crecimiento de Neisseria sp. Dado que el medio de cultivo también permite el crecimiento de otras especies del género Neisseria, es importante realizar el Gram de las colonias típicas (visualización de diplococos Gram negativos) y pruebas de oxidasa y catalasa, que deben arrojar resultados positivos cuando se trate de N. gonorrhoeae. Para el diagnóstico definitivo, las colonias pueden ser sometidas a pruebas bioquímicas (manuales o automatizadas), ya que el comportamiento particular de las bacterias en presencia de diferentes sustratos permite la identificación de especies de Neisseria.2 28 29 El cultivo también permite la investigación del perfil de susceptibilidad del gonococo a los antimicrobianos, mediante técnicas para la determinación de la concentración mínima inhibitoria, y es de gran utilidad para fines de vigilancia y para establecer pautas de tratamiento.24 29 Además de la bacterioscopia y el cultivo, están disponibles en el SUS las técnicas de biología molecular, como los NAAT, que tienen un óptimo desempeño para el diagnóstico etiológico de la uretritis sintomática y están muy recomendadas en el tratamiento etiológico de la secreción uretral.
En ausencia de los métodos citados, es posible utilizar pruebas que sugieren presencia de infección, aunque no definen el agente infeccioso, como la prueba positiva de esterase leucocitaria en el primer flujo de orina o el examen microscópico de sedimento urinario del primer flujo presentando más de diez leucocitos polimorfonucleares por campo (aumento de 1.000 veces).2
Tratamiento
El tratamiento recomendado de la uretritis puede depender o no del soporte de laboratorio.2 En presencia de un síntoma de secreción uretral, luego de anamnesis y exploración física, con secreción uretral confirmada, si no hay soporte de laboratorio (uretritis sin identificación del agente etiológico), está indicado el tratamiento de la clamidia y la gonorrea con azitromicina 1 g, oral (VO), dosis única, y ceftriaxona 500 mg, intramuscular (IM), dosis única. Ante la posibilidad de una bacterioscopia (Gram), con visualización de diplococos gram negativos intracelulares, la gonorrea y la clamidia deben tratarse como se describe anteriormente (ceftriaxona 500 mg, IM, dosis única, y azitromicina 1 g, VO, dosis única); la presencia de diplococos gram negativos intracelulares indica infección gonocócica, pero no excluye la posibilidad de infección por clamidia. En ausencia de estos hallazgos, se debe tratar solo la clamidia con azitromicina 1 g, VO, dosis única. Siempre que sea posible recolectar material biológico para cultivo o biología molecular en el laboratorio, eso debe ocurrir en la primera consulta. El tratamiento debe instituirse de inmediato y los resultados de las pruebas se pueden analizar en la visita de retorno.2
Es de destacar que, con base en los resultados del Proyecto SenGono 2015-2017 (descrito en el subtema Resistencia a los antimicrobianos), la guía de tratamiento brasileña recomienda a nivel nacional la doble terapia de ceftriaxona 500 mg, IM, dosis única, asociada a azitromicina 1 g, VO, dosis única, para la infección gonocócica anogenital no complicada (uretra, cuello uterino y recto).2
Después de siete días de tratamiento, se debe garantizar una consulta para la reevaluación de signos y síntomas y entrega de resultados de cultivos o pruebas de biología molecular, o ambas, cuando se realicen. La remisión de la sintomatología caracteriza la curación. Cuando los síntomas persisten, es importante excluir reinfección, tratamiento inadecuado para clamidia y gonorrea, resistencia a los antimicrobianos (principalmente relacionada al gonococo y M. genitalium), traumatismos, irritación química o inserción de cuerpos extraños. Como complemento, T. vaginalis debe tratarse con 250 mg de metronidazol, dos tabletas, VO, dos veces al día, durante siete días, y analizar los resultados de la prueba para evaluar la necesidad de instituir un nuevo tratamiento según el hallazgo. Se debe programar cita de reevaluación a los siete días, con determinación de alta en ausencia de signos y síntomas, y derivación a servicios especializados, en la persistencia de estos. Las opciones de tratamiento para la uretritis se muestran en la Figura 3.2
Figura 3 Tratamiento de uretritis
| Condición clínica | Primera opción | Segunda opción | Observaciones |
|---|---|---|---|
| Uretritis sin identificación del agente etiológicoa,b | Ceftriaxona 500 mg, intramuscular (IM), dosis única más azitromicina 500 mg, 2 comprimidos, vía oral (VO), dosis única | Ceftriaxona 500 mg, IM, dosis única más doxiciclina 100 mg, 1 comprimido, VO, 2x/día, por 7 días | |
| Uretritis gonocócica y demás infecciones gonocócicas NO complicadas (uretra, cuello del útero, recto y faringe)a,b | Ceftriaxona 500 mg, IM, dosis única más azitromicina 500 mg, 2 comprimidos, VO, dosis única | ||
| Uretritis no gonocócicab | Azitromicina 500 mg, 2 comprimidos, VO, dosis única | Doxiciclina 100 mg, 1 comprimido, VO, 2x/día, por 7 días | La resolución de los síntomas puede llevar hasta 7 días luego de la conclusión de la terapia. |
| Uretritis por clamidiab | Azitromicina 500 mg, 2 comprimidos, VO, dosis única | Doxiciclina 100 mg, 1 comprimido, VO, 2x/día, por 7 días | La resolución de los síntomas puede llevar hasta 7 días luego de la conclusión de la terapia. |
| Retratamiento de infecciones gonocócicasb | Ceftriaxona 500 mg, IM, dosis única más azitromicina 500 mg, 4 comprimidos, VO, dosis única | Gentamicina 240 mg, IM más azitromicina 500 mg, 4 comprimidos, VO, dosis única | Para casos de falla de tratamiento. Posibles reinfecciones deben ser tratadas con las dosis habituales. |
| Uretritis por Mycoplasma genitaliumb | Azitromicina 500 mg, 2 comprimidos, VO, dosis única | ||
| Uretritis por Trichomonas vaginalisb | Metronidazol 250 mg, 2 comprimidos VO, 2x/día, por 7 días | Clindamicina 300 mg, VO, 2x/día, por 7 días | |
| Infección gonocócica diseminada (excepto meningitis y endocarditis) | Ceftriaxona 1 g IM o IV al día, completando al menos 7 días de tratamiento más azitromicina 500 mg, 2 comprimidos, VO, dosis única | ||
| Conjuntivitis gonocócica en el adulto | Ceftriaxona 1 g, IM, dosis única |
Fuente: adaptado del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a las Personas con Infecciones de Transmisión Sexual, 2020.13
Notas: a) Si hubiera alergia grave a las cefalosporinas, indicar azitromicina 500 mg, cuatro comprimidos, vía oral, dosis única (dosis total: 2 g); b) Los casos y las parejas deben abstenerse de relaciones sexuales desprotegidas hasta que tratamiento de ambos esté completo (o sea, después del término del tratamiento con múltiples dosis o por siete días después de la terapia con dosis única).
Vigilancia, prevención y control
Las ITS se encuentran entre los problemas de salud pública más comunes en Brasil y en todo el mundo. La atención primaria de salud es el punto de partida para atender las ITS, con prevención, diagnóstico, tratamiento oportuno y adecuado y derivación de los casos que no competen a este nivel de atención. Para posibilitar la atención integral, es fundamental que los servicios estén organizados para promover el acceso a otros niveles de atención, cuando sea necesario.30
La anamnesis, la identificación de diferentes vulnerabilidades y la exploración física son elementos importantes en el abordaje de las personas con ITS. Para garantizar la calidad de la atención, la adhesión al tratamiento y la permanencia en el servicio de salud, el profesional de la salud necesita establecer una relación de confianza con la persona con ITS, asegurando la privacidad y la confidencialidad de las informaciones.
Es importante que el profesional esté disponible para el diálogo y brinde información sobre educación en salud, abordando temas como agentes causales de ITS, posibles formas de transmisión, prevención, diagnóstico e importancia de la adhesión al tratamiento, además de definir una estrategia de seguimiento, atención a parejas sexuales y acceso a insumos de prevención.31
La prevención y el control de las ITS que causan uretritis incluyen el uso correcto de condones durante las relaciones sexuales; detección y pruebas periódicas de personas asintomáticas, realizadas en poblaciones específicas; investigación y manejo de casos sintomáticos; institución de tratamiento inmediato, cuando esté indicado; y tratamiento de las parejas sexuales. El tratamiento, además de tener una función curativa, también tiene como objetivo interrumpir la cadena de transmisión y prevenir las complicaciones derivadas de la uretritis.2 31
El cribado de gonococos y clamidia en personas asintomáticas está indicado en las siguientes situaciones: gestantes menores de 30 años, en la primera consulta prenatal; personas que viven con el VIH en el momento del diagnóstico de la infección por el VIH; personas con indicación de profilaxis después de la exposición al VIH; personas con ITS en el momento del diagnóstico; personas que sufrieron violencia sexual, en la primera visita y en el servicio de cuatro a seis semanas después; personas con práctica sexual anal receptiva (pasiva) sin usar condón; y personas que usan profilaxis previa a la exposición al VIH cada seis meses.2
Para interrumpir la cadena de transmisión de las ITS es fundamental que los contactos sexuales de las personas infectadas sean tratados, incluso cuando sean asintomáticos.3 Por lo tanto, esta información debe ser transmitida a la persona con ITS, al mismo tiempo que se le brindan las herramientas de comunicación y apoyo hasta el final de la atención. Debe garantizarse la confidencialidad, la ausencia de coacción y la protección contra la discriminación.2
En los hombres con síntomas de infección gonocócica, C. trachomatis o M. genitalium, es necesario examinar y tratar todas las parejas sexuales durante las ocho semanas anteriores. En casos asintomáticos, esto se aplica a todas las parejas sexuales en los últimos seis meses.3
Las uretritis no son agravamientos de notificación obligatoria nacional; sin embargo, el síndrome de secreción uretral es de notificación obligatoria en algunos estados brasileños. Además, el Ministerio de Salud de Brasil publicó una resolución32 que instituye sitios para vigilancia centinela del síndrome de secreción uretral masculino, lo que deben suministrar informaciones para la construcción de datos epidemiológicos oficiales. Además, el objetivo es fortalecer acciones de prevención de ITS que causan secreciones uretrales, subsidiar recomendaciones nacionales para el tratamiento del síndrome, monitorear la susceptibilidad de gonococos a los antimicrobianos junto al Proyecto SenGono e investigar los agentes causadores de úlceras genitales y la resistencia de M. genitalium a los antimicrobianos.33
Resistência aos antimicrobianos
A lo largo de la historia de la antibioticoterapia, la N. gonorrhoeae desarrolló progresiva resistencia a los antibióticos, desde las sulfonamidas hasta las fluorquinolonas. Tras la propagación de la resistencia al ciprofloxacino, las cefalosporinas de tercera generación han sido la base del tratamiento, en asociación con la azitromicina. La aparición de la gonorrea resistente a las cefalosporinas tendrá un impacto negativo en la capacidad de los profesionales para tratar eficazmente la gonorrea. Las cepas de gonococo consideradas multidrogorresistentes y extensivamente resistentes a los fármacos, ya se encuentran en América, Asia, varios países europeos y Oceanía.34-37 Es, por lo tanto, esencial monitorear continuamente la resistencia a los antibióticos y fomentar la investigación y el desarrollo de nuevos esquemas de tratamiento.38 39
La OMS, en el “Informe de Vigilancia Global de Infecciones de Transmisión Sexual 2018”, prioriza el control de las infecciones gonocócicas debido a la posibilidad inminente de convertirse en infecciones no tratables.40 41 Brasil es uno de los países miembros del programa de vigilancia mundial de la susceptibilidad del gonococo a antimicrobianos (Gonococcal Antimicrobial Surveillance Programme, GASP).42 Las actividades del GASP en Brasil se desarrollan en el ámbito del Proyecto SenGono, resultado de la cooperación entre el Ministerio de Salud, el Laboratorio de Referencia Nacional (Laboratorio de Biología Molecular, Microbiología y Serología de la Universidad Federal de Santa Catarina) y los sitios centinela distribuidos en todas las regiones del país (Figura 4).33
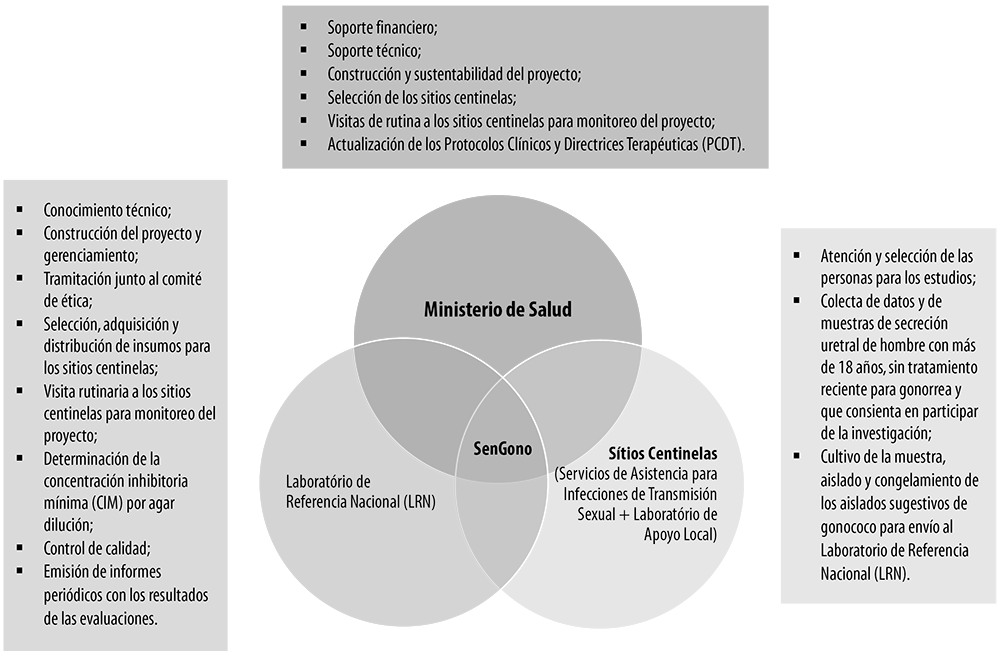
Fuente: adaptado del Boletín Epidemiológico nº 27/2020, del Ministerio de Salud.32
Figura 4 Funciones del Ministerio de Salud, del Laboratorio de Referencia Nacional y de los Sitios Centinelas en el ámbito del Proyecto SenGono
En la primera edición, realizada entre 2015 y 2017, se constató una alta resistencia al ciprofloxacino, con proporciones cercanas e incluso superiores al 50% en todas las regiones del país, y altas proporciones de susceptibilidad a las cefalosporinas de tercera generación (cefixima y ceftriaxona).26
La vigilancia realizada en el Proyecto SenGono formó parte del “Plan Nacional de Combate a la Resistencia a los Antimicrobianos 2019-2023”, y se encuentra en su segunda edición (2018-2020), con la ampliación a nuevos sitios centinela y evaluación de la susceptibilidad del gonococo a dos nuevos antimicrobianos (espectinomicina y gentamicina). Además, este tema incluía determinar la etiología de la secreción uretral masculina e investigar la resistencia de M. genitalium a los antimicrobianos.33
El M. genitalium se identificó por primera vez en 1980 y se reconoció como una causa importante de uretritis no gonocócica.25 43-45 Debido a que no tienen una pared celular, los antibióticos como los betalactámicos (incluidas las penicilinas y las cefalosporinas) no son eficaces.29 La introducción de la azitromicina, utilizada como terapia de dosis única para las infecciones por clamidia, resultó en la eliminación de M. genitalium del tracto urogenital, eliminando el patógeno sin el desarrollo de la enfermedad.25 43 46-50 Sin embargo, estudios recientes indican una tendencia al aumento en la prevalencia de infecciones por M. genitalium resistentes a macrólidos (resistencia transmitida) y casos de resistencia inducida después del tratamiento con azitromicina.3 43 50 No hay evidencia de que un régimen prolongado con azitromicina (1,5 g) sea superior al régimen 1 g en una sola dosis.51 El moxifloxacino sigue siendo muy activo contra la mayoría de M. genitalium resistentes a macrólidos. Sin embargo, se han publicado los primeros casos clínicos de fracaso del tratamiento con moxifloxacino.3 28 43 44 50-53 Por lo tanto, M. genitalium es un problema emergente, que requiere vigilancia frecuente y estudios con nuevas opciones de diagnóstico y tratamiento27.
El aumento de la resistencia, en las últimas décadas, refuerza la importancia del diagnóstico etiológico y la elección de tratamientos adecuados. En 2016, la Asamblea Mundial de la Salud adoptó la “Estrategia del sector de salud global sobre infecciones de transmisión sexual, 2016-2021”.38 Esa estrategia incluye la rápida expansión de intervenciones y servicios basados en evidencias para eliminar las ITS como preocupación de salud pública hasta 2030.
Agradecimiento
Los autores agradecen a los miembros del grupo técnico de especialistas responsables por la elaboración del PCDT para Atención Integral a las Personas con ITS en 2020 por la contribución substancial para la realización de este trabajo.
REFERENCIAS
1. Brasil. Ministério da Saúde. Portaria MS/SCTIE nº 42, de 5 de outubro de 2018. Torna pública a decisão de aprovar o Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis (IST), no âmbito do Sistema Único de Saúde - SUS. [Internet]. Diário Oficial da União, Brasília (DF), 2018 out 8 [citado 2020 jun 28]; Seção 1:88. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/sctie/2018/prt0042_08_10_2018.html [ Links ]
2. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Protocolo clínico e diretrizes terapêuticas para atenção integral às pessoas com infecções sexualmente transmissíveis (IST) [Internet]. Brasília: Ministério da Saúde; 2020 [citado 2020 out 13]. 131p. Disponível em: http://www.aids.gov.br/pt-br/pub/2015/protocolo-clinico-e-diretrizes-terapeuticas-para-atencao-integral-pessoas-com-infeccoes [ Links ]
3. Buder S, Schöfer H, Meyer T, Bremer V, Kohl PK, Skaletz-Rorowski A, Brockmeyer N. Bacterial sexually transmitted infections. JDDG: J Deutsch Dermatol Gesellschaft [Internet]. 2019 Mar [cited 2020 Oct 13]; 17(3):287-315. Available from: https://doi.org/10.1111/ddg.13804 [ Links ]
4. Rowley J, Vander Hoorn S, Korenromp E, Low N, Unemo M, Abud-Raddad L, et al. Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016. Bull World Health Organ [Internet]. 2019 Aug [cited 2020 Jun 28]; 97(8):548-62. Available from: https://dx.doi.org/10.2471%2FBLT.18.228486 [ Links ]
5. Baumann L, Cina M, Egli-Gany D, Goutaki M, Halbeisen FS, Lohrer G, et al. Prevalence of Mycoplasma genitalium in different population groups: systematic review andmeta-analysis. Sex Transm Infect [Internet]. 2018 Jun [cited 2020 Jun 28]; 94(4):255-62. Available from: https://doi.org/10.1136/sextrans-2017-053384 [ Links ]
6. European Centre for Disease Prevention and Control - ECDC. Gonorrhoea: annual epidemiological report for 2018 [Internet]. Stockholm: ECDC; 2019 [cited 2020 Oct 13]. 8 p. Available from: https://www.ecdc.europa.eu/sites/default/files/documents/gonorrhoea-annual-epidemiological-report-2018.pdf [ Links ]
7. Ministério da Saúde (BR). Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Ceftriaxona 500mg para tratamento da Neisseria gonorrhoeae resistente à ciprofloxacina: relatório de recomendação n. 154 [Internet]. Brasília: Ministério da Saúde; 2015 [citado 2020 out 13]. 29 p. Disponível em: http://conitec.gov.br/images/Relatorios/2015/Relatorio_Ceftriaxona_Gonorreia_final.pdf [ Links ]
8. Edwards JL, Apicella MA. The molecular mechanisms used by Neisseria gonorrhoeae to initiate infection differ between men and women. Clin Microbiol Rev [Internet]. 2004 Oct [cited 2020 Jun 20]; 17(4):965-81. Available from: https://doi.org/10.1128/cmr.17.4.965-981.2004 [ Links ]
9. Fuchs W, Brockmeyer NH. Sexually transmitted infections. J Dtsch Dermatol Ges [Internet]. 2014 Jun [cited 2020 Oct 13]; 12(6):451-63. Available from: https://doi.org/10.1111/ddg.12310 [ Links ]
10. Tu W, Ghosh P, Katz BP. A stochastic model for assessing chlamydia trachomatis transmission risk using longitudinal observational data. J R Stat Soc Ser A Stat Soc [Internet]. 2011 Oct [cited 2020 Oct 13]; 174(4):975-89. Available from: https://doi.org/10.1111/j.1467-985x.2011.00691.x [ Links ]
11. Smieszek T, White PJ. Apparently-different clearance rates from cohort studies of mycoplasma genitalium are consistent after accounting for incidence of infection, recurrent infection, and study design. PLoS One [Internet]. 2016 Feb [cited 2020 Oct 13]; 11(2):e0149087. Available from: https://doi.org/10.1371/journal.pone.0149087 [ Links ]
12. Thurman AR, Musatovova O, Perdue S, Shain RN, Baseman JG, Baseman JB. Mycoplasma genitalium symptoms, concordance and treatment in high-risk sexual dyads. Int J STD AIDS [Internet]. 2010 Mar [cited 2020 Oct 13]; 21(3):177-83. Available from: https://doi.org/10.1258/ijsa.2009.008485 [ Links ]
13. Walker J, Fairley CK, Bradshaw CS, Tabrizi SN, Chen MY, Twin J, et al. The difference in determinants of Chlamydia trachomatis and Mycoplasma genitalium in a sample of young Australian women. BMC Infect Dis [Internet]. 2011 [cited 2020 Oct 13]; 11:35. Available from: https://dx.doi.org/10.1186%2F1471-2334-11-35 [ Links ]
14. Francis SC, Kent CK, Klausner JD, Rauch L, Kohn R, Hardick A, et al. Prevalence of rectal Trichomonas vaginalis and Mycoplasma genitalium in male patients at the San Francisco STD clinic, 2005-2006. Sex Transm Dis [Internet]. 2008 Sep [cited 2020 Jul 10]:35(9):797-800. Available from: https://dx.doi.org/10.1097%2FOLQ.0b013e318177ec39 [ Links ]
15. Penna GO, Hajjar LA, Braz TM. Gonorreia. Rev Soc Bras Med Trop [Internet]. 2000 out [citado 2020 jul 25]; 33(5):451-64. Disponível em: https://doi.org/10.1590/S0037-86822000000500007 [ Links ]
16. Gaydos C, Maldeis NE, Hardick A, Hardick J, Quinn TC. Mycoplasma genitalium compared to chlamydia, gonorrhoea and trichomonas as an aetiological agent of urethritis in men attending STD clinics. Sex Transm Infect [Internet]. 2009 Oct [cited 2020 Jul 25]; 85(6):438-40. Available from: https://doi.org/10.1136/sti.2008.035477 [ Links ]
17. Daley GM, Russell DB, Tabrizi SN, McBride J. Mycoplasma genitalium: a review. Int J STD AIDS [Internet]. 2014 Jun [cited 2020 Jul 25]:25(7):475-87. Available from: https://doi.org/10.1177/0956462413515196 [ Links ]
18. Lis R, Rowhani-Rahbar A, Manhart LE. Mycoplasma genitalium infection and female reproductive tract disease: a meta-analysis. Clin Infect Dis [Internet]. 2015 Aug [cited 2020 Oct 13]; 61(3):418-26. Available from: https://doi.org/10.1093/cid/civ312 [ Links ]
19. Brígido HAZ, Mourão JRM. Corrimentos uretrais. In: Leão RNQ (coord.), Bichara CNC, Fraiha NH, Vasconcelos PFC. Medicina tropical e infectologia da Amazônia. Belém: Samauma Editorial; 2013. p. 245-50. [ Links ]
20. Rimawi BH, Soper DE. Infectious diseases of the female reproductive and urinary tract. In: Hacker N, Gambone J, Hobel C. Hacker & Moore's essentials of obstetrics and gynecology [Internet]. Philadelphia: Elsevier; 2016 [cited 2020 Oct 13]. p. 276-90. Disponível em: http://med-mu.com/wp-content/uploads/2018/07/Hacker-Moore-s-Essentials-of-Obstetrics-and-Gynecology-6E-PDF-UnitedVRG-1-.pdf [ Links ]
21. Moherdaui F, Vuylsteke B, Siqueira LF, dos Santos Júnior MQ, Jardim ML, de Brito AM, et al. Validation of national algorithms for the diagnosis of sexually transmitted diseases in Brazil: results from a multicentre study. Sex Transm Infect [Internet]. 1998 Jun [cited 2020 Jun 5]; 74(Suppl 1):S38-43. Available from: https://pubmed.ncbi.nlm.nih.gov/10023352/. [ Links ]
22. Menezes Filho JR, Sardinha JCG, Galbán E, Saraceni V, Talhari C. Effectiveness of syndromic management for male patients with urethral discharge symptoms in Amazonas, Brazil. An Bras Dermatol [Internet]. 2017 Nov-Dec [cited 2020 Jun 3]; 92(6):779-84. Available from: https://doi.org/10.1590/abd1806-4841.20175453. [ Links ]
23. Wi TE, Ndowa FJ, Ferreyra C, Kelly-Cirino C, Taylor MM, Toskin I, et al. Diagnosing sexually transmitted infections in resource-constrained settings: challenges and ways forward. J Int AIDS Soc [Internet]. 2019 Aug [cited 2020 Jun 20]; 22(Suppl 6):e25343. Available from: https://doi.org/10.1002/jia2.25343. [ Links ]
24. World Health Organization - WHO. Laboratory diagnosis of sexually transmitted infections, including human immunodeficiency virus [Internet]. Geneva: World Health Organization; 2013 [cited 2020 Jun 20]. 228 p. Available from: https://apps.who.int/iris/bitstream/handle/10665/85343/9789241505840_eng.pdf;jsessionid=89BC7AF948F36261070A5DB66F3CF2BA?sequence=1 [ Links ]
25. Taylor-Robinson D. Diagnosis and antimicrobial treatment of Mycoplasma genitalium infection: sobering thoughts. Expert Rev Anti Infect Ther [Internet]. 2014 Jun [cited 2020 Oct 13]; 12(6):715-22. Available from: https://doi.org/10.1586/14787210.2014.919220 [ Links ]
26. Bazzo ML, Golfetto L, Gaspar PC, Pires AF, Ramos MC, Franchini M, et al. First nationwide antimicrobial susceptibility surveillance for Neisseria gonorrhoeae in Brazil, 2015-16. J Antimicrob Chemother [Internet]. 2018 Jul [cited 2020 Jun 12]; 73(7):1854-61. Available from: https://doi.org/10.1093/jac/dky090 [ Links ]
27. Unemo M, Seifert HS, Hook EW, Hawkes S, Ndowa F, Dillon JR. Gonorrhoea. Nat Rev Dis Primers 5 [Internet]. 2019 Nov [cited 2020 Jun 15]; 5(1):79. Available from: https://doi.org/10.1038/s41572-019-0136-6 [ Links ]
28. Murray GL, Bradshaw CS, Bissessor M, Danielewski J, Garland SM, Jensen JS, et al. Increasing macrolide and fluoroquinolone resistance in mycoplasma genitalium. Emerg Infect Dis [Internet]. 2017 May [cited 2020 Oct 13]; 23(5):809-12. Available from: https://dx.doi.org/10.3201%2Feid2305.161745 [ Links ]
29. Workowski KA, Bolan GA; Centers for Disease Control and Prevention - CDC. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep [Internet]. 2015 Jun [cited 2020 Jun 20]:64(RR-03):1-137. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5885289/. [ Links ]
30. Ministério da Saúde (BR). Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Cadernos de atenção básica: HIV/Aids, hepatites e outras DST [Internet]. Brasília: Ministério da Saúde; 2006 [citado 2020 out 13]. 196 p. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/abcad18.pdf . [ Links ]
31. Barberá, MJ , Serra-Pladevall J. Infección gonocócica: un problema aún sin resolver. Enferm Infecc Microbiol Clin [Internet]. 2019 Feb [cited 2020 Jun 3]; 37(7):458-66. Available from: https://doi.org/10.1016/j.eimc.2018.12.008. [ Links ]
32. Brasil. Ministério da Saúde. Portaria MS/GM nº 1.553, de 17 de junho de 2020. Altera a Portaria de Consolidação nº 5/GM/MS, de 28 de setembro de 2017, para instituir a Vigilância Sentinela da Síndrome do Corrimento Uretral Masculino (VSCUM) [Internet]. Diário Oficial da União , Brasília (DF), 2020 jun 18 [citado 2020 out 13]; Seção 1:61. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/gm/2020/prt1553_18_06_2020.html . [ Links ]
33. Ministério da Saúde (BR). Informe semanal sarampo - Brasil, semanas epidemiológicas 1 a 25, 2020. Bol Epidemiol [Internet]. 2020 Jul [citado 2020 out 13]; 51(27). Disponível em: https://antigo.saude.gov.br/images/pdf/2020/July/09/Boletim-epidemiologico-SVS-27-06.07.2020.pdf . [ Links ]
34. Allen VG, Mitterni L, Seah C, Rebbapragada A, Martin IE, Lee C, et al. Neisseria gonorrhoeae treatment failure and susceptibility to cefixime in Toronto, Canada. JAMA [Internet]. 2013 Jan [cited 2020 Jun 3]:309(2):163-70. Available from: https://doi.org/10.1001/jama.2012.176575. [ Links ]
35. Unemo M, Golparian D, Nicholas R, Ohnishi M, Gallay A, Sednaoui P. High-level cefixime- and ceftriaxone-resistant Neisseria gonorrhoeae in France: novel penA mosaic allele in a successful international clone causes treatment failure. Antimicrob Agents Chemother [Internet]. 2012 Mar [cited 2020 Jun 3]:56(3):1273-80. Available from: https://doi.org/10.1128/aac.05760-11 [ Links ]
36. Unemo M, Nicholas RA. Emergence of multidrug-resistant, extensively drug-resistant and untreatable gonorrhea. Future Microbiol [Internet]. 2012 Dec [cited 2020 Jun 3]:7(12):1401-22. Available from: https://doi.org/10.2217/fmb.12.117. [ Links ]
37. Lewis DA. Global resistance of Neisseria gonorrhoeae: when theory becomes reality. Curr Opin Infect Dis [Internet]. 2014 Feb [cited 2020 Jun 3]:27(1):62-7. Available from: https://doi.org/10.1097/qco.0000000000000025. [ Links ]
38. World Health Organization - WHO. Global health sector strategy on Sexually Transmitted Infections, 2016-2021 [Internet]. Geneva: World Health Organization; 2016 [cited 2020 Jun 10]. Available from: https://www.who.int/reproductivehealth/publications/rtis/ghss-stis/en /. [ Links ]
39. Centers for Disease Control and Precention - CDC. Antibiotic resistance threats in the United States, 2019. Atlanta, GA: U.S. Department of Health and Human Services, CDC; 2019 [cited 2020 Oct 13]. Available from: http://www.cdc.gov/DrugResistance/Biggest-Threats.html . [ Links ]
40. Tien V, Punjabi C, Holubar MK. Antimicrobial resistance in sexually transmitted infections. J Travel Med [Internet]. 2020 Feb [cited 2020 Jun 3]; 27(1):taz101. Available from: https://doi.org/10.1093/jtm/taz101. [ Links ]
41. World Health Organization - WHO. Report on global sexually transmitted infection surveillance [Internet]. Geneva: World Health Organization; 2018 [cited 2020 Jun 7]. Available from: https://www.who.int/reproductivehealth/publications/stis-surveillance-2018/en/ . [ Links ]
42. World Health Organization - WHO. The gonococcal antimicrobial surveillance programme (GASP) [Internet]. Geneva: World Health Organization; 2020 [cited 2020 Jun 15]. Available from: https://www.who.int/reproductivehealth/topics/rtis/gonococcal_resistance/en /. [ Links ]
43. Horner P, Blee K, Adams E. Time to manage Mycoplasma genitalium as an STI: but not with azithromycin 1 g!. Curr Opin Infect Dis [Internet]. 2014 Feb [cited 2020 Oct 13]; 27(1):68-74. Available from: https://doi.org/10.1097/qco.0000000000000030. [ Links ]
44. Manhart LE, Jensen JS, Bradshaw CS, Golden MR, Martin DH. Efficacy of antimicrobial therapy for mycoplasma genitalium infections. Clin Infec Dis [Internet]. 2015 Dec [cited 2020 Oct 13]; 61(Suppl 8):S802-17. Available from: https://doi.org/10.1093/cid/civ785. [ Links ]
45. Birger R, Saunders J, Estcourt C, Sutton AJ, Mercer CH, Roberts T, et al. Should we screen for the sexually-transmitted infection Mycoplasma genitalium? Evidence synthesis using a transmission-dynamic model. Sci Rep [Internet]. 2017 Nov [cited 2020 Oct 13]; 7(1):16162. Available from: https://dx.doi.org/10.1038%2Fs41598-017-16302-8. [ Links ]
46. Kikuchi M, Ito S, Yasuda M, Tsuchiya T, Hatazaki K, Takanashi M, et al. Remarkable increase in fluoroquinolone-resistant Mycoplasma genitalium in Japan. J Antimicrob Chemother [Internet]. 2014 Sep [cited 2020 Oct 13]; 69(9):2376-82. Available from: https://doi.org/10.1093/jac/dku164. [ Links ]
47. Salado-Rasmussen K, Jensen JS. Mycoplasma genitalium testing pattern and macrolide resistance: a Danish nationwide retrospective survey. Clin Infect Dis [Internet]. 2014 Jul [cited 2020 Oct 13]; 59(1):24-30. Available from: https://doi.org/10.1093/cid/ciu217. [ Links ]
48. Jensen JS, Bradshaw C. Management of mycoplasma genitalium infections - can we hit a moving target? BMC Infect Dis [Internet]. 2015 Aug [cited 2020 Oct 13]; 15:343. Available from: https://doi.org/10.1186/s12879-015-1041-6. [ Links ]
49. Sethi S, Zaman K, Jain N. Mycoplasma genitalium infections: current treatment options and resistance issues. Infect Drug Resist [Internet]. 2017 Sep [cited 2020 Oct 13]; 10:283-92. Available from: https://dx.doi.org/10.2147%2FIDR.S105469. [ Links ]
50. Bissessor M, Tabrizi SN, Twin J, Abdo H, Fairley CK, Chen MY, et al. Macrolide resistance and azithromycin failure in a Mycoplasma genitalium-infected cohort and response of azithromycin failures to alternative antibiotic regimens. Clin Infect Dis [Internet]. 2015 Apr [cited 2020 Oct 13]; 60(8):1228-36. Available from: https://doi.org/10.1093/cid/ciu1162. [ Links ]
51. Read TR, Fairley CK, Tabrizi SN, Bissessor M, Vodstrcil L, Chen MY, et al. Azithromycin 1.5g over 5 days compared to 1g single dose in urethral mycoplasma genitalium: impact on treatment outcome and resistance. Clin Infect Dis [Internet]. 2017 Feb [cited 2020 Oct 13]; 64(3):250-6. Available from: https://doi.org/10.1093/cid/ciw719. [ Links ]
52. Dionne-Odom J, Geisler WM, Aaron KJ, Waites KB, Westfall AO, Van Der Pol B, et.al. High prevalence of multidrug-resistant mycoplasma genitalium in human immunodeficiency virus-infected men who have sex with men in Alabama. Clin Infect Dis [Internet]. 2018 Feb [cited 2020 Oct 13]; 66(5):796-8. Available from: https://doi.org/10.1093/cid/cix853 [ Links ]
53. Gratrix J, Plitt S, Turnbull L, Smyczek P, Brandley J, Scarrott R, et al. Prevalence and antibiotic resistance of Mycoplasma genitalium among STI clinic attendees in western Canada: a cross-sectional analysis. BMJ Open [Internet]. 2017 Jul [cited 2020 Oct 13]; 7(7):e016300. Available from: https://doi.org/10.1136/bmjopen-2017-016300 [ Links ]
Recibido: 31 de Julio de 2020; Aprobado: 01 de Octubre de 2020











 texto em
texto em 


