Apresentação
O artigo aborda a infecção pelo papilomavírus humano (human papillomavirus, HPV), tema que compõe o Protocolo Clínico e Diretrizes Terapêuticas (PCDT) para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis (IST), publicado pela Secretaria de Vigilância em Saúde do Ministério da Saúde. Para a elaboração do PCDT, foram realizadas a seleção e a análise das evidências disponíveis na literatura e sua discussão, em um painel de especialistas. O documento foi aprovado pela Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec) e atualizado pelo grupo de especialistas do PCDT-IST em 2020.1
Aspectos epidemiológicos
O HPV é um DNA vírus de cadeia dupla, não encapsulado, membro da família Papillomaviridae. Ele infecta o epitélio escamoso e pode induzir a formação de uma grande variedade de lesões cutaneomucosas, sobretudo na região anogenital. São identificados mais de 200 tipos de HPV, dos quais aproximadamente 40 acometem o trato anogenital.2
A principal forma de transmissão do HPV é a atividade sexual de qualquer tipo, podendo ocorrer, inclusive, a deposição do vírus nos dedos por contato genital e a autoinoculação. Excepcionalmente, durante o parto, pode ocorrer a formação de lesões cutaneomucosas em recém-nascidos ou papilomatose recorrente de laringe. A transmissão por fômites é rara. Trata-se da IST de maior transmissibilidade, superior à das infecções pelo herpes genital e pelo vírus da imunodeficiência humana (human immunodeficiency virus, HIV).3 O risco geral estimado para a exposição à infecção pelo HPV é de 15% a 25% a cada nova parceria sexual.4 A maioria das pessoas sexualmente ativas devem ser infectadas em algum momento de sua vida. Mulheres no início da atividade sexual e que se mantiveram com uma única parceria apresentaram risco de contrair HPV de 28,5% ao final do primeiro ano e de 50% ao final do terceiro ano.4
Geralmente, as infecções são assintomáticas. Aproximadamente 1% a 2% da população infectada desenvolverá verrugas anogenitais e cerca de 2% a 5% das mulheres cursarão com alterações na colpocitologia oncótica. A prevalência da infecção é maior em mulheres com menos de 30 anos de idade, sendo que a grande maioria das infecções por HPV em mulheres (sobretudo nas adolescentes) tem resolução espontânea em um período aproximado de até 24 meses.5-7 A proporção de aquisição de uma nova infecção por HPV em mulheres diminui com a idade; já entre os homens, a proporção de adquirir nova infeção não se altera, permanecendo alta durante toda a vida. Entretanto, uma vez adquirida a infecção por HPV, sua duração média parece ser similar entre homens e mulheres.8 Estudo realizado em 26 capitais brasileiras e no Distrito Federal, que incluiu 6.387 mulheres com idade média de 21,6 anos, identificou prevalência de HPV de 53,6%.9
Aspectos clínicos
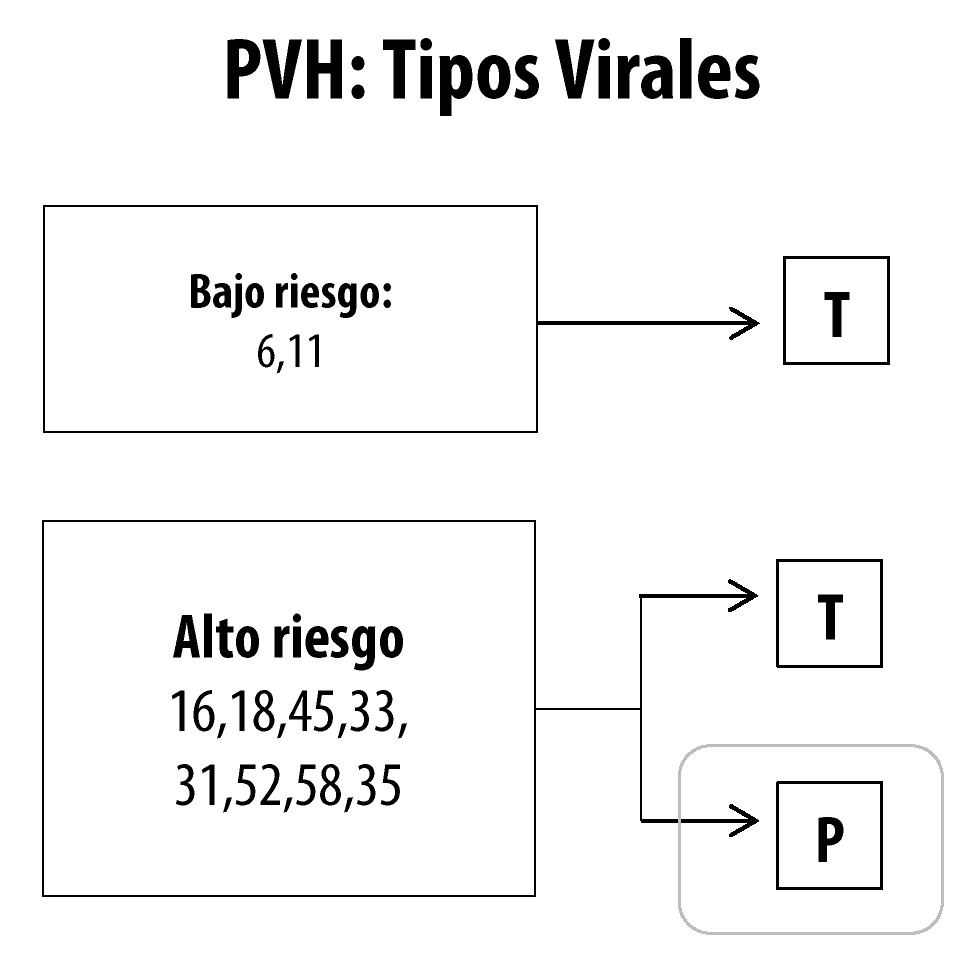
Os tipos de HPV que infectam o trato anogenital podem ser de baixo ou alto risco oncogênico. Os tipos que pertencem ao grupo de baixo risco (6, 11, 40, 42, 43, 44, 54, 61, 70, 72 e 81) ocorrem, frequentemente, em lesões benignas e lesões intraepiteliais escamosas de baixo grau. Os tipos de HPV do grupo de alto risco (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 e 82) ou oncogênicos estão frequentemente associados a lesões intraepiteliais escamosas de alto grau e aos carcinomas. É importante salientar que cerca de 85% das lesões de baixo grau contêm HPV do grupo oncogênico.10 A infecção por um determinado tipo viral não impede a infecção por outros tipos de HPV, podendo ocorrer infecções múltiplas. O tempo médio entre a infecção por HPV de alto risco e o desenvolvimento do câncer cervical é de, aproximadamente, 10 a 20 anos. Esse período varia de acordo com o tipo, a carga, a capacidade de persistência do vírus e o estado imunológico do hospedeiro. Algumas características individuais são fatores predisponentes ao aparecimento de lesões, tais como tabagismo, deficiências imunológicas (incluindo as decorrentes da infecção pelo HIV), desnutrição e cânceres, além do uso de medicamentos imunossupressores.11
Na maioria das pessoas, a infecção pelo HPV não produz qualquer manifestação clínica ou subclínica. O período de latência pode variar de meses a anos. A prevalência dos grupos virais de HPV de baixo e alto risco na população está demonstrada na Figura 1. Embora o grupo de alto risco seja mais prevalente (em torno de 80%), apenas 20% desses persistem, podendo causar lesões de alto grau com potencial de progressão para o câncer cervical. Os percentuais podem variar de acordo com a idade, região geográfica pesquisada, característica da população e metodologia. Além disso, existe um grupo de pessoas que apresenta, simultaneamente, infecção por HPV de ambos os grupos, de baixo e de alto risco (cerca de 30% dos infectados), não contemplado na Figura 1.12
Fonte: adaptado do Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis, 2020.1
Figura 1 Prevalência dos grupos virais do papilomavírus humano de baixo e alto risco oncogênico e capacidade de persistência no organismo humano (T: Transitórios; P: Persistentes)
As apresentações subclínicas do HPV podem ser detectadas pela citologia oncótica, por meio de lupas, corantes e da colposcopia, acompanhada ou não de biópsia. As lesões associadas a tipos virais de baixo risco oncogênico são, geralmente, lesões escamosas de baixo grau, equivalente ao do diagnóstico histopatológico de displasia leve ou neoplasia intraepitelial cervical (NIC) grau 1 (NIC 1). Já as lesões associadas a infecção por HPV de alto risco oncogênico são, em geral, associadas a lesões intraepiteliais escamosas de alto grau e ao diagnóstico histopatológico de neoplasia intraepitelial de grau 2 (NIC 2) ou 3 (NIC 3). Além da cérvice uterina, outros epitélios podem sofrer a ação oncogênica do vírus, originando neoplasias intraepiteliais vaginais, vulvares, perianais, penianas e anais.13
As manifestações clinicamente detectáveis induzidas pelo HPV são polimórficas, podendo ser pontiagudas (condiloma acuminado), espiculadas, com circunvoluções, ou mesmo planas. Seu tamanho varia de um milímetro a vários centímetros. Podem ser únicas ou múltiplas, achatadas ou papulosas, embora, na maioria das vezes, sejam papilomatosas. A superfície das lesões é fosca, aveludada ou semelhante à da couve-flor; e pode-se apresentar da cor da pele, eritematosa ou hiperpigmentada. Geralmente, as lesões são assintomáticas, podendo ser pruriginosas, dolorosas, friáveis ou sangrantes.14
No homem, as lesões ocorrem mais frequentemente no folheto interno do prepúcio, sulco bálano-prepucial ou glande, podendo ainda se localizar na pele do pênis e do escroto.15 Na mulher, costumam ser observadas na vulva, vagina e cérvice. Em ambos os sexos, podem ser encontradas nas regiões inguinais ou perianais. Com menos frequência, podem-se encontrar lesões em áreas extragenitais, como conjuntivas, mucosas nasal, oral e laríngea.16, 17
As pessoas vivendo com HIV referem maior frequência de infecções múltiplas, verrugas anogenitais, lesões intraepiteliais e neoplasias anogenitais decorrentes da infecção por HPV.18, 19 Estes dados foram confirmados no Brasil, em estudo de Miranda et al., sendo encontrada prevalência de 28,4% de HPV de alto risco, além de associação com anormalidades citológicas, idade menor de 35 anos e uso de drogas ilícitas.20
Diagnóstico
O diagnóstico das verrugas anogenitais é clínico. A biópsia para estudo histopatológico deve se realizar quando há dúvida diagnóstica (suspeita de neoplasias ou outras doenças), na presença de lesões atípicas ou que não respondem adequadamente aos tratamentos, e em lesões suspeitas ou muito volumosas em pessoas com imunodeficiências. No caso de mulheres com verrugas anogenitais, é necessária a realização de um exame ginecológico que inclua a citologia cervical para rastreamento do câncer de colo uterino e, na presença de alterações citológicas, colposcopia e biópsia se necessário.21
Na presença de lesões anais, o ideal seria a realização de um exame proctológico com anuscopia e toque retal, e até mesmo com anuscopia de alta resolução.22 O estudo citológico de material colhido do canal anal ainda não tem indicação de forma sistemática; não obstante, ele pode ser indicado em populações especiais (homens que fazem sexo com homens, pessoas com prática sexual anal receptiva e pessoas com câncer ou lesões de alto grau), em razão de aumento da incidência de câncer anorretal.23 Não são recomendados testes para a tipagem de HPV na rotina clínica ou no rastreamento de pessoas assintomáticas, especialmente em adolescentes, devido à alta prevalência de infecção pelo HPV nesse grupo etário. Esses testes têm importância no rastreamento de câncer genital, na dependência da organização e protocolo específico do sistema de saúde. Os exames sorológicos que demonstrem os anticorpos naturais, ou após vacinação contra o HPV, carecem de aplicabilidade prática e têm sido utilizados apenas em estudos.24 Portanto, para o diagnóstico da infecção pelo HPV, além de avaliar clinicamente os condilomas (verrugas anogenitais), é fundamental diagnosticar as lesões pré-neoplásicas a partir da coleta citológica, do teste que demonstra a presença do HPV por biologia molecular e, mediante indicação, da avaliação colposcópica que define a localização das lesões, que poderão ser biopsiadas. O teste de HPV como rastreamento primário das lesões pré-neoplásicas e sua implantação no Sistema Único de Saúde (SUS) ainda permanecem em discussão.24
Tratamento
O objetivo do tratamento das verrugas anogenitais é erradicar as lesões visíveis (condilomas), embora não haja evidência de que os tratamentos disponíveis até o momento modifiquem a história natural da infecção por HPV. Mesmo sem tratamento, as lesões podem desaparecer, permanecer inalteradas ou aumentar em número e volume. O tratamento das verrugas não elimina a infecção por HPV. O DNA do HPV que permanece nas células infectadas pode se manter inativo (latente), por períodos prolongados, e o primeiro episódio ou recorrência de sintomas pode acontecer após meses ou até anos da infecção inicial. Assim, aqueles que não eliminam o HPV também podem transmitir o vírus, mesmo após o tratamento ou remoção das lesões. A recorrência das verrugas após eliminação inicial é comum: no período de um ano após o tratamento, aproximadamente metade dos casos desenvolve novas verrugas.25
Vários tratamentos clínicos e cirúrgicos para as verrugas anogenitais estão disponíveis, entre os quais os seguintes medicamentos administrados pela via tópica: acido tricloroacético de 60% a 80%; creme imiquimode a 5%; solução de podofilina de 10% a 25%; solução de podofilotoxina a 0,5%; e creme de podofilotoxina a 0,15%. Quanto à solução de podofilotoxina a 0,5%, embora não esteja disponível no Brasil, nem pelo SUS, nem pela rede privada, ela deve ser destacada por seus benefícios. O tratamento com imiquimode ou podofilotoxina apresenta a comodidade da autoaplicação, embora necessite de orientação e acompanhamento rigoroso devido à possibilidade de efeitos colaterais. Por sua vez, o ácido tricoloroacético e a podofilina sempre devem ser aplicados pelo médico assistente e, da mesma forma, com acompanhamento rigoroso, pelos potenciais efeitos cáusticos. Existe consenso de que técnicas ablativas, como eletroterapia, crioterapia e laser, são altamente eficazes no tratamento das verrugas anogenitais. No entanto, a base de evidências sobre a eficácia clínica e a relação custo-benefício dos tratamentos utilizados em verrugas anogenitais é limitada. O tratamento deve ser individualizado, considerando-se as características das lesões, a disponibilidade de recursos, os efeitos adversos e a experiência do profissional. Como se trata de uma doença geralmente autolimitada, devem ser evitados tratamentos que gerem cicatrizes desfigurantes. As verrugas com as características macias, úmidas e não queratinizadas, geralmente, respondem bem ao tratamento com aplicação tópica de, por exemplo, imiquimode a 5%, creme de podofilotoxina a 0,15% ou ácido tricloroacético de 60% a 80%, na dependência do tipo de lesão e da característica da pele. Os métodos ablativos físicos são mais eficazes no tratamento de lesões queratinizadas.26 As situações de imunodeficiência, como pessoas transplantadas ou pessoas vivendo com HIV, não modificam as recomendações terapêuticas, embora seja necessário lembrar que os indivíduos portadores dessas condições tendem a apresentar pior resposta ao tratamento, com maiores proporções de recidiva, demandando maior atenção quanto à possibilidade de complicações.27
A mudança de opção terapêutica deve ser considerada nos casos em que não houver melhora significativa após três sessões, ou se as verrugas não desaparecerem após seis a oito sessões de tratamento. Também é possível a combinação de tratamentos, sobretudo nos casos complicados associados a imunossupressão, sempre com estrito controle dos efeitos inflamatórios sobre os tecidos normais.28
Existe ainda a possibilidade de as verrugas anogenitais desaparecerem sem qualquer tratamento, especialmente em pessoas imunocompetentes.14 Algumas pessoas podem optar por um período de espera antes de iniciar o tratamento. Entretanto, há incerteza quanto à frequência da resolução espontânea das lesões, com relatos de proporções de depuração sem tratamento variando entre 0% e 50% das pessoas afetadas. Além de aumentar o risco de transmissão subsequente, um atraso no tratamento pode resultar em piora das verrugas, aumentos de seu tamanho, número ou da área afetada, particularmente em pessoas com imunidade celular prejudicada (gestação, infecção pelo HIV ou outras imunossupressões). Pode ser necessário um período maior para erradicar as verrugas grandes ou persistentes.29, 30 Deve-se considerar, igualmente, o impacto psicossocial das manifestações da infecção pelo HPV. É dever do profissional de saúde orientar a pessoa, clara e objetivamente, sobre a transmissão e tratamento da doença.31, 32
Cumpre considerar, ainda, que a presença de verrugas genitais atua como "marcador" de IST, pois estima-se que 20% das pessoas com verrugas anogenitais tenham uma IST simultânea, incluindo clamídia, infecção pelo HIV e sífilis. Por conseguinte, o rastreamento de outras IST deve ser orientado. A infecção pela clamídia, quando associada ao HPV, além de dificultar o tratamento dos condilomas, facilita a progressão das lesões de NIC.33 Deve-se investigar e eliminar, sempre que possível, fatores imunossupressores como hábito de tabagismo, controle inadequado do diabetes mellitus e outras enfermidades, além de rastrear lesões precursoras do câncer e atualizar o exame de Papanicolau. O uso do preservativo, por sua vez, abrevia o processo de eliminação viral, promove maior regressão das NIC e diminui a chance de recidiva dos condilomas.34 O rastreamento e notificação de parcerias sexuais não é recomendado mas o exame das parcerias sexuais atuais deve ser considerado, sobretudo com o objetivo de rastrear outras IST.35
A Figura 2 resume as recomendações para o tratamento das verrugas anogenitais, conforme sua morfologia e distribuição.
Vigilância, prevenção e controle
A vacinação profilática é segura e eficaz na prevenção da infecção pelo HPV e suas complicações. Há evidências do benefício da vacinação, tanto para a proteção individual como para a coletiva, com redução na ocorrência de lesões benignas e malignas.36-38
A vacina tem maior eficácia em adolescentes vacinadas ou vacinados antes do primeiro contato sexual, com produção de anticorpos dez vezes maior que a encontrada na infecção naturalmente adquirida no período de dois anos. A vacinação contra o HPV não leva a mudanças de comportamento sexual entre adolescentes. Os profissionais de saúde devem indicar a vacinação e promover o aumento da cobertura vacinal no país.39-43 A partir de 2014, o Ministério da Saúde ampliou o Calendário Nacional de Vacinação, com a introdução da vacina quadrivalente contra HPV de tipos 6 e 11 (baixo risco oncogênico) e 16 e 18 (alto risco oncogênico). A Figura 3 apresenta as indicações de vacinação contra o HPV.3
Figura 3 Indicação de vacinação contra a infecção pelo papilomavírus humano
| Crianças e adolescentes | Pessoas vivendo com HIV, transplantados de órgãos sólidos, de medula óssea ou pessoas com câncer |
|---|---|
| 2 doses (0 e 6 meses) | 3 doses (0, 2 e 6 meses) |
| Meninas de 9 a 14 anos | Mulheres de 9 a 26 anos |
| Meninos de 11 a 14 anos | Homens de 9 a 26 anos |
Fonte: adaptado do Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis, 2020.1
A vacina profilática contra o HPV deve ser uma prioridade para o SUS, considerando-se seus benefícios relacionados a imunogenicidade, eficácia e segurança para a saúde da população.











 texto em
texto em