Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde vol.30 no.esp1 Brasília 2021 Epub 28-Fev-2021
http://dx.doi.org/10.1590/s1679-4974202100014.esp1
Consenso
Protocolo Brasileño para Infecciones de Transmisión Sexual 2020: infección por papilomavirus humano (PVH)
1Universidade Federal do Paraná, Departamento de Tocoginecologia, Curitiba, PR, Brasil
2Secretaria de Estado da Saúde, Centro de Referência e Treinamento DST/Aids, São Paulo, SP, Brasil
3Universidade Federal Fluminense, Departamento Materno-Infantil, Niterói, RJ, Brasil
4Universidade Federal de Santa Catarina, Programa de Pós-Graduação em Farmácia, Florianópolis, SC, Brasil
5Universidade Federal de Pelotas, Programa de Pós-Graduação em Epidemiologia, Pelotas, RS, Brasil
El tema del papilomavirus humano (PVH) es uno de los capítulos del Protocolo Clínico y Conductas Terapéuticas para la Atención Integral a Personas con Infecciones de Transmisión Sexual, publicado por el Ministerio de Salud de Brasil. Este documento fue desarrollado en base a evidencia científica y validado en discusiones con especialistas. Se presentan aspectos epidemiológicos y clínicos, así como guías para gestores y profesionales de la salud en el diagnóstico, tratamiento y prevención de la infección por papilomavirus. Este tema constituye uno de los principales problemas de salud pública, pues además de ser la infección transmitida sexualmente más prevalente en todo el mundo, puede tener implicaciones para el proceso oncogénico del cáncer de cuello uterino y la posibilidad de presentar verrugas anogenitales. Se presenta información sobre estrategias de acciones de prevención y control, las cuales son importantes para entender el problema, ofrecer asistencia de calidad y tratamiento efectivo.
Palabras clave: Infecciones por Papilomavirus; Papillomaviridae; Condiloma Acuminado; Verrugas
Presentación
El artículo aborda la infección por el papilomavirus humano (PVH), tema que compone el Protocolo Clínico y Directrices Terapéuticas (PCDT) para Atención Integral a las Personas con Infecciones de Transmisión Sexual (ITS), publicado por la Secretaría de Vigilancia en Salud del Ministerio de Salud de Brasil. Para la elaboración del PCDT, se realizó la selección y el análisis de las evidencias disponibles en la literatura y su discusión, en un panel de especialistas. El documento fue aprobado por la Comisión Nacional de Incorporación de Tecnologías en el SUS (Conitec) y actualizado por el grupo de especialistas del PCDT-ITS en 2020.1
Aspectos epidemiológicos
El PVH es un ADN virus de doble cadena, no encapsulado, miembro de la familia Papillomaviridae. Infecta el epitelio escamoso y puede inducir la formación de una gran variedad de lesiones cutáneo-mucosas, sobre todo en la región anogenital. Se han identificado más de 200 tipos de PVH, de los cuales, aproximadamente 40 acometen el tracto anogenital.2
La principal forma de transmisión do PVH es la actividad sexual de cualquier tipo, pudiendo suceder, incluso, la deposición del virus en los dedos por contacto genital y la autoinoculación. Excepcionalmente, durante el parto, puede ocurrir la formación de lesiones cutáneo-mucosas en recién nacidos o papilomatosis recurrente de laringe. La transmisión por fómites es poco común. Se trata de la ITS de mayor transmisibilidad, superior a las infecciones por herpes genital y por el virus de la inmunodeficiencia humana (VIH).3 El riesgo general estimado de exposición a la infección por PVH es del 15% al 25% con cada nueva relación sexual.4 La mayoría de las personas sexualmente activas se infectarán en algún momento de su vida. Las mujeres al inicio de la actividad sexual y que mantenían una sola pareja tenían riesgo de contraer el PVH del 28,5% al fin del primer año y del 50% al fin del tercer año.4
Las infecciones suelen presentarse de forma asintomática. Aproximadamente del 1% al 2% de la población infectada desarrollará verrugas anogenitales y alrededor del 2% al 5% de las mujeres presentarán alteraciones en la colpocitología oncótica. La prevalencia de infección es mayor en mujeres menores de 30 años, resolviéndose la gran mayoría de las infecciones por PVH en mujeres (especialmente en adolescentes) en un período aproximado de hasta 24 meses.5-7 La adquisición de una nueva infección por PVH en mujeres disminuye con la edad; entre los hombres, la proporción de personas que contraen una nueva infección no cambia y permanece alta durante toda la vida. Sin embargo, una vez adquirida la infección por PVH, su duración promedio parece ser similar entre hombres y mujeres.8 Un estudio realizado en 26 capitales brasileñas y el Distrito Federal, que incluyó a 6.387 mujeres con edad promedio de 21,6 años, identificó una prevalencia de PVH 53,6%.9
Aspectos clínicos
Los tipos de PVH que infectan el tracto anogenital pueden tener un riesgo oncogénico bajo o alto. Los tipos que pertenecen al grupo de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 70, 72 y 81) ocurren a menudo en lesiones benignas y lesiones intraepiteliales escamosas de bajo grado. Los tipos de PVH en el grupo de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82) u oncogénicos, a menudo se asocian con lesiones intraepiteliales escamosas de alto grado y carcinomas. Es importante señalar que alrededor del 85% de las lesiones de bajo grado contienen PVH del grupo oncogénico.10 La infección por cierto tipo viral no previene la infección por otros tipos de PVH y pueden ocurrir múltiples infecciones. El tiempo promedio entre la infección por PVH de alto riesgo y el desarrollo del cáncer de cuello uterino es de aproximadamente 10 a 20 años. Este período varía según el tipo, la carga, la persistencia del virus y el estado inmunológico del huésped. Algunas características individuales son factores que predisponen a la aparición de lesiones, como el tabaquismo, deficiencias inmunológicas (incluidas las derivadas de la infección por VIH), desnutrición y cánceres, además del uso de fármacos inmunosupresores.11
En la mayoría de las personas, la infección por PVH no produce ninguna manifestación clínica o subclínica. El período de latencia puede variar de meses a años. La prevalencia de grupos virales de PVH de bajo y alto riesgo en la población se muestra en la Figura 1. Aunque el grupo de alto riesgo es más prevalente (alrededor del 80%), solo el 20% de estos persisten y pueden causar lesiones de alto grado con potencial de progresión del cáncer de cuello uterino. Los porcentajes pueden variar según la edad, la región geográfica estudiada, las características de la población y la metodología. Además, existe un grupo de personas que presentan, simultáneamente, infección por PVH tanto de grupos de bajo como de alto riesgo (alrededor del 30% de los infectados), no incluidos en la Figura 1.12

Fuente: adaptado del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a las Personas con Infecciones de Transmisión Sexual, 2020.1
Figura 1 Prevalencia de los grupos virales del papilomavirus humano de bajo y alto riesgo oncogénico y capacidad de persistencia en el organismo humano (T: Transitorios; P: Persistentes)
Las presentaciones subclínicas del PVH pueden detectarse mediante citología oncótica, utilizando lupas, tintes y colposcopia, con o sin biopsia. Las lesiones asociadas a tipos virales de bajo riesgo oncogénico son generalmente lesiones escamosas de bajo grado, equivalentes al diagnóstico histopatológico de displasia leve o neoplasia intraepitelial cervical (NIC) grado 1 (NIC 1). Las lesiones asociadas a la infección por PVH de alto riesgo oncogénico se asocian, en general, a lesiones intraepiteliales escamosas de alto grado y al diagnóstico histopatológico de neoplasia intraepitelial grado 2 (NIC 2) o 3 (NIC 3). Además del cérvix uterino, otros epitelios pueden sufrir la acción oncogénica del virus, dando lugar a neoplasias intraepiteliales vaginales, vulvares, perianales, peneanas y anales.13
Las manifestaciones clínicamente detectables inducidas por el PVH son polimórficas y pueden ser puntiagudas (condiloma acuminata), espiculadas, con circunvoluciones o incluso planas. Su tamaño varía desde un milímetro hasta varios centímetros. Pueden ser únicos o múltiples, planos o papulosos, aunque en la mayoría de los casos son papilomatosos. La superficie de las lesiones es mate, aterciopelada o similar a la de la coliflor; y puede ser del color de la piel, eritematoso o hiperpigmentado. Las lesiones son generalmente asintomáticas y pueden ser pruriginosas, dolorosas, friables o sangrantes. 14
En los hombres, las lesiones ocurren con mayor frecuencia en la valva interna del prepucio, surco balanoprepucial o glande, y también pueden localizarse en la piel del pene y el escroto.15 En las mujeres, generalmente se observan en la vulva, la vagina y el cuello uterino. En ambos sexos, se pueden encontrar en las regiones inguinal o perianal. Con menor frecuencia se pueden encontrar lesiones en áreas extragenitales, como conjuntiva, mucosa nasal, oral y laríngea. 16, 17
Las personas que viven con el VIH reportan una mayor frecuencia de infecciones múltiples, verrugas anogenitales, lesiones intraepiteliales y neoplasias anogenitales resultantes de la infección por PVH.18, 19 Estos datos fueron confirmados en Brasil, en un estudio de Miranda et al., con una prevalencia de 28, 4% PVH de alto riesgo, además de asociación con anomalías citológicas, edad menor a 35 años y uso de drogas ilícitas.20
Diagnóstico
El diagnóstico de las verrugas anogenitales es clínico. La biopsia para estudio histopatológico debe realizarse cuando existe duda diagnóstica (sospecha de neoplasias u otras enfermedades), en la presencia de lesiones atípicas o que no responden adecuadamente a los tratamientos, y en lesiones sospechosas o muy voluminosas en personas con inmunodeficiencia. En el caso de mujeres con verrugas anogenitales, es necesario un examen ginecológico que incluya la citología cervical para rastreo del cáncer de cuello uterino y, en presencia de alteraciones citológicas, colposcopia y biopsia si necesario.21
En la presencia de lesiones anales, lo ideal sería la realización de un examen proctológico con anoscopia y toque rectal, o aún, con anoscopia de alta resolución.22 El estudio citológico de material recolectado del canal anal todavía no tiene indicación de forma sistemática; no obstante, puede ser indicado en poblaciones especiales (hombres que tienen sexo con hombres, personas con práctica sexual anal receptiva y personas con cáncer o lesiones de alto grado), en razón de aumento de la incidencia de cáncer anorrectal.23 No se recomiendan las pruebas para el tipado de PVH en la rutina clínica o en rastreo de personas asintomáticas, especialmente en adolescentes, debido a la alta prevalencia de infección por el PVH en ese grupo de edad. Esas pruebas tienen importancia en el rastreo de cáncer genital, en la dependencia de la organización y protocolo específico del sistema de salud. Os exámenes serológicos que demuestren los anticuerpos naturales, o pos vacunación contra el PVH, carecen de aplicabilidad práctica y han sido utilizados apenas en estudios.24 Por lo tanto, para el diagnóstico de la infección por PVH, además de evaluar clínicamente los condilomas (verrugas anogenitales), es fundamental diagnosticar las lesiones preneoplásicas a partir de la colecta citológica, de la prueba que demuestra la presencia del PVH por biología molecular y, mediante indicación, de la evaluación colposcópica que define la localización de las lesiones, que podrán pasar por biopsia. La prueba de PVH como el rastreo primario de las lesiones preneoplásicas y su implantación en el Sistema Único de Salud (SUS) todavía permanecen en discusión.24
Tratamento
El propósito del tratamiento de las verrugas anogenitales es erradicar las lesiones visibles (condilomas), aunque no hay evidencia de que los tratamientos disponibles hasta la fecha modifiquen la historia natural de la infección por PVH. Incluso sin tratamiento, las lesiones pueden desaparecer, permanecer sin cambios o aumentar en número y volumen. El tratamiento de las verrugas no elimina la infección por PVH. El ADN del PVH que permanece en las células infectadas puede permanecer inactivo (latente) durante períodos prolongados, y el primer episodio o la recurrencia de los síntomas puede ocurrir meses o incluso años después de la infección inicial. Así, quienes no eliminan el PVH también pueden transmitir el virus, incluso después de tratar o extirpar las lesiones. La recurrencia de las verrugas después de la eliminación inicial es común: hasta en un año después del tratamiento, aproximadamente la mitad de los casos desarrollan nuevas verrugas.25
Se encuentran disponibles varios tratamientos clínicos y quirúrgicos para las verrugas anogenitales, incluidos los siguientes medicamentos administrados por vía tópica: 60% a 80% de ácido tricloroacético; crema de imiquimod al 5%; solución de podofilina del 10% al 25%; solución de podofilotoxina al 0,5%; y crema de podofilotoxina al 0,15%. En cuanto a la solución de podofilotoxina al 0,5%, aunque no está disponible en Brasil, ni por el SUS ni en la red privada, debe ser destacada por sus beneficios. El tratamiento con imiquimod o podofilotoxina tiene la conveniencia de la autoaplicación, aunque necesite de orientación y un seguimiento estricto debido a la posibilidad de efectos secundarios. A su vez, el ácido tricoloroacético y la podofilina deben ser aplicados siempre por el médico tratante y, de igual forma, con un estricto seguimiento, por los posibles efectos cáusticos. Existe consenso de que técnicas ablativas, como electroterapia, crioterapia y láser, son altamente eficaces en el tratamiento das verrugas anogenitais. Sin embargo, la base de evidencias sobre la eficacia clínica y la relación costo-beneficio de los tratamientos utilizados en verrugas anogenitais es limitada. El tratamiento debe ser individualizado, considerando las características de las lesiones, la disponibilidad de recursos, los efectos adversos y la experiencia del profesional. Como es una enfermedad generalmente autolimitada, se deben evitar los tratamientos que causen cicatrices desfigurantes. Las verrugas con características suaves, húmedas y no queratinizadas generalmente responden bien al tratamiento con la aplicación tópica de, por ejemplo, imiquimod al 5%, crema de podofilotoxina al 0,15% o ácido tricloroacético al 60% al 80%, dependiendo del tipo de lesión y de las características de la piel. Los métodos de ablación física son más efectivos en el tratamiento de lesiones queratinizadas.26 Las situaciones de inmunodeficiencia, como pacientes trasplantados o personas viviendo con VIH, no cambian las recomendaciones terapéuticas, aunque es necesario recordar que los individuos con estas condiciones tienden a tener una peor respuesta al tratamiento, con mayores proporciones de recidiva, requiriendo mayor atención en cuanto a la posibilidad de complicaciones.27
El cambio de la opción terapéutica debe ser considerado en los casos en lo que no hubiera mejora significativa luego de tres sesiones, o si las verrugas no desaparecen después de seis a ocho sesiones de tratamiento. También es posible combinar tratamientos, sobre todo en los casos complicados asociados a inmunosupresión, siempre con estricto control de los efectos inflamatorios sobre los tejidos normales.28
Existe la posibilidad de que las verrugas anogenitales desaparezcan sin cualquier tratamiento, especialmente en personas inmunocompetentes.14 Algunas personas pueden optar por un período de espera antes de iniciar el tratamiento. Sin embargo, hay incerteza con relación a la frecuencia de la resolución espontánea de las lesiones, con relatos de proporciones de depuración sin tratamiento variando entre 0% y 50% de las personas afectadas. Además de aumentar el riesgo de transmisión subsecuente, un atraso en el tratamiento puede resultar en empeoramiento de las verrugas, aumentos de tamaño, número o del área afectada, particularmente en personas con inmunidad celular perjudicada (gestación, infección por VIH u otras inmunosupresiones). Es posible que haya un período mayor para erradicar las verrugas grandes o persistentes.29, 30 Se debe considerar, igualmente, el impacto psicosocial de las manifestaciones de la infección por el PVH. Es deber del profesional de salud orientar a la persona, clara y objetivamente, sobre la transmisión y tratamiento de la enfermedad.31, 32
Cumple considerar, aún, que la presencia de verrugas genitales actúa como "marcador" de ITS, ya que se estima que 20% de las personas con verrugas anogenitales tengan una ITS simultánea, incluyendo clamidia, infección por VIH y sífilis. Por lo tanto, el rastreo de otras ITS debe ser orientado. La infección por la clamidia, cuando asociada al PVH, además de dificultar el tratamiento de los condilomas, facilita la progresión de las lesiones de NIC.33 Es necesario investigar y eliminar, siempre que sea posible, factores inmunosupresores como hábito de tabaquismo, control inadecuado de diabetes mellitus y otras enfermedades, además de rastrear lesiones precursoras del cáncer y actualizar la prueba de Papanicolaou. El uso do preservativo, por su vez, abrevia el proceso de eliminación viral, promueve mayor regresión de las NIC y disminuye la posibilidad de recidiva de los condilomas.34 El rastreo y notificación de parejas sexuales no se recomienda, pero el examen de las parejas sexuales actuales debe ser considerado, sobre todo con el objetivo de rastrear otras ITS.35
La Figura 2 resume las recomendaciones para el tratamiento de las verrugas anogenitales, conforme su morfología y distribución.
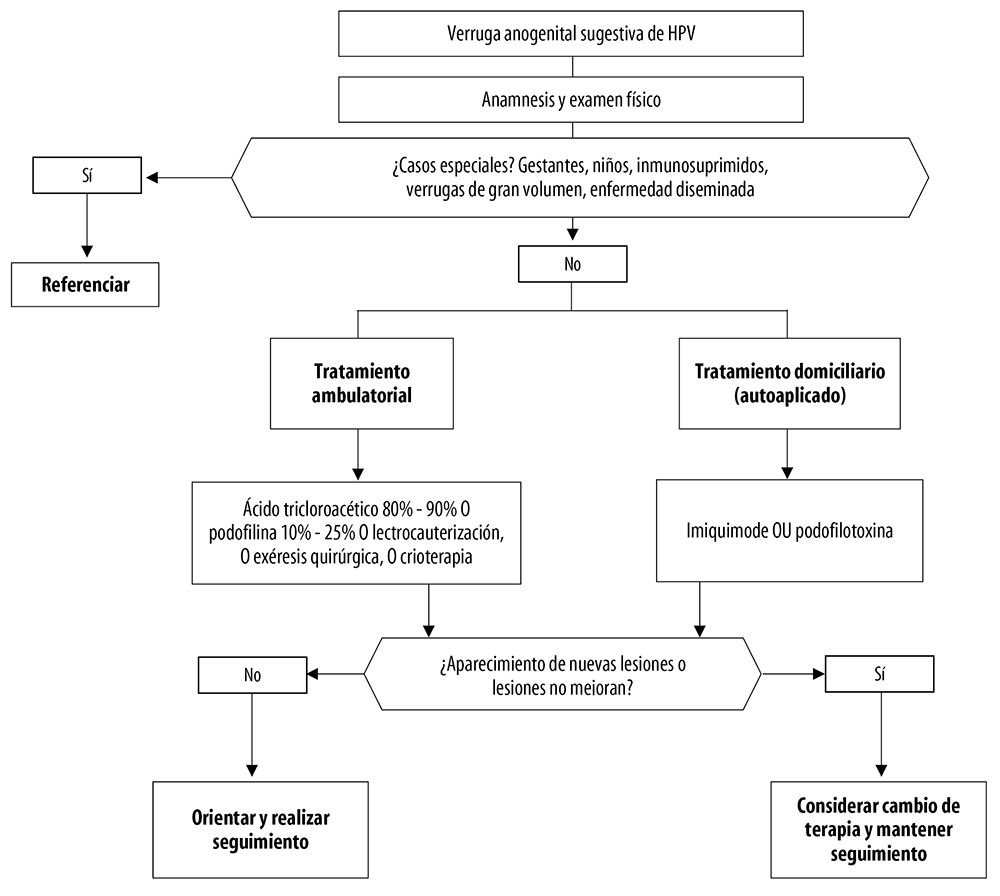
Fuente: adaptado del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a las Personas con Infecciones de Transmisión Sexual, 2020.1
Figura 2 Recomendaciones para el tratamiento de las verrugas anogenitales, de acuerdo con su morfología y distribución
Vigilancia, prevención y control
La vacunación profiláctica es segura y eficaz en la prevención de la infección por el PVH y sus complicaciones. Hay evidencias del beneficio de la vacunación, tanto para la protección individual como para la colectiva, con reducción de ocurrencia de lesiones benignas y malignas.36-38
La vacuna es más eficaz en adolescentes vacunadas o vacunados antes de su primer contacto sexual, con una producción de anticuerpos diez veces mayor que la encontrada en la infección adquirida naturalmente en el período de dos años. La vacunación contra el VPH no produce cambios en el comportamiento sexual de los adolescentes. Los profesionales de la salud deben indicar la vacunación y promover una mayor cobertura de vacunación en el país.39-43 A partir de 2014, el Ministerio de Salud amplió el Calendario Nacional de Vacunación, con la introducción de la vacuna tetravalente contra el VPH tipos 6 y 11 (bajo riesgo oncogénico) y 16 y 18 (alto riesgo oncogénico). En la Figura 3 se muestran las indicaciones de vacunación contra el VPH.3
La vacuna profiláctica contra el PVH debe ser una prioridad para el SUS, considerando sus beneficios relacionados a inmunogenicidad, eficacia y seguridad para la salud de la población.
Figura 3 Indicación de vacunación contra la infección por el papilomavirus humano
| Niños y adolescentes | Personas viviendo con VIH, transplantados de órganos sólidos, de médula ósea o personas con cáncer |
|---|---|
| 2 dosis (0 e 6 meses) | 3 dosis (0, 2 e 6 meses) |
| Niñas de 9 a 14 años | Mujeres de 9 a 26 años |
| Niños de 11 a 14 años | Hombres de 9 a 26 años |
Fuente: adaptado del Protocolo Clínico y Directrices Terapéuticas para Atención Integral a las Personas con Infecciones de Transmisión Sexual, 2020.1
Agradecimento
Los autores agradecen la contribución para la realización de este trabajo, a los miembros del grupo técnico de especialistas responsables por la elaboración del PCDT para Atención Integral a las Personas con ITS en 2020.
REFERENCIAS
1. Brasil. Ministério da Saúde. Portaria GM/MS nº 42, de 05 de outubro de 2018. Torna pública a decisão de aprovar o Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis (IST), no âmbito do Sistema Único de Saúde - SUS [Internet]. Diário Oficial da União, Brasília (DF), 2018 out 8 [citado 2020 ago 29]; Seção I:88. Disponível em: http://conitec.gov.br/images/Relatorios/Portaria/2018/Portaria_SCTIE_N42_05_10_2018.pdf [ Links ]
2. Bernard HU. The clinical importance of the nomenclature, evolution and taxonomy of human papillomaviruses. J Clin Virol [Internet]. 2005 Mar [cited 2020 Oct 19]; 32 (Suppl 1):S1-6. Available from: https://doi.org/10.1016/j.jcv.2004.10.021 [ Links ]
3. Burchell AN, Richardson H, Mahmud SM, Trottier H, Tellier PP, Hanley J. Modeling the sexual transmissibility of human papillomavirus infection using stochastic computer simulation and empirical data from a cohort study of young women in Montreal, Canada. Am J Epidemiol [Internet]. 2006 Mar [cited 2020 Oct 19]; 163(6):534-43. Available from: https://doi.org/10.1093/aje/kwj077 [ Links ]
4. Winer RL, Feng O, Hughes JP, O'Reilly S, Kiviat NB, Koutsky LA. Risk of female human papillomavirus acquisition associated with first male sex partner. J Infec Dis [Internet]. 2008 May [cited 2020 Oct 20]; 197(2):279-82. Available from: https://dx.doi.org/10.1086/52F524875 [ Links ]
5. Saeed-Vafa D, Huang Y, Manucha V. Should cervical cancer screening begin at age 21 for everyone? A quantitative analysis in a high-risk, low-income, African American/Hispanic young-adult population. Diagn Cytotaphol [Internet]. 2014 Mar [cited 2020 Oct 20]; 42(3):205-12. Available from: https://doi.org/10.1002/dc.23021 [ Links ]
6. Moscicki AB, Cox TC. Practice improvement in cervical screening and management (PICSM): symposium on management of cervical abnormalities in adolescents and young women. J Low Genit Tract Dis [Internet]. 2010 Mar [cited 2020 Oct 20]; 14(1):73-80. Available from: https://www.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&retmode=ref&cmd=prlinks&id=20043357 [ Links ]
7. Boardman LA, Kennedy CM. Management of atypical squamous cells, low-grade squamous intrepithelial lesions, and cervical intraepithelial neoplasia 1. Obstet Gynecol Clin N Am [Internet]. 2008 Dec [cited 2020 Oct 20]; 35(4):599-614. Available from: https://doi.org/10.1016/j.ogc.2008.09.001 [ Links ]
8. Giuliano AR, Lee JH, Fulp W, Villa LL, Lazcano E, Papenfuss MR, et al. Incidence and clearance of genital human papillomavirus infection in men (HIM): a cohort study. Lancet [Internet]. 2011 Mar [cited 2020 Oct 20]; 377(9769):932-40. Available from: https://doi.org/10.1016/s0140-6736(10)62342-2 [ Links ]
9. Wendland EM, Caierão J, Domionques C, Maranhão C, Souza FMA, Hammes LS, et al. POP-Brazil study protocol: a nationwide cross-sectional evaluation of the prevalence and genotype distribution of human papillomavirus (HPV) in Brazil. BMJ Open [Internet]. 2018 [cited 2020 Oct 20]; 8(6):e021170. Available from: https://bmjopen.bmj.com/content/8/6/e021170 [ Links ]
10. Muñoz N, Bosch FX, Sanjosé S, Herrero R, Castellsagué X, Shah KV. Epidemiologic classification of human papilloma virus types associated with cervical câncer. N Engl J Med [Internet]. 2003 Feb [cited 2020 Oct 20]; 348(6):518-27. Available from: https://doi.org/10.1056/nejmoa021641 [ Links ]
11. Muñoz N, Castellsagué X, Gonzável AB, Gissmann L. Chapter 1: HPV in the etiology of human câncer. Vaccine [Internet]. 2006 Aug [cited 2020 Oct 20]; 24 Suppl 3:S3/1-10. Available from: https://doi.org/10.1016/j.vaccine.2006.05.115 [ Links ]
12. Roteli-Martins CM, Carvalho NS, Naud P, Teixeira J, Borba P, Derchain S. Prevalence of human papillomavirus infection and associated risk factors in young women in Brazil, Canada, and the United States: a multicenter cross-sectional study. Int J Gynecol Pathol [Internet]. 2011 Mar [cited 2020 Oct 20]; 30(2):173-84. Available from: https://doi.org/10.1097/pgp.0b013e3181f38dfe [ Links ]
13. Darragh TM, Colgan TJ, Cox JT, Heller DS, Henry MR, Luff RD, et al. The Lower anogenital squamous terminology standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Arch Pathol Lab Med [Internet]. 2012 Oct [cited 2020 Oct 20]; 136(10):1266-97. Available from: https://doi.org/10.5858/arpa.lgt200570 [ Links ]
14. Handsfield HH. Clinical presentation and natural course of anogenital warts. Am J Med [Internet]. 1997 May [cited 2020 Oct 20]; 102(5A):16-20. Available from: https://doi.org/10.1016/s0002-9343(97)00179-4 [ Links ]
15. Buechner SA. Common skin disorders of the penis. BJU Int [Internet]. 2002 Sep [cited 2020 Oct 20]; 90(5):498-506. Available from: https://doi.org/10.1046/j.1464-410x.2002.02962.x [ Links ]
16. Kirby P, Corey L. Genital human papillomavirus infections. Infect Dis Clin North Am. 1987 Mar;1(1):123-43. [ Links ]
17. Oriel JD. Natural history of genital warts. Br J Vener Dis [Internet]. 1971 Feb [cited 2020 Oct 20]; 47(1):1-13. Available from: https://dx.doi.org/10.1136/52Fsti.47.1.1 [ Links ]
18. Levine RU, Crum CP, Herman E, Silvers D, Ferenczy A, Richart RM. Cervical papillomavirus infections and intraepithelial neoplasia: a study of male sexual partners. Obstet Gynecol. 1984 Jul;64(1):19-20. [ Links ]
19. Silva RJ, Casseb J, Andreoli MA, Villa LL. Persistence and clearance of HPV from the penis of men infected and non-infected with HIV. J Med Virol [Internet]. 2011 Jan [cited 2020 Oct 20]; 83(1):127-31. Available from: https://doi.org/10.1002/jmv.21950 [ Links ]
20. Miranda AE, Silveira MF, Travassos AG, Tenório T, Del Val ICC, Lannoy L, et al. High-risk papillomavirus infection among women living with human Immunodeficiency virus: Brazilian multicentric study. J Med Virol [Internet]. 2017 Dec [cited 2020 Oct 20]; 89(12):2217-23. Available from: https://doi.org/10.1002/jmv.24906 [ Links ]
21. Sellors JW, Sankaranarayanan R. Colposcopy and treatment of cervical intraepithelial neoplasia: a beginners’ manual. Lyon: IARC; 2003 [cited 2020 Aug 29]. Available from: https://screening.iarc.fr/colpo.php [ Links ]
22. Carvalho NS, Ferreira AM, Bueno CCT. HPV infection and intraepitelial lesions from the anal region: how to diagnose? Braz J Infect Dis [Internet]. 2011 Sep-Oct [cited 2020 Oct 20]; 15(5):473-7. Available from: https://doi.org/10.1590/S1413-86702011000500010 [ Links ]
23. Palefsky JM, Holly EA, Hogeboom CJ, Berry JM, Jay N, Darragh TM. Anal cytology as a screening tool for anal squamous intraepithelial lesions. J Acquir Immune Defic Syndr Hum Retrovirol [Internet]. 1997 Apr [cited 2020 Oct 20]; 14(5):415-22. Available from : https://doi.org/10.1097/00042560-199704150-00004 [ Links ]
24. Zeferino LC, Bastos JB, Vale DBAP, Zanine RM, Melo YLMF, Pereira-Primo WQS, et al. Recomendações para o uso de testes de DNA-HPV no rastreamento do câncer do colo útero no Brasil. Rev Bras Ginecol Obstet [Internet]. 2018 [citado 2020 out 20]; 40(6):360-8. Disponível em: https://doi.org/10.1055/s-0038-1657754 [ Links ]
25. Chow EPF, Danielewski JA, Fehler G, Tabrizi SN, Law MG, Bradshaw CS, et al. Human papillomavirus in young women with Chlamydia trachomatis infection 7 years after the Australian human papillomavirus vaccination programme: across-sectional study. Lancet Infect Dis [Internet]. 2015 Nov [cited 2020 Oct 20]; 15(11):1314-23. Available from: https://doi.org/10.1016/S1473-3099(15)00055-9 [ Links ]
26. Kahn JA, Widdice LE, Ding L, Huang B, Brown DR, Franco EL, et al. Substantial decline in vaccine-type Human Papillomavirus (HPV) among vaccinated young women during the first 8 years after HPV vaccine introduction in a community. Clin Infect Dis [Internet]. 2016 Nov [cited 2020 Oct 20]; 63(10):1281-7. Available from: https://dx.doi.org/10.10932Fcid2Fciw533 [ Links ]
27. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet [Internet]. 2007 Jul [cited 2020 Oct 20]; 370(9581):59-67. Available from: https://doi.org/10.1016/s0140-6736(07)61050-2 [ Links ]
28. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Protocolo clínico e diretrizes terapêuticas para atenção integral às pessoas com infecções sexualmente transmissíveis (PCDT-IST) [Internet]. Brasília: Ministério da Saúde; 2020 [citado 2020 out 20]. 248 p. Disponível em: http://www.aids.gov.br/pt-br/pub/2015/protocolo-clinico-e-diretrizes-terapeuticas-para-atencao-integral-pessoas-com-infeccoes [ Links ]
29. Wiley DJ, Douglas J, Beutner K, Cox T, Fife K, Moscicki AB, Furumoto L. External genital warts: diagnosis, treatment, and prevention. Clin Infect Dis [Internet]. 2002 Oct [cited 2020 Oct 20]; 35 (Suppl 2):S210-24. Available from: https://doi.org/10.1086/342109 [ Links ]
30. Bosch FX, Broker TR, Forman D, Moscicki AB, Gillison ML, Doorbar J, et al. Comprehensive control of human papillomavirus infections and related diseases. Vaccine [Internet]. 2013 Dec [cited 2020 Oct 20]; 31 Suppl 7:H1-31. Available from: https://doi.org/10.1016/j.vaccine.2013.10.003 [ Links ]
31. Graziottin A, Serafini A. HPV infection in women: psychosexual impact of genital warts and intraepithelial lesions. J Sex Med [Internet]. 2009 Mar [cited 2020 Oct 20]; 6(3):633-45. Available from: https://doi.org/10.1111/j.1743-6109.2008.01151.x [ Links ]
32. Cvejic E, Poynten IM, Kelly PJ, Jin F, Howard K, Grulich AE, et al. Psychological and utility-based quality of life impact of screening test results for anal precancerous lesions in gay and bisexual men: baseline findings from the Study of the Prevention of Anal Cancer. Sex Transm Infect [Internet]. 2020 May [cited 2020 Oct 20]; 96(3):177-83. Available from: https://doi.org/10.1136/sextrans-2019-054098 [ Links ]
33. Koutsky LA, Holmes KK, Critchlow CW, Stevens CE, Paavonen J, Beckmann AM, et al. A cohort study of the risk of cervical intraepithelial neoplasia grade 2 or 3 in relation to papillomavirus infection. N Engl J Med [Internet]. 1992 Oct [cited 2020 Oct 20]; 327(18):1272-8. Available from: https://doi.org/10.1056/nejm199210293271804 [ Links ]
34. Hogewoning CJA, Bleeker MCG, van den Brule AJC, Voorhorst FJ, Snijders PJF, et al. Condom use promotes regression of cervical intraepithelial neoplasia and clearance of human papillomavirus: a randomized clinical trial. Int J Cancer [Internet]. 2003 Oct [cited 2020 Oct 20]; 107(5):811-6. Available from: https://doi.org/10.1002/ijc.11474 [ Links ]
35. Hogben M, Collins D, Hoots B, O’Connor K. Partner services in STD prevention programs: a review. Sex Transm Dis [Internet]. 2016 Feb [cited 2020 Oct 20]; 43(001):S53-62. Available from: https://dx.doi.org/10.10972FOLQ.0000000000000328 [ Links ]
36. Drolet M, Bénard É, Boily MC, Ali H, Baandrup L, Bauer H, Beddows S, Brisson J, Brotherton JM, Cummings T, Donovan B, Fairley CK, Flagg EW, Johnson AM, Kahn JA, Kavanagh K, Kjaer SK, Kliewer EV, Lemieux-Mellouki P, Markowitz L, Mboup A, Mesher D, Niccolai L, Oliphant J, Pollock KG, Soldan K, Sonnenberg P, Tabrizi SN, Tanton C, Brisson M Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis. 2015 May;15(5):565-80. doi: 10.1016/S1473-3099(14)71073-4. [ Links ]
37. Spinner Chelse, Ding Lili, Bernstein David, Brown DR, Franco EL, Covert Courtney, Kahn JA. Human Papillomavirus Vaccine Effectiveness and Herd Protection in Young Women. Pediatrics. 2019 Feb;143(2):e20181902. doi: 10.1542/peds.2018-1902. Epub 2019 Jan 22. - DOI: 10.1542/peds.2018-1902 [ Links ]
38. Goggin O, Sauvageau C, Gilca V, Defay F, Lambert G, Mathieu-C S, et al. Low prevalence of vaccine-type HPV infections in young women following the implementation of a school-based and catch-up vaccination in Quebec, Canada. Hum Vaccin Immunother [Internet]. 2018 Jan [cited 2020 Oct 20]; 14(1):118-23. Available from: https://doi.org/10.1080/21645515.2017.1385688 [ Links ]
39. Liddon NC, Leichliter JS, Markowitz LE. Human papillomavirus vaccine and sexual behavior among adolescent and young women. Am J Prev Med [Internet]. 2012 Jan [cited 2020 Oct 20]; 42(1):44-52. Available from: https://doi.org/10.1016/j.amepre.2011.09.024 [ Links ]
40. Mather T, McCaffery K, Juraskova I. Does HPV vaccination affect women’s attitudes to cervical cancer screening and safe sexual behaviour? Vaccine [Internet]. 2012 May [cited 2020 Oct 20]; 30(21):3196-201. Available from: https://doi.org/10.1016/j.vaccine.2012.02.081 [ Links ]
41. Marchand E, Glenn BA, Bastani R. HPV vaccination and sexual behavior in a community college sample. J Community Health [Internet]. 2013 Dec [cited 2020 Oct 20]; 38(6):1010-4. Available from: https://doi.org/10.1007/s10900-013-9710-0 [ Links ]
42. Bowyer HL, Dodd RH, Marlow LAV, Waller J. Association between human papillomavirus vaccine status and other cervical cancer risk factors. Vaccine [Internt]. 2014 Jul [cited 2020 Oct 20]; 32(34):4310-6. Available from: https://dx.doi.org/10.10162Fj.vaccine.2014.06.011 [ Links ]
43. Rysavy MB, Kresowik JDK, Liu D, Mains L, Lessard M, Ryan GL. Human papillomavirus vaccination and sexual behavior in young women. J Pediatr Adolesc Gynecol [Internet]. 2014 Apr [cited 2020 Oct 20]; 27(2):67-71. Available from: https://doi.org/10.1016/j.jpag.2013.08.009 [ Links ]
Recibido: 31 de Agosto de 2020; Aprobado: 13 de Octubre de 2020











 texto em
texto em 


