Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde vol.30 no.esp1 Brasília 2021 Epub 28-Fev-2021
http://dx.doi.org/10.1590/s1679-4974202100017.esp1
Consenso
Protocolo Brasileño para Infecciones de Transmisión Sexual 2020: infección por el virus Zika
1Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, SP, Brasil
2Ministério da Saúde, Secretaria de Vigilância em Saúde, Brasília, DF, Brasil
3Programa de Pós-Graduação em Saúde Coletiva, Universidade de Brasília, Brasília, DF, Brasil
4Secretaria Municipal de Saúde do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
5Fundação Oswaldo Cruz, Instituto Leônidas e Maria Deane, Manaus, AM, Brasil
Este artículo aborda la transmisión vectorial, sexual y vertical del virus Zika, tema tratado en el Protocolo Clínico y Directrices Terapéuticas para la Atención Integral a Personas con Infecciones de Transmisión Sexual, publicado por el Ministerio de Salud de Brasil en 2020. Aunque en Brasil el virus Zika sea principalmente transmitido por Aedes aegypti, las vías vertical y sexual de transmisión son de gran importancia para la salud reproductiva. La transmisión sexual exige el uso de intervenciones profilácticas específicas, incluido el uso de preservativos masculinos o femeninos, especialmente entre las parejas que planean un embarazo. La transmisión vertical está ligada a graves anomalías estructurales del sistema nervioso central y todavía no existe una vacuna o recursos farmacológicos conocidos que puedan prevenirla. Como la enfermedad es predominantemente asintomática, el incumplimiento de los principios básicos de atención y las pautas relacionadas con la propagación de la infección trasciende la gravedad de los síntomas de la enfermedad.
Palabras clave: Virus Zika; Infección de Transmisión Sexual; Transmisión Vertical; Microcefalia; Anormalidad Congénita; Prevención de Enfermedades
Presentación
El presente artículo está relacionado al capítulo sobre el virus Zika que compone el Protocolo Clínico y Directrices Terapéuticas (PCDT) para Atención Integral a las Personas con Infecciones de Transmisión Sexual (ITS), publicado por la Secretaría de Vigilancia en Salud, del Ministerio de Salud de Brasil. Para la elaboración del PCDT, se realizó la selección y el análisis de las evidencias disponibles en la literatura y una discusión con un panel de especialistas. El referido PCDT fue aprobado por la Comisión Nacional de Incorporación de Tecnologías al Sistema Único Salud (Conitec)1 y actualizado por el grupo de especialistas del PCDT en 2020.
Aspectos epidemiológicos
El virus Zika pertenece a la familia Flaviviridae, género Flavivirus, y se aisló por primera vez en Uganda (África), en 1947.2, 3 Las infecciones en humanos fueron esporádicas durante aproximadamente medio siglo, antes de aparecer de manera epidémica en algunas islas del Pacífico y en América del Sur.4 Durante este período de diseminación bajo diferentes condiciones mesológicas, el virus desarrolló mutaciones importantes, caracterizando dos cepas diferentes, la africana y la asiática.5 Paralelamente a estas adaptaciones genómicas, se modificó el potencial patógeno del virus Zika.6, 7 Actualmente existe evidencia de que las formas de transmisión del virus, incluida la sexual, están influenciadas por estas mutaciones víricas.8
En abril de 2015, el virus Zika se identificó por primera vez en las Américas, y el primer caso se informó en Bahia, Brasil. A fines de enero de 2016, ya se había informado de su circulación autóctona en más de 20 países o territorios en América del Sur, Central y del Norte, en el Caribe y en Cabo Verde, África Occidental.4
La evolución de la incidencia de la infección por el virus Zika en Brasil se representa en la Figura 1. Se puede ver una reducción importante de los casos después del pico epidémico de 2015-2016. Durante este período, se notificaron 37.011 casos en 2015; 216.207 en 2016; 17.452 en 2017; 8.024 en 2018; 10.768 en 2019 y 3.692 hasta la Semana Epidemiológica 23 de 2020.9-12
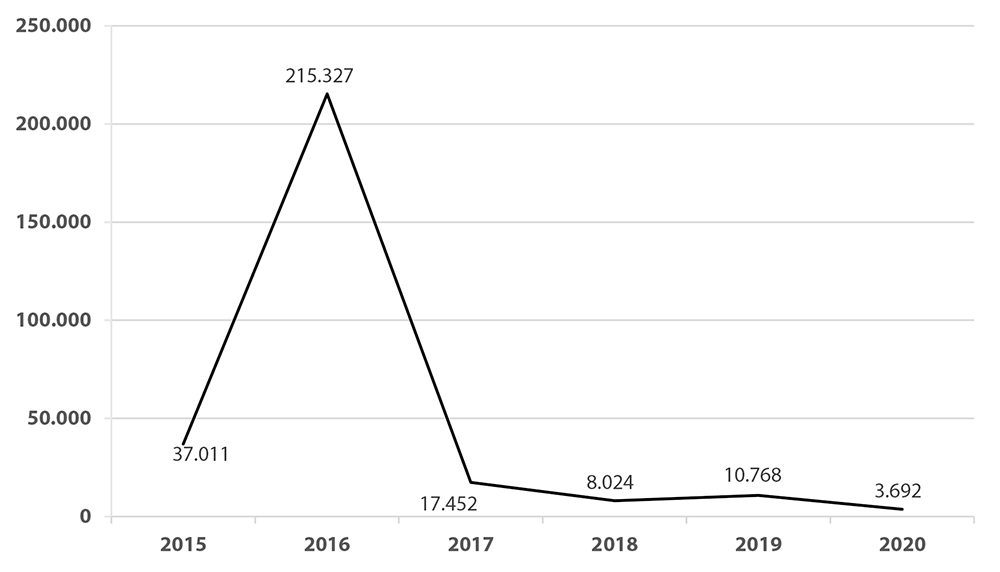
Fuente: Informaciones numéricas retiradas de las referencias 9, 10, 11 y 12.
Figura 1 Número de casos notificados de infección por el virus Zika en Brasil, de la Semana Epidemiológica 45 de 2015 hasta la Semana Epidemiológica 23 de 2020
Las tres formas de transmisión del virus del Zika más estudiadas son la transmisión vectorial, resultante de la picadura de mosquito, la transmisión vertical y la transmisión sexual.13 Este manuscrito trata de la transmisión vertical y sexual (sexo vaginal, anal y oral), debido al enfoque del PCDT. En Brasil, la transmisión vectorial es la más frecuente. Esto ocurre por la picadura de artrópodos infectados, siendo el Aedes aegypti el principal vector en el país. Hay que tener en cuenta que es el mismo mosquito que transmite los virus del dengue, chikungunya y fiebre amarilla.14
La transmisión transplacentaria del virus Zika trae en su contexto una inmensa preocupación debido a su potencial para causar anomalías estructurales del sistema nervioso central embrionario y fetal. Se evocan varios mecanismos para explicar cómo el virus llega al embrión y al feto. Como el sincitiotrofoblasto es resistente a la infección por el virus Zika,15 al inicio del embarazo se utilizan algunos mecanismos que permiten que el virus ingrese a las vellosidades coriónicas, entre los que se encuentran la escisión de las glucosaminas por una proteína viral no estructural (NS1).16 Dentro de las vellosidades, el virus Zika infecta a los macrófagos (células de Hofbauer), donde provoca una intensa proliferación celular e hiperplasia.17, 18
Estudios han descrito la presencia del virus Zika en la sangre, el semen, la orina y la saliva, lo que sugiere que el virus también podría ser transmitido por estos fluidos corporales, pero destacaron la rareza de la ocurrencia.19-22 En lugares con alta frecuencia del mosquito vector, existe dificultad para establecer el riesgo atribuible a la transmisión primaria por la vía sexual. Así, esta vía de transmisión es más importante y tiene un mayor potencial de investigación en países donde la infección por el virus del Zika no es endémica,23, 25 aunque también puede ocurrir en países con transmisión activa por artrópodos.26 Esa forma de transmisión ya se ha relatado en, al menos, 13 países sin transmisión por mosquito.27-28
La transmisión sexual del virus del Zika fue sugerida en 2011 en los Estados Unidos de América, reportando el caso de una mujer infectada con el virus cuando su pareja regresó de un viaje a Senegal en 2008, durante el cual se contagió.23 Posteriormente, se detectó la presencia del ARN del virus Zika en muestras de semen durante más tiempo que en muestras de sangre y orina en un paciente con hematospermia.24
Un estudio realizado en Padua (Italia), de enero de 2016 a enero de 2017, demostró que el virus del Zika se detectó en el semen de cinco de cada diez hombres analizados, con una eliminación de hasta 370 días y una depuración media de 25 días. Sin embargo, en general, este período de eliminación viral es extremadamente variable.28-30 Si bien la detección viral en líquidos no significa viabilidad para una nueva infección, la transmisión sexual de un hombre infectado está facilitada, ya que el semen tiene una mayor carga viral y un período de eliminación más prolongado que en suero y orina.31 Sin embargo, también hay casos de transmisión sexual de mujeres infectadas a sus parejas sexuales.32 También se ha demostrado la transmisión del virus Zika en relacionamiento sexual pasivo y activo entre hombres.21, 33
Aspectos clínicos
La infección por el virus del Zika se describe como una enfermedad febril aguda y autolimitada que dura de tres a siete días, generalmente sin complicaciones graves. La mayoría de las infecciones son asintomáticas, pero del 20 al 25% de las personas infectadas presentan manifestaciones clínicas inespecíficas, por lo que es necesario realizar el diagnóstico diferencial de laboratorio en relación con chikungunya y dengue.34-39 La infección debe sospecharse en presencia de dos o más de los síntomas descritos en la Figura 2. La definición de caso sospechoso es la misma para las personas que viven en áreas endémicas y para los viajeros provenientes de esas áreas, así como para sus contactos sexuales sin protección.25
Figura 2 Frecuencia comparativa de signos y síntomas más comunes en la infección por los virus del dengue, Zika y chikungunya
| Signos y síntomas | Dengue | Zika | Chikungunya |
|---|---|---|---|
| Fiebre (duración) | Superior a 38°C (4 a 7 días) | Sin fiebre o subfebril ≤38°C (1-2 días subfebril) | Fiebre alta >38°C (2-3 días) |
| Manchas en la piel (frecuencia) | Surgen a partir del cuarto día en 30%-50% de los casos | Surgen el primer o segundo día en 90%-100% de los casos | Surgen en 2-5 días en 50% de los casos |
| Dolor en los músculos (frecuencia) | +++/+++ | ++/+++ | +/+++ |
| Dolor articular (frecuencia) | +/+++ | ++/+++ | +++/+++ |
| Dolor articular (intensidad) | Leve | Leve/moderada | Moderada/intensa |
| Edema de la articulación (frecuencia e intensidad) | Raro | Frecuente y leve | Frecuente y de moderado a intenso |
| Conjuntivitis (frecuencia) | Rara | 50%-90% de los casos | 30% |
| Cefalea (frecuencia e intensidad) | +++ | ++ | ++ |
| Prurito | Leve | Moderado/intenso | Leve |
| Hipertrofia ganglionar (frecuencia) | Leve | Intensa | Moderada |
| Discrasia hemorrágica (frecuencia) | Moderada | Ausente | Leve |
| Acometimiento neurológico (frecuencia) | Raro | Más frecuente que dengue y chikungunya | Raro (predominante en neonatos) |
Fuente: adaptado de Duarte et al. (2016),36 Secretaria Estadual de Saúde de Pernambuco (2015)37 y Duffy et al. (2009).39
Entre todas las posibles complicaciones derivadas de la infección por el virus del Zika, se destacan las que ocurrieron como desenlaces gestacionales y neurológicos.40 Incluso en vista de las inexactitudes en cuanto a la prevalencia de estas complicaciones, ya que se desconoce la incidencia real de infecciones (considerando los asintomáticos), la asociación causal entre las complicaciones gestacionales y neurológicas y la infección por el virus del Zika ya se ha establecido científicamente.41, 43 Considerando las complicaciones del embarazo, se estima que las tasas de aborto (1,2% a 3,9% %), defectos oculares (1,0% a 7,5%), óbito fetal (0,7% a 1,6%) y malformaciones (3,1% a 22,8%) aumentan debido a la infección durante el embarazo.35, 44-46 La complicación neurológica más temida en adultos es el síndrome de Guillain-Barré, cuya frecuencia estimada por estudios metanalíticos oscila entre el 0,01% y el 1,23% .47, 48
Del punto de vista reproductivo masculino, en los casos en que el virus alcanza el testículo, se apunta la agresión del virus Zika a los tejidos testiculares, cuyo pronóstico dependerá de la intensidad de la respuesta inmune e inflamatoria, pudiendo variar de simple reducción reversible del número de espermatozoides hasta atrofia testicular.49, 50 Una evaluación realizada entre hombres retornando de áreas endémicas de la infección por el virus Zika para una ciudad europea sin transmisión por mosquitos encontró hematospermia macroscópica en 9,1%, hematospermia microscópica en 81,8% y oligospermia en 60% de ellos.51
Diagnóstico
El diagnóstico de laboratorio durante la infección aguda por el virus del Zika se basa en la detección de ARN viral mediante la reacción en cadena de la polimerasa, mediada por la reacción en cadena de la polimerasa con transcripción inversa, RT-PCR, en suero o sangre hasta siete días después del inicio de los síntomas, o en una muestra de orina hasta 14 días. Si bien existen casos en los que el ARN viral puede detectarse durante más tiempo, tanto en suero, orina y semen, esta posibilidad no contribuye al diagnóstico de la fase aguda de la enfermedad.34
En los casos de manifestaciones clínicas compatibles con la infección por el virus Zika, con resultado negativo en la prueba diagnóstica por RT-PCR, o si han transcurrido más de siete días desde el inicio de los síntomas, se debe solicitar un examen serológico para identificar inmunoglobulina M (IgM) para el virus Zika y el dengue. La IgM se puede detectar, en promedio, a partir del octavo día, y la inmunoglobulina G (IgG), a partir del 17º día después del inicio de la infección. Toda prueba serológica debe interpretarse con precaución, dado el elevado número de reacciones cruzadas con otros Flavivirus.52, 53
Si el resultado de la serología es negativo para ambos virus, se descarta la infección por ambos. Si alguno es positivo, se debe solicitar la prueba de neutralización por reducción de placa, caso esté disponible. Si la reducción es >10 para el virus del dengue y <10 para el virus del Zika, se confirma la infección por dengue. Si el resultado es >10 para el virus del Zika y <10 para el virus del dengue, se confirma la infección por el virus del Zika. Si >10 para ambos virus, se confirma la infección por Flavivirus, y si <10 para ambos, se descartan ambas infecciones.34
Debido a la superposición de síntomas, en regiones con una alta prevalencia de arbovirus, el diagnóstico diferencial de la infección por el virus del Zika debe realizarse con todas las enfermedades exantemáticas, incluidas chikungunya, dengue y sarampión. En gestantes, este diagnóstico diferencial debe ampliarse, considerando sífilis, toxoplasmosis, rubéola, citomegalovirus y herpes (STORCH), todos los cuales tienen el potencial de causar malformaciones fetales,36 extendido a Z-STORCH cuando incluye malformaciones causadas por el síndrome congénito del virus Zika.
Tratamiento
Actualmente, no hay un tratamiento específico para las infecciones por el virus Zika. El manejo implica tratamiento sintomático, que incluye hidratación, analgésicos y antipiréticos, evitando los antiinflamatorios no esteroideos hasta que el diagnóstico de dengue sea descartado.36 Ese principio vale también para las gestantes. En el caso de secuelas más graves, como enfermedades neurológicas, debe haber acompañamiento médico para evaluar el tratamiento adecuado a ser aplicado, prioritariamente en centros especializados.40
Vigilancia, prevención y control
La notificación de casos sospechosos de infección por el virus Zika es obligatoria para todos los estados de Brasil. La medida fue publicada en el Diario Oficial de la Federación a través de la Ordenanza Nº 204, de 17 de febrero de 2016. Todos los casos sospechosos también deben ser reportados a las autoridades sanitarias semanalmente. Para las gestantes con sospecha de infección por virus o de óbito sospechoso, la notificación es inmediata, es decir, debe realizarse dentro de las 24 horas.54
Uno de los factores que refuerza la importancia de las medidas de profilaxis primaria se basa en la falta de una vacuna o tratamiento específico contra la infección por el virus Zika y de métodos de prevención secundaria para la transmisión vertical.14 En la profilaxis primaria, se destaca el control de criaderos de Aedes aegypti y el uso de repelentes y ropa adecuada. También debe tenerse en cuenta que los mosquitos Aedes aegypti tienen hábitos preferentemente diurnos y dependen de la luz y de temperaturas más altas.55 Las estrategias de control biológico de la población de estos vectores se han mostrado prometedoras, como el uso de la bacteria Wolbachia pipiensis,56 que interfiere en la reproducción del Aedes aegypti impidiendo que los huevos de hembras libres de infección eclosionen cuando son fertilizados por un macho infectado con Wolbachia.57, 59
Con el objetivo de controlar la propagación sexual del virus Zika, se debe reforzar la importancia del uso de preservativos (femeninos o masculinos) en todos los casos de posible exposición vectorial o sexual al viajar a áreas de alta transmisión y regresar a áreas no endémicas, o incluso después de la infección diagnosticada.21, 30, 60, 61
En cuanto a las parejas sexuales, es fundamental adoptar medidas que reduzcan la transmisión entre personas infectadas y desarrollar estrategias para disminuir la cadena de transmisión, a través de la identificación y el manejo adecuado de las parejas sexuales. La comunicación de riesgo y la información adecuada a los usuarios de los servicios de salud son fundamentales. Un enfoque diferenciado por género es importante, considerando que las respuestas de hombres y mujeres a la prevención han demostrado ser diferentes. La conciencia sobre la enfermedad está relacionada con una actitud más preventiva y protectora por personas de ambos sexos.62
Según las directrices tanto de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos de América como de la Organización Mundial de la Salud, la cuarentena de las medidas de protección sexual o la abstención sexual al regresar de un viaje a regiones endémicas es de 90 días para hombres y de 60 días para las mujeres. En el caso de la pareja de una mujer embarazada que regresa de una región endémica de infección por el virus Zika, o que tiene la infección diagnosticada, estos organismos internacionales también comparten la orientación del sexo protegido o incluso la abstinencia sexual por el resto del embarazo.25, 63 Esas orientaciones pueden ser seguidas por profesionales brasileños hasta su incorporación a la próxima edición del PCDT.
La infección por el virus Zika durante la gestación
La transmisión vertical del virus Zika, que puede ocurrir en cualquier momento durante la gestación, se ha asociado con resultados graves y perjudiciales desenlaces gestacionales. Aunque la frecuencia de transmisión vertical del virus Zika entre mujeres embarazadas asintomáticas es difícil de medir, existe confirmación de su ocurrencia.13 La persistencia del ARN viral es más prolongada entre las mujeres embarazadas, probablemente debido a la replicación viral en la placenta, aumentando la exposición fetal y el riesgo de malformaciones congénitas, incluso entre madres asintomáticas.64-66
El espectro del acometimiento del sistema nervioso central embrionario o fetal que causa malformaciones y su patogenia aún no están completamente establecidos. Se sabe que el virus Zika tiene tropismo por las células progenitoras neuronales y que, en el cerebro embrionario o embrionario/fetal, detiene el crecimiento, la proliferación, la migración y la diferenciación de células neuronales, con graves consecuencias para el neurodesarrollo.40, 44-46, 67, 68
Cuando la infección ocurre durante el primer y el segundo trimestre del embarazo, existe un mayor riesgo de anomalías estructurales del sistema nervioso central del embrión y del feto. Estas infecciones presentan frecuentemente un cuadro variado de cambios anatómicos, que resultan en ventriculomegalia, calcificaciones intracraneales y microcefalia.13, 14, 35, 69
Los cambios neonatales resultantes de la infección por el virus Zika se agruparon bajo el nombre de síndrome congénito por el virus Zika, incluyendo la microcefalia con colapso del cráneo, córtex cerebral fina con calcificaciones subcorticales, desproporción facial, hipertonía, espasticidad, hiperreflexia, convulsiones, irritabilidad, artrogriposis, cicatrices maculares, manchas focales de la retina pigmentaria, ceguera e hipoacusia neurosensorial.67, 70
La evolución de la frecuencia de la microcefalia como complicador del embarazo en Brasil, entre los años 2015 y 2020, fue publicada en el Boletín Epidemiológico de la Secretaría de Vigilancia en Salud (Figura 3).12 La médula espinal también puede verse afectada, mostrando distorsión arquitectural, pérdida neuronal grave y microcalcificaciones.64 Sin embargo, también se han observado otros cambios en las infecciones que ocurren en el tercer trimestre del embarazo, pero que se detectan tarde, a veces después del nacimiento, como defectos oculares, disfagia, microcefalia, disminución de la agudeza auditiva, anomalías electroencefalográficas y convulsiones, entre otros problemas de salud.45 Solamente estudios de los niños expuestos al virus Zika en la vida intrauterina puede respaldar una comprensión más amplia del síndrome congénito del virus Zika.70
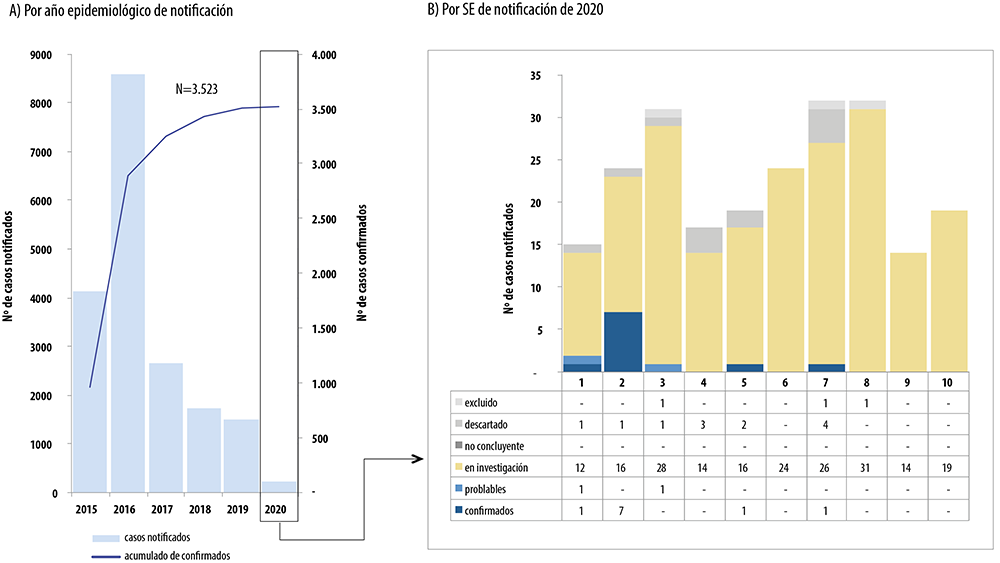
Fuente: Boletín Epidemiológico de la Secretaría de Vigilancia en Salud, Ministerio de Salud. Datos actualizados el 09/03/2020.10
Figura 3 Distribución de los casos notificados de síndrome congénita del virus Zika y otras etiologías infecciosas por año epidemiológico de notificación (A) y por semana epidemiológica (SE) de notificación de 2020 (B), Brasil, 2015 hasta la SE 10 de 2020
Asistencia prenatal de bajo riesgo o riesgo habitual (gestantes sin indicios de infección por el virus Zika)
Para las gestantes de bajo riesgo o riesgo habitual, la estrategia más importante con respecto al virus Zika es evitar que se infecten con este virus. Reafirmar las medidas preventivas para la infección vectorial o sexual son las estrategias más eficientes para prevenir la propagación de esta infección.13, 54 Se debe advertir a las personas que no viven en áreas endémicas que eviten viajar a áreas donde la frecuencia de infección por el virus Zika es elevada.36, 71
Desde el punto de vista asistencial, tras el brote epidémico de infección por el virus Zika, la Federación Brasileña de Asociaciones de Ginecología y Obstetricia recomienda la implantación de una ecografía alrededor de la 12ª semana, una ecografía morfológica alrededor de la 22ª semana y un tercero examen alrededor de la 32ª semana.72, 73 Estas pruebas tienen como objetivo la detección temprana de alteraciones fetales resultantes de una infección materna asintomática por el virus Zika.13, 71
No está indicada la detección universal de la infección previa por el virus Zika entre las “gestantes sintomáticas” mediante pruebas serológicas. Es fundamental considerar la baja precisión de las pruebas, los potenciales costos agregados y los escasos beneficios que se obtienen con esta medida. Si la serología es positiva, mostrando la presencia de anticuerpos al virus, es necesario asegurarse de no dar una falsa impresión de seguridad, que podría reducir el cuidado de la gestante en relación a otros arbovirus (dengue, chikungunya y fiebre amarilla), enfermedades que también pueden presentar resultados nocivos maternos y perinatales.73, 74
En casos sugestivos de infección por el virus, la gestante debe buscar atención médica y someterse a examen físico y de laboratorio, en un intento de orientar el diagnóstico.75 La Federación Brasileña de Asociaciones de Ginecología y Obstetricia indica que, a partir de la confirmación del diagnóstico, el embarazo se considera de alto riesgo perinatal.73
Asistencia prenatal para gestantes con diagnóstico de infección por el virus Zika
Una gran demanda de apoyo psicológico marca la atención prenatal de las embarazadas diagnosticadas con el virus Zika, que es una intervención fundamental, además del cumplimiento de los lineamientos prenatales básicos, como la atención relacionada con la presión arterial y el aumento de peso, nutrición adecuada, pruebas de rutina laboratorio y vacunas.36, 73
Actualmente, se conocen más de 500 causas de microcefalia, además de la infección congénita por el virus Zika, con diversos grados de gravedad. Considerando que la realización del tratamiento y seguimiento del embarazo, así como la del niño al nacer, puede verse influida por la etiología, se destaca la importancia de las pruebas diagnósticas para detectar el agente teratogénico. En el caso de la infección por el virus Zika, la RT-PCR del líquido amniótico, obtenido por amniocentesis, puede ser una alternativa para realizar el diagnóstico diferencial,13, 73 considerando la posibilidad de resultados falsos negativos.62
En los casos de acometimiento fetal, la asistencia prenatal demandará cuidado con la vitalidad fetal por medio de la cardiotocografía y ecografía. La frecuencia de retornos dependerá de cada cuadro clínico fetal, no habiendo condiciones de protocolar intervalos rígidos entre las consultas.13, 73
Parto y lactancia
De forma general, aun los niños acometidos por el síndrome congénito del virus Zika soportan bien el trabajo de parto, considerando el parto vaginal como preferencial para las madres.71, 73 También se considera que la lactancia natural sea lo ideal para los niños nacidos de madres portadoras de la infección por el virus Zika. No habiendo contraindicación de alimentación por vía oral, estará liberada la lactancia.9
Reproducción asistida
Hasta el momento, no hay casos descritos de transmisión vertical de virus Zika decurrente de gestación en que se hayan utilizado técnicas de reproducción asistida, pero se recomiendan algunos cuidados para parejas en tratamiento para infertilidad. Son ellos: a) presentar serología IgM negativa cinco días antes del procedimiento; b) aguardar hasta 90 días después del aparecimiento de signos y síntomas relacionados a infección por el virus Zika cuando el hombre fue infectado o relate exposición sexual de riesgo o viaje a regiones endémicas para esa infección; c) aguardar hasta 60 días luego de signos/síntomas relacionados a la infección por el virus Zika cuando la mujer fue infectada o relate exposición sexual de riesgo o viaje a regiones endémicas para esa infección.25, 63, 75, 76
Agradecimiento
Los autores agradecen a los miembros del grupo técnico de especialistas responsables por la elaboración del PCDT para Atención Integral a las Personas con ITS en 2020 por la contribución sustancial para la realización de este trabajo.
REFERENCIAS
1. Brasil, Ministério da Saúde. Portaria nº 42, de 5 de outubro de 2018. Torna pública a decisão de aprovar o Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis (IST) no âmbito do Sistema Único de Saúde - SUS. Diário Oficial da União, Brasília, DF, 8 out. 2018;194(Seção 1):88. [ Links ]
2. Dick GW, Kitchen SF, Haddow AJ. Zika virus. I. Isolations and serological specificity. Trans. R. Soc. Trop. Med. Hyg., 1952;46:509-520. [ Links ]
3. Macnamara FN. Zika virus: a report on three cases of human infection during an epidemic of jaundice in Nigeria. Trans. R. Soc. Trop. Med. Hyg., 1954;48:139-145. [ Links ]
4. Musso D, Gubler DJ. Zika virus. Clin. Microbiol. Rev., 2016;29(3):487-524. [ Links ]
5. Liu ZY, Shi WF, Qin CF. The evolution of Zika virus from Asia to the Americas. Nat. Rev. Microbiol., 2019;17(3):131-139. doi: 10.1038/s41579-018-0134-9. [ Links ]
6. Esser-Nobis K, Aarreberg LD, Roby JA, Fairgrieve MR, Green R, Gale M Jr. Comparative Analysis of African and Asian Lineage-Derived Zika Virus Strains Reveals Differences in Activation of and Sensitivity to Antiviral Innate Immunity. J. Virol.; 2019;93(13):e00640-19. doi: 10.1128/JVI.00640-19. [ Links ]
7. Hu T, Li J, Carr MJ, Duchêne S, Shi W. The Asian Lineage of Zika Virus: Transmission and Evolution in Asia and the Americas. Virol. Sin., 2019;34(1):1-8. doi: 10.1007/s12250-018-0078-2. [ Links ]
8. Borucki MK, Collette NM, Coffey LL, Van Rompay KKA, Hwang MH, Thissen JB, et al. Multiscale analysis for patterns of Zika virus genotype emergence, spread, and consequence. PLoS One, 2019;14(12):e0225699. doi: 10.1371/journal.pone.0225699. [ Links ]
9. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Situação epidemiológica da infecção pelo vírus Zika no Brasil, de 2015 a 2017. Boletim Epidemiológico, 2018;49(47). [ Links ]
10. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes (dengue, chikungunya e zika), Semanas Epidemiológicas 1 a 52. Boletim Epidemiológico, 2018;49(59). [ Links ]
11. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes (dengue, chikungunya e zika), Semanas Epidemiológicas 1 a 52. Boletim Epidemiológico, 2020;51(02). [ Links ]
12. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes (dengue, chikungunya e zika), Semanas Epidemiológicas 1 a 23. Boletim Epidemiológico, 2020;51(24). [ Links ]
13. Duarte G, Moron AF, Timerman A, Fernandes CE, Mariani Neto C, Almeida Filho GL, et al. Infecção do vírus Zika em gestantes e microcefalia. Rev. Bras. Ginecol. Obstet., 2017;39(5):235-248. [ Links ]
14. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância de Doenças e Agravos Não Transmissíveis e Promoção da Saúde. Saúde Brasil 2015/2016: uma análise da situação de saúde e da epidemia pelo vírus Zika e por outras doenças transmitidas pelo Aedes aegypti. Brasília: Ministério da Saúde; 2017. [ Links ]
15. Miranda J, Martín-Tapia D, Valdespino-Vázquez Y, Alarcón L, Espejel-Nuñez A, Guzmán-Huerta M, et al. Syncytiotrophoblast of Placentae from Women with Zika Virus Infection Has Altered Tight Junction Protein Expression and Increased Paracellular Permeability. Cells, 2019;8(10):1174. [ Links ]
16. Puerta-Guardo H, Tabata T, Petitt M, Dimitrova M, Glasner DR, Pereira L, et al. Zika Virus Nonstructural Protein 1 Disrupts Glycosaminoglycans and Causes Permeability in Developing Human Placentas. J. Infect. Dis., 2020;221(2):313-324. [ Links ]
17. Rosenberg AZ, Yu W, Hill DA, Reyes CA, Schwartz DA. Placental Pathology of Zika Virus: Viral Infection of the Placenta Induces Villous Stromal Macrophage (Hofbauer Cell) Proliferation and Hyperplasia. Arch. Pathol. Lab. Med.; 2017;141(1):43-48. [ Links ]
18. Simoni MK, Jurado KA, Abrahams VM, Fikrig E, Guller S. Zika virus infection of Hofbauer cells. Am. J. Reprod. Immunol., 2017;77(2):10.1111/aji.12613. [ Links ]
19. Musso D, Nhan T, Robin E, Roche C, Bierlaire D, Zisou K, et al. Potential for Zika virus transmission through blood transfusion demonstrated during an outbreak in French Polynesia, November 2013 to February 2014. Euro. Surveill., 2014;19.20761. doi: 10.2807/1560-7917. [ Links ]
20. Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detection of Zika virus in urine. Emerg. Infect. Dis., 2015;21(1):84-6. [ Links ]
21. Atkinson B, Hearn P, Afrough B, Lumley S, Carter D, Aarons EJ, et al. Detection of Zika Virus in Semen. Emerg. Infect. Dis., 2016;22(5):940. doi: 10.3201/eid2205.160107. [ Links ]
22. Barzon L, Pacenti M, Berto A, et al. Isolation of infectious Zika virus from saliva and prolonged viral RNA shedding in a traveller returning from the Dominican Republic to Italy, January 2016. Euro. Surveill., 2016; 21:30159. doi: 10.2807/1560-7917.ES.2016.21.10.30159. [ Links ]
23. Foy BD, Kobylinski KC, Chilson Foy JL, Blitvich BJ, da Rosa AT, Haddow AD, et al. Probable non-vector-borne transmission of Zika virus, Colorado, USA. Emerg. Infect. Dis., 2011;17(5):880-2. [ Links ]
24. Musso D, Roche C, Robin E, Nhan T, Teissier A, Cao-Lormeau VM. Potential sexual transmission of Zika virus. Emerg. Infect. Dis., 2015;21(2):359-61. [ Links ]
25. World Health Organization. WHO guidelines for the prevention of sexual transmission of Zika virus. Geneva: World Health Organization; 2020. Disponível em: https://apps.who.int/iris/bitstream/handle/10665/332466/9789241550482-eng.pdf. [ Links ]
26. Mead PS, Hills SL, Brooks JT. Zika virus as a sexually transmitted pathogen. Curr. Opin. Infect. Dis., 2018;31(1):39-44. doi: 10.1097/QCO.0000000000000414. [ Links ]
27. Counotte MJ, Kim CR, Wang J, Bernstein K, Deal CD, Broutet NJN, et al. Sexual transmission of Zika virus and other flaviviruses: a living systematic review. PLoS Med., 2018;15(7):e1002611. doi: 10.1371/journal.pmed.1002611. [ Links ]
28. Mead PS, Duggal NK, Hook SA, Delorey M, Fischer M, Olzenak McGuire D, et al. Zika Virus Shedding in Semen of Symptomatic Infected Men. N. Engl. J. Med., 2018; 378:1377-78. [ Links ]
29. Barzon L, Percivalle E, Pacenti M, Rovida F, Zavattoni M, Del Bravo P, et al. Virus and Antibody Dynamics in Travelers With Acute Zika Virus Infection. Clin. Infect. Dis., 2018;66:1173-1180. [ Links ]
30. Paz-Bailey G, Rosenberg ES, Doyle K, Munoz-Jordan J, Santiago GA, Klein L, et al. Persistence of Zika virus in body fluids: final report. N. Engl. J. Med., 2017; 379(13):1234-1243. [ Links ]
31. Calvet GA, Kara EO, Giozza SP, Bôtto-Menezes CH, Gaillard P, Franca RF, et al. Study on the persistence of Zika virus (ZIKV) in body fluids of patients with ZIKV infection in Brazil. BMC Infect. Dis., 2018;18(1):49. doi: 10.1186/s12879-018-2965-4. [ Links ]
32. Davidson A, Slavinski S, Komoto K, Rakeman J, Weiss D. Suspected Female-to-Male Sexual Transmission of Zika Virus - New York City, 2016. MMWR Morb. Mortal. Wkly. Rep., 2016;65:716-717. [ Links ]
33. Deckard DT, Chung WM, Brooks JT, Smith JC, Woldai S, Hennessey M, et al. Male-to-Male Sexual Transmission of Zika Virus - Texas, January 2016. MMWR Morb. Mortal. Wkly. Rep., 2016;65:372-4. [ Links ]
34. Sharp TM, Fischer M, Muñoz-Jordán JL, Paz-Bailey G, Staples JE, Gregory CJ, et al. Dengue and Zika Virus Diagnostic Testing for Patients with a Clinically Compatible Illness and Risk for Infection with Both Viruses. MMWR Recomm. Rep., 2019;68(No. RR-1):1-10. [ Links ]
35. Ximenes R, Ramsay LC, Miranda RN, Morris SK, Murphy K, Sander B; RADAM-LAC Research Team. Health outcomes associated with Zika virus infection in humans: a systematic review of systematic reviews. BMJ Open, 2019;9(11):e032275. doi: 10.1136/bmjopen-2019-032275. [ Links ]
36. Duarte G. Infecção pelo vírus Zika durante a gravidez. Femina, 2016;44:36-47. [ Links ]
37. Pernambuco (estado). Secretaria Estadual de Saúde. Secretaria Executiva de Vigilância em Saúde. Protocolo Clínico e Epidemiológico para investigação de casos de microcefalia no estado de Pernambuco. Versão n. 2. Pernambuco: Secretaria Estadual de Saúde; 2015. p. 1-42. [ Links ]
38. Lobkowicz L, Ramond A, Sanchez Clemente N, Ximenes RAA, Miranda-Filho DB, Montarroyos UR, et al. The frequency and clinical presentation of Zika virus coinfections: a systematic review. BMJ Glob Health. 2020;5(5):e002350. doi: 10.1136/bmjgh-2020-002350 [ Links ]
39. Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, et al. Zika virus outbreak on Yap Island, Federated States of Micronesia. N. Engl. J. Med., 2009;360:2536-2543. [ Links ]
40. Pan American Health Organization. Epidemiological alert. Neurological syndrome, congenital malformations, and Zika virus infections. Implications for public health in the Americas. Washington, DC: Pan American Health Organization; 1 dez. 2015. Disponível em: https://www.paho.org/hq/dmdocuments/2015/2015-dec-1-cha-epi-alert-zika-neuro-syndrome.pdf. [ Links ]
41. Pomar L, Musso D, Malinger G, Vouga M, Panchaud A, Baud D. Zika virus during pregnancy: From maternal exposure to congenital Zika virus syndrome. Prenat. Diagn., 2019;39(6):420-430. doi: 10.1002/pd.5446. [ Links ]
42. Counotte MJ, Egli-Gany D, Riesen M, Abraha M, Porgo TV, Wang J, Low N. Zika virus infection as a cause of congenital brain abnormalities and Guillain-Barré syndrome: From systematic review to living systematic review. F1000 Res., 2018;7:196. doi: 10.12688/f1000research.13704.1. [ Links ]
43. Cranston JS, Tiene SF, Nielsen-Saines K, Vasconcelos Z, Pone MV, Pone S, et al. Association Between Antenatal Exposure to Zika Virus and Anatomical and Neurodevelopmental Abnormalities in Children. JAMA Netw. Open, 2020;3(7):e209303. doi: 10.1001/jamanetworkopen.2020.9303. [ Links ]
44. Nithiyanantham SF, Badawi A. Maternal infection with Zika virus and prevalence of congenital disorders in infants: systematic review and meta-analysis. Can. J. Public Health, 2019;110(5):638-648. [ Links ]
45. Coutinho M, Negrini SFBM, Araujo DCA, Teixeira S, Amaral F, Moro MC, Fernandes J, et al. Early maternal Zika infection predicts severe neonatal neurological damage: results from the prospective Natural History of ZIKA Virus Infection in Gestation (NATZIG) cohort study. Br. J. Obstet. Gynaecol. June 01, 2020. doi: 10.22541/au.159103608.85557750. [ Links ]
46. Sanchez Clemente N, Brickley EB, Paixão ES, Almeida MF, Gazeta RE, Vedovello D, Rodrigues LC, et al. Zika virus infection in pregnancy and adverse fetal outcomes in São Paulo State, Brazil: a prospective cohort study. Sci. Rep., 2020;10(1):12673. doi: 10.1038/s41598-020-69235-0. [ Links ]
47. Mier-Y-Teran-Romero L, Delorey MJ, Sejvar JJ, Johansson MA. Guillain-Barré syndrome risk among individuals infected with Zika virus: a multi-country assessment. BMC Med., 2018;16(1):67. doi:10.1186/s12916-018-1052-4. [ Links ]
48. Barbi L, Coelho AVC, Alencar LCA, Crovella S. Prevalence of Guillain-Barré syndrome among Zika virus infected cases: a systematic review and meta-analysis. Braz. J. Infect. Dis., 2018;22(2):137-141. [ Links ]
49. Almeida RDN, Braz-de-Melo HA, Santos IO, Corrêa R, Kobinger GP, Magalhaes KG. The Cellular Impact of the ZIKA Virus on Male Reproductive Tract Immunology and Physiology. Cells, 2020;9(4):1006. doi: 10.3390/cells9041006. [ Links ]
50. Tsetsarkin KA, Acklin JA, Liu G, Kenney H, Teterina NL, Pletnev AG, Lim JK. Zika virus tropism during early infection of the testicular interstitium and its role in viral pathogenesis in the testes. PLoS Pathog., 2020;16(7):e1008601. doi: 10.1371/journal.ppat.1008601. [ Links ]
51. Huits R, De Smet B, Ariën KK, Van Esbroeck M, Bottieau E, Cnops L. Zika virus in semen: a prospective cohort study of symptomatic travellers returning to Belgium. Bull. World. Health Organ., 1 dez. 2017;95(12):802-809. doi: 10.2471/BLT.17.181370. [ Links ]
52. Eppes C, Rac M, Dunn J, Versalovic J, Murray KO, Suter MA, et al. Testing for Zika virus infection in pregnancy: key concepts to deal with an emerging epidemic. Am. J. Obstet. Gynecol., 2017;216(3):209-225. [ Links ]
53. Ximenes RAA, Miranda-Filho DB, Brickley EB, Montarroyos UR, Turchi Martelli CM, Barreto-Araújo TV, et al. Zika virus infection in pregnancy: Establishing a case definition for clinical research on pregnant women with rash in an active transmission setting. PLoS Negl. Trop. Dis., 2019;13(10):e0007763. [ Links ]
54. Brasil. Ministério da Saúde. Portaria nº 204, de 17 de fevereiro de 2016. Lista Nacional de Notificação Compulsória de doenças, agravos e eventos de saúde pública nos serviços de saúde públicos e privados em todo o território nacional. Diário Oficial da União, Brasília, DF, 18 fev. 2016; 32(Seção 1):23. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2016/prt0204_17_02_2016.html. [ Links ]
55. Brasil. Ministério da Saúde. Combate ao Aedes Aegypti: prevenção e controle da Dengue, Chikungunya e Zika. Brasília: Ministério da Saúde, 2020. Disponível em: https://www.saude.gov.br/saude-de-a-z/combate-ao-aedes. [ Links ]
56. O'Neill SL. The Use of Wolbachia by the World Mosquito Program to Interrupt Transmission of Aedes aegypti Transmitted Viruses. Adv. Exp. Med. Biol., 2018;1062:355-360. [ Links ]
57. Serbus LR, Casper-Lindley C, Landmann F, Sullivan W. The genetics and cell biology of Wolbachia-host interctions. Ann. ver. Genet., 2008;42:683-707. [ Links ]
58. Dutra HL, Rocha MN, Dias FB, Mansur SB, Caragata EP, Moreira LA. Wolbachia blocks currently circulating Zika virus isolates in Brazilian Aedes aegypti mosquitoes. Cell. Host. Microbe, 2016:771-774. [ Links ]
59. Caragata EP, Rocha MN, Pereira TN, Mansur SB, Dutra HLC, Moreira LA. Pathogen blocking in Wolbachia-infected Aedes aegypti is not affected by Zika and dengue virus co-infection. PLoS Negl. Trop. Dis., 2019;13(5):e0007443. [ Links ]
60. Deckard DT, Chung WM, Brooks JT, Smith JC, Woldai S, Hennessey M, et al. Male-to-male sexual transmission of Zika virus - Texas, January 2016. MMWR Morb. Mortal. Wkly. Rep., 2016;65(14):372-4. [ Links ]
61. Oster AM, Brooks JT, Stryker JE, Kachur RE, Mead P, Pesik NT, et al. Interim Guidelines for Prevention of Sexual Transmission of Zika Virus - United States, 2016. MMWR Morb. Mortal. Wkly. Rep., 2016;65(5):120-1. [ Links ]
62. Jo S, Kim Y, Choi JS. Influencing factors on preventive health behaviours for Zika virus in pregnant women and their partners. J. Clin. Nurs., 2019;28(5-6):894-901. [ Links ]
63. Polen KD, Gilboa SM, Hills S, Oduyebo T, Kohl KS, Brooks JT, et al. Interim guidance for preconception counseling and prevention of sexual transmission of Zika virus for men with possible Zika virus exposure - United States. MMWR Morb. Mortal. Wkly. Rep., 2018;67:868-871. [ Links ]
64. Ramalho FS, Yamamoto AY, da Silva LL, Figueiredo LTM, Rocha LB, Neder L, et al. Congenital Zika Virus Infection Induces Severe Spinal Cord Injury. Clin. Infect. Dis., 2017;65(4):687-690. [ Links ]
65. Reagan-Steiner S, Simeone R, Simon E, Bhatnagar J, Oduyebo T, Free R, et al. Evaluation of Placental and Fetal Tissue Specimens for Zika Virus Infection - 50 States and District of Columbia, January-December, 2016. MMWR Morb. Mortal. Wkly. Rep., 2017;66(24):636-643. [ Links ]
66. Venceslau EM, Guida JPS, Nobrega GM, Samogim AP, Parise PL, Japecangaet RR, et al. Adequate placental sampling for the diagnosis and characterization of placental infection by Zika virus. Front Microbiol., 2020;11:112. doi: 10.3389/fmicb.2020.00112. [ Links ]
67. van der Linden V, Filho EL, Lins OG, van der Linden A, Aragão MFVV, Brainer-Lima AM. et al. Congenital Zika syndrome with arthrogryposis: retrospective case series study. BMJ, 2016; 354:i3899. doi: 10.1136/bmj.i3899. [ Links ]
68. Liang Q, Luo Z, Zeng J, Chen W, Foo SS, Lee SA, et al. Zika Virus NS4A and NS4B Proteins Deregulate Akt-mTOR Signaling in Human Fetal Neural Stem Cells to Inhibit Neurogenesis and Induce Autophagy. Cell. Stem. Cell., 2016;19(5):663-671. [ Links ]
69. Schuler-Faccini L, Ribeiro EM, Feitosa IML, Horovitz DD, Cavalcanti DP, Pessoa A, et al. Possible association between Zika virus infection and microcephaly - Brazil, 2015. MMWR Morb. Mortal. Wkly. Rep., 2016;65:59-62. [ Links ]
70. Moore CA, Staples JE, Dobyns WB, Pessoa A, Ventura CV, Fonseca EB, et al. Characterizing the Pattern of Anomalies in Congenital Zika Syndrome for Pediatric Clinicians. JAMA Pediatr., 2017;171(3):288-295. [ Links ]
71. American College of Obstetricians and Gynecologists (ACOG). Management of Patients in the Context of Zika Virus: ACOG Committee Opinion, Number 784. Obstet. Gynecol., 2019;134(3):e64-e70. [ Links ]
72. Walker CL, Ehinger N, Mason B, Oler E, Little ME, Ohuma EO, Papageorghiou AT, et al. Ultrasound prediction of Zika virus-associated congenital injury using the profile of fetal growth. PLoS One, 2020;15(5):e0233023. doi: 10.1371/journal.pone.0233023. [ Links ]
73. Federação Brasileira das Associações de Ginecologia e Obstetrícia. Infecção pelo vírus Zika e microcefalia. Comissão Especializada Provisória para o estudo do vírus Zika, gravidez e microcefalia. São Paulo, SP: Febrasgo, 2016. Disponível em: https://www.febrasgo.org.br/media/k2/attachments/01-INFECCAO_PELO_VIRUS_ZIKA_EM_GESTANTES_E_MICROCEFALIA.pdf. [ Links ]
74. Charlier C, Beaudoin MC, Couderc T, Lortholary O, Lecuit M. Arboviruses and pregnancy: maternal, fetal, and neonatal effects. Lancet Child. Adolesc. Health, 2017;1(2):134-146. doi: 10.1016/S2352-4642(17)30021-4. [ Links ]
75. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis. Protocolo Clínico e Diretrizes Terapêuticas para Atenção Integral às Pessoas com Infecções Sexualmente Transmissíveis [Internet]. Brasília: Ministério da Saúde ; 2020. Disponível em: http://www.aids.gov.br/pt-br/pub/2015/protocolo-clinico-e-diretrizes-terapeuticas-para-atencao-integral-pessoas-com-infeccoes. [ Links ]
76. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 72, de 30 de março de 2016. Altera a Resolução da Diretoria Colegiada RDC nº 23, de 27 de maio de 2011, que dispõe sobre o regulamento técnico para o funcionamento dos Bancos de Células e Tecidos Germinativos e dá outras providências. Diário Oficial da União, DF, 1 abr. 2016; 62(Seção 1):103. Disponível em: http://portal.anvisa.gov.br/documents/10181/2718376/RDC_72_2016_.pdf/7283a105-bb94-4a6c-a3d6-ca69f8563dff. [ Links ]
Recibido: 25 de Julio de 2020; Aprobado: 19 de Octubre de 2020










 texto em
texto em