Contribuições do estudo
Principais resultados
Observou-se crescimento da prevalência da infecção por SARS-CoV-2 no Espírito Santo, Grande Vitória e interior do estado. As chances de exames reagentes foram maiores para o sexo feminino e em domicílios com mais de dois moradores.
INTRODUÇÃO
Após os primeiros casos de COVID-19, infecção causada pelo SARS-CoV-2, na China, no final do ano de 2019, rapidamente foram registrados casos e óbitos pela doença em todos os continentes,1-4 dada a rápida transmissão desse vírus por meio de gotículas de saliva ou aerossóis.5,6 Desde a declaração da pandemia, em 11 de março de 2020, mudanças no comportamento da sociedade e na tomada de decisões têm sido exigidas dos governos, a fim de se mitigarem os efeitos causados à população pela pandemia.6
O retorno às atividades sociais e laborais, após um período de medidas rígidas de isolamento, acarretou a elevação das curvas de incidência e mortalidade pela COVID-19, após um período inicial de queda desses indicadores, em todo o mundo. Essa oscilação no perfil epidemiológico da doença gera incertezas quanto à disponibilidade de recursos necessários para a adequada assistência aos casos.7
Dados divulgados pelo Ministério da Saúde do Brasil mostraram que, até 12 de setembro de 2021, haviam sido registrados cerca de 20 milhões de casos confirmados de COVID-19 e aproximadamente 600 mil óbitos atribuídos a ela, no país; no estado do Espírito Santo, até a mesma data, haviam sido notificados 571.396 casos e 12.352 óbitos por COVID-19.8
Nesse contexto da pandemia de COVID-19, informações sobre a taxa de incidência e o estado de imunidade da população são importantes para subsidiar o planejamento de políticas públicas, visando ao controle da doença. Inquéritos de base populacional são úteis para monitorar a progressão da infecção, conhecer e/ou monitorar características/comportamentos da população e/ou dos serviços de saúde, diante da disseminação viral. Nesse sentido, estudos de prevalência de base populacional têm sido indicados pela Organização Mundial da Saúde (OMS), porque auxiliam na tomada de decisões pelas autoridades sanitárias, sobretudo quando realizados de forma seriada, permitindo avaliar o comportamento da doença ao longo do tempo.9,10
O presente estudo teve como objetivo analisar a soroprevalência de SARS-CoV-2 e sua associação com aspectos sociodemográficos e clínicos, no estado do Espírito Santo, Brasil.
MÉTODOS
Estudo transversal de base populacional, seriado, realizado no Espírito Santo, tomando os domicílios como unidade de análise. Ele foi delineado segundo as diretrizes estabelecidas no protocolo de investigação soroepidemiológica estratificada por idade, com base na população, para infecção pelo vírus da COVID-19.9
Foram realizados quatro levantamentos transversais sequenciais, denominados aqui como ‘etapas’. O processo amostral de cada etapa foi independente. O intervalo entre as etapas foi de 15 dias, tendo-se concluído as quatro no período de dois meses. As etapas foram iniciadas nas datas de 10 de maio, 24 de maio, 7 de junho e 21 de junho de 2020, com duração de uma semana de coleta de dados para cada uma.
Segundo o Instituto Brasileiro de Geografia e Estatística (IBGE), o Espírito Santo possuía 4.018.650 habitantes em 2019, residentes em quatro regiões intermediárias e oito regiões imediatas.11 Os oito estratos da pesquisa correspondem às regiões imediatas do estado: Vitória, com dez municípios; Afonso Cláudio-Venda Nova do Imigrante-Santa Maria de Jetibá, com 11; São Mateus, com nove; Linhares, com seis; Colatina, com 13; Nova Venécia, com cinco; Cachoeiro de Itapemirim, com 12; e Alegre, também com 12 municípios.11
A amostragem foi realizada em municípios-sentinela que concentram as maiores populações urbanas por região geográfica do estado. A seleção de municípios-sentinela justificou-se pela exiguidade de tempo e disponibilidade limitada de testes. Foram selecionados os municípios mais representativos das regiões imediatas (um para cada região), acrescentando-se os municípios mais populosos da Região Metropolitana da Grande Vitória (Vitória; Vila Velha; Cariacica; Serra). Assim, foram pesquisados 11 municípios, e os resultados, apresentados segundo três agrupamentos: todo o Espírito Santo; Região Metropolitana da Grande Vitória; e municípios do interior.
O tamanho da amostra para cada etapa foi definido em 4.500 domicílios, considerando-se como prevalências esperadas, para cada uma delas, 3%, 5%, 10% e 20%, respectivamente. A precisão total associada a esses tamanhos de amostra foi de 0,5, 0,6, 1,0 e 1,2 pontos percentuais, respectivamente. O nível de significância adotado foi de 5%.
O número de domicílios selecionados em cada município foi proporcional ao tamanho de suas populações urbanas. A unidade territorial utilizada foi o setor censitário, sendo realizados sorteios de setores censitários urbanos da malha estabelecida em 2010, adotando-se como critérios a dimensão menor que 100 hectares e a presença de mais de 200 domicílios. Quando comparada a malha de 2010 com a malha preliminar de 2020, foram observadas pequenas mudanças quanto à divisão por setores censitários. Adotou-se o número fixo de domicílios da amostra de 40 por setor censitário, com uma amostra final de mais de 4.500 indivíduos, a despeito de arredondamentos. Foi selecionado um número maior de setores nos municípios com maiores populações, para se garantir a proporcionalidade das amostras. Conforme preconizado pelo IBGE, foram utilizados os setores censitários a fim de se obter homogeneidade de população para os setores.
Foi realizado um sorteio sistemático dos domicílios, com a seleção de um a cada cinco, a partir de um ponto gerado aleatoriamente. Em cada domicílio sorteado para a amostra, foi anotada a lista de moradores, e apenas um deles foi sorteado para participar do inquérito, de maneira a se garantir a independência das unidades amostrais consideradas no estudo: os domicílios. A cada nova etapa do inquérito, a amostragem incluiu os mesmos setores censitários, porém domicílios diferentes daqueles incluídos nas etapas anteriores. Nos casos em que o domicílio sorteado não possuía morador no momento da pesquisa, o pesquisador dirigiu-se ao domicílio seguinte, e, posteriormente, continuou a seleção sistemática de abordagem. Em caso do sorteio do mesmo domicílio da etapa anterior, o pesquisador dirigiu-se ao próximo domicílio. Foram incluídos no estudo indivíduos maiores de 2 anos de idade.
Os dados foram coletados por meio de entrevistas. As perguntas dos entrevistados com menos de 16 anos foram respondidas pelos responsáveis.
Os seguintes dados individuais dos participantes foram obtidos na entrevista:
sexo (masculino; feminino);
faixa etária (em anos: até 20; 21 a 40; 41 a 60; 61 a 80; 81 e mais);
anos de estudo do respondente (analfabeto; até 8; 9 ou mais);
escolaridade da pessoa com maior grau de instrução no domicílio (analfabeto; ensino fundamental; ensino médio; ensino superior completo; ensino superior incompleto);
raça/cor da pele autorreferida (branca; parda; preta; amarela; indígena);
número de moradores do domicílio (1; 2; 3; 4; 5 ou mais);
procura pela unidade de saúde, por conta de sintomas de COVID-19, nos últimos 15 dias (sim; não); e
sintomas de COVID-19 (tosse, febre, cansaço, dores no corpo, dificuldade para respirar, alterações no paladar ou olfato, outros) nos 15 dias anteriores à entrevista.
Realizou-se a coleta de uma amostra de sangue por meio de punção digital com lanceta estéril, de acordo com a técnica orientada pelo laboratório, respeitando-se os cuidados de biossegurança. A pesquisa de anticorpos IgM e IgG anti-SARS-Cov-2 foi realizada aplicando-se o teste rápido imunocromatográfico da marca Celer, registrado na Agência Nacional de Vigilância Sanitária (Anvisa) sob o no 80537410048. O teste foi considerado reagente quando indicou resultado reagente para os anticorpos SARS-CoV-2 na amostra, independentemente de ser IgG ou IgM. Esse teste possui sensibilidade de 86,4% e especificidade de 97,6%.11
A coleta dos dados foi realizada utilizando-se plataforma da Atenção Primária à Saúde no SUS (e-SUS) e smartphones conectados à internet, com a possibilidade de gerenciamento na ausência de conexão remota. Esses dados geraram um arquivo em planilha do programa Excel, com subsequente análise utilizando-se o programa Statistical Package for the Social Science (SPSS), em sua versão 20.0.
Os dados brutos foram organizados em tabelas de frequência, e a prevalência, com seus respectivos intervalos de confiança de 95% (IC95%), estimada pontualmente. A análise da associação das características dos participantes com a presença de anticorpos - anti-SARS-Cov-2 - foi realizada aplicando-se o teste qui-quadrado de Pearson e a razão de chances [ou odds ratio (OR)], mediante regressão logística. Na análise de regressão logística multivariável, permaneceram, no modelo final, as variáveis independentes que apresentaram p-valor no teste qui-quadrado menor ou igual a 0,20 para sua relação univariada com o desfecho (i.e., chance de teste reagente para COVID-19). O ajuste do efeito de cada variável, independente na chance de desfecho, foi realizado considerando-se todas as demais variáveis do modelo, de forma concomitante. Foi realizado o teste de Hosmer-Lemeshow (teste HL) para avaliar quão bem os dados se ajustavam ao modelo. O nível de significância adotado foi de 5%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade de Vila Velha (CEP/UVV): Certificado de Apresentação para Apreciação Ética (CAAE) no 31417020.3.0000.5064; Parecer no 4.317.264, emitido em 4 de maio de 2020. Todos os participantes foram informados sobre os objetivos do estudo, riscos e benefícios. A coleta dos dados foi realizada após a leitura e assinatura do Termo de Consentimento Livre e Esclarecido pelos participantes ou pelos responsáveis, entre aqueles com idade inferior a 18 anos.
As medidas de segurança biológica cabíveis foram tomadas, de forma a se garantir a saúde dos trabalhadores de campo durante a coleta dos dados e do material. Os casos positivos foram notificados ao serviço municipal de saúde, para as providências necessárias. Nos domicílios onde foram detectados participantes com resultado reagente ou casos sintomáticos de COVID-19, testes foram oferecidos aos demais residentes. Esses resultados não foram considerados no cálculo de prevalência apresentado, tendo em vista que esses indivíduos não estavam incluídos na amostra do estudo; entretanto, foi apresentada a razão entre o número de contatos reagentes dividido pelos casos reagentes, entre os sorteados na amostra.
RESULTADOS
A amostra total foi composta de 18.791 indivíduos, dos quais 4.597 na etapa 1, 4.638 na etapa 2, 4.633 na etapa 3 e 4.923 na etapa 4.
No total, foram observados 1.148 indivíduos com resultados reagentes. Nos domicílios com indivíduo cujo teste resultou reagente, foram testados todos os moradores presentes no momento da pesquisa, perfazendo 1.826 exames adicionais; destes, 738 apresentaram resultado reagente, indicando um percentual de 40,4% de resultados reagentes nos contatos.
A maioria dos avaliados era do sexo feminino (62,4%), havendo maior proporção para a idade entre 41 e 60 anos (35,1%), raça/cor da pele parda (45,4%), nove ou mais anos de estudo (59,5%), nenhum sintoma de COVID-19 (61,2%) e para quem não procurou por unidade de saúde ao apresentar sintomas de COVID-19 (82,6%) (Tabela 1).
Tabela 1 - Distribuição das características sociodemográficas de acordo com o resultado do teste para SARS-CoV-2 (N=18.791), Espírito Santo, maio-junho/2020
| Variável | Total | Resultado do teste | p-valora | ||||
|---|---|---|---|---|---|---|---|
| Reagente | Não reagente | ||||||
| N | % | n | % | n | % | ||
| Sexo | |||||||
| Feminino | 11.715 | 62,4 | 761 | 6,5 | 10.954 | 93,5 | 0,005 |
| Masculino | 7.071 | 37,6 | 387 | 5,5 | 6.684 | 94,5 | |
| Faixa etária (em anos) | |||||||
| ≤ 20 | 1.298 | 6,9 | 75 | 5,8 | 1.223 | 94,2 | 0,028 |
| 21-40 | 5.638 | 30,1 | 373 | 6,6 | 5.265 | 93,4 | |
| 41-60 | 6.598 | 35,1 | 424 | 6,4 | 6.174 | 93,6 | |
| 61-80 | 4.648 | 24,7 | 247 | 5,3 | 4.401 | 94,7 | |
| ≥ 81 | 604 | 3,2 | 29 | 4,8 | 575 | 95,2 | |
| Raça/cor da pele | |||||||
| Branca | 7.291 | 39,1 | 371 | 5,1 | 6.920 | 94,9 | 0,001 |
| Parda | 8.475 | 45,4 | 542 | 6,4 | 7.933 | 93,6 | |
| Preta | 2.650 | 14,2 | 208 | 7,8 | 2.442 | 92,2 | |
| Amarela | 183 | 1,0 | 14 | 7,7 | 169 | 92,3 | |
| Indígena | 49 | 0,3 | 3 | 6,1 | 46 | 93,9 | |
| Anos de estudo | |||||||
| Analfabeto | 662 | 3,6 | 33 | 5,0 | 629 | 95,0 | 0,089 |
| ≤ 8 | 6840 | 36,9 | 451 | 6,6 | 6.389 | 93,4 | |
| ≥ 9 | 11.050 | 59,5 | 655 | 5,9 | 10.395 | 94,1 | |
| Número de moradores no domicílio | |||||||
| 1 | 2.190 | 11,7 | 88 | 4,0 | 2.102 | 96,0 | 0,001 |
| 2 | 5.064 | 27,0 | 251 | 5,0 | 4.813 | 95,0 | |
| 3 | 5.012 | 26,6 | 299 | 6,0 | 4.713 | 94,0 | |
| 4 | 3.812 | 20,3 | 263 | 6,9 | 3.549 | 93,1 | |
| ≥ 5 | 2.706 | 14,4 | 247 | 9,1 | 2.459 | 90,9 | |
| Mais alto nível de escolaridade do domicílio | |||||||
| Analfabeto | 375 | 2,0 | 15 | 4,0 | 360 | 96,0 | 0,001 |
| Ensino fundamental | 4.608 | 24,5 | 286 | 6,2 | 4.322 | 93,8 | |
| Ensino médio | 7.720 | 41,1 | 568 | 7,4 | 7.152 | 92,6 | |
| Ensino superior completo | 4.735 | 25,2 | 200 | 4,2 | 4.535 | 95,8 | |
| Ensino superior incompleto | 1.348 | 7,2 | 79 | 5,9 | 1.269 | 94,1 | |
| Número de sintomas | |||||||
| Nenhum | 11.515 | 61,2 | 349 | 3,0 | 11.166 | 97,0 | 0,001 |
| 1 | 2.999 | 16,0 | 165 | 5,5 | 2.834 | 94,5 | |
| 2 | 1.573 | 8,4 | 125 | 7,9 | 1.448 | 92,1 | |
| 3 | 901 | 4,8 | 103 | 11,4 | 798 | 88,6 | |
| 4 | 1.798 | 9,6 | 406 | 22,6 | 1.392 | 77,4 | |
| Procurou uma unidade de saúde | |||||||
| Não | 15.512 | 82,6 | 735 | 4,7 | 14.777 | 95,3 | 0,001 |
| Sim | 3.274 | 17,4 | 413 | 12,6 | 2.861 | 87,4 | |
a) Teste qui-quadrado de Pearson.
Nos três agrupamentos - Espírito Santo, Grande Vitória, interior do estado -, as prevalências foram crescentes ao longo das quatro etapas; no estado como um todo, elas variaram de 2,1% (IC95% 1,7;2,5), na etapa 1, a 9,6% (IC95% 8,8;10,4) na etapa 4. A soroprevalência de infecção pelo SARS-Cov-2, na Região Metropolitana da Grande Vitória, foi de 2,7% (IC95% 2,2;3,3), na etapa 1, e atingiu o nível de 11,5% (IC95% 10,5;12,6) na etapa 4. No interior do estado, a prevalência variou de 0,4% (IC95% 0,1;0,9), na primeira etapa, a 4,4% (IC95% 3,2;5,5) na quarta etapa (Figura 1). Os maiores crescimentos ocorreram entre a primeira e a segunda etapas, chegando a 179% no interior. Da segunda para a terceira etapa, o crescimento foi menor, tanto para o conjunto do Espírito Santo como para a Região Metropolitana da Grande Vitória. O mesmo não ocorreu no interior do estado, onde foi registrado aumento de 194% na prevalência da infecção. Da mesma forma, da terceira para a quarta etapa, os incrementos foram menores, variando de 27%, na Grande Vitória, a 39% no interior (Figura 2).
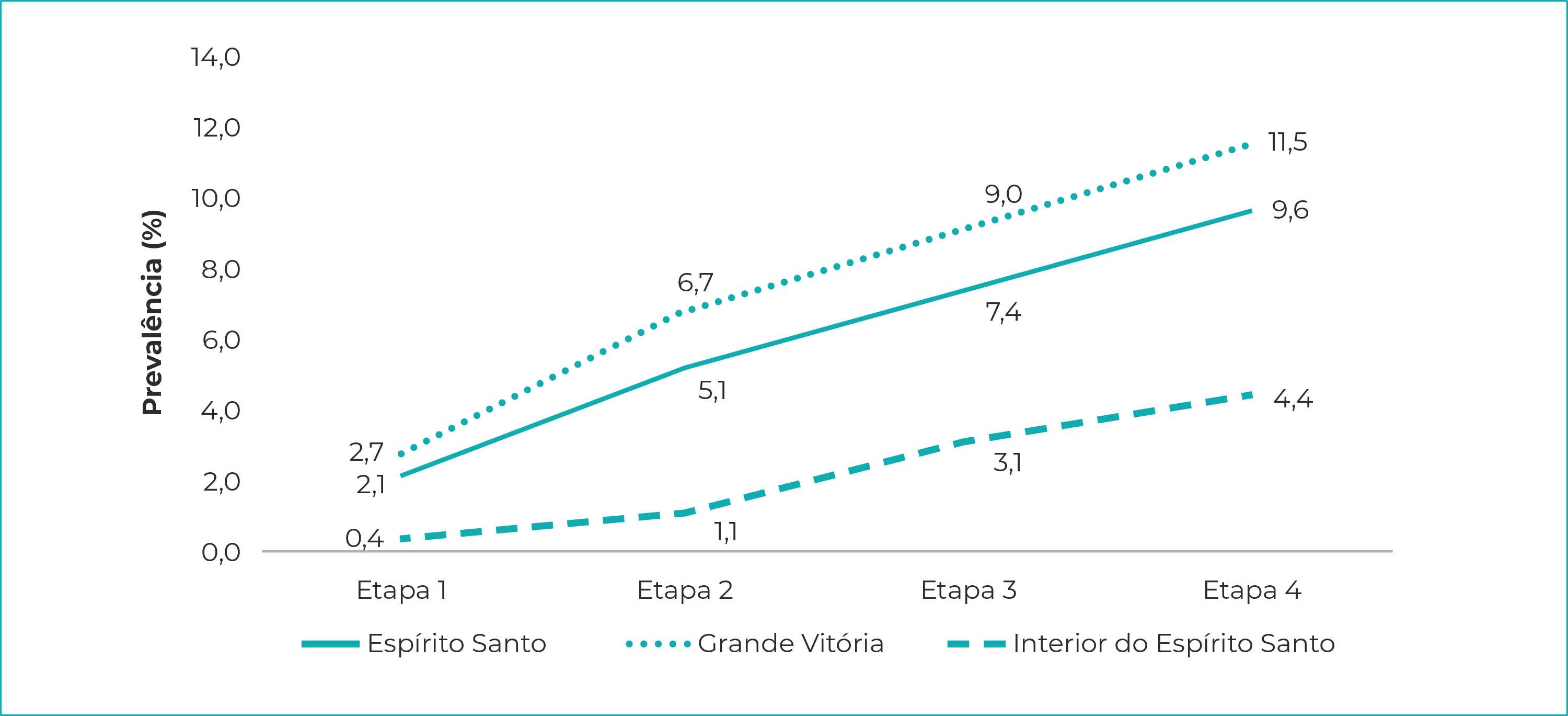
Notas: Etapa 1 = início em 10 de maio de 2020; Etapa 2 = início em 24 de maio de 2020; Etapa 3 = início em 7 de junho de 2020; Etapa 4 = início em 21 de junho de 2020.
Figura 1 - Prevalência de SARS-CoV-2, de acordo com dados da Pesquisa de Prevalência da infecção, Espírito Santo, Grande Vitória e interior do estado, maio-junho/2020
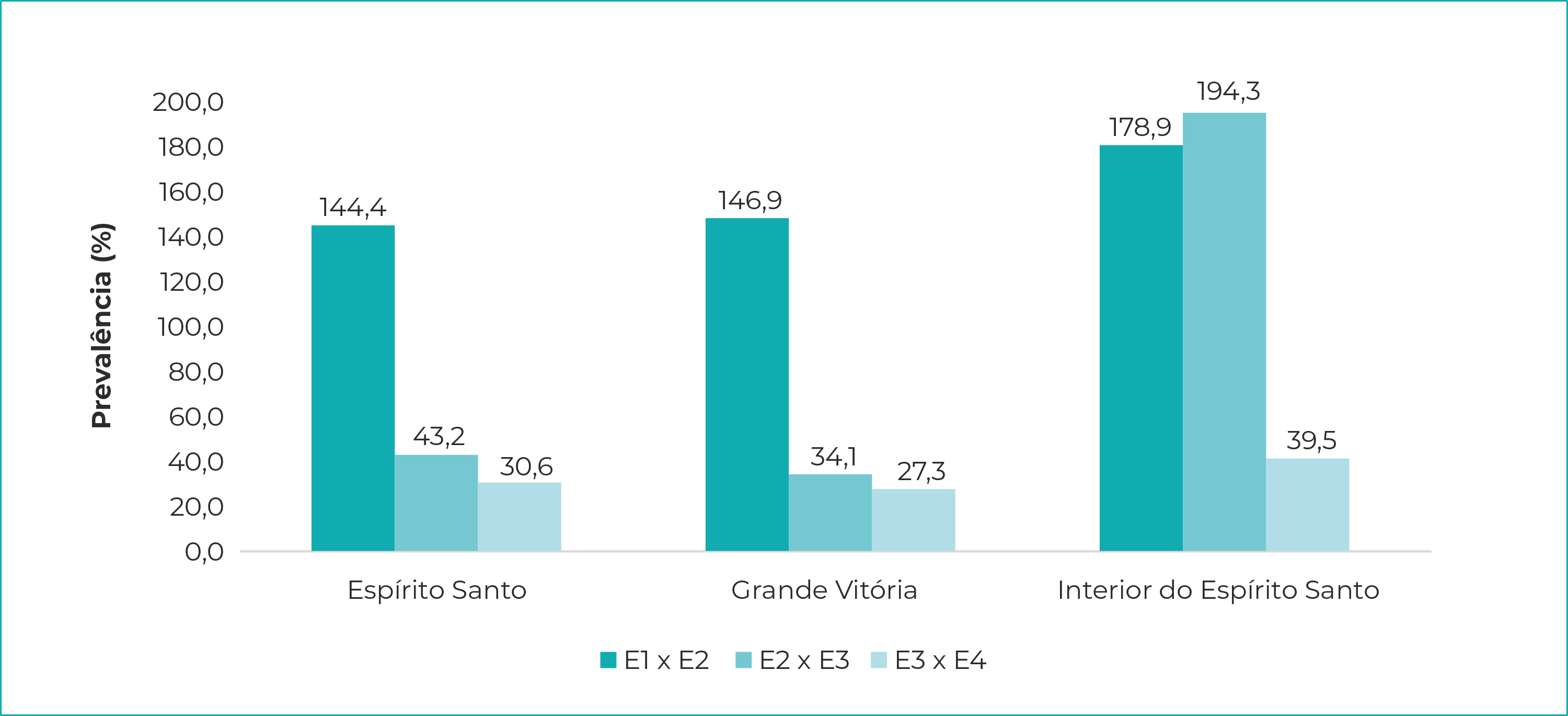
Legenda: E1 x E2 = Etapa 1 em relação à Etapa 2; E2 x E3 = Etapa 2 em relação à Etapa 3; E3 x E4 = Etapa 3 em relação à Etapa 4 (início em 21 de abril de 2020).
Notas: Etapa 1 = início em 10 de maio de 2020; Etapa 2 = início em 24 de maio de 2020; Etapa 3 = início em 7 de junho de 2020; Etapa 4 = início em 21 de junho de 2020.
Figura 2 - Variações percentuais da prevalência de SARS-CoV-2, relativamente à etapa anterior da Pesquisa de Prevalência da infecção, Espírito Santo, Grande Vitória e interior do estado, maio-junho/2020
O cálculo da razão entre o número de contatos reagentes (738) e o número de casos reagentes sorteados na amostra (1.148) apontou 0,64, indicando menos de um contato reagente por caso reagente.
A Tabela 2 apresenta os resultados das razões de chances, brutas e ajustadas. As chances de exames reagentes aumentaram 20% para indivíduos do sexo feminino (OR = 1,20; IC95% 1,05;1,36), entre 18% e 14% para indivíduos com até 8 anos e com nove anos ou mais de estudo, respectivamente, e entre 26% e 132% para indivíduos que moravam em domicílio com dois e com quatro moradores, respectivamente, em comparação com domicílios com um morador (p-valor = 0,001). O resultado da estatística de ajuste do modelo do teste de Hosmer-Lemeshow indica que ele foi bem ajustado (qui-quadrado = 3,864; p-valor = 0,869).
Tabela 2 - Fatores sociodemográficos associados ao resultado do teste reagente para SARS- -CoV-2, de acordo com dados da Pesquisa de Prevalência da infecção (n=1.148), Espírito Santo, maio-junho/2020
| Variável | Modelo bruto | Modelo ajustadob | ||
|---|---|---|---|---|
| ORa (IC95%) | p-valor | ORa (IC95%) | p-valorc | |
| Sexo | ||||
| Masculino | 1,00 | 0,005 | 1,00 | 0,006 |
| Feminino | 1,20 (1,06;1,36) | 1,20 (1,05;1,36) | ||
| Faixa etária (em anos) | ||||
| ≤ 20 | 1,00 | 0,001 | 1,00 | 0,363 |
| 21-40 | 1,16 (0,89;1,49) | 1,21 (0,93;1,57) | ||
| 41-60 | 1,12 (0,87;1,44) | 1,23 (0,95;1,58) | ||
| 61-80 | 0,92 (0,70;1,19) | 1,09 (0,83;1,43) | ||
| ≥ 81 | 0,82 (0,53;1,28) | 1,05 (0,67;1,64) | ||
| Raça/cor da pele | ||||
| Branca | 0,68 (0,45;1,02) | 0,001 | 0,69 (0,43;1,09) | 0,543 |
| Parda | 0,87 (0,58;1,30) | 0,78 (0,49;1,23) | ||
| Preta | 1,08 (0,71;1,64) | 0,95 (0,59;1,52) | ||
| Outras | 1,00 | 1,00 | ||
| Anos de estudo | ||||
| Analfabeto | 1,00 | 0,001 | 1,00 | 0,024 |
| ≤ 8 | 1,35 (0,94;1,93) | 1,18 (0,77;1,82) | ||
| ≥ 9 | 1,20 (0,84;1,72) | 1,14 (0,73;1,77) | ||
| Número de moradores no domicílio | ||||
| 1 | 1,00 | 0,001 | 1,00 | 0,001 |
| 2 | 1,25 (0,97;1,60) | 1,26 (0,98;1,63) | ||
| 3 | 1,52 (1,19;1,93) | 1,55 (1,20;2,00) | ||
| 4 | 1,77 (1,38;2,27) | 1,79 (1,38;2,32) | ||
| ≥ 5 | 2,40 (1,87;3,08) | 2,35 (1,81;3,04) | ||
| Mais alto nível de escolaridade do domicílio | ||||
| Analfabeto | 1,00 | 1,00 | ||
| Ensino fundamental | 1,59 (0,93;2,70) | 0,089 | 1,18 (0,63;2,20) | 0,652 |
| Ensino médio | 1,91 (1,13;3,22) | 1,27 (0,68;2,40) | ||
| Ensino superior completo | 1,06 (0,62;1,81) | 0,75 (0,39;1,44) | ||
| Ensino superior incompleto | 1,49 (0,85;2,63) | 1,00 (0,51;1,96) | ||
a) OR: odds ratio, ou razão de chances; b) Ajuste realizado para todas as variáveis incluídas no modelo; c) Significância do teste qui- -quadrado de Pearson para as ORs ajustadas.
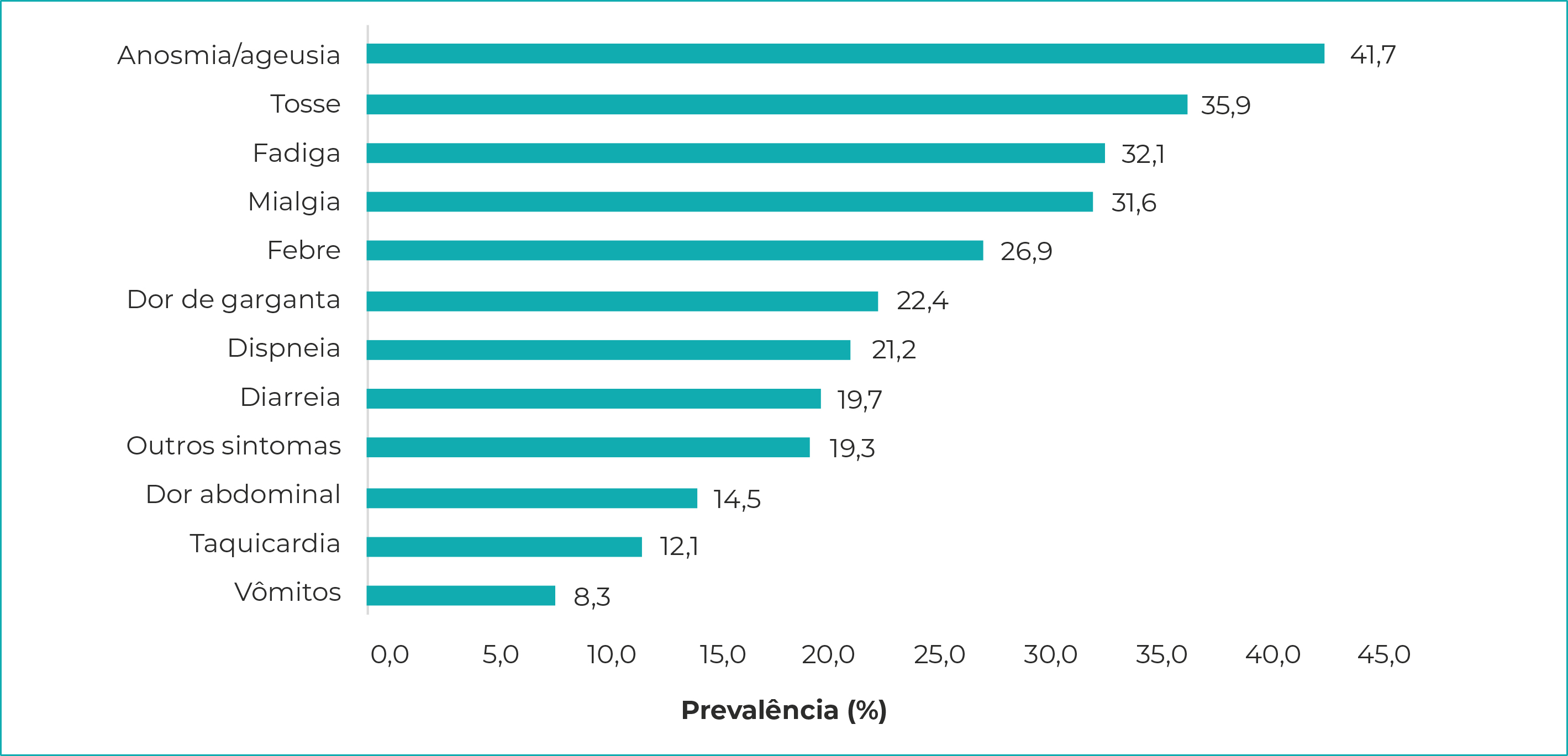
As manifestações clínicas mais prevalentes para os casos reagentes foram anosmia/ageusia (41,7%), tosse (35,9%) e fadiga (32,1%). A manifestação menos prevalente foi de vômitos: 8,3% dos casos (Figura 3).
DISCUSSÃO
O estudo avaliou, em suas quatro etapas, um total de 18.791 indivíduos, mostrando um crescimento da prevalência da infecção por SARS-CoV-2 entre cada etapa e a subsequente, ao longo de todo o inquérito e em todos os agrupamentos estudados: Espírito Santo, região da Grande Vitória e interior do estado. Além disso, a maioria dos avaliados era do sexo feminino, pessoas na idade de 41 a 60 anos, raça/cor da pele parda e ausência de qualquer sintoma de COVID-19. As chances de exames reagentes foram maiores para o sexo feminino, indivíduos com nove ou mais anos de estudo e aqueles cujo domicílio contava mais de dois moradores.
Há algumas limitações a apontar neste estudo. É importante salientar que, sendo as entrevistas a base para a coleta de dados, existe o viés de informação, tanto por parte do entrevistador como do entrevistado e seu viés de memória. Há também o viés de seleção, representado pela sobrevida seletiva: por se tratar de um estudo de base domiciliar, seriam incluídos - desproporcionalmente - mais indivíduos do espectro leve da COVID-19, dada a maior possibilidade de internação e/ou óbito daqueles com a forma grave de apresentação clínica da doença, o que poderia subestimar a prevalência observada neste estudo.
Existem preocupações sobre os testes sorológicos rápidos, mas elas se referem a seu uso na tomada de decisões clínicas no nível individual, haja vista a necessidade de indicação de acordo com a fase da doença.11-15 A aplicação de testes rápidos, para estimativas baseadas na população e, particularmente, para monitorar tendências ao longo do tempo, ainda foi o método de escolha, pois, até a data da pesquisa, nenhuma vacina, antiviral ou qualquer tratamento específico para COVID-19 estava disponível (fase de estudo).11 A sensibilidade do teste, inferior a 90%, pode ter possibilitado resultados falso- -negativos; entretanto, ainda nesses casos, a baixa prevalência provavelmente manteve alto valor preditivo negativo, ou seja, alta probabilidade da ausência da doença quando o teste é negativo.
Ressalta-se que, à época da realização do presente estudo, final de junho de 2020, poucas pesquisas de base populacional sobre a prevalência de SARS-CoV-2 haviam sido realizadas no Brasil, sendo a recomendação do distanciamento social a principal medida adotada.16,17
Um estudo realizado no estado do Rio Grande do Sul mostrou uma curva de prevalência também crescente até a terceira fase, tendo sido de 0,048% na primeira fase, entre 11 e 13 de abril, de 0,135% na segunda fase, de 25 a 27 de abril, e de 0,222% na terceira fase, de 9 a 11 de maio de 2020.18 As prevalências, em todas as fases, foram mais baixas em relação às obtidas no Espírito Santo, e uma das justificativas para esses resultados estaria na obtenção dos dados em um período anterior à fase da epidemia no país, ademais do fato de o estado apresentar maior adesão às medidas de distanciamento social, em relação ao que ocorria em outras partes do Brasil.11
Em relação aos indicadores de COVID-19 no Espírito Santo, no período da pesquisa, o boletim epidemiológico publicado em 24 de junho de 2020 indicava que haviam sido notificados 34.866 casos da doença no estado, até aquela data, tendo-se registrado 1.328 óbitos, que implicaram uma letalidade de 3,81%. Entre as principais medidas adotadas pela gestão estadual, naquele momento, destacam-se: a publicação do Plano Estadual de Prevenção e Controle do Novo Coronavírus, a criação do Centro de Operações Emergenciais em Saúde Pública, a suspensão das atividades educacionais nas unidades da rede pública e privada, e da realização de eventos e atividades com presença de público, além da suspensão de funcionamento de estabelecimentos comerciais.19
Um estudo realizado em Teresina, estado do Piauí, mostrou que, ao longo de sete semanas com testes seriados, entre 19 de abril e 31 de maio de 2020, a positividade sorológica aumentou de 0,56% (IC95% 0,18; 1,30) para 8,33% (IC95% 6,61; 10,33).20 Ainda, um inquérito domiciliar de base populacional, realizado no Maranhão, entre 27 de julho de 2020 e 8 de agosto de 2020, entrevistou 3.156 indivíduos e mostrou uma soroprevalência de anticorpos totais contra SARS-CoV-2 de 40,4% (IC95% 35,6; 45,3).21
Entre os participantes com exames reagentes, houve predominância do sexo feminino, cinco ou mais moradores no domicílio e maior grau de instrução, na comparação com aqueles que resultaram em exame não reagente. No início da epidemia, os casos estavam relacionados às classes sociais média e alta, com histórico de retorno de países, principalmente europeus, onde o número de casos de COVID-19 era elevado. No transcorrer da epidemia, houve um desvio do acometimento para a população de menor poder aquisitivo, o que também pode ser observado no Espírito Santo, como reflexo do cenário nacional.22,23
Dados coletados em Chicago, Estados Unidos, no dia 20 de abril de 2020, mostraram um acometimento por COVID-19 desproporcionalmente maior entre os afro-americanos e os mais pobres: foram observados significantes agrupamentos espaciais de vulnerabilidade social e fatores de risco, ambos significativamente associados ao aumento da taxa de mortalidade por COVID-19.24 Nesse sentido, a pandemia do novo coronavírus constitui um desafio para países com profundas desigualdades.25
No Brasil, sabe-se que grupos específicos também sofrem mais gravemente os impactos da pandemia. Estudo realizado nas cinco grandes regiões do país demonstrou que a proporção de indivíduos com testes reagentes foi maior entre indígenas, negros e pardos, na comparação com brancos, além de estar inversamente associada à posição socioeconômica.26,27
Neste estudo observou-se, além das disparidades de raça/cor da pele entre os casos reagentes, um maior percentual de pessoas do sexo feminino no domicílio, refletindo o perfil da cuidadora. Seja na atenção à família, gestão da casa ou envolvimento com iniciativas comunitárias, potencialmente, as mulheres expõem-se mais ao vírus, fato ademais reforçado por serem elas a maioria entre os profissionais de saúde.28 Essa maior prevalência no sexo feminino também pode estar associada ao viés de sobrevida, uma vez que o sexo masculino apresenta maior risco de evolução para gravidade e/o óbito por COVID-19, quando comparado ao sexo feminino.29
Observou-se maior prevalência de positividade de SARS-CoV-2 nos domicílios com maior número de moradores. A precariedade das moradias em algumas regiões, a falta de acesso a saneamento básico, água encanada e esgoto domiciliar são dificultadores no controle da epidemia, impondo barreiras à garantia do mínimo de isolamento domiciliar. A grande proporção de domicílios ocupados em aglomerados subnormais já foi descrita pelo IBGE, e especialmente no Espírito Santo, esse percentual é superior ao da maioria dos estados, ficando atrás apenas do Amazonas.30
Por fim, há de se considerar que os resultados de estudos sorológicos populacionais podem indicar caminhos mais seguros, no sentido da adoção de medidas que viabilizem o conhecimento de características da população avaliada, não apenas do ponto de vista clínico, senão também socioeconômico. Este e outros estudos que venham a contribuir para o conhecimento do espalhamento do vírus poderão orientar, com mais precisão, os processos de gestão da pandemia da COVID-19.










 texto en
texto en