Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Epidemiologia e Serviços de Saúde
versão impressa ISSN 1679-4974versão On-line ISSN 2237-9622
Epidemiol. Serv. Saúde vol.32 no.1 Brasília 2023 Epub 24-Mar-2023
http://dx.doi.org/10.1590/s2237-96222023000300004
Artigo original
Frequência e fatores associados ao atraso para o tratamento do câncer de mama no Brasil, segundo dados do PAINEL-Oncologia, 2019-2020
1 Universidade Federal de Juiz de Fora, Programa de Pós-Graduação em Saúde Coletiva, Juiz de Fora, MG, Brazil
2 Instituto Nacional de Câncer José Alencar Gomes da Silva, Divisão de Detecção Precoce e Apoio a Organização de Rede, Rio de Janeiro, RJ, Brazil
3 Instituto Nacional de Câncer José Alencar Gomes da Silva, Divisão de Pesquisa Populacional, Rio de Janeiro, RJ, Brazil
4 Universidade Estadual do Rio de Janeiro, Instituto de Medicina Social Hesio Cordeiro, Rio de Janeiro, RJ, Brazil
Objetivo:
analisar o atraso para o tratamento e o fluxo assistencial de mulheres com câncer de mama no Brasil em 2019 e 2020.
Métodos:
estudo de seguimento de casos de câncer de mama disponibilizados no PAINEL-Oncologia; para analisar as variáveis explicativas associadas ao atraso (maior que 60 dias) no início do tratamento, realizou-se teste qui-quadrado e regressão logística multinível.
Resultados:
identificaram-se 22.956 casos (54,5%) em 2019 e 17.722 (48,7%) em 2020, com atraso para o tratamento; a região Sudeste (54,6%) teve maior proporção de atraso, que foi maior quando o tratamento foi realizado fora do município de residência, e menor em 2020, comparando-se a 2019; os fluxos externos, em sua maioria, ocorreram para as capitais das mesmas Unidades da Federação (UFs) de residência.
Conclusão:
estratégias que diminuam o intervalo de tempo até o início do tratamento oncológico e otimizem as redes de atenção em saúde nas UFs devem ser priorizadas.
Palavras-chave: Tempo para o Tratamento; Neoplasias da Mama, Sistema Único de Saúde; Acesso aos Serviços de Saúde; Sistemas de Informação em Saúde
Contribuições do estudo
Principais resultados
Casos com atraso no início do tratamento foram 54,5% (2019) e 48,7% (2020), com chance 49% a 95% maior em mulheres de idade acima de 40 anos, 21% menor em 2020 que em 2019, e 21% maior para aquelas residentes a mais que 200 km do local do tratamento.
Introdução
O câncer de mama foi responsável por 11,7% do total de cânceres diagnosticados entre homens e mulheres de todo o mundo, em 2020, proporção que superou o câncer de pulmão, este com 11,4% dos diagnósticos de câncer em ambos os sexos.1 A mortalidade por câncer de mama vem caindo em muitos países de alta renda, independentemente de uma incidência que se mantém estável ou crescente. Os avanços científicos, sobretudo no tratamento, conquistados nas últimas décadas, têm feito com que a sobrevida líquida cresça em vários países;2 naqueles de média e baixa renda, verifica-se aumento, tanto na incidência quanto na mortalidade, o que indica a necessidade de priorização das ações de detecção precoce e acesso ao tratamento.3
No Brasil, a oferta e utilização dos serviços de rastreamento, diagnóstico e assistência a pessoas com câncer é desigual entre as regiões do país, comprometendo o início do tratamento em tempo oportuno.4 Dados dos Registros Hospitalares de Câncer (RHC), que abrangem os estabelecimentos responsáveis pela assistência de alta complexidade no Sistema Único de Saúde (SUS) e alguns serviços privados especializados em câncer, evidenciam que o risco de diagnóstico em estadiamento avançado é maior para mulheres pretas e pardas, comparadas às brancas, como também para aquelas de menor nível de estudo, comparadas às de maior escolaridade.5
Estudos que analisaram o tempo transcorrido entre a realização da mamografia com resultado alterado e o início do tratamento,6 ou entre o diagnóstico e o tratamento,7 encontraram intervalos prolongados. Observou-se que o risco de morte aumentou cerca de 38% quando o primeiro tratamento ocorreu após 60 dias do diagnóstico.8 Entre os motivos possivelmente relacionados à dificuldade para início do tratamento na rede SUS em tempo oportuno, a partir do momento do diagnóstico, destaca-se a distância da unidade de referência de tratamento, levando a que muitas usuárias tenham de se deslocar por cerca de 300 km desde sua residência.9
Avaliações feitas com base nos estudos citados6,7 indicam que as estratégias de controle da doença tiveram pouco impacto na reversão da tendência de mortalidade. A constatação de que o rastreamento para o câncer de mama se encontra em queda desde 2014, em todas as regiões do país,10 aponta para um cenário futuro de possível agravamento. É urgente, portanto, que as políticas de controle do câncer sejam revistas, considerando-se os dados disponíveis nos sistemas de informações em saúde (SIS) do SUS e o impacto das ações realizadas até agora, sempre pautadas nas melhores evidências científicas. Desta forma, certamente, pode-se reorientar o planejamento das ações de detecção precoce e o monitoramento do fluxo na rede assistencial do Sistema.
Nesse sentido, destaca-se o PAINEL-Oncologia, ferramenta disponibilizada pelo Ministério da Saúde em 2019 e que reúne informações dos SIS sobre o diagnóstico e o primeiro tratamento de neoplasias malignas, possibilitando aos gestores monitorarem o intervalo até o primeiro tratamento oncológico, a contar da data do diagnóstico.11
Este estudo teve como objetivo analisar o atraso para o tratamento e o fluxo assistencial de mulheres com câncer de mama no Brasil, no biênio 2019-2020.
Métodos
Foi realizado um estudo de seguimento de casos de câncer de mama, conforme descritos na Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde - Décima Revisão (CID-10) em sua categoria C50, no sexo feminino e no Brasil, diagnosticados em 2019 e 2020, com informação de tratamento, a partir dos dados individualizados disponíveis no PAINEL-Oncologia. Esses dados foram acessados na página do Departamento de Informática do SUS (Datasus), em 9 de dezembro de 2021.
O PAINEL-Oncologia é uma ferramenta para o monitoramento do tempo entre o diagnóstico e o primeiro tratamento a partir de dados dos sistemas de informações consolidados no SUS.11
Foram considerados apenas os tratamentos realizados em estabelecimentos habilitados para a assistência oncológica pelo SUS. Casos tratados cirurgicamente em hospitais não habilitados foram excluídos do estudo.
Variáveis
Tempo entre o diagnóstico e o primeiro tratamento, dicotomizado entre “menor ou igual a 60 dias” e “maior que 60 dias”, considerando-se esta segunda categoria como atraso, de acordo com a Lei nº 12.732/2012.12
Faixa etária (em anos completos: até 39; 40 a 49; 50 a 59; 60 a 69; 70 ou mais);
Ano do diagnóstico (2019; 2020);
Município de residência;
Município de tratamento [(mesmo município de residência; outro município, até 200 km de distância do município de residência; outro município, a mais de 200 km de distância do município de residência (o ponto de corte de 200 km discriminou a chance de atraso para os mais distantes, em análise exploratória inicial)];
Macrorregião de saúde de residência;
Macrorregião de saúde onde se realizou o tratamento;
Região do país de residência (Norte; Nordeste; Sudeste; Sul; Centro-Oeste).
Renda per capita média da macrorregião de saúde de residência, segundo o Censo Demográfico de 2010 (categorizada em tercis).
Para cada macrorregião de saúde, foi verificada a existência de estabelecimentos habilitados para a assistência oncológica pelo SUS13 e obtida a renda média per capita da população residente em 2010.14
Inicialmente, realizou-se a análise da distribuição de frequências (relativa e absoluta) das características relativas aos casos, de acordo com o atraso no início do tratamento. O teste qui-quadrado de Pearson foi utilizado para comparar a distribuição das variáveis.
Com o propósito de identificar os fluxos assistenciais predominantes, foram elaborados mapas temáticos com os fluxos entre macrorregiões de saúde de residência e de tratamento e as frequências absolutas de usuárias tratadas em cada macrorregião. E para facilitar a visualização dos fluxos mais importantes, foram selecionados apenas aqueles que indicaram pelo menos 10% das usuárias a se deslocar para outras macrorregiões de saúde. Para visualizar as desigualdades regionais, foram desenhados mapas temáticos das macrorregiões de saúde com a distribuição, em quintis, das variáveis “percentual de atraso superior a 60 dias para início do tratamento” e “distâncias médias percorridas para tratamento”.
Na elaboração dos mapas, utilizou-se o programa R, especificamente a função ggplot do pacote ggplot2. Foram plotados (i) os polígonos das macrorregiões como uma primeira camada, (ii) as setas de interligação dos centroides das macrorregiões de residência com os centroides das macrorregiões de tratamento, como uma segunda camada, e (iii) uma camada de pontos indicando o centroide da macrorregião de tratamento, com o diâmetro dos pontos proporcional à frequência de mulheres tratadas naquela macrorregião.
Para a avaliação dos fatores associados ao atraso no início do tratamento, considerando-se a existência de estrutura hierárquica por macrorregião de saúde, foram aplicados modelos logísticos multiníveis com intercepto aleatório,15 considerando-se a pessoa em tratamento como nível 1 e a macrorregião de saúde de residência como nível 2. Inicialmente, o modelo foi ajustado apenas com o intercepto aleatório, sem variáveis de exposição, para estimar a variação geral da chance de atraso e o coeficiente de correlação intraclasse, que quantifica a proporção da variância explicada pelo grupo (macrorregião de residência). A seguir, foram ajustados modelos simples com cada variável de exposição. Por fim, compôs-se o modelo múltiplo com as variáveis que apresentaram associação significativa nos modelos simples, utilizando-se o teste da razão de verossimilhança para comparar ambos os modelos. Os efeitos fixos das variáveis foram estimados como razão de chances - odds ratio (OR) - ao exponenciar os respectivos coeficientes, com intervalo de confiança de 95% (IC95%). O ajuste do modelo múltiplo final foi avaliado pela análise dos resíduos de superdispersão, normalidade e outliers, utilizando-se o conjunto de funções do pacote DHARMa (Diagnostics for HierArchical Regression Models) do programa R (https://cran.r-project.org/package=DHARMa). Os testes indicaram adequabilidade do modelo aos dados.
Todas as análises foram feitas com o uso do programa R,16 em sua versão 4.1.0; foi utilizado o pacote lme4, para o ajuste dos modelos multiníveis, por meio da função glmer, e o pacote Geosphere, para a estimativa da distância, com a função distHaversine. O nível de significância de 0,05 foi adotado em todas as análises.
Aspectos éticos
Por se tratar de dados de domínio público, sem a identificação dos participantes, o projeto do estudo não necessitou ser submetido à avaliação de um Comitê de Ética em Pesquisa (CEP).
Resultados
Nos anos de 2019 e 2020, no PAINEL-Oncologia, foram identificados 78.527 casos de câncer de mama em mulheres residentes nas 118 macrorregiões de saúde brasileiras: 42.102 foram diagnosticados em 2019 e 36.425 em 2020. Ou seja, em 2020, houve uma redução de 13,5% nos diagnósticos, na comparação com o ano anterior. Do total de casos incluídos no presente estudo, 51,8% (40.678) sofreram atraso no início do tratamento: 22.956 (54,5%) em 2019 e 17.722 (48,7%) em 2020 (Tabela 1).
Tabela 1 Frequências absolutas e relativas das variáveis, estratificadas pelo tempo entre diagnóstico e tratamento, 2019-2020
| Variáveis | Total (n = 78.527) | Tempo (em dias) | p-valora | |
|---|---|---|---|---|
| ≤ 60 (n = 37.849) | > 60 (n = 40.678) | |||
| n (%) | n (%) | n (%) | ||
| Idade (em anos completos) | < 0,001 | |||
| ≤ 39 | 8.850 (100,0) | 5.358 (60,5) | 3.492 (39,5) | |
| 40-49 | 17.800 (100,0) | 8.983 (50,5) | 8.817 (49,5) | |
| 50-59 | 21.189 (100,0) | 10.011 (47,2) | 11.178 (52,8) | |
| 60-69 | 17.791 (100,0) | 7.841 (44,1) | 9.950 (55,9) | |
| ≥ 70 | 12.897 (100,0) | 5.656 (43,9) | 7.241 (56,1) | |
| Ano do diagnóstico | < 0,001 | |||
| 2019 | 42.102 (100,0) | 19.146 (45,5) | 22.956 (54,5) | |
| 2020 | 36.425 (100,0) | 18.703 (51,3) | 17.722 (48,7) | |
| Município de tratamento | < 0,001 | |||
| Mesmo município de residência | 36.351 (100,0) | 17.757 (48,8) | 18.594 (51,2) | |
| Outro município, até 200 km | 37.158 (100,0) | 17.836 (48,0) | 19.322 (52,0) | |
| Outro município, a mais de 200 km | 5.018 (100,0) | 2.256 (45,0) | 2.762 (55,0) | |
| Tratamento em outra macrorregião de saúde | < 0,001 | |||
| Não | 67.827 (100,0) | 32.885 (48,5) | 34.942 (51,5) | |
| Sim | 10.700 (100,0) | 4.964 (46,4) | 5.736 (53,6) | |
| Serviço habilitado na macrorregião de residência | < 0,001 | |||
| Sim | 74.824 (100,0) | 36.198 (48,4) | 38.626 (51,6) | |
| Não | 3.703 (100,0) | 1.651 (44,6) | 2.052 (55,4) | |
| Renda per capita média da macrorregião de residência | < 0,001 | |||
| 1º tercil | 26.636 (100,0) | 13.194 (49,5) | 13.442 (50,5) | |
| 2º tercil | 23.515 (100,0) | 11.347 (48,3) | 12.168 (51,7) | |
| 3º tercil | 28.376 (100,0) | 13.308 (46,9) | 15.068 (53,1) | |
| Região do país de residência | < 0,001 | |||
| Norte | 3.162 (100,0) | 1.485 (47,0) | 1.677 (53,0) | |
| Nordeste | 18.489 (100,0) | 9.233 (49,9) | 9.256 (50,1) | |
| Sudeste | 35.689 (100,0) | 16.217 (45,4) | 19.472 (54,6) | |
| Sul | 16.147 (100,0) | 8.577 (53,1) | 7.570 (46,9) | |
| Centro-Oeste | 5.040 (100,0) | 2.337 (46,4) | 2.703 (53,6) | |
a) P-valor: Teste qui-quadrado de Pearson.
O atraso no tratamento foi maior à medida que avançou a faixa etária e a distância percorrida entre os locais de residência e de tratamento, para os tratamentos fora da macrorregião de residência e para residentes em macrorregiões de saúde sem estabelecimentos habilitados na assistência oncológica pelo SUS. Observou-se, também, maior atraso entre as mulheres residentes em macrorregiões de saúde com maior renda per capita. Maior proporção de usuárias com atraso no tratamento foi encontrada na região Sudeste, e menor proporção na região Sul (Tabela 1).
Ao se comparar a proporção de casos cujo tratamento foi atrasado, segundo a Unidade da Federação (UF) de residência, no ano de 2020, verificou-se crescimento nos estados do Amazonas, Pará, Piauí e Goiás. A menor proporção de atraso no tratamento, em 2020, referiu-se ao estado de Roraima (Tabela 2).
Tabela 2 Percentual de casos de câncer de mama tratados com intervalo de tempo acima de 60 dias, segundo ano do diagnóstico e Unidade da Federação (UF) de residência, Brasil, 2019-2020
| Região | UF de residência | 2019 | 2020 | ||
|---|---|---|---|---|---|
| Casos | Atraso | Casos | Atraso | ||
| n (%) | n (%) | n (%) | n (%) | ||
| Norte | Acre | 64 (100,0) | 36 (56,3) | 64 (100,0) | 31 (48,4) |
| Amapá | 53 (100,0) | 30 (56,6) | 51 (100,0) | 28 (54,9) | |
| Amazonas | 397 (100,0) | 233 (58,7) | 385 (100,0) | 228 (59,2) | |
| Pará | 702 (100,0) | 359 (51,1) | 584 (100,0) | 340 (58,2) | |
| Rondônia | 156 (100,0) | 80 (51,3) | 253 (100,0) | 110 (43,5) | |
| Roraima | 46 (100,0) | 31 (67,4) | 52 (100,0) | 9 (17,3) | |
| Tocantins | 192 (100,0) | 95 (49,5) | 163 (100,0) | 67 (41,1) | |
| Nordeste | Alagoas | 487 (100,0) | 255 (52,4) | 442 (100,0) | 230 (52,0) |
| Bahia | 2.324 (100,0) | 1.277 (54,9) | 2.035 (100,0) | 1.070 (52,6) | |
| Ceará | 1.868 (100,0) | 968 (51,8) | 1.725 (100,0) | 798 (46,3) | |
| Maranhão | 637 (100,0) | 369 (57,9) | 652 (100,0) | 322 (49,4) | |
| Paraíba | 861 (100,0) | 495 (57,5) | 772 (100,0) | 442 (57,3) | |
| Pernambuco | 1.860 (100,0) | 888 (47,7) | 1.521 (100,0) | 670 (44,0) | |
| Piauí | 577 (100,0) | 227 (39,3) | 433 (100,0) | 173 (40,0) | |
| Rio Grande do Norte | 845 (100,0) | 432 (51,1) | 705 (100,0) | 312 (44,3) | |
| Sergipe | 404 (100,0) | 192 (47,5) | 341 (100,0) | 136 (39,9) | |
| Sudeste | Espírito Santo | 955 (100,0) | 464 (48,6) | 819 (100,0) | 337 (41,1) |
| Minas Gerais | 5.021 (100,0) | 2.864 (57,0) | 4.199 (100,0) | 2.128 (50,7) | |
| Rio de Janeiro | 3.900 (100,0) | 2.433 (62,4) | 3.213 (100,0) | 1.805 (56,2) | |
| São Paulo | 9.459 (100,0) | 5.485 (58,0) | 8.123 (100,0) | 3.956 (48,7) | |
| Sul | Paraná | 2.927 (100,0) | 1.185 (40,5) | 2.602 (100,0) | 899 (34,6) |
| Rio Grande do Sul | 3.560 (100,0) | 1.832 (51,5) | 3.079 (100,0) | 1.436 (46,6) | |
| Santa Catarina | 2.058 (100,0) | 1.235 (60,0) | 1.921 (100,0) | 983 (51,2) | |
| Centro-Oeste | Distrito Federal | 476 (100,0) | 288 (60,5) | 481 (100,0) | 285 (59,3) |
| Goiás | 1.194 (100,0) | 611 (51,2) | 974 (100,0) | 525 (53,9) | |
| Mato Grosso | 565 (100,0) | 286 (50,6) | 451 (100,0) | 199 (44,1) | |
| Mato Grosso do Sul | 514 (100,0) | 306 (59,5) | 385 (100,0) | 203 (52,7) | |
| Brasil | 42.102 (100,0) | 22.956 (54,5) | 36.425 (100,0) | 17.722 (48,7) | |
Os mapas da Figura 1 mostram os fluxos assistenciais entre as macrorregiões de residência e de tratamento, em 2019 e 2020, além das macrorregiões que mais receberam usuárias para tratamento. Observa-se que as capitais das UFs são os principais destinos dos fluxos assistenciais, geralmente de usuárias de outras macrorregiões de saúde da própria UF, mas, ocasionalmente, também de outras UFs, como é o caso de algumas macrorregiões de saúde do estado de São Paulo (Figura 1).
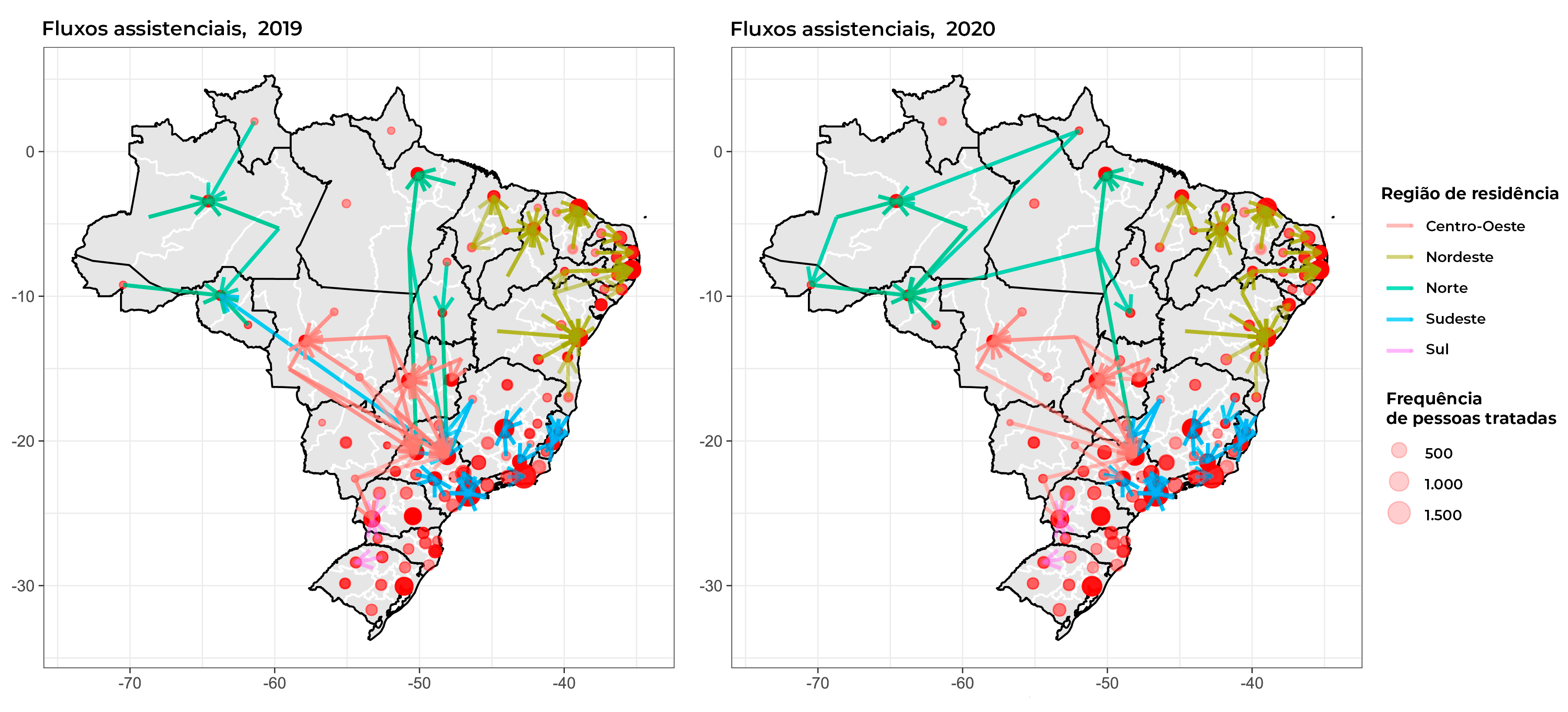
Figura 1 Mapas de fluxos entre as macrorregiões de saúde de residência (origem) e de início do tratamento (destino) para câncer de mama feminino, com representação dos principais destinos para tratamento, Brasil, 2019-2020
A partir do desenho dos mapas componentes da Figura 2, encontrou-se grande heterogeneidade nas proporções de usuárias do Sistema com atraso no início do tratamento, entre as macrorregiões de saúde de residência de praticamente todas as UFs. Comparando-se os anos de 2019 e 2020, observou-se que algumas macrorregiões de saúde das regiões Norte e Nordeste, assim como do estado do Mato Grosso do Sul em 2020, apresentam cores mais fortes, indicativas de maior atraso no tratamento realizado nessas macrorregiões.
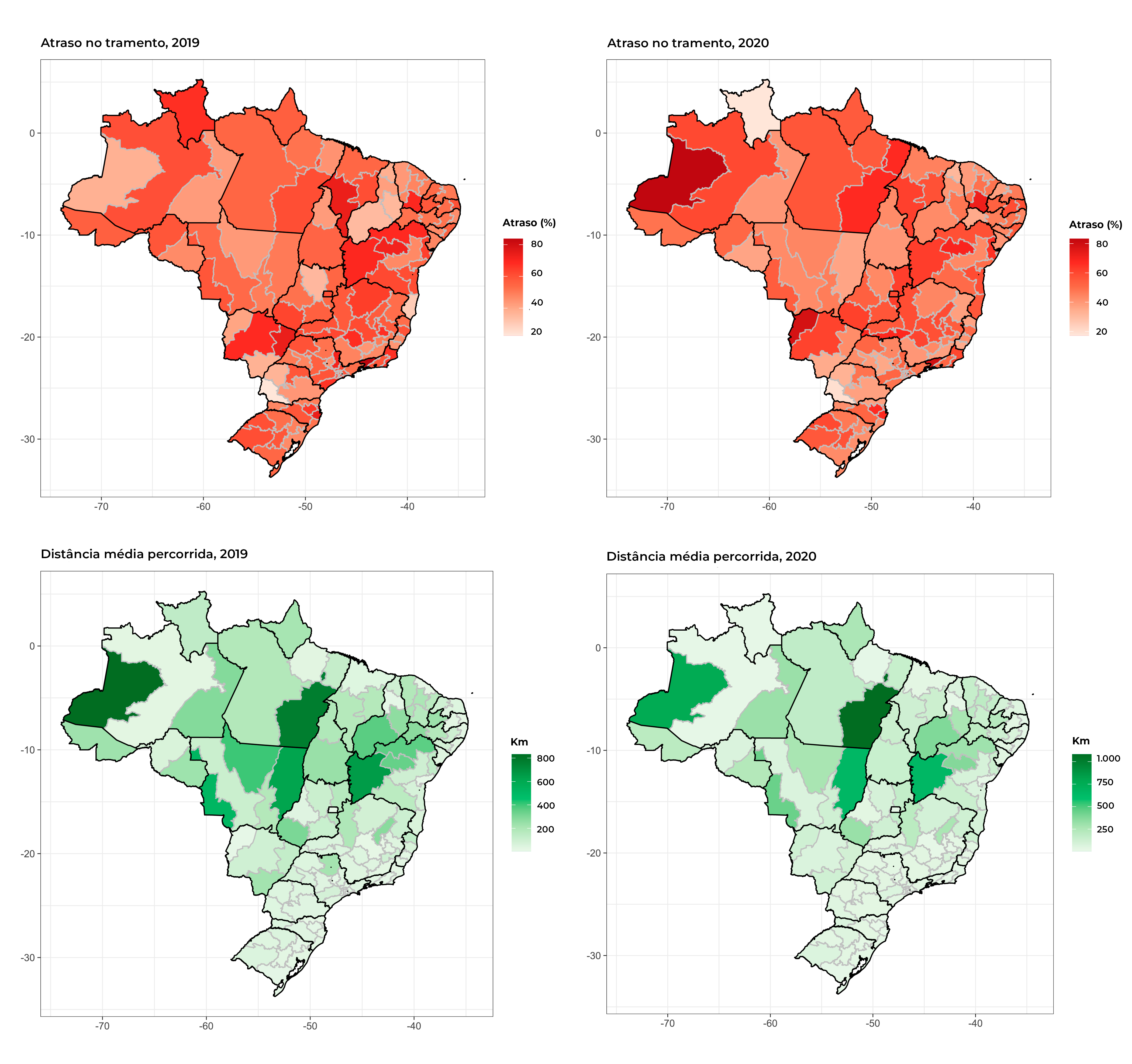
Figura 2 Mapas com a distribuição da proporção de atraso no início do tratamento para câncer de mama feminino e a distância média entre a macrorregião de saúde de residência e a de tratamento, por macrorregiões de saúde, Brasil, 2019-2020
Houve grande variação nas distâncias percorridas para o tratamento, observando-se maiores distâncias nas regiões Norte, Nordeste e Centro-Oeste. Nestas regiões, também foram observadas proporções mais elevadas de atraso no tratamento (Figura 2).
A regressão logística multinível permitiu concluir que, para os modelos simples, a chance de atraso aumentou com a idade e com a distância percorrida para o primeiro tratamento, e foi menor para o ano de 2020 (p-valor < 0,001), na comparação com o ano anterior. Tratar o câncer de mama fora da macrorregião de saúde de residência, residir em macrorregião de saúde com serviço habilitado nesse tratamento e grande região de residência não apresentaram associação com a chance de atraso (Tabela 3). O coeficiente de correlação intraclasse foi de 0,04, indicando que 4% da variância foi explicada pelo nível das macrorregiões.
Tabela 3 Odds ratio dos modelos simples e múltiplo de regressão logística multinível,a para o desfecho “atraso no início do tratamento para câncer de mama feminino”, Brasil, 2019-2020
| Variáveis | Modelo simples | Modelo múltiplod | ||||
|---|---|---|---|---|---|---|
| ORb | IC95% c | p-valor | ORb | IC95% c | p-valor | |
| Faixa etária (em anos completos) | ||||||
| ≤ 9 anos | 1,00 | < 0,001e | 1,00 | < 0,001e | ||
| 40-49 | 1,50 | 1,42;1,58 | 1,49 | 1,42;1,57 | ||
| 50-59 | 1,70 | 1,62;1,79 | 1,70 | 1,61;1,79 | ||
| 60-69 | 1,93 | 1,83;2,03 | 1,93 | 1,83;2,03 | ||
| ≥ 70 | 1,95 | 1,85;2,07 | 1,95 | 1,85;2,07 | ||
| Ano do diagnóstico | ||||||
| 2019 | 1,00 | 1,00 | ||||
| 2020 | 0,79 | 0,76;0,81 | < 0,001f | 0,79 | 0,77;0,81 | < 0,001f |
| Município de tratamento | ||||||
| Mesmo município de residência | 1,00 | < 0,001e | 1,00 | < 0,001e | ||
| Outro município, até 200 km | 1,07 | 1,03;1,10 | 1,09 | 1,05;1,12 | ||
| Outro município, a mais de 200 km | 1,20 | 1,11;1,29 | 1,21 | 1,13;1,31 | ||
| Tratamento fora da macrorregião de saúde de residência | ||||||
| Não | 1,00 | |||||
| Sim | 1,03 | 0,97;1,09 | 0,299f | |||
| Serviço habilitado na macrorregião de saúde de residência | ||||||
| Sim | 1,00 | |||||
| Não | 1,11 | 0,91;1,35 | 0,325f | |||
| Grande região do país de residência | ||||||
| Sul | 1,00 | |||||
| Norte | 1,05 | 0,80;1,39 | 0,729f | |||
| Nordeste | 1,06 | 0,85;1,32 | 0,592f | |||
| Sudeste | 1,18 | 0,96;1,46 | 0,119f | |||
| Centro-Oeste | 1,10 | 0,84;1,43 | 0,490f | |||
a) Modelo multinível tendo a pessoa (usuária) como nível 1 e a macrorregião de saúde de residência como nível 2; b) OR: Odds ratio (razão de chances); c) IC95%: Intervalo de confiança de 95%; d) Variáveis incluídas no modelo múltiplo: idade, distância percorrida para o primeiro tratamento e ano de diagnóstico; e) P-valor de tendência linear; f) P-valor de tendência para variáveis ordinais.
No modelo múltiplo da regressão logística multinível, a inclusão das variáveis que se mostraram significativas nos modelos simples (faixa etária; ano do diagnóstico; distância da residência à unidade de tratamento) possibilitou encontrar ORs ajustadas semelhantes às ORs brutas, tendo as três variáveis permanecido significativas. Assim, as chances de atraso no início do tratamento foram 49% (OR = 1,49; IC95% 1,42;1,57) a 95% (OR = 1,95; IC95% 1,85;2,07) maiores nas faixas etárias acima de 40 anos, quando comparadas às idades até 39 anos, 21% (OR = 0,79; IC95% 0,77;0,81) menores em 2020, na comparação com 2019, e 21% (OR = 1,21; IC95% 1,13;1,31) maiores entre as mulheres que se deslocaram mais de 200 km para tratamento (Tabela 3). A análise dos resíduos desse modelo não mostrou desvios em relação à distribuição esperada.
Discussão
Mais da metade dos casos de câncer de mama no sexo feminino iniciaram tratamento oncológico em um prazo de tempo superior a 60 dias passados do diagnóstico, nos períodos de 2019 e 2020, descumprindo a Lei nº 12.732/12.12 Essa situação foi pior para as faixas etárias mais elevadas e para as usuárias do Sistema que tiveram de se deslocar mais que 200 km de sua residência, para tratamento.
Os resultados do estudo indicaram que mulheres na idade de 40 anos ou mais tiveram maior chance de atraso quando comparadas às mais jovens, achado semelhante ao de pesquisa realizada antes da pandemia de covid-19, entre os anos de 2010 e 2012, para os quais se avaliou o tempo transcorrido desde uma mamografia alterada até o início do tratamento.6 Estudo realizado em um centro de referência no Rio de Janeiro/RJ, com mulheres diagnosticadas e tratadas entre 2014 e 2015, identificou, entre aquelas com 60 anos ou mais de idade, maior chance de iniciar o tratamento em um prazo superior a 60 dias contados do diagnóstico.17 Outro estudo, conduzido nos Estados Unidos, no período de 2004 a 2006, observou que as chances de atraso de 60 dias ou mais para o início do tratamento adjuvante entre mulheres com câncer de mama também aumentaram com a idade.18 A presença de comorbidades e a dificuldade de acesso aos serviços de saúde têm sido apontadas como fatores capazes de influenciar o início tardio do tratamento com o aumento da idade.19 Ressalta-se que, no presente estudo, não foi possível avaliar a presença de comorbidades associadas ao atraso no início do tratamento, porque tal variável não consta do sistema de informações utilizado.
Estudos que avaliaram o tempo até o início do tratamento de câncer de mama indicam que o acesso à confirmação diagnóstica é um dos componentes que influenciam o início do tratamento tardio e o diagnóstico de casos mais avançados.20,21 Entre 2019 e 2020, houve redução no número de diagnósticos de câncer de mama, indicando maior dificuldade das mulheres em confirmar o diagnóstico de neoplasia maligna durante a pandemia de covid-19.22,23
Para os casos diagnosticados em 2020, ano de início da pandemia, quando seria esperada uma piora no acesso aos serviços de saúde, identificou-se redução na proporção de casos com atraso, na comparação com os casos diagnosticados no ano anterior. Este achado poderia estar relacionado a um volume menor de mulheres diagnosticadas com câncer de mama em 2020, o que diminuiria a demanda assistencial, e consequentemente, reduziria o atraso para o início do tratamento. Estudo em unidade hospitalar da Filadélfia, Estados Unidos,24 ao comparar mulheres diagnosticadas e tratadas por câncer de mama, antes e durante a pandemia de covid-19, tampouco identificou atrasos maiores para o início do tratamento oncológico. Todavia, a proporção de usuárias diagnosticadas e não tratadas, que não foram abordadas no presente estudo, pode ocasionar uma interpretação equivocada, pois, apesar de ter-se verificado melhora do tempo para início do tratamento, muitas usuárias podem não ter acessado o tratamento, especialmente no ano de 2020.
Estudo que avaliou o tempo até o início do tratamento do câncer de pulmão no estado de Minas Gerais constatou que a disponibilidade de serviços nas macrorregiões de saúde também estava associada a esse intervalo de tempo.25 O presente estudo não observou influência das macrorregiões no tempo do início do tratamento de câncer de mama, seja para mulheres residentes em macrorregião com serviço habilitado, seja para mulheres tratadas em outra macrorregião. A análise empregada mostrou que o nível das macrorregiões de saúde explicou apenas 4% da variância. Os achados discordantes entre ambos os estudos, relativamente à existência dessa associação, podem ser explicados - em parte - pelas diferenças metodológicas e pelo fato de abordarem dois tipos de câncer, com características de diagnóstico e tratamento distintas.
Embora o atraso no início de tratamento tenha-se revelado menor em 2020, para alguns estados, houve aumento desse tempo, ainda que o mapa de fluxo assistencial mostre os principais fluxos a transcorrer dentro do próprio estado. Saldanha et al.,9 ao avaliarem os fluxos de tratamento para câncer de mama por município de residência, concluíram que a maioria dos fluxos conduzem às capitais ou grandes cidades do próprio estado, o que reforça a direção dos resultados encontrados. Contudo, foram encontrados alguns fluxos dirigidos a outras UFs, nas quais as referências da macrorregião funcionaram como polos de atração, a exemplo dos municípios de São Paulo/SP e Barretos/SP.
Apesar da redução em cerca de 13,5% dos casos diagnosticados em 2020, no Brasil como um todo, quatro estados apresentaram aumento na proporção de casos tratados em mais de 60 dias. Ressalta-se que, em 12 estados, o início do tratamento ocorreu com atraso para mais da metade das mulheres diagnosticadas.
A distância percorrida foi maior nas regiões Norte, Nordeste e Centro-Oeste; porém, localidades com maior percurso de deslocamento não necessariamente foram aquelas com maior atraso. Souza et al.,26 em pesquisa sobre dois hospitais de referência no estado do Piauí, identificaram que o atraso no tratamento do câncer de mama ocorreu independentemente da distância da residência até o local de tratamento, e de o território de residência possuir ou não estabelecimentos habilitados para tratamento oncológico. Os autores do estudo citado concluíram que a falta de organização da rede de atenção à saúde contribui para o atraso no tratamento do câncer de mama, e não, necessariamente, as barreiras geográficas.
Entre as limitações deste trabalho, encontra-se a possibilidade de as categorias de mensuração de deslocamento adotadas serem por demais amplas e pouco sensíveis à detecção da influência dos percursos sobre o tempo transcorrido até o início do tratamento. Ademais, outras dimensões das barreiras de acesso, como malhas viárias, facilidade e custo do deslocamento, fatores que influenciam o tempo de deslocamento, não foram avaliados. A falta de disponibilidade de informações de estadiamento para todos os casos tratados, por limitação do PAINEL-Oncologia,11 impossibilitou a avaliação da influência desse fator no atraso do início do tratamento do câncer de mama.
É possível que a não inclusão, no grupo de estudo, de mulheres diagnosticadas e sem tratamento possa ter influenciado os resultados encontrados. Adicionalmente, o PAINEL-Oncologia inclui apenas casos de usuários do SUS que possuem cartão nacional de saúde máster,11 e o tabulador de acesso público apresenta apenas pessoas com neoplasia para a qual foi identificado diagnóstico, elementos que também podem limitar o estudo. Entretanto, relatório sobre o intervalo entre diagnóstico e início do primeiro tratamento27 demonstra que a proporção de casos de câncer de mama sem informação de diagnóstico tem-se reduzido progressivamente. Portanto, o volume de pessoas tratadas e sem diagnóstico na base disponível para análise pode ter tido pouca influência nos resultados do estudo em tela.
Apesar das limitações apontadas, esta pesquisa mostra a necessidade de monitorar as etapas da linha de cuidado do câncer de mama no SUS, com vistas, sobretudo, a diminuir as iniquidades de acesso ao tratamento oncológico existentes no Brasil. A organização da rede de atenção à saúde deve considerar estratégias que otimizem os fluxos de encaminhamento e mitiguem o efeito da distância percorrida pelos usuários para o início do tratamento oncológico.
References
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209-49. doi: 10.3322/caac.21660 [ Links ]
2. Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nikšić M, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391(10125):1023-75. doi: 10.1016/s0140-6736(17)33326-3 [ Links ]
3. DeSantis CE, Bray F, Ferlay J, Lortet-Tieulent J, Anderson BO, Jemal A. International variation in female breast cancer incidence and mortality rates. Cancer Epidemiol Biomarkers Prev. 2015;24(10):1495-506. doi: 10.1158/1055-9965.epi-15-0535 [ Links ]
4. Tomazelli JG, Silva GA. Rastreamento do câncer de mama no Brasil: uma avaliação da oferta e utilização da rede assistencial do Sistema Único de Saúde no período 2010-2012. Epidemiol Serv Saude. 2017;26(4):713-24. doi: 10.5123/s1679-49742017000400004 [ Links ]
5. Renna-Junior NL, Silva GA. Late-stage diagnosis of breast cancer in Brazil: analysis of data from hospital-based cancer registries (2000-2012). Rev Bras Ginecol Obstet. 2018;40(03):127-36. doi: 10.1055/s-0038-1624580 [ Links ]
6. Tomazelli JG, dos-Santos-Silva I, Silva GA. Trajetória de mulheres rastreadas para o câncer de mama na rede pública de saúde. Rev Bras Cancerol. 2018;64(4):517-26. doi: 10.32635/2176-9745.RBC.2018v64n4.200 [ Links ]
7. Medeiros GC, Teodózio CGC, Fabro EAN, Aguiar SS, Lopes AHM, Conte BC, et al. Fatores Associados ao atraso entre o diagnóstico e o início do tratamento de câncer de mama: um estudo de coorte com 204.130 casos no Brasil. Rev Bras Cancerol . 2020;66(3):e-09979. doi: 10.32635/2176-9745.RBC.2020v66n3.979 [ Links ]
8. Ho PJ, Cook AR, Ri NKBM, Liu J, Li J, Hartman M. Impact of delayed treatment in women diagnosed with breast cancer: a population‐based study. Cancer Med. 2020;9(7):2435-44. doi: 10.1002/cam4.2830 [ Links ]
9. Saldanha RF, Xavier DR, Carnavalli KM, Lerner K, Barcellos C. Estudo de análise de rede do fluxo de pacientes de câncer de mama no Brasil entre 2014 e 2016. Cad Saude Publica. 2019;35(7):e00090918. doi: 10.1590/0102-311x00090918 [ Links ]
10. Alcantara LLM, Tomazelli J, Zeferino FRG, Oliveira BFA, Silva GA. Tendência temporal da cobertura de mamografias no Sistema Único de Saúde, Brasil, 2010-2019. Rev Bras Cancerol . 2022;68(3):e-052407. doi: 10.32635/2176-9745.RBC.2022v68n3.2407 [ Links ]
11. Atty ATM, Jardim BC, Dias MBK, Migowski A, Tomazelli JG. PAINEL-oncologia: uma ferramenta de gestão. Rev Bras Cancerol . 2020;66(2):e-04827. doi: 10.32635/2176-9745.RBC.2020v66n2.827 [ Links ]
12. Brasil. Presidência da República. Lei no 12.732, de 22 de novembro de 2012. Dispõe sobre o primeiro tratamento de paciente com neoplasia maligna comprovada e estabelece prazo para seu início [Internet]. Diário Oficial da União, Brasília (DF), 2012 Nov 23 [citado 2022 06 07], Seção 1:1. Disponível em: http://www.planalto.gov.br/CCIVIL_03/_Ato2011-2014/2012/Lei/L12732.htm [ Links ]
13. Ministério da Saúde (BR). Tabnet Datasus. Cadastro Nacional de Estabelecimentos de Saúde [Internet]. Brasília: Ministério da Saúde; 2022 [citado 2022 06 10]. Disponível em: http://cnes.datasus.gov.br/pages/consultas.jsp [ Links ]
14. Ministério da Saúde (BR). Tabnet Datasus. Trabalho e renda - Censos 1991, 2000 e 2010 [Internet]. Brasília: Ministério da Saúde ; 2022 [citado 2022 05 30]. Disponível em: https://datasus.saude.gov.br/trabalho-e-renda-censos-1991-2000-e-2010 [ Links ]
15. Hox J, Moerbeek M, van de Schoot R. Multilevel analysis: techniques and applications. 3rd. ed. New York: Routledge; 2017. 348 p. [ Links ]
16. R Core Team. A language and environment for statistical computating [Internet]. Vienna: R Foundation for Statistical Computing; 2013 [citado 2022 06 23]. Disponível em: http://www.R-project.org / [ Links ]
17. Medeiros GC, Thuler LCS, Bergmann A. Determinants of delay from cancer diagnosis to treatment initiation in a cohort of brazilian women with breast cancer. Health Soc Care Community. 2021;29(6):1769-78. doi: 10.1111/hsc.13284 [ Links ]
18. Fedewa SA, Ward EM, Stewart AK, Edge SB. Delays in adjuvant chemotherapy treatment among patients with breast cancer are more likely in African American and Hispanic populations: a national cohort study 2004-2006. J Clin Oncol. 2010;28(27):4135-41. doi: 10.1200/jco.2009.27.2427 [ Links ]
19. Unger-Saldaña K, Infante-Castañeda C. Delay of medical care for symptomatic breast cancer: A literature review. Salud Publica Mex. 2009;51(Suppl 2):S270-85. doi: 10.1590/s0036-36342009000800018 [ Links ]
20. Rezende MCR, Koch HA, Figueiredo JA, Thuler LCS. Causas do retardo na confirmação diagnóstica de lesões mamárias em mulheres atendidas em um centro de referência do Sistema Único de Saúde no Rio de Janeiro. Rev Bras Ginecol Obstet . 2009;31(2):75-81. doi: 10.1590/s0100-72032009000200005 [ Links ]
21. Tomazelli JG, Girianelli VR, Silva GA. Mulheres rastreadas para câncer de mama: acompanhamento por meio dos Sistemas de Informação em Saúde. Epidemiol Serv Saude . 2018;27(3):e2017445. doi: 10.5123/S1679-49742018000300005 [ Links ]
22. Tachibana BMT, Ribeiro RLM, Federicci ÉEF, Feres R, Lupinacci FAS, Yonekura I, et al. The delay of breast cancer diagnosis during the COVID-19 pandemic in São Paulo, Brazil. Einstein (São Paulo). 2021;19:eAO6721. doi: 10.31744/einstein_journal/2021ao6721 [ Links ]
23. Ribeiro CM, Correa FM, Migowski A. Efeitos de curto prazo da pandemia de COVID-19 na realização de procedimentos de rastreamento, investigação diagnóstica e tratamento do câncer no Brasil: estudo descritivo, 2019-2020. Epidemiol Serv Saude . 2022;31(1):e2021405. doi: 10.1590/s1679-49742022000100010 [ Links ]
24. Hawrot K, Shulman LN, Bleiweiss IJ, Wilkie EJ, Frosch ZAK, Jankowitz RC, et al. Time to treatment initiation for breast cancer during the 2020 COVID-19 Pandemic. JCO Oncol Pract. 2021;17(9):534-40. doi: 10.1200/op.20.00807 [ Links ]
25. Souza JAM, Rocha HA, Santos MAC, Cherchiglia ML. Fatores associados ao tempo para o início do tratamento do câncer de pulmão em Minas Gerais, Brasil. Cien Saude Colet. 2022;27(3):1133-46. doi: 10.1590/1413-81232022273.02992021 [ Links ]
26. Sousa SMMT, Carvalho MGFM, Santos Júnior LA, Mariano SBC. Acesso ao tratamento da mulher com câncer de mama. Saude debate. 2019;43(122):727-41. doi: 10.1590/0103-1104201912206 [ Links ]
27. Ministério da Saúde (BR). Instituto Nacional de Câncer José de Alencar Gomes da Silva. Relatório do intervalo entre diagnóstico e início do tratamento do câncer no SUS: dados do PAINEL-Oncologia [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José de Alencar Gomes da Silva; 2020 [citado 2022 05 30]. Disponível em: https://www.inca.gov.br/en/node/4045 [ Links ]
Recebido: 28 de Julho de 2022; Aceito: 21 de Dezembro de 2022











 texto em
texto em 


